-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Role patologa v programu transplantací jater
Autoři: Eva Honsová
Působiště autorů: Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM, Praha
Vyšlo v časopise: Čes.-slov. Patol., 51, 2015, No. 4, p. 158-161
Kategorie: PREFACE- Transplantační patologie II.
Péče o pacienty po transplantaci jater představuje komplexní proces, na kterém se podílí celá řada specialistů. Patolog je jedním z členů tohoto týmu, který diagnostikou rejekčních a nerejekčních příčin dysfunkce štěpu může významnou měrou přispívat k dobrému chodu transplantačního programu. Role patologa v transplantačním týmu je odlišná od běžné tzv. chirurgické patologie. V transplantační problematice jde vždy o interpretační diagnózu, kde k definitivnímu závěru je nezbytná znalost mnoha údajů, od příčiny selhání jater, po klinické informace, včetně dynamiky výsledků laboratorních dat, zobrazovacích metod, imunosupresivních agens s jejich dávkováním a samozřejmostí je porovnání s předcházející biopsií. Patolog se při hodnocení bioptických znaků ve štěpu jater pohybuje v terénu zánětlivých a metabolických změn a zvažuje kombinace vlivů, které by se mohly projevit obdobnými morfologickými změnami. Proto potřebuje dobrou znalost změn v jaterní tkáni obecně. Musí znát morfologii onemocnění, které k selhání jater vedlo, odlišné chování a morfologii hepatotropních infekcí pod vlivem imunosuprese, stejně tak jako morfologické znaky chirurgických komplikací. Na druhé straně, zpětná vazba o výsledku diagnostické práce je zde velmi rychlá a dobrým diagnostickým závěrem lze významně přispět k úspěšné léčbě mnoha afekcí u pacientů, kterým transplantace jater dala druhou šanci žít.
Základním předpokladem pro úspěšnou interpretaci biopsií jater jsou znalosti morfologie ve vztahu k funkci tkáně za normální situace. Klíčem k porozumění mnoha afekcí jater je znalost cévního zásobení. Už mediky učíme, že játra mají dominující zásobení z v. portae (2/3) a zbytek je tvořen arteriálním zásobením z a. hepatica. To platí pro hepatocyty; žlučovody jsou zásobovány pouze z arterie a jsou tedy velmi zranitelné k ischemii jakékoli etiologie. Žlučovody jsou obecně daleko náchylnější ke komplikacím také proto, že mají oproti hepatocytům daleko nižší schopnost regenerace. Normální vaskularizace jater míchá krev z větví portální žíly a z a. hepatica na kraji sinusoid, kde jsou sfinktery, které ovlivňují tlak v sinusoidách. Tlak musí být nízký, protože endotel v sinusoidách je fenestrovaný (což umožňuje hepatocytům brát z krve a vrátit do oběhu vše, co je třeba metabolizovat). Pokud se tlak v sinusoidách zvýší, dojde k tzv. arterializaci oběhu, tj. uzavřou se fenestrace endotelu a začne se tvořit fibróza v Disseho prostorech, což vyřadí příslušné hepatocyty z funkce (proto některé cirhózy mohou mít klinicky těžkou dysfunkci a prakticky normální velikost jater). Další závažné důsledky má arterializace oběhu při rozvoji cirhózy. S tím jak se vytvářejí vazivová septa, tvoří se v nich arterioly a malé arterie, které buď formují tzv. shunty a propojí přímo arterio-venózní oběh (septum a centrolobulární žíla, s následnou plošnou nekrózou hepatocytů) nebo zvyšují tlak v sinusoidálním řečišti s tzv. arterializací oběhu (viz předchozí text) a portální hypertenzí, což zpětnou vazbou vede k léčebně těžce ovlivnitelné vasodilataci (s nízkým tlakem) nejen v povodí a. hepatica, ale celého splanchniku (s následným hypoxickým poškozením ledvin).
Jak již bylo řečeno, na rozdíl od hepatocytů, žlučovody jsou zásobovány pouze z arterie a jsou proto v průběhu jakékoli ischemie postiženy vždy. Proto biliární patologie je morfologií vaskulárního ischemického poškození od protrahované hypotenze (např. léčené déle trvající šokové stavy) po trombózu arterie a také čistě biliárního poškození např. při poruše žlučové drenáže na velkých žlučovodech (stenózy a všechny příčiny obstrukce). Stejnou morfologii má i biliární leak (poškození žlučovodu s únikem žluči do okolí), pravděpodobně z důvodů reaktivního edému struktur.
V souvislosti s transplantací jater jedno z prvních morfologických vyšetření představuje vyšetření explantátu. Ve většině případů vyšetření autologních jater potvrdí klinicko-patologickou diagnózu základního onemocnění, pro které pacient podstoupil transplantaci. V malém procentu odkryje koincidenci další příčiny, která se spolu s původní diagnózou spolupodílela na vzniku cirhózy. Část chronických onemocnění jater ve stádiu cirhózy nemá typické morfologické rysy původního onemocnění, které jsou definovány pro aktivní fáze choroby a morfologický obraz v explantátu je s původní diagnózou kompatibilní, nikoli diagnostický. Je tomu tak proto, že původní aktivní proces takzvaně vyhoří a zůstávají pouze jizvy/vazivová septa s nepříznačnou smíšenou zánětlivou celulizací. Navíc změna vaskularizace v cirhóze změní morfologii základního onemocnění a zdůrazní vaskulární patologii včetně plošných nekróz/jizev. Tzn., že je-li cirhóza kryptogenní i po pečlivém klinickém vyšetření, může se stát, že zůstane kryptogenní cirhózou i po pečlivém histopatologickém vyšetření explantátu. Obvykle lze rozpoznat morfologii tzv. hepatitického typu poškození a cirhózy (s typickými uzly) a na druhé straně cholestatické/biliární cirhózy (s mapovitým uspořádáním). Přesto vyšetření explantátu jater představuje úžasný materiál, který umožní morfologické studium cílených oblastí, přispívá k lepší znalosti různé distribuce změn např. fibrózy u cholestatických chorob nebo velmi variabilního rozložení nekróz u fulminantních selhání jater. Dává patologovi nenahraditelnou zkušenost s chronickými pokročilými fázemi různých onemocnění jater, která může vyšetřit v naprosto rozdílném rozsahu, než kolik umožní jehlová biopsie. U části dospělých pacientů ve stadiu cirhózy, pečlivé vyšetření explantátu odhalí hepatocelulární karcinom (HCC). Obvykle se jedná o malý uzel nebo několik uzlů, které jsou transplantací vyléčeny a nemají vliv na následující prognózu. Trochu odlišná situace bývá u pacientů transplantovaných z důvodů HCC, kde histopatologické vyšetření explantátu často ne zcela odpovídá rozsahu onemocnění podle výsledků zobrazovacích metod a to jak ve velikosti ložiska, tak i v udávaném počtu ložisek.
V dalším období jde o situace, které nastávají těsně po transplantaci. Obecně lze říct, že na rozdíl od ostatních solidních orgánů, po transplantaci jater se vedle reperfuzního poškození, daleko častěji objevují chirurgické/anastomotické komplikace a rekurence onemocnění, která vedla k cirhóze. V obecné rovině se komplikace po transplantaci jater s dysfunkcí štěpu obvykle posuzují z klinického pohledu. Nejčastěji používané schéma hlavních skupin komplikací po transplantaci jater je následující:
- Komplikace v souvislosti s preservačním/reperfuzním poškozením štěpu.
- Technické tj. chirurgické komplikace související s vytvořením re-anastomóz cév a žlučovodů.
- Rejekce
- Rekurence původního onemocnění
- Komplikace v souvislosti s imunosupresivní terapií (infekce, potransplantační lymfoproliferativní onemocnění (PTLD) a jiné malignity, léková toxicita atd.)
Stejně jako v případě transplantovaných ledvin, i po transplantaci jater má při posuzování dysfunkce štěpu klíčovou roli hodnocení biopsie, které představuje diagnostický zlatý standard.
Prvním morfologickým vyšetřením indikovaným bezprostředně v průběhu transplantace jater je biopsie štěpu po reperfuzi. Tato biopsie nulté hodiny je základem pro porovnání při případných dalších komplikacích, umožní patologovi nepřehodnocovat podíl změn, z nichž část byla přítomna již po reperfuzi a na druhé straně umožní rozpoznat rozdílný stav, který se vyvinul později. Navíc může detekovat pre-existující změny v dárcovském orgánu. Základní morfologickou charakteristikou v biopsii nulté hodiny jsou většinou mírné „metabolické“ změny hepatocytů a tzv. chirurgická hepatitida (tj. kolekce polynukleárů v souvislosti s manipulací s orgánem). Přesný mechanismus vzniku metabolických změn v souvislosti s ischemicko/reperfuzním (I/R) poškozením není objasněn. Studován byl vliv různých typů roztoků používaných během operačního výkonu, vliv doby studené a teplé ischémie, věk dárce atd. Transplantační komunitou je akceptováno, že doba studené ischemie by neměla přesáhnout 12 hodin. V experimentech byly jako součást studené ischemie pozorovány změny sinusoidálních endoteliálních buněk. Jejich poškození vede ke změnám v mikrocirkulaci a je následováno poškozením hepatocytů, které je nejvíce patrné centrolobulárně (obr. 1). Reperfuze jater spolu s kongescí střeva při tzv. anhepatické fázi chirurgického výkonu vede k vyplavení endotoxinu a následné aktivaci Kupfferových buněk, současně dojde k aktivaci komplementu. Aktivované Kupfferovy buňky produkují další cytokiny a volné radikály a to vše dohromady u těžších forem poškození významně přispívá k porušení rovnováhy v mikrocirkulaci s převahou vasokonstriktorů (1). Proto vše další včetně terapie, co může prohloubit vasokonstrikci, poškození zhorší. Poškození mikrocirkulace se uplatňuje i v případě lezí žlučovodů, kde podkladem poškození žlučovodů u těžších forem ischemie je primární poškození mikrocirkulace v peribiliárních plexech se vznikem následných trombóz, což v dalším kroku vede k poškození stěny žlučovodu se všemi následky (leak, tvorba fibrózy a jizvení se stenózami).
Obr. 1. Ischemicko/reperfuzní poškození s metabolickými změnami hepatocytů centrolobulárně. Hepatocyty jsou zduřelé s mikrokapénkovou steatózou a s intracelulární i intrakanalikulární cholestázou (HE, objektiv 40x). 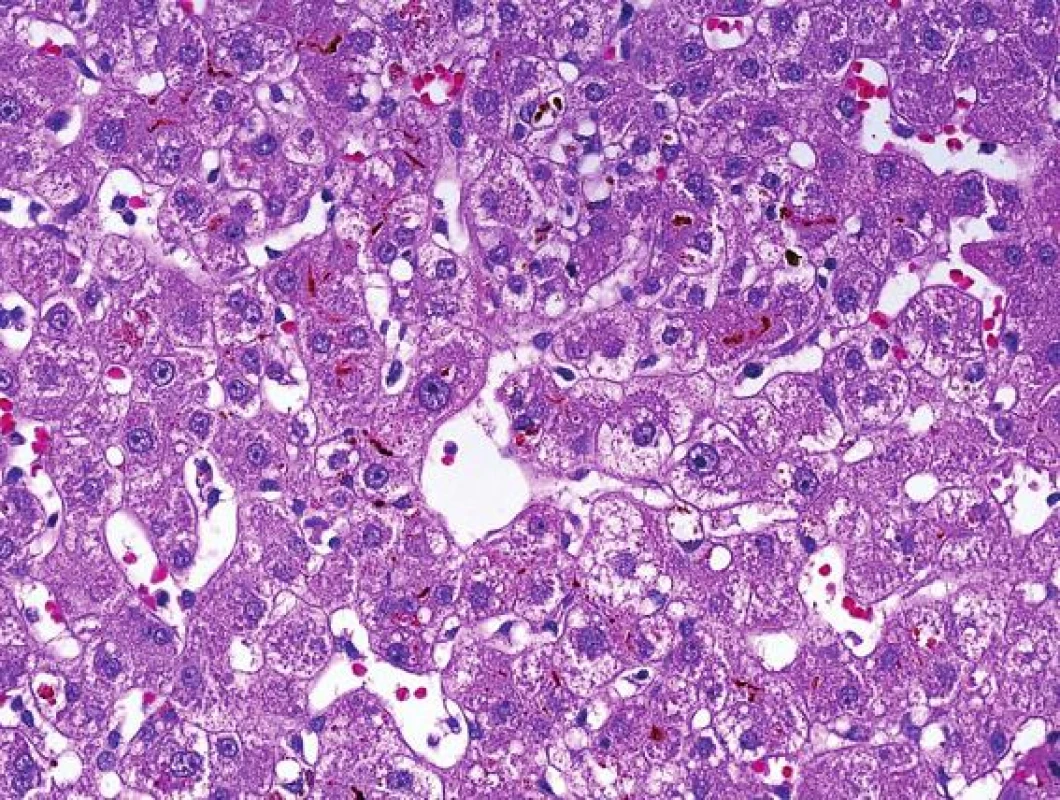
Samostatným problémem je transplantace jater se steatózou dárce. Je-li steatóza většího stupně, mohou od počátku hepatocyty s objemnými tukovými kapkami utlačovat sinusoidy a vést k poruchám v mikrocirkulaci. Situace se ještě zhorší ve chvíli, kdy hepatocyty s tukem v centrolobulární oblasti podlehnou v důsledku I/R poškození nekróze a tukové kapky se ocitnou v Disseho prostorech, event. v sinusech, tomuto stavu se říká lipopelioza a v klinice se tento stav může projevit jako suspektní porucha prokrvení štěpu s periferní rezistencí (obr. 2). K tomu přistupují ještě patofyziologické mechanismy ovlivňující tvorbu volných radikálů s dalším poškozením sinusoidálních buněk. Nepřidruží-li se další komplikace, stav se obvykle během 14 dnů spontánně upraví.
Obr. 2. Lipopelióza v centrolobulární oblasti po transplantaci jater s vyšším stupněm steatózy. Tukové kapky jsou v sinusech a klinicky mohou navozovat poruchu prokrvení s tzv. periferní rezistencí (HE, objektiv 40x). 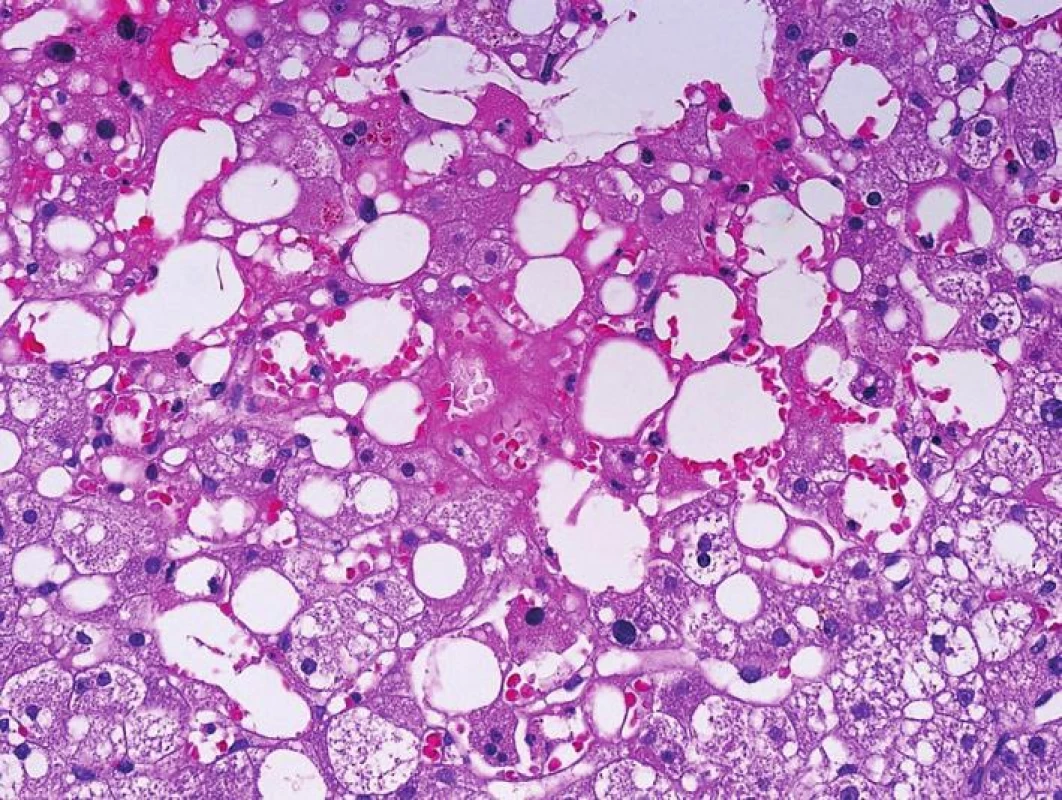
Hodnocení biopsie štěpu je klíčovým diagnostickým výkonem i v případě klasifikace rejekčních změn, protože v současnosti nejsou známé žádné jiné spolehlivé klinické markery, které by tuto diagnózu umožnily (viz článek Dr. Sticové v tomto čísle časopisu). Oproti transplantovaným ledvinám a dalším solidním orgánům, je hodnocení rejekčních změn v jaterní tkáni odlišné především v oblasti diagnostiky protilátkami zprostředkované/ humorální rejekce a jiná je také situace v oblasti chronické rejekce. Důvodů pro odlišné biologické chování a s tím související jiný klinický i morfologický přístup je mnoho. Stejně jako v jiných solidních orgánech humorální rejekční komponenta bude součástí většiny rejekčních epizod a u některých může i dominovat. Ze zkušenosti je ale známo, že na rozdíl od jiných solidních orgánů, v játrech tato komponenta rejekční odpovědi u většiny příjemců neohrožuje přežití štěpu a ve srovnání s chirurgickými/anastomotickými komplikacemi a rekurencemi chorob se jeví jako zanedbatelná (2). Proto ve většině center pozitivní lymfocytotoxický cross-match není důvodem k neuskutečnění transplantace jater. Na druhé straně se neprovádějí transplantace u dárce a příjemce s rozdílnými krevními skupinami, protože je známo, že v těchto případech je vysoké riziko klinicky významné humorální rejekce se selháním funkce štěpu. Výjimkou jsou pouze situace urgentních čekatelů. Rizikovými faktory pro vznik humorální rejekce je mladý věk, ženské pohlaví příjemce, černá rasa a onemocnění s dysregulací imunity (primární sklerotizující cholangitida (PSC), autoimunitní hepatitida (AIH), primární biliární cirhóza (PBC)).
Všechny příčiny toho, proč je humorální rejekce ve většině případů v játrech daleko benignější než v jiných solidních orgánech, nejsou přesně známé. Teoreticky rozumíme jen některým obranným mechanismům, které mohou modifikovat škodlivý vliv protilátek. Jedním z nich je lokální sekrece rozpustných MHC antigenů I. třídy, které se váží k protilátkám a neutralizují je. Dalším důvodem je množství tkáně jater s ohromným počtem fagocytujících Kupfferových buňek, které pak resorbují imunokomplexy i protilátky z oběhu. Dalším faktem pravděpodobně je, že v játrech se odbourává mnoho toxických zplodin a že tedy orgán se umí s takovou situací lépe vyrovnat už tím, že má ohromnou regenerační schopnost. V neposlední řadě lze spekulovat o vlastním imunitním prostředí, které v játrech je; stejně tak jako o vlivu úrovně antikomplementové ochrany, protože proteiny komplementu se v játrech tvoří. Pokud jde o diagnózu humorální rejekce, testy na přítomnost donor specifických protilátek (DSA) nepomohou (až 12 % příjemců transplantovaných jater má DSA a nemají akutní humorální rejekci; na druhé straně jak uvedeno, játra dokáží absorbovat enormní množství protilátek a pak je jejich hladina v séru pod hranicí detekovatelnosti). Průkaz C4d, který se běžně používá jako doklad protilátkami aktivované komplementové kaskády a humorální rejekce v jiných solidních orgánech, má v případě jater zatím nejistý význam. Pravděpodobně bude důležitý spíše u chronického postižení (chronické alloantigen dependentní reakce). Časně po transplantaci nastává mnoho důvodů, které v játrech depozici C4d ovlivňují, a proto postavení průkazu C4d časně po transplantaci není tak pevnou součástí diagnostických kritérií humorální rejekce jako je tomu v jiných orgánech. Během operace má část pacientů větší krevní ztráty s nutností náhrady plné krve s velkým množstvím různých protilátek, které mohou ovlivnit depozici a detekci C4d (detekovány by byly vlastně komponenty transfuzní krve). Navíc jak uvedeno výše, játra mají velmi mohutné ochranné mechanismy. Na druhé straně významné poškození endotelu může být velmi rychlé a pak je C4d nedetekovatelné, protože endotel je destruovaný a na takové tkáni nic detekovat nelze.
V současné době jsou definovaná kriteria pro případy humorální rejekce v časném období po transplantaci. Jde o situaci, která může vést k závažným komplikacím i k vážnému ohrožení funkce štěpu. Část těchto případů byla v minulosti klasifikovaná jako tzv. časná dysfunkce nebo byly tyto případy skryty pod chirurgickými komplikacemi s trombózou arterie, která se v průběhu humorální rejekce postupně vyvine (4). Jde vlastně o obdobnou situaci, kterou někteří z nás pamatují v nefropatologii z doby před klasifikací humorální rejekce, kdy se pravidelně řešily trombotické chirurgické komplikace, které jako zázrakem vymizely, když došlo k definování diagnostických kriterií a následně k léčbě protilátkami zprostředkované rejekce. Morfologické znaky ani diagnostická kriteria pro chronickou humorální rejekci nejsou v oblasti transplantace jater přesně vydefinovány, jsou navrženy ve velmi obecné rovině a v současnosti čekají na prověření ve větších studiích.
Morfologie akutní humorální rejekce vyžaduje interpretaci výsledků klinického stavu, znalost cévního zásobení s vyloučením trombózy arterie (CT angiografii) a porovnání s biopsií provedenou po reperfuzi. Je tomu tak proto, že zpočátku je morfologie prakticky stejná jako v případě ischemicko-reperfuzního poškození. I zde je cílovou strukturou endotel sinusů (pouze mechanismus poškození je jiný). Poškození endotelu vede v dalším průběhu ke změnám v mikrocirkulaci s následným poškozením hepatocytů (obr. 3). Pokud není stanovena diagnóza, jsou subtilní změny v mikrocirkulaci následovány vznikem trombóz (v klinickém obraze s trombocytopenií), dále nekrózami hepatocytů a trombózou arterie s biliárními komplikacemi.
Obr. 3. Biopsie jater pro dysfunkci štěpu časně po transplantaci s morfologií četných acidofilních tělísek, edému port. pole s polynukleáry, včetně eozinofilů. Morfologie je dobře kompatibilní s projevy akutní humorální rejekce (HE, objektiv 40x) 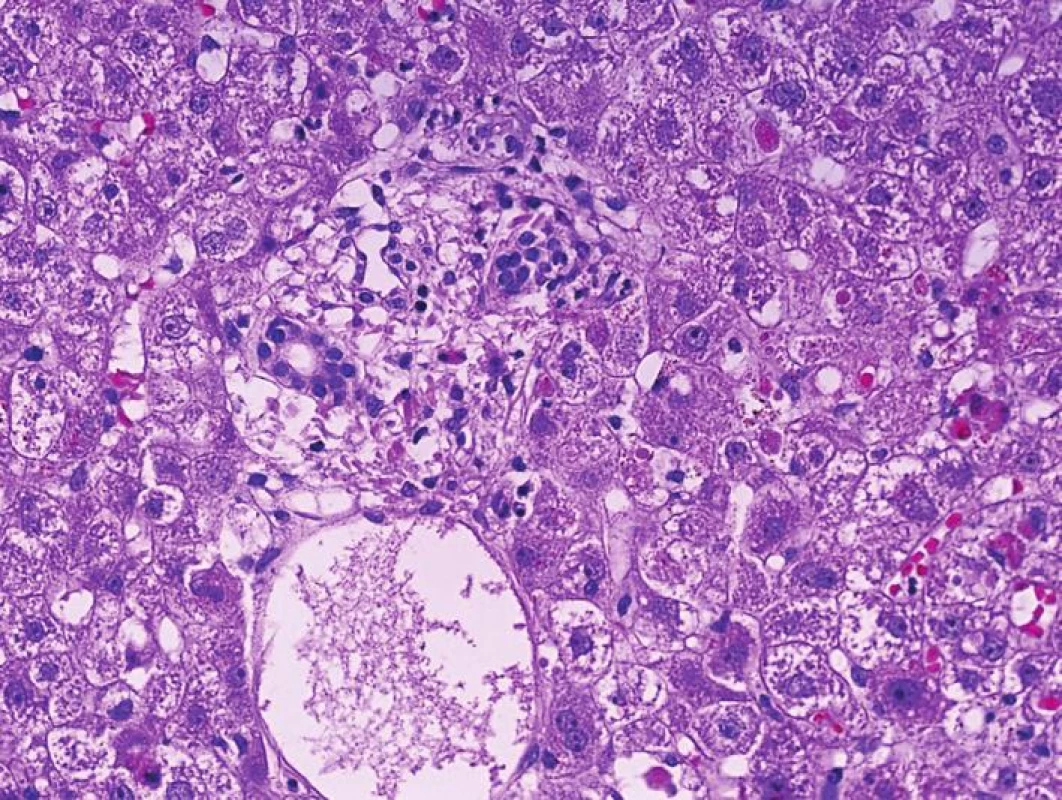
V diferenciální diagnostice není celulární klasická rejekce, ale ischemicko/reperfuzní poškození, chirurgické komplikace (především vaskulární) a také lytická forma rekurence virové hepatitidy C. Nejde o jednoduchou diagnózu, protože formulace definitivního závěru vyžaduje interpretaci mnoha klinických dat.
Nejen humorální rejekce, ale i chronická rejekce představuje odlišnou kategorii, než jakou známe po transplantaci jiných orgánů, zvl. ledvin. Termínem chronická rejekce se označuje situace, která chronická moc není, protože většina těchto případů se objevuje do 1 roku po transplantaci a na rozdíl od ledvin a dalších orgánů, není tento typ rejekce ireversibilní. Použití termínu odráží historické pozadí, kdy byly případy rejekcí se špatnou odpovědí na léčbu steroidy nebo případy, kde musela být z různých důvodů vysazena imunosuprese a štěp byl poškozený progredující rejekcí s destrukcí žlučovodů, označeny jako chronická duktopenická rejekce. To později přineslo problémy do klinické praxe, protože případy s plíživě se vytvářejícím chronickým zánětlivým poškozením štěpu nemohly být označeny jako chronická rejekce, protože termín už se používal pro jinou situaci. Proto stavy, které velmi pravděpodobně jsou ekvivalentem chronické rejekce v jiných orgánech (např. ledvinách), jsou v játrech nazývány jinak - nejčastěji chronická allograft hepatitida.
Chronická allograft hepatitida je zánětem způsobené poškození štěpu, které není součástí rekurence infekčních nebo zánětlivých onemocnění a proto jde nejspíše o formu rejekce (obr. 4). Pokud terminologii zjednodušíme, pak za rejekci považujeme imunologický útok příjemce vůči štěpu; při vyloučení chorob, které poškodily autologní játra. Z tohoto pohledu chronické rejekci odpovídají dlouhodobé zánětlivé změny ve štěpu a lze sem přiřadit 2 kategorie. Jednak chronickou allograft hepatitidu a také „de novo“ autoimunní hepatitidu (AIH). V případě chronické allograft hepatitidy má až 73 % příjemců v séru protilátky, což dále podporuje úvahu o tom, že jde o typ rejekční reakce.
Obr. 4. Chronická allograft hepatitida se zánětem na periferii port. pole u příjemce, který podstoupil transplantaci kvůli epiteloidnímu hemangioendoteliomu a nemá „de novo“ virovou hepatitidu (HE, objektiv 20x). 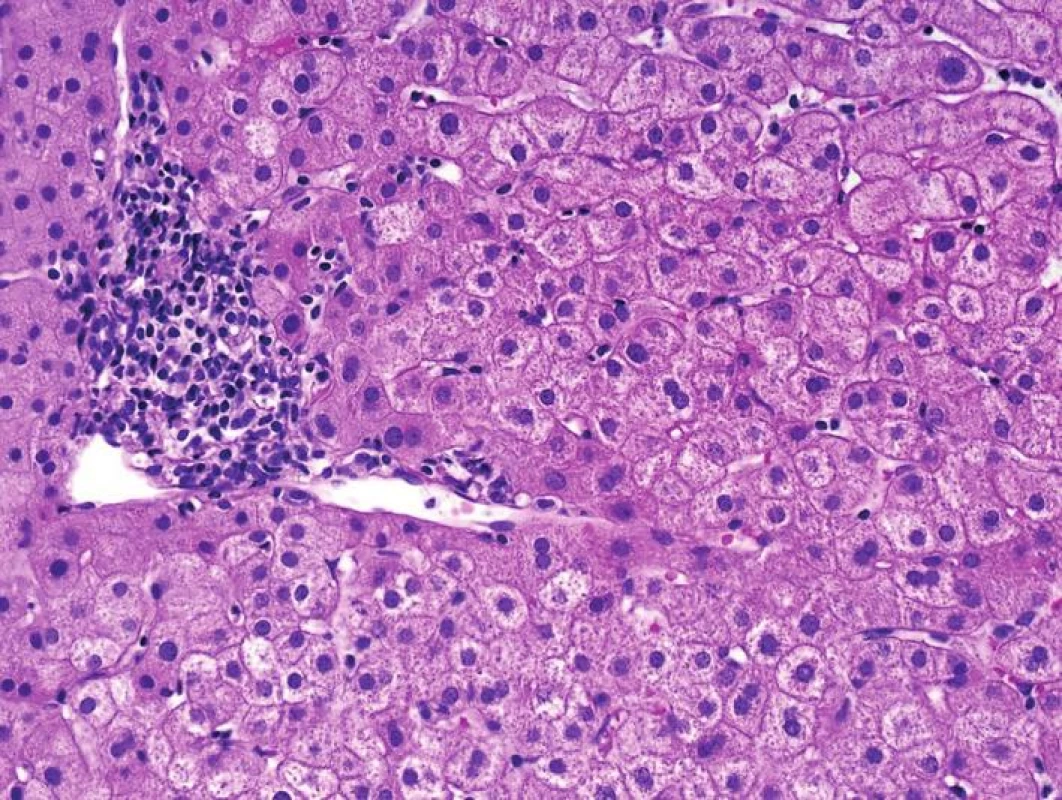
Existuje několik dobře doložených teoretických předpokladů proč tzv. „de novo“ AIH je považovaná za typ rejekce. Jedním z nich je fakt, že tyto případy jsou často u nemocných se suboptimální imunosupresí. Další ještě přesvědčivější je z oblasti polymorfismů, kdy vývoj „de novo“ AIH byl u příjemců, kteří neexprimovali glutation S transferázu T1 (GSTT1) a byli tedy GSST1 negativní a při transplantaci obdrželi štěp GSTT1 pozitivní. Začali proti tomuto antigenu tvořit protilátky a vyvinuli morfologii „de novo“ AIH.
Největší výzvou do budoucna zůstává otázka, jak indukovat toleranci u příjemců jaterních štěpů, aby se mohli kompletně vyhnout nebo alespoň minimalizovat imunosupresi. Tyto programy již existují a největší zkušenostmi s nimi jsou v Japonsku (5). Příjemci se vybírají mezi těmi, kteří nemají jako důvod selhání jater onemocnění s dysregulací imunity a kteří mají normální funkci štěpu alespoň 4 roky a nemají rejekci při pozvolném snižování imunosuprese. Jde o komplikovaný proces, do kterého mohou být zařazeni jen cíleně vybraní příjemci, u kterých se dále velmi pečlivě monitorují všechny typy imunologického poškození včetně subklinického (6). U malé části pacientů lze dosáhnout tzv. tolerance, tedy mít po transplantaci jater normální funkci štěpu bez imunosuprese. Protokoly bez imunosuprese jsou zvláště výhodné pro děti, které mají nezralý imunitní systém a protokol bez imunosuprese jim umožní po dobu fungujícího štěpu prakticky normální život.
Závěrem lze shrnout, že tkáň jaterního štěpu se z mnoha důvodů chová odlišně než štěpy jiných solidních orgánů a to nejen z pohledu hodnocení rejekčních změn. Játra představují funkčně mimořádně komplexní orgán, který se účastní většiny metabolických procesů; a současně s tím, játra představují samostatný imunitně aktivní orgán, který vytváří imunologickou barieru v gastrointestinální oblasti. Hodnocení biopsií štepu jater vyžaduje alespoň orientační znalosti mnoha funkčních vztahů, aby mohlo být klíčem k diagnóze různých příčin dysfunkce a tím také základem pro odpovídající terapii. V rámci transplantačního týmu je tak hepatopatolog jedním z expertů mezi představiteli různých odborností, který svou prací přispívá k úspěšnému chodu programu transplantace jater a výsledek práce hepatopatologa je kouskem skládačky koordinované komplexní péče o transplantovaného pacienta.
Adresa pro korespondenci:
Doc. MUDr. Eva Honsová, Ph.D.
Pracoviště klinické a transplantační patologie
Transplantcentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: eva.honsova@ikem.cz
Zdroje
1. Zhai Y, Busuttil RW, Kupiec - Weglinski JV. Liver ischemia and reperfusion injury: new insights into mechanisms of innate‑adaptive immune–mediated tissue inflammation. Am J Transplant 2011; 11 : 1563–1569.
2. Hübscher S. Antibody – mediated rejection in the liver allograft. Curr Opin Organ Transplant 2012; 17 : 280–286.
3. Neil D, Hübscher S. Current view on rejection pathology in liver transplantation. Transpl Int 2010; 23 : 971-983.
4. O’Leary JG, Kaneku H, Demetris A, et al. Antibody-mediated rejection as a contributor to previously unexplained early liver allograft loss. Liver Transpl 2014; 20 : 218-227.
5. Banff Working Group on Liver Allograft Pathology. Importance of liver biopsy findings in immunosuppression management: biopsy monitoring and working criteria for patients with operational tolerance. Liver Transpl 2012; 18 : 1154-1170.
6. Demetris A, Isse K. Tissue monitoring of operational tolerance in liver allograft recipients. Curr Opin Organ Transplant 2013; 18 : 345-353.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2015 Číslo 4-
Všechny články tohoto čísla
- Transplantační patologie - II. díl
- Veškerá mizérie je v tom, že hlupákům je všechno jasné, zatímco moudří jsou samá pochybnost (Bertrand Russell)
- MONITOR aneb nemělo by vám uniknout, že ...
- MONITOR aneb nemělo by vám uniknout, že ...
- Transplantace jater z pohledu hepatologa
- Role patologa v programu transplantací jater
- MONITOR aneb nemělo by vám uniknout, že ...
- Morfologie chirurgických komplikací v biopsiích jater časně po transplantaci
- Karcinomy dutiny ústní a hltanu
- Diagnostika rejekce v transplantovaných játrech
- Rekurence primárních chorob po transplantaci jater
- MONITOR aneb nemělo by vám uniknout, že ...
- Transplantace plic v České republice – z pohledu patologa
- MONITOR aneb nemělo by vám uniknout, že ...
- Biopsie renálních štěpů: průvodce spletitými detaily pro získání nejlepších výsledků
- Chirurgické techniky orgánových transplantací
- MONITOR aneb nemělo by vám uniknout, že ...
- Periostální osteosarkom - osobní zkušenost s pěti případy
- MONITOR aneb nemělo by vám uniknout, že ...
- Pitva mozku a míchy při diagnóze neurodegenerativního onemocnění – praktický postup pro optimalizaci vyšetření
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Periostální osteosarkom - osobní zkušenost s pěti případy
- Transplantace plic v České republice – z pohledu patologa
- Diagnostika rejekce v transplantovaných játrech
- Chirurgické techniky orgánových transplantací
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



