-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Periostální osteosarkom - osobní zkušenost s pěti případy
Periosteal osteosarcoma - personal experience with five cases
The authors present five cases of periosteal osteosarcoma located in the femur (4) and tibia (1) in children and young adults (1 female and 4 males) with an age range of 9 - 23 years (mean age 15 years). Radiographs in all cases showed a broad-based soft tissue mass attached to the cortex with periosteal reaction and in two of them cortical disruption with extensive medullary involvement. Follow-ups were available in four cases (range 11 - 73 months) and revealed pelvic metastasis after 15 months with ultimately rapid dissemination and death in a 9-year-old girl and metastasis to the humerus after 13 months in a 15-year-old boy. The former tumor widely extended into the medullary cavity and an amputation was carried out, the latter had a pure juxtacortical position and an en block resection was performed; both of them were treated with chemotherapy. All the lesions displayed distinctive structural patterns combining a large island of tumorous cartilage and hypocellular, bland-looking myxoid mesenchymal stroma with abrupt transition between both components. Contrary to conventional osteosarcoma, the delicate flocculent osteoid deposits were produced by innocuous stromal cells lacking apparent atypia. They were strictly situated outside the prevailing chondroid areas and disclosed sometimes only after a meticulous search. Immunohistochemical detection of SATB2, S100protein and D2-40 assisted effectively not only in recognition of the real stromal histogenetic derivation, but also in distinction of true differentiation of a heavily mineralized extracellular matrix. Molecular analysis revealed no IDH1/2 mutation in four examined cases. Regardless of unique low-grade morphology in rare periosteal osteosarcoma, an aggressive therapeutical approach similar to conventional osteosarcoma is justified, particularly in the case of a medullary extension.
Keywords:
bone - periosteal osteosarcoma - chondroplastic osteosarcoma - SATB2 - isocitrate dehydrogenase
Autoři: Zdeněk Kinkor 1; Henrieta Šidlová 2; Iveta Mečiarová 3; Andrej Švec 4; Marián Švajdler ml. 1; Peter Vasovčák 5; Roman Kodet 6; Zdeněk Matějovský 7; Ľubomír Straka 8
Působiště autorů: Bioptická laboratoř s. r. o., Šiklův ústav patologie, LF UK, Plzeň 1; Cytopathos s. r. o., Bratislava 2; Alfa Medical Patológia, FN Ružinov, Bratislava 3; Ortopedická klinika, Univerzitná nemocnica Akademika Dérera, Bratislava 4; Gendiagnostika s. r. o., Košice 5; Ústav patologie a molekulární medicíny, 2. LF UK, FN Motol, Praha 6; Ortopedická klinika, Nemocnice na Bulovce, Praha 7; Ústav patologie, FN Prešov 8
Vyšlo v časopise: Čes.-slov. Patol., 51, 2015, No. 4, p. 193-198
Kategorie: Původní práce
Souhrn
Popisováno je pět případů periostálního osteosarkomu dětí a mladých dospělých ve věku 9 - 23 let (průměr 15 let) uložených čtyřikrát ve femuru a jednou v tibii; velikost byla 6 - 18 cm (průměr 7 cm). Sledování čtyř nemocných v intervalu 11 - 73 měsíců ukázalo u 9leté dívky za 15 měsíců metastázu do pánve s následnou rychlou generalizací do plic a úmrtím a u 15letého chlapce zjistilo za 13 měsíců metastázu do humeru; v prvním případě nádor prorůstal do dřeňové dutiny a u obou byla aplikována chemoterapie. Nepřehlédnutelná podobnost nádorů spočívala jednak ve strukturální kompozici dominujících chondromatózních partií a blandního málobuněčného mezenchymálního stromatu, jednak ve způsobu produkce delikátní osteoidní matrix. Na rozdíl od evidentních atypií osteoblastů konvenčního osteosarkomu zde nenápadná depozita osteoidu ukládalo zdánlivě nevinné, myxoidní stroma mimo chrupavčité oblasti. Inverzní exprese SATB2 a S100 proteinu resp. D2-40 ozřejmila nejen pravou histogenetickou orientaci nádorů, ale umožnila odlišit i rozdílnou diferenciaci těžce kalcifikovaných, obdobně vypadajících extracelulárních hmot. Molekulární analýza čtyř případů neprokázala mutaci genů izocitrát dehydrogenázy 1 a 2. Vzácný periostální osteosarkom, zejména když prorůstá do dřeňové dutiny, je bez ohledu na unikátní low-grade morfologii podobně agresívní jako konvenční (chondroplastický) osteosarkom a nutno jej intenzívně léčit.
Klíčová slova:
periostální osteosarkom - chondroplastický osteosarkom - SATB2 - izocitrát dehydrogenáza
Konvenční/centrální osteosarkom (OS) je nejčastější, a pro specializovaného patologa, diagnosticky relativně nenáročný nádor kostí dětí a mladistvých; obojí však zdaleka neplatí pro vzácné juxtakortikálně uložené OS jako jsou parosteální a periostální varianta. Obě tyto nezvyklé léze se vedle typického umístění na povrchu kosti vyznačují charakteristickou morfologií a biologií, které se od konvenčního OS významně liší a jsou i důvodem rozdílných léčebných přístupů. Na rozdíl od výrazně osteoplastického parosteálního OS s určující molekulární aberací (amplifikace genu MDM2) a napodobujícího paradoxně spíše benigní procesy - např. fibrózní dysplázii, periostální OS (POS), naopak dojem a priori osteoplastického tumoru na první pohled nevzbuzuje. V tomto raritním kostním sarkomu totiž naprosto převládá produkce chondroidní matrix a tvorba osteoidu je natolik nenápadná, že svádí k mylné interpretaci primárně chondrogenní neoplázie. Náročnost rozpoznání a diferenciální diagnostiky POS dokládají i literární fakta poukazující i na to, že nepanuje absolutní shoda na definici této jednotky. Někteří totiž principielně vůbec nepřipouštějí možnost sekundárního šíření do dřeňové dutiny u tohoto tumoru; pro jiné není toto striktní diagnostické vymezení podmínkou, ale naopak citlivým prognostickým a prediktivním parametrem (1,3-5,9-12). Zkoumání molekulárního pozadí navíc ukázalo, že pro spolehlivější rozlišení diagnosticky obecně mnohdy problematického chondroplastického OS může být užitečný průkaz mutace genů izocitrát dehydrogenázy (IDH1/2), která je přítomna ve většině primárních benigních i maligních chondromatózních nádorů (2,7). Předkládáme vlastní zkušenost s pěti případy geneticky analyzovaných POS s důrazem kladeným především na jemné morfologické detaily, které však jsou podle nás pro tuto ojedinělou lézi příznačné.
MATERIÁL A METODY
Materiál byl fixován v 10% formolu a zalit do parafínu (FFPE); pro barvení hematoxylinem eozinem a molekulární analýzu byly krájeny řezy silné 2 mm, pro imunohistochemické vyšetření (IHC) řezy silné 4 mm. IHC bylo prováděno elektronicky nastaveným protokolem v automatu BenchMark ULTRA, VENTANA/Roche. K vizualizaci reakce byl použit diaminobenzidin tetrahydrochlorid, k dobarvení jader metylénová modř. Použity byly protilátky S100 protein (Dako, polyklonální, předředěno), D2-40 (Dako; monoklonální, předředěno) a SATB2 (Sigma-Aldrich, polyklonální, ředění 1 : 100).
DNA byla izolována z tkáňových řezů pomocí Qiagen QIAamp® DNA FFPE-kitu (Qiagen). Mutace v genech IDH1 (kodon 132) a IDH2 (kodony 140 a 172) byly analyzované pomocí PCR s primery překrývajícími cílené oblasti genů (IDH1: Fw 5´ GAGTGGATGGGTAAAACCTATC 3´, Re 5´ CATGCAAAATCACATTATTGC 3´; IDH2 : 172 kodón - Fw 5´ GAGCCCATCATCTGCAAAAAC 3´, Re 5´ GGTGCCCAGGTCAGAGGATC 3´, 140 kodón - Fw 5´ CTGCAGTGGGACCACTATTATCTC 3´, Re 5´ GTGGGATGTTTTTGCAGATGATG 3´).
Po vyčištění PCR produktů purifikačním kitem (Bioline, London, UK) byla uskutečněná sekvenační reakce s BigDye Terminator v1.1 sekvenačním kitem (Applied Biosystems, Foster City, CA, USA) a automatická analýza pomocí 3100 xl genetického analyzátoru (Applied Biosystems, Foster City, CA, USA).
VLASTNÍ POZOROVÁNÍ
Klinický průběh
Soubor pěti pozorování POS tvořili čtyři muži a jedna žena ve věku 9 - 23 let (průměr 15 let). Tumor byl čtyřikrát lokalizován ve femuru a jednou v tibii a velikost dosahovala 6 - 18 cm (průměr 8 cm). Radiologický obraz hodnocený vždy onkologickým kostním specialistou (Z.M. a A.Š.) ve všech případech dokumentoval poměrně rozsáhlý proces uložený na povrchu kosti s periostální reakcí a se značnou expanzí do okolních měkkých tkání. Dvakrát byla patrná evidentní destrukce kortikální kosti a extenzívní propagace do dřeňové dutiny doprovázená u jednoho případu dislokovanou zlomeninou (obr. 1). Při probatorní biopsii onkoortoped dokonce u třech nemocných diagnózu POS na histologické průvodce preferoval. Ošetřování pacientů na čtyřech různých pracovištích a desetiletý odstup mezi prvním a posledním případem ovlivnily terapeutické přístupy; jednou byla provedena prostá amputace bez další léčby, jednou amputace s následnou chemoterapií (CHT) a třikrát předcházela neoadjuvantní CHT doplněná jednou amputací a dvakrát blokovou resekcí s aloštěpem. Další sledování bylo dostupné u čtyř nemocných v intervalu 11 - 73 měsíců. To ukázalo u 9leté dívky za 15 měsíců metastázu do pánve s následnou rychlou generalizací do plic a úmrtím (primární tumor femuru zde částečně prorůstal do dřeňové dutiny a po neoadjuvantní CHT byl řešen blokovou resekcí). U 15letého chlapce byla zjištěna za 13 měsíců metastáza do humeru obdobné histologie a byla opět ošetřena blokovou resekcí s další sérií CHT; po 62 měsících je hoch bez známek recidivy (primární tumor femuru neprorůstal do dřeňové dutiny, po blokové resekci následovala adjuvantní CHT). Zbylí dva nemocní žijí a jsou bez dalších projevů onemocnění.
Obr. 1. A: Nativní snímek zobrazující těžce kalcifikovanou juxtakortikální lézi metafýzy tibie s erozí kortikalis; v boční projekci patrné šíření do dřeňové dutiny (RTG). B: Nativní snímek distální metadiafýzy femuru s jemně mineralizovaným, výlučně periostálně uloženým tumorem a otokem přilehlých měkkých tkání (RTG). C: Rozsáhlý juxtakortikální nádor metafýzy femuru odtlačující měkké tkáně s masívní intraoseální propagací a doprovodnou dislokovanou zlomeninou (MRI). 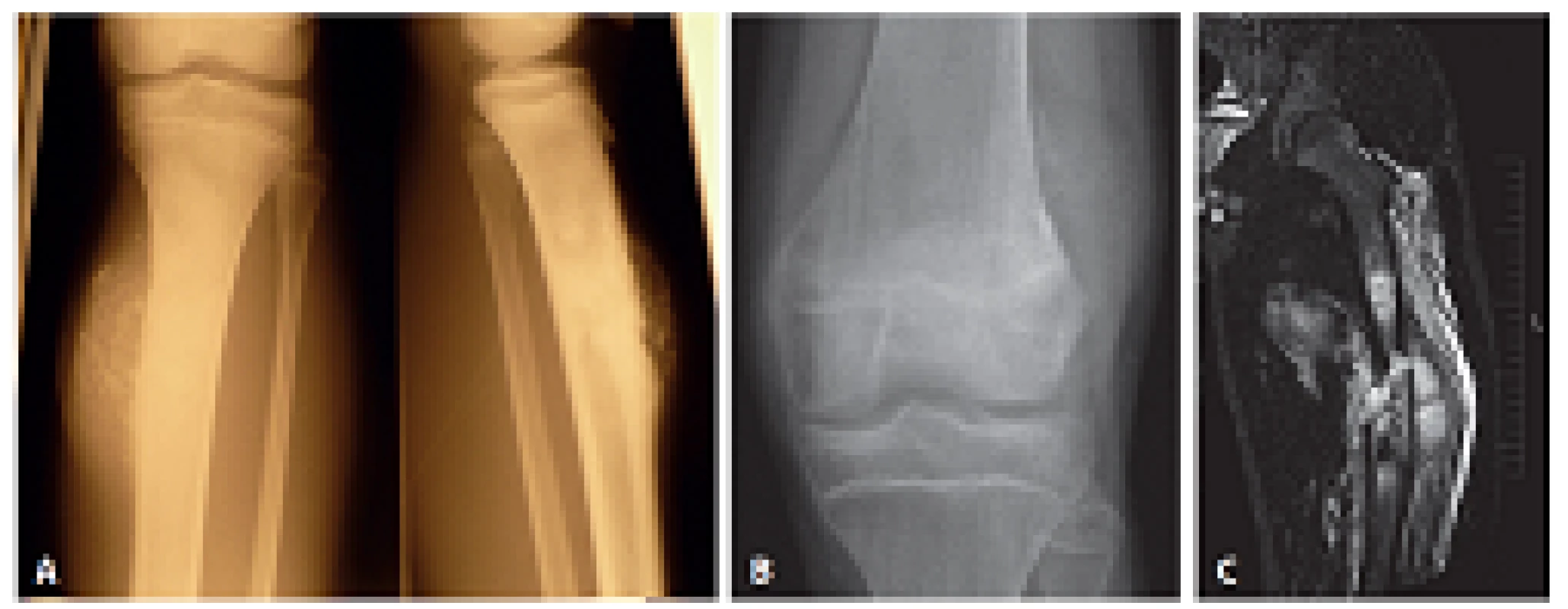
Morfologie, imunohistochemie a molekulární genetika
Histologický obraz byl ve všech případech překvapivě velmi podobný a principielně odlišný od chondroplastického konvenčního OS. Naprosto převládající chrupavčitá extracelulární matrix odpovídala spektru G2-3 chondrosarkomu a tvořila vždy více než 80 % celkového objemu nádoru (obr. 2). Přechod od okolní nádorové tkáně byl vesměs ostře ohraničen, což vzdáleně připomínalo organoidní uspořádání dediferencovaného chondrosarkomu (ChS); její morfologický vzhled byl však rozdílný a svým způsobem charakteristický. Velmi nenápadné, málo buněčné, prosáklé až myxoidní mezenchymální nádorové stroma zde bylo tvořené malými oválnými buňkami bez atypií, jen s ojedinělou pravidelnou mitotickou aktivitou (obr. 3). Teprve při pečlivém pozorování, a někdy až po rozsáhlém zpracování tkáně, se v těchto partiích podařilo zastihnout nenápadná obláčkovitá depozita osteoidu (obr. 4). Tyto oblasti, nacházející se až na jedinou výjimku mimo převažující chrupavčitou součást nádorů, byly však někdy intenzívně mineralizovány a potom bylo až nemožné je odlišit od mnohdy rozsáhle kalcifikované chondroidní matrix (obr. 5). Bezpečným vodítkem zde pak bylo imunohistochemické vyšetření s inverzní expresí antigenů S100 proteinu resp. D2-40 a SATB2 ve sporných úsecích rozdílných extracelulárních hmot (obr. 6). Vlastní mezenchymální nádorové stroma pak vždy beze zbytku postrádalo chondroidní fenotyp; naopak zde byla průkazná pozitivita SATB2 často i mimo osteoblasty osteoidních depozit. Celkové strukturální uspořádání, formování osteoidní matrix a absence evidentních maligních cytologických/jaderných znaků (vyjma chrupavky) se pak vymykaly typickému projevu jak dediferencovaného ChS tak chondroplastického konvenčního OS.
Obr. 2. Dominantní chrupavčitá součást POS odpovídající G2 chondrosarkomu byla ostře oddělena od okolního mezenchymálního stromatu, což vytvářelo dojem organoidního uspořádání vzdáleně připomínajícího dediferencovaný chondrosarkom (HE, 100x). 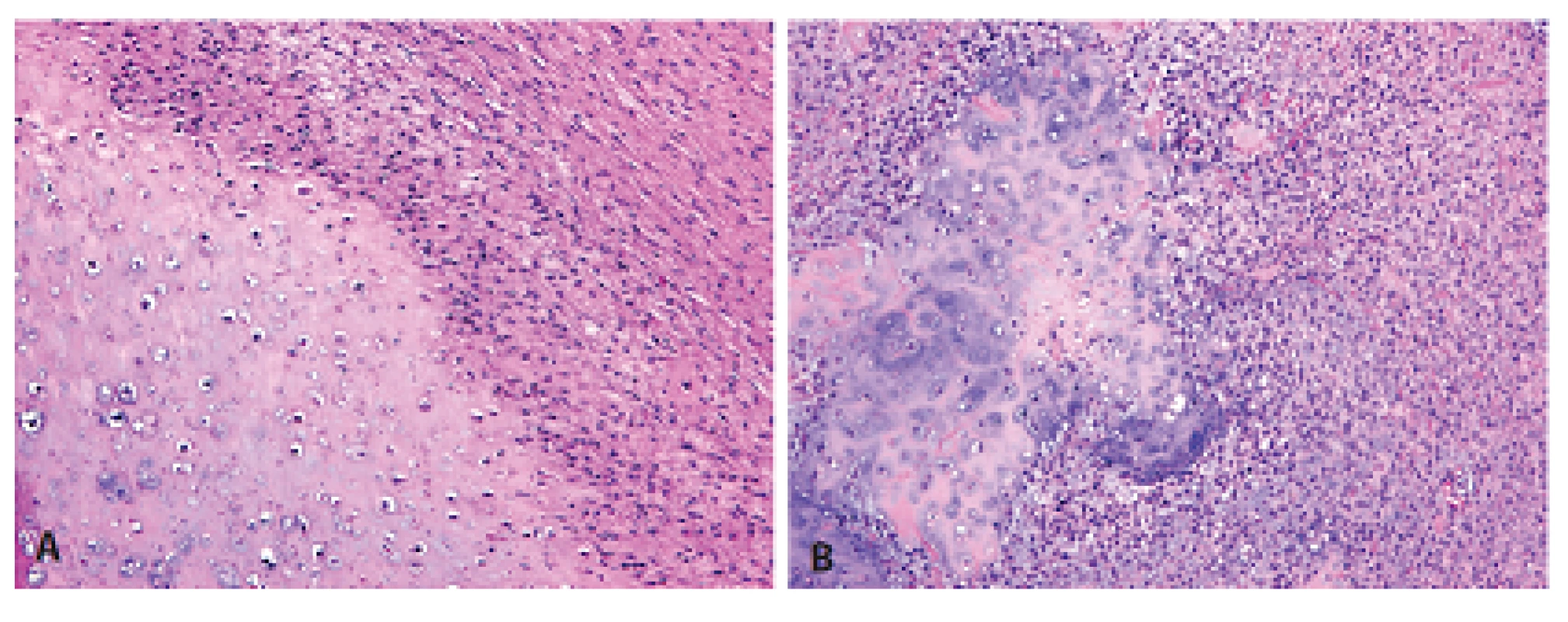
Obr. 3. Původní mezenchymální rozvolněné až myxoidní stroma vyhlíželo značně blandně a tvořily jej oválné nebo vřetenité buňky bez výraznějších atypií (HE, 200x). 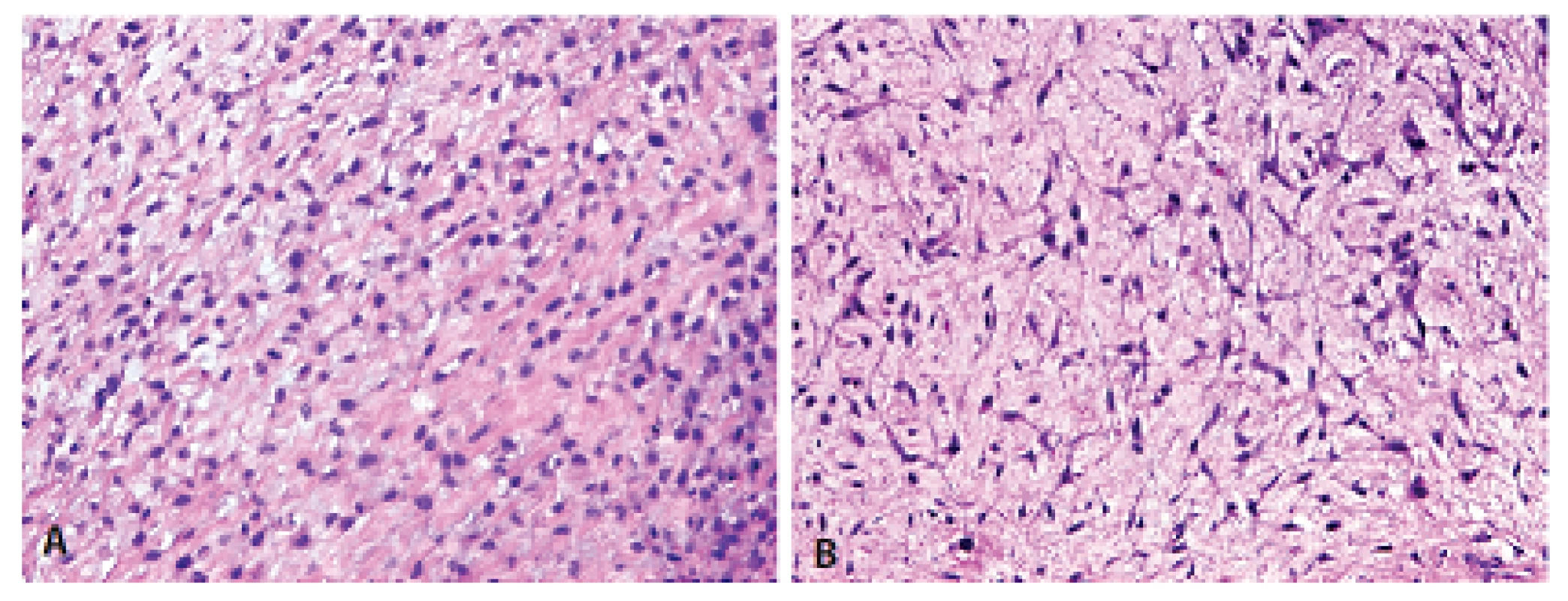
Obr. 4. Způsob ukládání diskrétní amorfní obláčkovité osteoidní matrix, produkované málobuněčným mezenchymem mimo chondromatózní partie, se dosti lišil od vzhledu konvenčního OSA (HE; A -100x, B - 200x). 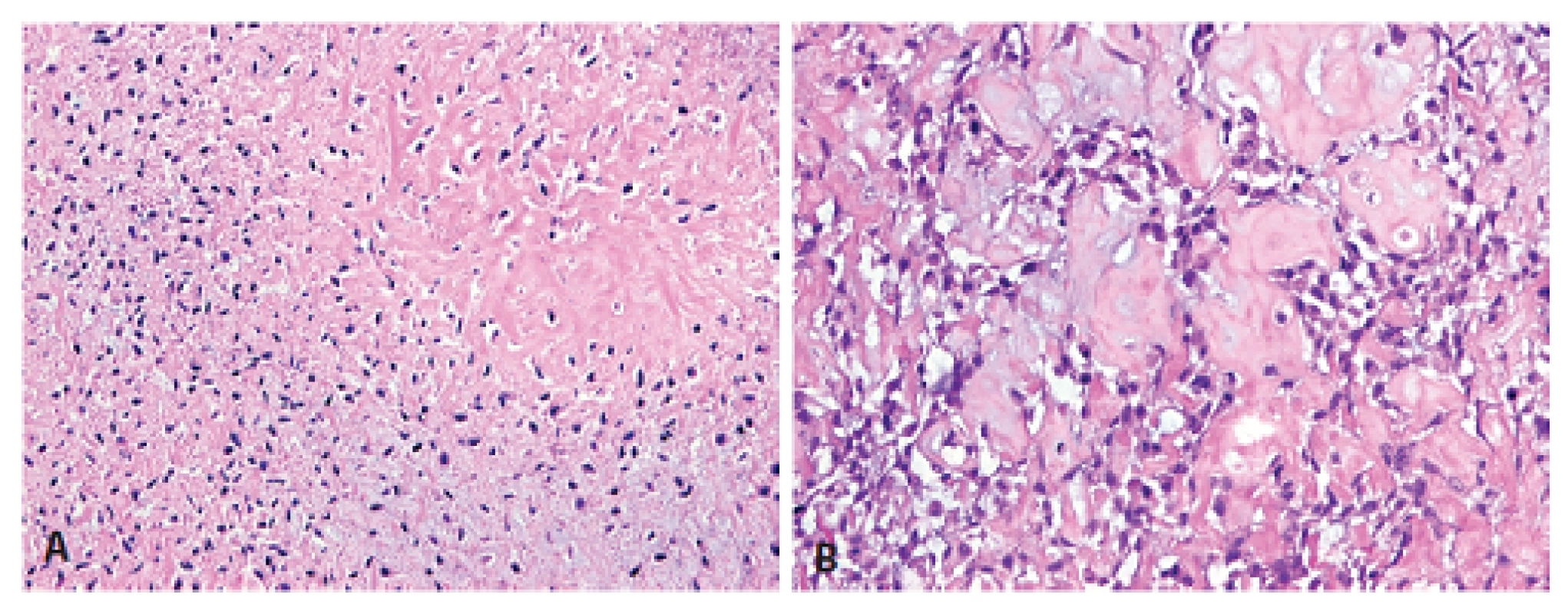
Obr. 5. Místní extenzívní mineralizace chondroidních resp. osteoidních hmot někdy úplně znemožňovala správné rozpoznání jejich skutečné diferenciace. A - chrupavka; B - osteoid (HE, 100x). 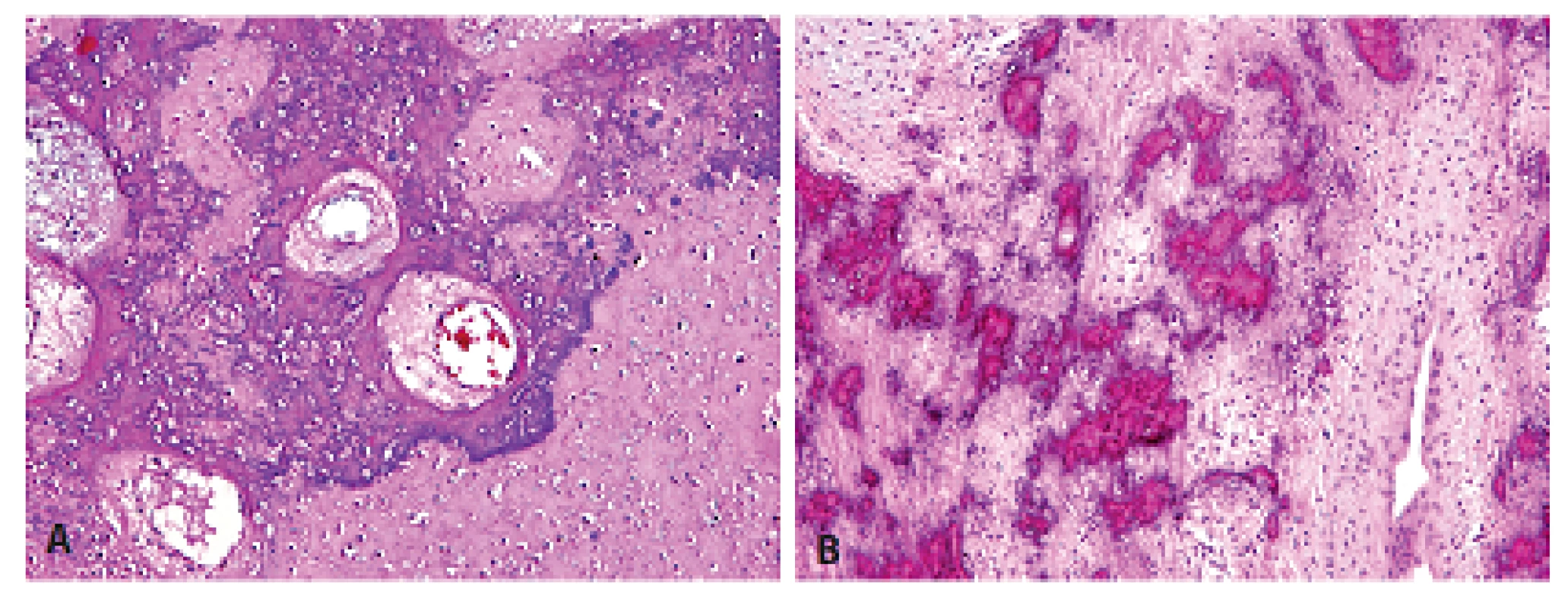
Obr. 6. Imunohistochemický průkaz antigenů SATB2 a D-2-40 dovolil spolehlivě odlišit nejen histogenetickou orientaci původního mezenchymu, ale i pravou podstatu výrazně kalcifikované rozdílné extracelulární matrix. A, B: Exprese SATB2 v nádorovém stromatu resp. mineralizovaném osteoidu. C, D: Exprese D2-40 v konvenční resp. mineralizované chondroidní matrix; stroma je negativní (200x). 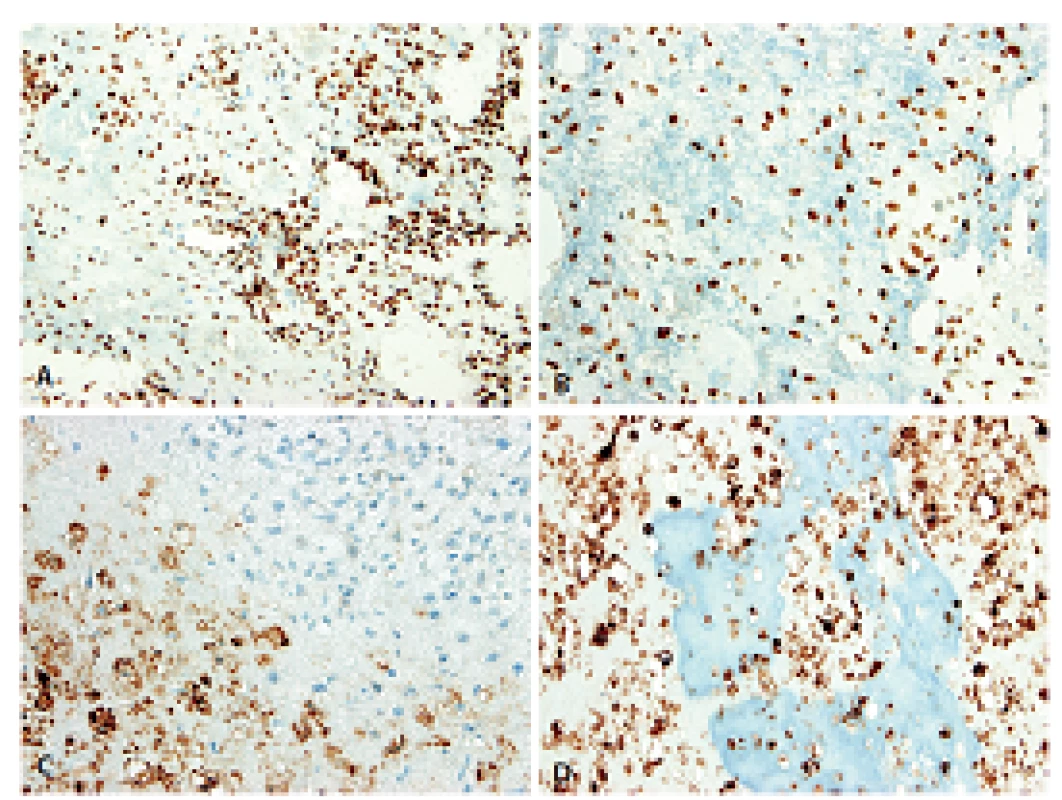
Molekulární analýza čtyř případů neprokázala mutaci genu IDH1 (R132H) resp. IDH2 (R140Q; R172K).
DISKUZE
Osteosarkom a chondrosarkom představují dva nejčastější primární maligní nádory kostí s rozdílným věkovým mediánem výskytu; přesto jak u konvenčního, tak u některých vzácnějších variant OS (např. parosteální OS) se jejich věkové rozložení značně překrývá. Na druhou stranu produkce nádorové chrupavčité matrix není omezena výlučně na primárně maligní chondrogenní tumory, ale může být rozsáhle zastoupena i např. v konvenčním (chondroplastickém), parosteálním či periostálním OS, což může významně ztěžovat přesné histogenetické zařazení léze především v malé probatorní biopsii. Je tedy pochopitelné, že konkrétně posledně jmenovaný POS byl historicky dlouho vnímán jako a priori chondrogenní nádor splývající s mimořádně vzácným periostálním ChS. Přesné rozlišení OS a ChS pak má terapeutický a prognostický význam; OS je obecně citlivější na chemoterapii a oproti ChS má principielně horší prognózu.
V diagnostice kostních nádorů má nezaměnitelnou úlohu radiologický obraz, přesněji řečeno úzká spolupráce patologa s kompetentním radiologem resp. specializovaným ortopedem. Exaktní interpretace nálezů zobrazovacích metod (RTG, CT, MRI) je zde klíčová např. v posouzení agresivity léze, přesného umístění a intimní topografie sousedících struktur; leckteré projevy jsou totiž v očích expertů pro mnohé léze až překvapivě určující. Morfologický dojem vnímaný v kontextu radiologických změn se pak může stát i pro POS téměř patognomonickým.
Literatura se dosti rozchází v několika důležitých aspektech týkajících se POS - např. radiologicko-makroskopickou definicí, popisovanými terapeutickými přístupy a biologickým chováním; morfologický projev je pak většinou jednotně dokumentován jako výrazně chondroplastický OS bez bližších určujících / „specifických“ histologických rysů (1,3-5,9-12). Lze např. jasně vyčíst, že prorůstá-li léze do dřeňové dutiny, je to pro některé znak principielně vylučující diagnózu POS; naopak jiní takto agresívní způsob růstu uvádějí a vnímají jej jako nepříznivý prognostický rys vyžadující vedle široké resekce i chemoterapii (1,3-5,10). Její efekt se však zdá nejistý; většina nemocných takto pokročilému procesu bohužel stejně podlehla. Čistě juxtakortikální uložení tumoru je naopak příslibem indolentního chování s dokládaným pěti resp. desetiletým přežitím kolem 80 % případů (1,4,11). U jednoho z našich pozorování paradoxně došlo v krátké době k histohomologní metastáze nádoru, který byl lokalizován striktně periostálně a byl zajištěn chemoterapií.
V našem malém souboru pěti případů POS jsme si povšimli nápadné mikroskopické podobnosti lišící se od běžných osteoplastických resp. chondroplastických kostních sarkomů, kterou však publikované zkušenosti výslovně nezmiňují. Zaujala nás neobvyklá strukturální/organoidní úprava a charakter produkce chondroidní, ale především osteoidní matrix. Vlastní mezenchymální, velmi blandně vyhlížející stroma bylo málo buněčné, prosáklé až myxoidní a společně s dominantní chondroidní složkou vytvářelo geografickou kompozici vzdáleně připomínající dediferencovaný ChS (kde však spíše menšinové chondromatózní součásti vévodí high-grade sarkom různých podob). Až na jedinou výjimku produkce osteoidu a chrupavky topograficky nesouvisela, jak je tomu běžně např. u chondroplastického konvenčního OSA. Naopak, delikátní depozita osteoidu byla omezena na relativně nevinné stroma, kde je bylo potřeba pečlivě hledat; obraz úplně odlišný od konvečního OSA, kde vesměs přesvědčivou kostěnou matrix ukládají buněčné shluky evidentně atypických osteoblastů. Lze říci, že na první pohled žádný z tumorů nevypadal jako typický OSA a stromální hypocelulární partie naopak mylně vzbuzovaly dojem myxoidní transformace převládající primárně chondroplastické neoplázie. Častá a někdy výrazná kalcifikace/mineralizace chondroidních i osteoidních hmot navíc nepříjemně stírala jejich morfologickou odlišnost. V obou těchto situacích imunohistochemické vyšetření usnadnilo rozeznat dvojakost matrikální diferenciace (pozn. - empirie s protilátkou SATB2 na vlastním materiálu nás přesvědčila, že primárně chondrogenní nádory kostí reagují vždy negativně).
Jako další možnost rozdílnosti histogenetické orientace chondrogenních a osteogenních tumorů se uvádí průkaz mutace genů IDH1/2, která se vedle gliomů a akutní myeloidní leukemie popisuje ve více než polovině chondromů (včetně Ollierovy nemoci a Maffuciho syndromu) a ChS (včetně dediferencovaného a juxtakortikálního) (2,7). Vzájemná incidence aberací IDH1 (R132H) resp. IDH2 (R172K; R140Q) v chondromatózních nádorech odpovídá asi 10 : 1 a v různých variantách OSA se prakticky nevyskytuje. Existují dosud ojedinělé práce dokumentující mutaci IDH2 (R172K) u třech konvenčních OSA resp. šestnácti (16/20; 80%) obrovskobuněčných kostních nádorů (6,8). Metodika sekvenování nové generace (next generation sequencing - NGS) může v brzké době ověřit specifitu tohoto testu a jeho využití v mezních případech diferenciální diagnostiky chondromatózních kostních nádorů. Čtyři naše vyšetřované nádory měly shodně wt IDH1/2 profil.
Literární zkušenosti někde připomínají též grading POS a to jak chondroplastické, tak i osteoplastické složky nádoru (1,10). Jakkoliv je grading ChS subjektivní, u našich případů dominoval stupeň G2 a pouze jednou jsme připustili G2-3. Náš pohled na grading osteogenní komponenty POS, popisovaný některými autory, se však liší. Společně s přesvědčením, že grade OSA obecně je determinován především typově (např. konvenční versus low-grade centrální či parosteální), rovněž u POS neshledáváme morfologický grading opodstatněným. Totiž, blandní vzhled mezenchymálních stromálních oblastí, charakter diskrétní produkce osteoidní matrix a organoidní integrace chrupavčitých struktur pokládáme za příznačné právě pro POS. Tento nepřehlédnutelný morfologický projev byl pak společný všem našim případům; nikde jsme nenalezli archetypální histologii chondroplastického (high-grade) konvenčního OSA. Lze spekulovat, zda některé publikované agresívní případy high-grade POS ve skutečnosti nebyly právě posledně zmíněným sarkomem, pouze juxtakortikálně uloženým.
Mikroskopická diferenciální diagnostika vedle již citovaného juxtakortikálního (high-grade) chondroplastického konvenčního OSA zahrnuje především periostální/juxtakortikální chondrom a ChS. Histologické obrazy obou těchto vzácných lézí se mohou značně překrývat a relativně spolehlivým (nikoliv absolutním) vodítkem je pouze věk a velikost. Lze říci, že léze větší než 3 cm u osoby nad 40 let bude nejpravděpodobněji ChS. Periostální ChS se na rozdíl od POS prakticky nikdy nechová agresívně vůči přilehlému skeletu; jen dostatečně reprezentativní materiál pak dovolí identifikovat diagnostické partie, které jsou pro POS charakteristické.
ZÁVĚR
Našich pět pozorování POS během deseti let tvořily pouze konzultační případy, což dokládá jeho vzácnost i v expertní praxi. Histologický obraz je však natolik osobitý, že při určité míře zkušeností a pečlivém prohlížení lze rozeznat rozdíl oproti „běžnému“ chondroplastickému OSA a dalším imitátorům. Při pochybnostech o histogenetické orientaci neurčité extracelulární matrix je efektivní imunohistochemické vyšetření (SATB2 S100 protein, D2-40 atd.) a přínosnou může být analýza mutace genů IDH1/2. Biologické chování POS, na rozdíl od low-grade centrálního či parosteálního OSA, zejména při agresívním růstu a šíření do dřeňové dutiny, se kvalitativně přibližuje konvenčnímu OSA se všemi klinicko-terapeutickými aspekty.
PODĚKOVÁNÍ
Autoři děkují prim. MUDr. Petrovi Mukenšnáblovi, Ph.D. za zhotovení kvalitní fotografie a Mgr. Vratislavu Šedivcovi za laboratorně technologickou a grafickou asistenci.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Zdeněk Kinkor, Ph.D.
Bioptická laboratoř s.r.o.,
Mikulášské nám. 4, 326 00 Plzeň
tel.: +420 737 220 449
e-mail: kinkor@medima.cz
Zdroje
1. Cesari M, Alberghini M, Vanel D, Palmerini E, et al. Periosteal osteosarcoma: a single institution experience Cancer 2011; 117 : 1731-1735.
2. Damato S, Alorjani M, Bonar F, McCarthy SW, et al. IDH1 mutations are not found in cartilaginous tumors other than central and periosteal chondrosarcomas and enchondromas. Histopathol 2012; 60 : 363-365.
3. Delling G, Amling M, Posl M, Ritzel H, et al. Periosteal osteosarcoma. Histologic characteristics, preparation technique, growth pattern and differential diagnosis. Pathologe 1966; 17 : 86-91.
4. Grimer RJ, Bielack S, Flege S, Cannon SR, Foleras G. Periosteal osteosarcoma: a European review of outcome. Eur J Cancer 2005; 41 : 2806-2811.
5. Gulia A, Puri A, Pruthi M Desai S, et al. Oncological and functional outcome of periosteal osteosarcoma. Indian J Orthop 2014; 48 : 279-284.
6. Kato K, Liu X, Oki H, Ogasavara S, et al. Isocitrate dehydrogenase mutation is frequently observed in giant cell tumor of bone. Cancer Sci 2014; 105 : 744-748.
7. Kerr DA, Lopez HU, Deshpande V, Hornicek FJ, et al. Distinction of chondrosarcoma from chondroblastic osteosarcoma trough IDH1/2 mutations. Am J Surg Pathol 2013; 37 : 787-795.
8. Liu X, Kato Y, Kaneko MK, Sugawara M. Isocitrate degydrogenase 2 mutation is a frequent event in osteosarcoma detected by a multi-specific monoclonal antibody MsMab-1. Cancer Med 2013; 2 : 803-814.
9. Murphey MD, Jelinek JS, Temple HT, Flemming DJ, Gannon FH. Imaging of periosteal osteosarcoma: radiologic-pathologic comparison. Radiology 2004; 233 : 129-138.
10. Revell MP, Deshmukh N, Grimer RJ, Carter SR et al. Periosteal osteosarcoma: a review of 17 cases with mean follow-up of 52 months. Sarcoma 2002; 6 : 123-130.
11. Rose PS, Diskey ID, Wenger DE, Unni KK, Sim FH. Periosteal osteosarcoma: long-term outcome and risk of late recurrence. Clin Orthop Relat Res 2006; 453 : 314-317.
12. Suehara Y, Yazawa Y, Hitachi K, Yazawa M et al. Periosteal osteosarcoma with secondary bone marrow involvement: a case report. J Orthop Sci 2004; 9 : 6
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2015 Číslo 4-
Všechny články tohoto čísla
- Transplantační patologie - II. díl
- Veškerá mizérie je v tom, že hlupákům je všechno jasné, zatímco moudří jsou samá pochybnost (Bertrand Russell)
- MONITOR aneb nemělo by vám uniknout, že ...
- MONITOR aneb nemělo by vám uniknout, že ...
- Transplantace jater z pohledu hepatologa
- Role patologa v programu transplantací jater
- MONITOR aneb nemělo by vám uniknout, že ...
- Morfologie chirurgických komplikací v biopsiích jater časně po transplantaci
- Karcinomy dutiny ústní a hltanu
- Diagnostika rejekce v transplantovaných játrech
- Rekurence primárních chorob po transplantaci jater
- MONITOR aneb nemělo by vám uniknout, že ...
- Transplantace plic v České republice – z pohledu patologa
- MONITOR aneb nemělo by vám uniknout, že ...
- Biopsie renálních štěpů: průvodce spletitými detaily pro získání nejlepších výsledků
- Chirurgické techniky orgánových transplantací
- MONITOR aneb nemělo by vám uniknout, že ...
- Periostální osteosarkom - osobní zkušenost s pěti případy
- MONITOR aneb nemělo by vám uniknout, že ...
- Pitva mozku a míchy při diagnóze neurodegenerativního onemocnění – praktický postup pro optimalizaci vyšetření
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Periostální osteosarkom - osobní zkušenost s pěti případy
- Transplantace plic v České republice – z pohledu patologa
- Diagnostika rejekce v transplantovaných játrech
- Chirurgické techniky orgánových transplantací
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



