-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba surfaktantem
Surfactant treatment
Surfactant therapy is essential for the treatment of respiratory distress syndrome. A modern approach to the treatment of the syndrome is to use distension support with nasal continuous positive airway pressure, upon meeting the criteria to administer surfactant as soon as possible, using the gentlest, less invasive method, before injuring the immature lung. The goal is to avoid invasive positive pressure ventilation that is harmful and poses a risk of lung damage. If intubation is necessary during stabilization, the rule of thumb is to administer surfactant as soon as possible and direct the newborn to early extubation and non-invasive respiratory support. The following text focuses mainly on specific points of the European consensus guidelines on the management of respiratory distress syndrome: 2022 update.
Keywords:
surfactant, respiratory distress syndrome, distension support, nCPAP, meconium aspiration, pulmonary hemorrhage, bronchopulmonary dysplasia
Autoři: J. Termerová
Působiště autorů: Klinika gynekologie, porodnictví a neonatologie, 1. LF UK a VFN, Praha
Vyšlo v časopise: Čes-slov Neonat 2023; 29 (2): 94-101.
Kategorie: Příspěvky k respirační problematice nezralých novorozenců
Souhrn
Terapie surfaktantem je zásadní pro léčbu syndromu dechové tísně. Moderním přístupem v léčbě syndromu je použití distenzní podpory kontinuálním pozitivním tlakem v dýchacích cestách, při splnění kritérií podat surfaktant co nejdříve, co nejšetrnější méně invazivní metodou ještě před poraněním nezralé plíce. Cílem je vyhnout se zraňující invazivní přetlakové ventilaci, která představuje riziko poškození plic. Pokud je při stabilizaci nutná intubace, i zde platí pravidlo podat surfaktant co nejdříve a směřovat novorozence k časné extubaci a neinvazivní dechové podpoře. Následující text se zaměřuje především na konkrétní body European consensus guidelines on the management of respiratory distress syndrome: 2022 update.
Klíčová slova:
surfaktant, syndrom dechové tísně, distenzní podpora, nCPAP, aspirace mekonia, plicní krvácení, bronchopulmonální dysplazie
EVROPSKÁ DOPORUČENÍ
V European consensus guidelines on the management of respiratory distress syndrome: 2022 update (EC 2022) jsou v oddílu Surfactant therapy uvedena následující doporučení:
- Babies with RDS should be given an animal-derived surfactant preparation (A1).
- LISA is the preferred method of surfactant administration for spontaneously breathing babies on CPAP (A1).
- Laryngeal mask surfactant may be used for more mature infants > 1.2 kg (B2).
- If a preterm baby < 30 week’s gestation requires intubation for stabilisation they should be given surfactant (A2).
- Rescue surfactant should be given early in the course of the disease (A1). Suggested protocol would be to treat worsening babies with RDS when FiO2 > 0.30 on CPAP pressure ≥ 6 cmH2O or if lung ultrasound suggests surfactant deficiency (B2). A lower FiO2 threshold may be considered for very immature infants (C2).
- An initial dose of 200 mg/kg of poractant alfa is better than 100 mg/kg of poractant alfa or 100 mg/kg beractant for rescue therapy (A1).
- A second and occasionally a third dose of surfactant should be given if there is ongoing evidence of RDS such as persistent high oxygen requirement and other problems have been excluded (A1).
Obr. 1. Aplikace surfaktantu LISA metodou pomocí videolaryngoskopu 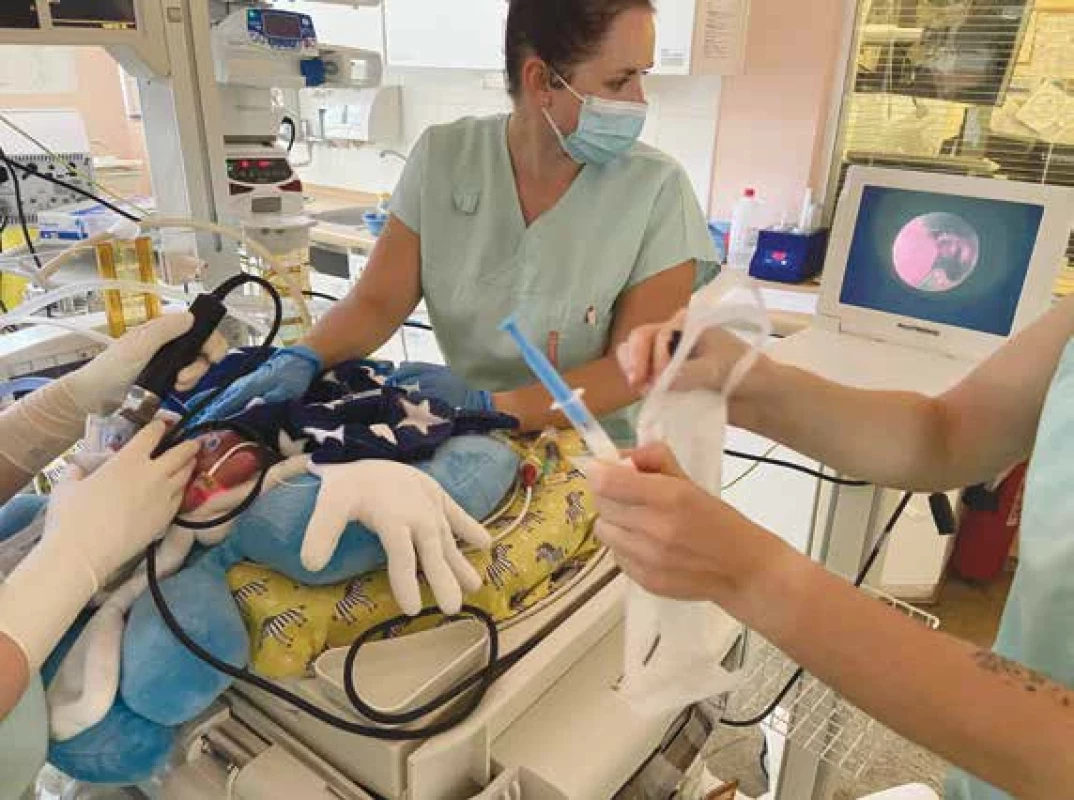
SURFAKTANT PŘI SYNDROMU DECHOVÉ TÍSNĚ NOVOROZENCŮ
Řada otázek v léčbě syndromu dechové tísně (RDS) zůstává ne zcela vyjasněných, protože není dostatek randomizovaných klinických studií, o které se lze opřít. Týká se to metody aplikace surfaktantu, časování jeho podání nebo opakovaného podání. Iniciativa RDS-NExT, která se vedle randomizovaných klinických studií opřela o průzkum mezi zkušenými neonatology, doplňuje Evropské doporučení pro klinické rozhodování v léčbě RDS [1] a stejně tak i další národní doporučení [2, 3].
1. Děti s RDS, které vyžadují léčbu, by měly dostat přípravek se surfaktantem živočišného původu (úroveň důkazu grade A1) [4].
Léčba surfaktantem je v neonatologii opřená o silné důkazy z klinických studií. Vede k rychlému zlepšení oxygenace, snižuje potřebu umělé plicní ventilace u RDS, snižuje riziko poranění plíce (pneumothoraxu), snižuje mortalitu, ale i riziko chronické plicní nemoci.
2. LISA je preferovaná metoda aplikace surfaktantu pro spontánně dýchající novorozence na distenzní léčbě CPAP (úroveň důkazu grade A1).
Současným cílem léčby RDS je vyhnout se nežádoucím důsledkům intubace a zraňující umělé plicní ventilace, primárně tedy preferovat metody známé jako méně invazivní aplikace surfaktantu (less invasive surfactant administration, LISA) nebo minimálně invazivní aplikace surfaktantu (minimal invasive surfactant therapy, MIST). Zásadní rozdíl mezi metodou LISA a INSURE (INtubation–SURfactant – Extubation) je nutnost prodýchávání pozitivním přetlakem u metody INSURE. Metoda LISA umožňuje spontánní ventilaci dítěte na distenzní podpoře kontinuálním pozitivním tlakem v dýchacích cestách (nasal continuous positive airway pressure, nCPAP) během aplikace surfaktantu a pravděpodobně i lepší distribuci surfaktantu v plicích. Obě techniky zahrnují přímou laryngoskopii, ale při metodě INSURE se používají standardní endotracheální kanyly (ETC) a adekvátní analgosedace pro intubaci. Při metodě LISA je možné úplně eliminovat ventilaci s pozitivním přetlakem, eventuálně i analgosedaci. Neinvazivní metody aplikace surfaktantu mohou vést ke snížení kombinovaného ukazatele smrti nebo bronchopulmonární dysplazie (BPD), u dětí ve věku < 26 g. t. i ke snížení rizika intraventrikulárního krvácení (intraventricular hemorrhage, IVH) [5].
Metoda LISA je podle studií bezpečná a již široce používaná metoda v různých částech Evropy. Časné podání surfaktantu metodou LISA snižuje náklady na léčbu snížením potřeby ventilace a snížením rizika rozvoje BPD. Postupně přibývají důkazy, a to včetně metaanalýzy studií, že metoda LISA vychází jako nejpreferovanější metoda pro aplikaci surfaktantu a metoda INSURE s neinvazivní nazální ventilací jako druhá preferovaná metoda [6]. Pro délku aplikace surfaktantu nejsou jasná doporučení. Z praktických důvodů jde o delší čas než u metody INSURE, protože nezralý novorozenec používá k distribuci surfaktantu vlastní dechové úsilí. Doba aplikace má široké rozpětí od 30 sekund po 3 minuty, aplikace by měla probíhat pomocí opakovaných malých bolusů. Dostupné studie týkající se metody LISA mají své limitace jak ve velikosti souborů, tak v metodice i v postupech, které srovnávají (např. zkreslení časnou vs. pozdní aplikací surfaktantu). Nejvhodnější metoda pro aplikaci surfaktantu závisí na řadě okolností, zejména na zkušenosti ošetřujícího týmu a typu pacienta (na jeho gestačním věku a tíži RDS). Další otázkou při použití metody LISA zůstává použití analgosedace. Laryngoskopie při metodě LISA je pro pacienta nepříjemná, analgetika a sedativa mohou zvýšit komfort, tlumí však spontánní dechovou aktivitu, a komplikují tak dobrou distribuci surfaktantu. Při použití sedace také roste riziko apnoických epizod vyžadujících umělé prodechy až umělou plicní ventilaci. Z doposud dostupných studií vyplývá, že nebyly pozorovány zásadní rozdíly při použití opiátů, perorální sacharózy či při aplikaci metody LISA bez použití analgosedace. Intravenózní atropin se rutinně nepoužívá pro méně invazivní metody podávání surfaktantu (maskování prolongované hypoxie), navíc podání surfaktantu by nemělo být odkládáno z důvodu zajištění i.v. vstupu.
Dle zkušeností našeho pracoviště je LISA metoda bezpečná a účinná u nezralých novorozenců s dobrým dechovým úsilím na podpoře nCPAP. Surfaktant metodou LISA indikujeme při hodnotě FiO2 0,3 obvykle při nastavení hodnoty pozitivního tlaku na konci expiria (positive end-expiratory pressure, PEEP) na 7 cmH20 (784,5 Pa). U vysoké dechové práce aplikujeme surfaktant již při nižších hodnotách FiO2. Aplikujeme na distenzní podpoře nCPAP, kdy se tak ve většině případů vyhneme umělým prodechům, což je jedním z hlavních benefitů této metody. V případech jejího selhání jsme pro opakované podání volili metodu INSURE (cca 11 % případů). S komplikacemi při aplikaci jsme se setkali vzácně (1× pneumothorax, 3× laryngospasmus při laryngoskopii, 1× rozvoj plicní hypertenze). Ani jednou jsme nezaznamenali jednostranné podání. Máme-li k dispozici venózní přístup, aplikujeme před podáním kofein i.v. Naše dohoda pro délku aplikace je 60 sekund. U novorozenců v nejnižších hmotnostních kategoriích nebo s nepravidelným dýcháním dobu aplikace prodlužujeme, vyvarujeme se tak většímu refluxu a komplikacím ze špatné distribuce (apnoe). Vhodné je rychlost aplikace přizpůsobit dechové aktivitě dítěte – pokud zpomalí, aplikaci zpomalíme či přerušíme a po stimulaci a obnovení dechové aktivity znovu v aplikaci pokračujeme. Dobrou zkušenost máme s použitím videolaryngoskopu, zvláště mladší lékaři oceňují možnost kontroly správné techniky podání do trachey. Vzhledem k riziku, které přináší analgosedace, používáme jen nefarmakologické metody klidnění před laryngoskopií. S našimi přibývajícími zkušenostmi s metodou LISA narůstá i počet extrémně nezralých novorozenců (< 25. g. t.), u kterých jsme metodu úspěšně použili v případech, kdy měli dobrou dechovou aktivitu. Bezpečnost metody LISA u populace extrémně nezralých novorozenců bude potřeba ještě ověřit dalšími studiemi, které tuto kategorii zahrnou ve větší míře.
3. U dětí s porodní hmotností > 1,0 kg lze použít pro aplikaci surfaktantu také laryngeální masku (úroveň důkazu grade B2).
Nejvhodnější metodou pro podání surfaktantu by byla metoda bez nutnosti vystavení novorozence nepříjemné laryngoskopii, např. pomocí laryngeální masky (laryngeal mask airways, LMA). Dostupných studií zatím není mnoho, z toho důvodu je úroveň doporučení B2. Studie K. Roberts et al. zaměřená na děti s p. h. ≥ 1250 g prokázala nižší procento intubovaných a ventilovaných dětí (38 % LMA vs. 64 % u kontrolní skupiny) [7]. Studie J. Gallup et al. srovnávala děti s p. h. > 810 g. Skupina s laryngeálním podáním surfaktantu neměla horší výsledky oproti skupině s aplikací surfaktantu metodou INSURE, jenž byla zatížená premedikací remifantanilem. Skupiny měly poměrně vysoké selhání terapie surfaktantem: 20 % u LMA a 29 % u INSURE [8].
S laryngeární maskou bohužel nemá naše oddělení zkušenosti, preferovanou metodou je u nás LISA, eventuálně INSURE. Při záchranné (rescue) aplikaci před převozem může být laryngeální maska vhodnou alternativou. Zatím nemáme dostatečné zkušenosti, abychom mohli metodu doporučit ke standardnímu podání surfaktantu. Metoda je navíc omezená dostupností vhodných masek pro děti s hmotností < 1,2 kg.
4. Vyžaduje-li nedonošený novorozenec (gestační stáří < 30 týdnů) ke stabilizaci intubaci, měl by mu podle EC RDS 2022 být bezprostředně po zaintubování aplikován surfaktant (úroveň důkazů grade A2).
Dle přehledu F. Bahadue et al. u dětí s RDS, vyžadujících umělou plicní ventilaci, časné podání surfaktantu v prvních 2 hodinách života snižuje riziko úmrtí, plicního poranění a chronické plicní nemoci [9]. Je tedy doporučováno bezprostřední podání surfaktantu u intubovaných novorozenců.
Na našem pracovišti nezralým novorozencům, kteří vyžadují intubaci na porodním sále, aplikujeme surfaktant ihned po zaintubování a ověření správné polohy endotracheální kanyly, přestože jasně definovanou hranici 30. g. t. tak ostře nevnímáme. Aplikaci provádíme pomocí vedlejšího portu u endotracheální kanyly. V případě, že vedlejší port na endotracheální kanyle není, aplikujeme surfaktant pomocí i.v. kanyly zavedené po rozpojení okruhu do endotracheální kanyly a po opětovném spojení systému následně prodýcháme přes Neo-puff. U části periviabilních novorozenců, kteří jsou zcela specifickou skupinou (22. až 23. g. t.), ve vysokém riziku IVH, bez antenatálních kortikosteroidů podaných matce, volíme i elektivní intubaci s podáním surfaktantu ještě před arteficiální aerací plic [10].
5. Surfaktant by měl být podán co nejdříve v průběhu RDS (grade A1). Navrhovanou hranicí pro léčbu RDS surfaktantem je frakce O2 ve vdechované směsi (FiO2) > 0,3 při definovaném tlaku CPAP ≥ 6 cmH2O (588,4 Pa) nebo pokud ultrazvuk plic prokazuje známky RDS (B2). Nižší hranice může být zvažována pro těžce nezralé novorozence (C2).
Rozsáhlá diskuse je věnována hranici FiO2 na distenzní podpoře nCPAP, při které bychom měli zvažovat podání surfaktantu. Hranice má jasnou souvislost s mírou dechové podpory (čím vyšší podporu použijeme, tím nižší FiO2; zvyšování distenze tak může vést k nežádoucímu oddálenému podání surfaktantu), proto je nutné hranici FiO2 vztáhnout k úrovni tlakové podpory. Použití nižší hranice by sice vedlo k časnější aplikaci surfaktantu, zároveň by to však mohlo vystavit větší počet dětí riziku souvisejícímu s aplikací surfaktantu, laryngoskopie, eventuálně umělé plicní ventilace.
Mezi pozitiva definované hranice patří jednoduchost a možnost generalizace na širokou populaci nezralých novorozenců. Negativně mohou neonatologové vnímat nedostatečné zohlednění dalších faktorů, které tíži a průběh RDS zásadně ovlivňují: gestační věk, aplikace antenatálních steroidů, kardiovaskulární stabilita a úroveň dechové podpory. U velmi nezralých dětí předpokládáme těžší průběh RDS, tudíž by mohly z nižší hranice FiO2 a časnější aplikace surfaktantu profitovat. Proto iniciativa RDS-NExT ve své indikační tabulce k aplikaci surfaktantu zohledňuje gestační věk (< 28. g t. / ≥ 28. g. t.), úroveň dechové podpory (střední tlak v dýchacích cestách [mean airway pressure, MAP] 6/7 cmH2O [686,47/784,5 Pa]), požadavky na FiO2 vzhledem k postnatálnímu věku (≤ 2 hod. života = 0,3 / > 2 hod. života = 0,4) a hodnoty acidobazické rovnováhy. Další z faktorů, které je vhodné brát v úvahu, jsou možnosti podání surfaktantu na daném pracovišti a s ním související rizika. Znamená-li aplikace surfaktantu použití invazivní umělé plicní ventilace, je namístě vyšší hranice FiO2 po podání. Pokud je k dispozici zkušený tým a je možné méně invazivní podání surfaktantu, může být pro novorozence přínosnější použití nižší hranice FiO2. Dalším pomocným parametrem při rozhodování může být dechová práce, ta je však velmi subjektivní.
Z rozsáhlé populační švédské studie (100 000 novorozenců, 8000 aplikací surfaktantu) vyplývá, že postnatální věk při podání surfaktantu vykazoval tři výrazné vrcholy: první a největší vrchol nastal 10 minut po narození (z toho se v 70 % jednalo o extrémně nezralé novorozence), druhý vrchol nastal mezi 8. až 10. hodinou po narození a třetí vrchol nastal 24–30 hodin po narození. Celkem 39 % novororozenců (22.–31. g. t.) dostalo surfaktant déle než 2 hodiny po porodu, tedy později, než je doporučováno. Pozdější podání bylo asociováno s vyšším rizikem pneumothoraxu (adjustovaný poměr šancí [adjusted odd ratio, aOR] 2,59; 95% interval spolehlivosti [confidence interval, CI] 1,76–3,83) a IVH stupně III a IV (aOR 1,71; 95% CI 1,23–2,39), použitím postnatálních kortikosteroidů, podpory CPAP, ale také s vyšším přežíváním u dětí z 28.–31. g. t. (aOR 1,45; 95% CI 1,10–1,91). Dále bylo uvedeno, že 6 % ventilovaných dětí nedostalo surfaktant vůbec. Vyšší mortalita u časného podání po porodu je ve studii vysvětlena pravděpodobným těžším stupněm RDS a rozsáhlejší resuscitací na porodním sále, což si časné podání surfaktantu vyžádalo [11].
Pozitivním přínosem nového doporučení z roku 2022 je zmínění ultrazvuku plic jako neinvazivního opakovatelného nástroje k odhadu aerace parenchymu, který může nabídnout alternativní způsob diagnostiky RDS již v časném stadiu. Použití ultrazvuku plic v diagnostice RDS nevede k vyššímu počtu léčených dětí [12]. Sonografický obraz špatné aerace plic může pomoci v rozhodování o léčbě RDS u všech věkových a hmotnostních skupin novorozenců, avšak jistě jsou zapotřebí další studie. Časné vysoké skóre ultrazvuku plic (lung ultrasound score, LUS) koreluje s potřebou podávání surfaktantu u předčasně narozených novorozenců s RDS. Přítomnost B-linií, výraznější echogenita pleury a konsolidace tkáně jsou nejčastější ultrazvukové známky nedostatečné vzdušnosti plic při RDS. Naproti tomu pravidelná linie pleury, A-linie, je typickým nálezem u přechodné tachypnoe novorozenců (transient tachypnea of the neonate, TTN), „double lung point“ může, ale nemusí být u TTN přítomný [13]. V současné době také probíhají klinické studie s možností rychlého testování složek surfaktantu ze žaludečního aspirátu, které probíhá u lůžka (bed-side).
Pro specifickou skupinu hraničně zralých či late preterm dětí, pro které nemáme dostatečná data, probíhá studie SURFON (surfactant or not) [14].
Také naše pracoviště používá nejčastěji hranici pro podání surfaktantu na nCPAP FiO2 0,3. Ve vnitřním standardu revidovaném roku 2018 najdeme sice rozlišení dle postnatálního stáří dítěte a dalších faktorů, avšak v praxi je hranice FiO2 0,3 skutečně používána nejvíce. Při výrazné dechové práci aplikujeme surfaktant již při nižších hodnotách. Standardní nastavení CPAP je dle našich zvyklostí 7 cmH2O a před aplikací ho dále nezvyšujeme. U časného podání do 3 hodin po porodu neprovádíme RTG plic. U pozdějšího podání, opakovaného podání či při podezření na jinou patologii než RDS provedeme RTG hrudníku vždy. Ultrazvukové vyšetření plic se postupně dostává i do naší praxe, zatím nejvíce při rozhodování u RDS či TTN u late pretem novorozenců. Zkušenosti s ultrazvukem plic sbíráme. Naopak po podání surfaktantu, po stabilizaci novorozence je vhodné při dobré saturaci bez oxygenoterapie distenzní úroveň postupně snižovat, a vyvarovat se tak hyperinflaci.
6. Úvodní rescue léčebná dávka 200 mg/kg poractantu alfa je lepší než 100 mg/kg poractantu alfa nebo 100 mg/kg beractantu (A1).
V České republice je dostupný poractant alfa (Curosurf), frakce fosfolipidů animálního původu z prasečích plic.
Doporučená dávka je 100–200 mg/kg, přičemž použití vyšších dávek (200 mg/kg) přináší příznivější výsledky. Nové syntetické surfaktanty se v klinických studiích ukázaly jako slibné, bohužel tyto syntetické látky zatím nejsou komerčně dostupné.
Na naší jednotce intenzivní a resuscitační péče používáme standardně poractant alfa v dávce 200 mg/kg jak při podávání surfaktantu metodou INSURE, tak při metodě LISA. Dávku zaokrouhlujeme spíše směrem nahoru pro celé ampule, často doprovází podání metodou LISA malé množství refluxu.
V současné době probíhají další slibné studie jako PLUSS trial, tj. podávání surfaktantu v kombinaci s inhalačním budesonidem (beta-mimetikum a inhalační kortikosteroid), zatím bohužel bez publikovaných výsledků [15].
7. Druhá a eventuálně třetí dávka surfaktantu by měla být aplikována při přetrvávajících známkách RDS, jako jsou vysoké požadavky na oxygenoterapii po vyloučení jiných příčin (A1).
Průběh RDS může vyžadovat podání druhé či třetí dávky surfaktantu. Nejvíce se týká novorozenců narozených v nejnižších gestačních týdnech, protože gestační věk je nejdůležitější prediktor tíže RDS. Přirozený pool surfaktantu je u extrémně nezralých dětí 2 až 10 mg/kg, oproti tomu u termínových 100 mg/kg [16]. To může vysvětlovat opakovanou potřebu exogenního surfaktantu, dokud se endogenní produkce nezačne zvyšovat v cca 48.–72. hodině života. Chybí studie o opakovaném podání surfaktantu z recentních let, během kterých se přístup v léčbě poněkud změnil (zavedení metody LISA, méně invazivní metody dechové podpory). Minimální rozestup mezi dávkami v doporučení EC 2022 není definován. Například doporučení Canadian Pediatric Society stanoví opakované podání surfaktantu během prvních 72 hodin při přetrvávání obtíží, pokud nároky na FiO2 znovu stoupají > 0,3 po 2–6 hodinách po předchozí aplikaci [17].
Z již výše zmiňované populační švédské studie vyplynulo: Z 8000 aplikací surfaktantu bylo 59 % podáno jednorázově, ve 26 % se jednalo o opakované (tedy dvě) podání a v 7 % šlo o tři podání, v necelých 3 % byly provedeny čtyři a více [11].
Na naší klinice při podpoře nCPAP zvažujeme podání druhé dávky surfaktantu s minimálním rozestupem 6 hodin, a to po kontrole RTG a echokardiografickém vyšetření (vyloučení plicní hypertenze). Opakovanou dávku zvažujeme v případech, kdy z různých důvodů surfaktant nedosáhl pneumocyty II. typu (správnost podání, správná distribuce, dobře otevřená plíce). U dětí s nejmenší porodní hmotností, které jsou většinou na oscilační umělé plicní ventilaci, podání další dávky připadá v úvahu po opakovaném splnění výše uvedených iniciačních indikačních kritérií po předcházejícím prokazatelném účinku. Nejvíce zvažujeme tři dávky během 24 hodin.
Nebulizační forma aplikace surfaktantu by byla nejvíce šetrná, neinvazivní. Dosavadní studie s nebulizační formou surfaktantu bohužel nepřinesly jasný benefit, a proto nebyla zavedena do klinické praxe. Recentní studie J. J. Cummings et al. zatím jako první přinesla výsledky potvrzující snížení potřeby intubace při aplikaci aerosolové formy přímo do trachey u gestačně vyšší věkové skupiny s mírným až středně těžkým RDS [18].
Doporučení EC 2022 krátce zniňuje možnost podání surfaktantu z jiných důvodů než RDS. Se sekundárním deficitem surfaktantu z jiných příčin se můžeme setkat u komplikací, jako je plicní krvácení, syndrom aspirace mekonia (meconium aspiration syndrome, MAS) u termínových dětí, ale také infekce, asfyxie či atelektázy. K ověření diagnózy je vhodné doplnit nový rtg snímek, eventuálně ultrazvuk plic či srdce. Surfaktant byl také testován u předčasně narozených dětí s vyvíjejícím se BPD.
LÉČBA SURFAKTANTEM U SYNDROMU ASPIRACE MEKONIA
Aspirované mekonium má na plíce vliv prostřednictvím více mechanismů: obstrukce dýchacích cest, zánět, inaktivace surfaktantu, plicní vazokonstrikce. Přibližně u 4–5 % dětí se zkalenou plodovou vodou se rozvine MAS, z toho asi třetina dětí vyžaduje intubaci a umělou plicní ventilaci (UPV). Základem léčby je udržení adekvátní oxygenace a perfuze, u nejtěžších forem je zapotřebí vysokofrekvenční oscilační ventilace (high frequency oscillatory ventilation, HFOV) či vysokofrekvenční trysková ventilace (high frequency jet ventilation, HFJV) a oběhová podpora. Mastné kyseliny v mekoniu působí inaktivaci surfaktantu, prostupující plazmatické proteiny při zánětlivých změnách způsobují poruchou pneumocytů II. typu, a tedy i sníženou produkci surfaktantu. Laváže surfaktantem mohou pomoci vymýt mekonium z dýchacích cest v prvních hodinách po porodu, v dalších fázích je namístě substituovat chybějící endogenní surfaktant. U nejtěžších forem je namístě vedle surfaktantu léčba plicní hypertenze inhalačním oxidem dusnatým (NO), eventuálně extrakorporální membránová oxygenace (extracorporeal membrane oxygenation, ECMO). Klinické studie neprokázaly snížení oxygenoterapie, délky ventilace či poranění plíce při léčbě exogením surfaktantem u MAS. Prokázaly však snížené riziko úmrtí a potřeby ECMO. Studie srovnávající bolusové podání s lavážemi neprokázaly významný rozdíl [19].
Podle interních standardů na našem oddělení pro léčbu MAS surfaktantem lze zvolit bolusové podání Curosurfu 200 mg/kg s možností opakování za 6–12 hodin. Alternativou v časném stádiu je laváž ředěným surfaktantem v případě, že se nedaří dosáhnout uspokojivé oxygenace (FiO2 > 0,6, MAP > 12 cmH2O [1176,8 Pa]). Ředění 10 mg v 1 ml fyziologického roztoku (FR) (pro balení Curosurfu 120 mg v 1,5 ml: ředit ve 12 ml FR), laváž 2× po sobě 8–10 ml/kg během 20 sekund. Po aplikaci provedeme 3–5 prodechů s tlakem 30 cmH2O. Poté následuje odsátí (−15cmH2O). Po ukončení laváže lze zvážit ještě bolusové podání surfaktantu.
LÉČBA SURFAKTANTEM U PLICNÍHO KRVÁCENÍ
Léčba surfaktantem patří mezi primární metody v managementu kritického plicního krvácení. Akutní plicní krvácení typicky postihuje těžce nezralé novorozence, zejména s otevřenou Botallovou tepennou dučejí (ductus arteriosus patens, PDA) (není nezbytná) a s RDS vyžadující umělou plicní ventilaci, kteří byli léčeni surfaktantem. Typicky se objevuje mezi 2. a 3. dnem života, kdy poklesne plicní cévní rezistence natolik, že se naplno uplatní levopravý zkrat PDA s rychle nastupujícím plicním průtokem. Inhibiční účinky plazmy v plicích snižují jak aktivitu, tak produkci endogenního surfaktantu podobně jako u MAS. Mortalita u plicního krvácení bývá uváděna až 50 %. V metaanalýze z roku 2022 bylo zahrnuto pět studií, ve kterých byl surfaktant použit jako primární léčba. Studie prokázala benefit jak v zastavení plicního krvácení, tak ve zlepšení oxygenačního indexu a snížení mortality. Léčba surfaktantem a HFOV s navýšením MAP jsou nejvíce podloženy důkazy (based evidence). Další léčba plicního krvácení zahrnuje léčbu koagulopatie, eventuálně intratracheální aplikace adrenalinu. Metaanalýza nepřináší závěr ohledně načasování, počtu dávek a způsobu aplikace surfaktantu [20].
Naše vnitřní doporučení pro léčbu akutního plicního krvácení zahrnuje intubaci, pokyn neodsávat víc, než je nezbytné, pouze k uvolnění endotracheální kanyly, dále aplikaci vysokého MAP a oxygenoterapii, aplikaci surfaktantu při FiO2 > 0,4.
LÉČBA SURFAKTANTEM PŘI ROZVOJI BPD
Mezi faktory, které se podílejí na vývoji BPD, jsou zraňující UPV, které způsobují dysfunkci pneumocytů II. typu, a tedy ovlivňují tvorbu surfaktantu. Negativně se podílejí i epizody zánětu, oxidativní stres a další okolnosti. Dvojitě zaslepená randomizovaná francouzská studie zařadila 118 novorozenců ve věku < 33. g. t., pokud u nich přetrvávala potřeba UPV ve 14. postnatálním dni. Intervencí byla aplikace surfaktantu v dávce 200 mg/kg. Výsledky studie nepřinesly rozdíl v délce UPV ani ve výskytu BPD, přesto děti léčené surfaktantem vykazovaly nižší respirační morbiditu v 1. roce života [21]. Studie Budesonide in Babies (BiB) je rozsáhlá randomizovaná klinická studie, která bude sledovat účinnost intratracheálního surfaktantu podaného v kombinaci s kortikoidem (budenosid) oproti samostatnému surfaktantu v prevenci BPD [22].
ZÁVĚR
Léčba surfaktantem při RDS je v neonatodolgii opřená o silné důkazy z klinických studií. Podání surfaktantu metodou LISA časně po porodu novorozencům na neinvazivní dechové podpoře je současným preferovaným postupem, jehož bezpečnost byla dobře zdokumentována řadou studií. Mezi diagnostické metody se vedle klinických známek a rtg snímku dostává ultrazvuk plic. S použitím laryngeální masky pro aplikaci surfaktantu jsou zatím malé zkušenosti. Další studie, které se zaměří na načasování, vytipování vhodné cílové skupiny pro metodu LISA a INSURE a na sledování doby aplikace či vhodné analgezie při metodě LISA metodě budou jistě přínosné.
Konflikt zájmu: žádný.
Došlo do redakce: 19. 9. 2023Adresa pro korespondenci:
MUDr. Jana Termerová
Klinika gynekologie, porodnictví a neonatologie
1. LF UK a VFN
Apolinářská 18
128 51 Praha 2
e-mail: jana.termerova@vfn.cz
Zdroje
- Bhandari V, Black R, Gandhi Bm et al. RDS-NExT workshop: consensus statements for the use of surfactant in preterm neonates with RDS. J Perinatol 2023; 43(8): 982–990.
- Ng EH, Shah V. Guidelines for surfactant replacement therapy in neonates. Paediatr Child Health 2021; 26(1): 35–41.
- Hoshino Y, Arai J, Cho K, et al. Diagnosis and management of neonatal respiratory distress syndrome in Japan: a national survey. Pediatr Neonatol 2023; 64(1): 61–67.
- Saugstad OD, Kirpalani H. Searching for evidence in neonatology. Acta Paediatr 2023; 112(8): 1648–1652.
- Vento M, Bohlin K, Herting E, et al. Surfactant administration via thin catheter: a practical guide. Neonatology 2019; 116(3): 211–226.
- Aldana-Aguirre JC, Pinto M, Featherstone RM, et al. Less invasive surfactant administration versus intubation for surfactant delivery in preterm infants with respiratory distress syndrome: a systematic review and meta-analysis. Arch Dis Child Fetal Neonatal Ed 2017; 102(1): F17–F23
- Roberts KD, Brown R, Lampland AL, et al. Laryngeal mask airway for surfactant administration in neonates: a randomized, controlled trial. J Pediatr 2018, 193 : 40–46.e1.
- Gallup JA, Ndakor SM, Pezzano C, et al. Randomized trial of surfactant therapy via laryngeal mask airway versus brief tracheal intubation in neonates born preterm. J Pediatr 2023; 254 : 17–24.e2.
- Bahadue F, Soll R. Early versus delayed selective surfactant treatment for neonatal respiratory distress syndrome. Cochrane Database Syst Rev 2012; 1(11): CD001456.
- Singh R, Gorstein SV, Bednarek F, et al. A predictive model for SIVH risk in preterm infants and targeted indomethacin therapy for prevention. Sci Rep 2013; 3(1): 2539.
- Challis P, Nydert P, Håkansson S, et al. Association of adherence to surfactant best practice uses with clinical outcomes among neonates in Sweden. JAMA Network Open 2021; 4(5): e217269.
- Capasso L, Pacella D, Migliaro F, et al. Can lung ultrasound score accurately predict the need for surfactant replacement in preterm neonates? A systematic review and meta-analysis protocol. Plos One 2021; 16(7): e0255332.
- Raimondi F, Yousef N, Rodriguez Fanjul J, et al. A multicenter lung ultrasound study on transient tachypnea of the neonate. Neonatology 2019; 115(3): 263–268.
- SurfON is trying to find out how best to treat babies born two to six weeks early with breathing problems [online]. 2023-0717 [cit. 2023-09-20]. Dostupné na: https://www.npeu.ox.ac.uk/ surfon.
- The PLUSS trial – preventing lung disease using surfactant – steroid [online]. 2022 [cit. 2023-09-20]. Dostupné na: https://www. plusstrial.org.
- Zimmermann LJI, Janssen DJMT, Tibboel D, et al. Surfactant metabolism in the neonate. Biol Neonate 2005; 87(4): 296–307.
- Coshal H, Mukerji A, Lemyre B, et al. Characteristics and outcomes of preterm neonates according to number of doses of surfactant received. J Perinatol 2021; 41(1): 39–46.
- Cummings JJ, Gerday E, Minton S, et al.; AERO-02 study investigators. Aerosolized calfactant for newborns with respiratory distress: a randomized trial. Pediatrics 2020; 146(5): e20193967.
- Olicker AL, Raffay TM, Ryan RM. Neonatal respiratory distress secondary to meconium aspiration syndrome. Children (Basel) 2021; 8(3): 246.
- Barnes ME, Feeney E, Duncan A, et al. Pulmonary haemorrhage in neonates: systematic review of management. Acta Paediatrica 2022; 111(2): 236–244.
- Hascoët JM, Picaud JC, Ligi I, et al. Late surfactant administration in very preterm neonates with prolonged respiratory distress and pulmonary outcome at 1 year of age: a randomized clinical trial. JAMA Pediatr 2016; 170(4): 365–372.
- The budesonide in babies (BiB) trial (BiB) [online]. 2023-07-21. [cit. 2023-09-20]. Dostupné na: https://classic.clinicaltrials.gov/ ct2/show/NCT04545866.
Štítky
Neonatologie Neonatologická sestra
Článek vyšel v časopiseČesko-slovenská neonatologie
Nejčtenější tento týden
2023 Číslo 2- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Isoprinosine nově bez indikačních a preskripčních omezení
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Pacienti s infekcemi HPV a EBV a možnosti léčebné intervence pomocí inosin pranobexu
- Cytomegalovirové infekce u novorozenců a dětí
-
Všechny články tohoto čísla
- Neinvazivní plicní ventilace novorozenců v režimu CPAP a HFNC
- Základní principy mechanické ventilace u nezralých novorozenců a používané ventilační módy
- Systémy pro automatické dávkování kyslíku v průběhu umělé plicní ventilace
- Ambulantní péče o kojence se závažným onemocněním plic vzniklým v perinatálním období
- Respirační selhání a ECMO u novorozenců
- Nárůst počtu rehospitalizací donošených novorozenců a možná rizika
- POKYNY PRO AUTORY
- PŘEDMLUVA
- EDITORIAL
- Standardizovaný postup stabilizace a resuscitace nezralých novorozenců
- Stupňované cílové saturace dle postmenstruačního stáří
- Léčba surfaktantem
- Česko-slovenská neonatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neinvazivní plicní ventilace novorozenců v režimu CPAP a HFNC
- Léčba surfaktantem
- Standardizovaný postup stabilizace a resuscitace nezralých novorozenců
- Respirační selhání a ECMO u novorozenců
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



