-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Respirační selhání a ECMO u novorozenců
Respiratory failure and ECMO in neonates
Extracorporeal Membrane Oxygenation is a method of extracorporeal life support indicated for critical respiratory or circulatory failure. Replacing the function of the lungs and/or the heart provides conditions to overcome the critical phase of the illness. Implementing its use in neonates entirely changed the prognosis of many diseases and ECMO is currently an integral part of the neonatal critical care.
Keywords:
newborn, respiratory failure, ECMO
Autoři: J. Kulhánek; S. Mečířová; P. Leden
Působiště autorů: Jednotka intenzivní a resuscitační péče, Klinika pediatrie a dědičných poruch metabolismu, 1. LF UK a VFN, Praha
Vyšlo v časopise: Čes-slov Neonat 2023; 29 (2): 130-137.
Kategorie: Varia
Souhrn
Mimotělní membránová oxygenace je metodou mimotělní podpory života indikované při kritickém respiračním či oběhovém selhání. Náhradou funkce plic a/či srdce poskytuje prostor pro překonání kritické fáze onemocnění. Zavedení jejího používání u novorozenců zcela změnilo prognózu řady onemocnění a v současné době je již ECMO integrální součástí péče o kriticky nemocné novorozence.
Klíčová slova:
novorozenec, respirační selhání, ECMO
ÚVOD
Mimotělní membránová oxygenace (extracorporeal membrane oxygenation, ECMO) je život zachraňující modalitou orgánové podpory indikované při kritickém a potenciálně reverzibilním respiračním či oběhovém selhání refrakterním ke konvenčním terapeutickým postupům.
První použití ECMO podpory u novorozence v roce 1975 předznamenalo zásadní zlom v péči o kriticky nemocné novorozence s respiračním a/či oběhovým selháním, což potvrdilo i několik randomizovaných studií v následujících letech [1, 2]. Některé ze studií musely být dokonce předčasně ukončeny vzhledem k zásadně vyššímu přežívání pacientů na ECMO podpoře oproti pacientům na konvenční terapii [3, 4]. ECMO od té doby prošlo mohutným rozvojem a stalo se integrální součástí terapeutického algoritmu kriticky nemocných novorozenců. V současné době dochází díky stále se zlepšujícím možnostem neonatologické péče ke změně spektra novorozenců indikovaných k ECMO. Zároveň jsou vzhledem k technologickému pokroku a celkově dokonalejšímu managementu ECMO podpory úspěšně napojováni novorozenci stále nižších váhových kategorií a nižších gestačních týdnů, dokonce i novorozenci s mnohočetnými komplexními medicínskými problémy [5, 6, 7].
PRINCIP ECMO A ECMO OKRUH
Principem ECMO podpory je derivace deoxygenované krve z žilního systému novorozence, nejčastěji z pravé síně, její okysličení v oxygenátoru, odstranění oxidu uhličitého a návrat takto upravené krve zpět do těla novorozence, a to buď zpět do systémového arteriálního řečiště, nejčastěji do ascendentní aorty (venoarteriální ECMO neboli VA ECMO, obr. 1a), nebo do žilního systému, nejčastěji do pravé síně (venovenózní ECMO neboli VV ECMO, obr. 1b) [4].
ECMO okruh se skládá z několika základních komponent. Kanyla odvádí krev z těla pacienta hadicovým setem, ve kterém je krev poháněna pumpou. Krev je okysličena a zbavena oxidu uhličitého v oxygenátoru, do kterého je přiváděna definovaná směs kyslíku a vzduchu. Krev následně prochází temperováním na požadovanou teplotu a je navracena zpět do těla pacienta návratovou kanylou. V případě potřeby je možné do okruhu snadno vřadit další komponenty, například dialyzační přístroj pro náhradu funkce ledvin.
ROZDĚLENÍ ECMO
ECMO je tradičně rozdělováno na ECMO respirační, ECMO kardiální a ECMO použité v rámci kardiopulmonální resuscitace (extracorporeal cardiopulmonary resuscitation, ECPR).
Pro kardiální ECMO je v drtivé většině případů (99 %) používána konfigurace VA ECMO. Respirační ECMO je u novorozenců také častěji prováděno jako VA ECMO, a to až v 87 % případů [8]. Prvním důvodem je velmi častá současná přítomnost oběhového selhání (nejčastěji na podkladě perzistující plicní hypertenze novorozence) u respiračního selhání v novorozeneckém věku. Druhým důvodem limitace použití VV konfigurace je dostupnost dostatečně malých double-lumen kanyl (obr. 1b). U novorozenců je totiž využití přístupu s použitím dvou žilních kanyl (double-site) většinou nemožné z důvodu neadekvátních rozměrů žilního systému, kdy jedinou žilou, kterou lze prakticky ke kanylaci využít, je vnitřní jugulární žíla. Konfigurace VV je proto obvykle možná pouze pomocí single-site přístupu s použitím jedné double-lumen kanyly cestou vnitřní jugulární žíly [9].
INDIKACE ECMO
Respirační indikace představují aktuálně cca 55 % případů s průměrným přežitím přibližně 73 %. Kardiální indikace tvoří 37 % s průměrným přežitím 53 % a ECPR je zastoupeno v cca 8 % novorozeneckých ECMO případů s přežitím 47 % [10]. Počty respirační ECMO podpory v dlouhodobém trendu klesají pro stále se zlepšující kvalitu neonatologické péče. Ze stejného důvodu se mění i poměrné zastoupení jednotlivých diagnóz. Počet případů kardiální ECMO podpory a neonatální ECPR se oproti tomu dlouhodobě zvyšuje, mimo jiné i z důvodu zařazování komplexních pacientů, u kterých byla v minulosti ECMO podpora kontraindikována [5, 10]. V současné době je respirační ECMO u novorozenců nejčastěji indikováno na podkladě [10]:
- kongenitální diafragmatické hernie (34 %),
- aspirace mekonia (16 %),
- perzistující plicní hypertenze novorozence (12 %),
- sepse (3 %),
- syndromu respirační tísně novorozence (< 1 %),
- pneumonie (< 1 %),
- z jiných důvodů (34 %)*.
Kardiální ECMO je nejčastěji indikováno z důvodu [10]:
- vrozené srdeční vady (pre-/periči pooperační stabilizace) (55 %),
- kardiogenního šoku (5 %),
- kardiomyopatie (< 1 %),
- myokarditidy (< 1 %),
- z jiných příčin (39 %)*.
* Vyčleněno z důvodů postupné změny klasifikačního systému nemocí, aplikace ECMO podpory na dříve kontraindikované stavy a pacienty s vícečetnými indikacemi k ECMO podpoře. Při detailní analýze jsou v této skupině „ostatní“ u respiračních příčin nejčastější příčinou a základní diagnózou perzistující plicní hypertenze novorozence, aspirace (i jiných tekutin než mekonia) a blíže neurčené respirační selhání. U kardiálních příčin se jedná např. o arytmie, plicní hypertenzi, syndrom nízkého srdečního výdeje z jiné příčiny, bridge k jiné terapii či transplantaci.
Pravděpodobnost přežití pacientů na ECMO je různá a záleží na základní diagnóze, pro kterou byli připojeni. Nejvyššího přežití dosahují pacienti připojovaní z důvodu aspirace mekonia (cca 91 %), pacienti se syndromem respirační tísně (cca 78 %) a s perzistující plicní hypertenzí (cca 72 %). Diagnóza kongenitální diafragmatické hernie je spojena s přežitím přibližně 58 %, sepse s přežitím ještě nižším (cca 47 %) [10]. Je však nutné zohlednit, že se prakticky vždy jedná o pacienty, jejichž predikovaná mortalita před napojením na ECMO podporu se blíží 100 %.
Obr. 1. a, b. Základní modality ECMO podpory s použitím double-lumen kanyly 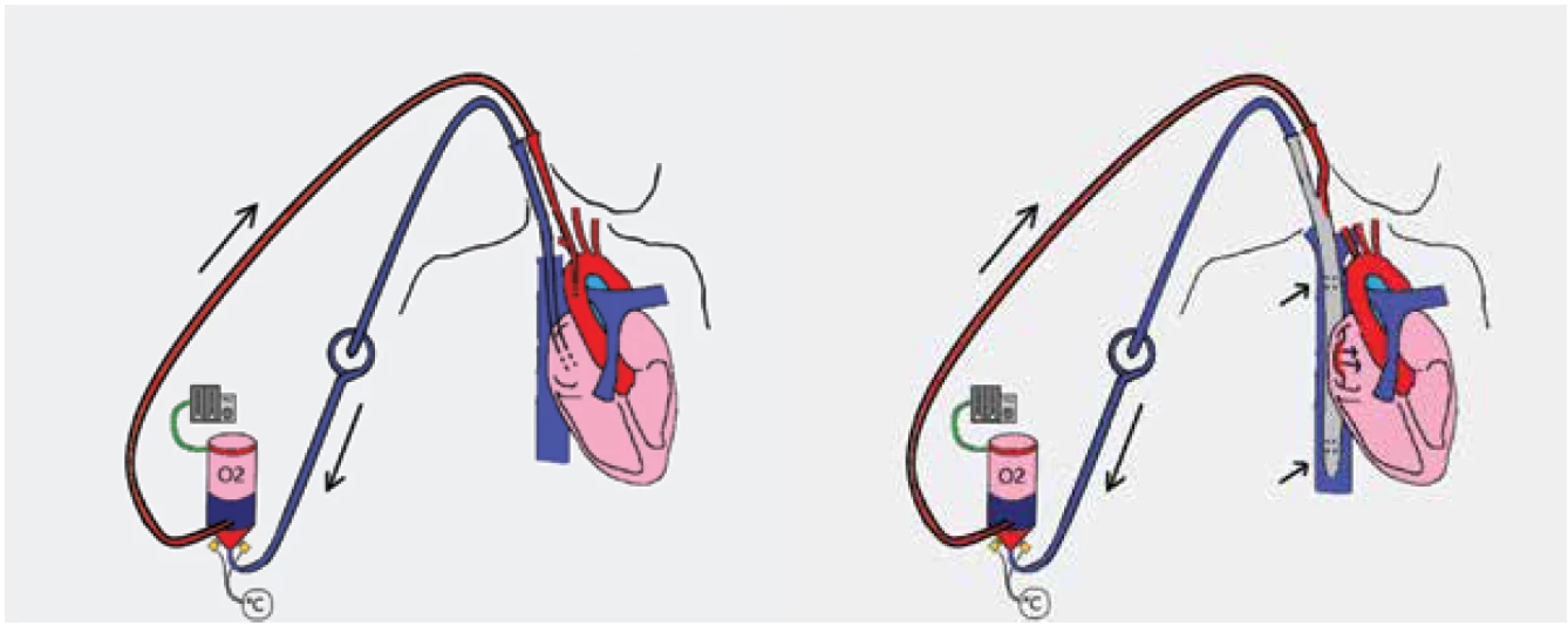
INDIKAČNÍ KRITÉRIA ECMO
Jedním z klíčových předpokladů úspěšného použití ECMO podpory u novorozenců je včasná detekce vhodných pacientů. Za tímto účelem byla vytvořena následující indikační kritéria [9, 11].
Respirační indikace
- OI (oxygenační index)** > 40 po > 4 hodiny, nebo
- OI > 20 bez zlepšení i přes maximální terapii (FiO2 setrvale 100 %) či s perzistujícími epizodami dekompenzace, nebo
- akutní dekompenzace s poklesem PaO2 < 40 mmHg nereagující na intervence, nebo
- těžká (progredující) plicní hypertenze se známkami dysfunkce pravé komory.
** OI = (MAP (mmHg) x FiO2 (%)) / PaO2 (mmHg)
Kardiální indikace
- nízký srdeční výdej se známkami orgánové malperfuze i přes maximální farmakoterapii, nebo
- refrakterní hypotenze, nebo
- nízký srdeční výdej s progredující laktátovou acidózou či saturací smíšené žilní krve < 50 %.
KONTRAINDIKACE ZAHÁJENÍ ECMO PODPORY
Absolutní kontraindikace je nezbytné před implantací ECMO podpory vždy vyloučit [9, 11]:
- letální chromozomální aberace či jiné letální kongenitální anomálie,
- ireverzibilní poškození mozku,
- nekontrolovatelné krvácení,
- intrakraniální krvácení III. nebo IV. stupně.
Relativní kontraindikace vyžadují pečlivé uvážení ECMO centra, zda je eventuálně možné pacienta k podpoře připojit [9, 11]:
- ireverzibilní orgánové poškození (pokud není zvažována transplantace),
- onemocnění s vysokou pravděpodobností nepříznivé prognózy navzdory ECMO podpoře,
- umělá plicní ventilace > 10–14 dní,
- v současné době hmotnost < 2 kg*** či gestační věk < 34 týdnů.
*** S klesající hmotností a gestačním týdnem novorozenců roste riziko mortality a závažné morbidity. Zejména ve váhové kategorii 2,5–2 kg je proto nezbytné pečlivé a komplexní posouzení indikace pacienta ECMO centrem.
Indikační algoritmus novorozenecké ECMO podpory je znázorněn na schématu 1
Schéma 1. Indikační algoritmus novorozenecké ECMO podpory 
POSTUP INDIKACE ECMO
Indikace ECMO podpory není postavena pouze na komplexním posouzení aktuálního stavu pacienta, velmi podstatným aspektem je také zhodnocení dynamiky vývoje stavu. Nezbytnou součástí indikačního procesu jsou kompletní klinická i laboratorní vyšetření, včetně ultrazvukového vyšetření srdce a mozku.
Pokud jsou splněna indikační kritéria, nejsou přítomny absolutní kontraindikace a jsou vyloučeny stavy ovlivnitelné jinými terapeutickými postupy, je kontaktováno ECMO centrum – Jednotka intenzivní a resuscitační péče Kliniky pediatrie a dědičných poruch metabolismu (JIRP KPDPM) 1. LF UK a VFN.
Pokud je ECMO podpora indikována, nebo pokud na základě dynamiky onemocnění stav směřuje k její indikaci, je obvykle volena jedna ze dvou variant zahájení ECMO podpory.
V případech, kdy stav pacienta umožňuje bezpečný transport za konvenční terapie, je pacient k implantaci ECMO podpory převezen do ECMO centra, kde je následně ECMO terapie zavedena. Tato varianta je spojena s nižším rizikem komplikací a je obecně jednodušší, což zdůrazňuje význam včasného referování potenciálních pacientů ve fázi, kdy je možný jejich transport.
V případech, kdy stav pacienta neumožňuje jeho bezpečný transport na konvenční terapii, je implantace ECMO podpory provedena ECMO týmem na kontaktujícím pracovišti a pacient je následně na již zavedené ECMO podpoře převezen na JIRP KPDPM 1. LF UK a VFN (obr. 2, obr. 3).
Obr. 2. Transportní systém pro novorozenecké ECMO 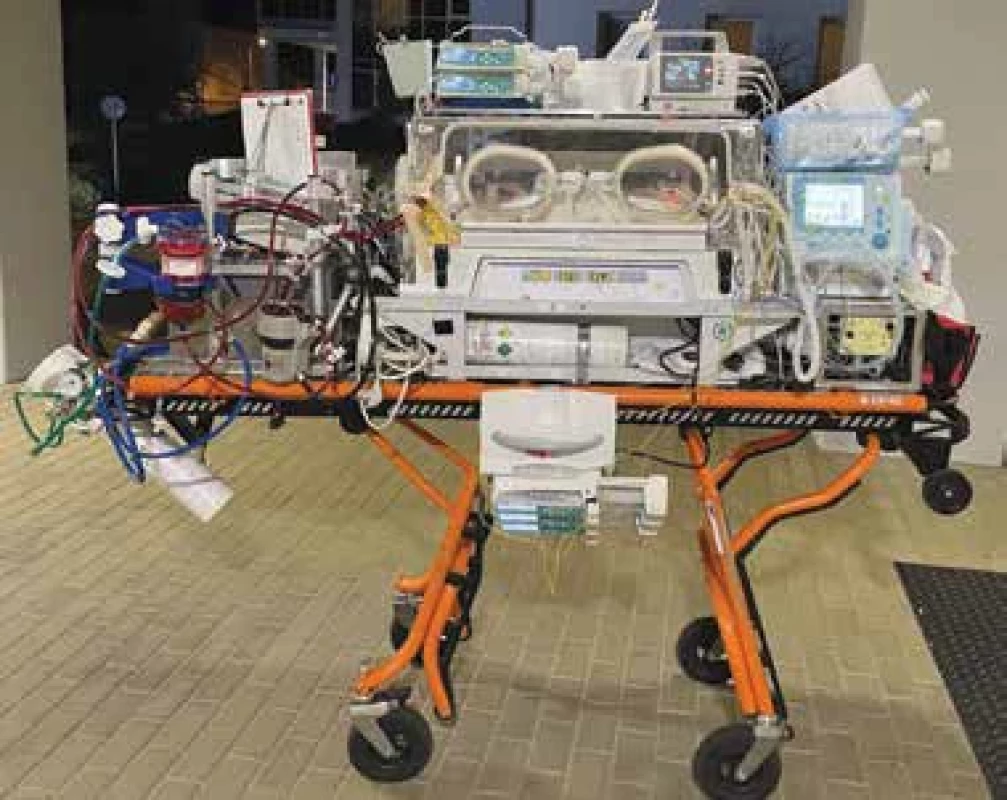
Obr. 3. ECMO podpora u novorozence 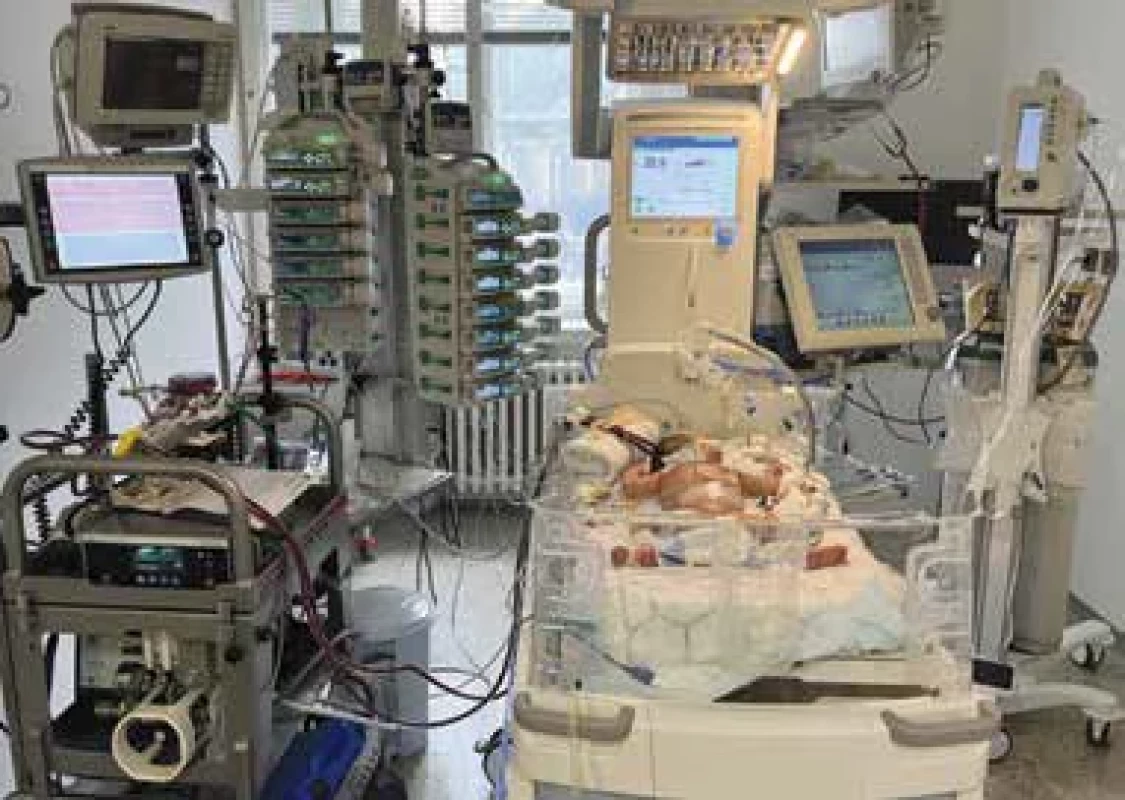
IMPLANTACE ECMO
Implantace ECMO u novorozenců je vzhledem k poměru velikosti kanylovaných cév a velikosti kanyl obvykle prováděna chirurgicky [11]. Při nejčastější VA konfiguraci je žilní kanyla zavedena cestou vnitřní jugulární žíly do pravé síně. Arteriální kanyla následně krev navrací cestou společné karotidy do ascendentní aorty v definované vzdálenosti nad aortální chlopní (viz obr. 1, obr. 4).
Je-li zvolena VV konfigurace, obvykle se používá double-lumen kanyla, která obsahuje přístupovou i návratovou větev a je umístěna cestou vnitřní jugulární žíly do oblasti pravé síně a velkých žil. Přístupová část kanyly se ideálně nachází v horní, eventuálně dolní, duté žíle a návratová část kanyly je umístěna v oblasti pravé síně a nasměrována k trikuspidální chlopni [5] (viz obr. 1, obr. 5). Přesné umístění kanyly je klíčové pro správnou funkci ECMO podpory. Použití dvou separátních kanyl (přístupové a návratové) při VV ECMO u novorozenců není obvykle možné z důvodu nedostatečného kalibru jiných cév mimo vnitřní jugulární žílu [11]. Bez ohledu na modalitu ECMO podpory je nutné správnou polohu kanyl vždy verifikovat, ideálně ultrasonograficky. Polohu kanyl je nutné opakovaně kontrolovat, a to nejen při kanylaci, ale v celém dalším průběhu trvání ECMO podpory. Před zahájením ECMO terapie je nutné vlastní okruh systému předplnit směsí erytrocytárního koncentrátu a čerstvé mražené plazmy a vhodného antikoagulantu.
Obr. 4. Respirační ECMO u novorozence v konfiguraci VA ECMO. Arteriální kanyla je zavedená cestou společné karotidy, žilní kanyla cestou vnitřní jugulární žíly. 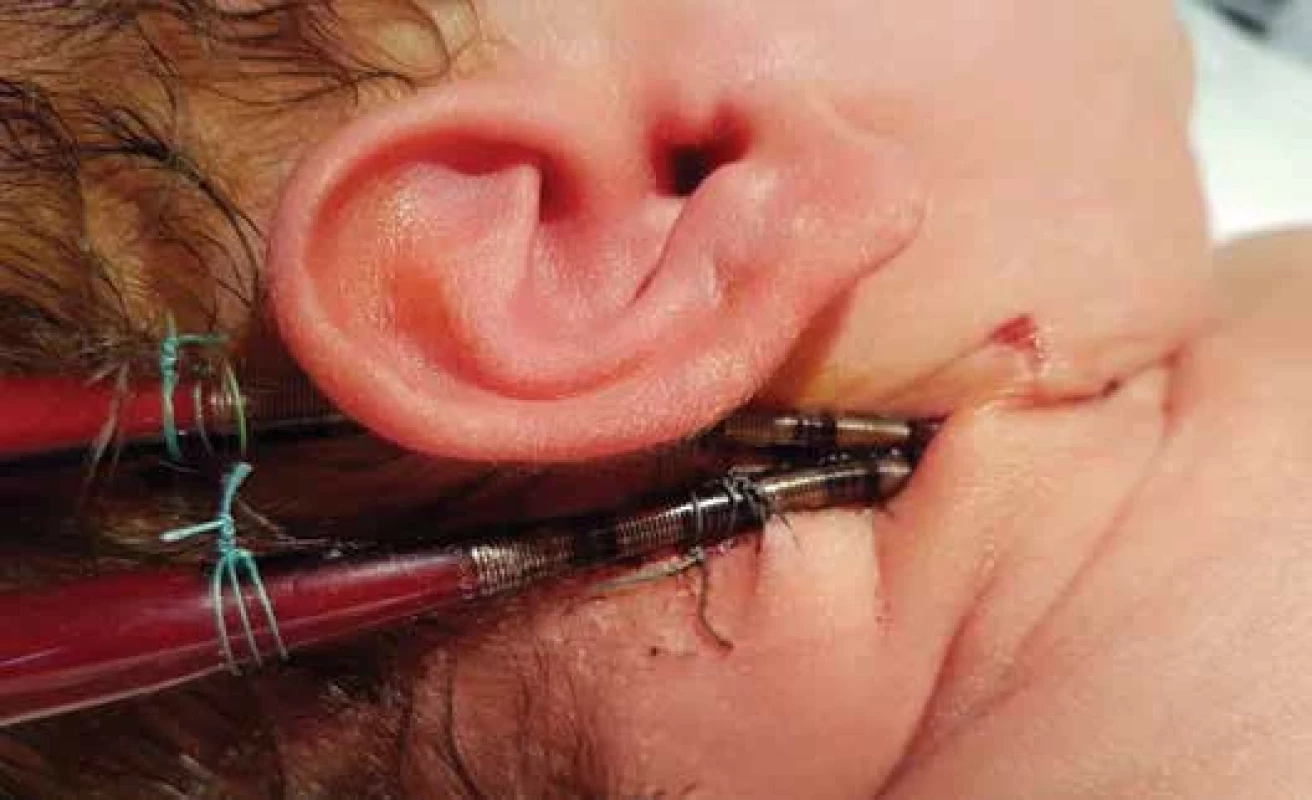
Obr. 5. Respirační ECMO u novorozence v konfiguraci VV ECMO. Double-lumen kanyla je zavedená cestou vnitřní jugulární žíly. 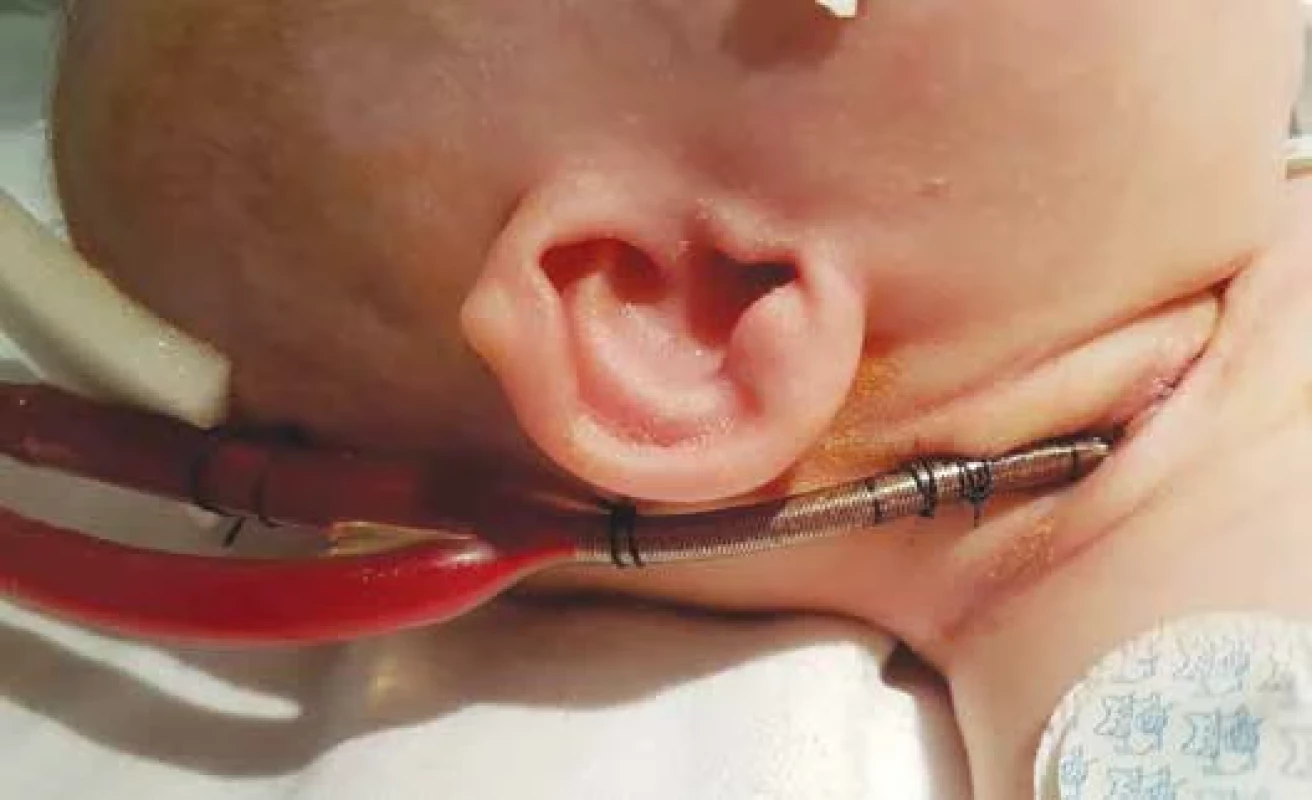
MANAGEMENT ECMO
Samotný management ECMO podpory u novorozenců je komplexní problematikou zahrnující řadu aspektů [5]. Klíčovým bodem je nastavení optimální antikoagulace v terénu velmi dynamického systému tvořeného vyvíjející se koagulační rovnováhou novorozeneckého období, odlišnou od dětského a dospělého věku (vývojová hemostáza), která je navíc modifikovaná koagulační dysfunkcí způsobenou základním onemocněním novorozence a také multifaktoriálně ovlivněná samotnou ECMO podporou [12, 13]. Ideálním stavem je dosažení a udržení „nesrážlivé“ krve v ECMO okruhu a „optimálně“ se srážející krve v těle novorozence. ECMO okruh a všechny jeho komponenty představují cizorodý ne-endoteliální materiál, kterému je krev novorozence vystavena, a to i přes modifikaci vnitřních povrchů komponent ECMO okruhu různými technologiemi zlepšujícími hemoa biokompatibilitu [14]. V okruhu rovněž dochází ke vzniku turbulentního proudění a hemolýzy krevních elementů. Všechny tyto faktory působí silně protrombogenně (ECMO asociovaná koagulopatie) a ve svém důsledku jsou jednou z hlavních příčin nejčastějších komplikací ECMO podpory s významnou morbiditou a mortalitou, tedy hemoragických a tromboembolických příhod [13]. Zlatým standardem antikoagulační léčby je stále použití nefrakcionovaného heparinu. Monitorace antikoagulace je v případě novorozenecké ECMO podpory vzhledem k nejen výše uvedeným faktům obtížná a nevyužívá zpravidla jeden test (ACT, APTT, AntiXa UFH, atd.) či parametr, nýbrž jejich kombinaci. S velkou výhodou jsou užívány viskoelastické metody umožňující funkční analýzu hemostázy jako celku [12].
Po iniciaci ECMO podpory je obvykle možné a zároveň žádoucí snížit ventilační parametry do tzv. rest settings ventilace se snahou o maximální protekci plicní tkáně (eliminace biotraumatu), umožňující její reparaci [15, 16]. Doporučení pro nastavení ventilace na ECMO podpoře nejsou dosud jednotná a do značné míry jsou závislá na etiologii plicního postižení. Jednotlivá centra obvykle užívají interní protokoly, společným jmenovatelem však je použití nižších inspiračních tlaků (PIP 15–20 cmH2O) a vyšších end-expiračních tlaků (PEEP 5–10 cmH2O) [11, 15, 16]. Vhodnými parametry k monitoraci adekvátní tkáňové perfuze je u VV modality obvykle SpO2, zatímco pro konfiguraci VA je přesnější veličinou SvO2 [11].
ECMO podpora může významně ovlivnit farmakokinetické i farmakodynamické vlastnosti léčiv aplikovaných pacientovi. Dochází například k nárůstu distribučního objemu léčiva či jeho různě významné sekvestraci v jednotlivých částech okruhu. Stejně tak se rozvíjí zánětlivá odpověď na přítomnosti ECMO jako cizorodého materiálu s potenciálním ovlivněním například clearance léčiva z organismu. V mnoha případech se uplatňuje i primární onemocnění, také s potenciálem významně měnit působení léčiv. V neposlední řadě je nutné zohlednit tzv. vývojovou farmakologii, tedy skutečnost, že v novorozeneckém věku dochází, stejně jako v případě hemostázy,kdynamickýmzměnámřadyproměnnýchvedoucích k měnícím se farmakokinetickým a farmakodynamickým vlastnostem léčiv v těle novorozence [17, 18]. Při ECMO podpoře novorozenců je proto nezbytné dávkování léčiv adekvátně upravovat a případně monitorovat jejich hladiny.
Ostatní aspekty péče o novorozence s ECMO podporou, jako je oběhová podpora, analgosedace, nutrice, tekutinový management atd., sledují obecné principy péče o kriticky nemocného novorozence, eventuálně s modifikacemi přesahujícími rámec tohoto sdělení.
Průměrná doba trvání respirační ECMO podpory u novorozence je závislá na diagnóze, pro kterou byla podpora indikována. Například v případě indikace z důvodu kongenitální diafragmatické hernie je udávána délka terapie 234–271 hodin, u syndromu aspirace mekonia se délka ECMO pohybuje v rozmezí 143 až 181 hodin a u perzistující plicní hypertenze v rozmezí 100–194 hodin [10].
WEANING A DEKANYLACE ECMO
V případě, že dojde k překonání kritické fáze onemocnění a potřeba ECMO podpory klesá, je zahajován proces weaningu a následně provedena explantace ECMO.
Postup weaningu se odlišuje v závislosti na použité modalitě (VV či VA) [11]. Obecným principem je snížení průtoku plynů v oxygenátoru či snížení průtoku krve přístrojem za současného navýšení ventilační, eventuálně oběhové, podpory na adekvátní úroveň. Pokud je dosaženo dostatečné ventilační a oběhové stability, je následně ECMO explantováno. Explantace probíhá opět chirurgicky se snahou o rekonstrukci nejen arteriálního řečiště (karotické tepny), ale také žilního řečiště (jugulární žíly).
KOMPLIKACE ECMO
ECMO podpora u novorozence s respiračním selháním je ultimativní terapeutickou modalitou v situaci kritického selhání refrakterního ke všem ostatním konvenčním terapeutickým postupům a jako taková s sebou přináší riziko řady komplikací.
Nejčastějšími komplikacemi jsou tvorba trombu v některé z komponent okruhu (cca 11 %) a nutnost výměny okruhu (cca 11 %) [10]. Akutní dysfunkce ECMO okruhu může představovat velmi vysoké riziko pro pacienta, a proto je mimo jiné nezbytné monitorovat parametry, které potvrzují tzv. „zdraví ECMO okruhu“ a které mohou tuto dysfunkci predikovat (např. tlakové gradienty v okruhu, otáčky pumpy, hladina volného hemoglobinu atd.) a případně ECMO okruh elektivně a bezpečně vyměnit [19].
Potřeba eliminačních metod je popisována až v 17 % případů [10]. Dialyzační přístroj je možné jednoduše vřadit do ECMO okruhu.
Velmi vysokou mortalitou a dlouhodobou morbiditou jsou zatíženy krvácivé a tromboembolické příhody do centrální nervové soustavy novorozence, které se vyskytují u přibližně 6–8 % novorozenců postupujících ECMO podporu [10].
DLOUHODOBÁ MORBIDITA PO ECMO
Neoddělitelnou součástí ECMO terapie je následné dlouhodobé systematické sledování pacientů. Dostupná data o dlouhodobé morbiditě pacientů přeživších ECMO v novorozeneckém věku jsou zatím stále nedostatečná. Sběr dat je nezbytný pro organizaci dlouhodobého multioborového sledování pacientů, stratifikaci individuálního rizika a zahájení včasné individualizované terapie. Obecně lze konstatovat, že pacienti po ECMO podpoře v novorozeneckém věku mohou mít vyšší riziko zhoršených plicních funkcí, sníženou toleranci zátěže, zhoršené motorické dovednosti, mohou trpět senzorineurálním poškozením sluchu či jsou ve vyšším riziku rozvoje chronického onemocnění ledvin. Nedojde-li ke vzniku závažných neurologických komplikací během akutní fáze onemocnění a v průběhu ECMO podpory, zdá se, že obecný neuropsychologický profil pacientů po ECMO podpoře z respirační indikace je charakterizován průměrnou celkovou inteligencí, avšak s výrazně horšími parametry v oblasti pozornosti, koncentrace a obecně exekutivních funkcí [20, 21].
Některá z těchto rizik jsou přímo závislá na základní diagnóze, pro kterou byl novorozenec napojen, u jiných tento trend vysledován není. Zároveň se některé deficity mohou projevit až s odstupem času či se dále v čase zvýrazňovat [20]. Zcela zásadní tak je dlouhodobé systematické a multidisciplinární sledování všech pacientů po ECMO podpoře s cílem včasné identifikace případných morbidit a iniciace terapeutických opatření k jejich zmírnění, eventuálně odstranění.
KOHORTA PACIENTŮ ECMO CENTRA JIRP KPDPM 1. LF UK A VFN
ECMO program byl zahájen na JIRP KPDPM 1. LK UK a VFN v roce 2010 a od té doby byla ECMO podpora poskytnuta sedmdesáti novorozencům s kritickým selháním životních funkcí. Celkové přežití v našem souboru (79 %) převyšuje nejen přežití pacientů z mezinárodního evropského registru EuroELSO (73 %), ale také přežití pacientů z celosvětového registru ELSO (68 %). Kanylace byla u 67 % pacientů provedena naším ECMO týmem na referujícím pracovišti a pacienti byli následně již na ECMO podpoře transportováni na JIRP KPDPM (viz obr. 4). Ve spektru diagnóz, pro které byli pacienti indikováni, dominuje syndrom aspirace mekonia (23 případů), perzistující plicní hypertenze (14 případů), sepse s perzistující plicní hypertenzí (13 případů) a kongenitální diafragmatická hernie (11 případů). Pacienti po ECMO podpoře zůstávají dlouhodobě v našem multidisciplinárním sledování. Jedním z klíčů k poskytování kvalitní standardizované ECMO podpory je centralizace péče. Neméně důležitým aspektem je rovněž členství ve výše zmíněných mezinárodních registrech, což je i jeden z doporučených bodů mezinárodních doporučení k poskytování stabilně kvalitní ECMO podpory. ECMO centrum VFN je jediným ECMO centrem v České republice poskytujícím komplexní ECMO péči celému spektru pediatrické populace, včetně novorozenců, a je členem výše zmíněných mezinárodních registrů.
ZÁVĚR
Respirační ECMO podpora u novorozenců představuje život zachraňující terapeutickou modalitu pro novorozence s refrakterním ventilačním či oběhovým selháním. V současné době je důraz kladen zejména na optimalizaci péče a snížení incidence komplikací a na vytvoření kvalitního dlouhodobého sledování pacientů přeživších ECMO podporu. Pro kvalitní poskytnutí ECMO podpory je zároveň zcela zásadní včasná indikace rizikových pacientů.
Seznam použitých zkratek:
FiO2 – inspirační koncentrace kyslíku, fraction of inspired oxygenMAP – střední tlak v dýchacích cestách, mean alveolar pressurePaO2 – parciální tenze kyslíku v arteriální krvi, partial pressure of arterial oxygenPEEP – pozitivní end-exspirační tlak, positive end-expiratory pressurePIP – vrcholový inspirační tlak, peak inspiratory pressureSpO2 – saturace periferní krve kyslíkem, saturation of peripheral oxygenSvO2 – saturace smíšené žilní krve kyslíkem, mixed venous oxygen saturationKonflikt zájmu: žádný.
Došlo do redakce: 19. 9. 2023Adresa pro korespondenci:
MUDr. Pavel Leden, Ph.D.
Jednotka intenzivní a resuscitační péče
Klinika pediatrie a dědičných poruch metabolismu
1. LF UK a VFN
Ke Karlovu 455/2 120 00 Praha
e-mail: pavel.leden@vfn.cz
Zdroje
- Bartlett RH. Esperanza: the first neonatal ECMO patient. ASAIO J 2017; 63(6): 832–843. doi: 10.1097/MAT.0000000000000697.PMID: 29084039.
- Bartlett RH, Roloff DW, Cornell RG, Andrews AF, Dillon PW, Zwischenberger JB. Extracorporeal circulation in neonatal respiratory failure: a prospective randomized study. Pediatrics 1985; 76(4): 479–87. PMID: 3900904.
- O’Rourke PP, Crone RK, Vacanti JP, Ware JH, Lillehei CW, Parad RB, Epstein MF. Extracorporeal membrane oxygenation and conventional medical therapy in neonates with persistent pulmonary hypertension of the newborn: a prospective randomized study. Pediatrics 1989; 84(6): 957–63. PMID: 2685740.
- UK Collaborative ECMO Trail Group. UK collaborative randomised trial of neonatal extracorporeal membrane oxygenation. Lancet 1996; 348(9020): 75–82. PMID: 8676720.
- Amodeo I, Di Nardo M, Raffaeli G, Kamel S, Macchini F, Amodeo A, Mosca F, Cavallaro G. Neonatal respiratory and cardiac ECMO in Europe. Eur J Pediatr 2021; 180(6): 1675–1692. doi: 10.1007/s00431-020-03898-9. [Epub 2021 Feb 5]. PMID: 33547504; PMCID: PMC7864623.
- Burgos CM, Frenckner B, Broman LM. Premature and extracorporeal life support: is it time? A systematic review. ASAIO J 2022; 68(5): 633–645. doi: 10.1097/MAT.0000000000001555. [Epub 2021 Sep 24]. PMID: 34593681.
- Etchill EW, Dante SA, Garcia AV. Extracorporeal membrane oxygenation in the pediatric population who should go on, and who should not. Curr Opin Pediatr 2020; 32(3): 416–423. doi: 10.1097/MOP.0000000000000904. PMID: 32332330.
- Extracroporeal Life Support Organization Registry. Available in September 2023.
- Brogan, Thomas V. et al. (eds.) Extracorporeal Life Support Organization. Extracorporeal life support: the ELSO red book. 5th edition. Ann Arbor, Michigan: 2017. Print.
- Extracroporeal Life Support Organization Registry. Data report 2018–2022. Available in April 2023.
- Wild KT, Rintoul N, Kattan J, Gray B. Extracorporeal Life Support Organization. Guidelines for neonatal respiratory failure. ASAIO J 2020; 66(5): 463–470. doi: 10.1097/MAT.0000000000001153. PMID: 32282347.
- Cortesi V, Raffaeli G, Amelio GS, Amodeo I, Gulden S, Manzoni F, Cervellini G, Tomaselli A, Colombo M, Araimo G, Artoni A, Ghirardello S, Mosca F, Cavallaro G. Hemostasis in neonatal ECMO. Front Pediatr 2022; 10 : 988681. doi: 10.3389/ fped.2022.988681. PMID: 36090551; PMCID: PMC9458915.
- Cashen K, Meert K, Dalton H. Anticoagulation in neonatal ECMO: an enigma despite a lot of effort! Front Pediatr 2019; 7 : 366. doi: 10.3389/fped.2019.00366. PMID: 31572699; PMCID: PMC6753198.
- Ontaneda A, Annich GM. Novel surfaces in extracorporeal membrane oxygenation circuits. Front Med 2018; 5 : 321. doi: 10.3389/ fmed.2018.00321. PMID: 30525038; PMCID: PMC6256321.
- Ibrahim J, Mahmood B, DiGeronimo R, Rintoul NE, Hamrick SE, Chapman R, Keene S, Seabrook RB, Billimoria Z, Rao R, Daniel J, Cleary J, Sullivan K, Gray B, Weems M, Dirnberger DR. Ventilation strategies during extracorporeal membrane oxygenation for neonatal respiratory failure: current approaches among level IV neonatal ICUs. Crit Care Explor 2022; 4(11): e0779. doi: 10.1097/ CCE.0000000000000779. PMID: 36406885; PMCID: PMC9668558.
- Alapati D, Aghai ZH, Hossain MJ, Dirnberger DR, Ogino MT, Shaffer TH. Extracorporeal Life Support Organization. Lung rest during extracorporeal membrane oxygenation for neonatal respiratory failure-practice variations and outcomes. Pediatr Crit Care Med 2017; 18(7): 667–674. doi: 10.1097/ PCC.0000000000001171. PMID: 28504997; PMCID: PMC5503755.
- Zimmerman KO, Dallefeld SH, Hornik CP, Watt KM. Sedative and analgesic pharmacokinetics during pediatric ECMO. J Pediatr Pharmacol Ther 2020; 25(8): 675–688. doi: 10.5863/1551-6776-25.8.675. [Epub 2020 Nov 13]. PMID: 33214778; PMCID: PMC7671016.
- Thakkar N, Salerno S, Hornik CP, Gonzalez D. Clinical pharmacology studies in critically ill children. Pharm Res 2017; 34(1): 7–24. doi: 10.1007/s11095-016-2033-y. [Epub 2016 Sep 1]. PMID: 27585904; PMCID: PMC5177463.
- Hazboun RG, Darwish N, Rotyliano-Sykes G, Chahin N, Xu J, Miller J, Calaritis C, Thacker L, Moores R, HendricksMuñoz KD. Predictors of circuit health in neonatal patients receiving extracorporeal membrane oxygenation (ECMO). Sci Rep 2022; 12(1): 1265. doi: 10.1038/s41598-022-05389-3. Erratum in: Sci Rep 2022; 12(1): 2805. PMID: 35075252; PMCID: PMC8786946.
- Hoskote A, Hunfeld M, O’Callaghan M, IJsselstijn H. Neonatal ECMO survivors: the late emergence of hidden morbidities – An unmet need for long-term follow-up. Semin Fetal Neonatal Med 2022; 27(6): 101409. doi: 10.1016/j.siny.2022.101409. [Epub 2022 Nov 25]. PMID: 36456434.
- IJsselstijn H, Hunfeld M, Schiller RM, Houmes RJ, Hoskote A, Tibboel D, van Heijst AFJ. Improving long-term outcomes after extracorporeal membrane oxygenation: from observational follow-up programs toward risk stratification. Front Pediatr 2018; 6 : 177. doi: 10.3389/fped.2018.00177. PMID: 30013958; PMCID: PMC6036288.
Štítky
Neonatologie Neonatologická sestra
Článek vyšel v časopiseČesko-slovenská neonatologie
Nejčtenější tento týden
2023 Číslo 2- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Cytomegalovirové infekce u novorozenců a dětí
- Pacienti s infekcemi HPV a EBV a možnosti léčebné intervence pomocí inosin pranobexu
- Isoprinosine nově bez indikačních a preskripčních omezení
-
Všechny články tohoto čísla
- Neinvazivní plicní ventilace novorozenců v režimu CPAP a HFNC
- Základní principy mechanické ventilace u nezralých novorozenců a používané ventilační módy
- Systémy pro automatické dávkování kyslíku v průběhu umělé plicní ventilace
- Ambulantní péče o kojence se závažným onemocněním plic vzniklým v perinatálním období
- Respirační selhání a ECMO u novorozenců
- Nárůst počtu rehospitalizací donošených novorozenců a možná rizika
- POKYNY PRO AUTORY
- PŘEDMLUVA
- EDITORIAL
- Standardizovaný postup stabilizace a resuscitace nezralých novorozenců
- Stupňované cílové saturace dle postmenstruačního stáří
- Léčba surfaktantem
- Česko-slovenská neonatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neinvazivní plicní ventilace novorozenců v režimu CPAP a HFNC
- Léčba surfaktantem
- Standardizovaný postup stabilizace a resuscitace nezralých novorozenců
- Respirační selhání a ECMO u novorozenců
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



