-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNeuromodulace
Neuromodulation
Neuromodulation is a process in which several classes of neurotransmitters in the nervous system regulate diverse populations of neurons. Neuromodulation in neurosurgery is a process in which artificial devices manage the nervous system. The main neuromodulatory methods for the treatment of chronic pain are described. These include traditional neurostimulation methods, such as peripheral subcutaneous field stimulation (PSFS), peripheral nerve stimulation (PNS), spinal cord stimulation (SCS), occipital nerve stimulation (ONS) and motor cortex stimulation (MCS) as well as non-invasive methods, such as transcutaneous electric stimulation (TENS), repetitive transcranial magnetic stimulation (rTMS), and drug-releasing therapy – programmable pumps. For each method, its history, pathophysiology, indications, description of the procedure, complications and outcomes are described.
Key words:
neuromodulation – neurostimulation – chronic pain – treatment
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: V. Masopust 1; R. Rokyta 2; V. Beneš 1
Působiště autorů: Neurochirurgická klinika ÚVN – Vojenská FN Praha a 1. LF UK v Praze 1; Ústav normální, patologické a klinické fyziologie, 3. LF UK v Praze 2
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(2): 138-152
Kategorie: Minimonografie
Podpořeno projektem UK PRVOUK – P34.
Souhrn
Neuromodulace je proces, ve kterém několik tříd neurotransmiterů v nervovém systému reguluje různé populace neuronů, avšak neuromodulace, jak ji chápeme v neurochirurgii, je proces, v němž umělá zařízení ovlivňují nervový systém. V práci jsou popsány základní způsoby neuromodulačních metod pro léčení chronické bolesti. Jedná se jednak o neurostimulační invazivní metody, jako je periferní podkožní stimulace (PSFS), periferní nervová stimulace (PNS), stimulace míšní (SCS), stimulace okcipitálního nervu (ONS), stimulace motorické mozkové kůry (MCS), jednak neinvazivní metody, jako je transkutánní elektrická stimulace (TENS), repetitivní transkraniální magnetická stimulace (rTMS) a v neposlední řadě léky uvolňující systémy, jakými jsou programovatelné pumpy. Historie, patofyziologie, indikace, popis výkonu, komplikace a jednotlivé výsledky jsou podrobně uvedeny pro každou metodu.
Klíčová slova:
neuromodulace – neurostimulace – chronická bolest – léčbaÚvod
Historie neurochirurgie je spjata s léčbou bolesti od jejího prvopočátku. Prvotní entuziazmus v chirurgii bolesti, který vládl při vytváření samostatných neurochirurgických pracovišť v padesátých letech a přetrvával až do let sedmdesátých, byl následně nahrazen útlumem této subspecializace. Jako příklad aktivity z doby entuziazmu jmenujme alespoň Kuncovy práce o spinálním trigeminálním traktu a jeho významu v chirurgické léčbě bolesti [1] a monografii Šourkovu [2].
V osmdesátých letech postupně začal útlum této oblasti. Příčin bylo mnoho. Jednou z nich byl rozvoj farmakologie, ale také změna přístupu k preskripci opioidních preparátů. Dalšími byla invazivita neurochirurgických postupů, které samy o sobě představovaly nejenom riziko z hlediska peroperačních a pooperačních komplikací, ale také možnost trvalé neurologické léze. Největší problém však byl, že se jednalo ve většině případů o neurodestruktivní léze, které dřív nebo později vyvolávaly centralizaci bolesti a zhoršení stavu pacienta. Doba od neurochirurgického výkonu k centralizaci bolesti byla dána místem vytvořené léze. Proto neurodestruktivní výkony přestaly být doporučovány u chronické nenádorové bolesti. V léčbě nádorové bolesti pro tyto výkony, s rozvojem opioidní terapie, také nebylo místo. A z rozsáhlého množství neurochirurgických výkonů zůstaly jen zlomky těchto metod, které jsou užívány v léčbě.
Prvním skutečně rekonstrukčním výkonem v léčbě bolesti se stala mikrovaskulární dekomprese [3].
Následně začaly do neurochirurgie pronikat neuromodulace, které lze vzhledem k jejich působení zařadit nejenom mezi minimálně invazivní, ale z moderního pohledu i mezi rekonstrukční výkony. Svým působením nejenom blokují patologický signál vedoucí informaci o bolesti, ale zároveň rozsáhlým působením na centrální nervový systém v pozitivním smyslu vedou k rekonstrukci vazeb narušených chronickou bolestí. Snaha autorů je předložit výčet všech neuromodulačních metod, které se v současné době v léčbě chronické bolesti používají v takovém rozsahu, že jsou schopny anatomicky pokrýt bolest v kterémkoliv místě lidského těla.
Historie
Historie neurostimulací je velmi stará a je obtížné datovat první neurostimulaci. Například podle Jensena lze považovat za první popsanou neurostimulaci práci Scriboniuse Larguse o snížení bolesti při dotýkání se elektrických ryb nohou na pobřeží pocházející z doby starého Říma [4]. O elektrických rybách existuje i záznam na stěně egyptské hrobky, nejedná se však o popis léčby, jako je tomu u Larguse. Rozvoj zkoumání vlivu elektrického proudu na člověka pak pokračuje až v 19. století a je spojen s mnoha dalšími výzkumy elektrického proudu. Samotnou historii elektrostimulací je vhodné rozdělit do jednotlivých typů stimulačních procedur, protože se v mnohém odlišují, včetně své historie. Není však možné nevzpomenout, že na začátku rozvoje neuromodulačních metod stála neurochirurgická klinika Ústřední vojenské nemocnice, a to již v 70. letech minulého století [5,6].
Mezi nejperiferněji uložené stimulace patří subkutánní stimulace (PSFS – Peripheral Subcutaneous Field Stimulation), která je obdobou transkutánní nervové stimulace, jejíž historie bude popsána u okcipitální nervové stimulace. Jedná se však o formu v těle pevně zabudované a permanentní stimulace. Jako takovou ji lze datovat až od roku 2001, kdy je popisována subkutánní stimulace v oblasti třísla [7]. Jedná se o mnohem mladší a zároveň technicky jednodušší metodu, než je periferní nervová stimulace, ale její rozvoj byl závislý na vývoji kulatých elektrod s dlouhými stimulačními plochami, protože ploché elektrody jsou pro dané použití nevhodné. Své uplatnění našla jak v oblasti léčby bolesti dolních zad včetně sakroilikálního skloubení, tak na velkých plochách, jakými jsou břišní nebo hrudní stěna [8,9]. Velký rozmach metody přinesla možnost zapojit dvě elektrody do jednoho generátoru, jednu pro stimulaci zadních provazců a jednu pro subkutánní stimulaci, čímž se efekt potencoval [10].
Samostatnou skupinu tvoří periferní nervová stimulace, ze které je z logických důvodů nutné vyčlenit okcipitální stimulaci a sakrální stimulaci, o jejíž historii se zmíníme dále. Historie neuromodulací je mnohem více než v kterémkoliv jiném oboru těsně spjata s rozvojem technologií. Periferní nervová stimulace především s vývojem plochých elektrod, protože kulaté nejsou vhodné. Dodnes tato skupina stimulací čeká na širší spektrum elektrod, které by přesně opisovaly velikost a tvar periferního nervu a držely u něj, aniž by jej poškodily. A proto možná není metoda tak rozšířena, jak by si zasloužila. Vlastní stimulace periferního nervu je používána již od roku 1970 a nejlepších výsledků bylo dosahováno při stimulacích poraněného nervus medianus [11]. Opravdu novodobou periferní nervovou stimulaci přinesly až nové ploché elektrody a vhodné stimulátory [12]. Typicky novodobá stimulace periferního nervu za pomoci ploché elektrody v České republice byla provedena na pracovišti v Motole [13].
Sakrální stimulace patří mezi periferní nervové stimulace jako takové, je zde vyčleněna z hlediska techniky provedení, ale i indikačního. Dnes je více než v léčbě bolesti používána jako funkční stimulace pro léčbu inkontinence [14]. I tady je využití pro léčbu bolesti v oblasti hýždí, přestože se jedná o metodu, která může pokrýt široké spektrum pánevních bolestí. Jde však o velmi složitou metodu s nutností dobré znalosti anatomie dané oblasti [15]. Efektivnost léčby pánevních bolestí touto metodou je vysoká a zasloužila by si zahrnutí do spektra neuromodulační léčby i v České republice, jak tomu doposud není [16].
Nejrozšířenější stimulace je stimulace míšní (SCS), dříve nazývaná stimulace zadních míšních provazců. Tato stimulace se vyznačuje jednoduchým technologickým postupem a relativně vysokou efektivitou léčby. To ovšem není příčina jejího širokého uplatnění. SCS je vhodná pro léčbu failed back surgery syndromu (FBSS), který je nejčastějším onemocněním v ambulancích léčby bolesti, a tak i nejvíce kandidátů k neuromodulacím je právě pro SCS. Historie stimulace zadních provazců je spojena se jménem Shealyho, jenž v roce 1968 provedl první stimulaci [17], u nás již v roce 1973 provedl SCS Beneš [5].
Následující práce pak potvrdily vhodnost této metody pro široké využití [18]. Poté se rozšířila metoda i do dalších oblastí mimo FBSS, ale nikdy nedosáhla takového rozmachu, jako je tomu u FBSS po celém světě [19,20]. Ve správnosti užití nás utvrzují i patofyziologické studie mechanizmu působení dané stimulace. Jedna z prvních je studie z roku 1999 [21]. V České republice se první míšní stimulace uskutečnily v Nemocnici Na Homolce a v Motole [22].
První okcipitální stimulace je popisována již v roce 1977 a následně v roce 1985 [23,24]. Nicméně první skupinu pacientů s okcipitální neuralgií léčených stimulací popisují Weiner a Reed až v roce 1999 [25,26]. Postupně se okcipitální stimulace začala provádět i u dalších typů bolestí: chronické migrény, refrakterní cluster headache, perzistující denní bolesti hlavy, hemicrania continua, chronické postraumatické bolesti, bolestí po whiplash poranění krční páteře, cervikogenní bolesti hlavy a okcipitální neuralgie [27 – 33]. První okcipitální stimulace v České republice byla provedena na neurochirurgické klinice ÚVN Praha [34].
Pokud popisujeme stimulaci okcipitálního nervu, je vhodné se v historii zmínit i o transkutánní elektrické neurostimulaci (TENS). Jedná se o metodu přesně vymezující vhodnost použití stimulace okcipitálního nervu. Poprvé byla transkutánní stimulace patentována v USA v roce 1974 [35]. Tento patent položil základ širokého využití TENS v léčbě bolesti. TENS byla zařazena mezi základní vyšetřovací metody před aplikací stimulace okcipitálního nervu [36,37]. Na neurochirurgické klinice ÚVN ve spolupráci s neurologickým oddělením Nemocnice Na Františku je pevnou součástí vyšetřovacích metod v předimplantačním období od roku 2012 [34].
Stimulace motorické mozkové kůry jako alternativní metoda hluboké mozkové stimulace byla poprvé použita v léčbě bolesti u člověka Tsubokawou [38]. Jednalo se o náhodnou stimulaci při původně zamýšlené hluboké stimulaci. Původní stimulace pouze motorické korové oblasti prováděná nejvíce Tsubokawou et al [38,39] a Mayersonem et al [40,41] byla doplněna stimulací motorické mozkové kůry s příčným postavením elektrod používaným např. Nguyenem et al [42,43]. V České republice byla poprvé provedena a popsána kortikální stimulace v ÚVN Praha [44]. Jednalo se stimulaci motorické mozkové kůry s příčným uložením elektrody. Následně byl technický postup implantace upraven k postavení podélnému s použitím dvou elektrod pro motorický i senzitivní gyrus tak, jak je používán dodnes [45].
Se stimulací motorického kortexu je spojena i transkraniální magnetická stimulace jako jedna z možností výběru vhodných kandidátů pro přímou stimulaci motorického kortexu. První zmínky o užití metody jako léčebného procesu u chronické bolesti jsou z roku 2004 [46,47]. První velká hodnoticí studie pochází z roku 2009 [48]. Naše první zkušenosti na neurochirurgické klinice ÚVN Praha s motorickou stimulací v léčbě bolesti pocházejí z roku 2005. Jedná se však o nonrepetitivní stimulaci, což je dáno přístrojovým vybavením [49]. Zavedení repetitivní transkraniální stimulace (rTMS) jako vyšetřovací a zároveň léčebné metody bylo možné až multioborovou spoluprací [50,51].
Patofyziologické principy neuromodulace obecně
Na začátku veškerého pochopení fungování neuromodulačních systémů v lidském těle bylo porozumění vlastnímu procesu vnímání informace o bolesti. První, kdo se pokusil osvětlit, jak na sebe různé podněty působí, byl kanadský psycholog Melzack a britský fyziolog Wall v roce 1965, kdy vytvořili vrátkovou teorii [52]. Zjednodušeně se dá vysvětlit tak, že pokud jsou vrátka uzavřena impulzy z tlustých myelinizovaných vláken, pak pomalá informace o chronické bolesti vedená tenkými nemyelinizovanými vlákny neprojde. Tato teorie ale již v moderním pojetí nemůže obstát, bez ní by však další výzkum nemohl pokračovat. Před nimi už Noordenbos v roce 1959 popsal dráhu vedení jako multisynaptickou s tím, že čím vyšší etáž, tím více lokalit, ke kterým vede buňka informace [53]. Zpětně pak mohou buňky následných lokalit ovlivňovat různé úrovně přepojení informace o bolesti. Další ranou pro jednoduchou teorii elektrického vedení informace, která je na různých místech přehrazena či puštěna, byl výzkum Liebeskinda v roce 1971, kdy stimuloval periakveduktální šeď a vyvolal u pokusného zvířete bolest a potom analgezii [54]. Pozorování zakončil Kosterlitz objevem enkefalinu v roce 1977 [55]. Tato pozorování znamenala konec jednoduchých elektrických teorií a dala podnět k pochopení složitého elektrochemického zpracování informace o chronické bolesti. Pochopení těchto dějů nepřispělo k přesnému určení vhodného místa stimulace, ale umožnilo pochopení základního principu – není možné přerušit dráhu vedení chronické bolesti, ale je nutné ji modulovat. Chirurgické přerušení dráhy na jakékoliv úrovni, včetně ablace senzitivního kortexu, vede v různě dlouhém horizontu nikoli ke snížení, ale zvýšení intenzity bolesti [56]. Tudíž chirurgické ablační metody na jakékoliv úrovni nejsou vhodné. Chceme‑li v nervovém systému jakoukoliv informaci přerušit, pak musíme naopak vytvořit novou, která zpětně původní informaci ovlivní, nikoli zruší.
Obecný princip funkce neuromodulace lze rozdělit do tří skupin:
- tvorba informace,
- interference informace,
- modulace informace.
K pochopení těchto principů z pohledu implantačního je nutné znát dráhy bolesti [57,58]. Je to pravý opak farmakoterapie, kdy jsou základem znalosti receptorů buněčných membrán. I když nastává jejich ovlivňování při elektrochemickém působení elektrické stimulace.
Informace o bolesti je vedena z receptorů nemyelinizovanými vlákny typu C a slabě myelinizovanými vlákny Ad do zadních rohů míšních, Rexedovy zóny 1 a 2 v substantia gelatinosa Rolandi. Dále informace pokračuje skrze tractus spinotalamicus ventralis a lateralis do talamu (ventrobazální části) a následně do kůry mozkové. Důležitým úsekem je tractus parabrachialis vedoucí informaci do hypotalamu a amygdaly (představují afektivně‑emoční složku bolesti). Výjimkou je bolest viscerální, neboť vlákna této bolesti probíhají i zadními provazci [59].
Z pochopení patofyziologie plyne několik závěrů pro provádění neuromodulačních metod:
- Pro stimulační techniky je vhodná bolest neuropatická (tj. bolest na pokladě léze dráhy bolesti na všech úrovních) a bolest ischemická.
- Stimulace na všech úrovních nezpůsobuje interferenci informace o bolesti, ale interferenci s informací senzitivní a tvorbu nového vzruchu, který až ovlivněním na následných úrovních zvýší filtraci informace o bolesti, nikoli její úplnou blokaci (víceúrovňová vrátková teorie).
- Stimulace změní psychické vnímání bolesti, což není dáno pouze snížením bolesti, ale následnou přímou stimulací oblastí ovlivňujících afektivně‑emoční složku.
- Efekt stimulace je ovlivňován i elektrochemickými procesy mozku a v konečném důsledku uvolňuje přirozené enkefaliny.
- Stimulace mozkové kůry není přímým blokem oblasti vnímání, ale stejně jako předchozí metody je stimulační a modulační. Umožní hyperpolarizaci k lokální inhibici postpsynaptických membrán přes GABA-B receptory, a je tedy i patofyziologickými principy stejná jako ostatní neuromodulace a platí i pro magnetickou stimulaci.
Anatomické rozdělení indikací neuromodulace
Jak již bylo uvedeno, základní princip pro neuromodulaci je potlačit bolest neuropatickou a ischemickou. Jednotlivé indikační skupiny budou probrány u konkrétního typu stimulace. Z indikačního pohledu je důležité i rozdělení neuromodulace podle uložení bolesti tak, abychom pokryli všechna místa prvotního bolestivého stimulu. Nejenom, že v současné době je to již proveditelné, ale v některých oblastech se stimulační techniky i překrývají, a je možný výběr techniky dle zkušeností operatéra. Současná technologie umožňuje i spojení více neurmodulačních procedur za použití jediného generátoru pulzů tak, jak je tomu například u low back pain syndromu. Zde je možné kombinovat míšní stimulaci a stimulaci subkutánní.
Rozdělení dle lokalizace
Dolní končetiny: zde jednoznačně dominuje míšní stimulace (SCS). Nejenom, že je standardním postupem, a tudíž nejlépe zvládnutelná a pro pacienty s minimem komplikací, ale také i při punkční technice je schopna stimulovat oblast dolních končetin až po hýždě s 90% pokrytím. Stejně je tomu u ischemické choroby dolních končetin, kam lokalizací bolesti toto onemocnění patří.
Oblast pánve a perinea: zde je dominantní sakrální stimulace, která ovšem v České republice není pro danou lokalizaci prováděna a je nahrazována SCS, PNS, či PSFS.
Oblast sakroiliakálního skloubení (SI) a oblast dolní bederní páteře (LBP): je rozhodující, zdali je oblast postižena samostatně, a pak je nejlepší alternativou kombinace míšní stimulace se subkutánní stimulací do oblasti lokalizace maxima bolesti. Jestliže je potom bolest dolní bederní páteře spojena s bolestí v dolních končetinách, je nutný větší rozsah pokrytí a na prvním místě ve výběru metody je stimulace míšní za pomoci 16kontaktní ploché elektrody otevřenou technikou.
Oblast břišní stěny: pokud je bolest přesně lokalizovaná, je na prvním místě subkutánní stimulace, ale je‑li pole bolesti širší s maximem v určitém bodě, pak je vhodná kombinace míšní stimulace a stimulace subkutánní.
Oblast hrudního koše: pokud se jedná o pásovitou lokalizaci bolesti, pak připadá v úvahu vysoká míšní stimulace; jde‑li o bolest lokalizovanou, třeba po hrudním poranění, je vhodnější subkutánní stimulace.
Ischemická choroba srdeční patří lokalizací k bolesti hrudního koše, avšak často s propagací do končetiny. Zde je na prvním místě míšní stimulace, ale jsou situace, kdy je vhodná i subkutánní stimulace.
Oblast plexu: může být řešena přímou stimulací plexu jako alternativy PNS či krční míšní stimulací.
Oblast ruky: zde je důležitá příčina bolesti, u komplexního regionálního bolestivého syndromu (KRBS) typu I, tedy pokud se nejedná o lokalizaci čistě v distribuci jednoho nervu a jsou vegetativní projevy na celé horní končetině, je indikována míšní stimulace, případně u nás neprováděná stimulace vegetativních ganglií. Jde‑li o neuropatickou bolest na pokladě poranění jednoho nervu, ať již úrazem, pooperačně, zánětem či úžinovým syndromem, a není možné primárně chirurgické řešení, je na prvním místě periferní nervová stimulace.
Oblast krku: dorzální část krku je spíše doménou subkutánní stimulace (PSFS), ventrální plocha patří převážně kortikální stimulaci v kraniální části a subkutánní stimulaci v kaudální části.
Horní část krční oblasti, zátylek v distribuci nervus occipitalis major a hemikranium či kranium náleží do oblasti okcipitální stimulace (ONS), s tím je spojená zkušebně i transkutánní elektrická neurostimulace (TENS).
Obličejová část v distribuci všech tří větví nervus trigeminus s přesahem na kraniální ventrální plochu krku patří stimulaci kortikální (MCS). Tady je jako diagnostická a částečně i léčebná metoda indikována repetitivní transkraniální magnetická stimulace (rTMS).
Subkutánní stimulace (PSFS)
Princip
Mechanizmus periferní nervové stimulace je velmi složitý a komplexní. Původní myšlenka, že se jedná pouze o vrátkovou teorii, již neplatí. Vrátková teorie hraje jen jednu z několika rolí ve výsledném efektu dané stimulace [60]. Při vrátkové teorii se počítá, že stimulace periferních zakončení vede informaci vlákny Ab do interneuronů v povrchových Rexedových zónách 2 a 3 v zadních rozích šedé hmoty míšní. Na tomto místě se blokují informace, které přicházejí do této zóny ostatními Ab a C nervovými vlákny [52].
Jiné možné vysvětlení přináší kombinace elektrického a neurohumorálního neboli chemického působení, kdy subkutánní stimulace mění lokální koncentraci neurotrasmiterů, jakými jsou například endorfiny, a zároveň mění lokální prokrvení, které je jinak u chronické bolesti změněné [61,62].
Současně periferní nervová stimulace mění excitabilitu periferních nervových zakončení a mění neurotransmisi na těchto zakončeních [63,64].
Mechanizmus působení je však mnohem komplexnější než pouhá periferní a míšní blokáda. Při stimulaci se totiž aktivují mozkové okruhy blokující vnímání bolesti na vyšší úrovni [65].
Indikace
Podle lokalizace:
- nejčastější místo stimulace dle lokalizace je lumbosakrální oblast (přímo nad sakro‑iliakálním skloubením) a v oblasti paravertebrálních spazmů bederních (rovnoběžné s procesi spinosi v místě maximální bolesti),
- paravertebrálně podél celé páteře v místě maxima bolesti,
- inguinální oblasti v podkoží rovnoběžné s ligamentum inguinale,
- na hrudním koši šikmo rovnoběžně s průběhem žeber v místě maxima vnímání bolesti,
- nad sternem rovnoběžné se sternální kostí,
- na břiše (rozhodující je zde vektor bolesti, ale laterálně převažuje šikmé uložení a ventrálně podélné).
Podle typu bolesti:
- chronická sakroiliakální blokáda a bolest,
- chronické paravertebrální spazmy a bolest dolních zad (low back pain),
- pooperační bolest páteře (failed back surgery syndrom) převážně v kombinaci s míšní stimulací (SCS),
- neuropatická bolest po traumatech či chirurgických invazích na hrudní a břišní dutině,
- neuralgická bolest, v dané lokalizaci převážně postherpetická neuralgie,
- ischemická choroba srdeční v případech, že není indikována míšní stimulace (SCS).
Hodnocení
Skupina nemocných implantovaných na našem pracovišti je velmi malá a nevhodná k přesnějšímu hodnocení efektivity metody. Ze zahraničních studií: největší studie zahrnující 111 pacientů po čistě subkutánní stimulaci s low back pain, failed back surgery pain, neck pain, postherpetickou neuralgií a hrudní bolestí stanovila průměrnou efektivitu na více než 50% redukci bolesti (z 8,2 na 4,0 VAS) [66]. Jedná se však o studii, kde není spojován efekt míšní a subkutánní stimulace (obr. 1, 2).
Obr. 1. Pacientka po zavedení míšní stimulace a subkutánní stimulace v oblasti sakroiliakálního skloubení. 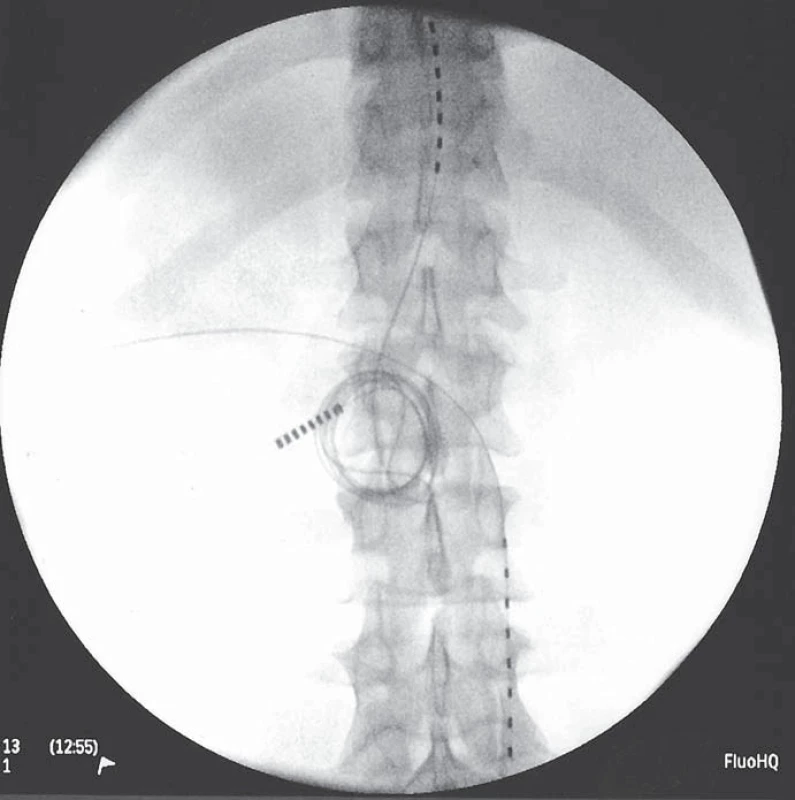
Obr. 2. Stejná pacientka po zavedení míšní stimulace a subkutánní stimulace paravertebrálně. 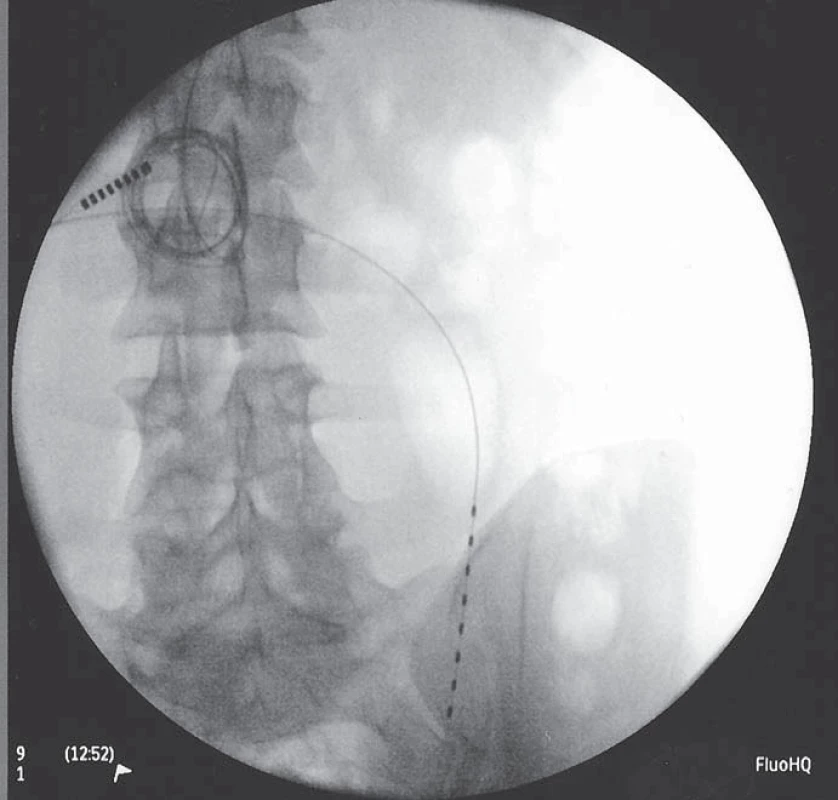
Komplikace
Jde o technologicky nejjednodušší stimulaci vůbec. To samozřejmě neznamená, že se u ní nemohou objevit komplikace. Jsou popisovány jak zánětlivé komplikace, tak i problémy s materiálem. Nejzranitelnější je při daném způsobu aplikace elektroda, protože je volně uložena v podkoží a může dojít nejenom k její deviaci, ale zároveň i ke zlomení a rozpojení. Popisováno je i prohojení elektrody při příliš povrchovém uložení. Výhodou je však možnost poměrně jednoduché výměny [67].
Periferní nervová stimulace (PNS)
Princip
Efekt je velmi podobný subkutánní stimulaci (PSFS). Samozřejmě zde ale není lokální účinek v místě stimulace nervových zakončení.
Převažují zde dva základní patofyziologické principy:
- Účinek periferní nervové stimulace na lokální úrovni způsobuje blokování sodíkových kanálů, čímž brání vzniku akčního potenciálu. Snižuje tak excitabilitu C vláken nervu [68].
- Zároveň se zdá, že stimulace mění uvolňování GABA, CGRP, substanci P, adrenalinu a serotoninu [51].
Indikace
Podle lokalizace:
- převážně horní končetina, vzácně i dolní končetina,
- okcipitální stimulace přestavuje patofyziologicky, nastavením, uložením i cílovou diagnostickou skupinou pacientů samostatnou oblast a bude zhodnocena v samostatné kapitole,
- sakrální stimulace je také odlišná od periferní nervové stimulace, a to hlavně provedením, jinak ostatní principy i diagnostická skupina nemocných jsou podobné,
- vzácně brachiální plexus, zde však je provedení podobné subkutánní stimulaci, ale kulatou elektrodu je nutné implantovat pod sono kontrolou, aby se nepoškodil plexus,
- stimulace interkostálního nervu.
Podle typu bolesti:
- komplexní regionální bolestivý syndrom (KRBS): u postižení v distribuci jednoho nervu tj. KRBS II, je efektivnější periferní nervová stimulace (PNS) oproti krční míšní stimulaci, u KRBS I je metodou volby pro svou úspěšnost míšní stimulace,
- neuropatie nervu po různých traumatech, ať již přirozených či postchirurgických, případně poškození nervu injekcí,
- výjimečně v případě úžinových syndromů, pokud selže chirurgická léčba,
- interkostální posttraumatická léze či postherpetická neuralgie.
Hodnocení
Statistické hodnocení našich nemocných pro nízký počet není možné. Skupiny nemocných po periferní nervové stimulaci hodnocené v literatuře nejsou veliké. Přesto efektivnost větší skupiny nemocných léčených pro chronickou neuropatickou bolest je 58 % s delta VAS 4+ [69]. Jiná studie udává podobný výsledek: 61 % s více než 50% snížením VAS [70] (obr. 3).
Obr. 3. Zavedení elektrody k interkostálnímu nervu a její posun po jednom dni. 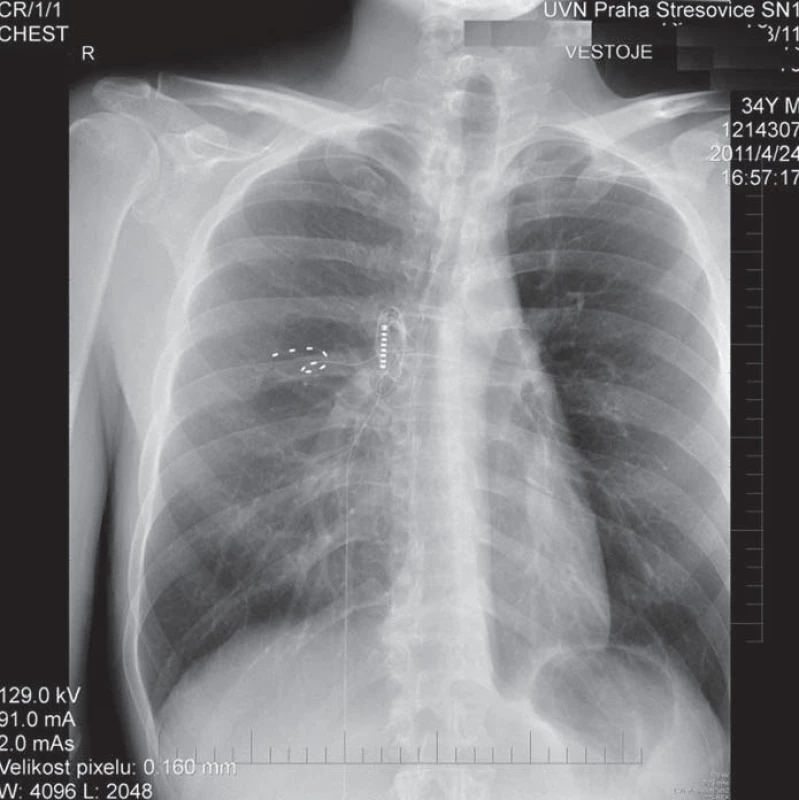
Komplikace
Komplikace jsou poměrně vzácné, ale musíme počítat s tím, že se jedná o otevřenou chirurgickou techniku, kdy je nutné dodržovat aseptické zásady. V literatuře je popisováno až 15 % pacientů, kterým musel být stimulátor pro zánět odstraněn [70]. Další důležitý bod je přesná fixace elektrody k nervu. Pokud nedodržíme přesný postup, může se poškodit nerv nejenom jeho přímým zaškrcením, ale i poruchou cévního zásobení.
Míšní stimulace (SCS)
Princip
Původně byla míšní stimulace (SCS) nazývána stimulací zadních provazců, protože se věřilo, že je založena na vrátkové teorii Walla a Melzacka. Avšak tato teorie není schopna vysvětlit všechny změny, které míšní stimulací nastávají [71].
Působení SCS:
- míšní stimulace zvyšuje hladinu endorfinů, které jsou produkovány převážně v nuclei raphe a jádrech periakveduktální šedi,
- aktivuje DNIC, difuzní kontrolní inhibici, začínající v subnucleus reticularis dorsalis v retikulární formaci a končící na WDR neuronech v míše, zahrnující GABA-B, substanci P a CGRP (kalcitonin gene related peptide),
- v neposlední řadě míšní stimulace zvyšuje krevní průtok ve stimulovaných oblastech sympatickou blokádou a uvolněním CGRP [51].
Indikace
Podle místa stimulace:
- dolní končetiny,
- dolní část bederní oblasti (vhodnější stimulace plochou elektrodou),
- pánev, pokud není indikována sakrální stimulace (SNS),
- oblast bolesti při ischemické chorobě srdeční (zde více než protibolestivě působí efekt zlepšení prokrvení srdečního svalu) a tím je uložení elektrody přesně dané bez určení směru vystřelování bolesti,
- oblast horní končetiny (krční míšní stimulace), pokud není indikována periferní nervová stimulace (PNS).
Podle typu bolesti:
- failed back surgery syndrom (FBSS),
- neuropatická bolest převážně na dolních končetinách,
- fantomová bolest převážně na dolních končetinách, ale krční míšní stimulace je možná i na končetinách horních,
- výjimečně na bolesti dolních zad (low back pain), tady je vhodnější subkutánní stimulace (PSFS), nebo pokud zvažujeme míšní stimulaci, pak je vhodná chirurgická implantace s plochou elektrodou ve výši Th 8,
- angina pectoris, indikovaná je hrudní míšní stimulace, ve výjimečných případech, kdy není proveditelná je na místě subkutánní stimulace (PSFS),
- ischemická choroba dolních končetin, účinná a vhodná, ale zatím běžně v praxi v České republice neprováděná,
- komplexní regionální bolestivý syndrom KRBS, a to převážně typ I, pro mononeuropatii je vhodnější periferní stimulace (PNS).
Hodnocení
Výsledky na neurochirurgické klinice Ústřední vojenské nemocnice dle hodnocení delta VAS jsou v průměru 5,3. Implantace přinesla úlevu u 88,5 % pacientů. Jedná se však o ještě neuzavřenou statisticky nezpracovanou studii.
Z prospektivně randomizované multicentrické studie lze konstatovat, že po 24 měsících sledování je míšní stimulace efektivnější než konvenční léčba. Přínos stimulace se snížením bolesti uvádělo 81 % nemocných [72] (obr. 4, 5, 6).
Obr. 4. Nastavení stimulace u pacienta s failed back surgery syndromem (FBSS). 
Obr. 5. Zavedení dvou elektrod, kdy jedna jehla je zaváděna o segment kaudálněji, ale lze zavádět i dvě jehly do jednoho patra, pokud je to nutné. 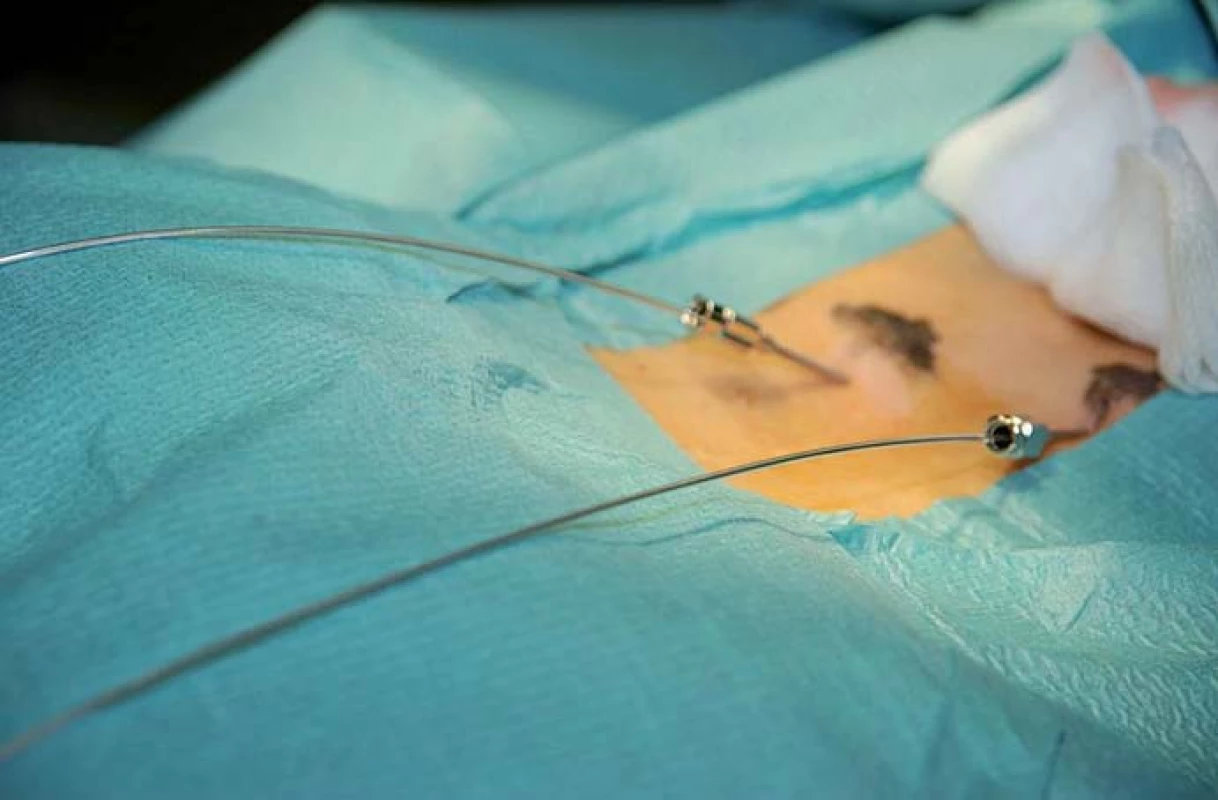
Obr. 6. Krční stimulace u nemocné s komplexním regionálním dystrofickým syndromem. 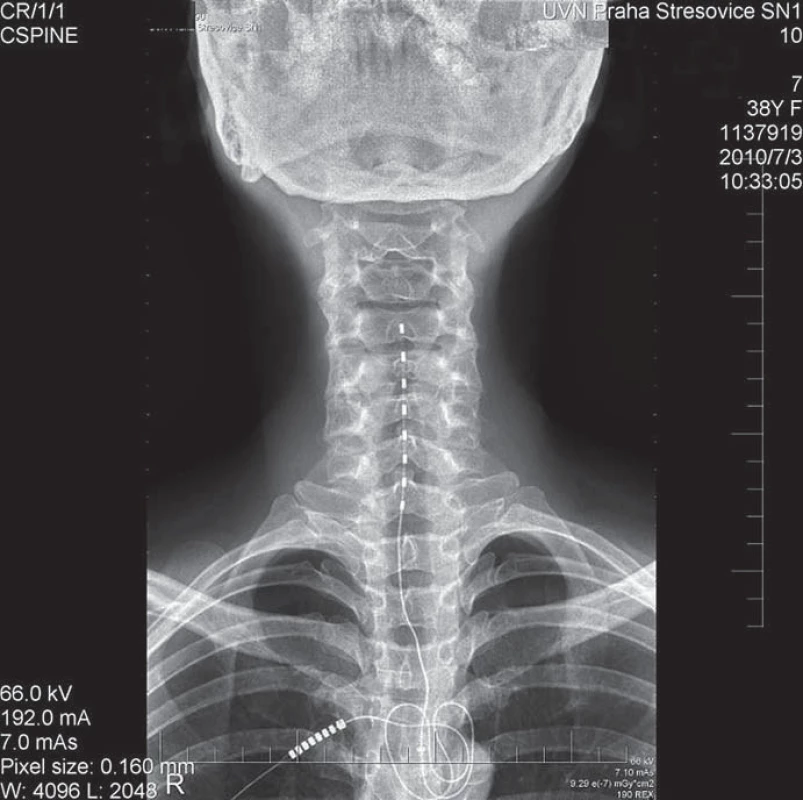
Komplikace
Komplikace jsou velmi vzácné a na našem pracovišti jsme z 50 implantací zaznamenali tři zánětlivé komplikace, kde se nám jednu podařilo přeléčit antibiotickou terapií. U dvou nemocných jsme museli systém přechodně odstranit a počkat do zahojení. Následně byl u jednoho nemocného implantován na druhé straně břišní dutiny s již dobrým efektem a u druhého již nebyl implantován. Třikrát jsme museli provést výměnu elektrody pro její zalomení. Ve dvou případech jsme znali příčinu. Pacient spadl na hýždě z výšky při podklouznutí, když byl bruslit. Druhá nemocná uklouzla na čerstvě umyté podlaze v nákupním centru. U jedné nemocné jsme museli vyměnit prodlužovací kabel. Z neznámých příčin si s generátorem točila v podkoží, až se jí stočil kabel tak, že přestal fungovat.
Z mezinárodních studií: ve velké multicentrické studii uvedené výše byla nutná chirurgická revize u 31 % pacientů [72]. Největší studie zabývající se čistě komplikacemi zhodnotila 707 případů se závěrem: posun elektrody (22,6 %), selhání spojek (9,5 %), zlomená elektroda (6 %), bolest v místě stimulátoru (12 %), infekce (4,5 %) [73].
Implantabilní pumpy
Princip
Chronická subarachnoidální aplikace protibolestivé medikace není přímo neuroelektrická modalita, přesto svým působením a patofyziologií i indikačními skupinami mezi neuromodulační metody patří.
Principy je nutné rozdělit podle jednotlivých látek aplikovaných za pomoci pumpy:
- morfin působí na G protein opioidních receptorů v šedé hmotě míšní s inhibicí adenylát cyklámy,
- morfin také inhibuje Ca++ kanály na presynatpických nervových zakončeních (inhibice uvolnění neurotransmitterů zodpovědných za přenos nocicepčních podnětů na míšní úrovni),
- morfin způsobuje hyperpolarizaci postsynaptických neuronů otevřením K+ kanálů,
- alfa2 mimetikum – klonidin aktivuje inhibiční antinocicepční noradrenergní systém a aktivuje míšní cholinergní neurony,
- klonidin dále intracelulárně ovlivňuje draslíkové kanály a způsobuje hyperpolarizaci, čímž snižuje vzrušivost a zvyšuje efektivitu analgezie [74],
- posledním již méně pro intratékální aplikaci používaným lékem je bupivakain, který zvyšuje efektivitu opioidů při společné aplikaci a má příznivý bakteriostatický účinek, v nízkých dávkách při intratékálním použití není neurotoxický.
Indikace
Indikace jsou podobné, jako je tomu u míšní stimulace (SCS):
- u nenádorové bolesti převažuje v indikacích failed back surgery syndrom (FBSS), a to převážně pokud jsou bolesti většího rozsahu než pouze jednokořenové, tj. vícekořenové, postihující obě končetiny a spojené s bolestí dolní bederní páteře či sakroiliakálního skloubení,
- neuropatická bolest dolní končetiny, není‑li indikována stimulace,
- neuropatické pánevní bolesti, pokud není indikována stimulace,
- dolní břišní bolesti vždy po úspěšném zkouškovém období,
- nociceptivní bolest.
Hodnocení
U chronické nenádorové bolesti je snížení bolesti u 73 % pacientů. Pokud se soustředíme čistě na failed back surgery syndrom, pak je efekt 67 % [75]. Musíme však počítat s větším počtem možných komplikací a nutností intenzivnější péče o nemocné, než je tomu u míšní stimulace (SCS).
V konečném důsledku je intratékální podávání opioidů i ekonomicky efektivní. Cena léků podávaných intratékálně je vyšší než u léků podávaných per os, ale množství, které je pumpovými systémy podáváno, je mnohonásobně menší než v případě per os preparátů.
Komplikace
- chirurgické (uvolnění katétru a jeho vysunutí ze subarachnoidálního prostoru, zalomení katétru, infekce kolem systému a nutnost odstranění celého systému, nesnášenlivost implantovaného materiálu, na konci katétru může vzniknout i granulom, který může tlačit na kořeny v okolí) [77],
- technické (mechanická nebo elektronická nefunkčnost pumpy),
- způsobené pumpou aplikovanými látkami (nesprávně nastavená bolusová dávka při vstupním plnění katétru a primárním programování pumpy po jejím plnění, podkožní aplikace při nesprávném plnění pumpy – 30 mg morfinu podaného parenterálně bez vyvinuté tolerance může ohrozit život depresí dechového centra (pokud by všechen obsah pumpy byl podán parenterálně, pak se jedná o 800 mg morfinu – 40 ml 2% roztoku), plnění pumpy je tedy možné pouze v zařízení se zázemím pro řešení takové život ohrožující akutní situace).
Stimulace motorické mozkové kůry (MCS)
Princip
Princip působení kortikální stimulace je velmi složitý a komplexní. V obecném principu vyvolává stimulace kůry mozkové hyperpolarizaci, tedy k lokální inhibici postsynaptických membrán přes GABA-B receptory, tudíž je i patofyziologickými principy stejná jako ostatní neuromodulace [79]. Stimulace nepůsobí pouze lokální změny, ale vstupuje do nich aktivace mnoha oblastí, například snížení aktivity oblasti hipokampu a zároveň zvýšení aktivity nefrontální kůry [80]. To by vysvětlovalo změnu psychického vnímání bolesti po kortikální stimulaci.
Indikace
Po úspěchu prvních stimulací se začala rozšiřovat i oblast aplikace. Meyerson publikuje jako první úspěch kortikální stimulace u deaferentační obličejové bolesti [81]. Saitoh následně efekt u fantomové končetinové bolesti [82].
Indikace k léčbě je možné rozdělit podle lokalizace a typu bolesti. Jejich kombinací se dostáváme k velkému počtu možných indikačních skupin.
Podle lokalizace:
Bolest v oblasti obličeje: na prvním místě neuralgie trigeminu při selhání veškerých dostupných metod včetně mikrovaskulární dekomprese a glycerolové neurolýzy. Dále neuropatické bolesti po poškození nervů obličeje, převážně větví nervus trigeminus.
Bolest způsobená lézí v oblasti míšní nebo přímo v mozku: jedná se o nejhůře zvladatelné bolesti. V oblasti míšní lze v některých případech použít anesteziologických metod. Pokud jde o segmentální bolest, aplikujeme metodu DREZ (Dorsal Roots Entry Zone). K ovlivnění na úrovni thalamických jader nebo na jiných úrovních dráhy bolesti v mozku je již ovlivnění na úrovni thalamu často neúspěšné. Zde je spíše indikována kortikální stimulace.
Bolest způsobená lézí periferního nervu: používá se v případech, kdy je obtížná přímá rekonstrukce nervu, ať již z hlediska morfologického nebo časového a tam, kde nejsou indikovány neurochirurgické techniky k ošetření amputačního bolestivého neuromu. Na prvním místě je však stimulace typu PNC či SCS.
Bolest způsobená lézí v oblasti brachiálního plexu: je rozhodující, zda postižení je distálně nebo proximálně od ganglia dorzálního míšního kořene. Je‑li léze centrálně od ganglia, ani anesteziologické postupy, ani stimulace dorzálních provazců míšních nemůže přinést efekt. V tomto případě připadají v úvahu pouze dvě možnosti léčby – DREZ (Dorsal Root Entry Zone – přerušení prvních pěti Rexedových míšních vrstev) nebo při jeho selhání korová stimulace.
Podle typu bolesti:
Neuralgie je záchvatovitá bolest se spouštěcí zónou a proměnnými přestávkami mezi záchvaty. Nejtypičtější je neuralgie trigeminu, u níž je nejvhodnější mikrovaskulární dekomprese, případně výkon v oblasti Gasserského ganglia. Pokud tato metodika selhává, připadá v úvahu i korová stimulace.
Neuropatická bolest: periferní neurogenní bolest – při poškození v oblasti periferního nervového systému. Zde je vhodná jak stimulace zadních provazců míšních, tak i stimulace kortikální.
Centrální bolest: někdy je zařazována i jako neuropatická bolest v širším smyslu – centrální neurogenní bolest. V tomto případě (jak bylo uvedeno) jsou použitelné algeziologické i chirurgické metody. Při jejich selhání připadá v úvahu pouze kortikální stimulace.
Hodnocení
Naše zkušenosti jsou velmi malé a celkově bylo od roku 2001 na neurochirurgické klinice provedeno pět stimulací. Ve čtyřech případech s velmi dobrým efektem s potlačením bolesti od 40 % do 90 % dle VAS. V jednom případě selhal výběr nemocného.
Zahraniční výsledky jsou velmi podobné, dostatečný efekt stimulace při léčbě centrální bolesti byl u 77 % pacientů a u neuropatické bolesti u 75 % pacientů [43] (obr. 7, 8).
Obr. 7. Uložení elektrod podél motorického a senzitivního gyru u pacientky s neuropatickou bolestí v oblasti obličeje. 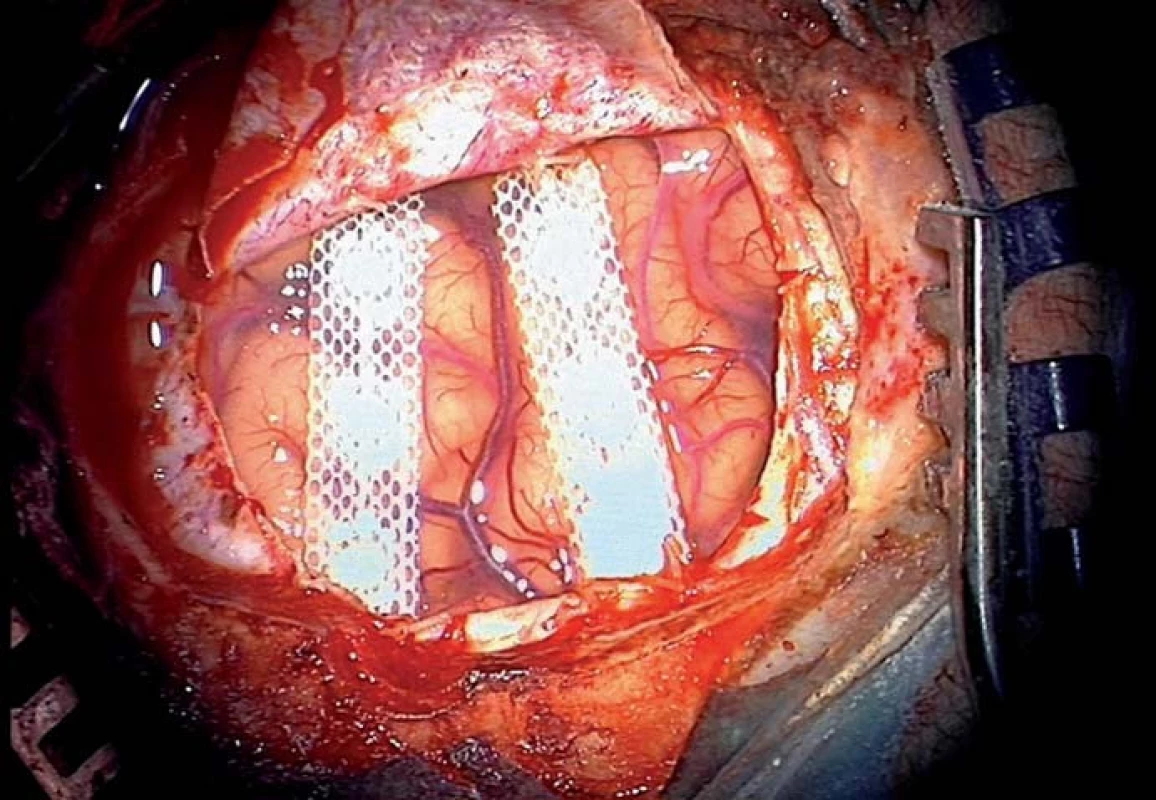
Obr. 8. RTG snímek stimulace motorického kortexu u pacientky s pooperační neuropatickou bolestí obličeje. 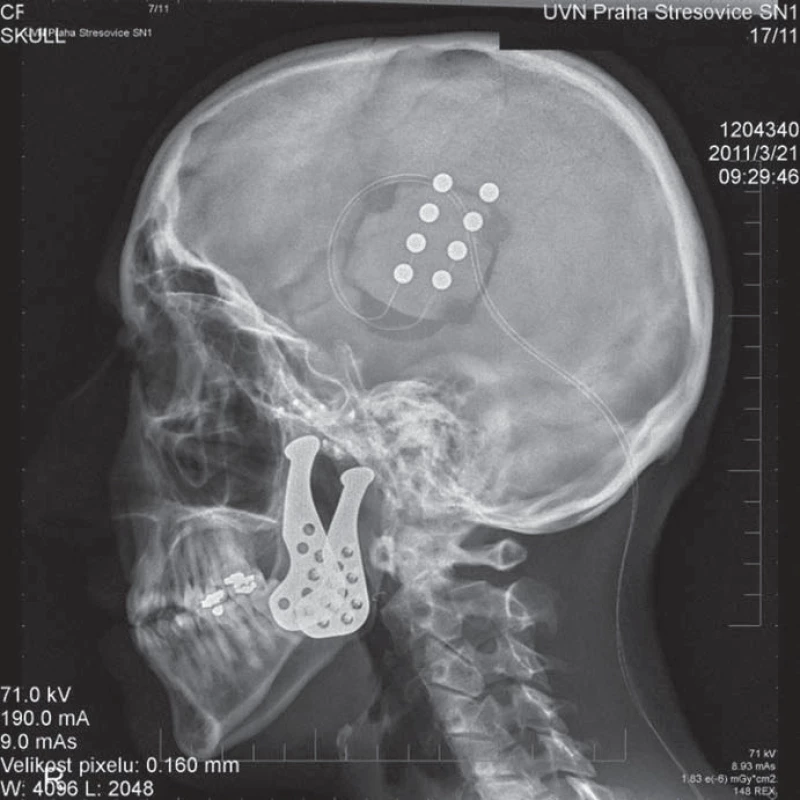
Komplikace
I přes to, že byla provedena změna implantace elektrod pod tvrdou plenu místo nad ni, komplikace jsme nezaznamenali. Při odpovídající chirurgické technice je krvácení nepravděpodobné a únik mozkomíšního moku je díky novým možnostem uzávěru za pomoci lepidel velmi vzácný.
Repetitivní magnetická stimulace (rTMS)
Patofyziologie
Repetitivní magnetická stimulace má vliv na:
- reorganizaci homunkula, kde je struktura kortexu změněna bolestí [83],
- nepřímý efekt na neuronální aktivitu vzdálených kortikálních a subkortikálních oblastí zapříčiňujících inhibici bolestivých senzorických informací probíhajících ve spinothalamických drahách [84],
- vzhledem ke změnám motorických evokovaných potenciálů [85] a snižování aktivity excitačních okruhů v lidském motorickém kortexu [86] je metoda zkoumána i u dalších onemocnění, jako jsou deprese, Parkinsonova choroba, epilepsie, migréna či chronický tinnitus [87,88].
Indikace
Je stejná jako u kortikální stimulace a je indikována pro výběr nemocných pro následnou kortikální stimulaci. Po určitý časový úsek je tato metoda zároveň léčebnou modalitou a je zahrnuta i mezi neuromodulační neinvazivní metodu v doporučeních Evropské neurologické společnosti [89].
Hodnocení
Vzhledem k tomu, že se jedná o metodu, která může být částečně ovlivněna subjektivním vnímáním povrchového nežádoucího efektu ve smyslu stahu svalů v blízkosti stimulace, je hodnocení prováděno jako porovnání normální a slepé cívky. Jednoznačně je stimulační cívka oproti slepé efektivnější v deltaVAS o 2, celkově pak v průměru o 4 [50]. Z velkých studií vyplývá, že nejvhodnější kandidáti pro rTMS jsou pacienti s neuralgií trigeminu. U těchto nemocných je velký analgetický efekt (tj. minimálně 95 %) u 33 % z nich. Nesmíme však zapomenout na časovou omezenost tohoto efektu, která však může být v nejlepším případě i několik měsíců [48,90].
Komplikace
Nízkofrekvenční rTMS může být příčinou nauzey při stimulaci zadní jámy lební [91]. Jsou popisovány případy vzniku přechodné deprese a parciálních epileptických záchvatů [92]. V neposlední řadě i vznik přechodné bolesti na straně stimulace [93].
Stimulace okcipitálního nervu (ONS)
Princip
Princip efektu okcipitální stimulace je založen na existenci trigemino ‑ cervikálního komplexu a ovlivnění kaudální části jádra nervus trigeminus v oblasti horní části krční míchy (C1 – 4) cestou nervového kořene C2 [94,95]. To osvětluje, proč jsme schopni stimulací okcipitálního nervu modulovat senzitivní informaci z celé hlavy u výše jmenovaných onemocnění. Trigemino ‑ cervikální komplex má spoje s periakveduktální šedí s tegmentum dorsolaterale a rostrální ventromediální prodlouženou míchou. Stimulace velkého okcipitálního nervu změní nastavení intenzity bolestivého vzruchu, a to anterográdní cestou. Změní se excitabilita periferních nervových vláken – v plném rozsahu od AALFA po ADELTA, kde jsou popisovány největší změny [63]. Studie pomocí vyšetření PET prokazuje také vliv na kůru mozkovou se zvýšením metabolizmu v oblasti gyrus cinguli anterior [65].
Indikace
Indikační skupiny dle diagnózy:
- chronická migréna,
- syndrom nakupených bolestí hlavy (cluster headache) a jeho podskupiny,
- bolesti hlavy cervikogenního původu,
- neuralgie okcipitálního nervu.
Podle lokalizace:
- cervikokraniální přechod,
- okcipitální oblast krania v distribuci nervus occipitalis major (nejefektivnější),
- hemikranie,
- uranium.
Okcipitální stimulace má jako jedna z mála stimulací možnost výběru vhodných kandidátů ještě před zavedení systému. Tím odpadá nutnost dvoudobého výkonu se zkouškovým obdobím a je možné neuromodulační systém implantovat v jedné době. Výběr nemocných je možné provést dvěma metodami. První je TENS, druhá metoda je zavedení zkušební elektrody.
TENS bude popsán v samostatné kapitole. Druhá možnost je zavedení zkušební kulaté elektrody do místa, kde bude implantována permanentní elektroda. Je to oproti TENS již invazivní výkon. Přesto se jedná o výkon jednoduchý, prováděný v lokálním znecitlivění bez větší traumatizace. Jediným rizikem je proniknutí jehlou hluboko a poranění nervus occipitalis major. Vždy pronikáme jehlou od střední čáry laterálně v interaurikulární čáře. Při pronikání jehly postupujeme povrchově v jedné vrstvě podkoží a uložení a pronikání hrotu jehly kontrolujeme pohmatem kůže. Výstup elektrody stačí fixovat kotvou povrchově. Zkušební elektroda má velkou výhodu v indikaci, protože její použití indikuje efektivnost výkonu téměř stoprocentně. Nevýhoda však je, že vzhledem k riziku infekce neponecháváme elektrodu v podkoží déle než týden. Tudíž je použitelná pouze u nemocných, kde jsou bolesti kontinuální. V literatuře však jednoznačně efekt zkušební elektrody podporován není, protože efekt permanentní stimulace se může objevit až po delší době [30]. V našich podmínkách je vzhledem k cenám stimulátoru dle našeho názoru lepší zvolit pacienta, kde je efekt za pomoci TENS nebo zkušební elektrody prokázán.
Hodnocení
Vzhledem k tomu, že se jedná o stimulaci periferního nervu, je potřebná nízká frekvence stimulace. Podle našich současných zkušeností používáme stimulační frekvenci od 2 do 8 Hz (v literatuře [60 – 80] [96]. Při intenzitě proudu od 1 do 2 mA a nutnosti stimulovat 10 min 4 – 8krát denně tak, jak je využívána našimi pacienty, je předpokládaná doba životnosti celého systému 10 let. To je příznivý ukazatel pro cost/ effectivity.
Další parametr je možnost použít starší typy neuromodulačních systémů, protože nejenom, že nám stačí čtyřkontaktní systém, který je v oblasti stimulace míšní již obsolentní, ale i systémy s nižší kapacitou baterie. Pokud bychom vycházeli z této možnosti, pak by nadále cost/ effectivity index stoupl oproti jiným typům neuromodulace.
Hodnocení efektivity léčby je zatím pouze předběžné, protože doba sledování nepřesáhla u žádného z nemocných 48 měsíců. Nikdy však efektivita neklesla pod 50 % VAS a u všech byla redukována medikace. Takže i z toho pohledu se dá uvažovat o cost/ effectivity výhodném poměru ceny a účinnosti, protože se snižují finančně náročné medikace. Důležitějším faktorem je ovšem zvýšení kvality života u nemocných, kde se snižuje nutnost podávání analgetické medikace, a bolest, které jinak omezují nemocné v denních aktivitách.
Efektivita léčby je dle zahraničních autorů hodnocena podle jednotlivých diagnostických skupin [27,31,32,97,98]. U cluster headache je 40 – 90% snížení intenzity dle VAS, u chronické migrény 35 – 45%, u okcipitální neuralgie 70 – 97% (ta je považována za nejefektivnější) (obr. 9).
Obr. 9. Chirurgická technika zavedení ploché elektrody k okcipitálnímu nervu. 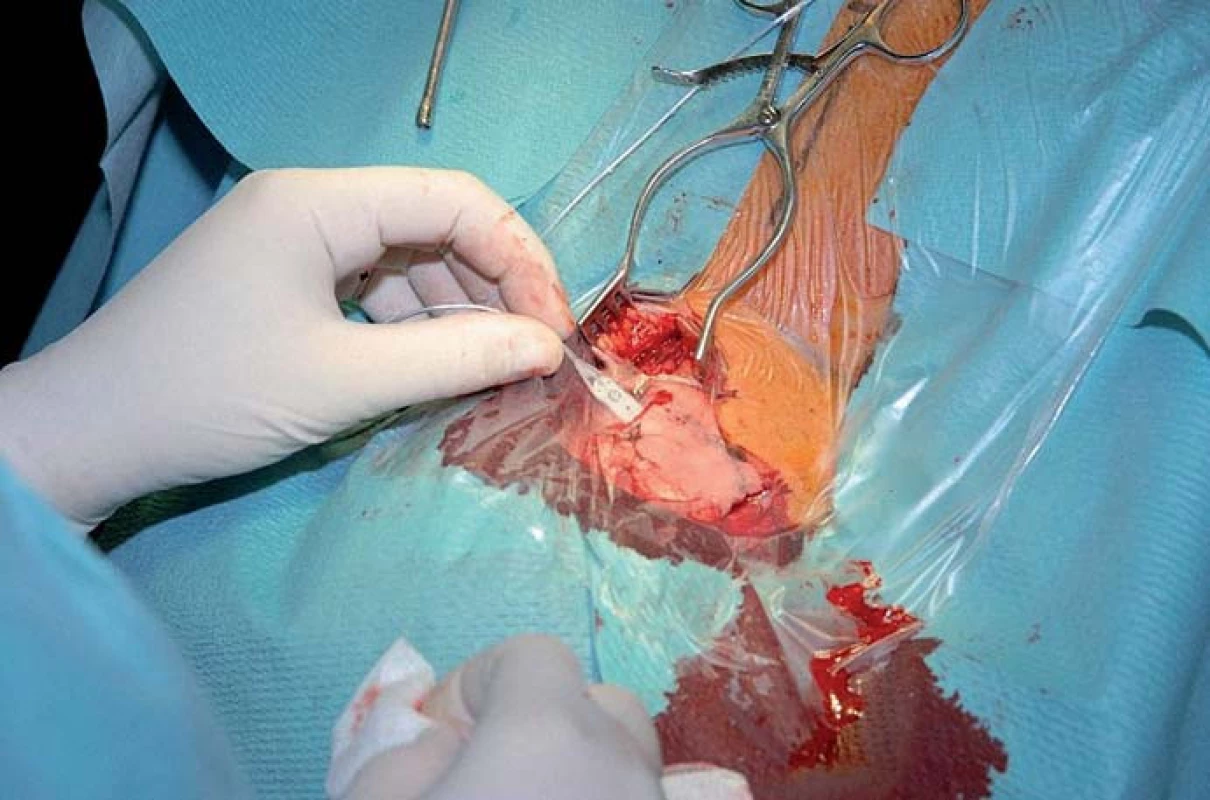
Komplikace
U našich nemocných jsme nepozorovali zánětlivou komplikaci, která je největším rizikem implantace. Podílí se na tom několik faktorů:
- hlavním faktorem je jednodobý výkon na chirurgickém sále,
- je sníženo riziko vstupu bakterií z vnějšího prostředí,
- významným faktorem je téměř úplná bezkrevnost celého výkonu.
TENS
Princip a indikace
Jsou shodné jako u stimulace okcipitálního nervu (ONS).
Hodnocení
Důležitější než vlastní efektivita je schopnost výběru nemocného pro permanentní stimulaci nervus occipitalis major (ONS) a ta dle literatury dosahuje 90 %. My jsme měli možnost na našem malém souboru tento fakt potvrdit [36,37].
Komplikace
Stimulace není nepříjemná a zatím jsme nezaznamenali nežádoucí pocity. Jediným možným nežádoucím účinkem dlouhodobé aplikace elektrod je vznik otlaku, kterému lze zabránit posunem elektrod se zachováním pocitu příjemných parestezií v místě stimulace.
Nezahrnuté neuromodulační metody
Vzhledem k omezenému rozsahu textu jsme se soustředili pouze na metody v léčbě bolesti. Další metody jsou následující:
- hluboká mozková stimulace používaná pro neurologická onemocnění: jako například pro Parkinsonovu chorobu nebo epilepsii,
- vagová stimulace v léčbě epilepsie,
- repetitivní magnetická stimulace (rTMS) v léčbě psychiatrických poruch,
- sakrální stimulace v chirurgii pro léčbu inkontinence,
- stimulace sluchových jader nebo kostní sluchová stimulace v otorinolaryngologii pro léčbu sluchových poruch,
- transkraniální stimulace stejnosměrným proudem (tPCS) používaná v léčbě bolesti. V České republice je plánováno její zařazení mezi neuromodulační metody v roce 2014.
Závěr
O hodnocení jednotlivých metod jsme již hovořili, a proto je závěrem vhodné uvést několik pohledů do budoucnosti těchto metod (obr. 10).
Obr. 10. Elektroda zavedená do akveduktu ke stimulaci periakveduktální šedi, kterou jsme provedli k ověření bezpečnosti této metody na praseti. 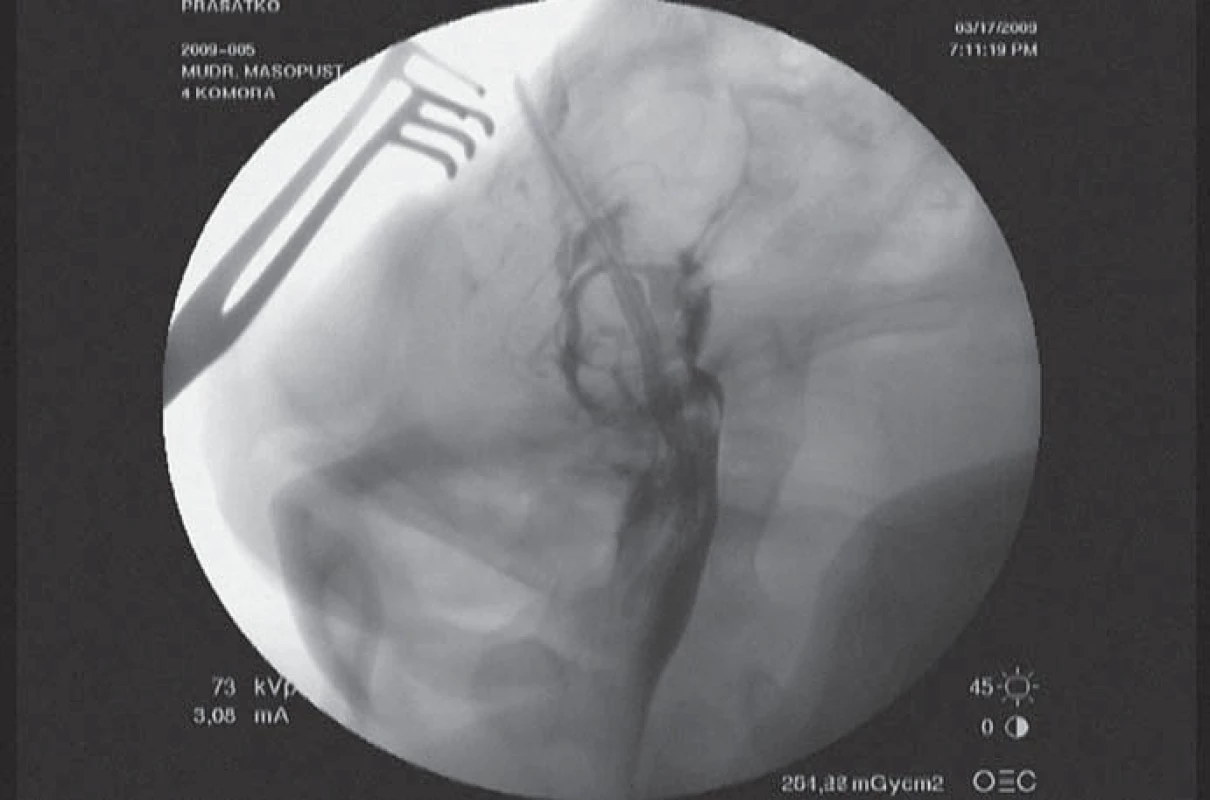
Na prvním místě je vhodné zmínit se o hledání cest, jak zintenzivnit stimulaci a zbavit ji vedlejších fenoménů, jakými jsou například „příjemné parestezie“. Také je třeba snížit spotřebu baterie a tím se vyhnout nutnosti dobíjecích systémů. V současnosti existují dvě nové metody. Vysokofrekvenční stimulace, která přináší efekt bez vedlejších fenoménů, ale znamená vysokou spotřebu energie, což vyžaduje každodenní dobíjení. Alternativou se zdá být „burst“ stimulace, kdy je vysokofrekvenční stimulace pouze na začátku a stimulujeme shlukem (burst) vysokofrekvenčních vln v krátkém časovém intervalu, po němž následuje dlouhá pauza. Tato technika by mohla splňovat všechna žádoucí kritéria [99].
Další možnost, jak lépe stimulovat při nízké spotřebě, je nahradit elektrickou stimulaci jiným stimulačním zdrojem. Perspektiva se zdá být v oblasti stimulace světelné. Takto je nyní testována stimulace buněk vnitřního ucha, kdy můžeme měnit nejen vlnovou délku, ale i směr laserového paprsku a tím ovlivňovat různě vzdálená zakončení.
Na tomto místě je nutné se zmínit i o budoucnosti neuroprotetiky. V současné době je výzkum již natolik daleko, že první lidé snímáním aktivity nervových buněk z kůry mozku ovládají svou robotickou končetinu, včetně toho, že se s ní dokáží napít. Jedná se o úžasný krok do budoucnosti. Pokud budeme schopni nahradit ztrátové poranění, které je často spojeno s bolestí, otevíráme nové možnosti pohybu pro takového jedince, ale hlavně změníme psychické vnímání ztráty. Nové možnosti znamenají naději a naděje znamená pozitivní ladění mozku a ústup bolesti. Úspěchem je nová myšlenka ve způsobu snímání. Pokud bychom chtěli snímat tak jemný záznam pohybu z kůry mozku, pak bychom potřebovali tisíce jemných snímačů. To však není nutné. Postačí několik standardních čidel zaznamenávajících křivku impulzu vyvolávajícího pohyb, která však zároveň zaznamenávají intenzitu podnětu a jeho směr. Tento vektor se pak matematicky přepočítá a získá se tím podrobná mapa aktivity motorické mozkové kůry. Potom už je poměrně jednoduché přenést tuto informaci do pohybu robotické ruky [100].
Na závěr je vhodné připomenout, že zde více než jinde je potřebná multioborová spolupráce nejen mezi lékaři, ale i s vědci jiných oborů a inženýry zabývajícími se jak elektrotechnikou a mechanikou, tak i biokompatibilními materiály. Jako příklad uveďme vývoj stimulátorů v léčbě epilepsie, kde podobně jako je tomu u kardiovertrů, sami poznají nutnost aktivace. Tyto stimulátory kůry mozkové reagují na záznam, který sami analyzují. Toto řešení by jistě našlo využití i v léčbě bolesti. Pokud by stimulátory samy dokázaly elektronicky vyhodnotit blížící se záchvat bolesti, mohly by se aktivovat ještě před vznikem záchvatu. Snad to vypadá jako příliš vzdálená budoucnost, ale ve skutečnosti tomu tak není. Za příklad může posloužit, že v roce 2011 vyslovený zájem, aby stimulátory byly schopné se přizpůsobit pozici nemocného, jestli leží nebo stojí, byl v praxi realizovatelný už v roce 2012, kdy tyto stimulátory byly k dispozici pro implantaci. Tím byla umožněna stimulace aktivním pacientům, kteří chodí do zaměstnání a nemají čas si ke stimulaci lehnout. V roce 2012 se začalo uvažovat o prvních stimulátorech, které by stejně jako kardiostimulátory neměly negativní vliv na magnetickou rezonanci a tím nebyly překážkou vyšetření v případě potřeby neurologických, ortopedických či jiných oborů [101]. V roce 2013 jsme pak na neurochirurgické klinice Ústřední vojenské nemocnice takovýto typ stimulátoru implantovali.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Recenzenti
MUDr. Marek Hakl, Ph.D.
MUDr. Jiří Kozák, Ph.D.
MUDr. Ivan Vrba, Ph.D.
Přijato k recenzi: 6. 1. 2014
Přijato do tisku: 4. 3. 2014
pplk. MUDr. Václav Masopust
Neurochirurgická klinika ÚVN – Vojenská FN
U vojenské nemocnice 1200
162 00 Praha 6
e-mail: masopust@uvn.cz
pplk. MUDr. Václav Masopust
Pplk. MUDr. Václav Masopust po promoci na Fakultě všeobecného lékařství Univerzity Karlovy pracoval v letech 1995–2013 jako sekundární lékař na Neurochirurgické klinice Ústřední vojenské nemocnice – Vojenské fakultní nemocnice Praha. Po návratu z mise v Afganistánu v roce 2013 je na stejném pracovišti vojenským zástupcem přednosty kliniky. Věnuje se chirurgické léčbě bolesti a neuroonkologické problematice se zaměřením na endoskopickou operativu adenomů hypofýzy a ostatních tumorů baze lební. Problematikou neuromodulací se zabývá od roku 2000. Je absolventem šesti zahraničních kurzů se zaměřením na neuromodulační problematiku. Byl organizátorem tří kurzů s neuromodulační problematikou. Je spoluautorem tří knižních publikací a autorem 30 článků v recenzovaných českých i zahraničních periodicích na témata chirurgické léčby bolesti a neuromodulace.
Zdroje
1. Kunc Z. Treatment of essentials neuralgia of the 9th nerve by selective tractotomy. J Neurosurg 1965; 23(5): 494 – 500.
2. Šourek K. Chirurgie bolesti. Praha: Avicenum 1981.
3. Jannetta PJ. Arterial compression of the trigeminal nerve at the pons in patients with trigeminal neuralgia. J Neurosurg 1967; 26 (Suppl 1): S159 – S162.
4. Jensen JE, Conn RR, Hazelrigg G, Hewett JE. The use of transcutaneous neural stimulation and isokinetic testing in arthroscopic knee surgery. Am J Sports Med 1985; 13(1): 27 – 33.
5. Beneš V, Šlégr Z, Strnad M. Elektrostimulace zadních míšních provazců při léčbě bolesti. Cas Lek Cesk 1973; 113(50 – 51): 1565 – 1568.
6. Pokorný J, Lébl M. Možnosti využití lokální elektroanalgezie u nemocných s neztišitelnou bolestí. Rozhl Chir 1977; 56(12): 801 – 809.
7. Stinson LW jr, Roderer GT, Cross NE, Davis BE. Peripheral subcutaneous field stimulation for control of intractable post‑operative inguinal pain: a case report series. Neuromodulation 2001; 4(3): 99 – 104. doi: 10.1046/ j.1525 – 1403.2001.00099.x.
8. Paicus RM, Bernstein CA, Lempert ‑ Cohen C. Peripheral nerve field stimulation in chronic abdominal pain. Pain Physician 2006; 9(3): 261 – 266.
9. Paicus RM, Bernstein CA, Lempert ‑ Cohen C. Peripheral nerve stimultaion for the treatment of chronic low back pain: preliminary results of long‑term follow‑up: a case series. Neuromodulation 2007; 10(3): 279 – 290. doi: 10.1111/ j.1525 – 1403.2007.00116.x.
10. Bernstein CA, Paicus RM, Barkow SH, Lempert ‑ Cohen C. Spinal cord stimulation in conjuction with peripheral nerve field stimulation for the treatment of low back and leg pain: a case series. Neuromodulation 2008; 11(2): 116 – 123. doi: 10.1111/ j.1525 – 1403.2008.00152.x.
11. Nashold BS jr, Goldner JL, Mullen JB, Bright DS. Long‑term pain control by derect paripheral ‑ nerve stimulation. J Bone Joint Surg Am 1982; 64(1): 1 – 10.
12. Hassenbusch SJ, Stanton ‑ Hicks M, Schoppa D, Walsh JG, Covington EC. Long‑term results of peripheral nerve stimulation for reflex sympathetic dystrophy. J Neurosurg 1996; 84(3): 415 – 423.
13. Kozák J, Vrba I, Steindler J. Použití periferní nervové stimulace u případu neztišitelné neuropatické bolesti, kazuistika. Bolest 2011; 14(2): 82 – 88.
14. Matzel KE, Stadelmaie U, Hohenfellner M, Gall FP.Electical stimulatation of sacral spinal nerves for treatment of faecal incontinence. Lancet 1995; 346(8983): 1124 – 1127.
15. Alo KM, Yland MJ, Redko V, Feler C, Naumann C.Lumbar and sacral nerve root stimulation (NRS) in the treatment of chronic pain: a novel anatomic approach and neuro stimulation technique. Neuromodulation 1999; 2(1): 23 – 31. doi: 10.1046/ j.1525 – 1403.1999.00023.x.
16. Siegel S, Paszkiewicz E, Kirkpatrick C, Hinkel B, Oleson K. Sacral nerve stimulation in patiens with chronic intractable pelvic pain. J Urol 2001; 166(5): 1742 – 1745.
17. Shealy CN. Dorsal column electrohypalgesia. Headache 1969; 9(2): 99 – 102.
18. Kumar K, Nath R, Wyant GM. Treatment of chronic pain by epidural spinal cord stimulation. J Neurosurg 1991; 75(3): 402 – 407.
19. Nachbur B, Gersbach P, Hasdemir M. Spinal cord stimulation for unreconstructable chronic limb ischaemia. Eur J Vasc Surg 1994; 8(4): 383 – 388.
20. Sanderson J, Ibrahim B, Waterhous D, Palmer RB. Spinal electrical stimulation for intractable angina – longterm ‑ clinical outcome and safety. Eur Heart J 1994; 15(6): 810 – 814.
21. Yakhnitsa V, Linderoth B, Meyerson BA. Spinal cord stimulation attenuates dorsal horn neuronal hyperexcitability in a rat model of mononeuropathy. Pain 1999; 79(2 – 3): 223 – 233.
22. Vrba I, Kozák J. Neuromodulace při chronické bolesti 1. část. Bolest 2002; 1 : 6 – 14.
23. Picaza JA, Hunter SE, Cannon BW. Pain suppression by peripheral nerve stimulation. Chronic effects of implanted devices. Appl Neurophysiol 1977 – 1978; 40(2 – 4): 223 – 234.
24. Waisbrod H, Panhans C, Hansen D, Gerbershagen HU. Direct nerve stimulation for painful peripheral neuropathies. J Bone Joint Surg Br 1985; 67(3): 470 – 472.
25. Weiner RL, Reed KL. Peripheral neurostimulation for control of intractable occipital neuralgia. Neuromodulation 1999; 2(3): 217 – 221. doi: 10.1046/ j.1525-1403.1999.00217.x.
26. Melvin EA jr, Jordan FR, Weiner RL, Primm D. Using peripheral stimulation to reduce the pain of C2 - mediated occipital headaches: a preliminary report. Pain Physician 2007; 10(3): 453 – 460.
27. Paemeleire K, Van Buyten JP, Van Buynder M, Alicino D, Van Maele G, Smet I et al. Phenotype of patients responsive to occipital nerve stimulation for refractory head pain. Cephalalgia 2010; 30(6): 662 – 673. doi: 10.1111/ j.1468 – 2982.2009.02022.x.
28. Ghaemi K, Capelle HH, Kinfe TM, Krauss JK. Occipital nerve stimulation for refractory occipital pain after occipitocervical fusion: expanding indications. Stereotact Funct Neurosurg 2008; 86(6): 391 – 393. doi: 10.1159/ 000175802.
29. Burns B, Watkins L, Goadsby PJ. Treatment of medically intractable cluster headache by occipital nerve stimulation: long‑term follow‑up of eight patients. Lancet 2007; 369(9567): 1099 – 1106.
30. Burns B, Watkins L, Goadsby PJ. Treatment of intractable chronic cluster headache by occipital nerve stimulation in 14 patients. Neurology 2009; 72(4): 341 – 345. doi: 10.1212/ 01.wnl.0000341279.17344.c9.
31. Magis D, Allena M, Bolla M, De Pasqua V, Remacle JM, Schoenen J. Occipital nerve stimulation for drug‑resistant chronic cluster headache: a prospective pilot study. Lancet Neurol 2007; 6(4): 314 – 321.
32. Saper JR, Dodick DW, Silberstein SD, McCarville S,Sun M, Goadsby PJ. Occipital nerve stimulation for the treatment of intractable chronic migraine headache: ONSTIM feasibility study. Cephalalgia 2011; 31(3): 271 – 285. doi: 10.1177/ 0333102410381142.
33. Burns B, Watkins L, Goadsby PJ. Treatment of hemicrania continua by occipital nerve stimulation with a bion device: long‑term follow‑up of a crossover study. Lancet Neurol 2008; 7(11): 1001 – 1012. doi: 10.1016/ S1474 – 4422(08)70217 – 5.
34. Masopust V, Nežádal T. Stimulace okcipitálního nervu v léčbě bolestí hlavy. Bolest 2012; 15(3): 117 – 120.
35. Maurer D. Transcutaneuous stimulator and stimulation method. U.S. Patent 3, 817, 254. Publication date June 18, 1974.
36. McQuay HJ, Moore RA, Eccleston C, Morley S, Williams AC. Systematic review of outpatient services for chronic pain control. Health Technol Assess 1997; 1(6): 1 – 135.
37. Oosterhof J, Wilder ‑ Smith OH, de Boo T, Oostendorp RA, Crul BJ. The long‑term outcome of transcutaneous electrical nerve stimulation in the treatment for patients with chronic pain: a randomized, placebo controlled trial. Pain Pract 2012; 12(7): 513 – 522. doi: 10.1111/ j.1533 – 2500.2012.00533.x.
38. Tsubokawa T, Katayama Y, Yamamoto T, Hirayama T, Koyama S. Chronic motor cortex stimulation for treatment of central pain. Acta Neurochir Suppl 1991; 52 : 137 – 139.
39. Tsubokawa T, Katayama Y, Yamammoto T, Hirayama T, Koyama S. Chronic motor cortex stimulation in patiens with thalamic pain. J Neurosurg 1993; 78(3): 393 – 401.
40. Mayerson BA, Linblom U, Linderoth B, Lind G, Herregodts P. Motor cortex stimulation as treatment of trigeminal neuropathic pain. Acta Neurochir 1993; 58 (Suppl): 150 – 153.
41. Mayerson BA. Pharmacological test in pain analysis and in prediction of treatment outcome. Pain 1997; 72(1 – 2): 1 – 3.
42. Nguyen JP, Keravel Y, Feve A, Uchiyama T, Cesaro P,Le Guerinel C et al. Treatment of deafferentation pain by chronic stimulation of the motor cortex, report of a series of 20 cases. Acta Neurochir 1997; 68 (Suppl): 54 – 60.
43. Nguyen JP, Lefaucheur JP, Decq P, Uchiyama T, Carpentier A, Fontaine D et al. Chronic motor cortex stimulatin in the treatment of central and neuropathic pain. Correlations between clinical, electrophysiological and anatomical data. Pain 1999; 82(3): 245 – 251.
44. Masopust V, Beneš V, Netuka D, Pollin B, Rokyta R,Stejskal L. Stimulace mozkové kůry v léčbě chronické talamické bolesti. Bolest 2001; 2 : 91 – 94.
45. Masopust V, Ostrý S, Beneš V, Fricová J, Rokyta R. Stimulace motorické mozkové kůry – nový pohled – kazuistika. Bolest 2010; 13(3): 135 – 138.
46. Lefaucheur JP. Transcranial magnetic stimulation in the management of pain. Clin Neurophysiol 2004; 57 (Suppl): 737 – 748.
47. Graff ‑ Guerrero A, González ‑ Olvera J, Fresán A, Gómez ‑ Martín D, Méndez ‑ Núnez JC, Pellicer F. Repetitive transcranial magnetic stimulation of dorsolateral prefrontal cortex increases tolerance to human experimental pain. Brain Res 2005; 25(1): 153 – 160.
48. Leung A, Donohue M, Xu R, Lee R, Lefaucheur JP, Khedr EM et al. rTMS for suppressing neurophatic pain: a meta‑analysis J Pain 2009; 10(12): 1205 – 1216. doi: 10.1016/ j.jpain.2009.03.010.
49. Masopust V, Häckel M, Rokyta R. Nerepetitivní magnetická stimulace. Bolest 2005; 4 : 243 – 245.
50. Fricová J, Klírová M, Masopust V, Novák J, Vérebová K, Rokyta R. Repetitive transcranial magnetic stimulation in the treatment of chronic orofacial pain. Physiol Res 2013; 62 (Suppl 1): S125 – S134.
51. Rokyta R, Fricová J. Neurostimulation methods in the treatment of chronic pain. Physiol Res 2012; 61 (Suppl 2): S23 – S31.
52. Melzack R, Wall PD. Pain Mechanisms: A New Theory. Science 1965; 150(3699): 971 – 979.
53. Noordenbos W. Pain: Problems Pertaining to the transmission of nerve impulses which give rise to pain. Amsterdam: Elsevier 1959.
54. Giesler GJ jr, Liebeskind JC. Inhibition of visceral pain by electrical stimulation of the periaqueductal gray matter. Pain 1976; 2(1): 43 – 48.
55. Hughes J, Kosterlitz HW, Smith TW. The distribution of metionine ‑ enkephalin and leucine ‑ enkephalin in the brain and peripheral tissues. Br J Pharmacol 1977; 61(4): 639 – 647.
56. Hassler R. Die zentralen systeme des schmerzes. Acta Neurochir 1960; 8 : 353 – 423.
57. Rokyta R. Bolest – morfologické a fyziologické základy. Remedia 1995; 5 : 64 – 70.
58. Rokyta R. Fyziologie a patofyziologie bolesti a její možné praktické výstupy. Prakt Lék 2000; 80(7): 372 – 377.
59. Rokyta R, Kršiak M, Kozák J (eds). Bolest. Praha: Tigis 2006.
60. Dickenson AH. Gate kontrol theory of pain stands the test of time. Br J Anaesth 2002; 88(6): 755 – 757.
61. Campbell JN, Long DM. Peripheral nerve stimulation in the treatment of intractable pain. J Neurosurg 1976; 45(6): 692 – 699.
62. Bartsch T, Goadsby PJ. Central mechanisms of peripheral nerve stimulation in headache disorders. In: Slavin KV (eds). Peripheral Nerve stimulation, Basel: Karger 2011 : 16 – 26.
63. Ignelzi RJ, Nyquist JK. Excitability changes in peripheral nerve fibers after repetitive electrical stimulation. Implications in pain modulation. J Neurosurg 1979; 51(6): 824 – 833.
64. Ellrich J, Lamp S. Peripheral nerve stimulation inhibic nociceptive processing an electrohysiological study in healthy volunteers. Neuromodulation 2005; 8(4): 225 – 232. doi: 10.1111/ j.1525 – 1403.2005.00029.x.
65. Matharu M, Bartsch T, Ward N, Frackowiak RS, Werner R, Goadsby PJ. Central neuromodulation in chronic migraine patients with suboccipital stimulators: a PET study. Brain 2004; 127(1): 220 – 230.
66. Sator ‑ Katzenschlager S, Fiala K, Kress HG, Kofler A, Neuhold J, Kloimstein H et al. Subcutaneous target stimulation (STS) in chronic noncancer pain: a nationwide retrospective study. Pain Pract 2010; 10(4): 279 – 286. doi: 10.1111/ j.1533 – 2500.2009.00351.x.
67. Slavin KV. Technical aspects of peripheral nerve stimulation: hardware and complications. Prog Neurol Surg 2011; 24 : 189 – 202. doi: 10.1159/ 000323275.
68. Lewis R, Racz G. Peripheral nerve stimulation – surgical technique laptop. Minneapolis: Medtronic 1992.
69. Slotty PJ, Vesper J, Pohlmier K, Wille Ch. Predicting outcome in peripheral nerve stimulation for chronic neuropathic pain. Neuromodulation 2013; 16(5): 483 – 489. doi: 10.1111/ ner.12091.
70. Mobbs RJ, Nair S, Blum P. Peripheral nerve stimulation for the treatment of chronic pain. J Clin Neurosci 2007; 14(3): 216 – 221.
71. Rokyta R, Kršiak M, Kozák J. Bolest. Praha: Tigis 2012.
72. Kumar K, Taylor RS, Jasques L, Eldabe S, Meglio M, Molet J et al. The effects of spinal cord stimulation in neurapthic pain are sustained: a 24 – month follow‑up of the prospective randomized controlled multicenter trial of the effectiveness of spinal cord stimulation. Neurosurgery 2008; 63(4): 762 – 770. doi: 10.1227/ 01.NEU.0000325731.46702.D9.
73. Mekhail NA, Mathews M, Nageeb F, Guirguis M, Mekhail MN, Cheng J. Retrospective review of 707 cases of spinal cord stimultaion: indikacations and complications. Pain Pract 2001; 11(2): 148 – 153. doi: 10.1111/ j.1533 – 2500.2010.00407.x.
74. Hess L. Mechanismy opioidy indukované hyperalgezie. Remedia 2004; 5. [online] Dostupné z URL: http:/ / www.remedia.cz/ Archiv ‑ rocniku/ Rocnik ‑ 2004/ 5 – 2004/ Mechanismy ‑ opioidy ‑ indukovane ‑ hyperalgezie/ e ‑ 9m ‑ 9H ‑ cN.magarticle.aspx.
75. Andel IF, Gould HJ jr, Carey ME. Intrathecal morfine pump as a treatment option in chronic pain of nonmalignant origin. Surg Neurol 1998; 49(1): 92 – 98.
76. Kumar K, Hunter G, Demeria DD. Treatment of chronic pain by using intrathecal drug therapy compared with conventional pain therapies a cost‑effectiveness analysis. J Neurosurg 2002; 97(4): 803 – 810.
77. Bejjani GK, Karim NO, Tzotzidis F. Intrathecal granuloma after implantation of a morfine pump: case report and review of literature. Surg Neurol 1997; 48(3): 288 – 291.
78. Chambers FA, MacSullivan R. Intrathecal morfine in the treatment of chronic intractable pain. Ir J Med Sci 1994; 163(7): 318 – 321.
79. McDonnell MN, Orekhov Y, Ziemann U. The role of GABAB receptors in intracortical inhibition in the human motor cortex. Exp Brain Res 2006; 173(1): 86 – 93.
80. Lindenberg R, Nachtigall L, Meinzer M, Sieg MM, Flöel A. Defferential effects of dual and unihemispheric motor cortex stimulation in older adults. J Neurosci 2013; 33(21): 9176 – 9183. doi: 10.1523/ JNEUROSCI.0055 – 13.2013.
81. Meyerson BA, Lindlom U, Linderoth B, Lind G, Herregodts P. Motor cortex stimulation as treatment of trigeminal neuropathic pain. Acta Neurochir 1993; 58 (Suppl): 150 – 153.
82. Saitoh Y, Hirano S, Kato A, Kishima H, Hirata M, Yamamoto K et al. Motor cortex stimulation for deafferentation pain. Neurosurg Focus 2001; 11(3): 1 – 5.
83. Borckardt JJ, Smith AR, Reeves ST, Weinstein M,Kozel FA, Nahas Z et al. Fifteen minutes of left prefrontal repetitive transcranial magnetic stimulation acutely increases thermal pain thresholds in healthy adults. Pain Res Manag 2007; 12(4): 287 – 290.
84. Rokyta R, Hakl M. Neuromodulace. Hakl M (eds.). Léčba bolesti. Praha: Mladá Fronta 2011 : 89 – 101.
85. Gilio F, Iacovelli E, Frasca V, Gabriele M, Giacomelli E, De Lena C et al. Electrical and magnetic repetitive transcranial stimulation of the primary motor cortex in healthy subjects. Neurosci Lett 2009; 455(1): 1 – 3. doi: 10.1016/ j.neulet.2009.03.035.
86. Di Lazzaro V, Pilato F, Dileone M, Profice P, Oliviero A, Mazzone P et al. Low ‑ frequency repetitive transcranial magnetic stimulation suppresses specific excitatory circuits in the human motor cortex. J Physiol 2008; 586(18): 4481 – 4487. doi: 10.1113/ jphysiol.2008.159558.
87. Kleinjung T, Vielsmeier V, Landgrebe M, Hajak G, Langguth B. Transcranial magnetic stimulation: a new diagnostic and therapeutic tool for tinnitus patiens. Int Tinnitus J 2008; 14(2): 112 – 118.
88. Hausmann A, Kemmler G, Walpoth M, Mechtcheriakov S, Kramer ‑ Reinstadler K, Lechner T et al. No benefit derived from repetitive transcranial magnetic stimulation in depression: a prospetive, single centre, randomised, double blind, sham controlled „add on“trial. J Neurol Neurosurg Psychiatry 2004; 75(2): 320 – 322.
89. Cruccu G, Aziz TZ, Garcia ‑ Larrea L, Hansson P, Jensen TS, Lefaucheur JP et al. EFNS guidelines on neurostimultion therapy for neuropathic pain. Eur J Neurol 2007; 14(9): 952 – 970.
90. Fricová J, Klírová M, Šoš P, Tišlerová B, Hackel M, Masopust V et al. Repetitive transcranial stimulation in chronic orofacial neurogenic pain treatment. Congress on Pain, WIP; 2009 March 13 – 16; New York, USA.
91. Sattow T, Mima T, Hara H, Oga T, Ikeda A, Hashimoto N et al. Nausea as a complication of low ‑ frequency repetitive transcranial magnetic stimulation of the posterior fossa. Clin Neurophysil 2002; 113(9): 1441 – 1443.
92. Rosa MA, Picarelli H, Teixeira MJ, Rosa MO, Marcolin MA. Accidental seizure with repetitive transcarnial magnetic stimulation. J ECT 2006; 22(4): 265 – 266.
93. Rossini PM, Rossi S. Transcranial magnetic stimulation: diagnostic, therapeutic, and research potential. Neurology 2007; 68(7): 484 – 488.
94. Piovesan EJ, Kowacs PA, Tatsui CE, Lange MC, Ribas LC, Werneck LC. Referred pain after painful stimulation of the greater occipital nerve in humans: evidence of convergence of cervical afferences on trigeminal nuclei. Cephalalgia 2001; 21(2): 107 – 109.
95. Busch V, Jakob W, Juergens T, Schulte ‑ Mattler W,Kaube H, May A. Functional connectivity between trigeminal and occipital nerves revealed by occipital nerve blockade and nociceptive blink reflexes. Cephalalgia 2006; 26(1): 50 – 55.
96. Schwedt TJ, Dodick DW, Hentz J, Trentman TL, Zimmerman RS. Occipital nerve stimulation for chronic headache – long‑term safety and efficacy. Cephalalgia 2007; 27(2): 153 – 157.
97. Young WB, Silberstein SD. Occipital nerve stimulation for primary headaches. J Neurosurg Sci 2012; 56(4): 307 – 312.
98. Shaladi A, Crestani F, Saltari R, Piva B. Percutaneous electrical nerve stimulation of peripheral nerve for the intractable occipital neuralgia. Recenti Prog Med 2008; 99(6): 295 – 301.
99. Crosby N, Keiser MG, Weisshaar CH, Zeeman M,Winkelstein B. Optimization of burst SCS parameters in a rat model of neuropathic pain. Proceedings of the North American Neuromodulation Society Annual Meeting; 2013 Dec 5 – 8; Las Vegas, USA.
100. Bouton Ch, Annetta N, Mysiw J. Neural bridging with dynamic and coordinated hand and Fišer movements in tetraplegia. Proceedings of the North American Neuromodulation Society Annual Meeting; 2013 Dec 5 – 8; Las Vegas, USA.
101. Desai MJ, Rayan M. Estimating the need for magnetic resonance paging (MRI) in patiens with spinal cord simulation. Proceedings of the North American Neuromodulation Society Annual Meeting; 2013 Dec 5–8; Las Vegas, USA.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2014 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Neuromodulace
- Alkoholový odvykací stav a delirium – od patofyziologie k léčbě
- Cerebrální vazospazmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčby
- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy
-
Komentář k článku autorek Ondrušová a Nováková
Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy - Porovnanie validity diagnostických kritérií sclerosis multiplex 2005 vs 2010 s aspektom včasnej diagnostiky
- Vývoj neurologického a funkčního obrazu po poranění míchy
- Projekt ncRNAPain
- Vztah mezi parametry transkraniální dopplerometrie a tkáňovou oxymetrií u pacientů s těžkým subarachnoidálním krvácením
- Posuzování gramatičnosti v Brocově afázii – příklad dvou pacientů
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Volumetrické vyhodnocení efektu následné onkologické léčby při inoperabilní progresi či reziduu nízkostupňového gliomu
- Ovlivnění funkce sluchové dráhy u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem
- REaDY – český registr svalových dystrofií
- Intoxikace metanolem v obraze magnetické rezonance – kazuistiky
- Krční epidurální absces – dvě kazuistiky
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Nemalinová myopatie asociovaná s monoklonální gamapatií – kazuistika
- Za MUDr. Luďkem Navrátilem, Ph.D
- Prof. MUDr. Jiří Tichý, DrSc. pětaosmdesátiletý
- Prof. MUDr. Josef Bednařík, CSc., slaví 60. narozeniny
- Webové okénko
- Recenze knihy
- Recenze knihy
-
Analýza dat v neurologii
XLIV. Grafy usnadňující studium zavádějících faktorů v asociačních studiích – II. Zdroj dat jako zavádějící faktor
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Neuromodulace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




