-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
Autonomic Dysreflexia – a Serious Complication of Spinal Cord Injury
Autonomic dysreflexia is a serious complication found in more than half of patients with spinal cord injury above the T6 level. In case of an autonomic system disorder, a trigger below the level of injury causes severe vasoconstriction with paroxysmal hypertension. Presenting symptoms include bradycardia, pounding headache, sweating and flushing above the level of lesion, and anxiety. However, AD can sometimes occur without symptoms. The causes of AD include bladder and bowel distension, urological surgeries as well as burning, pressure sores and fractures. Uncontrolled hypertension can lead to hemorrhagic stroke, retinal hemorrhage, respiratory or cardiac problems and even death. Management involves placing the patient in an upright position to take advantage of orthostatic reduction in blood pressure. As the first line of treatment, the cause of irritation has to immediately be eliminated; this usually leads to blood pressure stabilization. If hypertension continues, rapid onset antihypertensive drugs should be used.
Key words:
spinal cord injury – autonomic dysreflexia – tetraplegia
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: J. Kříž 1; M. Rejchrt 2
Působiště autorů: 2. LF UK a FN v Motole, Praha Spinální jednotka při Klinice rehabilitace a tělovýchovného lékařství 1; 2. LF UK a FN v Motole, Praha Urologická klinika 2
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(2): 168-173
Kategorie: Přehledný referát
Souhrn
Autonomní dysreflexie je závažná komplikace, která se projeví u více než poloviny pacientů s míšním poraněním nad šestým hrudním segmentem. Při poruše autonomního nervového systému je podráždění pod úrovní míšní léze zdrojem těžké vazokostrikce, která způsobí paroxysmální hypertenzi. Doprovází ji bradykardie, prudká pulzující bolest hlavy, pocení a zarudnutí nad úrovní léze i úzkost, někdy se však může vyskytovat bez subjektivních příznaků. Nejčastější příčinou je distenze močového měchýře, distenze rekta, operační zákroky na dolních močových cestách, ale i popáleniny, dekubity nebo fraktury. Nekontrolovaná hypertenze může vyústit v krvácení do mozku, krvácení do sítnice, respirační či kardiální obtíže, ale může vést i ke smrti. Léčba spočívá v rychlé vertikalizaci, která pomůže ortostaticky snížit krevní tlak, především je ale třeba neodkladně vyřešit příčinu podráždění. To vede zpravidla k normalizaci krevního tlaku. Při přetrvávající hypertenzi je nutné použít antihypertenziva s rychlým nástupem účinku.
Klíčová slova:
poranění míchy – autonomní dysreflexie – tetraplegieÚvod
U pacientů s poraněním míchy nad šestým hrudním segmentem se může rozvinout syndrom autonomní dysreflexie (AD). Jedná se o reflexní netlumenou reakci sympatiku na dráždivý podnět pod úrovní míšní léze. Důsledkem je těžká vazokonstrikce s prudkým zvýšením krevního tlaku doprovázená silnou pulzující bolestí hlavy. Neléčená ataka AD může mít závažné zdravotní důsledky, jako jsou krvácení do mozku, srdeční selhání až smrt.
V posledním desetiletí se v literatuře objevila řada nových informací týkajících se nejen patofyziologie tohoto syndromu, ale i aplikace preventivních a léčebných postupů. Také opakovaný výskyt závažných komplikací spojených právě s neléčenou autonomní dysreflexií, který jsme pozorovali v posledních letech na našem pracovišti, byl podnětem k vyhodnocení literatury týkající se AD a k sestavení souborného referátu.
Definice
Autonomní dysreflexie je syndrom masivní nevyvážené reflexní sympatické aktivity vyskytující se u pacientů po poranění míchy nad splanchnickým sympatickým výstupem. Projevuje se paroxyzmální hypertenzí. Pro syndrom AD svědčí zvýšení systolického tlaku nejméně o 20 mm Hg oproti bazální hodnotě [1].
Historie
Syndrom poprvé popsal Anthony Bowlby v roce 1890. Bowlby se ve své práci zabýval přítomností, resp. absencí reflexů u spinálních pacientů ve vztahu k rozsahu míšní léze a eventuální indikaci k operačnímu řešení. Své závěry prezentoval na základě hodnocení 11 případů kompletního a třech případů nekompletního míšního poranění. U jednoho pacienta s kompletní míšní lézí, který přežil několik měsíců, popisuje ve 24. týdnu po zranění pocit brnění a píchání v oblasti hrudníku při zavádění močového katétru a následně po jeho zavedení profuzní pocení na hlavě a krku s rozvojem jasného zarudnutí, jež přetrvávalo 15 – 20 min [2].
Kompletní popis syndromu provedli v roce 1947 Guttmann a Whitteridge [3]. Jejich soubor obsahoval 30 pacientů s různou úrovní míšní léze, způsobenou většinou střelným poraněním. Cílem studie bylo sledování autonomní reakce na distenzi močového měchýře. U pacientů s krční a horní hrudní lézí se během zvyšování intravezikálního tlaku objevily příznaky AD.
Incidence
Incidence AD u pacientů po míšním poranění se liší podle výsledků jednotlivých autorů. Curt et al uvádějí výskyt příznaků AD u 27 % pacientů s nekompletní krční lézí a v 97 % u kompletních tetraplegiků [4]. Bycroft et al udávají přítomnost AD mezi 50 % a 70 % pacientů s poraněním míchy nad úrovní T6 [5]. Furusawa et al hodnotili přítomnost symptomatické autonomní dysreflexie u 571 pacientů s míšní lézí v úrovni C1 – T6 v závislosti na vyprazdňování močového měchýře nebo střeva [6]. Vyšší procento AD zaznamenal u kompletních a senzitivně nekompletních lézí (42,9 %) proti motoricky nekompletním lézím (14,7 %). U pacientů s režimem intermitentní katetrizace byla významně nižší prevalence (26,2 %) v porovnání s pacienty se suprapubicky či transuretrálně zavedeným permanentním katétrem anebo u pacientů používajících trigerovanou mikci (48,6 %). Z uvedených prací je patrné, že incidence AD u pacientů s míšní lézí nad šestým hrudním segmentem se pohybuje nejčastěji mezi 40 a 70 %. V České republice nejsou v současné době data týkající se incidence AD k dispozici.
Neurofyziologie
Při poranění autonomního nervového systému se odehrává celá řada patologických procesů na buněčné i biochemické úrovni, které způsobí změny v chování organizmu, jako jsou rozvoj neurogenního a míšního šoku, porucha termoregulace, ale i riziko AD [7].
Bezprostředně po zranění krční a horní hrudní míchy dojde k přerušení descendentního bulbospinálního vstupu do sympatických pregangliových neuronů s jejich částečnou deaferentací, ztrátou dendritických trnů a sníženou citlivostí na excitační vstupy. V průběhu 30 dnů nastane obnovení dendritického tvaru pučením myelinizovaných a nemyelinizovaných vláken s tvorbou nových nebo změnou regulace původních receptorů. Ztráta descendentních drah k synaptickým pregangliovým neuronům a formace nových modifikovaných synaptických vstupů vede k rozvoji přehnaných reflexních odpovědí a abnormální autonomní kontroly. Neurobiochemické změny zahrnují zvýšenou expresi synaptofyzinu v synaptických vezikulách, dopamin beta‑hydroxylázy a substance P s možným excitačním efektem. Další důležitá změna je hypersenzitivita vaskulárních alfaadrenergních receptorů [8].
Výše uvedené změny vedou ke stavu sympatické hyperexcitability. Při podráždění pod úrovní míšního poranění jsou aferentní impulzy vedeny intaktními senzitivními nervy a následně spinothalamickými drahami a zadními provazci. Dochází ke stimulaci sympatických neuronů v intermediolaterální šedé hmotě míšní a k netlumenému sympatickému výstupu s uvolněním norepinefrinu, dopamin beta‑hydroxylázy a dopaminu. Následuje mohutná splanchnická a periferní vazokonstrikce s paroxyzmálním vzestupem krevního tlaku. Mozek detekuje hypertenzi prostřednictvím baroreceptorů v karotickém sinu a aortálním oblouku a stimuluje dva reflexy – jeden, který přes nervus vagus způsobuje bradykardii, a druhý, který zahrnuje inhibici descendentních sympatických drah. Tato inhibice se však může projevit pouze nad úrovní léze a nevede k adekvátnímu snížení krevního tlaku (obr. 1).
Obr. 1. Schéma patofyziologie autonomní dysreflexie. 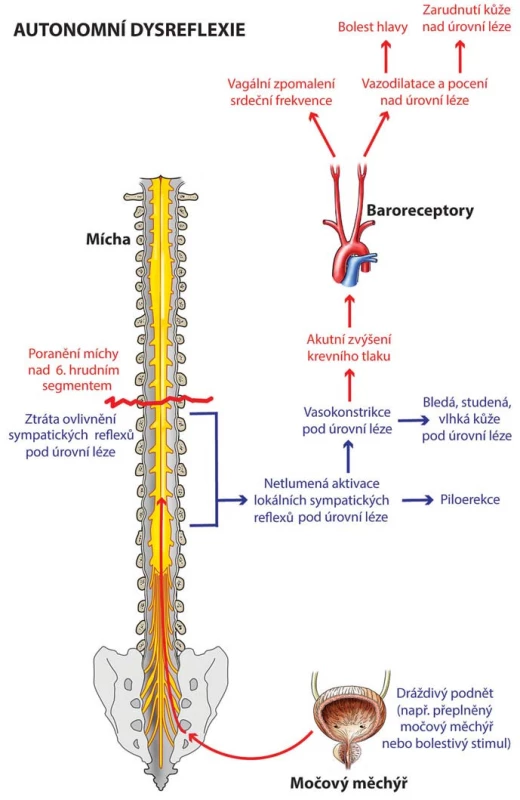
Příznaky
Hlavním objektivním příznakem AD je prudký vzestup krevního tlaku. Hodnoty systolického krevního tlaku se mohou pohybovat až k 250 – 300 mmHg a hodnoty diastolického tlaku jsou uváděny i kolem 200 – 220 mmHg [9]. Přitom bazální hodnota systolického krevního tlaku u pacienta s míšní lézí nad úrovní T6 je kvůli poruše sympatické kontroly pouze 90 – 110 mmHg [10]. Hypertenze je většinou doprovázena těžkou oboustrannou pulzující bolestí hlavy způsobenou pasivní cerebrální vazodilatací se zvýšeným cerebrálním průtokem. Dalším příznakem je bradykardie zapříčiněná zvýšenou aktivitou vagu zprostředkovanou baroreceptory v karotickém sinu a aortálním oblouku [7]. V některých případech ovšem byla pozorována naopak tachykardie. Důvodem může být to, že míšní reflexní oblouk, který vyvolá vazokonstrikci pod úrovní léze, zahrnuje také sympatická vlákna, jež zásobují srdce a zvyšují srdeční frekvenci. To může způsobit odlišnou reakci u pacientů s krční lézí na rozdíl od pacientů s horní hrudní lézí, kteří mají intaktní spojení mezi mozkem a sympatickými vlákny zásobujícími srdeční sval [9]. Parasympatikotonie má na svědomí rovněž vazodilataci nad úrovní léze s charakteristickými příznaky zarudnutí, profuzního pocení a kongescí sliznic. Stav bývá rovněž doprovázen úzkostí, malátností, nauzeou a zvýšenými spazmy [5,11].
Asymptomatická AD
V některých případech nemusí být zvýšení krevního tlaku doprovázeno dalšími příznaky AD. Tento stav je popisován jako tichá nebo asymptomatická AD. Byla zaznamenána u distenze močového měchýře a střeva, ale také během urodynamického vyšetření nebo vibrostimulace či elektroejakulace. Linsenmeyer et al sledovali 45 pacientů během urodynamického vyšetření a zaznamenali u 78 % příznaky AD. Nenašli žádný významný rozdíl mezi symptomatickou a asymptomatickou AD v hodnotách krevního tlaku, úrovni míšní léze, době od úrazu, intravezikálního tlaku a náplni močového měchýře [12]. Huang et al studovali přítomnost symptomatické a asymptomatické AD u 42 pacientů během urodynamického vyšetření. Asymptomatická AD, kterou zaznamenali v 50 % případů, byla spojena s významně nižšími hodnotami systolického tlaku a vyšším věkovým průměrem [13].
Příčiny
Stimuly vyvolávající AD mají zdroj nejčastěji v urogenitálním systému. Shergill et al pozorovali tuto souvislost v 81 – 87 % všech případů [14]. Jedná se především o distenzi močového měchýře způsobenou jeho přeplněním mezi intervaly intermitentní katetrizace nebo ucpáním či zalomením permanentního močového katétru. Dalšími urologickými příčinami může být infekce močových cest anebo diagnostické či operační urologické zákroky (cystoskopie, urodynamika). Muži trpící anejakulací podstupují procedury za účelem získání spermií k asistované reprodukci. Penilní vibrostimulace i rektální elektroejakulace jsou rizikové stran rozvoje AD. Příznaky se mohou nicméně projevit i při reflexní erekci a sexuálním styku [15]. U žen se může AD rozvinout v těhotenství a během porodu [16].
Druhou největší skupinou příčin AD jsou gastrointestinální potíže, převážně distenze rekta při nahromadění stolice. Může se také jednat o hemoroidy nebo fisury v oblasti anu. V neposlední řadě je třeba počítat s rizikem rozvoje AD při vyšetřeních, jako jsou kolonoskopie či rektosigmoideoskopie a při chirurgických zákrocích na břišních orgánech. AD může být rovněž způsobena apendicitidou, gastroezofageálním refluxem nebo vředovou chorobou gastroduodenální.
Další příčiny AD se týkají poruch v oblasti muskuloskeletárního systému. Patří sem zlomeniny, luxace, nestability a dále heterotopické osifikace, které se mohou rozvinout po poranění míchy v oblasti velkých končetinových kloubů pod úrovní léze. Dráždění však nemusí vycházet pouze z poranění nebo jiného patologického procesu pohybového aparátu. McGarry et al uvádějí tři případy přítomnosti AD při protažení dolních končetin během fyzioterapie [17]. Dalšími příčinami jsou kožní defekty při dekubitech, popáleninách nebo omrzlinách, ale může se takto projevit i pouhá námaha.
Komplikace
V některých případech může hypertenze dosáhnout extrémně vysokých hodnot. Systolický tlak 250 – 300 mmHg provází riziko orgánové dysfunkce, kardiovaskulárních změn a v krajním případě i riziko smrti. Během epizody AD může signifikantní zvýšení viscerální sympatické aktivity s konstrikcí koronárních arterií vyústit v myokardiální ischemii. Ho a Krassioukov publikovali v roce 2010 případ tetraplegika, u kterého se během nekontrolované AD objevily typické příznaky myokardiální ischemie s odezvou v EKG i laboratorních hodnotách, a to bez přítomné ischemické choroby srdeční v anamnéze [18].
Během hypertenzní krize se může rozvinout hypertenzní encefalopatie s neurologickými příznaky difuzního poškození mozku, jako jsou bolest hlavy, nauzea, zvracení, somnolence a kóma. Hypertenzní encefalopatie může vést k cerebrální hemoragii, speciálně u pacientů s predisponujícími faktory, jako je trombocytopenie. K cerebrální hemoragii dochází zřejmě v důsledku rychlého zvýšení hydrostatických sil, které podléhají autoregulačním mechanizmům průtoku mozku a způsobují roztržení krevních cév lokalizovaných v oblasti s předchozími patologickými změnami. Mortalita cerebrálního krvácení je vysoká, pohybuje se kolem 43 %. Vallès et al prezentovali v roce 2005 pacienta s neurologickou lézí v úrovni T4, u kterého se rozvinula AD po plastice ischiadického dekubitu v kombinaci s uroinfekcí. U pacienta se vyskytla porucha vědomí, následně provedená MR potvrdila podezření na hemoragické ložisko v levé okcipitální krajině. Nicméně po několika dnech došlo k úpravě neurologického stavu bez intervenčního chirurgického výkonu [19]. Eltorai et al popisují případ masivního mozkového krvácení s následkem smrti u pacienta s AD na podkladě distenze močového měchýře [20].
Nezvyklý průběh AD
Časná forma
Období míšního šoku je charakterizováno absencí volní a reflexní neurologické aktivity pod úrovní míšní léze včetně aktivity autonomní. Nicméně v literatuře se objevily dvě práce prezentující případy AD v době, kdy ještě nebyly přítomny šlachové reflexy. Silver popisuje čtyři případy časné AD zaznamenané při přeplnění močového měchýře nad 1 000 ml nebo traumatické katetrizaci. Jako pravděpodobnou příčinu uvádí aktivaci alfa‑adrenergních receptorů sympatiku v hrdle močového měchýře při zvýšené kapacitě močového měchýře kvůli areflexii detruzoru [21]. Krassioukov et al sledovali 53 pacientů v akutním stadiu po vzniku míšní léze nad 6. hrudním segmentem a zaznamenali výskyt AD v 5,7 % případů. Příčinou byla obstipace a distenze břišní stěny [22].
Maligní forma
Ve většině případů dochází po odstranění dráždivého stimulu působícího rozvoj AD k brzké stabilizaci krevního tlaku. Elliot a Krassioukov však prezentovali sérii tří případů protrahované těžké AD s tendencí ke zhoršení i po odstranění příčiny. Nazvali jí maligní AD. Vždy se jednalo o kombinaci zvlášť silných stimulů, a to ejakulace s iritací močového měchýře zánětem nebo cystolitiázou nebo s distenzí střeva. Ve všech třech případech byl systolický tlak zvýšený nad 220 mmHg a přetrvával nejméně týden. Po vyřešení urologických komplikací a nastavení preventivní antihypertenzivní medikace během sexuálního styku již k maligní formě AD nedocházelo [23].
Autonomní dysreflexie a boosting
Sympatická inervace srdce a většiny cév pro horní končetiny vychází ze segmentů T1 – T5. Cévy splanchniku a dolních končetin inervují sympatické neurony v segmentech T6 – L2. Proto u atletů po poranění míchy nad úrovní T6, resp. T1 nedochází k odpovídajícímu zvýšení srdeční frekvence a krevního tlaku během zátěže. To vede k horším výkonům a rychlejšímu vyčerpání [24]. Ztráta sympatické kardiální inervace vede k maximální tepové frekvenci mezi 110 a 130 pulzy za minutu. Snížená srdeční frekvence a minutový výdej jsou dále zhoršeny kvůli změně odpovědi katecholaminů na zátěž [25] a ztrátě svalové venózní pumpy na dolních končetinách. Tyto fyziologické limitace podněcují některé atlety s vysokou míšní lézí ke snaze kompenzovat stav indukcí AD působením bolesti nebo diskomfortu pod úrovní míšního poranění. Nejčastěji se jedná o zaštípnutí močového katétru vedoucí k distenzi močového měchýře, nadměrné utažení popruhů na nohou, přetočení nebo sezení na skrotu, tlak na palec nohy v těsné obuvi, břišní kompresi nebo kompresi dolních končetin. Toto úmyslné navození autonomní dysreflexie se nazývá boosting [26]. Způsobí dramatické zvýšení krevního tlaku, zvýšení vrcholu srdeční frekvence, zvýšení hladiny norepinefrinu, maximálního objemu O2, zlepšení prokrvení pracujících svalů a zlepšení výkonu.
Indukce AD však samozřejmě přináší významné riziko rozvoje závažných komplikací, a proto je v současné době paralympijským výborem z bezpečnostních důvodů zakázána [27].
Prevence AD
Preventivní opatření směřují ke snížení četnosti epizod a intenzity příznaků autonomní dysreflexie. Prevence AD vyvolané iritací přeplněného močového měchýře spočívá ve správně nastavené péči o dolní cesty močové a v pravidelném dlouhodobém sledování. Intermitentní katetrizace umožňuje pacientům plánovat vyprazdňování močového měchýře. V prvním měsíci po zahájení katetrizace je vhodné využít mikční deník a v závislosti na náplni močového měchýře upravit režim příjmu tekutin. U pacientů v režimu intermitentní katetrizace, kteří trpí hyperaktivitou detruzoru neodpovídající na farmakologickou léčbu, je terapeutickou efektivní volbou aplikace botulinumtoxinu do detruzoru. AD si může v případě opakujících se závažných komplikací vynutit chirurgické řešení. Volbou může být augmentace močového měchýře, která zvýšením kapacity a snížením intravezikálního tlaku redukuje podněty vedoucí k rozvoji AD [28]. U pacientů s rizikem rozvoje AD je vhodné provádět urologické procedury ve spinální anestezii. Subarachnoidálně nebo epidurálně aplikovaný meperidin blokuje nociceptivní impulzy z močového měchýře a předchází výskytu AD. Před celkovou anestezií je vhodné podat pacientům sublinguálně nifedipin 10 mg [29].
K prevenci rozvoje AD během anorektálních procedur je dobré aplikovat ve větším objemu lidokain gel. Efektivní je rovněž intersfinkterický anální blok lidokainem [30]. U žen s rizikem rozvoje AD je během porodu plně indikována a efektivní epidurální anestezie [31]. U mužů se v průběhu elektroejakulace snižuje riziko AD podáním nifedipinu [32].
Léčba
Nefarmakologická léčba
Léčebný postup při epizodě autonomní dysreflexie je zahájen změnou polohy pacienta do sedu či stoje s využitím výhody ortostatického snížení krevního tlaku. Dalším krokem je uvolnění pevných částí oblečení a kompresních pomůcek. Tento manévr umožní další přesun krevního poolu do dolní poloviny těla, ale může také snížit dráždění vyvolávající AD. Dále je třeba odhalit a eliminovat zdroj dráždění, kterým je nejčastěji přeplněný močový měchýř nebo rektum. Použití antihypertenzní medikace je indikováno, pokud i po provedení výše uvedených kroků přetrvává systolický tlak nad 150 mmHg [33]. Cílem je zmírnit příznaky a vyvarovat se komplikací spojených s nekontrolovanou hypertenzí.
Farmakologická léčba
Nifedipin (Cordipin) je blokátor kalciových kanálů, který selektivně inhibuje vstup kalciových iontů přes buněčnou membránu srdečního svalu a přes membránu hladkých svalů cév beze změn koncentrace sérového kalcia. Způsobuje snížení periferní vaskulární rezistence a mírné snížení systolického a diastolického tlaku (5 – 10 mmHg systolického), i když pokles krevního tlaku může být občas dramatický. Sublinguální absorpce je efektivní za 5 – 10 min a perorální užití za 45 až 60 min. Jedná se o nejčastěji užívané agens v léčbě AD [10,34].
Nitráty (nitroglycerin, isosorbid dinitrát) jsou rovněž používány při akutní epizodě AD kvůli schopnosti relaxace vaskulární hladké svaloviny s vazodilatačním účinkem na periferní arterie a vény [33]. Nitráty by se neměly podávat, pokud pacient užil v posledních 24 hod sildenafil [35].
Terazosin je dlouhodobě působící agens selektivně blokující alfa‑1 adrenoceptory. Selektivní alfa1 blokáda způsobuje relaxaci hladké svaloviny cév. Terazosin byl doporučen jako vhodná farmakologická léčba AD pro přidružený efekt na dolní močové cesty (alfa‑1 adrenoreceptory v oblasti hrdla a proximální uretry) [36].
Prazosin (Minipress) je selektivní antagonista alfa‑adrenergních receptorů, který redukuje celkovou periferní rezistenci spojenou se sympatickou aktivitou. Vyvolaná vazodilatace snižuje krevní tlak bez ovlivnění srdeční frekvence kromě mírné reflexní tachykardie při stoji [37]. V úvodu může způsobit hypotenzi a synkopu.
Captopril (Tensiomin) je specifický inhibitor angiotenzin I konvertujícího enzymu (ACE), blokuje renin‑angiotensin‑aldosteronový systém a způsobuje snížení periferní arteriální rezistence bez změny srdečního výdeje. Během akutní epizody AD se podává 25 mg sublinguálně [33].
Závěr
V České republice si každým rokem poraní míchu kolem 150 – 200 lidí. Spolu s neúrazovými míšními lézemi se jedná o téměř 300 pacientů ročně. Více než polovina z nich má poškození míchy v oblasti horní hrudní a krční páteře a může se u nich v poúrazovém období rozvinout syndrom AD. Během posledních 10 let se díky dobře fungujícímu spinálnímu programu zlepšila péče o spinální pacienty v prvních několika měsících po vzniku míšní léze včetně efektivního řešení syndromu AD. Po propuštění z rehabilitačního ústavu je však pacient předán do péče praktického lékaře a ambulantních specialistů. Zde vidíme prostor pro spolupráci a předávání zkušeností. V poslední době jsme zaznamenali u ambulantních pacientů závažné komplikace spojené s AD pramenící z neznalosti této problematiky. Proto jsme si dovolili vytvořit podle vzoru zahraničních kolegů kartu o příznacích a řešení syndromu AD, kterou by měli pacienti s tímto rizikem nosit neustále u sebe (obr. 2a, b). Souborný referát by měl poskytnout informace o této komplikaci široké zdravotnické veřejnosti.
Obr. 2a) Karta pro pacienty (přední strana). 
Obr. 2b) Karta pro pacienty (zadní strana). 
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 24. 4. 2013
Přijato do tisku: 4. 11. 2013
MUDr. Jiří Kříž, Ph.D.
Spinální jednotka při Klinice rehabilitace a tělovýchovného lékařství
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: jiri.kriz@fnmotol.cz
Zdroje
1. Alexander MS, Biering ‑ Sorensen F, Bodner D, Brackett NL, Cardenas D, Charlifue S et al. International standards to document remaining autonomic function after spinal cord injury. Spinal Cord 2009; 47(1): 36 – 43.
2. Bowlby A. On the Condition of the Reflexes in Cases of Injury to the Spinal Cord; with special reference to the Indications for Operative Interference. Med Chir Trans 1890; 73 : 313 – 325.
3. Guttmann L, Whitteridge D. Effects of bladder distension on autonomic mechanisms after spinal cord injuries. Brain 1948; 70(4): 361 – 404.
4. Curt A, Nitsche B, Rodic B, Schurch B, Dietz V. Assessment of autonomic dysreflexia in patients with spinal cord injury. J Neurol Neurosurg Psychiatry 1997; 62(5): 473 – 477.
5. Bycroft J, Shergill I, Choong E, Arya N, Shah P. Autonomic dysreflexia: a medical emergency. Postgrad Med J 2005; 81(954): 232 – 235.
6. Furusawa K, Tokuhiro A, Sugiyama H, Ikeda H, Tajima F, Genda E et al. Incidence of symptomatic autonomic dysreflexia varies according to the bowel and bladder management techniques in patients with spinal cord injury. Spinal Cord 2011; 49(1): 49 – 54.
7. Krassioukov AV, Karlsson AK, Wecht JM, Wuermser LA, Mathias CJ, Marino RJ et al. Assessment of autonomic dysfunction following spinal cord injury: rationale for additions to International Standards for Neurological Assessment. J Rehabil Res 2007; 44(1): 103 – 112.
8. Vaidyanathan S, Soni BM, Sett P, Watt JW, Oo T, Bingley J. Pathophysiology of autonomic dysreflexia: long‑term treatment with terazosin in adult and paediatric spinal cord injury patients manifesting recurrent dysreflexic episodes. Spinal Cord 1998; 36(11): 761 – 770.
9. Karlsson AK. Autonomic dysreflexia. Spinal Cord 1999; 37(6): 383 – 391.
10. Krhut J, Doležel J, Doležil D, Zachoval R, Ženíšek J. Neurourologie. 1. ed. Praha: Galén 2005 : 73 – 74.
11. Novotný T, Lukeš M, Bittner L, Heráček J, Urban M, Sobotka V et al. Urologické komplikace poranění míchy. Postgraduální medicína 2007; 9(9): 957 – 964.
12. Linsenmeyer TA, Campagnolo DI, Chou IH. Silent autonomic dysreflexia during voiding in men with spinal cord injuries. J Urol 1996; 155(2): 519 – 522.
13. Huang YH, Bih LI, Liao JM, Chen SL, Chou LW, Lin PH.Blood pressure and age associated with silent autonomic dysreflexia during urodynamic examinations in patients with spinal cord injury. Spinal Cord 2013; 51(5): 401 – 405.
14. Shergill IS, Arya M, Hamid R, Khastgir J, Patel HR, Shah PJ. The importance of autonomic dysreflexia to the urologist. BJU Int 2004; 93(7): 923 – 926.
15. Courtois F, Rodrigue X, Côté I, Boulet M, Vézina JG, Charvier K et al. Sexual function and autonomic dysreflexia in men with spinal cord injuries: how should we treat? Spinal Cord 2012; 50(12): 869 – 877.
16. Skowronski E, Hartman K. Obstetric management following traumatic tetraplegia: case series and literature review. Aust N Z J Obstet Gynaecol 2008; 48(5): 485 – 491.
17. McGarry J, Woolsey RM, Thompson CW. Autonomic hyperreflexia following passive stretching to the hip joint. Phys Ther 1982; 62(1): 30 – 31.
18. Ho CP, Krassioukov AV. Autonomic dysreflexia and myocardial ischemia. Spinal Cord 2010; 48(9): 714 – 715.
19. Vallès M, Benito J, Portell E, Vidal J. Cerebral hemorrhage due to autonomic dysreflexia in a spinal cord injury patient. Spinal Cord 2005; 43(12): 738 – 740.
20. Eltorai I, Kim R, Vulpe M, Kasravi H, Ho W. Fatal cerebral hemorrhage due to autonomic dysreflexia in a tetraplegic patient: case report and review. Paraplegia 1992; 30(5): 355 – 360.
21. Silver JR. Early autonomic dysreflexia. Spinal Cord 2000; 38(4): 229 – 233.
22. Krassioukov AV, Furlan JC, Fehlings MG. Autonomic dysreflexia in acute spinal cord injury: an under ‑ recognized clinical entity. J Neurotrauma 2003; 20(8): 707 – 716.
23. Elliott S, Krassioukov A. Malignant autonomic dysreflexia in spinal cord injured men. Spinal Cord 2006; 44(6): 386 – 392.
24. Mills PB, Krassioukov A. Autonomic function as a missing piece of the classification of Paralympic athletes with spinal cord injury. Spinal Cord 2011; 49 : 768 – 776.
25. Steinberg LL, Lauro FA, Sposito MM, Tufik S, Mello MT, Naffah ‑ Mazzacoratti MG et al. Catecholamine response to exercise in individuals with different levels of paraplegia. Braz J Med Biol Res 2000; 33(8): 913 – 918.
26. Burnham R, Wheeler G, Bhanbhani Y, Belanger M,Eriksson P, Steadward R. Intentional induction of autonomic dysreflexia among quadriplegic athletes for performance enhancement: efficacy, safety and mechanism of action. Clin J Sport Med 1994; 4 : 1 – 10.
27. International Paralympic Committee. Position statement on autonomic dysreflexia and boosting. Chapter 4.3 IPC Handbook. International Paralympic Committee, Bonn, Germany, 2010.
28. Krassioukov A, Warburton DE, Teasell R, Eng JJ, Spinal Cord Injury Rehabilitation Evidence Research Team. A systematic review of the management of autonomic dysreflexia after spinal cord injury. Arch Phys Med Rehabil 2009; 90(4): 682 – 695.
29. Vaidyanathan S, Soni B, Selmi F, Singh G, Esanu C,Hughes P et al. Are urological procedures in tetraplegic patients safely performed without anesthesia? A report of three cases. Patient Saf Surg 2012; 6 : 2 – 8.
30. Cosman BC, Vu TT. Lidocaine anal block limits autonomic dysreflexia during anorectal procedures in spinal cord injury: a randomized, double‑blind, placebo ‑ controlled trial. Dis Colon Rectum 2005; 48(8): 1556 – 1561.
31. Hughes SJ, Short DJ, Usherwood MM, Tebbutt H.Management of the pregnant woman with spinal cord injuries. Br J Obstet Gynaecol 1991; 98(6): 513 – 518.
32. Steinberger RE, Ohl DA, Bennett CJ, McCabe M, Wang SC. Nifedipine pretreatment for autonomic dysreflexia during electroejaculation. Urology 1990; 36(3): 228 – 231.
33. Consortium for Spinal Cord Medicine. Acute management of autonomic dysreflexia: individuals with spinal cord injury presenting to health ‑ care facilities. J Spinal Cord Med 2002; 25 (Suppl 1): S67–S88.
34. Thyberg M, Ertzgaard P, Gylling M, Granerus G. Effect of nifedipine on cystometry‑induced elevation of blood pressure in patients with a reflex urinary bladder after a high level spinal cord injury. Paraplegia 1994; 32(5): 308 – 313.
35. Ishikura F, Beppu S, Hamada T, Khandheria BK, Seward JB, Nehra A. Effects of sildenafil citrate (Viagra) combined with nitrate on the heart. Circulation 2000; 102(20): 2516 – 2521.
36. Vaidyanathan S, Soni BM, Sett P, Watt JW, Oo T, Bingley J. Pathophysiology of autonomic dysreflexia: long‑term treatment with terazosin in adult and paediatric spinal cord injury patients manifesting recurrent dysreflexic episodes. Spinal Cord 1998; 36(11): 761 – 770.
37. Krum H, Louis WJ, Brown DJ, Howes LG. A study of the alpha ‑ 1 adrenoceptor blocker prazosin in the prophylactic management of autonomic dysreflexia in high spinal cord injury patients. Clin Auton Res 1992; 2(2): 83 – 88.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek NeuromodulaceČlánek Cerebrální vazospazmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčbyČlánek Projekt ncRNAPainČlánek Webové okénkoČlánek Recenze knihyČlánek Recenze knihy
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2014 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Neuromodulace
- Alkoholový odvykací stav a delirium – od patofyziologie k léčbě
- Cerebrální vazospazmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčby
- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy
-
Komentář k článku autorek Ondrušová a Nováková
Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy - Porovnanie validity diagnostických kritérií sclerosis multiplex 2005 vs 2010 s aspektom včasnej diagnostiky
- Vývoj neurologického a funkčního obrazu po poranění míchy
- Projekt ncRNAPain
- Vztah mezi parametry transkraniální dopplerometrie a tkáňovou oxymetrií u pacientů s těžkým subarachnoidálním krvácením
- Posuzování gramatičnosti v Brocově afázii – příklad dvou pacientů
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Volumetrické vyhodnocení efektu následné onkologické léčby při inoperabilní progresi či reziduu nízkostupňového gliomu
- Ovlivnění funkce sluchové dráhy u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem
- REaDY – český registr svalových dystrofií
- Intoxikace metanolem v obraze magnetické rezonance – kazuistiky
- Krční epidurální absces – dvě kazuistiky
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Nemalinová myopatie asociovaná s monoklonální gamapatií – kazuistika
- Za MUDr. Luďkem Navrátilem, Ph.D
- Prof. MUDr. Jiří Tichý, DrSc. pětaosmdesátiletý
- Prof. MUDr. Josef Bednařík, CSc., slaví 60. narozeniny
- Webové okénko
- Recenze knihy
- Recenze knihy
-
Analýza dat v neurologii
XLIV. Grafy usnadňující studium zavádějících faktorů v asociačních studiích – II. Zdroj dat jako zavádějící faktor
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Neuromodulace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



