-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Alkoholový odvykací stav a delirium – od patofyziologie k léčbě
Alcohol Withdrawal Syndrome and Delirium – from its Pathophysiology to Treatment
Alcohol dependence leads to adaptations of the nervous system that leads to withdrawal syndrome manifestation when regular alcohol consumption is abruptly discontinued. Withdrawal syndrome is characterized mainly by excessive excitatory and diminished inhibitory mechanisms, mediated by glutamatergic and gaba-ergic systems. This imbalance leads to anxiety, restlessness, tremor and decreased seizure threshold. Furthermore, changes to dopaminergic, serotoninergic, noradrenergic, opioid system, or corticotropin releasing hormone-related activation of stress reaction contribute to the clinical picture that includes vegetative hyperactivity, affective changes, dysphoria, hypohedonia, etc. Delirium – a complication of severe withdrawal – is a significant clinical syndrome that complicates health care management and may lead to fatal outcomes. Treatment of alcohol withdrawal and delirium is based on gradual establishment of a new balance of excitatory and inhibitory systems without the presence of external inhibitory substance – alcohol. In clinical practice the pathophysiology is reflected in the administration of gaba-ergic compounds (benzodiazepines, clomethiazole) with gradual dose tapering. Complex effect of alcohol with a number of related somatic complications requires additional systematic somatic care.
Key words:
alcohol – withdrawal syndrome – delirium – neurotoxicity
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: T. Kašpárek; M. Dreisig; R. Barteček
Působiště autorů: Psychiatrická klinika LF MU a FN Brno
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(2): 153-157
Kategorie: Přehledný referát
Souhrn
Závislost na alkoholu se projevuje adaptací nervového systému, která vede při náhlém přerušení přísunu alkoholu k rozvoji odvykacího syndromu. Ten je charakterizován zejména excesivní glutamátergní excitační aktivitou a nedostatečnou aktivitou inhibičních mechanizmů, zprostředkovaných systémem kyseliny gama‑aminomáselné. Tato nerovnováha se projevuje anxietou, neklidem, tremorem, snížením záchvatového prahu. Další změny se týkají dopaminergního, serotoninergního, noradrenergního opioidního systému, aktivity kortikotropního hormonu, které se podílejí na klinickém obrazu odvykacího stavu, jenž zahrnuje vegetativní hyperaktivitu, změny emotivity, jako jsou dysforie, hypohedonie. Komplikací odvykacího stavu je delirium. Jde o závažný syndrom, který komplikuje zdravotnickou péči a sám o sobě může mít fatální následky. Léčba vychází z postupného nastolení rovnováhy mezi excitačními a inhibičními mechanizmy bez přítomnosti exogenní tlumící látky – alkoholu. To v praxi znamená podávání gabaergních preparátů (nejčastěji benzodiazepinů či klomethiazolu) s postupnou redukcí dávky v průběhu několika dní. Komplexní vliv alkoholu na organizmus s množstvím spojených komplikací současně vyžaduje systematickou somatickou péči.
Klíčová slova:
alkohol – odvykací stav – delirium – neurotoxicitaÚvod
Odvykací stav při závislosti na alkoholu se svými komplikacemi – deliriem a křečemi – je velmi častý klinický jev, s nímž se setkávají lékaři všech odborností. Jeho incidence je vysoká a u hospitalizovaných pacientů se odhaduje až na 40 % [1] či 60 % u specifických populací vyžadujících intenzivní péči [2]. V České republice existují zprávy o strmém nárůstu incidence deliria tremens v posledních letech [3]. Jde o stav, který komplikuje diagnostiku a léčbu za hospitalizace, sám o sobě je však potenciálně rizikový, zejména pro závažnost komplikací a z dlouhodobého hlediska pro eskalaci neurotoxických procesů. Cílem našeho přehledu je představit současné představy o patofyziologii tohoto klinického syndromu, ze které vyplývá jak klinický obraz, tak terapeutické intervence.
Mechanizmus účinku alkoholu
Působení alkoholu na organizmus je komplexní. Kromě jiného ovlivňuje tzv. systém odměny. Bezprostředně po požití nastává jeho aktivace, v dlouhodobém horizontu však mění jeho citlivost, resp. dochází k selektivnímu zaměření na stimuly spojené s alkoholem. Systém postupně nereaguje na přirozené stimuly z běžného života, nýbrž pouze na nadhraniční stimulaci psychoaktivním působením alkoholu [4,5]. Tento mechanizmus je odpovědný za rozvoj závislosti, za projevy bažení po psychoaktivní látce (odborně craving) a je v pozadí rizika relapsu i po dlouhých obdobích abstinence [6].
Chronické užívání alkoholu vede k adaptaci organizmu na pravidelný přísun inhibiční látky a k jeho neurotoxickému poškozování. Míra poškození organizmu je značně individuální, závisí na mnoha faktorech, jako jsou koncentrace a dávka požívaného alkoholu, délka expozice. Existuje individuální vulnerabilita vůči účinkům alkoholu, jejíž jednotlivé zdroje začínáme postupně odkrývat díky molekulárně genetickým přístupům.
Alkohol působí na glutamátové n ‑ metyl ‑ D ‑ aspartátové receptory (NMDA ‑ R). Při akutní intoxikaci dochází k jejich inhibici [7], při pravidelném užívání alkoholu dochází k up ‑ regulaci NMDA ‑ R [8], zvláště jeho 2A a 2B podjednotky, zejména v kortexu, hipokampu [9], což jsou kritické oblasti pro neurobiologii klinických komplikací abúzu alkoholu – křeče, delirium, kognitivní poruchy. Při odnětí alkoholu dochází u rozvinuté závislosti k projevům odvykacího stavu, který je charakteristický hyperaktivitou NMDA ‑ R, což se může manifestovat tremorem, anxietou, ataxiemi, epileptickými paroxyzmy [9]. Zvýšená aktivita NMDA ‑ R je také v pozadí neurotoxického poškozování nervové tkáně [10]. Jedním z mechanizmů je indukce hyperhomocysteinémie [11]. Opakování odvykacího stavu predisponuje k rozvoji odvykacích křečí [12]. Zábrana up ‑ regulaci NMDA ‑ R v animálním modelu vede k prevenci rozvoje epileptických paroxyzmů v odvykacím stavu [13]. Acamprosát, který působí redukci glutamátergní transmise, je preparát využívaný k léčbě závislosti na alkoholu [14].
Další transmiterový systém, do jehož funkce alkohol zasahuje, je kyselina gama‑aminomáselná (GABA). Při akutní intoxikaci je potencována GABA ‑ A funkce, při chronickém užívání dochází k down ‑ regulaci exprese alfa1 podjednotky [15], ke snížení efektu alkoholu na GABA receptory, což je v pozadí dalšího příznaku fyzické závislosti – tolerance [16]. Při odvykacím stavu dochází k nedostatečné GABA ‑ A funkci, což se může projevit anxietou, hyperexcitabilitou, křečemi [17]. Látky pozitivně ovlivňující GABA systém jsou účinné léky odvykacího stavu: benzodiazepiny, barbituráty, antikonvulziva.
Jsou ale ovlivňovány i další receptorové systémy: akutní intoxikace vede k zesílení dopaminergní aktivity neuronů přední tegmentální oblasti (VTA) [18], což způsobuje zvýšení výdeje dopaminu v mezolimbickém systému odměny a pozitivní posilování s rozvojem závislosti [19]. Při odvykacím stavu je přítomen hypodopaminergní stav [20], který se může manifestovat dysforií. Nejspíše v důsledku glutamátergní hyperaktivity je při odvykacím stavu přítomna i noradrenergní hyperaktivita [21]. Alkohol ovlivňuje i opioidní systém v mozku, chronický abúzus vede ke snížení exprese mi ‑ receptorů v mezolimbickém systému odměny, což se spolupodílí na snížení citlivosti systému na běžné libé stimuly [22,23]. Naltrexon je antagonista opioidních receptorů, snižuje tedy vliv alkoholu na systém odměny a tím snižuje požitek z konzumace alkoholu [24], stejně tak nově dostupný nalmefen [25]. To závislým pacientům umožňuje větší kontrolu nad konzumací alkoholu a rychlejší přerušení relapsu, když k němu dojde. I serotoninový systém je ovlivňován alkoholem. Akutní intoxikace vede ke zvýšené aktivitě 5HT1B, 2 a 3 receptorů [7] a ondansetron, který antagonistou 5HT3 receptorů byl účinný u mladých pacientů závislých na alkoholu [26]. Odvykací syndrom aktivuje stresovou reakci cestou zvýšené aktivity kortikotropinu [27]. Souhrn hlavních změn při akutní intoxikaci a v rámci odvykacího stavu ukazuje tab. 1.
Tab. 1. Přehled vlivu alkoholu na neurochemii mozku. 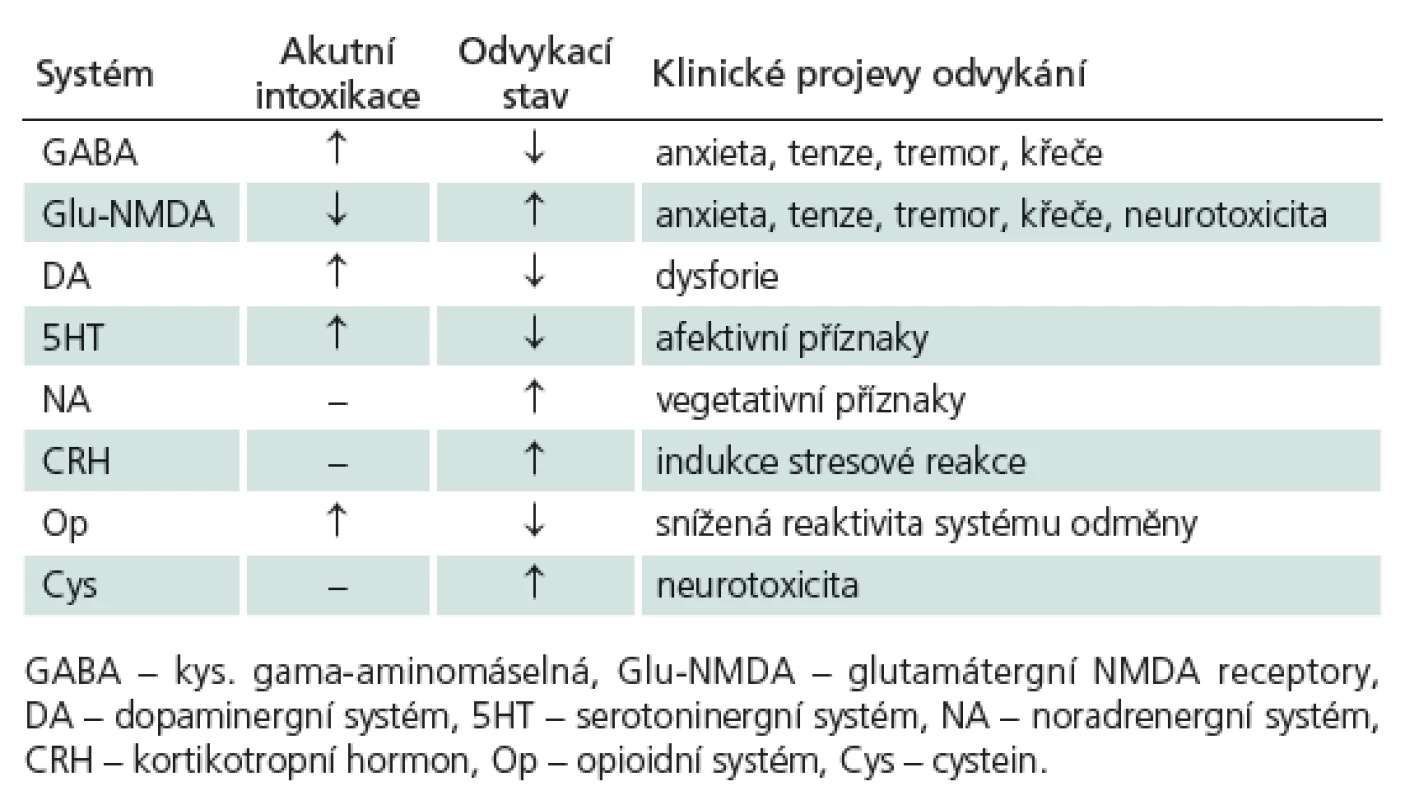
Odvykací stav při závislosti na alkoholu
V průběhu chronického abúzu alkoholu v podstatě dochází k nastavování nové rovnováhy mezi inhibičními a excitačními mechanizmy v mozku za opakované přítomnosti exogenního inhibičního alkoholu, tj. jsou posilovány excitační funkce. V případě náhlého vysazení exogenního inhibitoru dochází k přestřelení kompenzačních mechanizmů, jejichž klinickým projevem je odvykací syndrom. Principem detoxifikační léčby, tj. léčby odvykacího syndromu, je opětovné postupné nastavení rovnováhy mezi excitací a inhibicí bez přítomnosti alkoholu. Dochází k postupnému snížení excitačních mechanizmů, s doprovodným poklesem intenzity symptomů odvykacího stavu, až organizmus nevyžaduje exogenní inhibici. Zvládnutí odvykacího stavu, tj. úspěšná detoxifikační léčba tedy neznamená léčbu závislosti, ale umožní přerušit bludný kruh opakování abúzu alkoholu v důsledku rozvíjejících se abstinenčních příznaků. Po detoxifikační léčbě již člověk nemusí vyhledávat alkohol z důvodů projevů fyzické závislosti a má možnost pracovat na dlouhodobé léčbě závislosti, tj. zvládání jejích psychických příznaků.
Ne u každého člověka, který konzumuje pravidelně alkohol ve vysokých dávkách, se rozvine odvykací syndrom. Rizikovými faktory odvykacího stavu je množství konzumovaného alkoholu, míra adaptace organizmu a individuální vulnerabilita. Pro množství konzumovaného alkoholu je významná subjektivní odpověď na účinky alkoholu (level of response), která je značně variabilní, a nízká subjektivní odpověď je asociována s konzumací vysokých dávek alkoholu a rizikem odvykacího stavu [28,29]. Na individuální variabilitě konzumovaných dávek se podílí genetická variabilita enzymatického systému odbourávajícího alkohol [30]. A dále osobnostní charakteristiky – vysoká míra vyhledávání nového (novelty seeking) a impulzivita – jsou spojeny s výraznější konzumací alkoholu, rizikem cravingu a relapsu [31,32]. Adaptace organizmu závisí na adaptaci metabolizmu a rozvoji tolerance. Individuální variabilita k toxickému vlivu alkoholu odpovídá nejspíš neurobiologickým variantám, existují údaje o toleranci vysokých dávek s nezávažným odvykacím stavem, ale i o fenotypech tolerujících malé dávky alkoholu s výraznými odvykacími symptomy [33,34].
Klinický obraz
Odvykací stav je tedy projev fyzické závislosti na alkoholu. Jeho komplikace – epileptické paroxyzmy a delirium – jsou potenciálně fatální klinický stav [35,36]. Nejvýraznější příznaky jsou patrny v prvním týdnu od náhlého vysazení či prudkého snížení dávek alkoholu [37], některé příznaky však mohou přetrvávat měsíce a mohou být příčinou časného relapsu abúzu [38] – jde zejména o nespavost, pocity poklesu energie, změny nálad, jako již zmíněná dysforie při hypodopaminergním stavu [39]. Závažnost odvykacího stavu je také individuálně variabilní a znalost rizikových faktorů jeho komplikací je klinicky žádoucí.
Rozvíjí se typicky 4 – 12 hod po vysazení alkoholu. V klinice je patrný tremor (rukou, víček, jazyka, celého těla), pocení (často profuzní), nauzea a zvracení, cefalea, známky vegetativní hyperaktivity, jako jsou tachykardie, hypertenze, může být zvýšená citlivost vůči zvukům, světlu, mohou se objevovat různé distorze vnímání, které pak vyžadují blízké monitorování pro riziko přechodu v delirium.
Léčba
Odvykací stav odezní po požití alkoholu nebo podání tlumivých látek. V klinické praxi se nejčastěji podávají benzodiazepiny (vzhledem ke „zkřížené“ toleranci s alkoholem je nutné podávat vysoké dávky, které je třeba upravovat dle klinického účinku – doporučuje se lehká sedace – a možnosti kumulace u dlouhodobých preparátů) v postupně klesající dávce během několika dní [40]. Při podávání benzodiazepinů je nutné myslet na riziko útlumu dechového centra, které hrozí zvláště v případě kumulace dávky při opakovaném podávání vysokých dávek dlouhodobých preparátů u pacientů s hepatopatií. Z tohoto hlediska je výhodnější preparát klomethiazol (Heminevrin) [41,42], jenž má kratší vylučovací poločas, nemetabolizuje se játry, a nehrozí tedy tolik komplikace díky kumulaci dávky. I při podávání klomethiazolu je však riziko útlumu respirace, a je proto nutné pacienta důsledně monitorovat a upravovat dávkování dle klinického efektu. V případě nezvladatelného odvykacího stavu jsou alternativou barbituráty [43] či celková anestezie s umělou plicní ventilací a postupným odtlumováním. V této indikaci byla též zkoušena antikonvulziva s problematickým efektem – pozitivní zprávy jsou v případě valproátu [44], jistá evidence existuje i pro účinnost karbamazepinu, zvláště pokud je rychle titrován do dávek 800 mg/ den [45,46], žádný efekt nebyl pozorován u oxcarbazepinu, levetiracetamu.
Kauzální léčba odvykacího stavu je podávání látky, které tlumí glutamátergní hyperaktivitu a zvyšují aktivitu GABA ‑ ergní. Z tohoto hlediska je podávání antipsychotik (tiaprid, haloperidol) ke zvládání odvykacího stavu pouze symptomatická léčba, event. léčba psychomotorického neklidu, který odvykací syndrom někdy doprovází – a navíc symptomatická léčba riziková [40]. Antipsychotika nevedou k úpravě dysbalance excitačních a inhibičních mechanizmů, navíc vzhledem ke svému proepileptogennímu účinku také zvyšují riziko rozvoje odvykacích křečí, některá též přispívají ke kardiotoxickému účinku vegetativní hyperaktivity či nestability u závažnějších stavů, vše v terénu možné alkoholové myokardiopatie.
Delirium
Klinický obraz a diferenciální diagnostika
Delirium patří mezi přechodné kognitivní poruchy. Mezi „jádrové příznaky“ náleží kvalitativní porucha vědomí s poruchou pozornosti a rychlý rozvoj s fluktuujícím průběhem. Další příznaky mohou zahrnovat změny psychomotoriky (agitovanost i ztlum), poruchy vnímání (iluze či halucinace, typicky popisované mikrozoopsie, tj. vizuální halucinace malých zvířat), dezorganizace myšlení, nesystemizované prchavé bludy (které však mohou přetrvávat i v lucidních obdobích), poruchy spánku (s typickou inverzí, tj. denní spavost a noční hypervigilita s neklidem), poruchy emocí (jak plochost emoční reaktivity, tak iritabilita, anxieta…) [47].
V diferenciální diagnostice je nutné uvažovat o dalších příčinách deliria – v nemocničním prostředí se rozvíjí velmi často v kontextu somatické morbidity, a je tedy nutné zvažovat podíl somatické poruchy na rozvoji deliria. Dále se delirium vyskytuje v rámci akutní intoxikace psychoaktivními látkami (typicky u anticholinergik, dopaminergik), za již zmíněného odvykacího stavu (nejen u závislosti na alkoholu, ale i u hypnotik, sedativ), typická je kombinace příčin. V anamnéze proto pátráme po pravidelném abúzu psychoaktivních látek, po rizikové medikaci, po závažných somatických nemocech a po přítomnosti premorbidní kognitivní poruchy.
Klinické vyšetření
U deliria v rámci odvykacího stavu při závislosti na alkoholu typicky nacházíme další příznaky odvykacího stavu, jak bylo popsáno výše, v diagnostice dále pomáhá typický časový rozvoj potíží v návaznosti na vysazení alkoholu či inhibičního preparátu. Často musíme sahat k heteroanamnestickým údajům od blízkého okolí pacienta, neboť výtěžnost anamnestického rozhovoru s delirantním pacientem je mnohdy značně limitována. Stav pozornosti vyšetříme klinicky „sedmičkovým testem“, tj. žádáme pacienta, aby postupně odečítal číslo 7 od 100 a říkal jen výsledky. Stav orientace vyšetříme dotazy na to, zda pacient ví, kde je, proč tu je, zda rozpoznává situaci a okolnosti, zda zná časové okolnosti a zná své osobní údaje. Paměť je možné vyšetřit pomocí testu tří slov – bezprostřední a oddálené vybavení tří slov. Poruchy vnímání někdy pacienti sdělují spontánně, jindy je možné zjistit přítomnost vizuálních iluzí či halucinací tzv. testem čtení z prázdného listu, kdy se pacientovi předloží prázdná čtvrtka a je vyzván, aby přečetl, co je tam napsáno. Stejně tak poruchy myšlení charakteru bludů, nejčastěji paranoidně‑perzekučních, pacienti často spontánně verbalizují či se pod jejich vlivem chovají (snaha utéct z nemocnice, opustit lůžko, vytrhnout si katétr v domněnce úmyslného poškozování pacienta atd.). Kvalitativní porucha vědomí se manifestuje tím, že pacient nerozpoznává reálnou situaci a žije i reaguje v neskutečné komplexní realitě (např. se domnívá, že jej navštěvuje známý u něj doma, a podle toho se chová…).
Léčba
Léčba deliria se neliší od léčby odvykacího syndromu, tj. jsou podávány v sestupném dávkování benzodiazepiny či klomethiazol – za současné léčby somatické komorbidity [40].
I u deliria, které se rozvíjí čistě v rámci odvykacího stavu, existuje značná somatická morbidita (pro review) [48], jež může být příčinou komplikací i fatálních průběhů. Práce z 50. let uváděly až 15% mortalitu, novější zdroje dokládají mortalitu v rozmezí 0 – 7 % [36], na čemž se signifikantně podílí adekvátní klinický management – mortalitu výrazně snižuje sedativní medikace, zejména benzodiazepiny [40]. Naopak při podávání antipsychotik (klasických neuroleptik) dochází k signifikantnímu zvýšení mortality – při jejich podávání roste oproti podávání sedativní medikace relativní riziko až k hodnotě 7 [40,49]. Použití antipsychotik je tedy vyhrazeno zvládání agresivity, a to jen pro dobu nezbytně nutnou. Management pacienta v deliriu tudíž zahrnuje komplexní somatickou a ošetřovatelskou péči. Je nutné korigovat často rozvrácené vnitřní prostředí, mineralogram, vodní hospodářství, dekompenzaci hepatálních, renálních, kardiálních onemocnění, zvládat vegetativní hyperaktivitu či instabilitu, kompenzovat chronické deficity thiaminu, cyankobalaminu. V prevenci negativních důsledků zvýšení hladin amoniaku v krvi je vhodné podávat laxativa (lactulóza), která usnadní detoxifikaci střeva, je nutná preventivní zábrana epileptiformních křečí. Delirium často vede k imobilizaci pacienta, terapeutickému omezení, což vyžaduje jednak intenzivní ošetřovatelskou péči, jednak prevenci komplikací imobilizace, jako jsou trombembolizmus, proleženiny atd. V neposlední řadě je pro psychomotorický neklid obtížná lékařská i ošetřovatelská péče, a i proto hrozí komplikované průběhy somatické morbidity.
Prognóza deliria obecně závisí na premorbidním stavu organizmu, na premorbidním stavu kognice a závažnosti vyvolávající příčiny. Častá je restituce premorbidního stavu, ale jak již bylo opakovaně uvedeno, hrozí jednak somatická morbidita s možným fatálním průběhem, jednak dlouhodobá porucha kognitivních funkcí až plný rozvoj demence. Příčinou je právě neurotoxický charakter odvykacího stavu a deliria.
Neurotoxicita
Neurotoxické poškození je projev kombinovaného působení alkoholu, karencí a neurotoxického vlivu odvykacích syndromů. V animálním modelu vede odvykací stav k redukci neuropilu i neuronů [50]. V humánních post mortem studiích je patrná atrofie mozku, redukce neuronů v kortikálních a limbických oblastech [51] – tj. v oblastech, ve kterých dochází ke změnám NMDA ‑ R – viz výše. Redukce se týká zejména pyramidových neuronů [52], výrazně je však postižena též bílá hmota [52]. Zobrazovací studie ukazují redukce FT oblastí, rozšíření komor a sulků [53 – 55]. Nález změn mozku je spojen s křečemi, nutriční karencí a hepatopatií [56,57]. Zdá se ovšem, že změny mohou být reverzibilní – při abstinenci dochází ke zvýšení objemu šedé hmoty, zmenšení komor i sulků [58,59]. V tomto ohledu je nadějný osud pacientů s kognitivní dysfunkcí způsobenou abúzem alkoholu: je důsledkem chronického abúzu a opakovaných odvykacích stavů [60]. Otázkou však zůstává jeho reverzibilita či zda jde o trvalé reziduální změny vedoucí k alkoholové demenci, Korsakovskému syndromu anebo Wernickeově encefalopatii [61,62].
Závěr
Znalost patofyziologie odvykacího stavu a deliria umožňuje nejen adekvátní léčbu, která vede k úspěšnému zvládání těchto obtížných klinických jednotek, ale také k porozumění negativním důsledkům nedostatečného zvládání těchto stavů, tj. poškozování mozku, zejména oblastí kritických pro kognici, s klinickým odrazem v podobě kognitivní poruchy až plně vyvinuté demence.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 3. 5. 2013
Přijato do tisku: 11. 12. 2013
doc. MUDr. Tomáš Kašpárek, Ph.D.
Psychiatrická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: tkasparek@fnbrno.cz
Zdroje
1. de Wit M, Jones DG, Sessler CN, Zilberberg MD, Weaver MF. Alcohol ‑ use disorders in the critically ill patient. Chest 2010; 138(4): 994 – 1003.
2. O‘Regan NA, Fitzgerald J, Timmons S, O‘Connell H, Meagher D. Delirium: a key challenge for perioperative care. Int J Surg 2013; 11(2): 136 – 144.
3. Csemy L, Nespor K, Brozova J. Delirium tremens v České republice: strmý vzestup. Casopis lekaru ceskych 2007; 146(1): 82 – 83.
4. Wrase J, Schlagenhauf F, Kienast T, Wustenberg T, Bermpohl F, Kahnt T et al. Dysfunction of reward processing correlates with alcohol craving in detoxified alcoholics. Neuroimage 2007; 35(2): 787 – 794.
5. de Greck M, Supady A, Thiemann R, Tempelmann C,Bogerts B, Forschner L et al. Decreased neural activity in reward circuitry during personal reference in abstinent alcoholics – a fMRI study. Hum Brain Mapp 2009; 30(5): 1691 – 1704.
6. Heinz A, Beck A, Grüsser SM, Grace AA, Wrase J. Identifying the neural circuitry of alcohol craving and relapse vulnerability. Addict Biol 2009; 14(1): 108 – 118.
7. Grant KA, Lovinger DM. Cellular and behavioral neurobiology of alcohol: receptor ‑ mediated neuronal processes. Clin Neurosci 1995; 3(3): 155 – 164.
8. Snell LD, Nunley KR, Lickteig RL, Browning MD, Tabakoff B, Hoffman PL. Regional and subunit specific changes in NMDA receptor mRNA and immunoreactivity in mouse brain following chronic ethanol ingestion. Brain Res Mol Brain Res 1996; 40(1): 71 – 78.
9. Gulya K, Grant KA, Valverius P, Hoffman PL, Tabakoff B. Brain regional specificity and time ‑ course of changes in the NMDA receptor ‑ ionophore complex during ethanol withdrawal. Brain Res 1991; 547(1): 129 – 134.
10. Tsai G, Gastfriend DR, Coyle JT. The glutamatergic basis of human alcoholism. Am J Psychiatry 1995; 152(3): 332 – 340.
11. Bleich S, Degner D, Sperling W, Bonsch D, Thurauf N, Kornhuber J. Homocysteine as a neurotoxin in chronic alcoholism. Prog Neuropsychopharmacol Biol Psychiatry 2004; 28(3): 453 – 464.
12. Brown ME, Anton RF, Malcolm R, Ballenger JC. Alcohol detoxification and withdrawal seizures: clinical support for a kindling hypothesis. Biol Psychiatry 1988; 23(5): 507 – 514.
13. Snell LD, Szabo G, Tabakoff B, Hoffman PL. Gangliosides reduce the development of ethanol dependence without affecting ethanol tolerance. J Pharmacol Exp Ther 1996; 279(1): 128 – 136.
14. Zeise ML, Kasparov S, Capogna M, Zieglgansberger W. Acamprosate (calciumacetylhomotaurinate) decreases postsynaptic potentials in the rat neocortex: possible involvement of excitatory amino acid receptors. Eur J Pharmacol 1993; 231(1): 47 – 52.
15. Montpied P, Morrow AL, Karanian JW, Ginns EI, Martin BM, Paul SM. Prolonged ethanol inhalation decreases gamma ‑ aminobutyric acidA receptor alpha subunit mRNAs in the rat cerebral cortex. Mol Pharmacol 1991; 39(2): 157 – 163.
16. Allan AM, Harris RA. Acute and chronic ethanol treatments alter GABA receptor ‑ operated chloride channels. Pharmacol Biochem Behav 1987; 27(4): 665 – 670.
17. Hemmingsen R, Braestrup C, Nielsen M, Barry DI. The benzodiazepine/ GABA receptor complex during severe ethanol intoxication and withdrawal in the rat. Acta Psychiatr Scand 1982; 65(2): 120 – 126.
18. Brodie MS, Shefner SA, Dunwiddie TV. Ethanol increases the firing rate of dopamine neurons of the rat ventral tegmental area in vitro. Brain Res 1990; 508(1): 65 – 69.
19. Imperato A, Di Chiara G. Preferential stimulation of dopamine release in the nucleus accumbens of freely moving rats by ethanol. J Pharmacol Exp Ther 1986; 239(1): 219 – 228.
20. Weiss F, Parsons LH, Schulteis G, Hyytia P, Lorang MT,Bloom FE et al. Ethanol self ‑ administration restores withdrawal‑associated deficiencies in accumbal dopamine and 5 - hydroxytryptamine release in dependent rats. J Neurosci 1996; 16(10): 3474 – 3485.
21. Nutt D, Glue P, Molyneux S, Clark E. Alpha ‑ 2‑adrenoceptor function in alcohol withdrawal: a pilot study of the effects of iv. clonidine in alcoholics and normals. Alcohol Clin Exp Res 1988; 12(1): 14 – 18.
22. Tabakoff B, Hoffman PL. Alcohol interactions with brain opiate receptors. Life Sci 1983; 32(3): 197 – 204.
23. Tabakoff B, Urwyler S, Hoffman PL. Ethanol alters kinetic characteristics and function of striatal morphine receptors. J Neurochem 1981; 37(2): 518 – 521.
24. O‘Malley SS, Jaffe AJ, Chang G, Rode S, Schottenfeld R, Meyer RE et al. Six ‑ month follow‑up of naltrexone and psychotherapy for alcohol dependence. Arch Gen Psychiatry 1996; 53(3): 217 – 224.
25. Mann K, Bladström A, Torup L, Gual A, van den Brink W. Extending the treatment options in alcohol dependence: a randomized controlled study of as ‑ needed nalmefene. Biol Psychiatry 2013; 73(8): 706 – 713.
26. Johnson BA, Roache JD, Javors MA, DiClemente CC,Cloninger CR, Prihoda TJ et al. Ondansetron for reduction of drinking among biologically predisposed alcoholic patients: A randomized controlled trial. JAMA 2000; 284(8): 963 – 971.
27. Merlo Pich E, Lorang M, Yeganeh M, Rodriguez de Fonseca F, Raber J, Koob GF et al. Increase of extracellular corticotropin‑releasing factor‑like immunoreactivity levels in the amygdala of awake rats during restraint stress and ethanol withdrawal as measured by microdialysis. J Neurosci 1995; 15(8): 5439 – 5447.
28. Schuckit MA, Smith TL, Tipp JE. The Self ‑ Rating of the Effects of alcohol (SRE) form as a retrospective measure of the risk for alcoholism. Addiction 1997; 92(8): 979 – 988.
29. Schuckit MA, Smith TL, Kalmijn J. The search for genes contributing to the low level of response to alcohol: patterns of findings across studies. Alcohol Clin Exp Res 2004; 28(10): 1449 – 1458.
30. Li TK, Bosron WF. Genetic variability of enzymes of alcohol metabolism in human beings. Ann Emerg Med 1986; 15(9): 997 – 1004.
31. Evren C, Durkaya M, Evren B, Dalbudak E, Cetin R.Relationship of relapse with impulsivity, novelty seeking and craving in male alcohol ‑ dependent inpatients. Drug Alcohol Rev 2012; 31(1): 81 – 90.
32. Tomassini A, Struglia F, Spaziani D, Pacifico R, Stratta P, Rossi A. Decision making, impulsivity, and personality traits in alcohol ‑ dependent subjects. Am J Addict 2012; 21(3): 263 – 267.
33. Metten P, Belknap JK, Crabbe JC. Drug withdrawal convulsions and susceptibility to convulsants after short‑term selective breeding for acute ethanol withdrawal. Behav Brain Res 1998; 95(1): 113 – 122.
34. Metten P, Phillips TJ, Crabbe JC, Tarantino LM, McClearn GE, Plomin R et al. High genetic susceptibility to ethanol withdrawal predicts low ethanol consumption. Mamm Genome 1998; 9(12): 983 – 990.
35. Khan A, Levy P, DeHorn S, Miller W, Compton S. Predictors of mortality in patients with delirium tremens. Acad Emerg Med 2008; 15(8): 788 – 790.
36. Monte R, Rabunal R, Casariego E, López ‑ Agreda H, Mateos A, Pértega S. Analysis of the factors determining survival of alcoholic withdrawal syndrome patients in a general hospital. Alcohol Alcohol 2010; 45(2): 151 – 158.
37. Foy A, Kay J, Taylor A. The course of alcohol withdrawal in a general hospital. QJM 1997; 90(4): 253 – 261.
38. Simioni N, Cottencin O, Guardia D, Rolland B. Early relapse in alcohol dependence may result from late withdrawal symptoms. Med Hypotheses 2012; 79(6): 894 – 895.
39. De Soto CB, O‘Donnell WE, Allred LJ, Lopes CE. Symptomatology in alcoholics at various stages of abstinence. Alcohol Clin Exp Res 1985; 9(6): 505 – 512.
40. Mayo ‑ Smith MF, Beecher LH, Fischer TL, Gorelick DA,Guillaume JL, Hill A et al. Management of alcohol withdrawal delirium. An evidence‑based practice guideline. Arch Intern Med 2004; 164(13): 1405 – 1412.
41. Nimmerrichter AA, Walter H, Gutierrez ‑ Lobos KE,Lesch OM. Double‑blind controlled trial of gamma ‑ hydroxybutyrate and clomethiazole in the treatment of alcohol withdrawal. Alcohol Alcohol 2002; 37(1): 67 – 73.
42. de Millas W, Ganzer F, Kuhn S, Haasen C. Oxazepam versus clomethiazol in alcohol withdrawal treatment. Eur Addict Res 2010; 16(4): 179 – 184.
43. Rosenson J, Clements C, Simon B, Vieaux J, Graffman S, Vahidnia F et al. Phenobarbital for acute alcohol withdrawal: a prospective randomized double‑blind placebo ‑ controlled study. J Emerg Med 2013; 44(3): 592 – 598.
44. Reoux JP, Saxon AJ, Malte CA, Baer JS, Sloan KL. Divalproex sodium in alcohol withdrawal: a randomized double‑blind placebo ‑ controlled clinical trial. Alcohol Clin Exp Res 2001; 25(9): 1324 – 1329.
45. Minozzi S, Amato L, Vecchi S, Davoli M. Anticonvulsants for alcohol withdrawal. Cochrane Database Syst Rev 2010; (3): CD005064.
46. Barrons R, Roberts N. The role of carbamazepine and oxcarbazepine in alcohol withdrawal syndrome. J Clin Pharm Ther 2010; 35(2): 153 – 167.
47. Carlson RW, Kumar NN, Wong‑Mckinstry E, Ayyagari S, Puri N, Jackson FK et al. Alcohol withdrawal syndrome. Crit Care Clin 2012; 28(4): 549 – 585.
48. Dreisig M, Kašpárek T. Komplikace odvykacího stavu při závislosti na alkoholu – diagnostika a léčba. Psychiatrie pro praxi 2013; 14(1): 18 – 20.
49. Nespor K. Antipsychotika u deliria tremens znamenají nepřiměřené riziko. Česká a slovenská psychiatrie 2005; 101(4): 230 – 231.
50. Cadete ‑ Leite A, Alves MC, Paula ‑ Barbosa MM, Uylings HB, Tavares MA. Quantitative analysis of basal dendrites of prefrontal pyramidal cells after chronic alcohol consumption and withdrawal in the adult rat. Alcohol Alcohol 1990; 25(5): 467 – 475.
51. Harper C. The neuropathology of alcohol ‑ specific brain damage, or does alcohol damage the brain? J Neuropathol Exp Neurol 1998; 57(2): 101 – 110.
52. Kril JJ, Halliday GM, Svoboda MD, Cartwright H. The cerebral cortex is damaged in chronic alcoholics. Neuroscience 1997; 79(4): 983 – 998.
53. Jernigan TL, Butters N, DiTraglia G, Schafer K, Smith T, Irwin M et al. Reduced cerebral grey matter observed in alcoholics using magnetic resonance imaging. Alcohol Clin Exp Res 1991; 15(3): 418 – 427.
54. Pfefferbaum A, Sullivan EV, Mathalon DH, Lim KO.Frontal lobe volume loss observed with magnetic resonance imaging in older chronic alcoholics. Alcohol Clin Exp Res 1997; 21(3): 521 – 529.
55. Pfefferbaum A, Sullivan EV, Rosenbloom MJ, Mathalon DH, Lim KO. A controlled study of cortical gray matter and ventricular changes in alcoholic men over a 5‑year interval. Arch Gen Psychiatry 1998; 55(10): 905 – 912.
56. Barthauer L, Tarter R, Hirsch W, Van Thiel D. Brain morphologic characteristics of cirrhotic alcoholics and cirrhotic nonalcoholics: an MRI study. Alcohol Clin Exp Res 1992; 16(5): 982 – 985.
57. Sullivan EV, Marsh L, Mathalon DH, Lim KO, Pfefferbaum A. Relationship between alcohol withdrawal seizures and temporal lobe white matter volume deficits. Alcohol Clin Exp Res 1996; 20(2): 348 – 354.
58. Pfefferbaum A, Sullivan EV, Mathalon DH, Shear PK,Rosenbloom MJ, Lim KO. Longitudinal changes in magnetic resonance imaging brain volumes in abstinent and relapsed alcoholics. Alcohol Clin Exp Res 1995; 19(5): 1177 – 1191.
59. Gazdzinski S, Durazzo TC, Meyerhoff DJ. Temporal dynamics and determinants of whole brain tissue volume changes during recovery from alcohol dependence. Drug Alcohol Depend 2005; 78(3): 263 – 273.
60. Duka T, Townshend JM, Collier K, Stephens DN. Impairment in cognitive functions after multiple detoxifications in alcoholic inpatients. Alcohol Clin Exp Res 2003; 27(10): 1563 – 1572.
61. Jenkins RL, Parsons OA. Recovery of cognitive abilities in male alcoholics. Curr Alcohol 1979; 7 : 229 – 237.
62. Smith DM, Atkinson RM. Alcoholism and dementia. Int J Addict 1995; 30(13 – 14): 1843 – 1869.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek NeuromodulaceČlánek Projekt ncRNAPainČlánek Webové okénkoČlánek Recenze knihyČlánek Recenze knihy
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2014 Číslo 2- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Neuromodulace
- Alkoholový odvykací stav a delirium – od patofyziologie k léčbě
- Cerebrální vazospazmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčby
- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy
-
Komentář k článku autorek Ondrušová a Nováková
Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy - Porovnanie validity diagnostických kritérií sclerosis multiplex 2005 vs 2010 s aspektom včasnej diagnostiky
- Vývoj neurologického a funkčního obrazu po poranění míchy
- Projekt ncRNAPain
- Vztah mezi parametry transkraniální dopplerometrie a tkáňovou oxymetrií u pacientů s těžkým subarachnoidálním krvácením
- Posuzování gramatičnosti v Brocově afázii – příklad dvou pacientů
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Volumetrické vyhodnocení efektu následné onkologické léčby při inoperabilní progresi či reziduu nízkostupňového gliomu
- Ovlivnění funkce sluchové dráhy u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem
- REaDY – český registr svalových dystrofií
- Intoxikace metanolem v obraze magnetické rezonance – kazuistiky
- Krční epidurální absces – dvě kazuistiky
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Nemalinová myopatie asociovaná s monoklonální gamapatií – kazuistika
- Za MUDr. Luďkem Navrátilem, Ph.D
- Prof. MUDr. Jiří Tichý, DrSc. pětaosmdesátiletý
- Prof. MUDr. Josef Bednařík, CSc., slaví 60. narozeniny
- Webové okénko
- Recenze knihy
- Recenze knihy
-
Analýza dat v neurologii
XLIV. Grafy usnadňující studium zavádějících faktorů v asociačních studiích – II. Zdroj dat jako zavádějící faktor
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Neuromodulace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



