-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pankreatické cystické léze u pacientů po transplantaci jater
Pancreatic cystic lesions in liver transplant recipients
Background:
Pancreatic cystic lesions (PCLs) are common in the general population and their prevalence increases with age. Pancreatic cystic neoplasia accounts for more than half of all pancreatic cysts. Some of them have malignant potential. Solid organ transplant recipients have an elevated cancer risk due to immunosuppression. The natural course of PCL in solid organ transplant recipients is unknown.Aim and Methods:
The purpose of this study was to investigate the prevalence and course of incidental PCL in liver transplant recipients. We performed a retrospective analysis of imaging findings and medical records of all adult patients who underwent liver transplantation in the Institute for Clinical and Experimental Medicine in Prague between September 1996 and November 2014.Results:
In total, 967 orthotopic liver transplantations were performed in the study period in 578 males and 389 females (mean age 51 ± 11.7). PCLs were found in 60 patients (6.2%; 26 males, 34 females; mean age 61 ± 8.9), 29 of whom had PCLs before transplantation. The median size of the detected PCLs was 10 mm (range 5–85 mm). PCLs were located in the head (35%), body (33%) and tail (15%) of the pancreas, and 17% of patients had multifocal PCL. Two or more PCLs were present in 20 patients (33%). Mean follow-up duration was 37.5 months (range 6–194). In 10 patients (17%), the size of the lesion increased (mean + 4 mm); however, progression was clinically relevant in none of the patients. Patients with PCLs were significantly older (p < 0.001), more likely to be women (p < 0.05), and were more often transplanted for primary biliary cirrhosis (p < 0.05) and α1-antitrypsin deficiency (p < 0.05). No patient died from PCL during follow-up. There was no significant difference in the survival of patients with and without PCL.Conclusion:
PCLs are as frequent in liver transplant recipients as in the general population. Their presence was associated with higher age, female sex, and type of liver disease, but not with patient survival.Key words:
pancreatic cyst – liver transplantation – immunosuppression
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
8. 7. 2016Accepted:
1. 8. 2016
Autoři: P. Mačinga 1; D. Cupalová 2; D. Kautznerová 2; J. Froněk 3; P. Trunečka 4; J. Špičák 1; T. Hucl 1
Působiště autorů: Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 1; Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha 2; Klinika transplantační chirurgie, Transplantcentrum, IKEM, Praha 3; Transplantcentrum, IKEM, Praha 4
Vyšlo v časopise: Gastroent Hepatol 2016; 70(4): 295-299
Kategorie: Klinická a experimentální gastroenterologie: původní práce
doi: https://doi.org/10.14735/amgh2016295Souhrn
Úvod:
Pankreatické cystické léze (PCL) jsou častým nálezem v obecné populaci s narůstající prevalencí s věkem. Pankreatické cystické neoplazie reprezentují více než 50 % všech diagnostikovaných PCL. Pacienti po transplantaci solidních orgánů mají vyšší riziko nádorových onemocnění v důsledku expozice dlouhodobé imunosupresivní léčby. Přirozený vývoj PCL u pacientů po transplantaci solidních orgánů je neznámý.Cíl a metody:
Cílem studie bylo posoudit prevalenci a chování incidentálních PCL u pacientů po transplantaci jater. Provedli jsme retrospektivní analýzu nálezů zobrazovacích metod a anamnestických údajů u všech dospělých pacientů, kteří podstoupili v Institutu klinické a experimentální medicíny transplantaci jater v období od září 1996 do listopadu 2014.Výsledky:
Celkem bylo ve sledovaném období provedeno 967 transplantací u 578 mužů a 389 žen (průměrný věk 51 ± 11,7 let). PCL byly nalezeny u 60 pacientů (6,2 %; 26 mužů, 34 žen; průměrný věk 61 ± 8,9), z nichž u 29 byly diagnostikovány v předtransplantačním období. Medián velikosti detekovaných PCL byl 10 mm (5–85). PCL byly lokalizovány v hlavě pankreatu v 35 %, v těle v 33 % a v kaudě v 15 %, multifokální PCL mělo 17 % pacientů. Dvě a více PCL mělo 20 pacientů (33 %). Medián doby sledování byl 37,5 měsíců (6–194). U 10 pacientů (17 %) došlo ke zvětšení PCL (medián + 4 mm), u žádného z nich ale nebyla progrese klinicky relevantní. Pacienti s PCL byli signifikantně starší (p < 0,001), častěji byli ženského pohlaví (p < 0,05) a byli častěji transplantováni pro primární biliární cirhózu (p < 0,05) a deficit α-1-antitrypsinu (p < 0,05). Žádný z pacientů nezemřel v průběhu sledování v souvislosti s PCL, přežívání pacientů s PCL a bez PCL se signifikantně nelišilo.Závěr:
Prevalence PCL u pacientů po transplantaci jater je podobná jako v obecné populaci. Jejich přítomnost byla spojena s vyšším věkem, ženským pohlavím, primárním jaterním onemocněním a neovlivňovala přežívání pacientů.Klíčová slova:
pankreatická cysta – jaterní transplantace – imunosupreseÚvod
Pankreatické cystické léze (PCL) jsou v dnešní populaci v důsledku širšího využití a zdokonalení zobrazovacích metod relativně častým a obvykle náhodným nálezem. Jejich prevalence roste s věkem a v závislosti na použité zobrazovací metodě se dle recentních studií pohybuje mezi 2,6 % u multidetektorové počítačové tomografie (MDCT – multidetector computer tomography) a 20 % u magnetické rezonance (MR) [1,2]. PCL tak jsou nezanedbatelnou klinickou entitou.
PCL lze rozdělit na non-neoplastické a neoplastické. Nejčastější non-neoplastické PCL jsou pankreatické pseudocysty, často vznikající v terénu zánětlivého onemocnění pankreatu (akutní či chronická pankreatitida), či jako důsledek abdominálního traumatu. Nejvíce zastoupené pankreatické cystické neoplazie jsou intraduktální papilární mucinózní neoplazie (IPMN), mucinózní cystické neoplazie (MCN) a serózní cystadenomy (SCA). Ostatní PCL, jako např. solidní pseudopapilární neoplazie, cystický adenokarcinom pankreatu, cystické pankreatické neuroendokrinní neoplazie, degenerativní cysty a další, jsou vzácné a spolu odpovídají méně než 10 % všech případů [3]. Zatímco pseudocysty a SCA jsou považovány za benigní, MCN a IPMN jsou premaligní léze, jejichž maligní potenciál se liší v závislosti od histologického typu. MCN a IPMN hlavního pankreatického vývodu mají výrazně vyšší riziko maligní transformace než IPMN vedlejších vývodů [4]. Pacienti s neoplastickými PCL jsou proto indikováni k pravidelnému sledování dle mezinárodních doporučených postupů [4–7]. Recentní studie prokazují, že neoplastické cysty představují více než 50 % PCL, a to i u pacientů s anamnézou pankreatitidy [8,9].
Pacienti po transplantaci solidních orgánů exponovaní dlouhodobé imunosupresivní léčbě mají zvýšené riziko nádorových onemocnění, vč. nádorů gastrointestinálního traktu [10]. Recentní velké populační studie odhadly standardizovanou incidenci de novo karcinomu pankreatu u pacientů po transplantaci jater na 2,31 – 3,6 [11,12]. Ztráta imunologického dozoru při chronické imunosupresivní léčbě napomáhá proliferaci a přežívání atypických buněk. Zůstává otázkou, zda není chování neoplastických PCL u transplantované populace odlišné ve smyslu akcelerace maligní transformace. Na toto téma bylo prozatím publikováno pouze několik málo prací, a není tedy známo, zda lze doporučené postupy pro sledování pacientů s PCL v obecné populaci aplikovat také u pacientů po transplantaci [13–17].
Cílem naší studie bylo stanovit prevalenci a klinický průběh PCL u pacientů po transplantaci jater.
Metody
Provedli jsme retrospektivní analýzu klinických údajů a nálezů zobrazovacích metod u všech dospělých pacientů, kteří podstoupili transplantaci jater v Institutu klinické a experimentální medicíny v období mezi zářím 1996 a listopadem 2014. Do studie byli zařazeni všichni pacienti s nálezem PCL na jakékoli zobrazovací metodě (abdominální sonografie, MDCT, MR, magnetická cholangiopankreatografie (MRCP)) jak před transplantací jater, tak po výkonu. Všichni pacienti měli v rámci předtransplantačního vyšetření provedenou sonografii a CT dutiny břišní. Podmínkou zařazení byla minimální doba follow-up šest měsíců od stanovení diagnózy PCL.
V potransplantačním období byli všichni pacienti standardně léčeni trojkombinací inhibitorů kalcineurinu (takrolimus, cyklosporin), mykofenolátu a kortikosteroidů s postupnou detrakcí kortikoidů.
Ke statistické analýze kvantitativních údajů byl použit dvouvýběrový t-test, k posouzení nezávislostí kvalitativních znaků Fisherův exaktní test s hladinou významnosti p = 0,05. Kumulativní křivka přežívání byla generována Kaplan-Meierovou metodou, přežívání mezi skupinami bylo porovnáno log-rank testem.
Výsledky
Ve sledovaném období byla provedena transplantace jater u 967 pacientů starších 18 let, z toho bylo 578 mužů (60 %) a 389 žen (40 %) průměrného věku 51 ± 11,7 let. PCL byly detekovány u 60 pacientů (6,2 %) – 26 mužů (43 %) a 34 žen (57 %) průměrného věku 61 ± 8,9 let. U 29 pacientů byla přítomnost PCL zjištěna v předtransplantačním období, u 31 byly PCL diagnostikovány po transplantaci jater. Nejčastější metodou detekce byla CT (67 %), následovaná MR (18 %) a ultrasonografií (USG) (16 %).
Pacienti s PCL byli signifikantně starší (p < 0,001) a prevalence PCL byla signifikantně vyšší u žen (8,7 vs. 4,5 %; p < 0,05). Prevalence PCL byla signifikantně vyšší u pacientů s primární biliární cirhózou (PBC) (p < 0,05) a deficitem α-1-antitrypsinu (A1AT) (p < 0,05). Tyto výsledky jsou shrnuty v tab. 1.
Tab. 1. Charakteristika pacientů po transplantaci jater v závislosti na přítomnosti PCL. Tab. 1. Characteristics of liver transplant recipients in relation to the presence of a PCL. 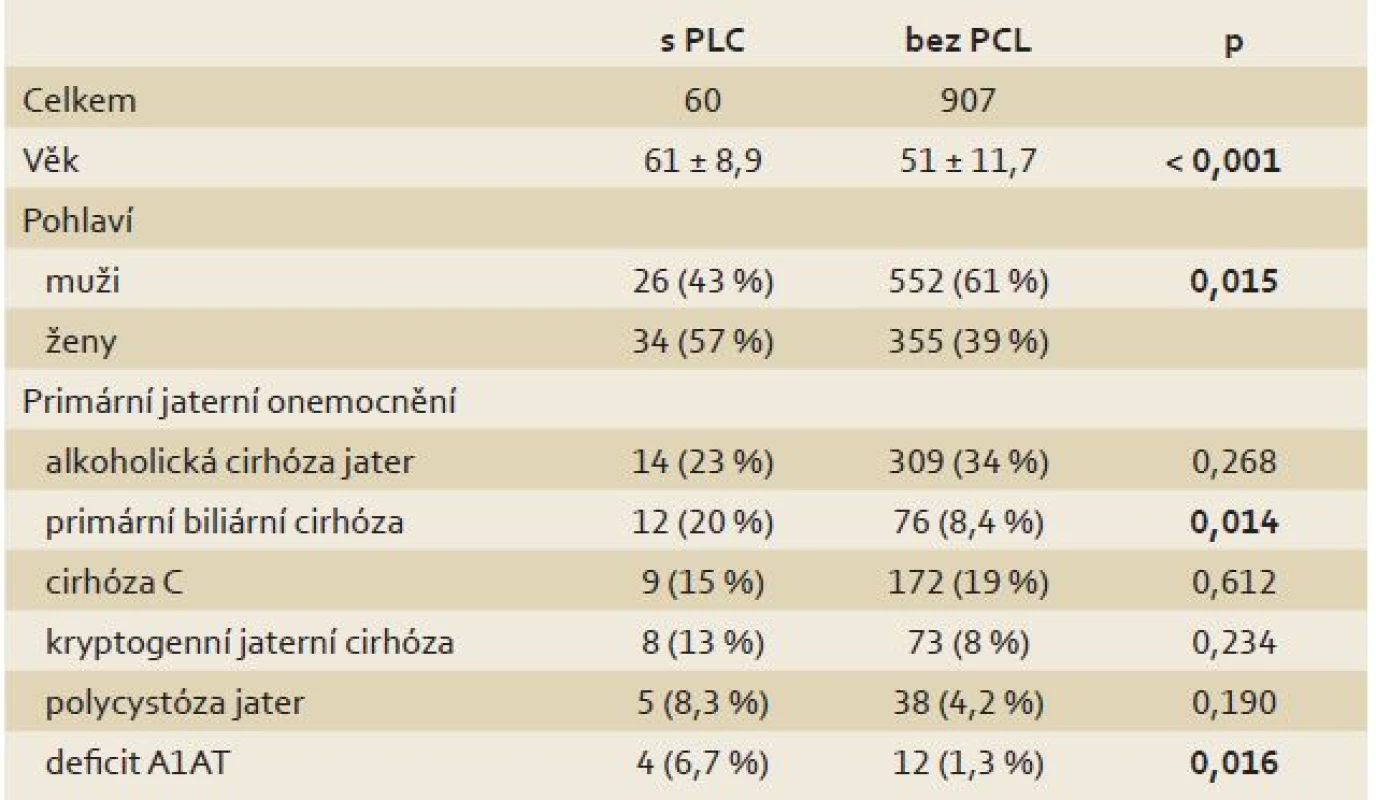
PCL – pankreatické cystické léze, A1AT – α-1-antitrypsin PCL byly nejčastěji lokalizovány v hlavě (35 %) a těle pankreatu (33 %), méně v kaudě (15 %), 17 % pacientů mělo multifokální PCL. Dvě a více lézí bylo nalezeno u 20 pacientů (33 %), tři a více PCL mělo 12 pacientů (20 %).
Průměrná velikost největší přítomné cystické léze byla 15,6 ± 13,4 mm, medián byl 10,5 mm (5–85). V průběhu střední doby sledování 37,5 měsíce (6 – 194) došlo u 10 pacientů (17 %) k progresi velikosti léze, medián 4 mm (2–9), u žádného z nich ale nebyla změna klinicky relevantní. U zbylých 50 pacientů byla velikost cystoidů stacionární nebo v regresi. U dvou pacientů byla provedena transgastrická drenáž infikované pseudocysty, která vedla k úplné rezoluci cystoidu. Vývoj nálezů u ostatních pacientů si nevyžádal žádnou intervenci.
Celkem zemřelo devět pacientů s PCL, čtyři z nich na maligní onemocnění (bronchogenní karcinom, karcinom ovaria, posttransplantační lymfoproliferativní nemoc a karcinom pankreatu). Karcinom pankreatu vyvstal v kaudě pankreatu u pacienta, který byl sledován s cystickými lézemi hlavy a těla, které na zobrazovacích metodách opakovaně neměly známky malignity. Další z pacientů zemřel na selhání jater při cirhóze štěpu, další na GVHD (graft vs. host disease), jeden pacient na pneumonii, jeden na komplikace v souvislosti s urologickou operací. U jednoho z pacientů není příčina úmrtí známa.
Nebyl nalezen statisticky významnýrozdíl v přežívání pacientů po transplantaci jater v závislosti na přítomnosti PCL (log-rank p = 0,245; graf 1).
Graf 1. Přežívání pacientů po transplantaci jater v závislosti na přítomnosti PCL. Graph 1. Survival of liver transplant recipients in relation to the presence of a PCL. 
Diskuze
Cílem naší studie bylo posoudit prevalenci a chování PCL u pacientů po transplantaci jater. Vzhledem k významnému riziku vzniku malignity u PCL v obecné populaci a dlouhodobému užívání imunosupresivní léčby u transplantovaných pacientů, v jejímž důsledku mají tito pacienti zvýšené riziko maligního onemocnění, zůstává otázkou, zda je výskyt a chování těchto lézí v transplantované populaci odlišný. Populaci příjemců jater jsme vybrali z důvodu existence protokolárního MDCT vyšetření břicha u všech kandidátů transplantace jater. Studovat tento fenomén u pacientů po transplantaci ledvin by se mohlo jevit s ohledem na obecně vyšší dávkování udržovací imunosupresivní léčby vhodnější, tito pacienti ale v našem centru obvykle neabsolvují v rámci předtransplantačního vyšetření CT. Navíc jsou příjemci jater v potransplantačním období častěji vyšetřováni zobrazovacími metodami vzhledem k výskytu biliárních a cévních komplikací.
V důsledku širšího využití radiologických metod bylo možné u pacientů po transplantaci jater očekávat vyšší prevalenci PCL oproti obecné populaci. Prevalence PCL v naší studii byla 6,4 %, což je vzhledem k diverzitě zobrazovacích metod (kombinace MDCT, MR a USG) srovnatelné s obecnou populací. V předchozích publikovaných pracích se prevalence PCL u pacientů po transplantaci jater výrazně lišila s hodnotami od 3,2 % až k téměř 60 % [14,16]. Extrémní nález italských autorů je možné z části vysvětlit využitím MRCP jako zobrazovací metody a rovněž selekčním biasem – do studie byli zahrnuti pouze pacienti, kteří absolvovali vyšetření z důvodu biliárních komplikací.
Vyšší výskyt PCL u starších pacientů je obecně známý [2,18]. Neočekávaným výsledkem byl téměř dvojnásobný výskyt PCL u žen ve srovnání s muži. Pohlavní predominance nebyla u obecné populace popsána [18,19], 1,5× vyšší prevalence PCL u žen po transplantaci solidních orgánů byla ale pozorována i v recentní studii autorů z Mayo Clinic [17]. Příčina tohoto rozdílu není známá. Výskyt některých cystických neoplazií je sice vyšší v ženské populaci (MCN 9 : 1, SCN 3 : 1), výskyt IPMN je ale lehce vyšší u mužů (3 : 2) [20].
Prevalence PCL v námi studované populaci byla ovlivněna i primárním jaterním onemocněním. Až pětina pacientů s PCL byla transplantována pro PBC v porovnání s 8,4 % u transplantovaných pacientů bez PCL. Pro vyšší výskyt PCL u pacientů s PBC není jasné vysvětlení, jelikož toto onemocnění není obecně spojeno s onemocněním pankreatu. Na druhou stranu bývá PBC často sdružena se Sjögrenovým syndromem, který může vzácně doprovázet autoimunitní pankreatitidu [21]. Abnormální wirsungogram byl v jedné studii popsán u 43 % studovaných pacientů s PBC, u stejné skupiny pak byla prokázána sekretinovým testem pankreatická hyposekrece [22]. Zastoupení pacientů s deficitem A1AT bylo 4× vyšší ve skupině pacientů s PCL (6,7 vs. 1,3 %). Asociace deficitu A1AT s chronickou pankreatitidou byla postulována několika pracemi [23], recentní genetická studie ale neprokázala vyšší frekvenci Z nebo S alely genu pro A1AT u pacientů s idiopatickou či hereditární chronickou pankreatitidou [24]. Polycystóza jater byla 2× častěji indikací k transplantaci jater u pacientů s PCL než u pacientů bez PCL (8,3 vs. 4,2 %), rozdíl ale nedosáhl statistické významnosti. Toto pozorování není překvapivé, cysty pankreatu se vyskytují až u 9 % pacientů s polycystickým onemocněním jater [25]. Nejčastější indikací k transplantaci jater u pacientů s PCL byla alkoholická cirhóza jater, nicméně relativní zastoupení této indikace bylo u pacientů s PCL nižší než u pacientů bez PCL (23,3 vs. 34 %). Chronický abúzus alkoholu je rizikovým faktorem rozvoje chronické pankreatitidy, nicméně koincidence alkoholické jaterní cirhózy a chronické pankreatitidy je popisována vzácně, patofyziologický mechanizmus tohoto fenoménu je nejasný [26,27].
Odlišení non-neoplastických a neoplastických lézí a přesná specifikace jednotlivých neoplastických lézí je v klinické praxi velmi obtížné. Vyžadují většinou užití kombinace zobrazovacích metod, v řadě případů i jejich opakování v čase, 100% v určení typu léze je pouze histologické hodnocení resekátu. Svízelnost přesné diagnostiky je v našem souboru ještě umocněna jejím retrospektivním charakterem, kdy u části pacientů nebyl diagnostický algoritmus kompletní. Pouze šest pacientů s PCL mělo v anamnéze chronickou či akutní pankreatitidu, pět pacientů bylo transplantováno pro polycystózu jater, 12 pacientů mělo na zobrazovacích metodách nález slučitelný s diagnózou IPMN vedlejších vývodů. Zbylí pacienti byli vzhledem k necharakteristickému nálezu na zobrazovacích metodách sledováni bez definitivní diagnózy, u mnoha z nich ale bylo pomýšleno na neoplastickou cystickou lézi, nejčastěji IPMN z vedlejších vývodů. Tento nález je kompatibilní s názorem některých expertů, že IPMN vedlejších vývodů reprezentují většinu malých incidentálních cystických lézí [28].
Toho času je dostupných pouze velice málo informací o přirozeném průběhu PCL u pacientů po transplantaci solidních orgánů. V našem souboru, který je druhý největší z doposud publikovaných, došlo k mírné progresi velikosti (medián + 4 mm, 2–9 mm) největšího cystoidu pouze u 10 pacientů (17 %), u žádného z nich ale nebyla progrese nálezu klinicky relevantní. U žádného z pacientů nevzniklo v průběhu sledování podezření na maligní proces, které by vedlo ke změně sledovacího algoritmu či k operačnímu řešení. Naše pozorování je tak v souladu s předchozími studiemi [13,17]. Z těchto výsledků tedy nelze zatím doporučit odlišný přístup k pacientům s PCL po transplantaci. K definitivnímu potvrzení tohoto závěru budou nutné prospektivní kontrolované studie s vyšším počtem pacientů a delší dobou sledování.
Shrnutí
Prevalence PCL po transplantaci jater je obdobná jako ve všeobecné populaci. Pacienti s PCL byli signifikantně starší a prevalence PCL byla signifikantně vyšší u žen, pacientů s PBC a deficitem A1AT. V průběhu sledování došlo u menšiny pacientů k progresi velikosti cysty, která nebyla klinicky relevantní a nevyžádala si změnu sledování či intervenci. Přítomnost PCL nekompromitovala přežívání pacientů po transplantaci jater.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 8. 7. 2016
Přijato: 1. 8. 2016
doc. MU Dr. Tomáš Hucl, Ph.D.
Klinika hepatogastroenterologie
Transplantcentrum, IKEM
Vídeňská 1958/ 9
140 21 Praha 4
tomas.hucl@ikem.cz
Zdroje
1. Lee HJ, Kim MJ, Choi JY et al. Relative accuracy of CT and MRI in the differentiation of benign from malignant pancreatic cystic lesions. Clin Radiol 2011; 66(4): 315 – 321. doi: 10.1016/ j.crad.2010.06.019.
2. Laffan TA, Horton KM, Klein AP et al. Prevalence of unsuspected pancreatic cysts on MDCT. AJR Am J Roentgenol 2008; 191(3): 802 – 807. doi: 10.2214/ AJR.07.3340.
3. Sahani DV, Kambadakone A, Macari M et al. Diagnosis and management of cystic pancreatic lesions. AJR Am J Roentgenol 2013; 200(2): 343 – 354. doi: 10.2214/ AJR.12.8862.
4. Del Chiaro M, Verbeke C, Salvia R et al. European experts consensus statement on cystic tumours of the pancreas. Dig Liver Dis 2013; 45(9): 703 – 711. doi: 10.1016/ j.dld.2013.01.010.
5. Tanaka M, Chari S, Adsay V et al. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology 2006; 6(1 – 2): 17 – 32.
6. Tanaka M, Fernández-del Castillo C, Adsay V et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas. Pancreatology 2012; 12(3): 183 – 197. doi: 10.1016/ j.pan.2012.04.004.
7. Italian Association of Hospital Gastroenterologists and Endoscopists, Italian Association for the Study of the Pancreas, Buscarini E et al. Italian consensus guidelines for the diagnostic work-up and follow-up of cystic pancreatic neoplasms. Dig Liver Dis 2014; 46(6): 479 – 493. doi: 10.1016/ j.dld.2013.12.019.
8. Spinelli KS, Fromwiller TE, Daniel RA et al. Cystic pancreatic neoplasms: observe or operate. Ann Surg 2004; 239(5): 651 – 657.
9. Fernández-del Castillo C, Targarona J, Thayer SP et al. Incidental pancreatic cysts: clinicopathologic characteristics and comparison with symptomatic patients. Arch Surg 2003; 138(4): 427 – 433.
10. Herrero JI, Lorenzo M, Quiroga J et al. De novo neoplasia after liver transplantation: an analysis of risk factors and influence on survival. Liver Transpl 2005; 11(1): 89 – 97.
11. Aberg F, Pukkala E, Höckerstedt K et al. Risk of malignant neoplasms after liver transplantation: a population-based study. Liver Transpl 2008; 14(10): 1428 – 1436. doi: 10.1002/ lt.21475.
12. Krynitz B, Edgren G, Lindelöf B et al. Risk of skin cancer and other malignancies in kidney, liver, heart and lung transplant recipients 1970 to 2008 – a Swedish population-based study. Int J Cancer 2013; 132(6): 1429 – 1438. doi: 10.1002/ ijc.27765.
13. Gill KR, Pelaez-Luna M, Keaveny A et al. Branch duct intraductal papillary mucinous neoplasm of the pancreas in solid organ transplant recipients. Am J Gastroenterol 2009; 104(5): 1256 – 1261. doi: 10.1038/ ajg.2009.62.
14. Girometti R, Intini SG, Cereser L et al. Incidental pancreatic cysts: a frequent finding in liver-transplanted patients as assessed by 3D T2-weighted turbo spin echo magnetic resonance cholangiopancreatography. JOP 2009; 10(5): 507 – 514.
15. Lennon AM, Victor D, Zaheer A et al. Liver transplant patients have a risk of progression similar to that of sporadic patients with branch duct intraductal papillary mucinous neoplasms. Liver Transpl 2014; 20(12): 1462 – 1467. doi: 10.1002/ lt.23983.
16. Darstein F, König C, Hoppe-Lotichius Met al. Impact of pancreatic comorbidities in patients with end-stage liver disease on outcome after liver transplantation. Eur J Intern Med 2014; 25(3): 281 – 285. doi: 10.1016/ j.ejim.2014.01.005.
17. Ngamruengphong S, Seeger KM, McCrone LM et al. Prevalence and outcomes of cystic lesion of the pancreas in immunosuppressed patients with solid organ transplantation. Dig Liver Dis 2015; 47(5): 417 – 422. doi: 10.1016/ j.dld.2015.02.011.
18. Lee KS, Sekhar A, Rofsky NM et al. Prevalence of incidental pancreatic cysts in the adult population on MR imaging. Am J Gastroenterol 2010; 105(9): 2079 – 2084. doi: 10.1038/ ajg.2010.122.
19. Zhang XM, Mitchell DG, Dohke M et al. Pancreatic cysts: depiction on single-shot fast spin-echo MR images. Radiology 2002; 223(2): 547 – 553.
20. Matthaei H, Schulick RD, Hruban RH et al. Cystic precursors to invasive pancreatic cancer. Nat Rev Gastroenterol Hepatol 2011; 8(3): 141 – 150. doi: 10.1038/ nrgastro.2011.2.
21. Li A, Wang Y, Deng Z. Concurrent autoimmune pancreatitis and primary biliary cirrhosis: a rare case report and literature review. BMC Gastroenterol 2014; 14 : 10. doi: 10.1186/ 1471-230X-14-10.
22. Epstein O, Chapman RW, Lake-Bakaar G et al. The pancreas in primary biliary cirrhosis and primary sclerosing cholangitis. Gastroenterology 1982; 83(6): 1177 – 1182.
23. Rabassa AA, Schwartz MR, Ertan A. Alpha 1-antitrypsin deficiency and chronic pancreatitis. Dig Dis Sci 1995; 40(9): 1997 – 2001.
24. Witt H, Kage A, Luck W et al. Alpha1-antitrypsin genotypes in patients with chronic pancreatitis. Scand J Gastroenterol 2002; 37(3): 356 – 359.
25. Torra R, Nicolau C, Badenas C et al. Ultrasonographic study of pancreatic cysts in autosomal dominant polycystic kidney disease. Clin Nephrol 1997; 47(1): 19 – 22.
26. Veena AB, Rajesh G, Varghese J et al. Alcoholic chronic pancreatitis and alcoholic liver cirrhosis: differences in alcohol use habits and patterns in Indian subjects. Pancreas 2012; 41(5): 703 – 706. doi: 10.1097/ MPA.0b013e31823b62ca.
27. Spicak J, Pulkertova A, Kralova-Lesna Iet al. Alcoholic chronic pancreatitis and liver cirrhosis: coincidence and differences in lifestyle. Pancreatology 2012; 12(4): 311 – 316. doi: 10.1016/ j.pan.2012.05.008.
28. Farrell JJ, Fernández-del Castillo C. Pancreatic cystic neoplasms: management and unanswered questions. Gastroenterology 2013; 144(6): 1303 – 1315. doi: 10.1053/ j.gastro.2013.01.073.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2016 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Pneumokoková vakcína – vzácná nežádoucí reakce
- Pankreatické cystické léze u pacientů po transplantaci jater
- První hodnocená zkušenost s testem Septin 9 v České republice
- Význam regulácie tranzientných relaxácií dolného pažerákového zvierača v patogenéze pažerákovej refluxovej choroby
- Bronchogenní cysta jícnu
- Apoptóza při vývoji kolorektální neoplazie
- Primární adenokarcinom žaludku s yolk sac diferenciací
- Metabolický profil pacientů po transplantaci jater ve vztahu k rozvoji NAFLD – výsledky pilotní studie
- Nezvyklá manifestace časného kryptogenního hepatocelulárního karcinomu
- Nedostatočná liečba tiopurínmi u pacientov s nešpecifickými zápalovými ochoreniami čreva odoslaných na anti-TNF liečbu
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Noví členové redakční rady časopisu
- Falk Symposium 202 – Evolving therapies in clinical practice in IBD
- Výběr z mezinárodních časopisů
-
Správná odpověď na kvíz
Pemfigus - Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Olysio® (simeprevir)
- SOUTĚŽ O DVĚ NEJLEPŠÍ PŮVODNÍ PRÁCE 2016
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- První hodnocená zkušenost s testem Septin 9 v České republice
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Bronchogenní cysta jícnu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



