-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Apoptóza při vývoji kolorektální neoplazie
Apoptosis in the development of colorectal neoplasia
Background:
The Czech Republic has one of the highest incidence rates of colorectal cancer. Cell proliferation, differentiation, and apoptosis play a key role in the development of this disease. The aim of our study was to assess the level of apoptosis at each stage of colorectal neoplasia.Methodology:
Apoptosis was evaluated by examining mucosal biopsies of colorectal neoplasm and normal mucosa. This was performed in 20 patients with non-advanced adenoma, 20 patients with advanced adenoma, 20 patients with colorectal carcinoma, and 20 individuals with normal colorectal findings. The grade of apoptosis was assessed after hematoxylin-eosin staining (in three compartments: the superficial compartment and the upper and lower parts of the crypts) and by immunohistochemical methods (by detection of activated-caspase-3).Results:
Apoptotic activity was reported as an apoptotic index. In healthy colorectal mucosa, low apoptotic activity was observed in the lower part of the crypts. In the upper part of the crypts, apoptotic activity decreased (to almost zero) and in the superficial compartment, there was an increase in apoptotic activity. Transformation of healthy mucosa into non-advanced colorectal adenoma was associated with a statistically significant increase in apoptotic activity in all three compartments (p ≤ 0.05), with the biggest increase in the upper part of the crypts. Transformation of non-advanced adenoma into advanced adenoma was related to further increases in apoptotic activity, again, mainly in the upper part of the crypts. There was a statistically significant decrease in apoptotic activity in all three comparments of carcinoma samples compared to advanced adenoma (p ≤ 0.05). Results of immunohistochemical methods confirmed this trend.Conclusions:
We have shown deregulation of apoptosis during the development of colorectal neoplasia. Being able to influence the degree of apoptosis, especially during the transformation of an advanced adenoma into a carcinoma, would have beneficial consequences in clinical practice.Key words:
colorectal adenoma – colorectal carcinoma – apoptosis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
7. 6. 2016Accepted:
5. 7. 2016
Autoři: D. Kohoutová 1; J. Pejchal 2; J. Cyrany 1; Petra Morávková 1
; S. Rejchrt 1; J. Bureš 1
Působiště autorů: II. interní gastroenterologická klinika LF UK a FN Hradec Králové 1; Katedra toxikologie a vojenské farmacie, FVZ UO, Hradec Králové 2
Vyšlo v časopise: Gastroent Hepatol 2016; 70(4): 313-318
Kategorie: Gastrointestinální onkologie: původní práce
doi: https://doi.org/10.14735/amgh2016313Souhrn
Úvod:
Česká republika se dlouhodobě řadí ke státům s nejvyšším výskytem kolorektálního karcinomu. Při vývoji kolorektální neoplazie hraje významnou roli proliferace, diferenciace a apoptóza buněk. Cílem naší studie bylo stanovit míru apoptózy u jednotlivých stadií kolorektální neoplazie.Metodika:
Apoptóza byla stanovena ve slizničních biopsiích kolorektální neoplazie a normální sliznice u 20 pacientů s nepokročilým kolorektálním adenomem, u 20 pacientů s pokročilým kolorektálním adenomem, u 20 pacientů s kolorektálním karcinomem a u 20 jedinců s normálním nálezem v kolorektu. Míra apoptózy byla hodnocena po obarvení hematoxylin-eozinem (ve třech kompartmentech: povrchový kompartment, horní a dolní část krypt) a imunohistochemickými metodami (detekcí aktivované kaspázy-3).Výsledky:
Apoptotická aktivita byla vyjádřena pomocí apoptotického indexu. Ve zdravé sliznici kolorekta byla pozorována v dolní části krypt nízká úroveň apoptotické aktivity. V horní části krypt klesla apoptotická aktivita k nulovým hodnotám. Nárůst apoptotické aktivity byl pozorován v povrchovém kompartmentu. Přeměna zdravé sliznice v tkáň nepokročilého kolorektálního adenomu byla doprovázena statisticky signifikantním vzestupem apoptotické aktivity ve všech třech kompartmentech (p ≤ 0,05), přičemž nejvyšší nárůst byl pozorován v horní části krypt. Přeměna nepokročilého adenomu v pokročilý byla spojena s dalším navýšením apoptotické aktivity, a to opět především v horní části krypt. U karcinomů ve srovnání s pokročilým adenomem došlo k významnému poklesu apoptotické aktivity ve všech třech kompartmentech (p ≤ 0,05). Výsledky imunohistochemických hodnocení potvrdily trend pozorovaný u vzorků barvených hematoxylin-eozinem.Závěry:
Prokázali jsme přítomnost deregulace apoptózy při vývoji kolorektální neoplazie. Ovlivnění míry apoptózy především při přeměně pokročilého adenomu v kolorektální karcinom by mělo v klinické praxi příznivé konsekvence.Klíčová slova:
kolorektální adenom – kolorektální karcinom – apoptózaÚvod
Kolorektální karcinom (CRC – colorectal carcinoma) je třetím nejčastějším karcinomem celosvětově, incidence v roce 2012 činila 1,36 mil. Letalita na toto onemocnění zůstává vysoká, v roce 2012 byla 694 000 [1]. ČR se dlouhodobě řadí ke státům s nejvyšším výskytem tohoto onemocnění: incidence CRC v ČR v roce 2013 byla 77 a letalita 35 na 100 000 [2].
Kolem 70 % CRC vzniká sporadicky [3], obvykle sekvencí „adenom-karcinom“. V roce 1990 byl Fearonem a Vogelsteinem představen model kolorektální karcinogeneze, který předpokládá přítomnost mnohočetných na sebe navazujících genetických změn. Jako první nastává inaktivace APC (adenomatous polyposis coli) tumor supresorového genu, která je ve stadiu nepokročilého adenomu následována aktivací mutace KRAS onkogenu. Na úrovni pokročilého kolorektálního adenomu pak dochází k dalším mutacím, vč. mutace v p53 genu [4,5]. Pokročilý kolorektální adenom je definován jako neoplazie velikosti > 10 mm a/nebo obsahující vilózní komponentu a/ nebo přítomnost vysokého stupně dysplazie [6].
Při vývoji kolorektální neoplazie hraje klíčovou roli úroveň proliferace, diferenciace a apoptózy buněk. Regulace těchto dějů je vysoce komplexní, neboť ke kompletní výměně všech kolonocytů v tlustém střevě člověka dochází v intervalu 3–5 dnů a za den je vyprodukováno 3–10 bilionů kolonocytů, což činí sliznici kolorekta nejrychleji proliferujícím orgánem savců [7–9]. Je zřejmé, že při této enormní obnově kolorektálních epiteliálních buněk je přítomen potenciál akumulace genetických změn [10].
Apoptóza („programovaná smrt buňky“) byla představena Lockshinem v roce 1964 [11]. Definice a mechanizmus apoptózy byl přesně popsán Kerrem v roce 1972 – jde o kontrolovanou smrt buňky, která je komplementárním, ale přitom opačným dějem k mitóze. Zahrnuje změny jádra (kondenzace chromatinu) a cytoplazmy („smrsknutí buňky“) a rezultuje ve vznik apoptotických tělísek, která jsou fagocytována okolními buňkami, což eliminuje vznik zánětlivé reakce. Apoptóza může být iniciována fyziologickými, ale i patologickými ději. Apoptotické děje jsou zodpovědné za eliminaci buněk během normálního embryonálního vývoje. Apoptóza je fyziologicky přítomna ve tkáni dospělého člověka, avšak vyskytuje se i ve tkáních neoplazmatických [12].
Cílem naší práce je stanovit míru apoptózy u jednotlivých stadií kolorektální neoplazie.
Metodika
V rámci našeho projektu jsme při diagnostické a/nebo terapeutické koloskopii odebírali biopsie ze sliznice tlustého střeva – párové biopsie v případě nálezu kolorektální neoplazie (jedna biopsie z oblasti patologie, druhá biopsie ze zdravé sliznice, 10 cm vzdálené od místa neoplazie); u jedince s normálním pankoloskopickým nálezem byla biopsie odebrána pouze ze zdravé sliznice, a to obvykle v rektu (na závěr vyšetření, po vyloučení orálněji lokalizované kolorektální neoplazie). Zařazeno bylo 20 pacientů s nepokročilým kolorektálním adenomem, 20 s pokročilým kolorektálním adenomem, 20 s CRC a 20 jedinců s normálním pankoloskopickým nálezem.
Vzorky byly fixovány v 10% formalinu a dopraveny na Fakultu vojenského zdravotnictví v Hradci Králové. Následně byly odvodněny, zality do parafinu, z každého vzorku byl odkrojen 5 μm silný řez a ten odbarven hematoxylin-eozinem.
Vzhledem k charakteru kinetiky buněčné populace tlustého střeva byla v každém vzorku měřena apoptóza (apoptotický index (%) = počet apoptotických buněk × 100/ celkové množství hodnocených buněk) a mitóza (mitotický index (%) = počet mitotických figur × 100/celkové množství hodnocených buněk) ve třech různých kompartmentech: povrchový (v přímém kontaktu s lumen tlustého střeva), horní část krypt a dolní část krypt. Za apoptotické buňky byly považovány buď jednotlivé apoptotické fragmenty velikosti odpovídající sousedním buňkám, nebo shluk alespoň tří drobných apoptotických tělísek. V každém kompartmentu bylo hodnoceno minimálně 750 buněk.
Dále byla míra apoptotické aktivity u kolorektálních neoplazií hodnocena pomocí imunohistochemických metod, kdy byla prováděna detekce aktivované (štěpené) kaspázy-3, jenž je kritickým elementem regulujícím apoptotický proces, pomocí králičí monoklonální protilátky (1 : 200; Cell Signaling Technology, Danvers, MA, USA) za použití standardní peroxidázové techniky na 5 μm silných řezech [13]. Vzorky byly po imunohistochemickém značení dobarveny hematoxylinem (obr. 1).
Obr. 1. Imunohistochemická detekce aktivované kaspázy-3 ve vzorcích dobarvených hematoxylinem. Zvětšeno 500×. Na obrázku jsou znázorněny aktivovaná kaspáza-3 pozitivní buňky (šipka). Rovněž jsou zde patrny dva shluky ≥ 3 apoptotických tělísek (v kroužku), jež by při hodnocení ve vzorcích barvených hematoxylin-eozinem byly považovány za pozitivní, avšak pozitivitu aktivované kaspázy-3 nevykazovaly. Apoptotická tělíska vykazovala pozitivitu jen tehdy, pokud v nich byla zachována cytoplazmatická hmota. Jestliže tělísko obsahovalo pouze jaderný materiál, pozitivita nebyla zachycena. Fig. 1. Immunohistochemical detection of activated caspase-3 with subsequent haematoxylin staining. Original magnification ×500. Activated-caspase-3 positive cells are shown in the picture (arrow). Two clusters ≥ 3 of apoptotic bodies (in circle) are also present; these would be positive for haematoxylin-eosin staining, but have not shown positivity of activated-caspase-3. Apoptotic bodies were only seen if the cytoplasmatic tissue was maintained. If the apoptotic body only contained nuclear ma-terial, positivity was not observed. 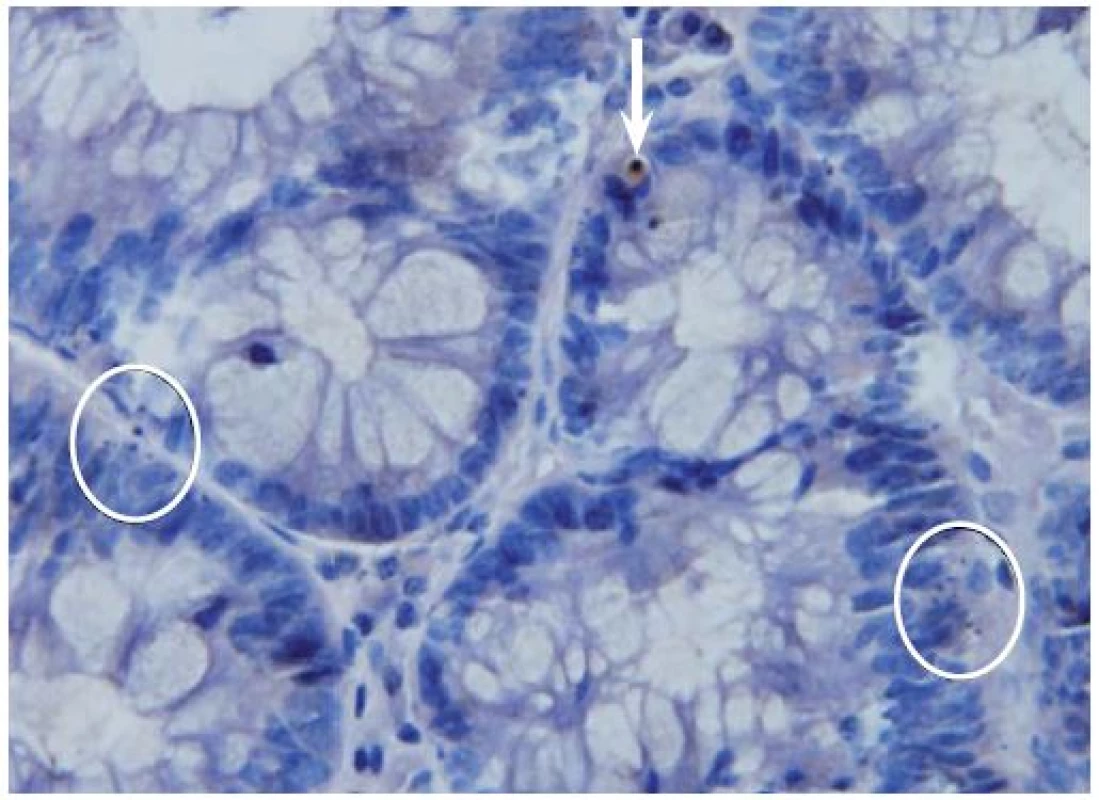
Získané výsledky byly statisticky zpracovány pomocí Mann-Whitneyova testu (nenormální rozdělení dat) statistickým programem SigmaStat.
Všichni jedinci zařazení do studie byli starší 18 let, se zařazením do studie souhlasili a podepsali souhlas informovaného. Byli srozuměni s použitím získaných výsledků a jejich publikováním v anonymní formě. Projekt byl schválen Etickou komisí (UK v Praze, LF UK a FN Hradec Králové).
Výsledky
Ve zdravé sliznici kolorekta bylo možné pozorovat mitotickou aktivitu pouze v dolní části krypt doprovázenou určitou úrovní apoptotické aktivity. Horní část krypt je kompartment, ve kterém buňky podléhají diferenciaci. Mitotická i apoptotická aktivita zde klesly k nulovým hodnotám (obr. 2). Opětovný nárůst množství apoptotických buněk byl pozorován v povrchovém kompartmentu, ve kterém jsou buňky střevní sliznice přirozeně obměňovány. Přeměna zdravé sliznice v tkáň non-advanced adenomu byla doprovázena statisticky signifikantním vzestupem apoptotické aktivity ve všech třech kompartmentech, (p ≤ 0,05) (graf 1). Největší nárůst byl přitom pozorován v horní části krypt. Přeměna non-advanced adenomu v advanced adenom byla spojena s dalším navýšením apoptotické aktivity (graf 1), a to opět především v horní části krypt (obr. 3). U karcinomů na rozdíl od advanced adenomu dochází k významnému poklesu apoptotické aktivity v povrchovém kompartmentu a horní i dolní části krypt, (p ≤ 0,05) (graf 1).
Obr. 2. Nulová apoptotická aktivita v horní části krypt kontrolních vzorků. Hematoxylin-eozin, originální zvětšení 600×. Fig. 2. No apoptotic activity in the upper part of the crypts of control samples. Haematoxylin-eosin, original magification ×600. 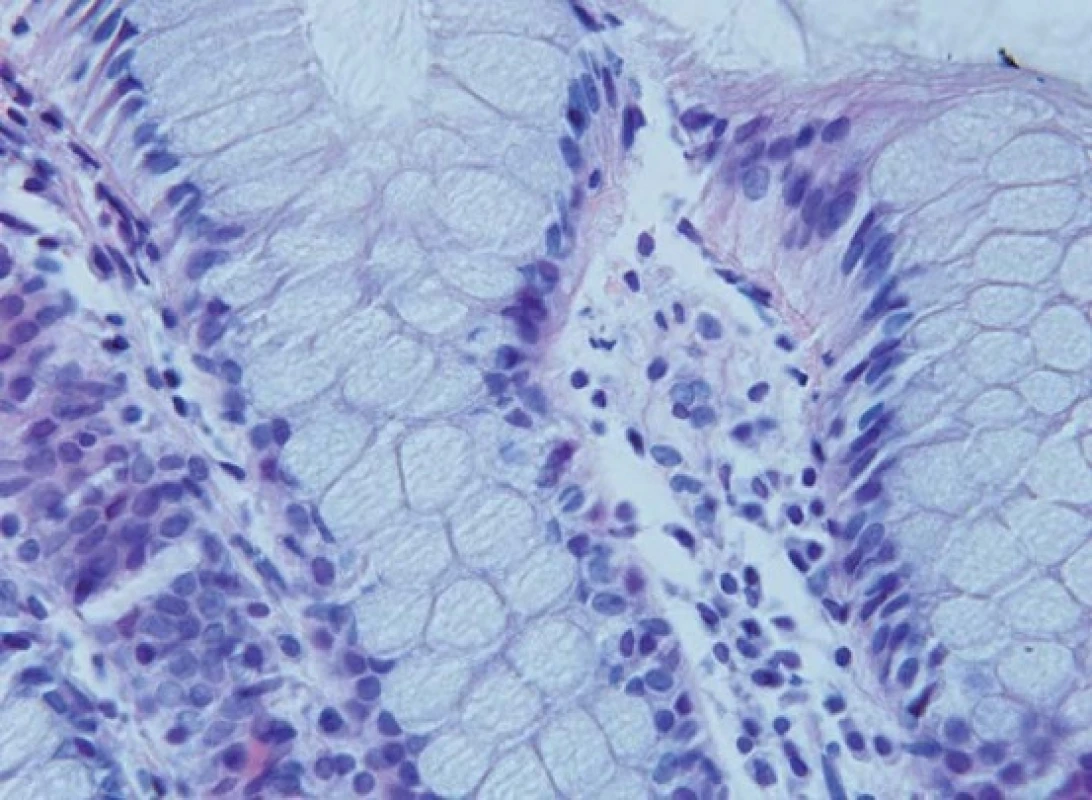
Obr. 3. Apoptotická aktivita v horní části krypt pokročilého adenomu – mitotická figura (šipka), apoptotická tělíska (v kroužku). Hematoxylin-eozin, originální zvětšení 600×. Fig. 3. Apoptotic activity in the upper part of the crypts in advanced adenoma – mitotic figure (arrow), apoptotic bodies (in circle). Haematoxylin-eosin, original magnification ×600. 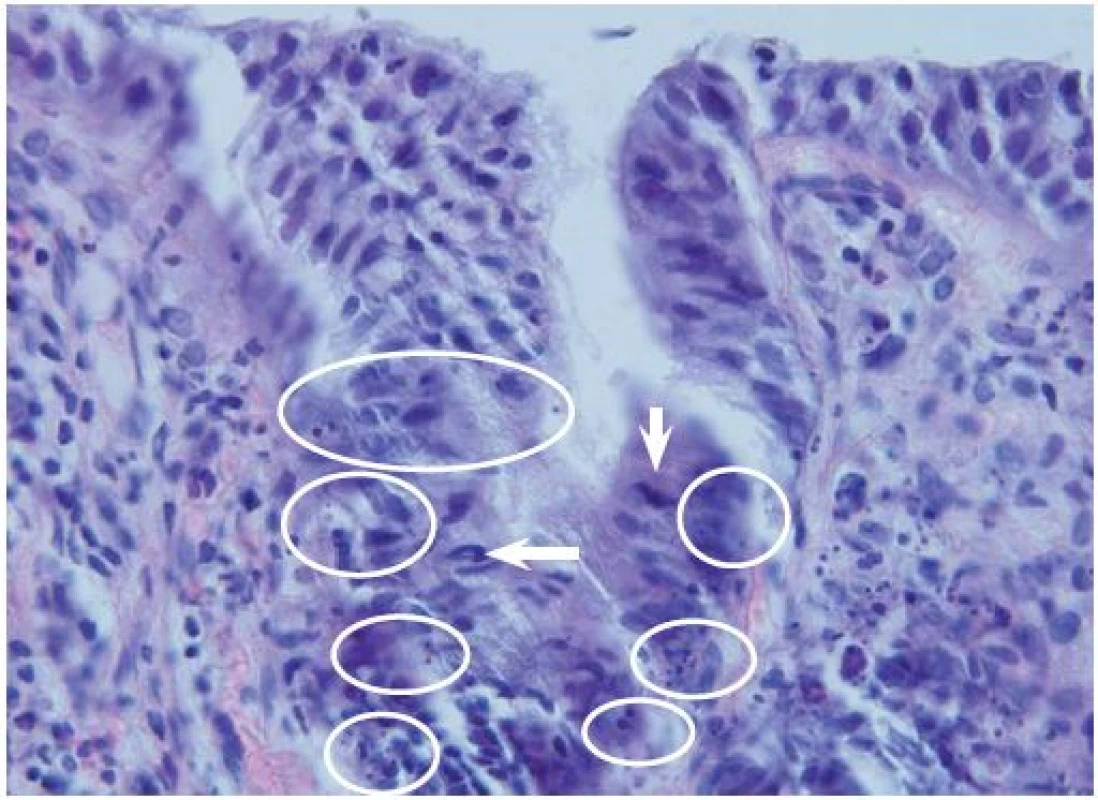
Graf 1. Apoptóza v oblasti dolní části krypt (A), horní části krypt (B) a povrchové části krypt (C), vyjádřená jako apoptotický index (%) (medián a interkvartilové rozpětí). 1 – statisticky významný rozdíl proti kontrolní skupině (p ≤ 0,05), 2 – statisticky významný rozdíl proti non-advanced adenomu (p ≤ 0,05), 3 – statisticky významný rozdíl proti advanced adenomu (p ≤ 0,05). Graph 1. Apoptosis in the lower part of the crypts (A), upper part of the crypts (B) and superficial compartment (C) conveyed as an apoptotic index (%) (median and interquartile range). 1 – statistically significant difference when compared to control group (p ≤ 0.05), 2 – statistically significant difference when compared to non-advanced adenoma (p ≤ 0.05), 3 – statistically significant difference when compared to advanced adenoma (p ≤ 0.05). 
non-A-a – non-advanced adenom, A-a – advanced adenom, Ca – karcinom Apoptotická aktivita byla hodnocena v závislosti na lokalizaci patologie – nebyl pozorován statisticky signifikantní rozdíl v míře apoptózy mezi kolorektálními neoplaziemi lokalizovanými v pravé a levé částí tračníku (a rekta). Hranicí mezi pravou a levou částí tračníku byla flexura lienalis. Ve skupině pokročilého adenomu a karcinomu jde však o malý počet pozorování, proto je nutné toto tvrzení hodnotit rezervovaně.
Výsledky imunohistochemických hodnocení (detekce aktivované kaspázy-3) potvrdily trend pozorovaný u vzorků barvených hematoxylin-eozinem – došlo ke statisticky signifikantnímu nárůstu apoptotické aktivity v horní části krypt při přeměně v non-advanced adenom (p ≤ 0,05); k dalšímu statisticky signifikantnímu nárůstu apoptotické aktivity při přeměně v advanced adenom (p ≤ 0,05) a statisticky signifikantnímu poklesu při vzniku karcinomu z advanced adenomu (p ≤ 0,05).
Diskuze
Přítomnost deregulace apoptózy při iniciaci a progresi maligních onemocnění je zřejmá a nezpochybnitelná. Proto především v posledním desetiletí bylo ve výzkumu vyvinuto mnoho úsilí jak apoptózu kontrolovat a terapeutické strategie zahrnující indukci apoptózy se stávají efektivní součástí léčby maligních onemocnění, vč. léčby CRC [14,15].
Apoptóza může být indukována buď vnitřní (mitochondriální) [16,17] nebo zevní cestou (aktivací buněčných „receptorů smrti“) [18]. Stěžejní roli v samotné realizaci apoptózy mají kaspázy, které jsou produkované ve formě inaktivních zymogenů a podléhají proteolytické přeměně, a tím dochází k jejich aktivaci [17,19].
Apoptóza je regulována dvěma základními mechanizmy – BCL-2 rodinou [20] a inhibitory proteinů apoptózy (IAPs) [21,22]. BCL-2 rodina obsahuje pro - a antiapoptotické proteiny. Obzvlášť významným, antiapoptoticky působícím regulátorem, je protein BCL-2 [23]. Nádorové buňky s vysokou expresí BCL-2 jsou rezistentní k apoptóze, což snižuje jejich senzitivitu k onkologickým terapeutickým modalitám a hraje významnou roli i při vzniku mnohočetné rezistence k léčivům [16,24].
IAPs se vyznačují antiapoptotickými vlastnostmi. Doposud bylo rozpoznáno osm členů rodiny IAPs [21,22]. Nejmenším z rodiny IAPs je survivin; ten se stal díky své selektivní expresi v tumorózních buňkách ideálním tumorózním markerem a vzhledem ke své významné antiapoptotické roli terapeutickým cílem [25,26]. Norská studie označila survivin za nezávislý prediktor vývoje metachronního CRC u pacientů s kolorektálním adenomem [27]. Konturek et al vyšetřovali u pacientů s distálním CRC vliv inhibitoru cyklooxygenázy-2 (celekoxibu) na expresi survivinu ve tkáni nádoru a intaktní sliznici vzdálené 10 cm od nádoru. Po 14denní léčbě celekoxibem došlo ke statisticky významnému snížení exprese survivinu v nádorové tkáni a sliznici rekta. Chemoprevence CRC by proto mohla být mimo jiné realizována supresí antiapoptoticky působících proteinů [28].
V naší studii jsme při porovnání míry apoptózy ve zdravé sliznici pacientů s kolorektální neoplazií s mírou apoptózy ve zdravé sliznici jedinců s normálním nálezem v kolorektu zaznamenali pouze mírně vyšší apoptotický index v povrchové části krypt zdravé sliznice u pacientů s advanced adenomem ve srovnání s jedinci s normálním nálezem v kolorektu. Nešlo však o statisticky signifikantní diferenci.
Apoptóza je u CRC buněk s mutací ve WNT/ β-katenin dráze (která je přítomna u většiny sporadických CRC) indukována inhibitory histon deacetylázy. Známým inhibitorem histon deacetylázy je butyrát [29], který vzniká fermentací vlákniny působením intestinálních mikrobiot v tlustém střevě [30]. Butyrát je hlavním zdrojem energie (70 %) pro normální, zdravé kolonocyty [31,32]. Vzhledem k rozdílné koncentraci butyrátu při bázi krypt a v lumen střeva je jeho efekt na jednotlivé kolonocyty různý – nízké koncentrace butyrátu, přítomné při bázi krypt, jsou ihned metabolizovány v mitochondriích, podléhají β-oxidaci a stimulují proliferaci buněk, přičemž se velmi málo akumulují v jádru buňky [32,33]. Vyšší koncentrace butyrátu, které jsou přítomné v lumen tlustého střeva, výrazně převyšují metabolickou kapacitu kolonocytu. Nemetabolizovaný butyrát vstupuje do jádra kolonocytu a funguje jako inhibitor histon deacetylázy, což má za následek inhibici proliferace buňky a navození apoptózy [33]. Výsledky míry apoptózy ve zdravé sliznici kolorekta v naší studii kopírují tyto teoretické předpoklady – apoptóza v souvislosti s relativním nadbytkem butyrátu v povrchové části krypt výrazně vzrostla ve srovnání s dolní a horní částí krypt.
Zcela jinak je tomu u buněk kolorektální neoplazie: ty podléhají tzv. Warburgovu efektu – jejich preferovaným zdrojem energie je glukóza (ne butyrát), a energii tak čerpají při aerobní glykolýze. Důsledkem je nižší metabolizace butyrátu a jeho snazší akumulace v jádrech buněk kolorektální neoplazie, kde se uplatňuje jako inhibitor histon deacetylázy, čímž dochází k indukci apoptózy s navozením tumor-supresorového efektu [33,34]. K významnému zvýšení apoptózy ve všech vyšetřovaných kompartmentech došlo u nepokročilého i pokročilého kolorektálního adenomu i v naší studii. Při přeměně pokročilého kolorektálního adenomu v karcinom však došlo k významnému poklesu apoptotického indexu, což bylo sice v souladu se studií provedenou Kikuchi et al [35], avšak nebyl naplněn předpoklad Warburgova efektu a efektu butyrátu. Jedno z mnoha případných vysvětlení poskytuje studie Hernandeze et al – ti zkoumali expresi survivinu ve tkáni kolorektálního adenomu a karcinomu a prokázali, že během sekvence vývoje normální sliznice kolorekta-adenom-karcinom dochází ke zvyšování exprese survivinu [25]. Je tedy možné, že na úrovni přeměny pokročilého adenomu v karcinom převáží účinek antiapoptoticky působících proteinů (survivinu) nad inhibičním histon deacetylázovým efektem butyrátu a dochází k poklesu apoptózy. Dalším vysvětlením je skutečnost, žemíra navozené apoptózy inhibitory histon deacetylázy je vždy v zápětí snižována „aktivací záchranných drah“ (AKT, JAK/ STAT, ERK), k čemuž dochází na podkladě efektu mitogenů secernovaných z apoptotických buněk [36–38].
Efektivním přístupem k terapii CRC by tak mělo být kombinované použití apoptózu indukujících léčiv (inhibitory histon deacetylázy, např. butyrát) spolu s agens, které suprimují všechny kompenzatorní „záchranné dráhy“ aktivované během procesu apoptózy. Aplikace těchto poznatků do klinické praxe by vzhledem k incidenci CRC v ČR byla mimořádně účelná.
Práce vznikla v rámci řešení grantu IGA NT/ 13413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 7. 6. 2016
Přijato/: 5. 7. 2016
MU Dr. Darina Kohoutová, Ph.D.
II. interní gastroenterologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
darina.kohoutova@fnhk.cz
Zdroje
1. Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136(5): E359 – E386. doi: 10.1002/ ijc.29210.
2. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: www.svod.cz.
3. Brenner H, Kloor M, Pox CP. Colorectal cancer. Lancet 2014; 383(9927): 1490 – 1502. doi: 10.1016/ S0140-6736(13)61649-9.
4. Fearon E, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell 1990; 61(5): 759 – 767.
5. Pino MS, Chung DC. The chromosomal instability pathway in colon cancer. Gastroenterology 2010; 138(6): 2059 – 2072. doi: 10.1053/ j.gastro.2009.12.065.
6. Kohoutova D, Smajs D, Moravkova P et al. Escherichia coli strains of phylogenetic group B2 and D and bacteriocin production are associated with advanced colorectal neoplasia. BMC Infect Dis 2014; 14 : 733. doi: 10.1186/ s12879-014-0733-7.
7. van der Wath RC, Gardiner BS, Burgess AWet al. Cell organisation in the colonic crypt:a theoretical comparison of the pedigree and niche concepts. PLoS One 2013; 8(9): e73204. doi: 10.1371/ journal.pone.0073204.
8. Raskov H, Pommergaard HC, Burcharth Jet al. Colorectal carcinogenesis – update and perspectives. World J Gastroenterol 2014; 20(48): 18151 – 18164. doi: 10.3748/ wjg.v20.i48.18151.
9. Potten CS, Kellett M, Roberts SA et al. Measurement of in vivo proliferation in human colorectal mucosa using bromodeoxyuridine. Gut 1992; 33(1): 71 – 78.
10. Zhao R, Michor F. Patterns of proliferative activity in the colonic crypt determine crypt stability and rates of somatic evolution. PLoS Comput Biol 2013; 9(6): e1003082. doi: 10.1371/ journal.pcbi.1003082.
11. Lockshin RA, Williams CM. Programmed cell death – II. Endocrine potentiation of the breakdown of the intersegmental muscles of silkmoths. J Ins Physiol 1964; 10 : 643 – 649.
12. Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. J Cancer 1972; 26(4): 239 – 257.
13. Pejchal J, Novotný J, Mařák V et al. Activation of p38 MAPK and expression of TGF-β1 in rat colon enterocytes after whole body γ-irradiation. Int J Radiat Biol 2012; 88(4): 348 – 358. doi: 10.3109/ 09553002.2012.654044.
14. Plati J, Bucur O, Khosravi-Far R. Apoptotic cell signaling in cancer progression and therapy. Integr Biol (Camb) 2011; 3(4): 279 – 296. doi: 10.1039/ c0ib00144a.
15. Koehler BC, Jäger D, Schulze-Bergkamen H. Targeting cell death signaling in colorectal cancer: current strategies and future perspectives. World J Gastroenterol 2014; 20(8): 1923 – 1934. doi: 10.3748/ wjg.v20.i8.1923.
16. Wang H, Sun X, Li M. Apoptosis-induction is a novel therapeutic strategy for gastrointestinal and liver cancers. Curr Gene Ther 2015; 15(2): 193 – 200.
17. Baig S, Seevasant I, Mohamad J et al. Potential of apoptotic pathway-targeted cancer therapeutic research: where do we stand? Cell Death Dis 2016; 7: e2058. doi: 10.1038/ cddis.2015.275.
18. Lavrik IN. Systems biology of apoptosis signaling networks. Curr Opin Biotechnol 2010; 21(4): 551 – 555. doi: 10.1016/ j.copbio.2010.07.001.
19. Lavrik IN, Golks A, Krammer PH. Caspases: pharmacological manipulation of cell death. J Clin Invest 2005; 115(10): 2665 – 2672.
20. Czabotar PE, Lessene G, Strasser A et al. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy. Nat Rev Mol Cell Biol 2014; 15(1): 49 – 63. doi: 10.1038/ nrm3722.
21. Wang K, Lin B. Inhibitor of apoptosis proteins (IAPs) as regulatory factors of hepatic apoptosis. Cell Signal 2013; 25(10): 1970 – 1980. doi: 10.1016/ j.cellsig.2013. 06.003.
22. Salvesen GS, Duckett CS. IAP proteins: blocking the road to death’s door. Nat Rev Mol Cell Biol 2002; 3(6): 401 – 410.
23. Kelly PN, Strasser A. The role of Bcl-2 and its pro-survival relatives in tumourigenesis and cancer therapy. Cell Death Differ 2011; 18(9): 1414 – 1424. doi: 10.1038/ cdd.2011.1.
24. Juin P, Geneste O, Gautier F et al. Decoding and unlocking theBCL-2 dependency of cancer cells. Nat Rev Cancer 2013; 13(7): 455 – 465. doi: 10.1038/ nrc3538.
25. Hernandez JM, Farma JM, Coppola D et al. Expression of the antiapoptotic protein survivin in colon cancer. Clin Colorectal Cancer 2011; 10(3): 188 – 193. doi: 10.1016/ j.clcc.2011.03.014.
26. Pennati M, Folini M, Zaffaroni N. Targeting survivin in cancer therapy: fulfilled promises and open questions. Carcinogenesis 2007; 28(6): 1133 – 1139.
27. Søreide K, Gudlaugsson E, Skaland I et al. Metachronous cancer development in patients with sporadic colorectal adenomas-multivariate risk model with independent and combined value of hTERT and survivin. Int J Colorectal Dis 2008; 23(4): 389 – 400. doi: 10.1007/ s00384-007-0424-6.
28. Konturek PC, Rembiasz K, Burnat G et al. Effects of cyclooxygenase-2 inhibition on serum and tumor gastrins and expression of apoptosis-related proteins in colorectal cancer. Dig Dis Sci 2006; 51(4): 779 – 787.
29. Candido EP, Reeves R, Davie JR. Sodium butyrate inhibits histone deacetylation in cultured cells. Cell 1978; 14(1): 105 – 113.
30. Andoh A. Physiological role of gut microbiota for maintaining human health. Digestion 2016; 93(3): 176 – 181. doi: 10.1159/ 000444066.
31. Cummings JH, Pomare EW, Branch WJet al. Short chain fatty acids in human large intestine, portal, hepatic and venous blood. Gut 1987; 28(10): 1221 – 1227.
32. Donohoe DR, Garge N, Zhang X et al. The microbiome and butyrate regulate energy metabolism and autophagy in the mammalian colon. Cell Metab 2011; 13(5): 517 – 526. doi: 10.1016/ j.cmet.2011.02.018.
33. Bultman SJ. Molecular pathways: gene-environment interactions regulating dietary fiber induction of proliferation and apoptosis via butyrate for cancer prevention. Clin Cancer Res 2014; 20(4): 799 – 803. doi: 10.1158/ 1078-0432.CCR-13-2483.
34. Donohoe DR, Collins LB, Wali A et al. The Warburg effect dictates the mechanism of butyrate-mediated histone acetylation and cell proliferation. Mol Cell 2012; 48(4): 612 – 626. doi: 10.1016/ j.molcel.2012.08.033.
35. Kikuchi Y, Dinjens WN, Bosman FT. Proliferation and apoptosis in proliferative lesions of the colon and rectum. Virchows Arch 1997; 431(12): 111 – 117.
36. Bordonaro M, Drago E, Atamna W et al. Comprehensive suppression of all apoptosis-induced proliferation pathways as a proposed approach to colorectal cancer prevention and therapy. PLoS One 2014; 9(12): e115068. doi: 10.1371/ journal.pone.0115068.
37. Ryoo HD, Gorenc T, Steller H. Apoptotic cells can induce compensatory cell proliferation through the JNK and the Wingless signaling pathways. Dev Cell 2004; 7(4): 491 – 501.
38. Fan Y, Bergmann A. Apoptosis-induced compensatory proliferation. The Cell is dead. Long live the Cell! Trends Cell Biol 2008; 18(10): 467 – 473. doi: 10.1016/ j.tcb.2008.08.001.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2016 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Pneumokoková vakcína – vzácná nežádoucí reakce
- Pankreatické cystické léze u pacientů po transplantaci jater
- První hodnocená zkušenost s testem Septin 9 v České republice
- Význam regulácie tranzientných relaxácií dolného pažerákového zvierača v patogenéze pažerákovej refluxovej choroby
- Bronchogenní cysta jícnu
- Apoptóza při vývoji kolorektální neoplazie
- Primární adenokarcinom žaludku s yolk sac diferenciací
- Metabolický profil pacientů po transplantaci jater ve vztahu k rozvoji NAFLD – výsledky pilotní studie
- Nezvyklá manifestace časného kryptogenního hepatocelulárního karcinomu
- Nedostatočná liečba tiopurínmi u pacientov s nešpecifickými zápalovými ochoreniami čreva odoslaných na anti-TNF liečbu
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Noví členové redakční rady časopisu
- Falk Symposium 202 – Evolving therapies in clinical practice in IBD
- Výběr z mezinárodních časopisů
-
Správná odpověď na kvíz
Pemfigus - Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Olysio® (simeprevir)
- SOUTĚŽ O DVĚ NEJLEPŠÍ PŮVODNÍ PRÁCE 2016
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- První hodnocená zkušenost s testem Septin 9 v České republice
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Bronchogenní cysta jícnu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



