-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Variabilní endoskopický obraz časného dlaždicobuněčného karcinomu jícnu
Variable endoscopic appearance of early squamous cell carcinoma of the oesophagus
We present a case report of a 68-year-old patient with accidental detection of early squamous cell carcinoma of the middle part of the oesophagus. During the diagnostic process, the macroscopic fading of the tumour had changed and Lugol’s staining (otherwise a very sensitive and specific method for diagnosing early squamous carcinoma) was false negative. The false negative Lugol’s staining was explained by a detailed histological assessment.
Key words:
oesophageal squamous cell carcinoma – Lugol’s solution – endoscopic resection
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
25. 7. 2015Accepted:
26. 8. 2015
Autoři: J. Knot 1; I. Peisarová 2; J. Malušková 3; V. Nosek 4
; P. Štirand 5; J. Martínek 5
Působiště autorů: Gastroenterologie, Oblastní nemocnice Mladá Boleslav, a. s. 1; Patologicko-anatomické oddělení, Oblastní nemocnice Mladá Boleslav, a. s. 2; Pracoviště klinické a transplantační patologie, Transplantcentrum, IKEM, Praha 3; Gastroenterologie, Nemocnice Jablonec nad Nisou, p. o. 4; Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 5
Vyšlo v časopise: Gastroent Hepatol 2015; 69(5): 414-417
Kategorie: Klinická a experimentální gastroenterologie: kazuistika
doi: https://doi.org/10.14735/amgh2015414Souhrn
V našem kazuistickém sdělení představujeme případ 68letého pacienta se zcela náhodným záchytem časného dlaždicobuněčného karcinomu střední části jícnu. Během diagnostického procesu se makroskopický obraz nádoru měnil a i barvení Lugolovým roztokem (jinak pro diagnostiku časného dlaždicobuněčného karcinomu velice senzitivní a specifické metody) bylo překvapivě falešně negativní. Tuto „falešnou negativitu“ vysvětlilo podrobné histopatologické vyšetření.
Klíčová slova:
časný spinocelulární karcinom jícnu – Lugolův roztok – endoskopická resekceÚvod
Karcinom jícnu je celosvětově osmou nejčastější malignitou a šestou nejčastější příčinou úmrtí na zhoubný nádor [1]. Navzdory tomu, že došlo k výraznému nárůstu výskytu adenokarcinomu v západních zemích, kde se výskyt dlaždicobuněčného karcinomu s adenokarcinomem téměř vyrovnal, zůstává problematika diagnostiky a léčby dlaždicobuněčného karcinomu stále aktuální. V případě tohoto nádoru je incidence i prevalence stabilní, nedochází tudíž k absolutnímu snížení jeho výskytu.
Celkové pětileté přežití pacientů s nádory jícnu je pouze okolo 17 % [2]. Hlavní příčinou je pozdní záchyt onemocnění v pokročilém stadiu a vysoká incidence onemocnění ve státech s nízkou socioekonomickou úrovní (např. Čína). Na rozdíl od adenokarcinomu, kde je známá prekanceróza (Barrettův jícen), není strategie časné diagnostiky dlaždicobuněčného karcinomu jednoznačná. Objevují se návrhy na plošné použití Lugolova roztoku u rizikových jedinců, avšak ty nedosáhly všeobecného konsenzu. Většina časných dlaždicobuněčných nádorů je tudíž objevena v asymptomatickém stadiu jen díky náhodě.
V našem sdělení prezentujeme případ 68letého pacienta s náhodně diagnostikovaným časným dlaždicobuněčným karcinomem jícnu, který zcela atypicky měnil svůj makroskopický vzhled a jehož endoskopická diagnostika i léčba byla proto komplikovanější.
Popis případu
V březnu 2014 byl na endoskopické pracoviště Oblastní nemocnice Mladá Boleslav, a.s. odeslán 68letý muž ke gastroskopickému vyšetření. Indikací byly tři měsíce trvající bolesti epigastria bez vazby na příjem potravy. V anamnéze byly přítomny stav po infarktu myokardu v roce 1982, diabetes mellitus na perorálních antidiabeticích (metformin, glimeprid), exnikotinizmus od roku 1988 a nepříliš významný příjem alkoholu. Pacient měl negativní osobní i rodinnou onkologickou anamnézu.
Pacienta jsme endoskopicky vyšetřili (Olympus GIF-Q165) a nalezli jsme erytém žaludečního antra a bulbu duodena a skluznou hiátovou hernii. Dalším nálezem byla plochá léze ve středním jícnu velikosti 15 × 10 mm typu 0–IIb dle Pařížské klasifikace. Z této léze byla odebrána jedna biopsie. Fotodokumentace nebyla pro poruchu zařízení pořízena.
V biospii z léze jícnu popsal místní patolog dlaždicový epitel s high-grade dysplazií místy přecházející ve středně diferencovaný dlaždicobuněčný karcinom se známkami invaze do lamina muscularis mucosae. Submukózní vrstva byla bez nádorových změn.
Následně jsme indikovali CT vyšetření hrudníku, na kterém byl jícen intaktní a byly zde patrné kulovité lymfatické uzliny v dolní třetině zadního mediastina. Metastázy nebyly přítomny. V odstupu 14 dnů jsme doplnili endosonografické vyšetření jícnu včetně vyšetření vysokofrekvenční sondou. Endoskopicky byla patrna změna charakteru léze oproti první endoskopii – léze byla větší (25 × 12 mm) a okraje byly mírně navalité (obr. 1). Endosonograficky léze vykazovala známky slizniční a submukózní infiltrace (obr. 1). Periezofageálně byla v úrovni tumoru lymfadenopatie a jedna z uzlin měla suspektní vzhled (obr. 1). Endosonografický staging byl T1 (SM1) a N1 a bylo doporučeno zvážení operačního řešení.
Obr. 1. A. Endoskopický obraz léze při endosonografii, B. endoskopický obraz při kontrole po endosonografii – léze a refluxní ezofagitida v NBI, C. EUS obraz léze, D. EUS – lymfadenopatie. Fig. 1. A. Endoscopic image of the lesion on endosonography, B. Endoscopic image during check-up after endosonography – lesion and reflux oesophagitis in NBI, C. EUS image of the lesion, D. EUS – lymphadenopathy. 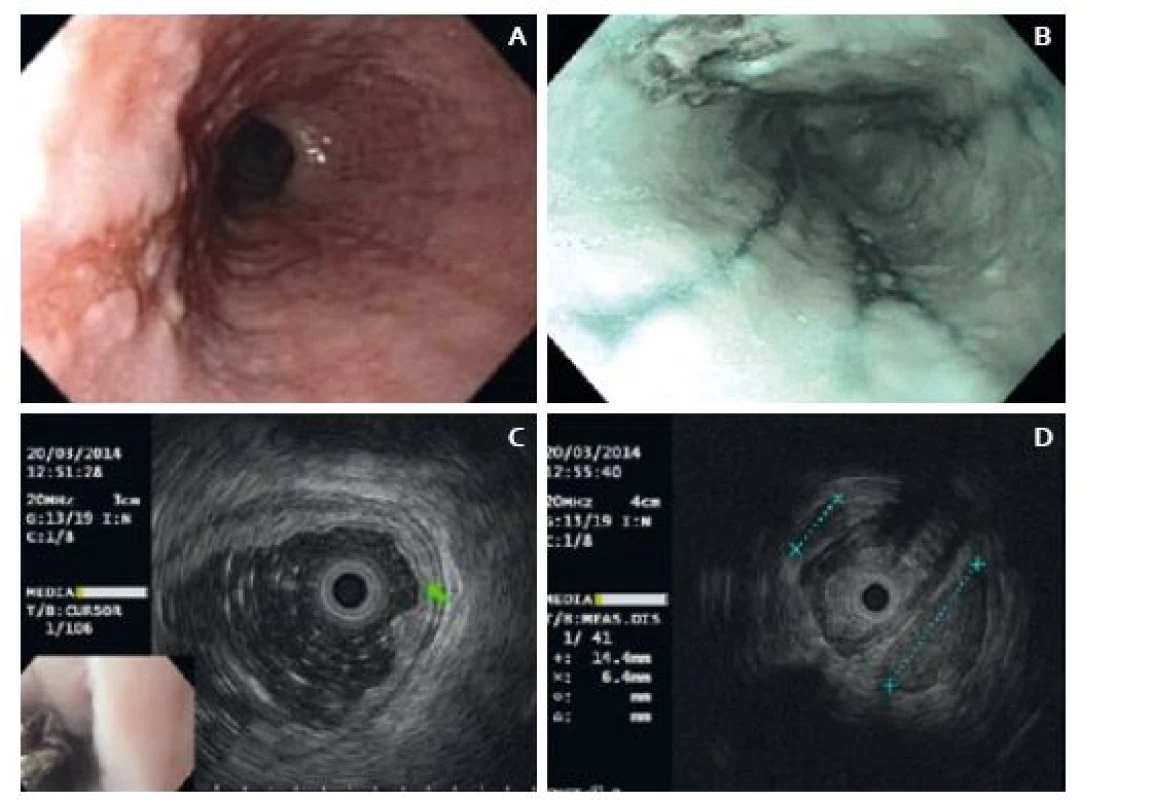
Na další kontrolu (po endosonografickém vyšetření) dorazil pacient značně negativistický a jednoznačně odmítal podstoupit jakoukoli další terapii. Až po delším rozhovoru jsme jej přesvědčili o miniinvazivitě endoskopického řešení a o jeho možné radikalitě. Po domluvě s kolegy v IKEM, kde se léčbou časných malignit jícnu a žaludku systematicky zabývají, jsme našeho pacienta objednali k endoskopické resekci (ER) nebo endoskopické submukózní disekci (ESD).
V rámci vyšetření před ER jsme ještě provedli kontrolní gastroskopii, kde opět došlo ke změně nálezu (obr. 1). Léze byla okrouhlá, zčásti krytá dlaždicovým epitelem a celková velikost byla 15 × 10 mm. V distálním jícnu jsme zaznamenali refluxní ezofagitidu II. stupně dle klasifikace Savary-Millera se štěrbinovitými erozemi zasahujícími až do úrovně tumoru. V biopsii z distálního jícnu byly známky refluxu bez dysplazie. Pacient zpětně přiznal, že neužíval dříve předepsaný omeprazol.
V polovině dubna (pět týdnů od úvodní gastroskopie) byl pacient přijat do IKEM k plánované ER/ESD. Výkon byl plánovaně proveden v analgosedaci s propofolem za přítomnosti anesteziologa, k výkonu byl použit přístroj Olympus GIF-H180J. V místě předpokládané léze (30 cm od řezáků) byl však endoskopicky zcela normální nález (obr. 2), a to jak v bílém světle, tak i v zobrazení NBI (narrow band imaging). Ani po nabarvení jícnu Lugolovým roztokem nebyla žádná léze patrná. Přestože jsme zvážili možnost předchozího chybného zhodnocení histologického nálezu patologem, rozhodli jsme se pro provedení ER „naslepo“ s využitím ligátoru – EMRL. V oblasti předpokládané léze (při výkonu asistoval i lékař, který lézi jako první diagnostikoval) jsme postupně nasadili čtyři ligační kroužky a odpovídající resekáty jsme po resekci připevnili na korkovou destičku a odeslali specializovanému jícnovému patologovi. Drobné krvácení po výkonu jsme stavěli koag-grasperem, jinak výkon proběhl bez komplikací.
Obr. 2. A. Endoskopický obraz v IKEM před resekcí – v bílém světle, B. v NBI, C. endoskopická resekce s použitím ligátoru – EMRL, D. epodina po endoskopické resekci. Fig. 2. A. Endoscopic image taken at the Institute for Clinical and Experimental Medicine before resection – in white light, B. in NBI, C. endoscopic mucosal resection with ligation – EMRL, D. resected area after endoscopic resection. 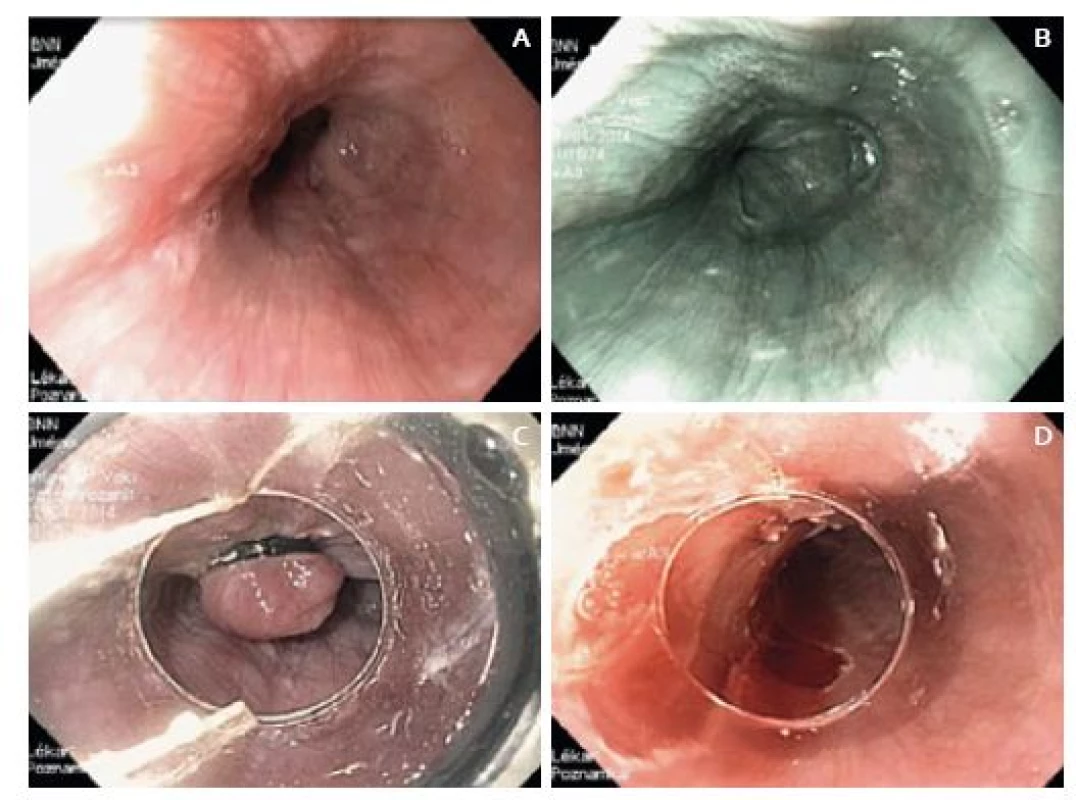
Histologicky byl překvapivě ve dvou ze čtyř resekátů nález dobře diferencovaného dlaždicového karcinomu (obr. 3). V prvním resekátu nádor prorůstal do horní třetiny lamina muscularis mucosae a podrůstal morfologicky přiměřený epitel. Ve druhém resekátu byl karcinom omezený pouze na epitel. V obou resekátech nádor nedosahoval k okrajům ani ke spodině excize a nebyly známky invaze do krevních či lymfatických cév. Endoskopicky jsme tudíž odstranili dva nádory a jednalo se o R0 resekce (staging nádorů byl T1a (M3) a T1a (M1), G1 (dobře diferencovaný)).
Obr. 3. Histologický nález, barvení hematoxylin eozinem. Fig. 3. Histological finding, haematoxylin- eosin staining. 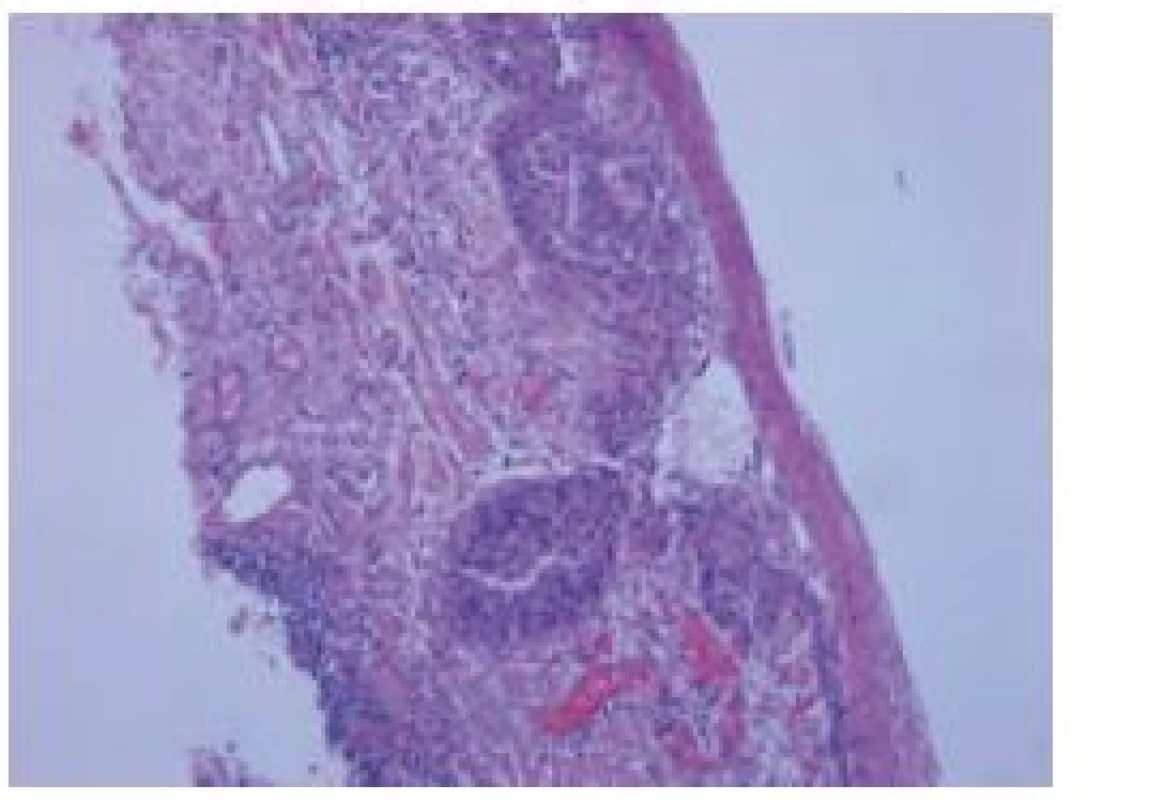
Po jednom měsíci jsme provedli kontrolní gastroskopii s nálezem klidné jizvy po resekci, barvení Lugolovým roztokem bylo lehce heterogenní. V biopsii z nenabarvených okrsků byl nález low-grade dysplazie ve dvou z 10 vzorků a jizva byla bez nádorových změn. Při následné kontrole na začátku října byla v biopsiích zachycena třikrát high-grade dysplazie a dvakrát low-grade dysplazie, proto jsme dané místo ošetřili radiofrekvenční ablací HALO 90.
V současné době (červen 2015) je pacient bez makroskopických známek nádoru a epitel jícnu nevykazuje žádné dysplastické změny.
Na kontrolním endosonografickém vyšetření v polovině června 2014 byl v jícnu normální nález a byly patrny tři uzliny spíše benigního vzhledu ve vzdálenosti 27–30 cm od řezáků. Uzliny byly velikosti do 20 mm a z největší z nich jsme provedli aspirační biopsii tenkou jehlou (FNAB – fine needle aspiration biopsy). Histologicky byl nález bez známek malignity. Endosonografická kontrola v roce 2015 prokázala stacionární nález tří uzlin zcela stejného charakteru bez progrese velikosti, proto jsme další FNAB neprovedli.
Diskuze
Hlavním faktorem pro přežití pacientů je stanovení diagnózy v časném stadiu onemocnění. Záchyt časného karcinomu jícnu pouze v bílém světle bez použití chromodiagnostiky je však dle různých studií okolo 50–60 %, u ložisek s pouhou high-grade dysplazií již jen 20 % a u malých ložisek do 10 mm je záchyt zpravidla velmi nízký [3–5]. Za zlatý standard v diagnostice časného spinocelulárního karcinomu jícnu tedy stále považujeme endoskopické vyšetření (high resolution endoscopy) s barvením Lugolovým roztokem. Senzitivita vyšetření je velmi vysoká – dle různých souborů mezi 95 a 100 % [3,5,6]. Specifitu snižuje hlavně absence zbarvení při refluxní ezofagitidě. Zvýšit ji lze využitím „pink colour sign“, tj. růžové zbarvení neoplastické léze cca 2–5 min po nabarvení Lugolovým roztokem a poté specifita dosahuje cca 95 % [7].
Role endosografie a CT vyšetření při stagingu časného karcinomu jícnu je hlavně v detekci postižení lymfatických uzlin v mediastinu. K přesnému posouzení hloubky invaze se endosonografie nehodí, protože i přes použití vysokofrekvenčních sond dochází velmi často k overstagingu. Ten je podmíněn zánětlivou či desmoplastickou reakcí tkáně u neoplazie [8].
V minulosti byly téměř všechny nádory jícnu včetně časných řešeny chirurgicky. V současné době je správným postupem ošetření časné léze endoskopicky (ER/ESD). Resekát musí být odeslán k podrobnému histopatologickému vyšetření. Dle jeho výsledku by měl multidisciplinární tým doporučit definitivní terapii [9]. Patolog má vždy posoudit typ nádoru, grading, hloubku invaze, disociaci, invazi do cév a lymfatik [10]. Endoskopicky lze léčit nádory T1a a T1b (s invazí SM1) u adenokarcinomu a prozatím pouze T1a (se slizniční invazí) u dlaždicobuněčných nádorů.
Dlouhodobé výsledky endoskopické terapie časného spinocelulárního karcinomu jícnu jsou velmi dobré. Hlavním prognostickým faktorem je hloubka invaze a věk pacienta. Například dle rozsáhlého souboru Yamashiny et al jsou výsledky pětiletého přežití při postižení T1 M1 a M2 99 %, T1 M3 98 % a pro T1S M1 85,7 % [11].
U našeho pacienta chceme poukázat na velkou variabilitu endoskopického obrazu časného karcinomu jícnu. Nález se opakovaně měnil v krátkých časových intervalech a při plánované resekci nebyl dokonce patrný vůbec, a to i přes použití chromodiagnostiky. Domníváme se, že v tomto případě hrál při změnách nálezů dominantní roli gastroezofageální reflux. Na zhoršení nálezu při kontrole před plánovanou resekcí (nález refluxní ezofagitidy II. stupně) se mohl výrazněji podílet i psychický stres po sdělení diagnózy. Pro kompletní zhojení léze byl jistě zásadní vliv omeprazolu a na reepitelizaci se mohl podílet i předchozí odběr biopsie. Negativitu Lugolova roztoku i NBI můžeme u prvního ložiska (T1 M3) vysvětlit podrůstáním normálního epitelu, ale u druhého ložiska omezeného na epitel vysvětlení nemáme.
Zajímavé je i multifokální postižení – dvě ložiska časného karcinomu s R0 resekcí při záchytu onemocnění a při kontrolách vícečetné nálezy low-grade i high-grade dysplazie v biopsiích. Proto jsme se rozhodli pro ošetření jícnu pomocí radiofrekvenční ablace, které se jinak používá hlavně při terapii časných neoplazií v terénu Barrettova jícnu.
I u našeho pacienta jsme potvrdili skutečnost, že při posouzení hloubky invaze dochází endosonograficky velmi často k overstagingu – zde byly známky SM invaze nejspíše v důsledku desmoplastické reakce. Definitivní histopatologický staging byl T1a, a i proto jsme zvažovanou chirurgickou terapii neindikovali. Avšak i hodnocení lymfadenopatie je subjektivní, zde uzliny hodnotili dva velmi zkušení endosonografisté, a přesto byly hodnoceny odlišně. Lymfadenopatie je v tomto případě s největší pravděpodobností benigní – výsledek FNAB byl negativní a při opakovaných kontrolách jsou uzliny stacionární. Lze tedy doporučit velkou opatrnost u hodnocení EUS nálezů u časných nádorů jícnu, kdy by indikace k chirurgickému řešení neměla vycházet z pouhého výsledku endosonografického vyšetření.
Dále je potřeba poukázat na výbornou komunikaci mezi lékaři, kteří se na vyšetření a léčbě pacienta podíleli. Komunikace tří pracovišť, vzájemné výměny dokumentace i přítomnost ošetřujícího lékaře při endoskopické resekci a kooperace mezi patology jistě přispěly k diagnostice i léčbě. V momentě, kdy v IKEM (před plánovanou resekcí) nebyla patrná žádná léze, a proto jsme zvažovali resekci neprovést, jsme komunikovali s ošetřujícím lékařem i s lékařem, který lézi též viděl a prováděl EUS vyšetření, a díky jejich okamžitému sdělení i sdílení obrázků jsme nakonec nejen diagnostickou, ale hlavně kurativní ER provedli „naslepo“.
Také se potvrzuje stále větší tlak na správnou komunikaci s pacienty, kdy může současná medicína nabízet různé alternativy terapie a záleží i na jejich preferencích. Náš pacient byl již na počátku rozhodnutý nepodstupovat jakoukoli terapii z obav z rozsáhlého chirurgického výkonu či chemoradioterapie. Mohl se jevit jako problematický a malkompliantní. Nicméně po vysvětlení možnosti endoskopické terapie zcela změnil přístup a doposud s optimizmem zvládá celou léčbu.
Závěr
Přestože ČR patří mezi země s nižší incidencí dlaždicového karcinomu jícnu, je k časné diagnostice neoplastických lézí zásadní pečlivé provedení endoskopického vyšetření, zejména pak u rizikových skupin nemocných. Endoskopický obraz časného karcinomu jícnu může být variabilní a ke stanovení diagnózy pomáhá použití chromodiagnostiky Lugolovým roztokem. Ve výjimečných případech však nemusí být nádor přes veškerou snahu detekovatelný.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 25. 7. 2015
Přijato: 26. 8. 2015
MUDr. Jan Knot
Gastroenterologie
Oblastní nemocnice Mladá Boleslav, a.s.
třída Václava Klementa 147
293 01 Mladá Boleslav
jknot@centrum.cz
Zdroje
1. Jemal A, Bray F, Center MM et al. Global cancer statistics. CA Cancer J Clin 2011; 61(2): 69–90. doi: 10.3322/caac.20107.
2. Zhang Y. Epidemiology of esophageal cancer. World J Gastroenterol 2013; 19(34): 5598–5606. doi: 10.3748/wjg.v19.i34.5598.
3. Hahimoto CL, Iriya K, Baba ER et al. Lugol’s dye spray chromoendoscopy establishes early diagnosis of esophageal cancer in patients with primary head and neck cancer. Am J gastroenterol 2005; 100(2): 275–282.
4. Dubuc J, Legoux J, Winnock M et al. Endoscopic screening for esophageal squamous-cell carcinoma in high-risk patients: a prospective study conducted in 62 french endoscopy centers. Endoscopy 2006; 38(7): 690–695.
5. Ide E, Maluf-Filho F, Chaves DM et al. Narrow-band imaging without magnification for detecting early esophageal squamous cell carcinoma. World J Gastroenterol 2011; 17(39): 4408–4413. doi: 10.3748/wjg.v17.i39.4408.
6. Mori M, Adachi Y, Matsushima T et al. Lugol staining pattern and histology of esophageal lesions. Am J Gastroenterol 1993; 88(5): 701–705.
7. Ishihara R, Yamada T, Iishi H et al. Quantitative analysis of the color change after iodine staining for diagnosing esophageal high-grade intraepithelial neoplasia and invasive cancer. Gastrointest Endosc 2009; 69(2): 213–218. doi: 10.1016/j.gie.2008.04.052.
8. Arantes V, Forero Piñeros EA, Yoshimura K et al. Advances in the management of early esophageal carcinoma. Rev Col Bras Cir 2012; 39(6): 534–543.
9. Cotton RG, Langer R, Leong T et al. Coping with esophageal cancer approaches worldwide. Ann N Y Acad Sci 2014; 1325 : 138–58. doi: 10.1111/nyas.12522.
10. Vieth M, Stolte M. Pathology of early upper GI cancers. Best Pract Res Clin Gastroenterol 2005; 19(6): 857–869.
11. Yamashina T, Ishihara R, Nagai K. Long-term outcome and metastatic risk after endoscopic resection of superficial esophageal squamous cell carcinoma. Am J Gastroenterol 2018; 108(4): 544–551. doi: 10.1038/ajg.2013.8.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2015 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Odcházení
- Pneumoperitoneum
- Pilotní experimentální studie stenóz jícnu po ESD
- Variabilní endoskopický obraz časného dlaždicobuněčného karcinomu jícnu
- Prvé skúsenosti s digitálnym Spyglass™ DS na Slovensku z gastroenterologického pracoviska FN Trnava
- Endoskopická histologizace diminutivních polypů tračníku. Jsme připraveni na změnu?
- Kvalita biopsií u pacientů s Barrettovým jícnem – jumbo vs. large capacity kleště
- Screeningové kolonoskopie u seniorů starších 70 let
- Nové přístupy u pacientů trpících nespecifickými střevními záněty
- Domáca parenterálna výživa – význam a využitie v klinickej praxi
- Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C
- Ledipasvir/ sofosbuvir – rychlý vývoj poznatků vede ke zkrácení léčby u cirhotických pacientů s chronickou hepatitidou C
- Recenze knihy
- Hands-on trénink pokročilých endoskopických metod – mezinárodní workshop v Aténách
-
XXIX. Hildebrandovy Bardějovské gastroenterologické dny
Střevní záněty v kazuistických obrazech a přehledných přednáškách - Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Autodidaktický test: klinická a experimentální gastroenterologie
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Endoskopická histologizace diminutivních polypů tračníku. Jsme připraveni na změnu?
- Pneumoperitoneum
- Screeningové kolonoskopie u seniorů starších 70 let
- Domáca parenterálna výživa – význam a využitie v klinickej praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



