-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Problém nemusí být tak jednoduchý, jak se na první pohled jeví – komentář k Doporučení ČGS pro podávání antiagregační terapie kyselinou acetylsalicylovou
Vyšlo v časopise: Gastroent Hepatol 2013; 67(4): 319-323
Kategorie: Diskuzní fórum
V letošním druhém čísle časopisu Gastroent Hepatol byla zveřejněna Doporučení České gastroenterologické společnosti pro podávání antiagregační terapie kyselinou acetylsalicylovou [1]. Vůbec nechci polemizovat s argumentací a řadou důkazů, z nichž autoři vyvodili logický závěr, který do Doporučení vtělili. Byl jsem však redakcí požádán o komentář k této problematice.
Shrňme fakta. Na základě řady dokladů byl učiněn závěr, že aplikace enterosolventní kyseliny acetylsalicylové (ecASA) snížila výskyt NSA-gastropatie a jejích komplikací ve srovnání s ostatními lékovými formami ASA. Obdobný efekt má profylaxe inhibitory protonové pumpy (IPP) a u nemocných s infekcí H. pylori též jeho eradikace. Autoři Doporučení uzavírají, že u nemocných s vysokým rizikem gastrointestinální toxicity (NSA-gastropatie, komplikace nebo více než dva rizikové faktory) je nutno upřednostnit podávání enterosolventní formy kyseliny acetylsalicylové, kterou je vždy nutné doplnit o antisekreční terapii inhibitory protonové pumpy (IPP).
O zvýšení jak bezpečnosti, tak tolerance protidestičkové léčby ASA uvedenými postupy není nejmenších pochyb. Méně však víme o tom, zda tento postup – konkrétně volba ecASA a komedikace IPP – neovlivní účinnost léčby, tedy zda zůstane plně zachován efekt na snížení výskytu aterotrombotických příhod.
Podívejme se nejprve na problematiku enterosolventní formy ASA. Ta byla vyvinuta před více než dvěma desítkami let k potlačení gastrotoxicity. Předpokládal se dominantní přímý vliv tablet obsahujících kyselinu na žaludeční sliznici. Objev vlivu inhibice cyklooxygenázy-1 (COX-1) na žaludeční cirkulaci, sekreci a cytoprotekci byl doložen až později. Nicméně tyto enterosolventní tablety nikdy nebyly užity v klinických studiích, na jejichž výsledcích byl dokumentován protidestičkový účinek a redukce aterotrombotických příhod asi o pětinu. Ty byly prováděny s formami rozpustnými v žaludku. Bohužel by volba lékové formy mohla mít v případě ASA význam nejen na snížení toxicity, ale i na ovlivnění účinnosti. Klíčová otázka zní – poškozuje žaludeční sliznici vystavení ASA či snížení nabídky vazodilatačně a cytoprotektivně působících prostaglandinů (PGE2 a prostacyklinu) při nízké aktivitě COX-1 v žaludeční stěně? Odpovíme-li v souhlase s tím, co učíme, že se jedná o inhibici syntézy prekurzorů výše uvedených prostaglandinů, tj. PGH2/G2, pak vyvstane další otázka. Je protektivní efekt ecASA dán tím, že nedojde k absorpci kyseliny acetylsalicylové přímo v žaludeční sliznici, ale až ve střevě, a snížená lokální koncentrace má menší dopad na inhibici COX-1? Nebo nedostatečná absorpce kyseliny acetylsalicylové v žaludku sníží její nabídku v portálním oběhu natolik, že inhibice COX-1 je nedostatečná a nevede k významnější redukci syntézy prostaglandinů? Na základě současných znalostí je pravděpodobné, že se mohou uplatnit obě příčiny.
Mechanizmem protidestičkového účinku ASA je ireverzibilní inaktivace COX-1 v trombocytu acetylací serinu v oblasti katalytického centra enzymu. Tak je inhibována konverze kyseliny arachidonové na prekurzory TXA2, tj. meziprodukty – prostaglandiny G2 a H2. Kritickým místem pro zajištění efektu je resorpce. Acetylsalicylová kyselina (jako hydrofilní slabá kyselina s disociační konstantou pK = 3,5) se spolehlivě vstřebává pouze v nedisociovaném stavu, tj. při pH < 3,5; konkrétně v kyselém prostředí žaludku a proximálního duodena (obr. 1). Inaktivace trombocytů acetylací COX-1 probíhá zejména v portálním oběhu, v játrech je rozhodující většina ASA degradována na kyselinu salicylovou. Ta sice inhibuje COX-1 též, nikoli však ireverzibilně [2,3]. Mechanizmus inhibice syntézy prostanoidů kyselinou salicylovou je méně znám, zdá se, že se jedná o vliv na genovou expresi.
Obr. 1. Mechanizmus ireverzibilní inaktivace COX-1 v trombocytu a závislosti tohoto procesu na vstřebávání a degradaci kyseliny acetylsalicylové v žaludku či ve střevě (při různém pH). Acetylsalicylová kyselina jako slabá hydrofilní kyselina se vstřebává zejména v nedisociovaném stavu. Při hodnotě disociační konstanty pKa = 3,5 se ASA spolehlivě resorbuje v kyselém prostředí (při pH < 3,5), tj. v žaludku či v proximálním duodenu. Není-li kyselina acetylsalicylová vstřebána v žaludku, je ve střevě deacetylována „aspirinovými“ esterázami na kyselinu salicylovou (lipofilní molekulu), která se již dobře resorbuje ve střevě. Salicylová kyselina také snižuje aktivitu COX-1 a COX-2, ale tato inhibice je jen krátkodobá a reverzibilní. Její protidestičkový účinek není doložen. Vzhledem k dominující degradaci ASA ve střevě je resorpce v prostředí pH > 3,5 nepředvídatelná a předpokládá se, že koncentrace v portálním oběhu je pod účinnou hladinou. Za fyziologických podmínek při dostatečné resorpci ASA v kyselém prostředí dochází k acetylaci COX-1 ještě v portálním oběhu; v játrech je totiž rozhodující část ASA degradována na kyselinu salicylovou. 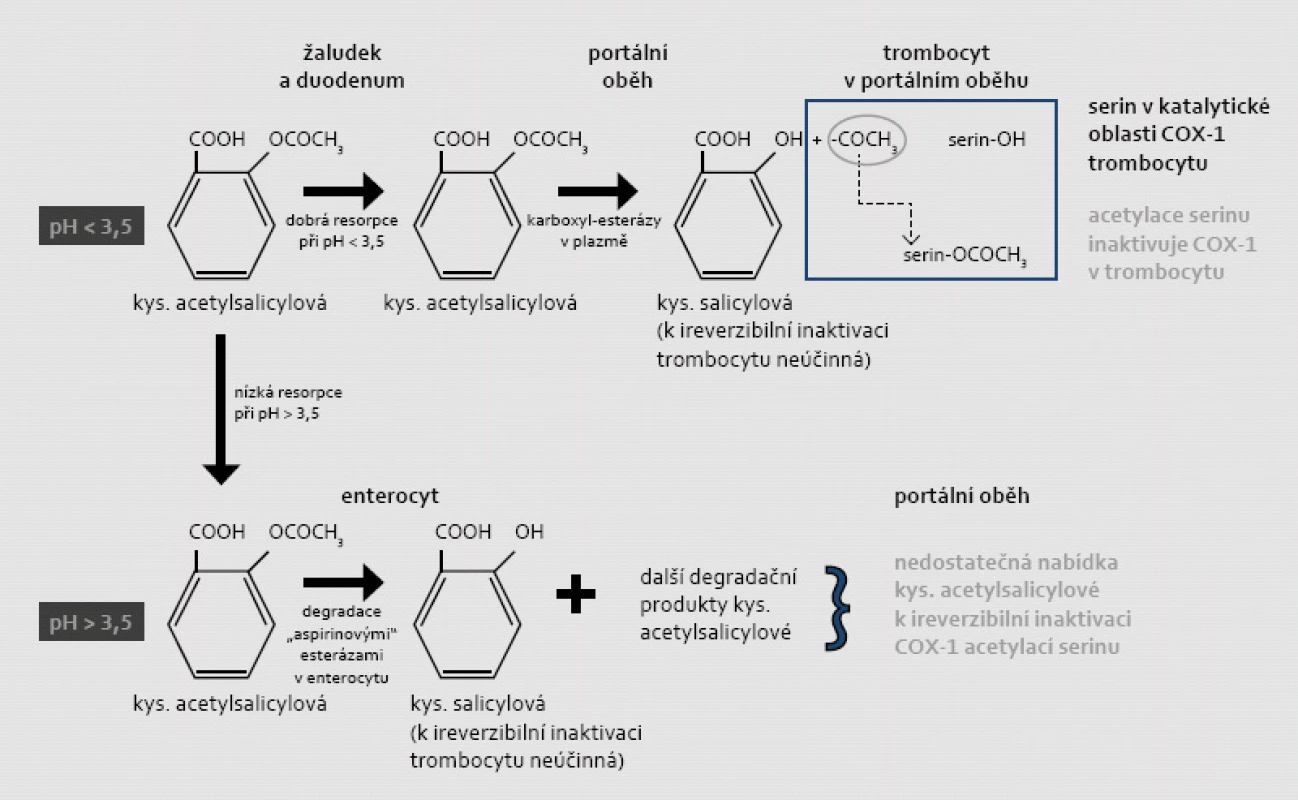
Nedojde-li k resorpci v žaludku, dochází k deacetylaci ASA „aspirinovými“ esterázami ve střevě na kyselinu salicylovou, která (jako lipofilní molekula) se již ve střevě vstřebá dobře. Díky degradaci esterázami a variabilní resorpcí v alkalickém prostředí je výsledná koncentrace ASA v portálním oběhu nepredikovatelná a celkově je výrazně snížená [4,5].
Setkáváme se tak se situací, kdy jeden efekt – ireverzibilní inhibice trombocytární COX-1 acetylací serinu – je způsoben presystémově v portálním oběhu vlastní mateřskou látkou (tj. ASA) a systémový antiflogistický a analgetický účinek pak metabolitem – kyselinou salicylovou. Při vzestupu pH nad 3,5 – jak je tomu při komedikaci ASA s inhibitory protonové pumpy či při aplikaci enterosolventních tablet ASA – vázne resorpce v žaludku a předpokládá se, že nabídka ASA v portálním oběhu zůstává v subterapeutické koncentraci.
Máme doklady o klinickém významu nižší dostupnosti, a tak i koncentraci ASA při podání v enterosolventní formě? Přímý dopad formou head-to-head na ovlivnění mortality a morbidity enterosolventní formy proti formě rozpustné v žaludku bohužel nemáme doložen. Máme však práce, které dokládají nižší efekt této lékové formy na potlačení aktivace trombocytů. Asi nejvýznamnější je práce z prestižního časopisu Circulation z tohoto roku [6]. U 400 zdravých osob byl porovnáván efekt 325 mg ASA ve dvou formách – rozpustné v žaludku a ve střevě, sledována byla agregace trombocytů optickým agregometrem po řadě podnětů. Zatímco po podání rychle rozpustné formy se nesetkali s rezistencí, při užití enterosolventní formy se objevila rezistence u téměř poloviny léčených (49 %). Podání ASA k trombocytům ex vivo však COX-1 inhibovalo a rezistence prokázána nebyla. Dlouhodobá léčba ecASA však vedla k vymizení rezistence. Studie doložila, že i po podání vyšší dávky (325 mg) enterosolventní formy ASA je rezistence častá, důvodem je nedostatečná dostupnost. Teprve opakované podání vyšší dávky ASA vede k vymizení rezistence. Rychle rozpustná forma ASA nevedla k selhání efektu léčby ani po jednorázovém podání. Studie ukázala, že léčba vyšší dávkou ecASA sice zprvu sníží dostupnost ASA a vede k nedostatečné terapeutické odpovědi, nicméně opakované podání tento handicap upraví. Bohužel studie nezodpověděla otázku, jak je ovlivněna rezistence menšími dávkami (100 mg) ecASA, které užíváme v Evropě.
Resorpcí ASA v dávce 100 mg v rychle se uvolňující a v enterosolventní formě se zabývala práce již téměř čtvrt století stará [7]. Biologická dostupnost kyseliny acetylsalicylové ve dvou enterosolventních formách byla poloviční či spíše třetinová proti dvěma standardním lékovým formám. Navíc, a to je nutno zdůraznit, vrcholová koncentrace, která je důležitá pro acetylaci COX-1, byla výrazně nižší. Obdobný nález, tj. významné snížení inhibice COX-1 (měřeno hladinou TXB2) při léčbě ASA v enterosolventních tabletách, byl doložen i jinými autory v prospektivní studii u nemocných s metabolickým syndromem [8]. Aplikace ecASA vedla k výraznějšímu snížení efektu, než k jakému vedla přítomnost metabolického syndromu či diabetu.
K zachování objektivity je nutno uvést i zcela čerstvou práci, která do tohoto konceptu nezapadá. Maďarští autoři použili elegantní metodu ke stanovení poměru acetylované a neacetylované formy COX-1 na základě monoklonálních protilátek [9]. U více než stovky dobrovolníků léčených po dobu sedmi dnů 100 mg acASA nalezli pouze acetylovanou formu COX-1, zatímco před léčbou pouze neacetylovanou formu. Nicméně tuto, jistě stěžejní práci, bude nutno ověřit.
Shrneme-li tyto argumenty, pak nemáme doklad, že ASA v enterosolventní formě je účinná v profylaxi aterotrombotických příhod. Máme naopak podezření, že inhibice trombocytů při této lékové formě nemusí být dostatečná. Farmakokinetické vlastnosti ASA podporují představu o nižší dostupnosti v nedostatečně kyselém prostředí. Jasnou odpověď na otázku, zda je enterosolventní forma ASA bezpečnější v profylaxi než rychle se uvolňující forma, dát můžeme – bezesporu ano. Nemůžeme však odpovědět i na otázku, zda je ecASA také stejně účinná. Zastáváme-li zásady evidence based medicine, pak z tohoto pohledu můžeme konstatovat – při užití rychle se uvolňujících forem ASA máme doklady o efektu na prognózu nemocných s vysokým kardiovaskulárním rizikem, při užití enterosolventních forem tuto jistotu nemáme. Nelze vyloučit, že příčinou poklesu toxicity ASA v této lékové formě je ztráta či snížení účinnosti. Kdyby nebylo kyselinou acetylsalicylovou léčeno jen v ČR asi milion osob, jevil by se problém malicherný. Při snížení mortality/morbidity o 20 % zabráníme devastaci zdraví tímto lékem nejméně 100 tisíci nemocných. Pokud by došlo ke snížení efektu, pak dopad na populaci nebude zanedbatelný.
Druhou otázkou je kombinace ASA s IPP. Zvýšení bezpečnosti a tolerance léčby kyselinou acetylsalicylovou je nepochybné, je však plně zachována také účinnost léčby? Léta je diskutován problém snížení bioaktivace klopidogrelu inhibitory protonové pumpy. O ten však zde nejde. Ukazuje se, že IPP ovlivňují též efekt ASA, mechanizmus je však odlišný. Jak bylo ukázáno, kyselina acetylsalicylová se absorbuje optimálně při pH < 3,5. Acidita žaludečních šťáv se však při léčbě IPP snižuje a pH stoupá na hodnoty 4 a vyšší. Jsme v situaci obdobné jako při aplikaci enterosolventních tablet. Dostupnost ASA v portálním i v systémovém oběhu klesá. Klesá však natolik, aby došlo ke klinicky významné ztrátě efektu?
Vzhledem k tomu, že dosavadní studie dokládající efekt ASA v profylaxi aterotrombotických chorob byly prováděny bez aplikace IPP, nelze pokládat komedikaci (tj. podávání jednoho léku k potlačení nežádoucího účinku druhého léku) IPP k ASA za postup prověřený z hlediska evidence based.
Prospektivní kontrolovanou studii zabývající se ovlivněním dopadu kombinace ASA s IPP na ovlivnění prognózy zatím nemáme. Retrospektivní analýzy – jak kohortních studií, tak kontrolovaných megastudií – však negativní dopad podporují.
První prací, která vzbudila pochybnosti o vhodnosti komedikace IPP k léčbě ASA, byla analýza Dánského národního registru nemocných po infarktu myokardu [10]. Do retrospektivní analýzy mortality a morbidity bylo vzato téměř 20 tisíc nemocných po prvním infarktu myokardu, kteří nebyli léčeni duální protidestičkovou léčbou, ale pouze ASA v dávce 75 mg (obr. 2). Ve skupině léčené ASA v kombinaci s IPP se objevilo 987 (22,9 %) příhod typu MACE, ve skupině neléčené IPP se těchto komplikací objevilo 2 378 (15,2 %). Při analýze rizika Coxovým modelem byl doložen vzestup kardiovaskulárního rizika o 46 % (HR = 1,46; 95% CI: 1,33–1,61; p < 0,001), absolutní riziko vzrostlo významně o 7,7 %. Vzhledem k tomu, že příhod bylo téměř 3 500, je analýza dostatečně robustní. Nemocní, kteří byli léčeni inhibitory H2 receptorů (kdy pH v žaludku nestoupá nad 3,5), neměli prognózu ovlivněnu.
Obr. 2. Metaanalýza efektu IPP v kombinaci s klopidogrelem (CAPRIE, CREDO), s ASA (CAPRIE), s duální léčbou klopidogrel a ASA (CREDO, TRITON, PLATO) či s ASA v kombinaci s prasugrelem či tikagrelorem (TRITON, PLATO). Do metaanalýzy bylo zařazeno 53 500 nemocných v rámci sekundární prevence aterotrombózy. Byl hodnocen efekt na primární ukazatel účinku, tj. kardiovaskulární mortalitu a morbiditu. Výsledky metaanalýzy těchto největších sekundárně preventivních studií sice ukazují významné zvýšení kardiovaskulární mortality/morbidity v jednotlivých studiích, výsledně však v průměru zůstává negativní ovlivnění prognózy komedikací s IPP na hranici významnosti. Ve studiích, kdy byl podáván klopidogrel (zpravidla spolu s ASA), je negativní efekt zřetelnější než při aplikaci samotné ASA či ASA v kombinaci s jinými inhibitory ADP receptorů. Efekt IPP byl ve všech studiích adjustován na přítomnost základních rizikových faktorů [10]. ![Metaanalýza efektu IPP v kombinaci s klopidogrelem (CAPRIE, CREDO), s ASA (CAPRIE), s duální léčbou klopidogrel a ASA (CREDO, TRITON, PLATO) či s ASA v kombinaci s prasugrelem či tikagrelorem (TRITON, PLATO). Do metaanalýzy bylo zařazeno 53 500 nemocných v rámci sekundární prevence aterotrombózy. Byl hodnocen efekt na primární ukazatel účinku, tj. kardiovaskulární mortalitu a morbiditu. Výsledky metaanalýzy těchto největších sekundárně preventivních studií sice ukazují významné zvýšení kardiovaskulární mortality/morbidity v jednotlivých studiích, výsledně však v průměru zůstává negativní ovlivnění prognózy komedikací s IPP na hranici významnosti. Ve studiích, kdy byl podáván klopidogrel (zpravidla spolu s ASA), je negativní efekt zřetelnější než při aplikaci samotné ASA či ASA v kombinaci s jinými inhibitory ADP receptorů. Efekt IPP byl ve všech studiích adjustován na přítomnost základních rizikových faktorů [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/88172c80b106b8f0f1a58bee7daa84ca.jpg)
Na základě této analýzy byl proveden rozbor dopadu podávání inhibitorů protonové pumpy ve čtyřech megastudiích s ASA, klopidogrelem a s kombinační léčbou [11]. Do této metaanalýzy bylo zařazeno 53 510 nemocných, jedna část byla léčena klopidogrelem (z rozhodující většiny v kombinaci s ASA), druhá buď samotnou ASA, či ASA v kombinaci s blokátorem ADP receptorů, jehož bioaktivace není ovlivněna IPP, tj. prasugrelem či tikagrelorem (obr. 3). Analýza efektu komedikace IPP s protidestičkovými léky asi v polovině studií dokládá negativní dopad na prognózu, nicméně souhrnná analýza je na samé hranici významnosti – pro kombinaci s klopidogrelem/ASA je riziko vyšší o 41 % (HR 1,41; 95% CI: 0,99–2,0), pro kombinaci s ASA je vyšší jen o 16 % (HR 1,16; 95% CI: 0,98–1,38). Tato čísla reflektují i skutečnost, že samotná ASA snižuje kardiovaskulární mortalitu/morbiditu asi o 20 %, duální protidestičková léčba ASA s klopidogrelem asi o 40 %. Slabinou metaanalýzy je skutečnost, že výsledek je na hranici významnosti. Na druhé straně význam naopak zvyšuje adjustace výsledků na nerovnoměrný výskyt rizikových faktorů v obou skupinách (IPP–/IPP+).
Obr. 3. Význam komedikace ASA s IPP na mortalitně/morbiditní ukazatele při retrospektivní analýze registru nemocných po IM z Dánského národního registru během prvých 12 měsíců po příhodě. Je patrná významně vyšší incidence sledovaných aterotrombotických příhod typu MACE ve skupině léčené současně IPP. Analyzována byla pouze podskupina nemocných neléčená klopidogrelem ani jinými inhibitory ADP receptorů. 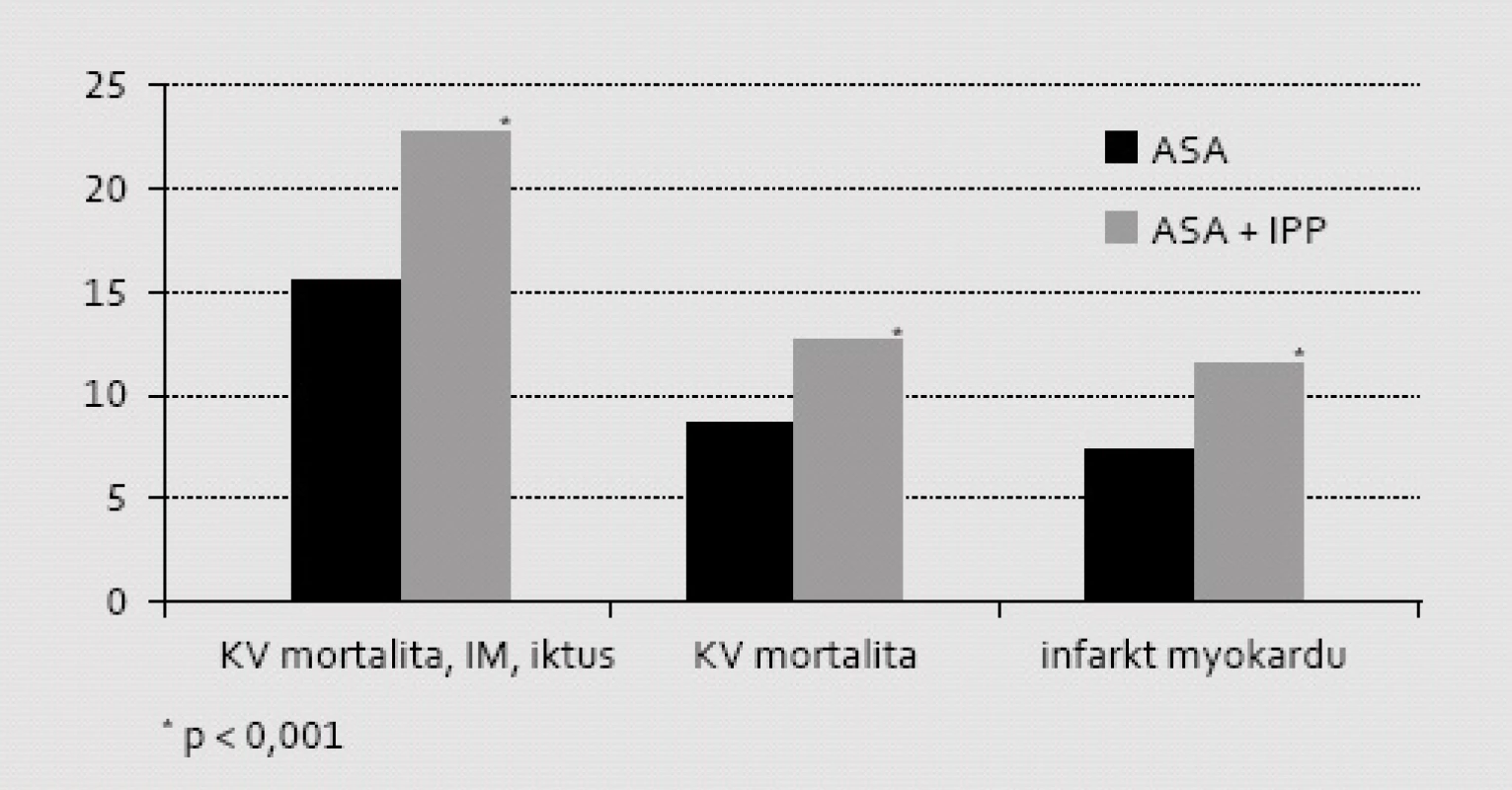
Celková interpretace dostupných výsledků není jednoznačná, ve hře je mnoho neznámých. Vedle ovlivnění biologické dostupnosti ASA různým pH v místě absorpce se mohou uplatnit ještě influxní a efluxní pumpy potencující přestup organických i anorganických molekul přes buněčné membrány. Konkrétně kyselina acetylsalicylová je substrátem dvou takovýchto pump – multidrug resistance protein-4 (MRP4) či organic anion transporting polypeptide 1B1 (OATP1B1) kódovaný genem SLCO1B1. Aktivita těchto polymorfních pump mimo jiné kontroluje koncentraci ASA v trombocytu či riziko vzniku aspirinem indukovaného peptického vředu [12,13]. Inhibitory protonové pumpy ovlivňují aktivitu H-K(+) ATP-ázy v žaludeční stěně, čímž mění nejen pH extracelulárně, ale také intracelulárně. Výše uvedené efluxní pumpy pak toto výsledné pH cytoplazmy významně ovlivní.
Můj komentář rozhodně není polemikou se závěry Doporučení. Ano, podávání enterosolventních tablet ASA a komedikace s inhibitory protonové pumpy vedou k významnému snížení výskytu „aspirinové“ toxicity. Možná však i k omezení či snad dokonce ke ztrátě protektivního efektu na výskyt aterotrombotických příhod. Tedy – s vaničkou možná vyléváme i dítě.
Vedle upozornění na rub problému by měl komentář přimět k zamyšlení nad složitostí situace a vést k velké pokoře. Naše znalosti jsou velmi kusé. Máme výsledky velkých studií a přenášíme populační data na jednotlivce. Méně si však uvědomujeme, že kvůli tisícům vzájemných odlišností nás všech nemusí to, co platí pro populaci, platit pro jednotlivce. Sám čím více poznávám složitosti vztahů, tím více jsem potěšen, když se povede léčbu správně cílit.
prof. MUDr. Jan Bultas, CSc.
Ústav farmakologie 3. LF UK v Praze
Ruská 87, 100 00 Praha 10
jan.bultas@lf1.cuni.cz
Zdroje
1. Lukáš M, Špičák J, Keil R. Doporučení Česté gastroenterologické společnosti pro podávání antiagregační terapie kyselinou acetylsalicylovou. Gastroent Hepatol 2013; 67(2): 90–94.
2. Wichliński L, Jankowski A, Krzyśko K. Bioavailability of acetylosalicylic acid. II. Comparative studies Polfa's Polopiryne and Bayer's aspirin. Acta Pol Pharm 1978; 35(1): 99–106.
3. Ayub S, Ali SA. Effect of certain tablet formulation factors on dissolution of aspirin tablets. J Pak Med Assoc 1979; 29(5): 91–92.
4. Pedersen AK, FitzGerald GA. Preparation and analysis of deuterium-labeled aspirin: application to pharmacokinetic studies. J Pharm Sci 1985; 74(2): 188–192.
5. Pedersen AK, FitzGerald GA. Dose-related kinetics of aspirin. Presystemic acetylation of platelet cyclooxygenase. N Engl J Med 1984; 311(19): 1206–1211.
6. Grosser T, Fries S, Lawson JA et al. Drug resistance and pseudoresistance: an unintended consequence of enteric coating aspirin. Circulation 2013; 127(3): 377–385.
7. Bochner F, Somogyi AA, Wilson KM. Bioinequivalence of four 100 mg oral aspirin formulations in healthy volunteers. Clin Pharmacokinet 1991; 21(5): 394–399.
8. Smith JP, Haddad EV, Taylor MB et al. Suboptimal inhibition of platelet cyclooxygenase-1 by aspirin in metabolic syndrome. Hypertension 2012; 59(3): 719–725.
9. Kovács EG, Katona E, Bereczky Z et al. New direct and indirect methods for the detection of cyclooxygenase 1 acetylation by aspirin; the lack of aspirin resistance among healthy individuals. Thromb Res 2013; 131(4): 320–324.
10. Charlot M, Grove EL, Hansen PR et al. Proton pump inhibitor use and risk of adverse cardiovascular events in aspirin treated patients with first time myocardial infarction: nationwide propensity score matched study. BMJ 2011; 342: d2690.
11. Dunn SP, Steinhubl SR, Bauer D et al. Impact of proton pump inhibitor therapy on the efficacy of clopidogrel in the CAPRIE and CREDO trials. J Am Heart Assoc 2013; doi: 10.1161/JAHA.112.004564.
12. Mattiello T, Guerriero R, Lotti LV et al. Aspirin extrusion from human platelets through multidrug resistance protein-4-mediated transport: evidence of a reduced drug action in patients after coronary artery bypass grafting. J Am Coll Cardiol 2011; 58(7): 752–761.
13. Shiotani A, Murao T, Sakakibara T et al. Association of SLCO1B1 1b with peptic ulcer amongst Japanese patients taking low-dose aspirin. Dig Liver Dis 2012; 44(3): 201–205.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2013 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Letní gastroenterologický koktejl
- Kvíz – známá osobnost
- Manometrie jícnu
- Vzácný typ achalázie jícnu III. typu řešený perorální endoskopickou myotomií (POEM)
- Biopsie nejsou dostatečné pro přesnou diagnostiku neoplazie u pacientů s Barrettovým jícnem
- Úspěšná endoskopická léčba makroskopicky pokročilého adenokarcinomu jícnu u rizikového pacienta
- Etiopatogeneze chronické pankreatitidy
- Inhibitory protonové pumpy: vedlejší účinky a interakce
- Experimentální model perianální píštěle na malém laboratorním zvířeti
- Guidelines for the administration of biological therapy in patients with inflammatory bowel diseases – the amendment to the 2nd editon
- Současnost a budoucnost v léčbě Crohnovy nemoci
- Ulcerózní kolitida komplikovaná tromboembolizmem a toxickým megakolon – existuje souvislost toxického megakolon s antikoagulační terapií?
- Léčba těžké ataky ulcerózní kolitidy – komentář ke kazuistice dr. Mokré
- Problém nemusí být tak jednoduchý, jak se na první pohled jeví – komentář k Doporučení ČGS pro podávání antiagregační terapie kyselinou acetylsalicylovou
- Májové hepatologické dny
- Ostrava Live Endoscopy (OLE) 2013
- Správná odpověď na kvíz
- Autodidaktický test: klinická a experimentální gastroenterologie
- Pentasa Sachet 2 g
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Manometrie jícnu
- Pentasa Sachet 2 g
- Inhibitory protonové pumpy: vedlejší účinky a interakce
- Vzácný typ achalázie jícnu III. typu řešený perorální endoskopickou myotomií (POEM)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



