-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Biopsie nejsou dostatečné pro přesnou diagnostiku neoplazie u pacientů s Barrettovým jícnem
Biopsy is inadequate for precise diagnosis of neoplasia in patients with Barrett's esophagus
Endoscopic resection (ER) is a diagnostic and therapeutic method of treatment of early esophageal neoplasia. Diagnosis of neoplasia is usually based on forceps biopsy. However, it is not clear whether the diagnostic agreement between forceps biopsies and ER is sufficient.
Aim:
To compare diagnostic yield of targeted biopsies compared with ER in patients with early esophageal neoplasia, and to analyze histological diagnosis and the advancement of lesions based on the macroscopic type.Method:
69 patients with 78 suspected lesions of the esophagus (eight women and 61 men, average age 63 years, range 34–85) undergoing both targeted biopsies with trimodal endoscopy, and ER.Results:
Initial diagnoses of targeted biopsies were: 17× early adenocarcinoma (EAC), two squamous carcinoma (SCC), 36× high-grade dysplasia (HGD), and 23× low-grade dysplasia (LGD). Compared to prior forceps biopsies, histopathology from ER specimen was the same in 45 lesions (58%) and changed in 33 lesions (42%). In 21 samples (63%) diagnosis has been up-staged after ER. In 12 samples (37%) diagnosis has been down-staged. Macroscopic lesion type 0-IIa (slightly protruding lesion) and 0-IIb (flat lesion) were the most frequent in our study. From a total of 39 cancers (diagnosis based on ER), 20 (51%) were in lesion type 0-IIa.Conclusion:
Targeted biopsies are not sufficient for an accurate diagnosis of esophageal cancer. ER should be preferred as a diagnostic method in patients with suspected esophageal neoplasia.Key words:
Barrett’s esophagus – neoplasia – targeted biopsy – endoscopic resection
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
19. 7. 2013Accepted:
9. 8. 2013
Autoři: M. Stefanová 1; I. Tučková 2; J. Malušková 3; M. Kollár 3; J. Špičák 4; J. Martínek 4
Působiště autorů: Interní oddělení, Nemocnice Na Františku, Praha 1; Oddělení patologie, ÚVN, Praha 2; Patologické oddělení, IKEM, Praha 3; Klinika hepatogastroenterologie, IKEM, Praha 4
Vyšlo v časopise: Gastroent Hepatol 2013; 67(4): 264-270
Kategorie: Klinická a experimentální gastroenterologie: původní práce
Souhrn
Endoskopická resekce (ER) je diagnostická i léčebná metoda časných neoplazií jícnu. Většina pacientů má diagnózu neoplazie stanovenu na základě výsledku klešťových biopsií. Není zcela jasné, jaká je diagnostická shoda mezi klešťovými biopsiemi a ER.
Cíl studie:
Srovnání diagnostické přesnosti vyšetření cílených biopsií vs vyšetření endoskopických resekátů. Analýza histologické diagnózy a pokročilosti léze na základě makroskopického typu.Metoda:
69 pacientů se 78 suspektními lézemi jícnu (osm žen, 61 mužů, průměrný věk 63 let, rozmezí 34–85) podstoupilo vyšetření trimodální endoskopií s cíleným odběrem biopsií. Následně byla provedena endoskopická resekce (ER) těchto lézí.Výsledky:
Vstupní diagnózy z cílených biopsií byly: 17× časný adenokarcinom (EAC), 2× spinocelulární karcinom (SCC), 36× vysoký stupeň dysplazie (HGD), 23× lehký stupeň dysplazie (LGD). Diagnóza na základě ER byla s biopsiemi shodná u 45 lézí (58 %). Diagnóza se lišila od vstupních biopsií u 33 lézí (42 %). „Upstaging“ diagnózy (tj. diagnóza směrem k vyššímu stupni dysplazie) po ER byl prokázán ve 21 vzorcích (63 %). „Downstaging“ diagnózy k nižšímu stupni dysplazie byl prokázán ve 12 vzorcích (37 %). V našem souboru byly nejčastěji zastoupeny makroskopické léze typů 0-IIa (lehce prominující plochá léze) a 0-IIb (plochá léze). Z celkového počtu 39 karcinomů (diagnóza na základě ER) byly nejčastěji zastoupeny léze typu 0-IIa (20; 51 %).Závěr:
Cílené biopsie nejsou dostatečné pro přesnou diagnózu jícnových neoplazií. ER by proto měla být preferovanou diagnostickou metodou u pacientů se suspektní neoplazií.Klíčová slova:
Barrettův jícen – neoplazie – cílené biopsie – endoskopická resekce
Endoskopická resekce je zavedenou metodou léčby časných neoplazií u pacientů s Barrettovým jícnem (BJ) [1]. Vyšetření resekátu patologem umožňuje nejen přesnou diagnózu (dysplazie, karcinom), ale též staging onemocnění (grading, lymfangioinvaze, arterioinvaze, nádorová disociace a posouzení laterálních okrajů) [2]. U většiny pacientů s dysplazií nebo časným karcinomem v terénu BJ je diagnóza stanovena na základě biopsií, ať již cílených v případě přítomnosti léze nebo náhodných, které se odebírají při kontrolních endoskopiích.
U pacientů, kteří mají viditelnou a prominující lézi, je indikovaná endoskopická resekce (a event. předtím endosonografické vyšetření) nezávisle na výsledku histologického vyšetření bioptických vzorků. Na druhou stranu u pacientů, kteří nemají jednoznačně viditelnou prominující lézi, bývá další postup (typ léčby – např. RFA nebo observace) stanoven na základě výsledků bioptického vyšetření, a to i včetně pacientů s plochými lézemi typu 0-IIb [3].
Nedávno bylo publikováno sdělení, které přineslo zprávu o rozvoji adenokarcinomu jícnu u pacientů, kteří byli ošetřeni radiofrekvenční ablací pro vysoký stupeň dysplazie v terénu Barrettova jícnu [4]. Nabízí se spekulace, že tito pacienti neměli ve chvíli ošetření dysplazii, ale již karcinom, který však nebyl detekován standardními biopsiemi. Pokud tento problém zobecníme, je otázkou, zda biopsie z Barrettova jícnu (a z jícnových lézí obecně) jsou dostatečné k přesné diagnostice. Je logické, že informace po vyšetření resekátu z ER poskytuje mnohem více informací oproti malým bioptickým vzorkům. Nicméně přesnost diagnózy nebyla významněji zpochybněna, byť dvě retrospektivní studie již v minulosti ukázaly, že histopatologické vyšetření resekátu přináší větší shodu mezi patology oproti vyšetření bioptických vzorků, a tyto studie naznačily, že diagnostický přínos ER je větší oproti biopsiím [5,6].
V této souvislosti je též zajímavá otázka predikce diagnózy (dysplazie, slizniční karcinom, invazivní karcinom) na základě makroskopického typu léze.
Cílem naší retrospektivní analýzy s prospektivní kolekcí údajů bylo porovnat diagnostickou přesnost cílených biopsií s přesností vyšetření resekátů a dále analyzovat histologickou diagnózu a pokročilost léze na základě makroskopického typu.
Metodika práce
Design studie a pacienti
Jedná se o retrospektivní studii s prospektivně sbíranými daty. Studie probíhala na dvou pracovištích: nejprve na Interní klinice 1. LF UK a ÚVN Praha a v důsledku odchodu řešitelského kolektivu byla dokončena na Klinice hepatogastroenterologie IKEM. Studie probíhala v období od roku 2009 do 2013. Do analýzy byli zahrnuti všichni pacienti s makroskopicky patrnou lézí jícnu s diagnózou neoplazie (dysplazie nízkého nebo vysokého stupně, karcinom). Převážnou většinu tvořily léze u pacientů s Barrettovým jícnem, nicméně do analýzy jsme zařadili i dva pacienty s dlaždicobuněčnou neoplazií.
Vstupní endoskopie
Všichni pacienti byli vyšetřeni tzv. trimodální endoskopií kvalitním endoskopem Q 260 FZ s autofluorescencí, NBI a zvětšením (Olympus Medical Co., Tokio, Japonsko) s plastikovým nástavcem na konci tubusu. Vyšetření bylo provedeno u všech pacientů ve standardní lokální anestezii (Xylokain 10% – AstraZeneca AB, S-151 85 Södertälje, Švédsko), u některých pacientů v mírné sedaci (Dormicum 2,5–5 mg i.v. – Roche s.r.o., Praha, Česká republika).
Vstupní endoskopie byla prováděna dvěma zkušenými lékaři (M. Stefanová, J. Martínek). Po zavedení endoskopu jsme sliznici jícnu opláchli vodou nebo mukolytikem. Následně jsme detailně prohlíželi jednotlivé metaplastické jazýčky v obraze NBI, AFI a zvětšení a snažili se detekovat a blíže charakterizovat danou lézi (obr. 1).
Obr. 1. Patologická vaskulární kresba u LGD (NBI a ZOOM zobrazení). Fig. 1. Irregular vessels in LGD (NBI, ZOOM). 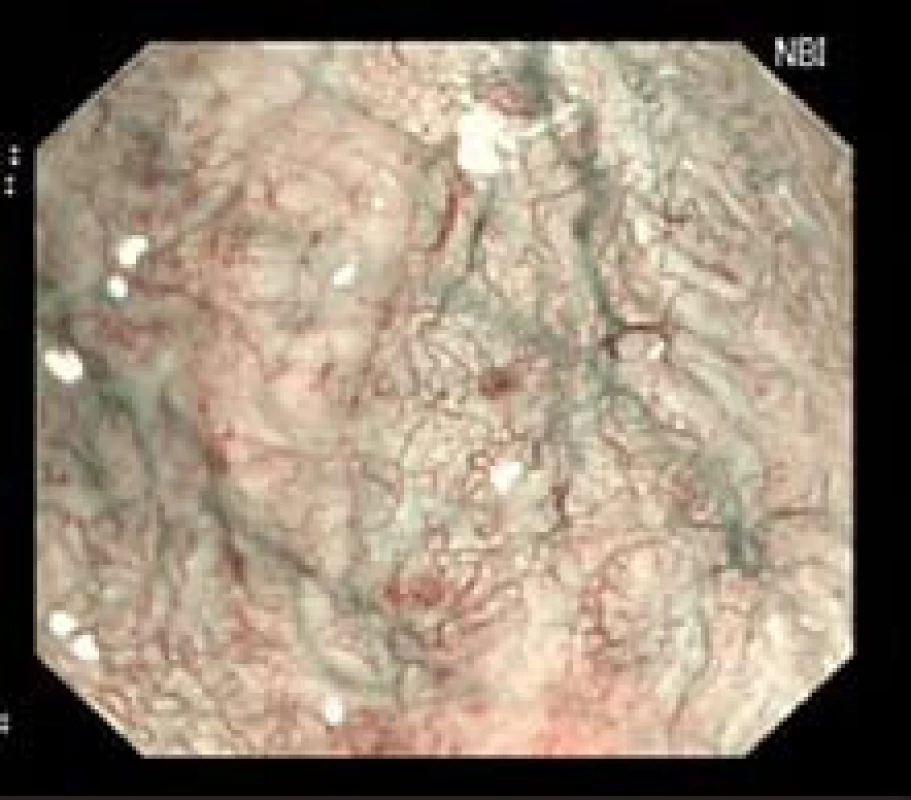
Všechny makroskopicky suspektní léze byly popsány podle Pařížské klasifikace [7] a byly cíleně bioptovány (obr. 2). K odběru biopsií byly použity různé typy velkokapacitních kleští: SwingJaw FB 220K Olympus (Olympus Medical Co., Tokio, Japonsko), BIO 2 series with spike Medwork BIO2-F1-18-180 (Medwork GmbH, Höchstadt/Aisch, Německo), Oval cups with spike Medi-Globe GBF-02-23-180 (Medi-Globe GmbH, Rosenheim, Německo) nebo jumbo kleště Radial Jaw 4 (Boston Scientific, Natick, Mass, USA). Cílené biopsie byly odebrány metodou „turn and suck“. Při této metodě je léze nacentrovaná na střed zorného pole, endoskop je napřímený a při zavírání bioptických kleští se aplikuje aspirace. Místa odběrů biopsií byla zdokumentovaná.
Obr. 2. Plochá léze 0-IIa dle Pařížské klasifikace – časný karcinom v terénu BJ. Fig. 2. Flat lesion 0-IIa according Paris classification – early adenocarcinoma in BE. 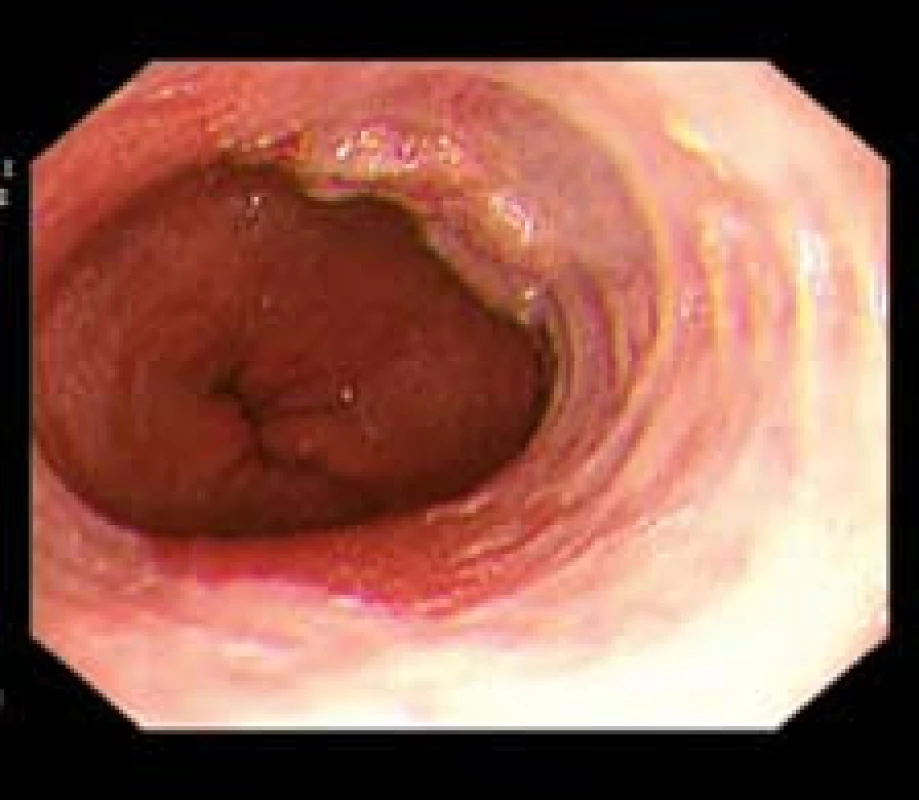
Endoskopická resekce
Endoskopická resekce byla provedena v rozmezí 7–25 dnů po trimodální endoskopii multiband technikou s ligátorem (EMRL) jedním lékařem (J. Martínek). Všechny výkony byly provedeny v hluboké analgosedaci či v celkové anestezii s přítomností anesteziologa. Patologická léze byla nasáta do ligátoru COOK (Four/Six shooters, Cook Endoscopy, Winston-Salem, NC) a zaškrcena gumičkou (obr. 3). Tím byl vytvořen pseudopolyp, který byl následně snesen polypektomickou kličkou (Olympus SD210-25, Olympus Medical Co., Tokio, Japonsko) (obr. 4). Po resekci léze byl vzorek extrahován buď nasátím do plastového nástavce, nebo síťkou. Vzorek byl vypnut a přišpendlen na korkovou destičku resekční plochou dolů, vložen do 10% formaldehydu a odeslán k patologickému zpracování (obr. 5). U jednoho pacienta s dlaždicobuněčnou lézí typu 0-IIb byla namísto piece-meal endoskopické resekce provedena endoskopická submukózní disekce (obr. 6A–C).
Obr. 3. Endoskopická resekce technikou s ligátorem. Fig. 3. Endoscopic resection using a ligator. 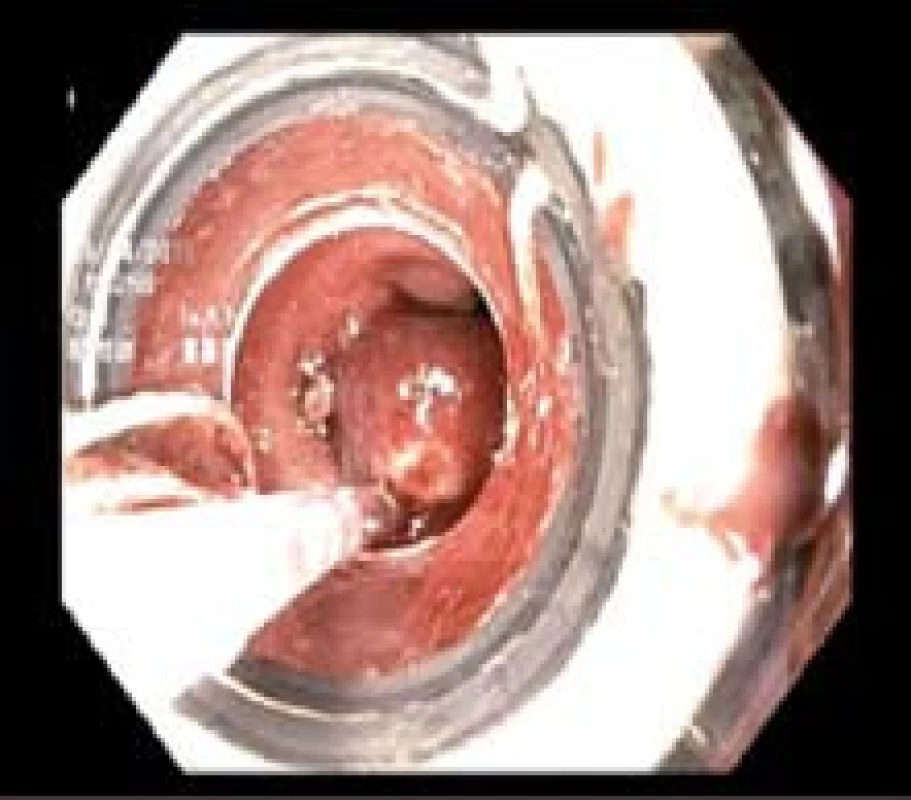
Obr. 4. Spodina po endoskopické resekci. Fig. 4. Resected area after endoscopic resection 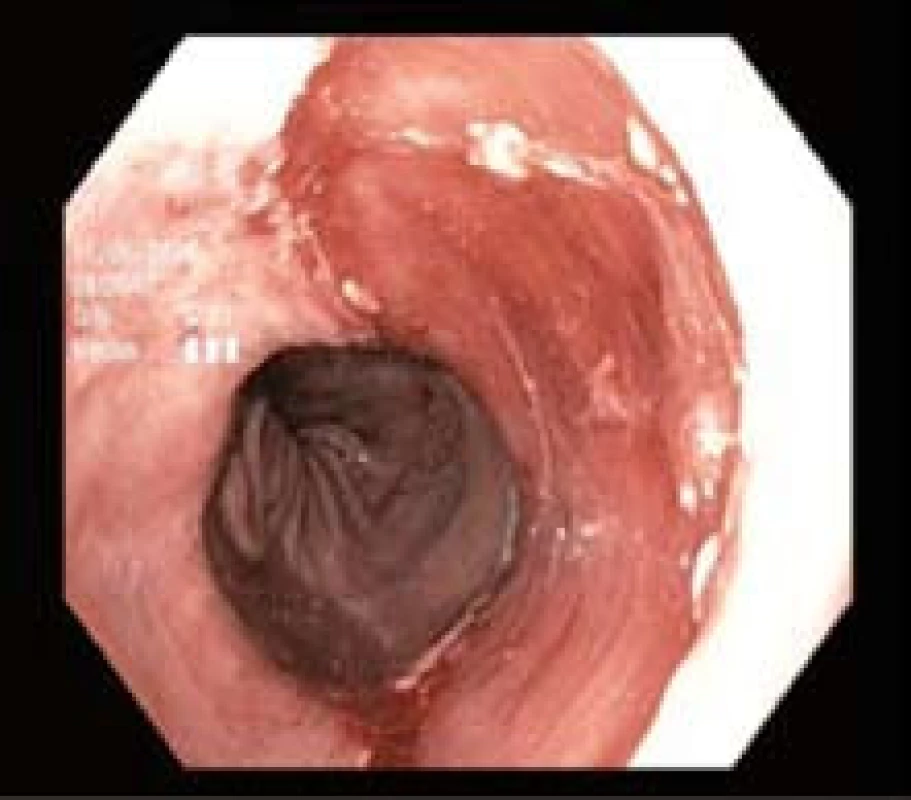
Obr. 5. Vzorek po endoskopické resekci vypnutý na korek. Fig. 5. ER specimen. 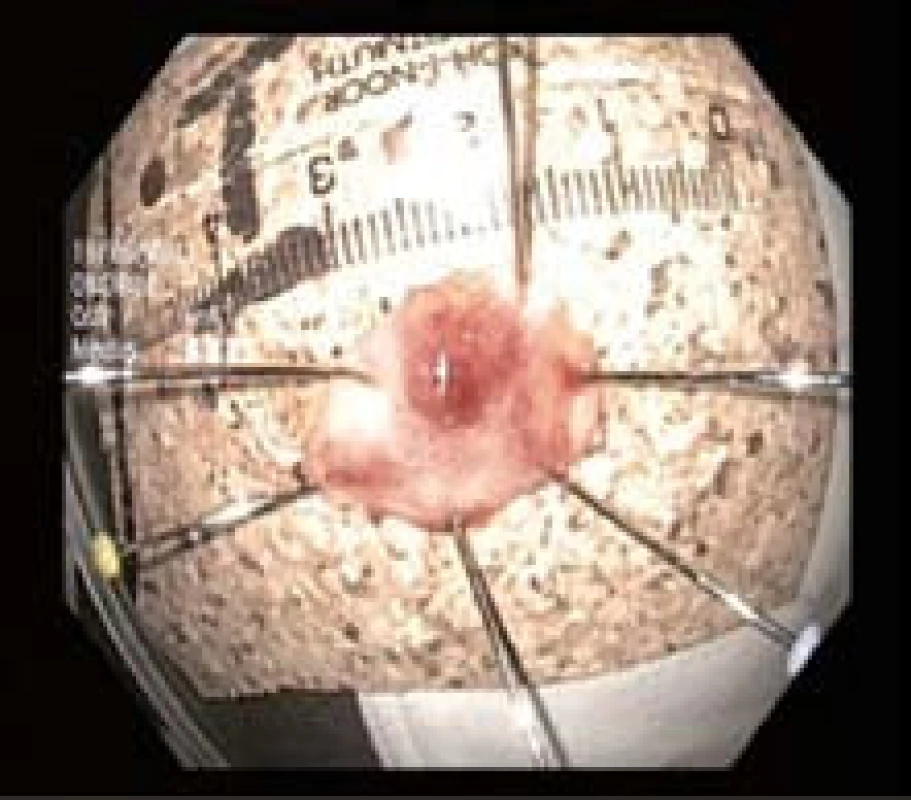
Obr. 6A. Spinocelulární karcinom jícnu – barvení Lugolovým roztokem. Fig. 6A. Spinocelular carcinoma of esophagus – Lugol dye. 
Obr. 6B. Endoskopická submukózní disekce – cirkulární řez kolem neoplazie. Fig. 6B. Endoscopic submucosal dissection – circular cut around neoplasia. 
Obr. 6C. Spodina po endoskopické submokózní disekci. Fig. 6C. Resected area after endoscopic submucosal dissection. 
Histopatologické zpracování
Všechny vzorky byly fixované vodným roztokem formaldehydu. Fixovaná tkáň byla odvodněna etanolem. Pro usnadnění pronikání parafínu do tkáně se vzorek prosytil organickým rozpouštědlem (xylenem). Po zalití tkání do parafínových bloků byly vzorky krájeny na tenké řezy o síle cca 2–4 µm a umístěny na podložní sklo. Poté byly vzorky histologicky barveny.
Při hodnocení bioptických i ER vzorků bylo použito barvení HE (hematoxylin-eozin), ALP (PAS s alciánovou modří) a saturnová červeň k průkazu amyloidu. Cílené bioptické vzorky a ER vzorky hodnotil na obou pracovištích vždy specializovaný jícnový patolog.
Nízký stupeň dysplazie (LGD) byl charakterizován mírnou nepravidelností architektoniky žlázek, mírně zvýšeným poměrem jádra a cytoplazmy, různými tvary buněčných jader a nepřítomností jadérek.
Vysoký stupeň dysplazie (HGD) byl charakterizován výraznou nepravidelností žlázových struktur a cytologickými nepravidelnostmi, hyperchromatickými jádry různého tvaru a velikosti, výrazně nepravidelnou jadernou membránou a nepřítomností jadérek.
Karcinom byl charakterizován ztrátou vyzrávání epitelu, nepravidelnými jádry s přítomností mitóz a úbytkem cytoplazmy ve prospěch jádra. Karcinom na rozdíl od dysplazie již vykazuje infiltrativní růst [8].
Statistické hodnocení
V naší studii jsme použili základních metod deskriptivní statistiky. Data jsou udávána buď ve formě průměru se standardní odchylkou, nebo mediánu s příslušnými hranicemi. Vzhledem k povaze studie jsme nepoužili žádných statistických testů k ověřování hypotéz.
Výsledky
Soubor pacientů
Celkem jsme ve studii diagnostikovali 78 makroskopicky suspektních lézí u 69 pacientů (61 mužů, 8 žen, průměrný věk 63 let v rozmezí 34–85 let). Diagnóza z biopsií (tab. 1) byla následující: 23× LGD, 36× HGD, 17× časný adenokarcinom a 2× spinocelulární karcinom.
Tab. 1. Histologie z ER. Shoda, či neshoda v diagnóze mezi biopsiemi (sloupec) a ER (řádek) – tučné číslice značí shodu mezi biopsiemi a ER (event. ESD). Tab. 1. Histology of ER. An agreement and disagreement in diagnosis between biopsies (column) and ER (row) – an agreement between biopsies and ER (event. ESD) is marked with bold numbers. 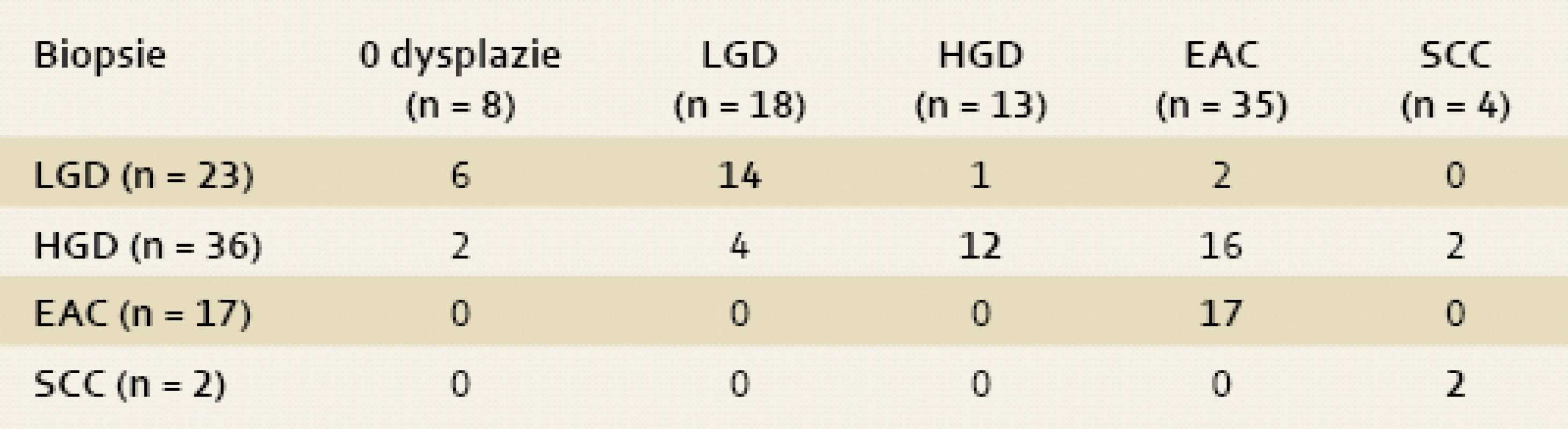
Korelace diagnózy mezi biopsiemi a ER
Diagnóza z endoskopické resekce se lišila od vstupních biopsií u 33 vzorků (42 %) (graf 1). Diagnóza směrem k vyššímu stupni dysplazie nebo karcinomu (tj. „up-staging“) po ER byla provedena 21 vzorcích (63 %). Diagnóza k nižšímu stupni dysplazie (nebo bez dysplazie, tzv. „down-staging“) byla provedena po ER ve 12 vzorcích (37 %) (tab. 1).
Graf 1. Shoda a neshoda v diagnóze mezi biopsiemi a ER/ESD („up-staging“ a „down-staging“ diagnózy). Graph 1. An agreement and disagreement between biopsies and ER/ESD („up-staging“ a „down-staging“). 
Největší rozdíl v diagnóze mezi biopsiemi a endoskopickou resekcí byl u pacientů s bioptickým nálezem HGD. Celkem u 16 takových pacientů byla po resekci změněna diagnóza na karcinom, což u části nemocných změnilo další léčebný postup. U dvou pacientů došlo dokonce k zásadní změně diagnózy z LGD v biopsiích na karcinom po endoskopické resekci.
Histologie a makroskopická klasifikace suspektních lézí
Nejvíce makroskopických lézí bylo typu 0-IIa a 0-IIb, ostatní typy lézí se vyskytovaly u menšího počtu pacientů. Shoda mezi cílenými biopsiemi a endoskopickou resekcí byla u lézí 0-IIa (63 %) a lézí 0-IIb (62 %) podobná. Velice důležité je zjištění, že u čtyř pacientů s plochou lézí 0-IIb byla diagnóza HGD překlasifikována po resekci na časný karcinom. U všech lézí 0-IIc (celkem 4) byla diagnóza z biopsií po endoskopické resekci přehodnocena směrem k horší dysplazii či karcinomu (graf 2).
Graf 2. Shoda a neshoda mezi biopsiemi a ER/ESD na základě makroskopického typu léze. Graph 2. An agreement and disagreement between biopsies and ER/ESD based on macroscopic type of lesion. 
Nejvíce karcinomů bylo diagnostikováno v lézích typu 0-IIa (20 z 39, 51 %), nejvíce LGD bylo zastiženo v lézích typu 0-IIb (13 z 18, 72 %). V ostatních případech nesouvisel makroskopický vzhled léze s jednotlivými typy neoplazie (graf 3).
Graf 3. Zastoupení typů neoplazií v závislosti na makroskopickém vzhledu léze. Graph 3. Type of neoplasia depending on macroscopic appereance of lesions. 
Makroskopický nález nepredikoval přítomnost nebo absenci submukózní invaze.
Diskuze
Endoskopická léčba (ER/ESD, radiofrekvenční ablace) je v současnosti metodou volby v přístupu k pacientům s časnými neoplaziemi jícnu. Endoskopická resekce je vhodná u všech pacientů s viditelnými lézemi. Jedná se o vynikající stagingovou metodu, která mimo diagnózy určí i další charakteristiky (hloubku invaze, angioinvazi apod.), na základě kterých se pak rozhodujeme, zda je, nebo není nutná chirurgická léčba [1,2]. Z toho plyne, že ER může být u části pacientů i kurativní metodou. U některých pacientů lze namísto ER uvažovat o provedení endoskopické submukózní disekce, která je v jícnu velice náročná a vcelku riziková. Radiofrekvenční ablace je metodou, která je užívána jednak u pacientů s dysplastickými změnami (např. HGD v terénu Barrettova jícnu, bez viditelné léze) nebo jako doplňující ošetření u pacientů po ER/ESD, kdy není nutná chirurgická léčba (např. ošetření zbytkové metaplastické sliznice BJ po ER karcinomu).
Lze tvrdit, že kombinace ER/RFA je tedy zlatým standardem léčby časných neoplazií jícnu, většinou vycházejících z terénu Barrettova jícnu. Tato léčba vede k eradikaci neoplazie u 90 % pacientů a procento recidiv je téměř nulové [9]. U pacientů s dysplazií bez viditelné léze je indikována ablační léčba (RFA), zvláště u pacientů s delšími segmenty, kde endoskopická resekce nebo disekce trvá déle a je zatížena komplikacemi, zejména vznikem stenóz [10].
V nedávné době bylo publikováno alarmující sdělení amerických autorů o detekci adenokarcinomu u tří pacientů, kteří podstoupili RFA pro HGD v terénu Barrettova jícnu. Karcinom vznikl během několika měsíců po skončení léčby RFA [4]. Lze se domnívat, že pacienti mohli mít karcinom již ve chvíli, kdy se prováděla RFA. Tento karcinom nebyl nejspíš zachycen při endoskopickém vyšetření s biopsiemi. Proč tyto karcinomy nebyly zachyceny, je spekulativní, nicméně zde mohla hrát roli „méně“ kvalitní diagnostická endoskopie.
Důvodem věřit, proč byl karcinom přítomný ve chvíli ošetření RFA, je přítomnost karcinomu v resekátech u pacientů s BJ a HGD, kteří bývali v minulosti indikováni k ezofagektomii [11].
Na základě této zprávy jsme se rozhodli provést naši retrospektivní analýzu shody diagnózy bioptických vzorků a endoskopických resekátů. Nalezli jsme, že u 42 % lézí byla bioptická diagnóza odlišná od diagnózy stanovené vyšetřením resekátu. Neshody byly přítomny i u plochých lézí, kde biopsie diagnostikovaly HGD a ER již karcinom. Tito pacienti mohli být s klidným svědomím indikováni k RFA – a pokud by tomu tak bylo, mohli jsme s odstupem několika měsíců diagnostikovat karcinom.
Zde je asi hlavní poselství naší studie – biopsie, byť kvalitně odebírané kvalitními kleštěmi (tudíž ne obyčejnými kleštěmi, které jinak většina endoskopistů k odběru biopsií z jícnu používá), nevedou k přesné diagnóze u 42 % lézí.
Jiní autoři sledovali v různě postavených studiích shodu mezi biopsiemi a vyšetřením resekátů z různých hledisek. Wani et al nalezli větší shodu mezi patology, pokud vyšetřovali resekáty oproti vyšetření bioptických vzorků [6]. V této studii nebyla hodnocena shoda, nebo neshoda diagnózy jako ve studii naší, která má unikátní design v tom, že každá léze byla nejprve bioptována a teprve posléze byla resekována. Studii, která se velice podobá naší, provedli Hull et al. Nevýhodou je, že korelovali výsledky biopsií, které byly odebírány na různých pracovištích, s resekáty, které byly provedeny na jediném pracovišti, a navíc hodnotili nejen jícnové, ale i žaludeční léze [5]. V naší studii jsme všechny biopsie prováděli při trimodální endoskopii sami. K čemu Hull et al došli? Jednoznačně považují ER za diagnosticky přínosnější oproti biopsiím, 39 % případů nemělo shodu mezi biopsií a resekcí. U celkem 18 pacientů s HGD v biopsiích byla tato potvrzena jen u 7 pacientů, 10 pacientů mělo již karcinom a u jednoho pacienta došlo k down-stagingu na LGD. Tedy výsledky velice podobné naší analýze.
Na rozdíl od HGD byla specificita diagnózy karcinomu na základě biopsií 100 %. Tj. každý karcinom v biopsiích byl potvrzen v resekátu. Podobné výsledky přinesla i výše zmíněná studie Hulla et al.
Diskrepance mezi ER a biopsiemi může být způsobena několika příčinami. Na prvním místě je nepochybně velikost a dobrá orientace vzorku po endoskopické resekci. Vzorky po ER obsahují ve většině případů submukózu, a tudíž jsou lépe hodnotitelné. Další příčinou tohoto rozdílu je kvalita bioptických vzorků, která je dána bioptickými kleštěmi a endoskopickou technikou při odběru biopsií. V naší studii jsme používali ve většině případů kvalitní velkokapacitní nebo jumbo kleště.
Správná endoskopická technika při odběru biopsií z jícnu rovněž ovlivňuje kvalitu vzorku, v naší studii jsme používali doporučovanou „turn and suck“ techniku. Při odběru cílených biopsií touto technikou jsou vzorky větší, a tudíž kvalitnější. S vývojem moderních endoskopů s lepšími zobrazovacími možnostmi se při odběru biopsií při dispenzárních endoskopických kontrolách stále více diskutuje upřednostnění metody „see more, biopsy less“ před standardními náhodnými biopsiemi [12]. To znamená nejprve vyhledat suspektní léze a ty následně cíleně bioptovat (nebo spíše rovnou resekovat).
Dále jsme se zaměřili na makroskopický typ lézí a zda nám tento typ může predikovat histologickou diagnózu či staging [13]. V našem souboru jsme nejčastěji detekovali léze typu 0-IIa (62 %) a 0-IIb (63 %). Nejvíce karcinomů bylo zastoupeno u lézí typu 0-IIa. V našem souboru bylo relativně málo lézí typu 0-IIa + c (4 %), který byl nejčastějším typem léze ve studii Peterse et al [14]. Rozdíl bude nejspíš vysvětlitelný jiným přístupem ke klasifikaci lézí (které jsme v naší práci všechny opětovně na videu revidovali), nepředpokládáme, že by nizozemská populace s BJ byla rozdílná od populace české. Na základě našich dat lze říci, že makroskopická charakteristika (nebo typ léze) nepředpovídá tíži histologické neoplazie, nepředpovídá ani event. invazi do submukózy. Jiné charakteristiky, které jsme v naší práci nehodnotili, mohou k takové predikci přispět (např. hodnocení léze pomocí NBI a ZOOM přináší informace daleko přesnější). Nicméně predikce na základě pouhé endoskopie je zrádná, jak popíšeme u následujících dvou pacientů.
Provedli jsme např. endoskopickou resekci u pacienta s makroskopicky pokročilou neoplazií (0-Is, obr. 7A, 7B), histologie ukázaly jen HGD, ale k našemu překvapení ani kompletní vyšetření resekátu neprokázalo předpokládaný karcinom. U jiného pacienta jsme na základě endoskopie diagnostikovali HGD (vcelku překvapivě, neboť i segment Barrettova jícnu nevykazoval zásadně podezřelé znaky) a v resekátu jsme diagnostikovali invazivní slizniční karcinom s invazí do hluboké části sliznice m4 (obr. 8). Lze tvrdit, že většina neoplastických lézí, včetně karcinomů, je však menšího rozsahu, max. do 2 cm. Větší karcinomy jsme vídali zřídka.
Obr. 7A. Makroskopicky pokročilá léze v jícnu, biopsie a překvapivě i ER prokázaly jen HGD. Fig. 7A. Macroscopic advanced lesions in the esophagus. Only HGD was found on biopsy and ER. 
Obr. 7B. Kontrola za měsíc po endoskopické resekci, zhojený distální jícen. Fig. 7B. One month after endoscopic resection, distal esophagus without any lesion remains. 
Obr. 6. Patologická léze 0-IIb dle Pařížské klasifikace s HGD v biopsiích. Ve vzorku z ER byl potvrzený časný adenokarcinom s hlubokou slizniční invazí. Fig. 8. Flat lesion 0-IIb with HGD on biopsy and EAC in ER specimen. 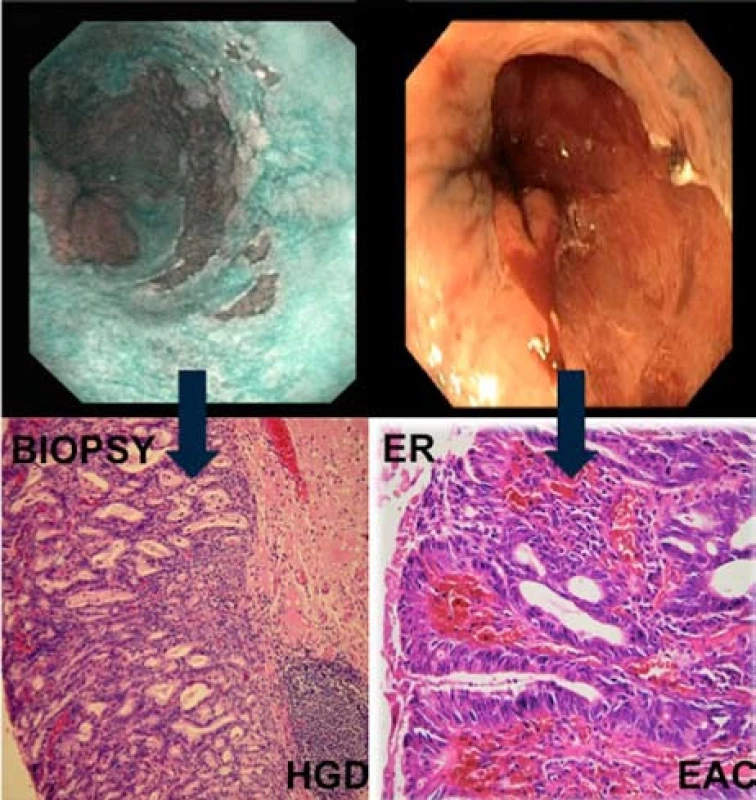
Naše analýza zahrnovala i čtyři pacienty s dlaždicobuněčnou neoplazií, kdy u jednoho pacienta byl časný karcinom odstraněn endoskopickou submukózní disekcí. I zde jsme nalezli dva pacienty, kde biopsie ukazovaly HGD, zatímco resekát diagnostikoval již karcinom. U jedné mladé pacientky (35 let) se jednalo o pokročilý karcinom se sm2 invazí, pacientka byla operována. Na tomto místě bychom chtěli připomenout výhodu a v podstatě nezbytnost barvení Lugolovým roztokem u rizikových pacientů (jejichž definice není jednoznačná), neboť bez této chromodiagnostiky je detekce a hlavně ohraničení dlaždicobuněčných lézí téměř nemožné.
Naše výsledky též poukazují na obtížnost histopatologického hodnocení vzorků z jícnu. Držíme se doporučení, aby se jícnovou problematikou časných neoplazií zabýval na pracovišti specializovaný patolog. V naší studii spolupracovali dvě specializované jícnové patoložky (I. Tučková, J. Malušková).
Závěrem bychom chtěli shrnout, že cílené biopsie nejsou dostatečné pro přesnou diagnózu časné neoplazie jícnu, zejména u pacientů s BJ. Na výsledky biopsií se nelze příliš spoléhat, což může být klíčové před indikací ablační léčby u pacientů s HGD. U pacientů s BJ v dispenzárním programu by měla být maximální snaha detekovat suspektní lézi při použití kvalitní endoskopie. Při nálezu léze je klíčové provedení diagnostické a stagingové endoskopické resekce, nejlépe v centru s přítomností specializovaného jícnového patologa. RFA u pacientů s HGD bez viditelné léze by měla být indikována s velkou obezřetností.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 19. 7. 2013
Přijato: 9. 8. 2013
MUDr. Magdalena Stefanová
Interní oddělení Nemocnice na Františku
Na Františku 8, 110 00 Praha 1
magdalena.stefanova@seznam.cz
Zdroje
1. Spechler SJ, Sharma P, Souza RF et al. American Gastroenterological Association medical position statement on the management of Barrett’s esophagus. Gastroenterology 2011; 140(3): 1084–1091.
2. Ell C, May A, Gossner L et al. Endoscopic mucosal resection of early cancer and high--grade dysplasia in Barrett's esophagus. Gastroenterology 2000; 118(4): 670–677.
3. Bennett C, Vakil N, Bergman J et al. Consensus statements for management of Barrett’s dysplasia and early-stage esophageal adenocarcinoma, based on a Delphi process. Gastroenterology 2012; 143(2): 336–346.
4. Titi M, Overhiser A, Ulusarac O et al. Development of subsquamous high-grade dysplasia and adenocarcinoma after successful radiofrequency ablation of Barrett’s esophagus. Gastroenterology 2012; 143(3): 564–366.
5. Hull MJ, Mino-Kenudson M, Nishioka NS et al. Endoscopic mucosal resection: an improved diagnostic procedur for early gastroesophageal epithelial neoplasms. Am J Surg Pathol 2006; 30(1): 114–118.
6. Wani S, Mathur SC, Curvers WL et al. Greater interobserver agreement by endoscopic mucosal resection than biopsy samples in Barrett’s dysplasia. Clin Gastroenterol Hepatol 2010; 8(9): 783–788.
7. Endoscopic Classification Review Group. Update on the paris classification of superficial neoplastic lesions in the digestive tract. Endoscopy 2005; 37(6): 570–578.
8. Montgomery E, Bronner MP, Goldblum JR et al. Reproducibility of the diagnosis of dysplasia in Barrett esophagus: a reaffirmation. Hum Pathol 2001; 32(4): 368.
9. Phoa KN, Pouw RE, van Vilsteren FG et al. Remission of Barrett's esophagus with early neoplasia 5 years after radiofrequency ablation with endoscopic resection: A Netherlands Cohort Study. Gastroenterology 2013; 145(1): 96–104.
10. van Vilsteren FG, Bergman JJ. Endoscopic therapy using radiofrequency ablation for esophageal dysplasia and carcinoma in Barrett’s esophagus. Gastrointest Endosc Clin N Am 2010; 20(1): 55–74.
11. Reed MF, Tolis G Jr, Edil BH et al. Surgical treatment of esophageal high--grade dysplasia. Ann Thorac Surg 2005; 79(4): 1110–1115.
12. Sharma P, Bansal A. Toward better imaging of Barrett’s esophagus – see more, biopsy less! Gastrointest Endosc 2006; 64(2): 188–192.
13. Pech O, Gossner L, Manner H et al. Prospective evaluation of the macroscopic types and location of early Barrett’s neoplasia in 380 lesions. Endoscopy 2007; 39(7): 588–593.
14. Peters FP, Brakenhoff KP, Curvers WL et al. Histologic evaluation of resection specimens obtained at 293 endoscopic resections in Barrett’s esophagus. Gastrointest Endosc 2008; 67(4): 604–609.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2013 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Letní gastroenterologický koktejl
- Kvíz – známá osobnost
- Manometrie jícnu
- Vzácný typ achalázie jícnu III. typu řešený perorální endoskopickou myotomií (POEM)
- Biopsie nejsou dostatečné pro přesnou diagnostiku neoplazie u pacientů s Barrettovým jícnem
- Úspěšná endoskopická léčba makroskopicky pokročilého adenokarcinomu jícnu u rizikového pacienta
- Etiopatogeneze chronické pankreatitidy
- Inhibitory protonové pumpy: vedlejší účinky a interakce
- Experimentální model perianální píštěle na malém laboratorním zvířeti
- Guidelines for the administration of biological therapy in patients with inflammatory bowel diseases – the amendment to the 2nd editon
- Současnost a budoucnost v léčbě Crohnovy nemoci
- Ulcerózní kolitida komplikovaná tromboembolizmem a toxickým megakolon – existuje souvislost toxického megakolon s antikoagulační terapií?
- Léčba těžké ataky ulcerózní kolitidy – komentář ke kazuistice dr. Mokré
- Problém nemusí být tak jednoduchý, jak se na první pohled jeví – komentář k Doporučení ČGS pro podávání antiagregační terapie kyselinou acetylsalicylovou
- Májové hepatologické dny
- Ostrava Live Endoscopy (OLE) 2013
- Správná odpověď na kvíz
- Autodidaktický test: klinická a experimentální gastroenterologie
- Pentasa Sachet 2 g
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Manometrie jícnu
- Pentasa Sachet 2 g
- Inhibitory protonové pumpy: vedlejší účinky a interakce
- Vzácný typ achalázie jícnu III. typu řešený perorální endoskopickou myotomií (POEM)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



