-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Od drenáže cystoidu po karcinom pankreatu
From drainage of the cystoid to pancreatic cancer
Pancreatic cancer tumours are among those tumours with a high malignant potential. Most patients with pancreatic cancer experience dyspepsia, pain in the upper abdomen or jaundice, and sometimes also acute pancreatitis. In our text we describe the case of a patient with repeated attacks of acute pancreatitis, which were followed by the development of a large pseudocyst and then after a long time pancreatic cancer was diagnosed. In this case report we would like to show the very difficult differential diagnostic of a wide spectrum of cystic lesions of the pancreas.
Key words:
cystic lesion of the pancreas
Autoři: G. Suchánková; P. Štirand; L. Voska; J. Špičák
Působiště autorů: Klinika hepatogastroenterologie, IKEM, Praha
Vyšlo v časopise: Gastroent Hepatol 2011; 65(6): 343-347
Kategorie: Klinická a experimentální gastroenterologie: kazuistika
Souhrn
Adenokarcinom pankreatu patří mezi nádory s vysokým maligním potenciálem. Typicky se manifestuje dyspepsií, bolestmi v epigastriu nebo ikterem, ale v malém množství případů se může projevit i atakou akutní pankreatitidy. V našem sdělení popisujeme případ pacientky s recidivujícími atakami akutní pankreatitidy následované rozvojem objemné pseudocysty a poté s dlouhým odstupem diagnostikovaným karcinomem pankreatu. Kazuistikou poukazujeme na velmi obtížnou diferenciální diagnostiku širokého spektra cystických lézí pankreatu.
Klíčová slova:
cystická léze pankreatuPrognóza pacientů s adenokarcinomem pankreatu je velmi špatná. Střední věk při stanovení diagnózy je 65 let, maximum incidence v sedmé a osmé dekádě. Kumulativní riziko pro 75letého pacienta činí 1 %. Jedinou potenciálně kurabilní metodou je chirurgická resekce, ale v době stanovení diagnózy je resekabilních maximálně 15–20 % nádorů. U pacientů po resekci R0 je pětileté přežití jen asi 20 %. Pokud bereme v úvahu všechna stadia onemocnění, činí pětileté přežití jen 1 %. Průměrná doba přežití od stanovení diagnózy je šest měsíců [1,2].
Etiologie a molekulární patogeneze tohoto onemocnění není zcela objasněna. Na vzniku karcinomu pankreatu se podílí faktory exogenní i endogenní. Z exogenních faktorů je významný zejména nikotinizmus [3], dieta, obezita a nízká fyzická aktivita. Alkohol není přímým rizikovým faktorem, ale působí zprostředkovaně cestou chronické pankreatitidy. Dalším možným faktorem je i pravidelný a dlouhodobý abúzus aspirinu a nesteroidních antiflogistik (14 a více tablet týdně po dobu minimálně čtyř let) [1,2]. K endogenním činitelům řadíme zejména chronickou pankreatitidu [4] včetně hereditární, u které je riziko ve srovnání s nehereditární chronickou pankreatitidou signifikantně zvýšené (v 50 letech činí přibližně 10 % a v 70 letech cca 50 %) [5,6]. Dále zde řadíme i stav po gastrektomii a přítomnost diabetes mellitus. Význačnou roli hrají i molekulárně biologické faktory. Mutace K-ras genu jsou přítomny přibližně u 85 % sporadických nádorů pankreatu a lze je detekovat již v časných stadiích onemocnění. K-ras mutace může být detekována i u pacientů s chronickou pankreatitidou, což snižuje její specifitu. Téměř u všech pankreatických tumorů nalézáme mutaci genu p16 (CDKN2A), známkou pokročilého procesu jsou mutace genu p53 a MADH4 (SMAD4,DPC4). Všechny tyto mutace lze detekovat v pankreatické šťávě, v aspirátu tenkou jehlou, duodenálním obsahu, žluči a i ve stolici pacientů s karcinomem pankreatu [7].
Popis případu
Sedmapadesátiletá pacientka s negativní osobní i rodinnou anamnézou, ale s dlouholetým významným abúzem nikotinu, prodělala v letech 2003 až 2007 recidivující ataky lehké akutní pankreatitidy. Etiologie nebyla nikdy jednoznačně objasněna. V květnu 2008 proběhla již těžká ataka akutní pankreatitidy s rozvojem objemné pseudocysty kaudy pankreatu o průměru 12 × 9 cm a pacientka byla následně odeslána na naše pracoviště k dalšímu řešení. Při příjmu pacientka bez větších potíží, ale fyzikálním vyšetření zjištěna rezistence v levém hypochondriu. Byla provedena kontrolní počítačová tomografie (obr. 1a) a doplněna endosonografie (obr. 1b) s nálezem objemné pseudocysty kaudy pankreatu naléhající na žaludek, která obsahovala i částečně solidní složku charakteru buněčného detritu. Endoskopická retrográdní cholangiopankreatografie ukázala normální pankreatikogram bez komunikace s cystoidem.
Obr. 1a. Pseudocysta kaudy pankreatu. Fig. 1a. Pseudocyst of the pancreatic cauda. 
Obr. 1b. Pseudocysta v oblasti kaudy pankreatu obsahující detritus. Fig. 1b. Pseudocyst in the pancreatic cauda area containing detritus. 
Po zvážení klinického obrazu a na základě zobrazovacích vyšetření bylo přistoupeno k transgastrické drenáži (obr. 2). Drenáž probíhala v prosinci 2008, kdy bylo v několika sezeních pod endosonografickou kontrolou postupně zavedeno do pseudocysty celkem šest pigtail stentů. Výkon byl komplikován krvácením do pseudocysty a její následnou infekcí. Po endoskopické dilataci drenážního kanálu a lokální i celkové antibiotické terapii nález zregredoval. Punktát z pseudocysty obsahoval zánětlivé elementy bez cytologických známek malignity. Pacientka byla v dobrém klinickém stavu propuštěna do ambulantní péče.
Obr. 1. Drenáž cystoidu pod endosonografickou kontrolou. Fig. 2. Cystoid drainage under endosonographic follow-up. 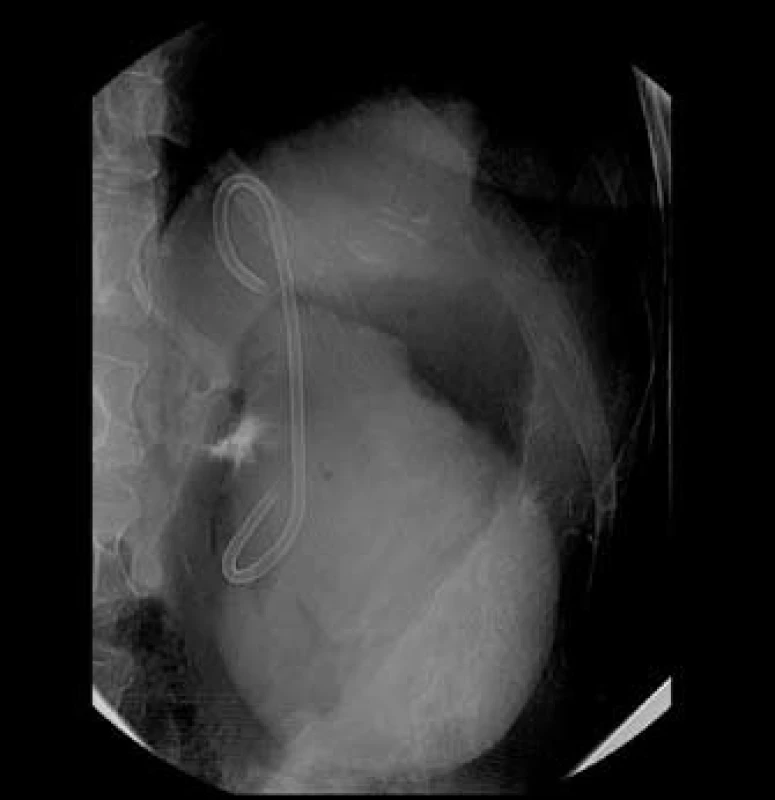
Kontrolní sonografie ukázala kompletní regresi pseudocysty a pigtail stenty byly po třech měsících odstraněny. V dalším sledování byla pacientka bez obtíží, pravidelně kontrolována v šestiměsíčních intervalech. Poslední kontrolu bez patologického nálezu absolvovala v březnu 2010.
V květnu 2010 se pacientka dostavila pro náhle vzniklé bolesti v epigastriu. Při vyšetření nebyla prokázána recidiva akutní pankreatitidy. Pro sonografickou nepřehlednost v oblasti pankreatu bylo doplněno vyšetření břicha počítačovou tomografií s nálezem tumoru těla pankreatu se suspektní angioinvazí, bez známek lymfadenopatie či metastáz (obr. 3a). Endosonografie (obr. 3b) zobrazila neurčité ložisko těla pankreatu bez známek angioinvaze. Aspirační biopsie tenkou jehlou neprokázala jednoznačné známky malignity, ale nález byl suspektní pro přítomnost atypických buněk s mírně posunutým nukleoplazmatickým poměrem a lehce hyperchromními jádry (obr. 4).
Obr. 3a. Tumor těla pankreatu na CT. Fig. 3a. Tumour of the pancreatic body in a CT scan. 
Obr. 3b. Tumor těla pankreatu, endosonografické zobrazení. Fig. 3b. Tumour of the pancreatic body, endosonographic image. 
Obr. 2. Aspirační biopsie tenkou jehlou. Fig. 4. Aspiration biopsy using a thin needle. 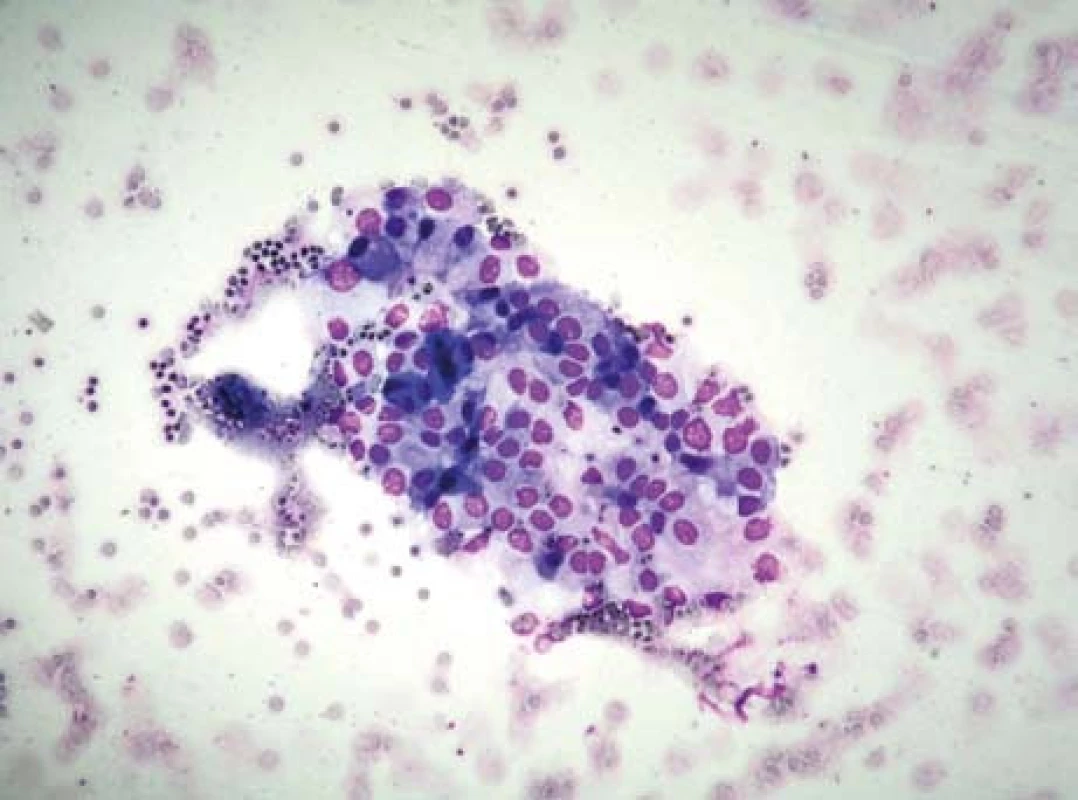
V červenci 2010 podstoupila nemocná distální pankreatektomii. V resekátu byl přítomen invazivní, středně diferencovaný duktální karcinom pankreatu s prorůstáním do okolní peripankreatické tukové tkáně, dezmoplazií a perineurálním šířením, bez angioinvaze a bez prorůstání do resekční plochy. Histologicky G2, pT3pN0pMX, stadium IIA.
Diskuze
Cystické léze pankreatu mohou být velkým diferenciálně diagnostickým problémem [8,9]. Nejčastěji se jedná o pseudocysty v rámci akutní či chronické pankreatitidy. Podobnou morfologii při běžném zobrazovacím vyšetření ale mohou vykázat i cystické tumory. Proto je vždy důležitá důkladná diagnostika zobrazovacími metodami i vyšetření obsahu cystoidu. Nejdostupnější je stále kromě standardní břišní sonografie počítačová tomografie. Magnetická rezonance poskytuje výhodu současného zobrazení pankreatického vývodu při přesnějším posouzení charakteru tkáně a obsahu cystoidu. Nezastupitelnou úlohu má endoskopická ultrasonografie, která kromě zobrazení poskytuje i možnost odběru biologického materiálu a terapeutického zákroku [10].
V aspirační biopsii se vyšetřuje amyláza (vyšší u pseudocysty po akutní pankreatitidě), onkomarkery a cytologie. Z onkomarkerů má největší význam stanovení karcinoembryonálního antigenu (CEA), jehož zvýšená hodnota v aspirátu predikuje potenciálně maligní lézi. K dalšímu průkazu etiologie cystoidu může být přínosné DNA vyšetření, jímž se zabývala studie PANDA [11]. Nejedná se o izolované vyšetření, pomocí kterého jednoznačně určíme povahu cystoidu, ale v kombinaci s ostatními vyšetřeními nám může napomoci v rozlišení mezi maligní a nemaligní lézí. Dle doporučení je v podstatě každá mucinózní cystická léze indikována k chirurgické intervenci, ale vždy musíme k pacientům přistupovat individuálně. DNA vyšetření by nám mohlo v tomto směru napomoci. I když má cytologické vyšetření poměrně dobrou senzitivitu (75 %), může být významná část pacientů falešně negativní. A právě v těchto případech by byla indikována DNA analýza. Hodnotí se jednak celkové množství DNA v cystoidu, ale i jednotlivé mutace, mezi které patří ztráta alely a K-ras mutace. Pozitivní nález v korelaci se stanovením CEA i při negativní cytologii potvrdí maligní etiologii.
Mezi nejčastější cystické tumory pankreatu patří serózní cystadenom, mucinózní cystický tumor a intraduktální papilární mucinózní neoplazie (tab. 1). Serózní cystadenom je tvořen množstvím menších cyst obsahujících čirou tekutinu, takže voštinovitou strukturou připomíná včelí plát. Fibrózní stroma tvoří hvězdicovitou centrální jizvu. Někdy lze tento tumor zaměnit na zobrazovacích metodách i za solidní tkáň. Punktát je čirý s negativními onkomarkery i amylázou. Tento typ nádoru postihuje nejčastěji starší ženy a poměrně často bývá objeven náhodou, ve 2/3 případů se vyskytuje v oblasti kaudy pankreatu. Mucinózní cystický tumor je naopak charakterizován makrocystickou strukturou se septy a kalcifikacemi. V 90 % se vyskytuje v těle nebo kaudě pankreatu a nemá spojení s pankreatickým vývodným systémem. Většinou postihuje ženy středního věku (45–50 let). Obsah je viskózní, bohatý na mucin s pozitivním CEA. Intraduktální papilární mucinózní neoplazie (IPMN) je charakterizována proliferací buněk produkujících mucin, který vede k dilataci pankreatických vývodů a následné tvorbě cyst s nálezem CEA i amylázy. Častěji postihuje hlavní pankreatický vývod, může být fokální i difuzní. Ze sekundárních vývodů vychází tzv. branch-duct typ, který má nižší maligní potenciál. Na rozdíl od mucinózních tumorů jsou intraduktální papilární mucinózní neoplazie lokalizovány zejména v hlavě pankreatu (70 %) a častěji jsou postiženi muži než ženy [12–15].
Tab. 1. Diferenciální diagnostika cystických lézí pankreatu. Tab. 1. Differential diagnostics of cystic lesions of the pancreas. 
Papilární cystický tumor je vzácný nádor, který postihuje zejména mladší ženy ve věku 25–35 let. Je tvořen solidní a pseudopapilární tkání, která je podpírána hyalinním stromatem prostoupeným četnými hemorhagiemi. Prognóza tohoto tumoru je výborná, riziko malignity je malé. Tak jako u serózního cystadenomu jsou onkomarkery i amyláza v punktátu negativní.
U naší pacientky zpočátku nic nenasvědčovalo jiné etiologii než proběhlé akutní nekrotizující pankreatitidě, čemuž odpovídala klinika, zobrazovací i cytologické vyšetření. Proto jsme nepřistoupili k vyšetření punktátu na onkomarkery. Je otázkou, zda vůbec byly recidivující ataky akutní pankreatitidy u naší pacientky v příčinné souvislosti s později diagnostikovaným karcinomem pankreatu. Mujica et al [16] zkoumali pacienty s karcinomem pankreatu s dříve manifestní atakou akutní pankreatitidy. Jednalo se o retrospektivní studii, do které bylo zařazeno celkem 45 pacientů. Počet epizod akutní pankreatitidy před diagnózou karcinomu pankreatu byl 1–15 a v naprosté většině (89 %) případů se jednalo o lehkou ataku. Průměrná doba od ataky pankreatitidy k diagnóze karcinomu pankreatu byla 34 týdnů (rozmezí 1–52). Pokud zvažujeme u naší pacientky zcela první epizodu pankreatitidy, tak celková doba od první epizody akutní pankreatitidy ke karcinomu pankreatu byla 84 měsíců. Zůstává sporné, zda byl nádor pankreatu opravdu v tomto případě příčinou recidivujících atak akutní pankreatitidy či zda se jednalo o koincidenci dvou onemocnění.
Mechanizmus rozvoje akutní pankreatitidy u karcinomu pankreatu není zcela jasný. Jednou z možností je mechanická obstrukce pankreatických vývodů, dále obstrukce cév vedoucí k ischemii anebo přímá aktivace pankreatických enzymů tumorem. Diagnóza karcinomu pankreatu vedoucí k akutní pankreatitidě je obtížná a spočívá v pečlivém vyloučení jiných, běžnějších příčin. Jedním z důvodů obtížné diagnostiky karcinomu pankreatu při epizodě akutní pankreatitidy jsou kromě velikosti tumoru i současné patologické změny v rámci aktuálně probíhajícího zánětu.
Závěr
Přesná diagnostika cystického tumoru a pseudocysty pankreatu má zcela zásadní význam. Vyplývá z toho adekvátní diferencovaný terapeutický přístup i další prognóza pacienta. Algoritmus vyšetřovacích metod zahrnuje CT, MR a endoskopickou ultrasonografii v individuálním zastoupení a pořadí spolu s aspirační biopsií ložiska s cytologickým vyšetřením, stanovením hladiny CEA a amylázy. Přes dodržení uznávaných principů je v důsledku širokého spektra cystických lézí a neúplně vyjasněné patogeneze karcinomu pankreatu překvapení možné.
Zkratky
- CT = Počítačová tomografie
- MR = magnetická rezonance
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Doručeno/Submitted: 4. 8. 2011
Přijato/Accepted: 23. 9. 2011
MUDr. Gabriela Suchánková
Klinika hepatogastroenterologie, IKEM
Vídeňská 1958/9, Praha 4
gabriela.suchankova@ikem.cz
Zdroje
1. Castillo CF, Jimenez RE. Epidemiology and risk factors for exocrine pancreatic cancer. www.uptodate.com.
2. Johnson CD, Imrie CW. Pancreatic disease. Basic Science and Clinical management. Springer/Verlag London, 2004.
3. Nakamura K, Nagata C, Wada K et al. Cigarette smoking and other lifestyle factors in relation to the risk of pancreatic cancer death: a prospective cohort study in Japan. Jpn Clin Oncol 2011; 41(2): 225–231.
4. Raimondi S, Lowenfels AB, Morselli-Labate AM et al. Pancreatic cancer in chronic pancreatitis: etiology, incidence and early detection. Best Pract Res Clin gastroenterol 2010; 24(3): 349–358.
5. Lowenfels AB, Maisonneueve P, DiMagno EP et al. Hereditary pancreatitis and the risk of pancreatic cancer. International hereditary Pancreatitis Study Group. J Natl Cancer Inst 1997; 89(6): 442–446.
6. Whitcomb DC. Hereditary pancreatitis. www.uptodate.com.
7. Ságlová A, Špičák J, Hucl T. Karcinom pankreatu: Molekulární biologie a časná diagnostika. Praktický lékař 2010; 90(8): 489–493.
8. Basturk O, Coban I, Adsay NV. Pancreatic cysts: pathology classification, differential diagnosis, and clinical implications. Arch Pathol Lab Med 2009; 133(3): 423–438.
9. Friedel DM, Abraham B, Georgiou N et al. Pancreatic cystic neoplasms. South Med J 2010; 103(1): 51–57.
10. Iglesias García J, Lariňo Noia J, Dominquez Muňoz JE. Endoscopic ultrasound in the diagnosis and staging of pancreatic cancer. Rev Esp Enferm Dig 2009; 101(9): 631–638.
11. Khalid A, Zahid M, Finkelstein SD et al. Pancreatic cyst fluid DNA analysis in evaluating pancreatic cysts: the report of the PANDA study. Gastrointest Endosc 2009; 69(6): 1095–1102.
12. Adsay NV. Cystic neoplasia of the pancreas: pathology and biology. J Gastrointest Surg 2008; 12(3): 401–404.
13. Leffler J. Cystické léze pankreatu In: Špičák a kol. Novinky v gastroenterologii a hepatologii. Praha: Grada 2008 : 357–383. 1. vyd.
14. Adet A, Miquel R, Bombi JA et al. Incidence and characteristics of pancreatic cystic neoplasms. Gastroenterol Hepatol 2010; 33(8): 563–568.
15. Klöppel G. Pseudocysts and other non-neoplastic cysts of the pancreas. Semin Diagn Pathol 2000; 17(1): 1–7.
16. Mujica VR, Jamie SB et al. Acute pankreatitis Secondary to Pancreatic carcinoma Pancreas 2000; 21(4): 329–332.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2011 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- November 17th 1989 and today
- Erratum
-
Prof. MUDr. Petr Dítě, DrSc., jubilující
Prof. MUDr. Petr Dítě, DrSc., celebrant -
Rozhovor s prof. MUDr. Juliem Špičákem, CSc.,
předsedou České gastroenterologické společnosti o 32. českém a slovenském gastrontereologickém kongresu v Brně (3.–5. 11. 2011) - Kvíz – Neobvyklý případ z klinické praxe
- Chronická radiačná proktitída – rieši argón plazma koagulácia tento terapeutický problém?
-
Elektrogastrografie u pokusných prasat
Analýza amplitud - Inhibitory protonové pumpy – up to date
- Od drenáže cystoidu po karcinom pankreatu
- Virtuální simulátor pro digestivní endoskopii
- 20th Congress of the Gastroenterology Society of Central Germany in Magdeburg from 12 to 14 May 2011
- Odpověď na kvíz
- Mladý český výzkumník, hepatolog MUDr. Jan Petrášek, Ph.D., obdržel za mimořádné vědecké objevy prestižní ocenění Česká hlava
- S lítostí oznamujeme, že dne 29. 11. 2011 zemřel ve věku 66 let pan doc. MUDr. Milan Kaláb, CSc.
- Rejstřík 65. ročníku 2011
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chronická radiačná proktitída – rieši argón plazma koagulácia tento terapeutický problém?
-
Prof. MUDr. Petr Dítě, DrSc., jubilující
Prof. MUDr. Petr Dítě, DrSc., celebrant - Inhibitory protonové pumpy – up to date
- Od drenáže cystoidu po karcinom pankreatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



