-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Molekulární biologie a imunopatogeneze sepse
Molecular biology and immunopathogenetic mechanisms of sepsis
Sepsis, the systemic inflammatory response to infection, causes high mortality in patients in non-coronary units of intensive care. The most important characteristic of sepsis is the interaction between two subjects, the macro and the microorganism, associated with the dysfunction of innate and adaptive immunity. Sepsis is understood more as a dynamic syndrome characterized by many phenomenona which are often antagonistic. The inflammation, characterizing sepsis, does not act as a primary physiological compensatory mechanism and rather oscillates between the phase of hyperinflammatory response and anergy or immunoparalysis. The elucidation of the pathogenesis of sepsis is linked to the understanding of immunopathogenetic mechanisms, which characterize the interaction between the macro and microorganisms.
Key words:
sepsis, immunity, inflammation, apoptosis, immunogenetics.
Autoři: M. Průcha
Působiště autorů: Nemocnice Na Homolce Praha, Oddělení klinické biochemie, hematologie a imunologie
Vyšlo v časopise: Čas. Lék. čes. 2009; 148: 86-90
Kategorie: Přehledový článek
Souhrn
Sepse, systémová zánětlivá odpověď k infekci, je příčinou vysoké mortality pacientů na nekoronárních jednotkách intenzivní péče. Patofyziologie sepse zahrnuje komplex interakcí mezi mikro - a makroorganismem, které jsou spojeny s dysfunkcí systému vrozené a adaptivní imunity. Sepse představuje dynamický proces, který je charakterizován řadou často antagonistických jevů. Zánět charakterizující sepsi zde nenaplňuje svou primárně kompenzační fyziologickou roli a přestřeluje do fáze hyperzánětlivé odpovědi nebo na straně druhé do anergie – imunoparalýzy. Objasnění patogeneze sepse představuje pochopení imunopatologických procesů, které charakterizují interakci makro - a mikroorganismu.
Klíčová slova:
sepse, imunita, zánět, apoptóza, imunogenetika.Úvod
Sepse představuje jeden z největších současných problémů medicíny. Česká jednodenní studie z roku 2003 prokázala prevalenci sepse 34,2 % a těžké sepse 16,8 % (1). Incidence těžké sepse v USA je 3,0/1000 obyvatel a 2,26/100 propuštění z nemocnice (2). Incidence se zvyšuje s věkem více než stonásobně (0,2/1000 dětí a 26,2/1000 u dospělých nad 85 let). Počet hospitalizací s těžkou sepsí se v letech 1993–2003 téměř zdvojnásobil (3). Problémem je vysoká mortalita sepse (28,6 %) i těžké sepse (37,8 %) (4). Ještě nepříznivější data ukazuje analýza pacientů se septickým šokem (5). Jeho incidence je 58% u pacientů s těžkou sepsí a jeho mortalita stále převyšuje 50%.
V patogenezi sepse se významným způsobem uplatňují dysregulace mechanismů vrozené i adaptivní imunity. Jednou z úloh imunitního systému je udržování homeostázy. Mechanismy vrozené a adaptivní imunity zabezpečují odpověď makroorganismu na infekční agens. V případě sepse je tato homeostáza podstatným způsobem narušena. Lokalizovaná zánětlivá odpověď přerůstá do odpovědi systémové, která je výrazem selhání imunologických kompenzačních mechanismů.
Definice sepse, SIRS a PIRO systému
Jedním z důležitých mezníků v chápání patogeneze sepse byla konsenzuální konference v roce 1991 s definováním pojmů: syndrom systémové zánětlivé odpovědi (SIRS), sepse, těžká sepse, septický šok, bakterémie (6). Konkrétním vyjádřením byla definice syndromu systémové zánětlivé odpovědi-SIRS. Představovala nové chápání interakcí pro - a protizánětlivých mechanismů a mediátorů uplatňujících se v rámci odpovědi makroorganismu na infekci, trauma, závažný operační zákrok. Definice SIRS nabídla koncept účasti a významu endogenních zánětlivých mediátorů u syndromu zánětlivé odpovědi infekční i neinfekční etiologie.
PIRO concept
Klinická praxe ukázala, že kritéria SIRS mají vysokou senzitivitu, ale příliš nízkou specificitu. Skupiny pacientů definované podle konsenzu z roku 1991 byly velice heterogenní a této heterogennosti se přičítal vliv na špatné klinické výsledky s použitím imunomodulační terapie. Proto vznikla snaha tuto heterogennost odstranit, přičemž východiskem se staly nové metodologie s detekcí nových biomarkerů, jako je např. prokalcitonin, studování genetických polymorfismů atd. Cílem je rozšíření diagnostických možností u pacientů se sepsí a jejich staging, jak je tomu například onkologických nemocných a používaného TNM systému. V roce 2001 byla přijata tzv. PIRO klasifikace (7). „PIRO“ systém znamená Predisposition „P“, Infection „I“, Response „R“ a Organ dysfunction „O”.
Vliv infekčních agens na imunitní a koagulační systém
Sepse představuje systémovou zánětlivou reakci organismu na infekci. Etiologicky se uplatňují bakteriální, virová, mykotická nebo parazitární agens. U gram-negativních bakterií je základní stavební složkou endotoxin, resp. lipid A, který je odpovědný za patogenetické účinky (8).Plazmatická koncentrace endotoxinu koreluje s rozvojem syndromu multiorgánové dysfunkce (MODS) a letalitou. Příčinou endotoxémie může být bakteriální translokace, při které dochází k prostupu mikrobů a jejich produktů přes slizniční bariéru (9, 10). Důležitým faktorem uplatňujícím se při navození translokace střevní flóry je dysfunkce retikuloendotelového systému – zejména jater (11). Bakteriální translokace a její spojení se vznikem SIRS a sepse se považuje za prokázané (12, 13). Závislost bakteriální translokace na imunosupresi byla prokázána v experimentálních i klinických studiích. Zvýšená bakteriální translokace byla prokázána u atymických myší (14), závislost na provedeném chirurgickém zákroku při střevní obstrukci zase na lidském modelu (15). Podobné účinky jako endotoxin mají struktury gram-pozitivních bakterií – teichoová a lipoteichoová kyselina, kapsulární lipopolysacharid a skupinově specifické karbohydráty. Většina patogenetických účinků u gram-pozitivních bakterií je výsledkem působení exotoxinů. Tyto exotoxiny mohou působit také jako superantigeny. Superantigeny se váží přímo na MHC antigeny II. třídy exprimované na antigen-prezentujících buňkách a reagují přímo s T-buněčnými receptory (TCR). Příkladem je toxický šok syndrom způsobený toxinem 1, který produkuje Staphylococcus aureus. Účinkem výše zmíněných bakteriálních struktur na leukocyty a buňky parenchymatózních orgánů dochází k produkci prozánětlivých cytokinů. Dva hlavní cytokiny jsou důležité v rozvinutí zánětlivé kaskády indukované endotoxinem – tumor nekrotizující faktor-α a interleukin-1β (16). Tyto cytokiny stimulují imunitní odpověď, která zahrnuje: uvolnění cytokinů, aktivaci metabolismu kyseliny arachidonové, expresi integrinů, aktivaci komplementu, produkci oxidu dusnatého. Pro navození imunitní odpovědi u gram-negativní infekce je nezbytná vazba lipopolysacharidu (LPS) k receptoru monocytárních fagocytů – molekule CD14, který je exprimovaný na povrchu myelomonocytárních buněk. Kromě této buněčné formy existují dvě solubilní formy CD14, které vazbou k LPS indukují rozvinutí zánětlivé kaskády. Proteinem odpovědným za vazbu LPS k molekule CD14, je LPS-vázající protein (LBP), který je přítomen v plasmě. V dalším průběhu odpovědi se specificky uplatňuje receptor z rodiny Toll-like receptorů (TLR), konkrétně TLR-4 (17). CD14 molekula se rovněž uplatňuje jako receptor pro peptidoglykan, který je komponentou buněčné stěny gram-pozitivních bakterií (18).
Gram-pozitivní i gram-negativní bakterie i další patogeny disponují molekulárními strukturami, které jsou hlavními „terči“ při rozpoznání systémem vrozené imunity. Tyto molekuly označujeme jako „s patogenem asociované molekulární vzory“ PAMPs (pathogen-associated molecular patterns) (19). Těmito strukturami je u gram-negativních bakterií lipid A, u gram-pozitivních bakterií peptidoglykan a teichoová kyselina. Dvouvláknová RNA je typická pro RNA viry, manany jsou charakteristické pro kvasinky. V systému vrozené imunity se při jejich rozpoznání uplatňují jako antigen-prezentující buňky (APC) makrofágy a dendritické buňky (DB), které je pak předkládají T-lymfocytům. Oba typy antigen prezentujících buněk disponují „receptory rozpoznávání“ (pattern recognition receptors – PRRs), které se na tyto struktury vážou. Mezi tyto receptory patří kolektiny, CD14, Toll-like receptory (TLRs), manózu vázající protein, sérový amyloid P, receptory pro komplement, C-reaktivní protein, Fc receptory, CD11b,c/CD18 a DEC 205. Důsledkem těchto vazeb je přenos signálu prostřednictvím proteinu myeloid differentiation factor 88 (MYD88) a nuclear factor κB (Nκ-FB) do nitra hostitelské buňky, což vede k transkripci genů pro produkci cytokinů – IL-1 a IL-12, TNF-α a B7 (20–23). Primární úlohou zánětlivé odpovědi je lokalizace poškození. Uvolnění zánětlivých mediátorů – leukotrienů, složek komplementu, cytokinů a tvorba antigen-protilátkových komplexů způsobuje akumulaci neutrofilů a monocytů v místě poškození. Monocyty a neutrofily lokálně uvolňují množství cytokinů – prozánětlivých – TNF-α, IL-1, IL-2, IL-6, interferon-γ a další. Vedle produkce prozánětlivých cytokinů se kompenzačně uplatňuje protizánětlivá odpověď, kterou představuje produkce IL-4, IL-10, IL-11, IL-13, solubilních TNF-α receptorů. Neutrofily, které fungují jako fagocyty, jsou ale také hlavní příčinou orgánového poškození. Vlivem zánětlivých cytokinů produkovaných neutrofily se na povrchu endotelií poškozených tkání exprimují adhezní molekuly. Proces zahrnuje primární adhezi leukocytů zprostředkovanou selektiny L, E a P, které jsou přítomny na leukocytech, endoteliích a destičkách. Prvotní adhezní interakce pohyb neutrofilů zpomalí, v další fázi dochází k vazbě leukocytárních integrinů na povrchový glykoprotein endoteliálních buněk ICAM 1 (intercellular adhesion molecule-1). Monocyty přilínají na cévní stěnu prostřednictvím β1-integrinů. Protějškem na endoteliích je molekula VCAM-1 (vascular adhesion molecule). Ligandem pro β1-integriny jsou složky mezibuněčné hmoty (kolageny, fibronektin). Výjimkou je VLA-4, jejímž ligandem je VCAM-1. Po pevném zachycení na povrchu endotelií neutrofily cévu opustí a přejdou do tkáně. Neutrofily v místě poškození odstraní mikroorganismy, eventuálně jiné cizorodé částice a během krátké doby hynou. Samy jsou odstraněny dalšími fagocytujícími buňkami, zejména makrofágy.
Přehled nejdůležitějších zánětlivých mediátorů uvádí tabulka 1.
Tab. 1. Přehled pro- a protizánětlivých mediátorů 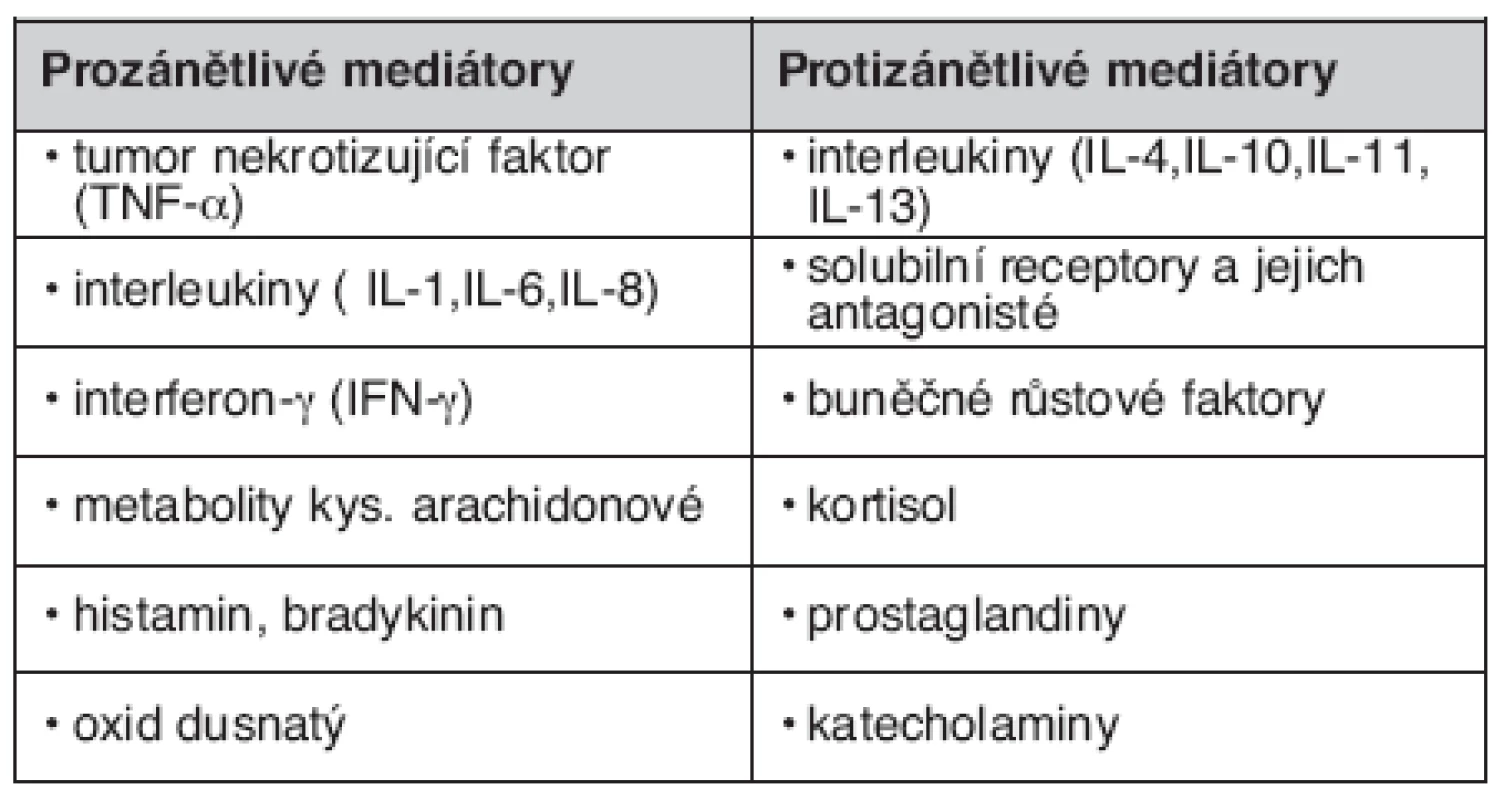
Pokud nedojde k lokalizaci etiologického agens nebo poranění, dochází k progresi prozánětlivé odpovědi s masivní produkcí mediátorů, která je příčinou klinické manifestace syndromu systémové zánětlivé odpovědi. Cytokiny produkované u septických pacientů aktivují jejich koagulační systém (24, 25). Klíčovou roli hraje v koagulační kaskádě tkáňový faktor (TF), který je aktivován TNF-α, IL-2, IL-6. Působení cytokinů vede k redukci fibrinolýzy, poklesu proteinu C a antitrombinu III. Aktivovaný protein C inhibuje faktory Va, VIIa a inhibitor aktivátoru plasminogenu (PAI-1). Antitrombin III inhibuje koagulační faktory Xa, XIa, IIa a plasmin. Progredující prokoagulační stav akcentuje zánětlivou odpověď při sepsi. Významnou roli v další progresi má dysfunkce endotelu. Působením TNF-α, IL-1 a dalších prozánětlivých mediátorů dochází k významné dysfunkci endotelu společně se změnou jeho fenotypu na protrombotický. Důsledkem je tvorba mikrovaskulárních trombů a ischémie. Je významně narušena mikrocirkulace se zvýšenou permeabilitou, progredující vazodilatací, orgánovou dysfunkcí a šokem.
Zánět jako hlavní patogenetický mechanismus sepse
Hlavním patogenetickým mechanismem u pacientů se sepsí je zánět. Zánět představuje fyziologický kompenzační mechanismus, který spojuje systém vrozené a získané imunity. Jeho primární úlohou je zachování homeostázy, odstranění inzultů, které tuto homeostázy narušují. Patogeneze sepse je spojena s poruchou imunitních funkcí na úrovni humorální i buňkami zprostředkované imunity. Imunitní odpověď pacientů se sepsí je charakterizována buď hyperzánětlivou systémovou odpovědí, nebo naopak stavem „imunoparalýzy“ s nízkou expresí HLA-DR na monocytech a sníženou produkcí TNF-αex vivo po stimulaci lipopolysacharidem (26). Hyperzánětlivou fázi charakterizuje vysoká produkce cytokinů – TNF α, migraci inhibujícího faktoru (MIF) a high-mobility group box I (HMGB-I) proteinu (27, 28). Obě fáze se vyskytují nezávisle na sobě a v různých časových okamžicích při rozvoji sepse. Důležitou roli v procesu navození imunoparalýzy hraje IL-10. IL 10 suprimuje expresi znaků II. třídy MHC a touto cestou inhibuje antigen-specifickou proliferaci T-lymfocytů (29).
Apoptóza v procesu sepse
Apoptóza je fyziologický děj, programovaná smrt. Podobně jako u zánětu je to proces primárně fyziologický, který má za úkol zachování homeostázy, remodelaci tkání, aktivní proces imunitní odpovědi na exo - a endogenní podněty. U sepse je zvýšená apoptóza imunokompetentních buněk, která ve svém důsledku působí imunosupresivně (30, 31). Největší počet apoptotických buněk byl prokázán ve slezině a střevě (32). Takový pokles imunokompetentních buněk má pochopitelně odezvu ve snížené schopnosti organismu reagovat na infekci. Apoptotické buňky navíc aktivně potlačují zánětlivou odpověď. Otázkou zůstává význam apoptózy pro klinický výsledek sepse. Zatímco byla prokázána závislost klinického výsledku sepse na počtu lymfocytů, kauzalita mezi zvýšenou apoptózou lymfocytů a letalitou pacientů se sepsí prokázána nebyla. V současné době se diskutuje otázka možného terapeutického přístupu s využitím signálních molekul pro apoptózu jako cíle pro terapii sepse (33).
Dysregulace systému vrozené a adaptivní imunity v patogenezi sepse
Syndrom systémové zánětlivé odpovědi i sepse je charakterizován zánětem a poruchou homeostázy. V obou případech se jedná o komplex reakcí vzniklý jako odpověď na porušení integrity organismu. Mechanismy zánětlivé reakce jsou v případě syndromu systémové zánětlivé odpovědi neinfekční etiologie i sepse identické, rozdíl je v ne/přítomnosti infekce. Patogeneze uvedených stavů je významným způsobem spojena s poruchou imunitních funkcí na úrovni humorální i buňkami zprostředkované imunity. Zahrnuje systémovou odpověď k infekci nebo neinfekčním podnětům, při které monocyto-makrofágový systém produkuje velké množství pro a protizánětlivých cytokinů – TNF-α, IL-1, IL-6, IL-10 a další.Sepse i SIRS jsou na svém počátku charakterizovány zvýšením koncentrace zánětlivých mediátorů v krvi. Souběžně dochází ke kompenzační protizánětlivé imunosupresivní odpovědi. Mechanismy adaptivní imunity, které se zde uplatňují, jsou zprostředkovány především buňkami zprostředkovanou imunitou. Aktivované CD4+ T-lymfocyty se dělí na dvě podskupiny s antagonistickým profilem produkovaných cytokinů – typ TH1 produkující zejména TNF-α, interferon-γ a interleukin-2 (prozánětlivé) a typ TH2 s produkcí IL 4 a IL-10 (protizánětlivé). IFN-γ a TNF α produkované TH1 buňkami zvyšují schopnost fagocytů zabíjet infekční agens, zatímco IL-4 a IL-10 produkované TH2 buňkami podporují zejména humorální odpověď proti extracelulárním patogenům. Faktory, které rozhodují o diferenciaci T-buněk, nejsou zcela známy, ale v případě infekce je důležitý typ patogenu, množství infekčního inokula a lokalizace infekce. Důležitým faktorem je také poměr koncentrací IL-12 a IL-4. IL-12 je produkován makrofágy a dendritickými buňkami, IL-4 bazofily a mastocyty. Převažující typ mediátorové produkce je důležitý pro dominanci pro nebo protizánětlivé odpovědi. Její intenzita rozhoduje rovněž o tzv. kompartmentalizaci imunitní odpovědi, zda bude zánětlivá odpověď lokalizována nebo systémová. Také stresová odpověď se svými mechanismy hraje důležitou roli v navození imunosuprese nejen při infekci, ale také po traumatu nebo krevní ztrátě. Nedávné práce prokázaly vliv autonomního nervstva (sympatiku a parasympatiku) na imunitní odpověď (34, 35). Neuroendokrinní systém tak reguluje prozánětlivou roli monocytů a makrofágů (produkce TNF) a antigen-prezentující funkci přímo i nepřímo indukcí imunomodulačních cytokinů – např. IL-10. Účinkem jeho působení dochází k deaktivaci TH1 buněk. Tyto interakce jsou důležité v zabránění excesivní zánětlivé reakce. Pokud se ale zvyšuje intenzita zánětlivé reakce – při masivní infekci, traumatu, dochází k výraznější aktivaci stresové osy, která vede k vyšší imunosupresi, a tím ke zvýšenému riziku systémové infekce. Vysoké koncentrace kortikosteroidů a katecholaminů vedou ke zvýšené apoptóze lymfocytů a snížení funkčnosti adaptivních mechanismů imunity. Heidecke et al. zjistili, že snížení TH1 funkce bez zvýšení TH2 cytokinové produkce odpovídá stavu anergie – neschopnost odpovědi na antigen. Tato snížená funkce T lymfocytů koreluje s mortalitou. Pacienti s traumatem, sepsí a popáleninami mají snížené počty cirkulujících T-lymfocytů a jsou anergní (36). Velké množství lymfocytů a epiteliálních buněk střeva hyne během sepse mechanismem apoptózy. Jedním z mechanismů je stresem indukované uvolnění glukokortikosteroidů. Apoptické buňky navozují anergii a protizánětlivou cytokinovou produkci, zatímco buňky nekrotické působí imunostimulačně a zvyšují obranyschopnost organismu (37, 38). A tak kombinace uvedených faktorů navozuje imunosupresi charakteristickou pro pacienty se sepsí (tab. 2).
Tab. 2. Přehled mechanismů imunosuprese u sepse 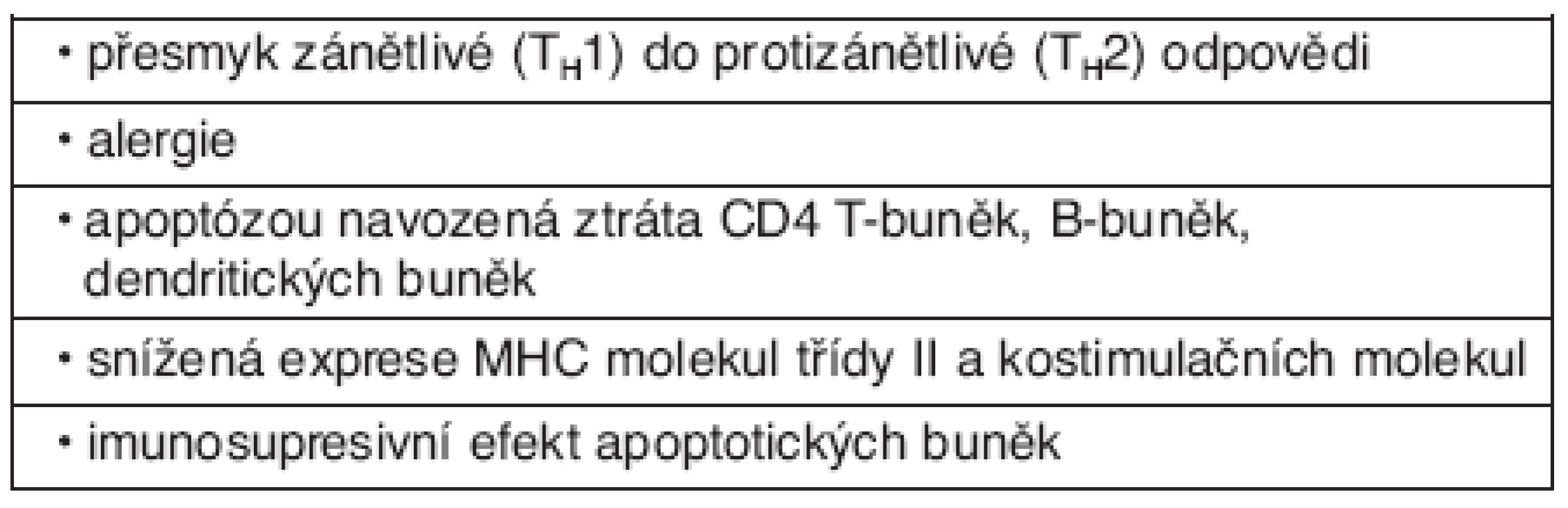
Genetické predispozice sepse
Genetický polymorfismus faktorů vrozené imunity se uplatňuje v rámci interakcí makro - a mikroorganismu. Byla zkoumána závislost mezi polymorfismem CD14, LBP a BPI u pacientů v sepsi. Polymorfismy Toll like receptorů jsou spojeny se zvýšenou vnímavostí k infekčním agens (39). Polymorfismy cytokinů a jejich receptorů (TNF-α, TNFR, IL-1,IL-6), faktorů endoteliální dysfunkce (PAI-1 – inhibitor aktivátoru plasminogenu) se rovněž uplatňují významným způsobem (40). Zjišťování genetických predispozic u sepse se již stalo nedílnou součástí současného klinického výzkumu u kriticky nemocných. Nové technologické postupy (DNA arrays) a vyspělá výpočetní technika umožňují postoupit dále v tomto výzkumu. Dosavadní výsledky dávají důvod ke střízlivému optimismu při hodnocení jejich úlohy v diagnostice, patogenezi a potencionální terapii sepse.
Závěr
Přes významný pokrok v objasnění patogeneze sepse v posledních 20 letech zůstává její mortalita příliš vysoká. Dysregulace imunologických mechanismů vrozené a adaptivní imunity je významnou příčinou této vysoké mortality. Dokonalejší poznání těchto dysregulací, používání diagnostických parametrů, které dokáží dostatečně rychle a spolehlivě detekovat přítomnost infekce a zhodnotit funkční stav imunitního systému makroorganismu – tedy robustní diagnostika je cílem, který umožní včasnější a účinnější imunoterapii sepse.
Zkratky
APC – antigen-prezentující buňky
DB – dendritické buňky
HMGB-I – high-mobility group box I
ICAM-1 – intercellular adhesion molecule-1
LBP – LPS-vázající protein
LPS – lipopolysacharid
MIF – migraci inhibujícího faktor
MODS – multiorgánová dysfunkce
MYD88 – myeloid differentiation factor 88
NF-κB – nuclear factor κB
PAI-1 – inhibitor aktivátoru plasminogenu
PAMPs – pathogen-associated molecular patterns
PIRO – Predisposition Infection Response Organ dysfunction
PRRs – receptory rozpoznávání (pattern recognition receptors)
TCR – T-buněčnými receptory
TF – tkáňový faktor
TNF – tumor nekrotizující faktor
TLR – Toll like receptor
VCAM-1 – vascular adhesion molecule
Adresa pro korespondenci:
MUDr. Miroslav Průcha, Ph.D.
Oddělení klinické biochemie, hematologie a imunologie Nemocnice Na Homolce
Roentgenova 2, 150 00 Praha 5
e-mail: miroslav.prucha@homolka.cz
Zdroje
1. Černý V, Novák I, Šrámek V. Prevalence těžké sepse v České republice – prospektivní multicentrická jednodenní studie. Anest Intenziv Med 2003; 14 : 218–222.
2. Angus DC, Linde-Zwirble WT, Lidicker J, et al. Epidemiology of severe sepsis in the United States: Analysis of incidence, outcome, and associated costs of care. Crit Care Med 2001; 29 : 1303–1310.
3. Dombrovskiy VY, Martin AA, Sunderram J, et al. Rapid increase in hospitalization and mortality rates for severe sepsis in the United States: A trend analysis from 1993 to 2003. Crit Care Med 2007; 35 : 1244–1250.
4. Dellinger RP. Cardiovascular management of septic shock. Crit Care Med 2003; 31 : 946–955.
5. Esper A, Martin GS. Is severe sepsis increasing in incidence AND severity? Crit Care Med 2007; 35 : 1414–1415.
6. Bone RC, Balk RA, Cerra FB, et al. American College of Chest Physicians/Society of Critical Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of Innovative therapies in sepsis. Chest 1992; 101 : 1644–1655.
7. Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Intensive Care Med 2003; 29 : 530–538.
8. Braude AE, Jones JL, Douglas H. The behavior of Escherichia coli endotoxin (somatic antigen) during infectious arthritis. J Immunol 1963; 90 : 297–301.
9. Andriole VT. Urinary tract infections in the 90s: Pathogenesis and management. Infection 1992; 20(Suppl 4): S251–S256.
10. Feltis BA, Jechorek RP, Erlanden SL, et al. Bacterial translocation and lipopolysaccharide-induced mortality in genetically macrophage-deficient op/op mice. Shock 1994; 2 : 29–33.
11. Go LL, Healey PJ, Watkins SC. et al. The effect of endotoxin on intestinal mucosal permeability to bacteria in vitro. Arch Surg 1995; 130 : 53–58.
12. Sedman PC, MacFie J, Sagar P, et al. The prevalence of gut translocation in humans. Gastroenterology 1994; 107 : 643–649.
13. Cabie A, Farkas JC, Fitting C, et al. High levels of portal TNF-α during abdominal aortic surgery in man. Cytokine 1993; 5 : 448–453.
14. Owens WE, Berg RD. Bacterial translocation from the gastrointestinal tract of thymectomized mice. Curr Microbiol 1982; 7 : 169–174.
15. O’Boyle CJ, Mac Fie J, Mitchell CJ, et al. Microbiology of bacterial translocation in humans. Gut 1998; 42 : 29–35.
16. Morin M, Schindler R, Wakabayashi G, et al. Picogram concentrations of endotoxin stimulate synthesis of IL-1β and TNF‑α by human peripheral blood mononuclear cells exposed to recombinant human C5a. Eur Cytokine Netw 1991; 2 : 27–30.
17. Quereshi ST, Lariviere G, Leveque S, et al. Endotoxin-tolerant mice have mutations in Toll-like receptor 4. J Exp Med 1999; 189 : 615–625.
18. Cleveland MG, Gorham JD, Murphy TL, et al. Lipoteichoic acid preparations of Gram-positive bacteria induce interleukin-12 through a CD14-dependent pathway. Infect Immun 1996; 64 : 1906–1912.
19. Medzhitov R, Janeway C. Innate immunity: the virtues of a nonclonal system of recognition. Cell 1997; 91 : 295–298.
20. Hemmi H. A Toll-like receptor recognizes bacterial DNA. Nature 2000; 408 : 740–745.
21. Ozinsky A. The repertoire for pattern recognition of pathogens by the innate immune system is defined by cooperation between Toll-like receptors. Proc Natl Acad Sci USA 2000; 97 : 13766–13771.
22. Broad A, Kirby JA, Jones DEJ. Toll-like receptor interactions: tolerance of MyD88 - dependent cytokines but enhancement of MyD88-independent interferon-ß production. Immunology 2007; 120 : 103–111.
23. Wiel E, Lebuffe G, Vallet B. Bacterial CpG DNA in septic shock. In: Yearbook of Intensive Care and Emergency Medicine 2002; Ed. JL.Vincent: 388–398.
24. Schouten M, Wiersinga WJ, Levi M, van der Poll. Inflammation, endothelium, and coagulation in sepsis. J Leukoc Biol 2008; 83 : 536–545.
25. Stief TW, Ijagha O, Weiste B, et al. Analysis of hemostasis alterations in sepsis. Blood Coagul Fibrinolysis 2007; 18 : 179–186.
26. Průcha M, Herold I, Zazula R, Dubská L, Kavka B. Monocytární deaktivace a produkce tumor nekrotizujícího faktoru-α ex vivo prognostické parametry u pacientů jednotek intenzivní péče. Anesteziologie Intenzivní medicína 2003; 5 : 223–228.
27. Calandra T, Echtenacher B, Le Roy D, et al. Protection from septic shock by neutralization of macrophage migration inhibitory factor. Nature Medicine 2000; 6 : 164–170.
28. Wang H, Zhang M, et al. HMG-I as a late mediator of endotoxin letality in mice. Science 1999; 285 : 248–251.
29. Oberholzer A, Oberholzer C, Moldawer LL. Interleukin-10: a complex role in the pathogenesis of sepsis syndromes and its potential as an anti-inflammatory drug. Crit Care Med 2002; 30: S58–S63.
30. Ayala A, Lomas JL, Grutkoski PS, Chung CS. Pathological aspects of apoptosis in severe sepsis and shock? Int J Biochem & Cell Biol 2003; 35 : 715–720.
31. Chung CS, Chaudry IH, Ayala A. The apoptotic response of the lymphoid immune system to trauma, shock and sepsis. In Vincent J-L, editor. Yearbook of Intensive Care and Emergency Medicine. Berlin: Springer Verlag 2000; 27–40.
32. Hotchkiss RS, Swanson PE, Knudson CM, Chang M, et al. Overexpression of Bcl-2 in transgenic mice decreases apoptosis and improves survival in sepsis. J Immunol 1999; 162 : 4148–4156.
33. Wesche-Soldato DE, Stan RZ, Chung CHS, Ayala A. The apoptotic pathway as a therapeutic target in sepsis. Curr Drug Targets 2007; 8 : 493–500.
34. Borowikova LV, Ivanova S, Zhang H, et al. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin. Nature 2000; 405 : 458–462.
35. Woiciechowsky C, Asadullah K, Nestler D, et al. Sympathetic activation trigger systemic IL-10 release in immunodepression induced by brain injury. Nat Med 1998; 4 : 808–813.
36. Pellegrini JD, De Ak J, Kodys K, et al. Relationships between T lymphocytes apoptosis and anergy following trauma. J Surg Res 2000; 88 : 200–206.
37. Greene DR, Beere HM. Apoptosis:gone but not forgotten. Nature 2000; 405 : 28–29.
38. Fadok VA, Bratton DL, Rose DM, et al. A receptor for phosphatidylserine-specific clearence of apoptotic cells. Nature 2000; 405 : 85–90.
39. Smirnova I, Mann N, Dois A, et al. Assay of locus–specific genetic load implicates rare Toll–like receptor 4 mutations in meningococcal susceptibility. Proc Natl Acad Sci USA 2003; 100 : 6075–6080.
40. Haralambous E, Hibberd ML, Hermans PWM, et al. Role of functional plasminogen-activator-inhibitor-1 4G/5G promoter polymorphism in susceptibility, severity, and outcome of meningococcal disease in Caucasian children. Crit Care Med 2003; 31 : 2788–2793.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodníkČlánek Hypertenze v těhotenstvíČlánek Abdominální obezitaČlánek KNIHYČlánek LAUREÁTI NOBELOVY CENYČlánek Kaprasův den
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Ohlédnutí za XVIII. kongresem České lékařské společnosti J. E. Purkyně v Brně
- 10. konference evropské Společnosti pro výzkum nikotinu a tabáku: na důkazech založená léčba a prevence Řím, 23.–26. září 2008
- KNIHY
- LAUREÁTI NOBELOVY CENY
- Úvodník
- Genetické testování způsobem DTC i v našich krajích
- Aktuální možnosti léčbychronické plicní hypertenze
- Hypertenze v těhotenství
- Konzervativní léčba diabetické mikroangiopatie a makroangiopatie
- Abdominální obezita
- Šedá eminence v medicíně – štítná žláza: 1. část
- Molekulární biologie a imunopatogeneze sepse
- E-kadherin v řízení přechodu prekancerózy v karcinomu
- Smads a jeho funkce ve vývoji kůže
- Kožní změny po hadím uštknutí
- Dvojbalónová enteroskopie, její možnosti a alternativy
- Vítězové nad závislostmi – devět typů
- Bezlepková dieta v léčbě celiakie a psoriázy
- Kaprasův den
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hypertenze v těhotenství
- Abdominální obezita
- Konzervativní léčba diabetické mikroangiopatie a makroangiopatie
- Dvojbalónová enteroskopie, její možnosti a alternativy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



