-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPerioperační neurokognitivní porucha – advanced narrative review
Perioperative neurocognitive disorder – advanced narrative review
Term postoperative cognitive disorder stands for deterioration of cognitive function after surgery in postoperative period. Evaluation and diagnostics of cognitive disorders in perioperative period were highlighted by the increasing number of geriatric patients undergoing a surgery with general anaesthesia, with the goal of fast recovery and preservation of the quality of life. Deterioration in cognitive function after surgery was originally called postoperative cognitive dysfunction. The definitions of postoperative cognitive dysfunction varied. In order to unite them, in 2018 there were published new recommendations during which the postoperative cognitive dysfunction was replaced by the term perioperative neurocognitive disorder. This was divided based on different time frames of onset to pre-existing neurocognitive disorder, postoperative delirium, delayed neurocognitive disorder and (postoperative) neurocognitive disorder. Main goals of this advanced narrative review were description of terminology, identification of risk factors, prevention, and therapy of perioperative neurocognitive disorder.
Keywords:
postoperative cognitive dysfunction – perioperative neurocognitive disorder – postoperative delirium – general anaesthesia
Autoři: K. Nekvindová 1,2; Kateřina Ivanová 2
; L. Juríčková 2; D. Tučková 2; J. Vévoda 2; T. Gabrhelík 1
Působiště autorů: ARIM Krajská nemocnice Tomáše Bati, a. s., Zlín 1; Lékařská fakulta Univerzity Palackého v Olomouci, Ústav veřejného zdravotnictví 2
Vyšlo v časopise: Anest. intenziv. Med., 33, 2022, č. 1, s. 39-44
Kategorie: Přehledový článek
Souhrn
Termínem pooperační kognitivní dysfunkce bývá označováno zhoršení mentálního výkonu pacientů v pooperačním období. Diagnostika a hodnocení kognitivních poruch v perioperačním období se dostaly do popředí zájmu v souvislosti s narůstajícím počtem geriatrických pacientů podstupujících operaci a celkovou anestezii, se snahou o jejich rychlé zotavení a zachování kvality života. Dříve se deteriorace kognitivních funkcí po operaci označovala pojmem pooperační kognitivní dysfunkce. Její definice byly nejednotné. Ve snaze sjednotit nomenklaturu byla v roce 2018 vydána nová doporučení, v kterých byla pooperační kognitivní dysfunkce nahrazena termínem perioperační neurokognitivní porucha. Dle délky trvání se dělí na preexistující neurokognitivní poruchu, pooperační delirium, opožděné neurokognitivní zotavení a pooperační neurokognitivní poruchu. Cílem advanced narrative review byl popis terminologie, identifikace rizikových faktorů, prevence a léčba perioperační neurokognitivní poruchy.
Klíčová slova:
celková anestezie – pooperační kognitivní dysfunkce – perioperační neurokognitivní porucha – pooperační delirium
Úvod
Vliv operace a anestezie na kognitivní funkce, pozornost a paměť jsou zkoumány již od minulého století. Změně kvality kognitivních funkcí v souvislosti s operací a anestezií je v posledních letech věnována zvýšená pozornost, tato problematika se dostává do popředí zájmu nejen lékařů, ale i pacientů a jejich rodin [1].
Kognitivní poruchy v souvislosti s operačním zákrokem nebo anestezií jsou skrytou epidemií [2]. Počet rizikových pacientů podstupujících operaci s celkovou nebo regionální anestezií se stále zvyšuje. Příkladem může být Austrálie, kde je téměř 1/3 anestezií podávána pacientům nad 60 let, přestože představují pouze 14 % populace [3]. V retrospektivní kohortové studii zahrnující téměř 2,4 milionů pacientů, u nichž se rozvinul kognitivní deficit v pooperačním období, došlo ke zvýšení ceny zdravotní péče. Tato komplikace je považována za potenciálně preventabilní. Zdravotní péče zaměřená na prevenci nebo redukci délky symptomů by mohla vést k významným úsporám peněz ve zdravotnictví [4].
Jedním ze zásadních rizikových faktorů ovlivňujících rozvoj pooperační kognitivní dysfunkce, zejména postižení paměti, je věk pacienta. V západních zemích je zhruba 37 % operačních výkonů provedeno u pacientů starších 65 let [1]. Poškození kognitivních funkcí je v této věkové kategorii jednou z nejčastějších komplikací po operačním zákroku [3]. Zkoumány jsou však i vlivy jiných potenciálních rizikových faktorů. Patří mezi ně kognitivní dysfunkce, demence, mozková příhoda, vaskulární onemocnění, diabetes, alkoholismus nebo stařecká křehkost v anamnéze pacienta.
Výzkum perioperačních kognitivních změn v minulosti probíhal v izolaci od studií zkoumajících kognitivní dysfunkce v populaci, která nepodstupovala operaci a anestezii [5], což vedlo k nomenklaturním neshodám. Dříve používaným termínem označujícím zhoršení kognitivních funkcí po operačním zákroku byla pooperační kognitivní dysfunkce (POCD – PostOperative Cognitive Dysfunction). K diagnostice bylo používáno mnoho různých neuropsychologických testů před a po operaci, ve variabilních časových úsecích po zákroku (3 měsíce až 7,5 let) [5]). Hlavním problémem byla nejednotnost a nejasná bodová hranice testů, což znemožňovalo validní srovnání výsledků a provedení kvalitního výzkumu.
V roce 2018 byl Americkou anesteziologickou společností (ASA – American Society of Anesthesiologists) iniciován vznik mezioborové skupiny odborníků (ASA Brain Health Initiative Summit), která navrhla novou jednotnou nomenklaturu usnadňující výzkum a komunikaci mezi jednotlivými obory [1]. Termín POCD byl nahrazen termínem perioperační neurokognitivní porucha (PND – Perioperative Neurocognitive Disorder), který zahrnuje stavy zhoršení kognitivních funkcí v předoperačním (tedy nezávisle na operaci či anestezii) i v pooperačním období.
Hlavním cílem práce je informovat o změně názvosloví kognitivních dysfunkcí souvisejících s anestezií a operačním zákrokem, představit srovnání starší a nové terminologie a uvést aktuální možnosti prevence a terapie perioperační neurokognitivní poruchy.
Metodika vyhledávání
Metodika článku byla vedena jako advanced narrative review. Má stejný systematický postup jako klasické systematické review, ale bez nutnosti publikovat protokol. Obsahuje úvod (introduction), cíl sytematického review (review objectives), kritéria pro zahrnutí (inclusion criteria), metodiku (methods), kdy jsou vyhledané výsledky hodnoceny dvěma nezávislými hodnotiteli, kritické hodnocení studií (critical appraisal), výběr studií (study selection), extrakci dat (data extraction) a syntézu dat (data synthesis), výsledky (results) a závěr (conclusion). Selekce a proces vyřazování studií jsou uvedeny ve schématu 1.
Schéma 1. PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses) 
Metoda advanced narrative review dle Joanna Briggs Institute, Adelaide, Australia Vyhledávací strategie je uvedena v tabulce 1. Byly prohledány lékařské databáze Medvik, Medline, PubMed, EBM Reviews, Embase, Clinical trials, Current controled trials a Open Grey, v období 28. 6.–2. 7. 2021. Po kritickém zhodnocení relevantních textů zahrnutých v advanced narrative review byla jeho struktura rozčleněna do kapitol pooperační kognitivní dysfunkce, perioperační neurokognitivní porucha, identifikace rizikových faktorů PND, patofyziologie, preexistující neurokognitivní porucha, pooperační delirium, ostatní formy zhoršení kognitivních funkcí, perioperační strategie a předoperační příprava pacientů.
Tab. 1. Vyhledávací strategie (Pubmed) 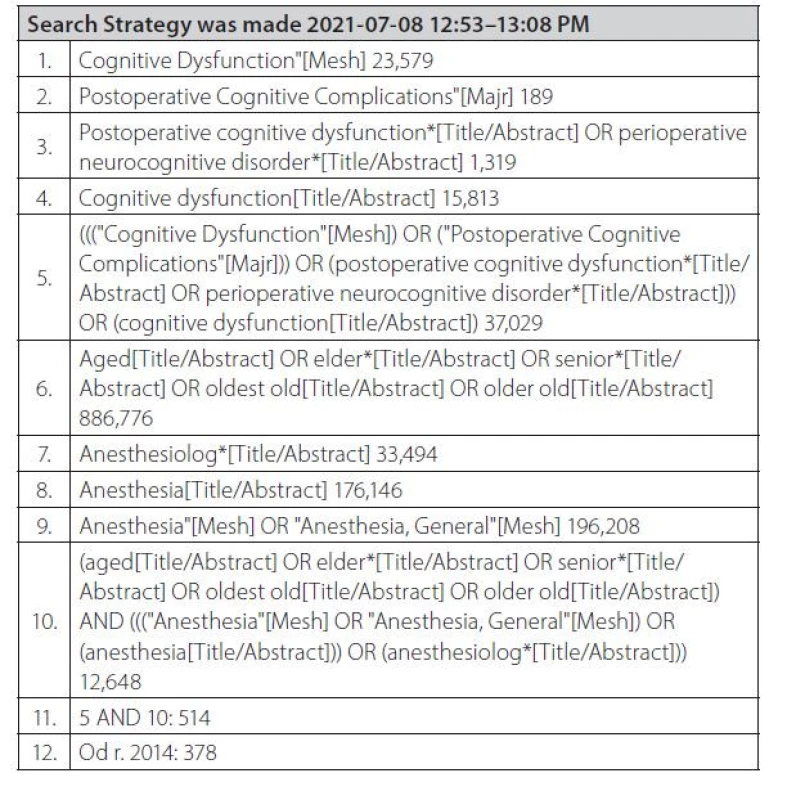
Pooperační kognitivní dysfunkce
Původní termín pooperační kognitivní dysfunkce (POCD) označoval zhoršení kognitivních funkcí po operačním zákroku. Definice se ovšem zásadně neshodovala s neuropsychiatrickými kritérii pro kognitivní poškození. Termín také nezahrnoval preexistující kognitivní poruchu před operací nebo zhoršení kognitivních funkcí, kterých si všiml sám pacient nebo jeho blízcí. K diagnostice POCD byla používána řada psychologických testů, které neměly jednotnou metodiku [6].
Perioperační neurokognitivní porucha
Nová nomenklatura navržená ASA Brain Health Initiative Summit sjednotila v souladu s diagnostickým a statistickým manuálem duševních poruch 5. edice (DSM‑V) názvosloví a diagnostiku všech kognitivních poruch, čímž se dosáhlo transparentnější mezioborové komunikace. Perioperační neurokognitivní porucha (PND) zastřešuje zhoršení kognitivních funkcí v předoperačním i perioperačním období. Její symptomy zahrnují alteraci v chování, afektu a kognici. Rozděluje se na preexistující neurokognitivní poruchu (NCD – NeuroCognitive Disorder), pooperační delirium (akutní forma) a ostatní formy neurokognitivní poruchy, kam patří opožděné (neuro)kognitivní zotavení (zhoršení kognitivních funkcí do 30 dnů po operaci) a pooperační (neuro)kognitivní poruchu (POCD – Postoperative Neurocognitive Disorder), která může být diagnostikována v období do 12 měsíců po operaci [3]. Tyto nomenklaturní změny jsou založeny na hodnocení 3 oblastí dle manuálu DSM‑V: subjektivní stížnosti (pacient, jiná blízká osoba, lékař), objektivním zhoršení nebo změně kognice a zhoršení ve vykonávání běžných aktivit denního života.
Identifikace rizikových faktorů vzniku PND
Podle současného stavu poznání není k dispozici dostatek důkazů, které by jednoznačně definovaly rizikové faktory vzniku PND. Nelze určit, zda a do jaké míry se na problematice podílí anestezie, operační výkon, či oba faktory [2]. Podle studie autorů Tzimas et al. z roku 2016 může být opakované vystavování seniorů vlivům celkové anestezie potenciálním rizikovým faktorem pro větší poškození krátkodobé paměti [7].
Mezi předoperační rizikové faktory vzniku PND patří NCD, demence, nižší dosažené vzdělání, anémie, historie vaskulárního onemocnění a předchozí mozková příhoda nebo infekce SARS‑CoV-19 [8–13]. Věk je nezávislým rizikovým faktorem [14]. Mezi další rizikové faktory se může řadit vliv přerušovaného spánku, excesivního příjmu alkoholu, užívání psychotropních léků, předchozí poškození neuronů, stařecká křehkost a diabetes mellitus [9, 10, 15–23]. Křehkost (neboli frailty) je stav snížených fyziologických rezerv a rezistence ke stresorům, s prevalencí až 26 % u lidí nad 85 let [24]. Tito pacienti mohou být náchylnější ke vzniku geriatrických syndromů a perioperačních komplikací jako je pooperační kognitivní dysfunkce [24]. Anamnesticky známý kognitivní deficit může hrát klíčovou roli ve vzniku pooperačního deliria a ostatních pooperačních kognitivních poruch, i tyto výsledky ovšem vyžadují další zkoumání [16].
Operační rizikové faktory zahrnují dlouhé, rozsáhlé a emergentní chirurgické výkony [9, 10, 26–28], zejména rizikové jsou kardiochirurgické operace [29]. Mezi pooperační rizikové faktory se řadí bolest, dyskomfort, smyslová deprivace, specifické laboratorní abnormality (především abnormální hladiny sodíku a glykemie) a přijetí na jednotku intenzivní péče [30].
Patofyziologie
Patofyziologie PND není stále objasněna. Hlavním důvodem je heterogenita podílejících se rizikových faktorů [1]. Jednou z hlavních hypotéz patofyziologie PND je přítomnost aberantního oxidativního buněčného metabolismu, který způsobuje neurotransmiterové abnormality. Jiná hypotéza je založena na stresové odpovědi sympatického nervového systému na chirurgický výkon a celý perioperační proces včetně samotné hospitalizace, včetně alterace osy hypotalamus – nadledvinky, což vede ke zvýšení vylučování cytokinů a změně koncentrace neurotransmiterů [1]. Další hypotézy poukazují na vliv perioperační neuroinflamace nebo možnou akceleraci skryté Alzheimerovy choroby či jiného cerebrovaskulárního onemocnění [1]. Tyto čtyři hypotézy se pravděpodobně navzájem nevylučují. Hypotézu vlivu neuroinflamace podporují recentní studie, které poukázaly na možné postižení hematoencefalické bariéry samotným chirurgickým výkonem nebo anestezií, kdy dochází k aktivaci zánětlivých faktorů jako je TNF‑α a NF‑κB, což vede ke snížení kognitivní funkce hippokampu [31]. Komplement C3 se může podílet na kognitivním poškození indukovaném anestezií a operačním zákrokem, možným mechanismem se jeví abnormální signalizace komplementu a disrupce synapsí [32].
Preexistující neurokognitivní porucha
Preexistujicí neurokognitivní onemocnění (NCD) je charakterizované objektivním měřitelným úbytkem kognitivních funkcí ve srovnání s běžnou populací. Není důsledkem obav, úzkosti nebo deprese z nadcházející anestezie a operace. Jeho symptomy se dělí na mírné, střední nebo velké (odpovídající demenci) [3]. NCD se střední mírou kognitivního poškození se u věkové skupiny nad 70 let vyskytuje ve 14–48 % [33].
Pooperační delirium
Dle klasifikace DSM‑V charakterizuje pooperační delirium porucha pozornosti, kognice nebo vědomí, které se rozvine během krátkého časového období a má fluktuující charakter [34]. Rozlišujeme tři formy deliria – hyperaktivní, hypoaktivní a smíšené (nejčastější forma 40–60 %) [35]. Přívlastek pooperační se používá, pokud tento stav vznikne nově v období mezi 10. minutou po ukončení anestezie a jedním týdnem po operaci a splňuje DSM‑V kritéria [3]. Jako pooperační delirium nejsou hodnoceny stavy neklidu, zmatenosti, agitace, hyperexcitability nebo disinhibice přítomné krátce po probuzení z anestezie (do 10 minut), které obvykle odeznívají po odstranění dráždícího stimulu (například endotracheální rourky) [36–39]. Dle DSM ‑ V se delirium vyskytuje u 15–53 % starších pacientů po operaci a až u 70–87 % na jednotce intenzivní péče [40].
Patofyziologicky je vznik deliria chápán jako výsledek přímých inzultů působících na mozek nebo nepřímého působení akutních stresorů, které narušují homeostatické mechanismy mozku [20]. Rizikové faktory pro vznik pooperačního deliria se obvykle dělí na predisponující (pacientova základní zranitelnost) a precipitující (potenciálně reverzibilní vlivy v perioperačním období) [1]. Patří mezi ně věk nad 65 let, preexistující kognitivní deficit nebo demence, porucha sluchu nebo zraku, hypertenze (predisponující), tíže stavu při přijetí, přítomnost infekce, bolest (precipitující) [1, 10]. Přerušovaný spánek v nemocnici nebo doma může být nezávislým rizikovým faktorem [17]. Hodnotit tyto rizikové faktory před operačním zákrokem bylo doporučeno Americkou Geriatrickou Společností už v roce 2006 [15].
Pooperační delirium způsobuje prodlouženou hospitalizaci, další následný úbytek kognitivních funkcí, zhoršení výkonnosti, vyšší mortalitu, vyšší riziko opakované hospitalizace [41] a následnou zvýšenou potřebu domácí péče [42]. Mezi doporučené preventivní kroky k zabránění vzniku deliria patří řada nefarmakologických opatření – časná rehabilitace, redukce imobility, dodržování cirkadiánních rytmů, omezení smyslové deprivace, opakovaná reorientace a minimalizace hluku [43]. Preventivní efekt má také léčba hypoxie, hyperkapnie, anémie, kardiálního selhání, infekcí, selhání ledvin nebo jater, a psychiatrických onemocnění [44].
Jednou z uznávaných strategií pro léčbu bolesti, sedaci a prevenci deliria v intenzivní péči je eCASH koncept (early comfort and patient ‑ centred care without excessive sedation). Tato strategie má v prostředí jednotky intenzivní péče za cíl zajištění optimálního komfortu pacienta za pomocí pečlivé titrace analgetik a sedativ, které by měly být podávány v nejnižších možných dávkách. Hlavní prioritou je efektivní úleva od bolesti pomocí multimodální analgezie s důrazem na redukci vysokých dávek opioidů. Tento přístup napomáhá lepšímu spánkovému cyklu, brzké mobilizaci a lepší komunikaci pacienta s personálem [45].
Farmakologická prevence vzniku pooperačního deliria naopak doporučována není (především používání atypických antipsychotik nebo haloperidolu). V léčbě pooperačního deliria jsou preferována atypická antipsychotika nebo dexmedetomidin, pro použití haloperidolu chybí v literatuře jednoznačná evidence, benzodiazepiny doporučeny nejsou (pouze v léčbě deliria tremens). Podávání melatoninu jako preventivního opatření vzniku pooperačního deliria přineslo v malých randomizovaných studiích rozporuplné a nejednoznačné výsledky [1].
Ostatní formy zhoršení kognitivních funkcí
Dle časového úseku se dělí ostatní formy zhoršení kognitivních funkcí po operaci na opožděné neurokognitivní zotavení (diagnostikováno do 30 dní po operaci) a pooperační neurokognitivní poruchu (diagnostikovanou do 12 měsíců po operaci). Mezi symptomy těchto forem PND patří perzistentní nebo náhlé pooperační zhoršení kognitivních funkcí, kterých si všiml sám pacient, lékař nebo blízká osoba a jsou doprovázeny objektivními známkami poklesu v aktivitě běžných denních činností. Symptomy se rozlišují na mírné (odpovídající zhoršení kognitivních funkcí nenarušující fungování v aktivitách denního života) a vážné (odpovídající demenci) [40]. Přívlastek pooperační se vypouští, pokud byla diagnóza stanovena po 12 měsících [3]. Vyskytuje se přibližně u 17–43 % pacientů po operaci [6]. U některých pacientů, kteří na sobě pozorují alteraci kognitivních funkcí po operaci, nelze odhalit konzistentní zhoršení kognitivních funkcí v neuropsychologických testech [46]. Tito lidé mohou trpět vyšší mírou deprese nebo úzkosti [47]. Přestože probíhá výzkum vlivu hladin různých biomarkerů (například nepeptidový analog angiotensinu 1–7), jejich význam zůstává zatím nejistý. Léčba těchto poruch je většinou dlouhodobá [3].
Perioperační strategie
Podle recentních relevantních studií není možné jednoznačně určit, která farmaka, typy perioperačních technik či monitorování, mohou hrát úlohu v prevenci vzniku určitých typů PND (pooperačního deliria a ostatních forem zhoršení kognitivních funkcí) [12]. Rozhodnutí, zda použít regionální anestezii místo celkové není podpořeno validními daty. Studie zkoumající tuto problematiku nenašly zvýšené riziko pooperačního deliria nebo POCD při použití celkové anestezie ve srovnání s regionální anestezií [12]. Periferní blokády s analgosedací nebo bez ní nebyly dostatečně studovány. Se zvyšujícím se věkem stoupá citlivost na inhalační anestetika, proto je doporučeno korigovat MAC podle věku pacienta (pokles MAC o 6 % každou dekádu po 40. roku života)[12]. Přesto nebyl prokázán kauzální vztah mezi hloubkou anestezie a vývojem pooperačního deliria. Doporučeno je zabránit vzniku hypotenze během operačního zákroku ve snaze zajistit adekvátní cerebrální perfuzi [12]. Studie, které se věnovaly výzkumu vlivu hypotenze na vznik PND, však nepřinesly jednoznačné doporučení. Další výzkum ke zhodnocení a srovnání anesteziologických postupů, perioperační strategie a specifických postupů monitorace mozkových funkcí (BIS, EEG) je nezbytný [12].
Mezi rizikové léky pro pacienty starších 65 let patří první generace antihistaminik, anticholinergika, antipsychotika (první a druhá generace), benzodiazepiny, kortikosteroidy (hydrokortison a metylprednison), antagonisté H2 receptorů, petidin, metoklopramid a svalová relaxancia [12]. Ačkoliv perioperační použití dexametazonu nebo metylprednisolonu vedlo ke snížení zánětlivé odpovědi (teorie neuroinflamace), výsledky studií jsou nekonzistentní. Ketamin byl zkoumán pro své analgetické vlastnosti a eventuální možnost snížení spotřeby opioidů během operačního zákroku, ale výsledky studií jeho efekt na snížení výskytu pooperačního deliria neprokázaly [1].
Předoperační příprava pacientů
Nerozpoznaná kognitivní porucha se může u starších pacientů stát právním, etickým nebo logistickým problémem, zejména při podepisování informovaného souhlasu. Studie naznačují, že lékaři tento fakt při přípravě pacientů na operaci často přehlížejí [48].
Před podepsáním informovaného souhlasu k anestezii by měli být starší pacienti informováni o možnosti zhoršení kognitivních funkcí po operaci. Měli by vědět o možnosti vzniku symptomů po operaci jako je zmatenost, nepozornost nebo problémy s pamětí. To umožní pacientům i jejich rodinám získat realističtější pohled na budoucí operační výkon a připravit se na něj, což jim může napomoci udělat důležitá životní rozhodnutí, eventuálně se rozhodnout o odložení elektivního výkonu [12].
Po podání informací o rizicích by měla následovat objektivní evaluace kognice krátkým screeningovým nástrojem během předoperačního vyšetření u všech pacientů nad 65 let [12]. Kvůli časovým a ekonomickým restrikcím kladeným na předoperační vyšetření, může být detekce kognitivního deficitu v předoperačním období obtížná [49]. Anesteziolog ovšem v rámci předoperačního vyšetření obvykle kognitivní funkce nehodnotí a mírná kognitivní porucha může zůstat často nepovšimnuta. V praxi chybí vhodný test, protože během předoperační přípravy nelze provádět zdlouhavé neuropsychologické testy paměti. Nejpřínosnější pro každodenní praxi by byl krátký, orientační test kognitivních funkcí, který by pomohl anesteziologovi v identifikaci rizikových pacientů. Existuje nepřeberné množství testů hodnotících kognitivní funkce.
Známým testem v českém prostředí je test epizodické paměti na gesta (TEGEST test), který vyvinul prof. MUDr. Aleš Bartoš, Ph.D. Je určen pro rychlé orientační vyšetření paměti v klinické praxi (trvá 1–2 minuty). Vyšetřuje epizodickou paměť, afázii a apraxii [50]. Pacient si nemusí být zhoršení kognitivních funkcí vědom, proto mohou v diagnostice pomoci příbuzní, jsou‑li při vyšetření přítomni. Je doporučeno cíleně se dotazovat na zhoršení kognitivních funkcí po minulé anestezii [12] a dodržovat zásady během testování, jako jsou dostupnost pomůcek (brýle či sluchadlo) nebo vytvoření přátelského a rovnocenného prostředí pro pacienta. Dalším zdrojem informací může být zdravotnický informační systém nebo dokumentace. PND může mít vliv na soběstačnost pacientů, projevit se v aktivitách běžného denního života a zvyšovat závislost na pomoci druhých.
Závěr
Přestože termín POCD z odborné literatury nevymizel a stále se používá, je používání nové nomenklatury podporováno Americkou společností anesteziologů (ASA) [1]. Definice PND a její dělení umožňuje lepší mezioborovou komunikaci, validní a srovnatelnou metodiku výzkumu a detailnější identifikaci možných rizikových faktorů. Orientační vyšetření kognitivních funkcí a zhodnocení rizikových faktorů by mělo být rutinní součástí předoperační přípravy pacientů nad 65 let věku. Správně zvolená a cílená perioperační strategie, která sníží rizika vzniku či zhoršení PND, může významně redukovat sociální i ekonomické důsledky s ohledem na soběstačnost a kvalitu života pacientů [51].
Zkratky:
ASA = American Association of Anesthesiologist, Americká společnost anesteziologů
AGS = American Geriatrics Society, Americká geriatrická společnost
DSM‑V = Diagnostický a Statický Manuál, 5. edice
EEG = elektroencefalografie
NCD = neurocognitive disorder
MAC = minimální alveolární koncentrace
POCD = pooperační kognitivní dysfunkce
TEGEST test = test epizodické paměti na gesta
PROHLÁŠENÍ AUTORŮ: Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média. Střet zájmů: Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce. Podíl autorů: Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. I.K., J.L, T.D., V.J., se podíleli na rešeršní činnosti, návrhu struktury článku. Hodnocení nalezených abstraktů a na jejich kompletaci do článku se podíleli K.N. a T.G. Financování: Žádné. Poděkování: Děkuji doc. MUDr. Tomáši Gabrhelíkovi, Ph.D. za cenné rady, věcné připomínky a vstřícnost při konzultacích. Mé poděkování patří také doc. et doc. PhDr. Kateřině Ivanové, Ph.D. za odborné vedení a rady při zpracování článku. Registrace: N/A. Projednání etickou komisí: Žádné.
KORESPONDENČNÍ ADRESA AUTORKY
MUDr. Klára Nekvindová
Článek přijat redakcí: 25. 10. 2021; Článek přijat k tisku: 31. 1. 2022
Cit. zkr: Anest intenziv Med. 2022;33(1):39-44
Zdroje
1. Mahanna ‑ Gabrielli E, Eriksson L, Browndyke J, Wright C, Evered L, Scott A, et al. State of the clinical science of perioperative brain health: report from the American Society of Anesthesiologists Brain Health Initiative Summit 2018. BJA [online]. 2019 [cit. 2021-07-4];123(4):464-470. Dostupné z: https://www.bjanaesthesia.org/article/S0007-0912(19)30556-2/fulltext.
2. O’ Brien H, Mohan H, Hare CO, Reynolds JV, Kenny RA. Mind over matter? the hidden epidemic of cognitive dysfunction in the older surgical patient. Ann Surg [online]. 2017 [cit. 2021-5-7];265(4):677-691. Dostupné z: https://pubmed.ncbi.nlm.nih.gov/27537541/ doi: 10.1097/SLA.0000000000001900.
3. Eckenhoff RG, Maze M, Xie Z, Culley DJ, Goodlin SJ, Zuo Z, Wei H, Whittington RA, Terrando N, Orser BA, Eckenhoff MF. Perioperative Neurocognitive Disorder: State of the Preclinical Science. Anesthesiology. 2020 Jan;132(1):55-68. doi: 10.1097/ALN.0000000000002956. PMID: 31834869; PMCID: PMC6913778.
4. Boone MD, Sites B, Recklinghausen FM, Mueller A, Taenzer AH, Shaefi S. Economic burden of postoperative neurocognitive disorders among US medicare patients. JAMA Netw Open [online]. 2020 [cit. 2021–07-01]. 3(7): e208931. doi:10.1001/jamanetworkopen.2020.8931.
5. Evered L, Silbert B, Knopman D, Scott D, DeKosky S, Rasmussen L, et al. Recommendation for the nomenclature of cognitive change associated with anaesthesia and surgery-2018. BJA [online]. 2018 [cit. 2021-4-7];121(5): 1005-1012. Dostupné z: https://www.bjanaesthesia.org/article/S0007-0912(17)54082-9/fulltext#relatedArticles.
6. Evered L, Scott DA, Silbert B, Maruff P. Postoperative cognitive dysfunction is independent of type of surgery and anesthetic. Anesth Analg. [online]. 2011 [cit. 2021-06-28];112(5):1179-1185. Dostupné z: https://pubmed.ncbi.nlm.nih.gov/21474666/. doi: 10.1213/ANE.0b013e318215217e.
7. Tzimas P, Andritsos E, Arnaoutoglou E, Papathanakos G, Papadopoulos G. Short‑term postoperative cognitive function of elderly patients undergoing first versus repeated exposure to general anaesthesia. Middle East J Anaesthesiol. [online]. 2016 [cit. 2021-07-11]; 23(5):535-542. Dostupné z: https://pubmed.ncbi.nlm.nih.gov/27487639/.
8. Culley DJ, Flaherty D, Fahey MC, Rudolph JL, Javedan H, Huang CC, et al. Poor performance on a preoperative cognitive screening test predicts postoperative complications in Older Orthopedic Surgical Patients. Anesthesiology [online]. 2017 [cit. 2021-07-16]; Nov;127(5):765-774. doi: 10.1097/ALN.0000000000001859.
9. Aldecoa C, Bettelli G, Bilotta F, Sanders RD, Audisio R, Borozdina A, et al. European society of anaesthesiology evidence‑based and consensus‑based guideline on postoperative delirium. Eur J Anaesthesiol. [online]. 2017 [cit. 2021-07-28]; 2017 Apr;34(4):192-214. doi: 10.1097/EJA.0000000000000594.
10. American Geriatrics Society Expert Panel on Postoperative Delirium in Older Adults. American geriatrics society abstracted clinical practice guideline for postoperative delirium in older adults. J Am Geriatr Soc. [online]. 2015 [cit. 2021-07-26]; 63(1):142-150. doi: 10.1111/jgs.13281.
11. Berian JR, Zhou L, Russell MM, Hornor MA, Cohen ME, Finlayson E, Ko CY, Rosenthal RA, Robinson TN. Postoperative Delirium as a target for surgical quality improvement [online]. 2018 [cit. 2021-06-17];268(1):93-99. doi: 10.1097/SLA.0000000000002436.
12. Berger M, Schenning KJ, Brown CH, Deiner SG, Whittington RA, Eckenhoff RG, Angs MS, et al. Perioperative Neurotoxicity Working Group. Best practices for postoperative brain health: Recommendations from the fifth international perioperative neurotoxicity working group. Anesthesia and Analgesia [online]. 2018 [cit. 2021-07-3];127(6):1406-1413. doi: 10.1213/ane.0000000000003841.
13. Scott DA, Evered L, Maruff P, MacIsaac A, Maher S, Silbert BS. Cognitive function before and after left heart catheterization. J Am Heart Assoc. [online]. 2018 [cit. 2021-07-6];10;7(6): e008004. doi: 10.1161/JAHA.117.008004.
14. Watt J, Tricco AC, Talbot‑Hamon C, Pham B, Rios P, Grudniewicz A, et al. Identifying older adults at risk of delirium following elective surgery: a systematic review and meta‑analysis. Journal of general internal medicine [online]. 2018 [cit. 2021-07-3]; 33(4),500-509. Dostupné z: https://doi.org/10.1007/s11606-017-4204-x.
15. Dasgupta M, Dumbrell AC. Preoperative risk assessment for delirium after noncardiac surgery: a systematic review. Journal of the American Geriatrics Society [online]. 2006 [cit. 2021–07-10]; 54(10),1578-1589. Dostupné z: https://doi.org/10.1111/j.1532-5415.2006.00893.x.
16. Scholz AF, Oldroyd C, McCarthy K, Quinn TJ, Hewitt J. Systematic review and meta‑analysis of risk factors for postoperative delirium among older patients undergoing gastrointestinal surgery. The British journal of surgery [online]. 2016 [cit. 2021-07-6];103(2), e21-e28. Dostupné z: https://doi.org/10.1002/bjs.10062.
17. Todd OM, Gelrich L, MacLullich AM, Driessen M, Thomas C, Kreisel SH. Sleep disruption at home as an independent risk factor for postoperative delirium. Journal of the American Geriatrics Society [online]. 2017 [cit. 2021-07-9];65(5),949-957. Dostupné z: https://doi.org/10.1111/jgs.14685.
18. Feinkohl I, Winterer G, Pischon T. Diabetes is associated with risk of postoperative cognitive dysfunction: a meta‑analysis. Diabetes Metab Res Rev. [online]. 2017 [cit. 2021-07-26]; 33(5):10. doi:10.1002/dmrr.2884.
19. Hermanides J, Qeva E, Preckel B, Bilotta F. Perioperative hyperglycemia and neurocognitive outcome after surgery: a systematic review. Minerva Anestesiol. [online]. 2018 [cit. 2021-07-13];84(10):1178-1188. doi: 10.23736/S0375-9393. 18. 12400-X.
20. Borozdina A, Qeva E, Cinicola M, Bilotta F. Perioperative cognitive evaluation. Curr Opin Anaesthesiol. [online]. 2018 [cit. 2021-07-20];31(6):756-776. doi: 10.1097/ACO.0000000000000658.
21. Kant IMJ, de Bresser J, van Montfort SJT, Slooter AJC, Hendrikse J. Markers of neurodegenerative and neurovascular changes in relation to postoperative delirium and postoperative cognitive decline. Am J Geriatr Psychiatry [online]. 2017 [cit. 2021-07-18];25(10): 1048-1061. doi: 10.1016/j.jagp.2017. 06. 016.
22. Brown CH 4th, Max L, LaFlam A, Kirk L, Gross A, Arora R, et al. The association between preoperative frailty and postoperative delirium after cardiac surgery. Anesth Analg. [online]. 2016 [cit. 2021-07-24];123(2):430-435. doi: 10.1213/ANE.0000000000001271.
23. Nomura Y, Faegle R, Hori D, Al‑Qamari A, Nemeth AJ, Gottesman R, et al. Cerebral small vessel, but not large vessel disease, is associated with impaired cerebral autoregulation during cardiopulmonary bypass: a retrospective cohort study. Anesth Analg. [online]. 2018 [cit. 2021-07-15];127(6):1314-1322. doi: 10.1213/ANE.0000000000003384.
24. Lin HS, McBride RL, Hubbard RE, McBride RL, Hubbard RE. Frailty and anesthesia - risks during and post‑surgery. Local Reg Anesth. [online]. 2018 [cit. 2021-07-14];11 : 61-73. doi: 10.2147/LRA.S142996.
25. Knaak C, Brockhaus WR, Spies C, Borchers F, Piper K, Radtke FM, et al. Presurgical cognitive impairment is associated with postoperative delirium and postoperative cognitive dysfunction. Minerva anestesiologica [online]. 2020 [cit. 2021-07-10];86(4),394-403. Dostupné z: https://doi.org/10.23736/S0375-9393. 20. 13903-8.
26. Beishuizen SJ, Scholtens RM, van Munster BC, de Rooij SE. Unraveling the relationship between delirium, brain damage, and subsequent cognitive decline in a cohort of individuals undergoing surgery for hip fracture. J Am Geriatr Soc. [online]. 2017 [cit. 2021-07-27];65(1):130-136. doi: 10.1111/jgs.14470.
27. Schulte PJ, Roberts RO, Knopman DS, Petersen RC, Hanson AC, Schroeder DR, et al. Association between exposure to anaesthesia and surgery and long‑term cognitive trajectories in older adults: report from the Mayo Clinic Study of Aging. Br J Anaesth. [online]. 2018 [cit. 2021-07-22];121(2):398-405. doi: 10.1016/j.bja.2018. 05. 060.
28. Berian JR, Zhou L, Russell MM, Hornor MA, Cohen ME, Finlayson E, et al. Postoperative delirium as a target for surgical quality improvement. Ann Surg. [online]. 2018 [cit. 2021-07-11]; 268(1):93-99. doi: 10.1097/SLA.0000000000002436.
29. Berger M, Terrando N, Smith SK, Browndyke JN, Newman MF, Mathew JP. Neurocognitive function after cardiac surgery: from phenotypes to mechanisms. Anesthesiology [online]. 2018 [cit. 2021-08-12]; 129(4):829-851. doi: 10.1097/ALN.0000000000002194.
30. Pandharipande PP, Girard TD, Jackson JC, Morandi A, Thompson JL, Pun BT, et al. Long‑term cognitive impairment after critical illness. The New England journal of medicine [online]. 2013 [cit. 2021-07-22];369,14 : 1306-1316. doi:10.1056/NEJMoa1301372.
31. Zhu S, Zhao S, Wang X. Effect of intraoperative sedation on PND in elderly patients effect of intraoperative sedation on perioperative neurocognitive disorders in elderly patients., EBM Reviews – Cochrane Central Register of Controlled Trials [online]. 2021 [cit. 2021-07-14]. NCT04891458. Dostupné z: https://clinicaltrials.gov/show/NCT04891458.
32. Ji MH, Qiu LL, Mao MJ, Zhang L, Yang JJ. Hippocampal complement C3 might contribute to cognitive impairment induced by anaesthesia and surgery. Neuroreport [online]. 2020 [cit. 2021-07-23]; 7;31(7):507-514. doi: 10.1097/WNR.0000000000001422.
33. Petersen RC, Roberts RO, Knopman DS, Boeve BF, Geda YE, Ivnik RJ, et al. Mild cognitive impairment: ten years later. Arch Neurol. [online]. 2009 [cit. 2021-06-27]; Dec;66(12):1447-55. doi: 10.1001/archneurol.2009.266.
34. Janjua MS, Spurling BC, Arthur ME. Postoperative Delirium. In: StatPearls Treasure Island (FL): StatPearls Publishing [online]. 2021 [cit. 2021-07-11]. Dostupné z: https://www.ncbi.nlm.nih.gov/books/NBK534831/.
35. Devlin JW, Fong JJ, Fraser GL, Riker RR. Delirium assessment in the critically ill. Intensive Care Med. [online]. 2007 [cit. 2021-07-14]; 33(6):929-940. doi: 10.1007/s00134-007-0603-5
36. Hewer CL. The stages and signs of general anaesthesia. Br Med J. [online]. 1937 [cit. 2021-07-18]; 7;2(3996):274-6. doi: 10.1136/bmj.2.3996.274.
37. Card E, Pandharipande P, Tomes C, Lee C, Wood J, Nelson D, et al. Emergence from general anaesthesia and evolution of delirium signs in the post‑anaesthesia care unit. Br J Anaesth. [online]. 2015 [cit. 2021-07-14]; 115(3):411-417. doi: 10.1093/bja/aeu442.
38. Guenther U, Riedel L, Radtke FM. Patients prone for postoperative delirium: preoperative assessment, perioperative prophylaxis, postoperative treatment. Curr Opin Anaesthesiol. [online]. 2016 [cit. 2021-06-22]; 29(3):384-390. doi: 10.1097/ACO.0000000000000327.
39. Munk L, Andersen G, Møller AM. Post‑anaesthetic emergence delirium in adults: incidence, predictors and consequences. Acta Anaesthesiol Scand. [online]. 2016 [cit. 2021-07-20]; 60(8):1059-1066. doi: 10.1111/aas.12717.
40. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. Fifth Edition, Washington DC: American Psychiatric Association Publishing [online]. 2013 [cit. 2021-07-14];598-602. Dostupné z: http://repository.poltekkes‑kaltim.ac.id/657/1/Diagnostic%20and%20statistical%20manual%20of%20mental%20disorders%20_%20DSM-5%20%28%20PDFDrive.com%20%29.pdf.
41. Robinson TN, Raeburn CD, Tran ZV, Angles EM, Brenner LA, Moss M. Postoperative delirium in the elderly: risk factors and outcomes. Ann Surg. [online]. 2009 [cit. 2021-07-11]; 249(1):173-8. doi: 10.1097/SLA.0b013e31818e4776.
42. Zugni N, Guadrini L, Rasulo F. Non‑invasive neuromonitoring in the operating room and its role in the prevention of delirium. Best Pract Res Clin Anaesthesiol. [online]. 2020 [cit. 2021-07-11]; 35(2):191-206. doi: 10.1016/j.bpa.2020. 09. 006.
43. Kenndy M, Enander RA, Tadiri SP, Wolfe RE, Shapiro Ni, Marcatonio ER. Delirium risk prediction, healthcare use and mortality of eldery adulst in the emergency department. J Am Geriatr. [online]. 2014 [cit. 2021-07-19]; 62(3):462-9. doi: 10.1111/jgs.12692.
44. Macedo G, Diógenes A, Remígio D, Correia M, Pinheiro F, Rêgo A, et al. Delirium in the elderly hospitalized. Literature Review [online]. 2019 [cit. 2021-07-11]. 10. 30-36. Dostupné z: https://www.researchgate.net/publication/330184078_Delirium_In_The_Elderly_Hospitalized_A_Literature_Review.
45. Vincent JL, Shehabi Y, Walsh TS, Pandharipande PP et al. Comfort and patient‑centred care without excessive sedation: the eCASH concept. Intensive Care Med. [online]. 2016 [cit. 2021-07-12]. Jun;42(6):962-71. doi: 10.1007/s00134-016-4297-4.
46. Belrose JC, Noppens RR. Anesthesiology and cognitive impairment: a narrative review of current clinical literature. BMC Anesthesiol. [online]. 2019 [cit. 2021-08-12]. 27;19(1):241. doi: 10.1186/s12871-019-0903-7.
47. Newman S, Klinger L, Venn G, Smith P, Harrison M, Treasure T. Subjective reports of cognition in relation to assessed cognitive performance following coronary artery bypass surgery. J Psychosom Res. [online]. 1989 [cit. 2021-07-22]; 33(2):227-33. doi: 10.1016/0022-3999(89)90050-0.
48. Sessums LL, Zembrzuska H, Jackson JL. Does this patient have medical decision‑making capacity? JAMA [online]. 2011 [cit. 2021-07-16]; 27;306(4):420-7. doi: 10.1001/jama.2011.1023.
49. Borchers F, Knaak C, Piper SK, Spies C. Empfehlungen zur erfassung und beschreibung perioperativer kognitiver störungen in wissenschaft und praxis [Recommendations for the detection and specification of perioperative neurocognitive disorders]. Anasthesiol Intensivmed Notfallmed Schmerzther [online]. 2019 [cit. 2021-08-12]; 54(11-12):652-667. German. doi: 10.1055/a-0853-3060.
50. Bartoš A. Nové testy paměti. [online]. 2018. [cit. 13. 10. 2021]. Dostupné z: https://www.nudz.cz/adcentrum/dokumenty/3_Bartos_Nove_Testy_Pameti_Zlist_2018.pdf.
51. Norris CM, Close JCT. Prehabilitation for the frailty syndrome: improving outcomes for our most vulnerable patients. Anesth Analg. [online]. 2020 [cit. 2021-08-10]. 130(6):1524-1533. doi: 10.1213/ANE.0000000000004785.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2022 Číslo 1- Jak souvisí postcovidový syndrom s poškozením mozku?
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Základní autorskoprávní aspekty v kontextu lékařských publikací
- Nové supraglotické pomůcky v klinické praxi
- Principy systémové bezopioidní anestezie a pooperační analgezie, naše zkušenosti u bariatrických chirurgických výkonů
- ČSARIM v roce 2022 – krátké ohlédnutí zpět a pohled dopředu
- Heparinem indukovaná trombocytopenie v perioperačním období
- Význam střevní mikrobioty u kriticky nemocných pacientů a možnosti jejího ovlivnění
- Perioperační neurokognitivní porucha – advanced narrative review
- Česká intenzivní medicína – výhledy do budoucnosti
- Anesteziologické možnosti ovlivnění přehlednosti operačního pole při endonazální chirurgii
- Tracheální intubace při vědomí u dospělých za použití různých optických technik – přehledný článek a metaanalýza
- Deficit butyrylcholinesterázy aneb „Pamatuji si na intubaci“
- Botulotoxin A pro bederní sympatickou blokádu při syndromu regionální chronické bolesti
- Kombinace „hypertonický roztok NaCl a furosemid“ v léčbě srdečního selhání – 20 let od konceptu k účinné (ale stále možná opomíjené) klinické intervenci
- Předoperační POCT ultrazvuk významně zpřesňuje zhodnocení křehkosti a pooperační perspektívy
- K článku: Prevence venózní tromboembolie u pacientů v intenzivní péči
- Funkční kvalita života po zresuscitované nitronemocniční srdeční zástavě
- Odpověď autorů K článku: Prevence venózní tromboembolie u pacientů v intenzivní péči
- Doporučení Evropské kardiologické společnosti (ESC) pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2021
- Desatero přikázání pro léčbu srdečního selhání podle ESC 2021
- Praxe podávání systémových kortikosteroidů kriticky nemocným pacientům s covidem-19 v České republice – dotazníkový průzkum (studie ASAP‑ C)
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Principy systémové bezopioidní anestezie a pooperační analgezie, naše zkušenosti u bariatrických chirurgických výkonů
- Deficit butyrylcholinesterázy aneb „Pamatuji si na intubaci“
- Nové supraglotické pomůcky v klinické praxi
- Význam střevní mikrobioty u kriticky nemocných pacientů a možnosti jejího ovlivnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



