-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Propofol v Československu používáme již 30 let – historie intravenózních anestetik
Propofol has already been used in Czechoslovakia for 30 years – history of intravenous anaesthetics
The article presents discovery of intravenous anaesthetic drugs that preceded or followed introduction of propofol as well as notable names connected with this history.
Keywords:
history – Intravenous injections – intravenous anaesthetics – discovery – abuse
Autoři: J. Málek 1,2; L. Hess 2,3
Působiště autorů: Klinika anesteziologie a resuscitace 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha 1; Komise pro historii ČSARIM JEP 2; Experimentální pracoviště, Institut klinické a experimentální medicíny, Praha 3
Vyšlo v časopise: Anest. intenziv. Med., 32, 2021, č. 3, s. 142-149
Kategorie: Přehledový článek
Souhrn
Článek popisuje historii objevu intravenózních anestetik, která předcházela či následovala po zavedení propofolu do klinické praxe, a jména osob, které se na těchto objevech podílely.
Klíčová slova:
historie – nitrožilní injekce – nitrožilní anestetika – objevy – zneužití
Úvod
Propofol je v ČR v současnosti pravděpodobně nejpoužívanějším nitrožilním anestetikem. Poprvé byl jako Diprivan v Československu registrován Státním ústavem pro kontrolu léčiv dne 29. 5. 1991, 4 roky poté, co byl pod týmž jménem registrován ve Velké Británii a 2 roky po registraci v USA. Propofol je považován za transformační lék, protože změnil významným způsobem lékařskou praxi nejen v anestezii, ale i v sedaci. To vedlo k řadě nových doporučení a často i k vyostřeným mezioborovým diskuzím. Propofol v anesteziologii nahradil thiopental, který byl dominantním nitrožilním anestetikem téměř půl století, a zatím se nezdá, že by propofolu vyrůstala významná konkurence. Cesta k jeho uvedení na trh však byla dlouhá, a i poté prodělal mnoho změn.
Prvé začátky: opium a alkohol
Ačkoliv se obecně považuje za začátek éry nitrožilních farmak určených k uvedení pacientů do bezvědomí thiopental, předcházelo mu mnoho jiných látek. Historie intravenózního podávání látek začíná asi nejdříve v 17. století poté, co anglický lékař William Harwey (1578–1657) v r. 1603 objevil a v r. 1628 publikoval existenci krevního oběhu a jeho význam. Injekční jehla ještě nebyla objevena a k pokusům se využívaly různé měchýře nebo stříkačky (stříkačky ve formě dutého válce s pístem byly známé již dlouho) napojené na duté kanyly z nejrůznějších materiálů, které se do žíly zaváděly po venesekci. Hlavními pokusnými zvířaty té doby byli psi, protože se dali snadno sehnat a byli dostatečně velcí. Anestezie ani analgezie experimentálních zvířat se neprováděly, vivisekce byly běžné. Prvá nitrožilní aplikace se odehrála pravděpodobně v r. 1656 v anglickém Oxfordu, i když Dundee uvádí, že Rakušan Lausitz omámil psa nitrožilním podáním vína již v r. 1642 [1]. Iniciátorem pokusu v Oxfordu byl vzdělaný aristokrat Robert Boyle (obr. 1), který se mimo jiné zajímal o rozdílné účinky „indiánských“ hadích a pavoučích jedů aplikovaných buď orálně, nebo vstříknutím do těla, kde působí přes poraněné cévy. Boyle poskytnul lehkého a štíhlého psa s dobře přístupnými žílami. Hlavní osobou byl Christopher Wren (1632–1723), všestranně vzdělaný vědec, matematik, astronom a architekt, kterému asistovalo několik „eminentních lékařů a dalších vzdělaných mužů“ [2]. Pes byl v supinační poloze pevně připoután ke stolu a Wren mu vypreparoval žílu na pánevní končetině. Po založení distální ligatury a podložení mosaznou destičkou rychle podal stříkačkou (někde se udává měchýřem s husím brkem) experimentální roztok (obr. 2). Tím bylo opium rozpuštěné v silném víně, oboje v medicíně často orálně používané. Po uvolnění se pes chvíli potácel, a pak byl omámen tak, že byly uzavírány sázky, zda přežije. Boyle však chtěl psa zachovat pro další pokusy, takže ho bičíkem nutili k pohybu, aby se zotavil. Pes přežil pokus v pořádku a žil na dvoře rezidence Boyla minimálně několik měsíců, než mu byl ukraden [2]. Podobný pokus publikoval Thomas Willis v roce 1674–1675, kdy injikoval asi 90 ml silného roztoku opia v kanárském víně (tinktury z lichořeřišnice žluté?) do jugulární žíly u psa. Nástup anestezie trval asi čtvrt hodiny a pes se rovněž zotavil. Obdobné pokusy se konaly i jinde, ale bez myšlenky využití k anestezii u člověka. Přesto jako kuriozitu lze uvést, že Boyleho asistent a společník při pokusech, Robert Hooke, byl tak dojat utrpením psů při vivisekcích a vlastních pokusech s pneumotoraxem a umělým dýcháním, že uvažoval o možnosti zlepšení jejich osudu podáním opia.
Obr. 1. Obraz „Učenci“ od Rity Greerové (2007). Robert Hooke (vlevo) provádí pokus s vývěvou, Robert Boyle (s knihou) dohlíží na průběh. Zdroj: Wikimedia Commons (CC BY 4.0) 
Obr. 2. „Christopher Wren demonstruje Dr. Willisovi v roce 1667 svoji metodu podání látky do žíly“. Namaloval Ernest Board, okolo r. 1912. Zdroj: Wikimedia Commons (CC BY 4.0) 
Ch. Wren byl také prvním, kdo se pokusil podat látku do žíly u člověka. Pokusnou osobou byl odsouzený sluha, kterého jeho pán, zahraniční vyslanec a též nadšený experimentátor, Wrenovi nabídl. Injekce vinum emeticum (víno s tartarátem antimonylo‑draselným [4]) však podána nebyla, protože muž ať již skutečně, či předstíraně omdlel (citace v [3]).
První publikované dokončené nitrožilní injekce u člověka (nepočítaje pokusy o krevní transfuze) sloužily především k léčbě různých vředů, syfilis, a dalších neduhů pomocí rostlinných výluhů. Za publikaci prvního podání alkoholu do žíly u člověka se považuje latinsky psaná disertace G. F. Stiria: Dissertatio medica de Chirurgia infusoria, Leipzig, 1668. Stirius shrnuje problematiku nitrožilního podání jak u experimentálních zvířat, tak u člověka [3]. Popsal, že stejné množství běžně používané u lidí působí u psa spánek, ale u koček delirium. Další přehlednou prací je kapitola M. G. Purmanna o chirurgických procedurách, která vyšla v r. 1683 v Londýně. Nejčastěji citovanými přípravky byla laxativa, purgativa, emetika a narkotika. Purmann uvedl, že opium působí spánek, ale ve velké dávce smrt [3].
Proč se pokusy dále nerozvíjely a první operace nebyly prováděny v celkové intravenózní anestezii (TIVA, Total Intravenous Anaesthesia) s alkoholem a opiem? Příčin bylo několik. Jak vysvětluje Málek [5], snaha o potlačení bolesti během operací nebyla v 17. a na začátku 18. století na pořadu dne. Další problémy byly technické: nebylo snadné získat dlouhodobý přístup do žíly, vztah mezi dávkou a účinkem nebyl ještě znám, navíc z důvodů nejednotného složení injikovaných směsí nebyl ani měřitelný, a konečně cílem tehdejších experimentátorů byla především vědecká zvídavost bez jasného cíle [2]. Pokusy prováděli vzdělanci, kteří měli velmi široký záběr zájmů (viz Ch. Wren) a praktické využití bylo mimo jejich obor. Pokusy s nitrožilním podáním látek u člověka byly nakonec zakázány po smrtelné komplikaci během transfuze jehněčí krve a musely čekat ještě dlouho po objevu injekční jehly a stříkačky [3]. Nové, promyšlenější experimenty s nitrožilními injekcemi probíhaly až na konci 18. a začátku 19. století a vedly k objevu vzduchové embolie a k pokusům o léčbu tetanu a hydrofobie [2]. Na přelomu 19. a 20. století se nitrožilně aplikoval chinin při léčbě malárie a soli stříbra pro léčbu různých infekcí.
Alkohol jako nitrožilní anestetikum zažil svoji renesanci až ve 20. století. Behan v r. 1920 používal 5% roztok alkoholu k sedaci a výživě u pacientů po operaci a Nakagawa v r. 1921 a Cadot a Laugier v r. 1922 experimentovali v anestezii s roztoky obsahující chlorid sodný, alkohol a ether či morfin [6]. Velkou sérii pokusů na zvířatech následovanou několika sty podáními u pacientů publikoval ve své disertační práci mladý mexický armádní lékař Miguel Garcia Martin v r. 1929 [7]. Vědecká komise však metodu zavrhla jako bezcennou, nebezpečnou a pro člověka nepoužitelnou [6]. Martinova práce byla ještě několikrát citována a proběhlo pár pokusů, ale alkohol jako i.v. anestetikum byl zapomenut po další třetinu století. Nový zájem začal až po 2. světové válce. Alkohol byl podáván jak k běžným operacím, tak k udržování anestezie při mimotělním oběhu, kdy nešla použít inhalační anestetika. Chapman et al. [8] v r. 1951 popsali podání 7,5% alkoholu v 5% roztoku glukózy s malým množstvím DEMEROLu (pethidinu) k tišení bolestí při porodu. Dundee [6] v r. 1968 doporučil po řadě výzkumů následující metodu: optimální koncentrace etanolu je 8 % v Hartmannově roztoku (roztok sodných, draselných, vápenatých a chloridových iontů doplněný laktátem); nižší vede při snaze o rychlý úvod k přetížení tekutinami, 10% pak ke komplikacím (bolest, flebitida a trombóza). K potenciaci účinků a potlačení deliria při úvodu lze podat barbituráty, k terapii deliria po probuzení diazepam. Výhodné byly i nutriční účinky, do infuze se někdy přidávaly aminokyseliny. Karp ve své statistice (citace v [9]) uvádí, že během let 1942–1951 spotřebovali celkem přes 3 121 litrů alkoholu ve formě 5–10% roztoku podaného intravenózně 2 000 pacientů k anestezii nebo sedaci. Ještě v r. 1971 se objevuje článek o použití etanolu k anestezii u malých gynekologických výkonů [10], ale pak zprávy končí.
Injekční jehla a stříkačka
V současnosti považujeme toto vybavení za samozřejmé, ale kvalitní stříkačka s pístem a standardizovaným napojením na standardizovanou jehlu nebyla běžná ani začátkem 20. století (viz nekompatibilní jehla a stříkačka při Bierově experimentu se subarachnoidální blokádou [11]). Jako objevitel injekční jehly se uvádí irský lékař Francis Rynd (1801–1861), který r. 1845 publikoval článek o injekcích morfinu k různým hlavovým nervům speciálně zhotoveným přístrojem. Ten popsal až v r. 1861; byla to poměrně primitivní pomůcka zakončená dutou jehlou používající k aplikaci gravitaci [3]. Hlavním popularizátorem byl skotský lékař Alexander Wood (1817–1884). V r. 1853 podával k nervům injekční stříkačkou (vyrobenou Fergussonem, obr. 3) a jehlou morfin při léčbě neuralgií. V témže roce Charles Pravaz (1791–1853) ve Francii využil injekční jehlu a stříkačku u ovcí při výzkumu možnosti léčby cévních aneurysmat jejich koagulací [3].
Obr. 3. Originální Woodova injekční stříkačka. Zdroj: Wikimedia Commons (CC BY 4.0) 
Předbarbiturátová éra
V druhé polovině 19. století byla již známá anestezie, dostupná injekční jehla a stříkačka a látky s hypnotickým účinkem, takže nové experimenty na sebe nenechaly dlouho čekat. Ruský chirurg Pirogov, který patřil mezi průkopníky anestezie etherem ve válečných podmínkách během Krymské války, si byl vědom toho, že ether se dostává do mozku prostřednictvím krve. Pokusil se přenos zjednodušit podáním etheru do žíly. Uskutečnil pokusy na psech, ti však po podání ihned zemřeli, takže metodu zavrhnul [12]. Prvým skutečným hypnotikem byl chloralhydrát, který byl určen primárně pro perorální sedace a navození spánku.
Chloralhydrát (systematicky 2,2,2-trichlorethan-1,1-diol) byl syntetizován v r. 1832 Justusem Liebigem v Giessenu, ale jeho sedativní a hypnotické účinky byly popsány až berlínským farmakologem Oskarem Liebreichem v r. 1869 [13]. Účinky chloralhydrátu byly mylně vysvětlovány tím, že se v těle rozloží na kyselinu mravenčí a anestetikum chloroform. Francouzský chirurg Pierre‑Cyprien Ore’s ho používal intravenózně v 70. letech 19. stol. Byl asi jediný, kdo tuto anestezii prováděl. Výhody oproti etheru nebo chloroformu nebyly žádné a počet úmrtí vysoký [14].
Ether a chloroform byly extenzivně testovány pro možnost nitrožilní aplikace německým chirurgem Ludwigem Burkhardtem ve Würzburgu až v r. 1905–1911 [15]. Metoda s použitím intravenózního etheru se stala v Německu velmi populární především u operací v oblasti hlavy a krku. Další renesance proběhla v Německu po 2. světové válce zvláště tam, kde byla tracheální intubace vzácností [15]. Eger et al. [16] testovali tuto možnost ještě v r. 1963 zejména s ohledem na využití při laryngoskopiích a bronchoskopiích. Více jak 5% koncentrace etheru ve fyziologickém roztoku nebo v roztoku glukózy vyvolávala hemolýzu. Roztok byl uchováván v chladu, což působilo bolest v žíle. Pro úvod bez použití barbiturátů bylo třeba 250–600 ml a nástup byl po 5–15 minutách; při podání přetlakem po 2–4 minutách, což ale bylo často doprovázeno hypotenzí. Jinak byl oběh stabilní, častější byla hypoventilace. Udržovací dávka roztoku byla 500–1 000 ml během první hodiny a 300–500 ml během druhé hodiny. Časté byly po probuzení nauzea a zvracení, hlavně při infuzi větších objemů. Další nevýhodou bylo dlouhé probouzení a vydechované koncentrace etheru na hraně rizika hoření (5–6 %) [16]. Velký objem chladných roztoků působil též hypotermii a otoky [15].
Hedonal byl asi prvým intravenózním anestetikem s přijatelným bezpečnostním profilem. V roce 1885 německý chemik Oswald Schmiedeberg začal experimentovat s molekulou ethyl‑karbamátu (též urethan), který byl z důvodu krátkého ethylového řetězce příliš slabý a další pokusy směřovaly k prodlužování molekuly. V Mnichově na jeho radu H. Dresser nahradil ethylový zbytek pentan-2-ylem (obr. 4) a tak v r. 1899 vznikl hedonal [14]. Prvé nitrožilní podání chirurgickému pacientovi provedl prof. Nikolas Krawkow v St. Petěrburgu v r. 1909. Krawkow byl vyškolen O. Schmiedebergem v jeho laboratoři a v době podání byl vedoucím farmakologie Vojenské lékařské akademie v carském Rusku. V r. 1901 S. P. Lampsakow z Krawkovovy laboratoře zjistil, že orální podání hedonalu vede k hluboké a dlouhodobé chirurgické anestezii. K výzkumu byl přizván mladý chirurg Jeremič. Nejprve byla kombinována orální premedikace hedonalem s inhalací chloroformu, poté co vyšel článek L. Burkhardta o podávání velkého objemu infuzí s chloroformem a etherem, byl vyzkoušen 0,75% hedonal rozpuštěný ve fyziologickém roztoku nejprve u psů, a následně 7. 12. 1909 u člověka. Starší muž s maligním nádorem dolní končetiny po premedikaci 3 g hedonalu p. o. dostal 275 ml 0,75% hedonalu. Nástup účinku byl 4 minuty, během operace bylo ještě podáno 75 ml, a pak nakonec dalších 5 ml roztoku. Pacient spal po operaci 4 hodiny a probudil se bez nauzey a neklidu. Další operace v hedonalové anestezii byly prováděny u pacientů ve věku 9–65 let v trvání od 14 minut do 2 hodin 42 minut a bylo podáno 325–1 100 ml 0,75% hedonalu [14]. Metoda se nejprve rozšířila v Rusku a po jejím publikování též v Německu a Anglii. Ve srovnání s inhalačními anestetiky byla úmrtnost např. během kardiochirurgických operací 3 %, což je podstatně méně než při užití etheru (13 %) nebo chloroformu (20 %). Výhodou byla dobrá svalová relaxace, nedráždivost v dýchacích cestách, malý účinek na parenchymové orgány a možnost použití u pacientů s onemocněním plic, hypotenzí a krvácením. Nevýhodou je malá rozpustnost ve vodě, nutnost zařízení na podávání infuzí [17] a dlouhá doba účinku. Hedonal byl používán do 30. let, než byl nahrazen barbituráty. Úspěšnost hedonalové anestezie vedla k intravenóznímu podání dalších látek: paraldehydu (1913), síranu hořečnatého (1916), ethanolu (1921, viz výše) a prvých barbiturátů (viz dále), žádný z preparátů však tou dobou nedosáhl velké popularity.
Obr. 4. Chemické struktury některých i. v. anestetik 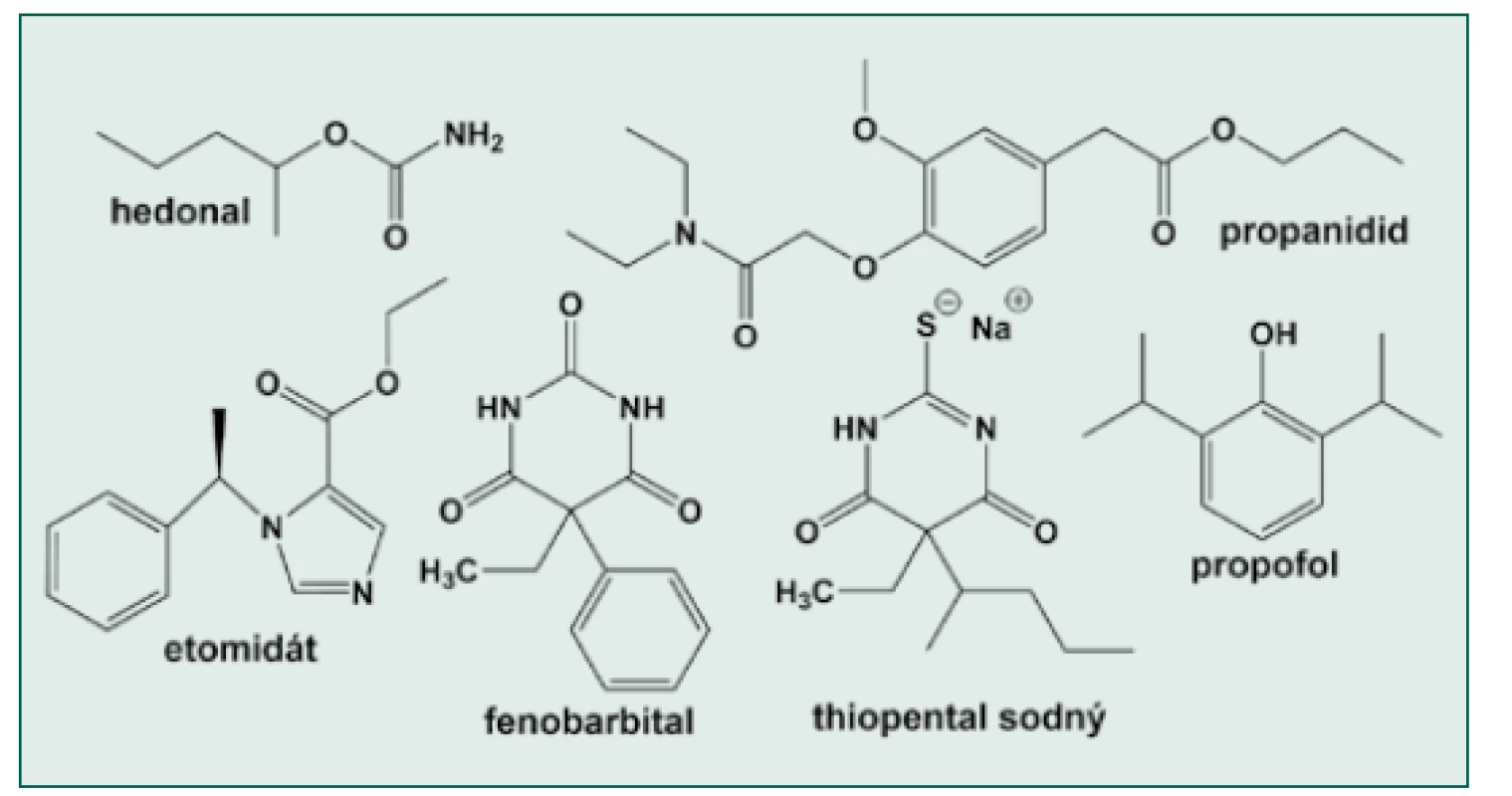
Barbituráty
Historie barbiturátů začíná v r. 1864, kdy Adolf von Baeyer, nositel Nobelovy ceny za objevy v organické chemii z r. 1905, vytvořil reakcí urey a kyseliny malonové kyselinu barbiturovou. O původu názvu existují 3 domněnky [13]: sentimentální pojmenování na počest Baeyrovy přítelkyně Barbory, to, že objev sloučeniny Baeyer oslavoval v hospodě, kde současně dělostřelci (v jiné variantě ohněstrůjci) slavili svátek své patronky sv. Barbory nebo to, že krystaly jsou jakoby vousaté (barbed). Lewandowski [18] uvádí ještě jednu možnost, totiž že Barbora bylo jméno mnichovské číšnice, která von Baeyerovi poskytla moč k jeho pokusům. V každém případě název („Barbitursäure“) napovídá sloučení slov „barb(ara)“ a „urea“. Samotná kyselina neměla žádné využití. V průběhu 20. století vzniklo okolo 2 500 jejích sloučenin, z nich asi 50 mělo komerční využití. Fischer a von Mering v r. 1903 syntetizovali kyselinu diethylbarbiturovou a uvedli ji jako hypnotikum na trh pod názvem VERONAL. Název vznikl podle hory Mount Verona v Itálii, kde předtím Fischer cestoval. Další populární látkou byl fenobarbital (LUMINAL) (obr. 4) firmy Bayer (1911) [13]. Barbituráty byly dlouho patentem německých firem, po 1. světové válce však byly patentové ochrany Německa zrušeny a vývoj pokračoval i jinde. První barbituráty byly špatně rozpustné, k nitrožilnímu podání byl určen až SOMNIFEN. Směs VERONALu a kyseliny diallylbarbiturové vytvořil v r. 1920 T. A. Redonnet a v r. 1924 byl SOMNIFEN použit při operacích. Zajímavé bylo použití při porodu, kdy „žena dostane 6 ml a po 6 hodinách se probere a ani si nepamatuje, kdy jsem vytáhnul jehlu“ (citace v [19]). Z popisu je jasné, že ani SOMNIFEN, ani další podobné látky, jako PERNOCTON (1927), PERNOSTON a další nebyly pro krátkodobé anestezie optimálním farmakem. Tím se stal hexobarbital syntetizovaný Helmutem Weesem, vedoucím laboratoří firmy Bayer ve Wuppertalu‑Elberfeldu [19]. Klinicky byl dostupný od r. 1932 a záhy se stal nesmírně populární. Jako EVIPAN či EVIPAL byl používán ještě dlouho po nástupu thiopentalu [19]. Hlavním vedlejším účinkem byly svalové záškuby.
Přítomnost síry v molekule barbiturátu byla považována za toxickou, protože prvá takováto látka podaná psovi v r. 1903 ho okamžitě usmrtila [20]. Thiobarbituráty začaly být nově zkoumány až počátkem 30. let ve firmě Abbot v USA. Prvé zkušenosti s thiopentalem (Obr. 4) publikoval John Lundy z Mayo Clinic v r. 1936 [13, 20]. Protože zjistil, že thiopental dělá dechovou depresi, doporučoval monitorovat dýchání tak, že přilepil chomáček bavlny na horní ret pacienta a sledoval jeho pohyby [20]. J. Lundy byl první, kdo propagoval koncepci doplňované (balancované) anestezie. Anesteziologové té doby experimentovali s mnoha novými látkami a mnoha novými způsoby vedení anestezie, což mohlo vést i k omylům. Jako fáma přežívá z těch dob historka, že při napadení Pearl Harboru zabil více Američanů thiopental než Japonci. Zpráva pochází od civilního lékaře, který v nemocnici pomáhal a citaci admirála Gordona‑Taylora z britského námořnictva („spinální anestezie je ve válečné medicíně ideální metoda euthanasie“) parafrázoval i pro thiopental. Ačkoliv bylo jeho tvrzení opakovaně vyvráceno jako nepravdivé, stále přežívá [12]. Thiopental se stal nesmírně populární, i když nebyl bez problémů (apnoe po podání, kardiodepresivní účinek, zásadité pH roztoku). V 50. a 60. letech byly testovány další látky, z nichž některé se dostaly i ke krátkému klinickému použití (SURITAL, THIOSECONAL, INAKTIN, RAPITAL, TRANSITHAL, ULBREVAL, THIOGENAL, NERAVAL, NARCODROM, NARCONUMAL) [1, 21], ale větší význam měl pouze v pořadí 25 398. methylovaný barbiturát firmy Lilly – methohexital (BREVITAL, BRIETAL) syntetizovaný v r. 1956 [21]. Má kratší účinek než thiopental, ale nevýhodou jsou záškuby končetin, které jsou společné všem barbiturátům s methylovou skupinou. Zatímco methohexital už v ČR registrován není, thiopental má stále ještě své (byť omezené) využití.
Etomidát
Etomidát byl objeven náhodou ve firmě Janssen při výzkumu nových imidazolových antibiotik. Jedna ze sloučenin vykazovala u pokusných potkanů hluboké hypnotické účinky. Na základě tohoto pozorování bylo vytvořeno a testováno 50 dalších derivátů [22]. Jedním z nich byl esterový analog původního methylesteru, který byl posléze uveden v r. 1972–1973 do klinické praxe jako etomidát (obr. 4) [22, 23]. Od začátku byl zřejmý široký terapeutický index (poměr letální a účinné dávky – LD50/ED50) ve srovnání s ostatními nitrožilními anestetiky (tab. 1). Výhodná byla zejména kardiovaskulární a respirační stabilita při jeho použití. Původní látka byla racemát, vlastnosti R-(+) enantiomeru (prostorový isomer R stačí rovinu polarizovaného světla doprava (+)) byly ještě výhodnější. Etomidát se začal stále častěji používat v infuzi nejen u anestezií, ale i k sedaci pacientů na jednotkách intenzivní péče. V r. 1983 Ledingham a Watt pracující na jednotce intenzivní péče v Glasgow poprvé popsali vyšší mortalitu u pacientů sedovaných etomidátem (citace v [1]). Po rozsáhlé diskuzi příznivců a odpůrců etomidátu se prokázalo, že příčinou je potlačení syntézy steroidů v nadledvinách snižující schopnost pacientů reagovat na zátěž. Další výzkumy ukázaly, že zatímco plazmatická koncentrace etomidátu potřebná pro anestezii je více než 200 ng/ml, koncentrace vyvolávající útlum kůry nadledvin je méně než 10 ng/ml [23]. To vysvětluje i rozdíl v délce trvání hypnotického účinku ve srovnání s účinkem na nadledviny (5–10 min. versus 6–8 hodin [23]). Výsledky vedly k poklesu popularity etomidátu. V současnosti se vyvíjejí další deriváty původní molekuly, které nežádoucí účinek na syntézu steroidů nemají.
Tab. 1. Poměr toxické a účinné dávky vybraných anestetik u pokusných zvířat (upraveno podle [23]) ![Poměr toxické a účinné dávky vybraných anestetik u pokusných
zvířat (upraveno podle [23])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/74eab24392ab2dcc82dcc42e83d87c4b.png)
* LD50 – dávka, která je smrtelná pro 50 % pokusných subjektů, ED50 – dávka, která je účinná u 50 % pokusných subjektů. Steroidy
Počátkem 40. let Hans Selye (1907–1982) objevil, že kortikosteroidy mají u hlodavců hypnotické účinky [24]. V současnosti se předpokládá, že endogenní neurosteroidy mají fyziologický účinek i u člověka a během gravidity působí analgezii a jsou zodpovědné za snížení minimální alveolární koncentrace inhalačních anestetik u těhotných [25]. Nejúčinnější z nových látek založených na steroidech byl pregnanedion, ale byl špatně rozpustný ve vodě a při podání do žíly silně dráždil; nikdy se nedostal do klinického použití [24]. Hydroxydion (5β‑dihydrodeoxykortikosteron) byl používán pod názvy VIADRIL a PRESUREN krátce v polovině 50. let. Byl rozpustný ve vodě, ale rovněž dráždil žilní stěnu, nástup účinku byl pomalý (3–5 minut) a probouzení dlouhé. Nikdy nedosáhnul větší popularity [24].
V dalším výzkumu pokračovala firma Glaxo začátkem 70. let. Výsledkem byl v r. 1973 ALTHESIN: směs dvou steroidů (alfaxalon/ alfadolon) [24]. Alfaxalon měl anestetický účinek, alfadolon měl pouze poloviční anestetický efekt alfaxalonu, ale zvyšoval jeho rozpustnost [25]. Výhodou ALTHESINu byl jeho krátkodobý účinek, který umožňoval kontinuální podávání a menší pokles tlaku ve srovnání s tehdejšími anestetiky. Problémem bylo to, že podobně jako propanidid byl ALTHESIN stabilizován Cremoforem EL (ethylen oxid s glycerolem), který vyvolával vzácné, ale velmi závažné anafylaktické reakce. Z trhu byl stažen v r. 1984 [24]. V současnosti se znovu zkouší možnost nahradit Cremofor EL cyklodextrinem a umožnit tak návrat alfaxalonu do klinické praxe [25]. Přípravek pod názvem PHAXAN je ve fázi III klinického hodnocení [26].
Propanidid
Koncem 50. let byly v laboratořích firmy Bayer zkoumány anestetické účinky látek odvozených od eugenolu, který se získával z hřebíčku [1]. Vznikly 3 sloučeniny na bázi fenylacetátu, které se dále sledovaly: G29.505 (eunal – acetamidoeugenol), E34 (propinal – N,N‑diethyl - 2 - (2-methoxy-4-propylfenoxy)acetamid) a FBA.1420 (propanidid – propyl( 4-((diethylkarbamoyl)methoxy)-3-methoxyfenyl) acetát) (obr. 4) [27]. Eunal měl mnoho užitečných vlastností: velmi rychlé odeznění účinku, stimulaci dýchání a absenci nežádoucích účinků na oběh, ale byl vyřazen pro vysoké riziko žilní trombózy po podání. Podobné vlastnosti měl i propinal, ale časté byly pooperační nauzea a zvracení a občasná lymfangoitida [27]. Propanidid se od předchozích lišil tím, že byl metabolizován plazmatickou cholinesterázou, nikoliv oxidací v játrech. Do klinického použití se propanidid dostal v r. 1964 pod názvy EPONTOL a FABONTAL. Nažloutlá olejovitá látka se dodávala ve formě 5% roztoku stabilizovaného 20% Cremoforem EL z ricinového oleje. Výhodou bylo velmi rychlé probuzení a lokálně anestetický efekt, nevýhodou hypoventilace po iniciální hyperventilaci, poklesy krevního tlaku, občasné mimovolní pohyby a vzácné, leč těžké anafylaktické reakce na Cremofor EL [27]. V Československu se používal pod názvem SOMBREVIN pro krátké ambulantní anestezie, ze kterých se pacienti velmi rychle budili do plného vědomí (JM, osobní vzpomínka). Vzhledem k anafylaktickým reakcím byl nakonec v 80. letech stažen z trhu. V současnosti je propanidid registrován snad ještě v Rusku a Mexiku [28].
Ketamin
Historie ketaminu začíná v laboratořích firmy Parke‑Davis and Company (nyní součást firmy Pfizer) hledáním ideálního anestetika s analgetickými vlastnostmi mezi látkami ze skupiny cyklohexylaminů. Chemik V. H. Maddox syntetizoval 26. 3. 1956 fencyklidin a látku poskytl k pokusům na zvířeti G. Chenovi a E. F. Dominovi ze stejné laboratoře [29]. Látka opravdu prokázala kvalitní analgetické účinky, ale zvířata byla v kataleptickém stavu s otevřenýma očima a nedostatečnou svalovou relaxací. Pod firemním názvem SERNYL byl v r. 1958 testován v univerzitní nemocnici v Detroitu. První série testů proběhla u 64 pacientů operovaných především pro výkony bez otevření břišní dutiny [30]. K výhodám patřila kvalitní analgezie a zachovaná spontánní ventilace s více či méně zvýšeným krevním tlakem. Přesto se u 13 operovaných musel fencyklidin doplnit dalším anestetikem (thiopentalem samotným či v kombinaci s oxidem dusným a halotanem) pro excitaci a neklid. Ten u některých z nich trval ještě dlouho po konci operace. V podobné studii [31] ve Velké Británii musel být SERNYL doplněn dalšími anestetiky u sedmnácti z šedesáti sedmi pacientů. Důvody byly hlučné delirium s neklidem, nedostatečná svalová relaxace, excesivní pohyby během operace, tachykardie, hypertenze a setrvalý priapismus během operace kýly interferující s operací. V pooperačním období přetrvávala analgezie několik hodin, ale zatímco starší pacienti byli klidní či euforičtí, mladší muži byli často agresivní a stav u mladších žen autoři popisovali jako spokojenou opilost (happily drunken state) [31]. Vyskytly se i nepříjemné halucinace. Záhy bylo zřejmé, že fencyklidin se k anestezii lidí nehodí. Další látkou byl eticyklidin, který působil četné halucinace a katatonii se svalovou rigiditou. V r. 1960 Collins et al. popsali tento stav jako disociaci (rozplývání, rozpojování) (citace v [29]). Název disociativní anestezie se používá dosud (druhá verze je ta, že termín navrhla manželka Dr. Domina, když ji popisoval, jak jsou pacienti v ketaminové anestezii odpojeni od okolí [29]). Výzkum pokračoval dále a v r. 1962 C. Stevens syntetizoval molekulu CI-581 nazvanou později ketamin, protože obsahuje jak keton, tak aminovou skupinu v racemické formě 2 isomerů (obr. 5) [29, 32].
Obr. 5. Chemická struktura ketaminu 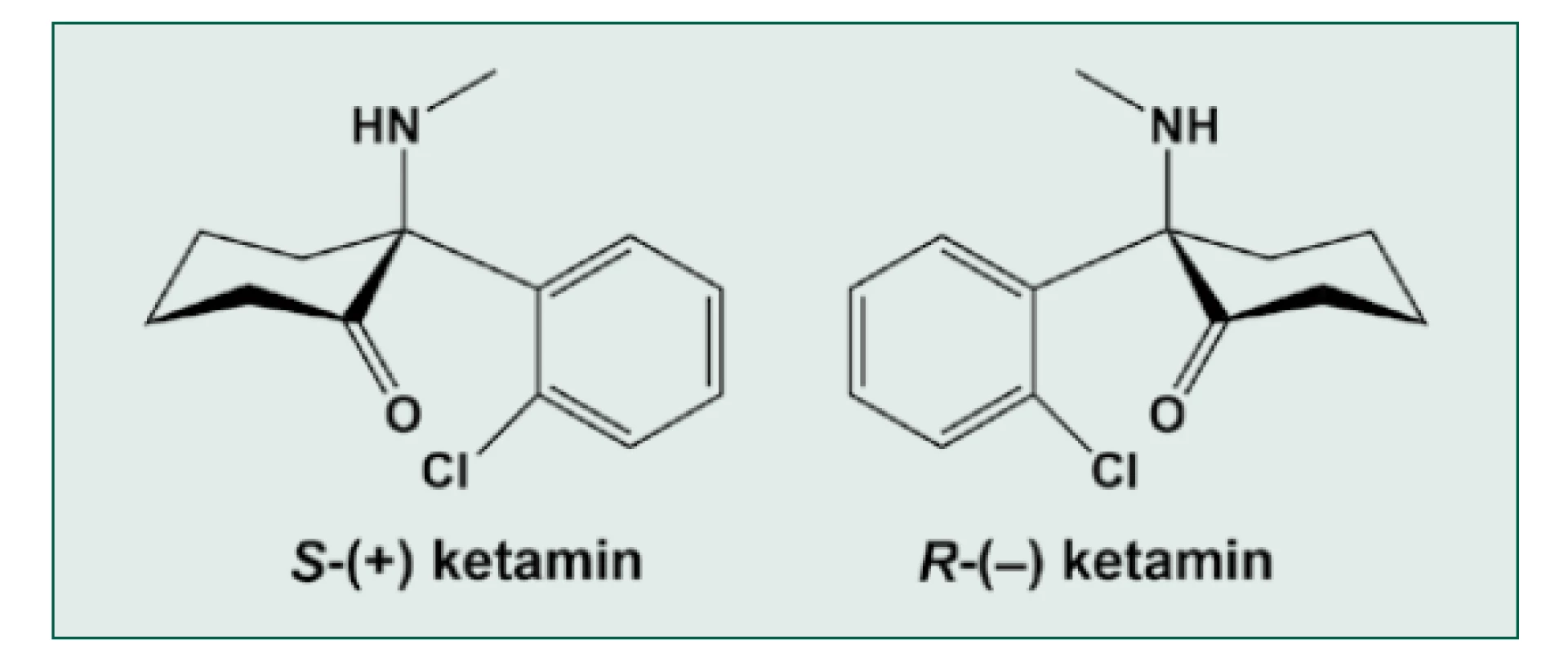
Nejprve byl ketamin testován a registrován jako veterinární anestetikum (Belgie, 1963), u člověka proběhly klinické zkoušky na vězních v r. 1964 a projevily se psychomimetické účinky – létání v prostoru, ztráta končetin [29]. Původní termín schizofrenomimetikum byl posléze nahrazen termínem disociativní anestetikum. V r. 1969 se pod názvem KETALAR začal dodávat pro humánní anestezii a v r. 1970 se vzhledem k sympatomimetickým a analgetickým účinkům a velké bezpečnostní šíři začal využívat ve Vietnamské válce. Další výhodou je podání i.m. a nasálně. Psychomimetické účinky byly potlačovány benzodiazepiny, droperidolem, chlorpromazinem a pomalou aplikací. Samostatný výzkum jednotlivých isomerů začal v r. 1982 a postupně se začalo rozšiřovat použití ketaminu pro pokusy v psychiatrii, k analgezii, léčbě hyperalgezie vyvolané opioidy a terapii deprese [33]. S-(+) enantiomer je v mnoha zemích registrován jako dvakrát účinnější anestetikum než racemát [34], R-(–) enantiomer (arketamin) je testován jako SOS antidepresivum při riziku suicidia [35]. Ketamin zůstává v mnoha rozvojových zemích jediným dostupným anestetikem, což vedlo WHO k zařazení ketaminu mezi základní léky a opakovaně k odmítnutí globálního zařazení ketaminu mezi kontrolované substance [36], i přes známé riziko zneužívání [37]. V rozvojových zemích probíhá pětidenní kurz základního výcviku v anestezii ketaminem, jehož frekventanti (neanesteziologové a často i nelékaři) bývají pak ve svých zemích jediní dostupní anestetisté [38, 39].
Propofol
Sloučenina ICI 35 868 (propofol) vznikla v laboratořích firmy ICI (nyní Astra Zeneca) při studiu anestetických účinků molekul odvozených od fenolu [40]. Propofol (2,6-diisopropyl fenol, obr. 4) měl v pokusech na zvířeti rychlý nástup účinku jako thiopental, ale s rychlejším odezněním. Zbýval problém, jak upravit lipofilní propofol tak, aby mohl být podán do žíly. Prvá kombinace využívala podobně jako předchozí látky Cremofor EL a byla poprvé v Evropě testována v r. 1977. Pro četné anafylaktické reakce byla stažena v r. 1980 a byly hledány další možnosti [41]. Propofol byl rozpuštěn v sójovém oleji a emulgován fosfolipidem lecitinem z vaječného bílku. Lecitin obsahuje hydrofilní fosfát a cholin a dva lipofilní řetězce mastných kyselin. V centru mikroskopické kapky je molekula propofolu obklopená lipofilními částmi, zatímco hydrofilní části směřují ven a mají negativní náboj, který zabraňuje jejich shlukování. Tyto kapičky jsou velmi fragilní a vyžadují další aditiva, pH 6–9 a další podmínky, aby byla emulze stabilní [41]. V r. 1982 byla v Evropě zkoušena kombinace propofolu, sójového oleje, lecitinu, glycerolu a hydroxidu sodného, která se dostala na trh pod názvem DIPRIVAN ve Velké Británii a N. Zélandu v r. 1986/87, v USA v r. 1989 a v Československu v r. 1991. Dalším problémem byly zprávy o riziku infekcí zaviněných externí kontaminací. Zeneca Pharmaceuticals testovala možnosti antibakteriálního přídavku k látce, aby tuto vlastnost potlačila. Výsledkem bylo přidání kyseliny ethylendiamintetraoctové (EDTA) nebo benzylalkoholu, které potlačily mikrobiální růst [41]. V současnosti není konzervans součástí v ČR obchodovaných preparátů s propofolem. Propofol významně přispěl ke změně strategie vedení anestezie, sedace a propagaci laryngeální masky v klinické praxi. Přístroj pro cíleně řízenou infuzi pro TIVA Diprofusor vyrobila firma Astra Zeneca v r. 1986 [40].
Temné stránky intravenózních anestetik
Četná farmaka používaná v anesteziologii působí při subanestetickém dávkování amorózní chování, v naprosté většině u žen [42]. Dochází ke ztrátě reality a projekcí skrytých sexuálních přání do chování. Má to značný forenzní význam. Již ve středověku byly zneužívány lilkovité rostliny obsahující atropin a skopolamin. Skopolamin má výrazné centrální účinky, omámený působí jako v hypnotickém stavu a na chování během účinku je amnézie.
Jako tzv. date rape drugs – drogy znásilnění jsou označována všechna farmaka, která usnadňují sexuální násilí. Jsou zneužívány především benzodiazepiny, které mají v závislosti na dávce anxiolytický, amnestický, sedativní, svalově relaxační, antikonvulzivní a hypnotický účinek. Anxiolytický účinek benzodiazepinů vede k psychické relaxaci, ztrátě sebekontroly a amnézii. V minulosti byl často zneužíván flunitrazepam (Rohypnol Roche) v kombinaci s alkoholem tzv. uspávačkami, které vyhlédnutou oběť uspaly a následně okradly. Ženy pod vlivem flunitrazepamu ztrácely veškeré zábrany a nebyly schopné odporovat sexuálnímu násilí. Nyní se nahrazuje midazolamem [42].
Z dalších anestetik je zneužíván ketamin, a to jako rekreační droga i jako date rape drug. Může být šňupán, podáván v tekutinách nebo kouřen. Po perorálním podání nastupují účinky za 15 minut. Na Slovensku v roce 2009 působil ketaminový fantom. V ulicích Bratislavy přepadal mladé ženy, píchal jim intramuskulárně ketamin, následně je okradl, někdy i znásilnil (obr. 6) [43]. Od 1. 1. 2010 je ketamin na Slovensku veden jako droga a jeho použití je přísně sledováno. Americký biolog Patrick Ryan použil ketamin k omámení své kolegyně, se kterou se podílel na výzkumu medvědů baribalů. Po jejím usnutí ji sexuálně obtěžoval a své zážitky zaznamenával na video. Právě videozáznamy ho pak usvědčily [42]. V nemocnicích občas dochází ke kriminálním činům, kdy zdravotnický personál zneužije farmaka k usmrcení pacienta. Např. 26letý ošetřovatel Stephan Letter zabil nejméně 29 pacientů v Sonthofenu v Bavorsku. Mezi únorem 2003 a červencem 2004 jim podal koktejl anestetik (etomidát, benzodiazepiny, svalová relaxancia) a způsobil tak zástavu dechu [42]. I v České republice došlo k zabití pacientů, nikoliv však anestetiky (heparinem, roztoky s vysokou dávkou draslíku). Kromě abúzu ketaminu se zneužívaly i další látky: barbituráty jako hypnotika i k suicidiím (orálně Marilyn Monroe), velkou pozornost vyvolalo smrtelné předávkování Michaela Jacksona propofolem.
Obr. 6. Ketaminový fantom na Slovensku (Nový Čas, publikováno se svolením) 
V USA se používají intravenózní anestetika ke smrtící injekci při popravách – lethal injection (obr. 7). Letální injekci tvoří směs thiopentalu, pankuronium bromidu – svalového relaxancia a chloridu draselného, který zastavuje srdce v diastole [44]. Správné načasování jednotlivých injekcí je velmi důležité. Letální injekce vyžaduje účast alespoň osoby se základním medicínským vzděláním. První poprava smrtící injekcí byla v roce 1982 v Texasu. Thiopental je podáván v dávce 2 až 3 g, od aplikace až do nástupu smrti uplyne asi 10 minut. Osoba očekávající exekuci je plná strachu, anxiózní, hyperadrenergní, a proto potřebuje daleko víc thiopentalu než premedikovaný chirurgický pacient. Také farmakodynamika a farmakokinetika thiopentalu u umírající osoby se velmi liší ve srovnání s ventilovaným pacientem [45]. Lékaři se často odmítají podílet na popravách, i když někteří argumentují zvýšením humánnosti, např. zručným a spolehlivým zavedením intravenózní kanyly oproti riziku paravenózního podání, a rovněž farmaceutické firmy odmítají použití svých preparátů k popravám [46]. American Medical Association (AMA) účast na popravách svým etickým kodexem přímo zakazuje [47]. Složení letální injekce se v současnosti změnilo. Nejčastěji jde o benzodiazepiny, etomidát, propofol, novější svalová myorelaxancia a jen chlorid draselný zůstává [48, 49].
Obr. 7. Místnost pro popravy smrtící injekcí v Kalifornii. Zdroj: Wikimedia Commons (CC BY 4.0) 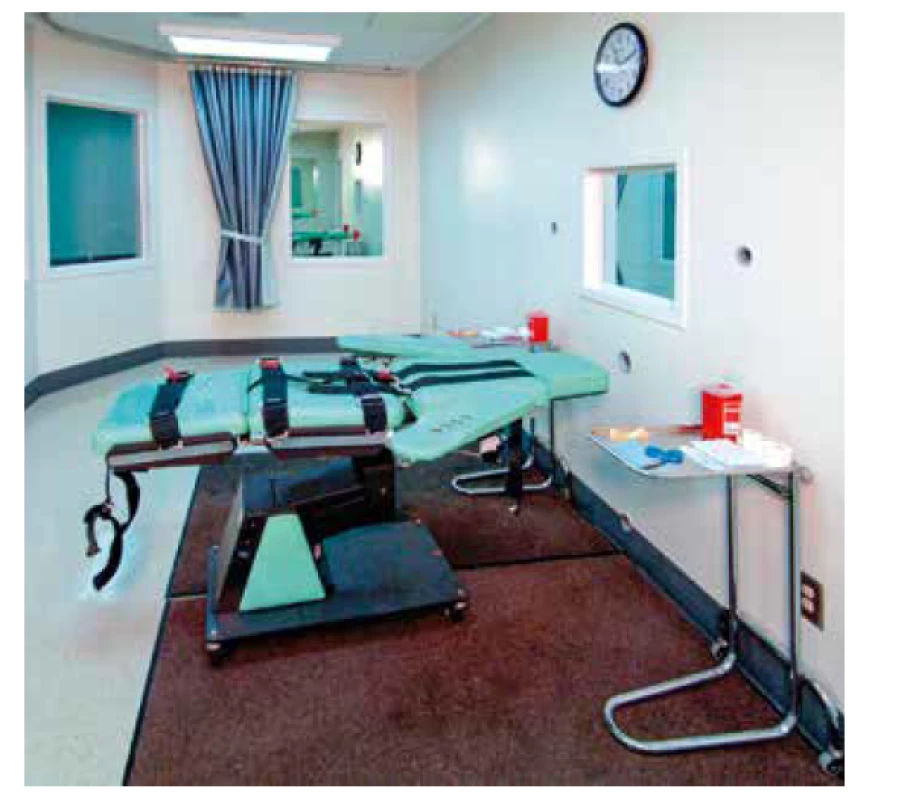
Budoucnost intravenózních anestetik
Vývoj nových molekul je náročný, proto většina nových látek vzniká modifikací přípravků již dříve použitých. Cílem jsou molekuly s rychlou eliminací a snadnou řiditelností účinku (softdrugs) [50, 51]. AZD3043 (fenylpropanoid) je krátkodobé anestetikum odvozené od propanididu s rychlou eliminací a bez hemodynamické nestability. Nevýhodou jsou mimovolní pohyby. Alfaxalon (PHAXAN) je odvozený od althesinu, pokusy fáze 3 zatím skončily v r. 2018 po „dosažení cíle“ [50]. Řada látek je odvozena od etomidátu s cílem zachovat výhodný kardiorespirační profil bez adrenokortikálního účinku. Ve fázi 1, respektive v preklinické studii, jsou ABP-700 (cyklopropyl‑methoxykarbonyl etomidát) a ET26 [50]. Fospropofol je prodrug propofolu rozpustný ve vodě, nevýhodou je dlouhý nástup účinku. Byl registrován pod názvem LUSEDRA, ale není používán. V roce 2020 byl registrován k použití remimazolam, ultrakrátce působící derivát midazolamu. Testována jsou i emulgovaná inhalační anestetika pro nitrožilní podání [52]. Vzhledem k rostoucímu zájmu o ochranu životního prostředí je pravděpodobné, že bude trend omezovat inhalační anestetika a ekonomické důvody povedou farmaceutické firmy ke zvýšenému úsilí v hledání nových intravenózních anestetik.
PROHLÁŠENÍ AUTORŮ: Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média. Střet zájmů: Oba autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce. Podíl autorů: Oba autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. Oba autoři se podíleli na textu rukopisu rovným dílem. Financování: Podpořeno projektem Karlovy univerzity Progres Q37. Poděkování: Autoři děkují prof. RNDr. Ing. Petru Tůmovi, Ph.D., z Ústavu hygieny 3. LF UK za cennou pomoc při korekci chemických názvů.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Jiří Málek, CSc.
Článek přijat redakcí: 17. 3. 2021
Článek přijat k tisku: 30. 4. 2021
Zdroje
1. Dundee JW. After thiopentone: a review of recent history. Baillière’s Clinical Anaesthesiology 1991; 5(2): 267–281. https://doi.org/10.1016/S0950-3501(05)80189-8.
2. Dorrington KL, Poole W. The first intravenous anaesthetic: how well was it managed and its potential realized? Br J Anaesth. 2013 Jan; 110(1): 7–12. doi: 10.1093/bja/aes388.
3. Macht DI. The history of intravenous and subcutaneous administration of drugs. Journal A. M. A. 1916; 66(12): 856–860.
4. Drábek P. Naše léčivé přípravky v polovině 19. století. II. část – galenické přípravky. Čes. slov. Farm. 2012; 61 : 178–184.
5. Málek J, Tůma P. Sto devadesát let od objevu chloroformu. Historie inhalačních anestetik. Část 1. Anest intensiv Med. 2021; 32(1): 30–35.
6. Dundee JW. Intravenous ethanol anesthesia: a study of dosage and blood levels. Anesth Analg. 1970 May-Jun; 49(3): 467–475.
7. Aldrete JA. Original contributions of latin-americans to anesthesia. Bulletin Anaesth History 2002; 20(2): 5–6.
8. Chapmann ER, Williams PT Jr. Intravenous alcohol as an obstetrical analgesia. Am J Obstatet Gyn 1951; 61(3): 676–679. doi: https://doi.org/10.1016/0002-9378(51)91422-6
9. Anonym. Intravenous alcohol in surgery. Hospital Topics. 1952; 30(3): 62–63. doi: 10.1080/00185868.1952.9951627
10. Isaac M, Pandit SK, Dundee JW, Galway JE. Intravenous ethanol anaesthesia: a study of sequelae and their implications. Acta Anaesthesiologica Scandinavica, 1971; 15 : 141–155. https://doi.org/10.1111/j.1399-6576.1971.tb05457.x
11. Gimunová O, Málek J. Anestezie v Rakousko-Uhersku během I. světové války a po vzniku samostatného československého státu. Část III – Intravenózní regionální anestezie a neuroaxiální metody anestezie. Anest intenziv Med 2017; 28(6): 381–385.
12. Roberts M, Jagdish S. A History of intravenous anesthesia in war (1656-1988). Journal of Anesthesia History 2016; 2(1): 13–21.
13. López-Muñoz F, Ucha-Udabe R, Alamo C. The history of barbiturates a century after their clinical introduction. Neuropsychiatr Dis Treat. 2005 Dec; 1(4): 329–343.
14. Kissin I, Wright AJ. The introduction of hedonal: a Russian contribution to intravenous anesthesia. Anesthesiology. 1988 Aug; 69(2): 242–245. doi: 10.1097/00000542-198808000 - 00014.
15. Goerig M, Schulte am Esch J. Historical remarks regarding intravenous ether anesthesia. Bulletin of Anesthesia History 1996; 15(44): 3-6. doi: https://doi.org/10.1016/S1522 - 8649(96)50040-5
16. Eger EI II., Johnson EA. Intravenous ether anaesthesia. Calif Med. 1963; 99(4): 236–240.
17. Donald J. Methylpropylcarbinol urethane. The physiological action in animals. BJA: British Journal of Anaesthesia 1928; 5(3): 112–120. https://doi.org/10.1093/bja/5.3.112
18. Lewandowski, K. Schutzheilige der Anästhesie. Anaesthesist 2014; 63(12): 961–967. https://doi.org/10.1007/s00101-014-2409-5
19. Ball H, Westhorpe R. History of intravenous anaesthesia: The barbiturates. Part 1. Anaesth Intensiv Care 2001; 29(2): 3.
20. Ball H, Westhorpe R. History of intravenous anaesthesia: The barbiturates. Part 2. Anaesth Intensiv Care 2001; 29(3): 219.
21. Ball H, Westhorpe R. History of intravenous anaesthesia: The barbiturates. Part 3. Anaesth Intensiv Care 2001; 29(4): 323.
22. Sneader W. Drug discovery. A history. John Wiley and Sons Ltd, Chichester, 2005: s. 335.
23. Forman SA, Warner DS. Clinical and molecular pharmacology of etomidate. Anesthesiology 2011; 114 : 695–707. doi: https://doi.org/10.1097/ALN.0b013e3181ff72b5
24. A history of intravenous anesthesia. Anesthesia Key. [on-line]. [cit. 2021-02-07]. Dostupné z: https://aneskey.com/a-history-of-intravenous-anesthesia/
25. Kharasch ED, Hollmann MW. Steroid anesthesia revisited: Again. Anesth Analg. 2015; 120(5): 983–984. doi: 10.1213/ANE.0000000000000667.
26. Hollmann MW, Sear JW. Another steroid hypnotic. More of the same or something different? Anesthesia & Analgesia 2015; 120(5): 980–982. doi: 10.1213/ANE.0000000000000661
27. Ball H, Westhorpe R. Intravenous induction agents: Propanidid. Anaesth Intensiv Care 2002; 30(3): 261.
28. Sombrevin [on-line]. [cit. 2021-02-07]. Dostupné z: https://pillintrip.com/medicine/ sombrevin-rus.
29. Mion G. History of anaesthesia. The ketamine story – past, present and future. European Journal of Anaesthesiology 2017; 34(9): 571–575. doi: 10.1097/EJA.0000000000000638
30. Greifenstein FE, Devault M, Yoshitake J, Gajewski JE. A study of a 1-aryl cyclo hexyl amine for anesthesia. Anesth Analg. 1958 Sep-Oct; 37(5): 283–294. PMID: 13583607.
31. Johnstone M, Evans V, Baigel S. Sernyl (CI-395) in clinical anaesthesia. Br J Anaesth. 1959 Oct; 31 : 433–439. doi: 10.1093/bja/31.10.433. PMID: 14407580.
32. Ball C, Westhorpe R. Intravenous induction agents: ketamine. Anaesth Intensive Care. 2002 Apr; 30(2): 115. doi: 10.1177/0310057X0203000201.
33. Kraus C, Wasserman D, Henter ID, Acevedo-Diaz E, Kadriu B, Zarate CA Jr. The influence of ketamine on drug discovery in depression. Drug Discov Today. 2019 Oct; 24(10): 2033 – 2043. doi: 10.1016/j.drudis.2019.07.007.
34. Esketamine [on-line]. [cit. 2021-02-07]. Dostupné z: Esketamine – Wikipedia
35. Arketamin. Arketamine: a fast-acting antidepressant without dissociative effects? | Benzinga.
36. WHO. WHO recommends against international control of ketamine. [on-line]. Dostupné z: https://www.who.int/medicines/access/controlled-substances/recommends_ against_ick/en/
37. Ketamine [on-line]. [cit. 2021-02-07]. Dostupné z: www.ketamine.com.
38. Burke TF, Suarez S, Senay A, Masaki C, Rogo K, Sessler DI, et al. Safety and feasibility of a ketamine package to support emergency and essential surgery in Kenya when no anesthetist is available: An Analysis of 1216 Consecutive Operative Procedures. World J Surg. 2017 Dec; 41(12): 2990–2997. doi: 10.1007/s00268-017-4312-0.
39. Sessler D. Anesthetizing with ketamine can make a life-or-death difference in countries short on options. [on-line]. [cit. 2021-02-07]. Dostupné z: https://consultqd.clevelandclinic. org/anesthetizing-with-ketamine-can-make-a-life-or-death-difference-in-countries - short-on-options/
40. Ball H, Westhorpe R. Intravenous induction agents: Propofol. Anaesth Intensiv Care 2002; 30(5): 543.
41. Fresenius Kabi. Celebrating 30 years of Diprivan®: How propofol transformed the practice of anaesthesia Anesthesiology News 2019. [on-line]. [cit. 2021-02-07]. Dostupné z: https:// www.anesthesiologynews.com/Monographs-and-Whitepapers/Article/04-18/Celebrating - -30-Years-of-Diprivan-sup-sup-How-Propofol-Transformed-the-Practice-of-Anesthesia/56037
42. Hess L. Date rape drugs, Farmakologická modifikace ženského sexuální chování aneb o amorózním chování, afrodiziakách a tzv. date rape drugs. Remedia 2015; 25 : 295–301.
43. Ketamínový fantóm v Bratislave: Čím vás môžu zdrogovať. Nový čas 19. 11. 2009. [on - -line]. [cit. 2021-02-07]. Dostupné z: https://www.cas.sk/clanok/139302/ketaminovy-fantom - v-bratislave-cim-vas-mozu-zdrogovat/
44. Koniaris LG, Zimmers TA, Lubarsky DA, Sheldon JP. Inadequate anaesthesia in lethal injection for execution. Lancet. 2005 Apr 16–22; 365(9468): 1412–1414. doi: 10.1016/S0140 - 6736(05)66377-5
45. Groner JI. Inadequate Anaesthesia in lethal injection executions. Lancet 2005; 366 : 1073–1074.
46. Zimmers TA, Lubarsky DA. Physician participation in lethal injection executions. Curr. Opin. Anaesthesiol. 2007; 20 : 147–151.
47. AMA. Code of Medical Ethics Opinion 9.7.3. [on-line]. [cit. 2021-04-27]. Dostupné z: https://www.ama-assn.org/delivering-care/ethics/capital-punishment
48. Wikipedia. Capital punishment in the United States [on-line]. [cit. 2021-02-07]. Dostupné z: https://en.wikipedia.org/wiki/Capital_punishment_in_the_United_States
49. Woolston C. Bid to use common anesthetic for executions threatens U.S. patients. Nature Magazine October 23, 2013. [on-line]. [cit. 2021-02-07]. Dostupné z: https://www. scientificamerican.com/article/bid-to-use-common-anesthetic-for-executions-threatens - us-patients/#
50. Birgenheier NM, Stuart AR, Egan TD. Soft drugs in anesthesia: remifentanil as prototype to modern anesthetic drug development. Curr Opin Anaesthesiol. 2020 Aug; 33(4): 499–505. doi: 10.1097/ACO.0000000000000879.
51. Herold I. Nová farmaka v anesteziologii: pohled za horizont. PGM 2018; 20(5): 511–518.
52. Málek J, Tůma P. Sto devadesát let od objevu chloroformu. Historie inhalačních anestetik. Část 2. Anest intensiv Med. 2021; 32(2): 87–93.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2021 Číslo 3- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Má být studium odborných zahraničních zdrojů považováno za povinnost českých lékařů v rámci jejich celoživotního vzdělávání?
- Účinek heparinu na primární hemostázu měřený pomocí PFA-200
- Vliv nitrožilních a inhalačních anestetik na pooperační kognitivní funkce u starších pacientů po laparoskopických břišních výkonech
- Prehabilitace v chirurgii – nesystematický přehledový článek
- Padesátiletí umělé plicní ventilace – 1970–2020
- Propofol v Československu používáme již 30 let – historie intravenózních anestetik
- Systémové kortikoidy v terapii ARDS vyvolaného onemocněním covid-19
- Kompartmenty a blokády nervů v oblasti bérce
- Centrální anticholinergní syndrom – zapomenutá diagnóza
- Leukocyty, mikroagregace a reakce na hypoxemii v mikrocirkulaci pacientů při koronarovirové chorobě 2019
- Chirurgická extrakce kaválního filtru pohledem anesteziologa a chirurga
- Postavení a role anesteziologů v přicházející transformaci zdravotní péče a perioperační medicíny
- Hyperbarická oxygenoterapie a onemocnění covid-19?
- Klinický význam epiglotis
- MEZIOBOROVÉ STANOVISKO (evidenční číslo ČSARIM: 23/2021)
- doc. MUDr. Ivan Čundrle, CSc., 9. 1. 1947 – 28. 5. 2021
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Centrální anticholinergní syndrom – zapomenutá diagnóza
- Propofol v Československu používáme již 30 let – historie intravenózních anestetik
- Systémové kortikoidy v terapii ARDS vyvolaného onemocněním covid-19
- Kompartmenty a blokády nervů v oblasti bérce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



