-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Plicní alveolární proteinóza: opakovaná oboustranná celoplicní laváž s podporou mimotělní membránové oxygenace
Pulmonary alveolar proteinosis: repeated bilateral whole lung lavage supported by extracorporeal membrane oxygenation
Whole lung lavage with large quantity of normal saline is the current standard of care treatment of pulmonary alveolar proteinosis. This rare disease characterized by alveolar accumulation of lipoproteinaceous material leads to respiratory failure of different severity. In some cases, it is not possible to perform the treatment safely without risk of severe periprocedural hypoxia. These rare cases can be treated with the support of extracorporeal membrane oxygenation. We present a case of a 41-year old patient successfully treated with repeated bilateral whole lung lavage supported by extracorporeal membrane oxygenation. Extracorporeal membrane oxygenation has been used during whole lung lavage in patients with risk of life-threatening hypoxia. The increasing availability and safety of extracorporeal life support methods enables more frequent use of the methods in cases with significant risk of hypoxia related complications that have so far been treated with one lung ventilation. This practice increases not only safety but also effectivity of the procedure because it enables performance of bilateral lavage in one session.
Keywords:
pulmonary alveolar proteinosis – whole lung lavage – extracorporeal membrane oxygenation
Autoři: J. Beneš 1; P. Roleček 1; V.- Černý 1 5
Působiště autorů: Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně v Ústí nad Labem, Masarykova nemocnice v Ústí nad Labem 1; Institut postgraduálního vzdělávání ve zdravotnictví, Praha 2; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové 3; Dept. of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Canada 4; Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové 5
Vyšlo v časopise: Anest. intenziv. Med., 31, 2020, č. 1-2, s. 42-45
Kategorie: Kazuistika
Souhrn
Celoplicní laváž velkým množstvím fyziologického roztoku je v současnosti zlatým standardem léčby plicní alveolární proteinózy. Toto vzácné onemocnění charakterizované akumulací lipoproteinózního materiálu v alveolech vede k respiračnímu selhání různé tíže. V některých případech není možné provést celoplicní laváž vyžadující jednostrannou plicní ventilaci bez rizika závažné periprocedurální hypoxie. V těchto vzácných případech lze výkon provést za podpory mimotělní membránové oxygenace. Předkládaná kazuistika popisuje případ 41letého pacienta úspěšně léčeného opakovanou oboustrannou celoplicní laváží provedenou za podpory veno‑venózní mimotělní membránové oxygenace. Mimotělní membránová oxygenace je používána k provedení celoplicní laváže u pacientů s rizikem život ohrožující hypoxie. Zvyšující se dostupnost a bezpečnost metod mimotělní podpory životních funkcí umožňuje rozšířit indikaci jejich použití o případy, kdy by provedení plicní laváže za použití jednostranné plicní ventilace bylo sice možné, nicméně zatížené významným rizikem komplikací v důsledku závažné hypoxie. Tato praxe zvyšuje nejen bezpečnost, ale i efektivitu procedury, neboť umožnuje provést v jedné době oboustrannou laváž.
Klíčová slova:
plicní alveolární proteinóza – celoplicní laváž – mimotělní membránová oxygenace
Úvod
Plicní alveolární proteinóza (PAP) je vzácné (4–6/1 000 000) plicní onemocnění, popsané poprvé v roce 1958 Rosenem, charakterizované vyplněním plicních sklípků periodic acid‑Schiff (PAS) pozitivním materiálem, vzniklým při poruše homeostázy surfaktantu. Dále je pro nemoc charakteristická zachovaná struktura plicního parenchymu a mikroskopicky nepřítomnost zánětu. Onemocnění postihuje 2,65× častěji muže, medián věku při diagnóze je 39 let pro muže a 35 let pro ženy [1].
Při PAP jsou plicní sklípky vyplněny fosfolipidy a proteiny, které jsou součástí plicního surfaktantu. Hromaděním surfaktantu dochází postupně k hypoxemické respirační insuficienci. Patofyziologicky se jedná o poruchu clearance surfaktantu v důsledku porušené funkce alveolárních makrofágů. Clearance plicními alveolárními makrofágy je ovlivňována stimulací granulocyte‑macrophage colony‑stimulating factor (GM‑CSF).
PAP lze rozdělit na hereditární (porucha regulace GM‑CSF), autoimunitní a sekundární (porucha funkce nebo počtu alveolárních makrofágů). Sekundární PAP je ve vztahu s hematologickými onemocněními, malignitami, autoimunitními nemocemi, infekcemi a inhalací kouře a prachu. Odhaduje se, že 90 % PAP je autoimunitního původu s tvorbou protilátek proti GM‑CSF.
Klinický obraz PAP zahrnuje nespecifické symptomy, jako námaho ‑ vou dušnost, kašel, únavu a ztrátu váhy. Horečka a vykašlávání sputa jsou méně obvyklé. V některých souborech byly dvě třetiny pacientů muži a kuřáci, ačkoli vztah kouření k PAP není jednoznačný.
PAP je diagnostikována na základě klinického podezření (většinou na intersticiální plicní proces), typickým CT nálezem, bronchoalveolární laváží a plicní biopsií. V laboratorním vyšetření je zvýšena laktátdehydrogenáza, což je ale nespecifický nález.
V roce 1963 byla do léčby PAP zavedena celoplicní laváž (whole lung lavage), ta je i v současnosti metodou volby [2]. Procedura je prováděna v celkové anestezii za použití biluminální tracheální rourky a selektivní plicní ventilace. Plíce jsou lavážovány až 50 litry ohřátého fyziologického roztoku. V případě sekundárního PAP je zásadní léčba základního onemocnění, je‑li to možné. Z experimentálních léčebných pokusů je zatím slibné podávání exogenního GM‑CSF, ať již inhalačně či subkutánně [3].
Dále se v případě autoimunitního PAP používá léčba rituximabem nebo plazmaferézou [4], tyto postupy však nejsou univerzálně adoptovány a vyžadují další ověření před zavedením do rutinní praxe.
Popis případu
41letý pacient, muž, 173 cm vysoký, vážící 97 kg, byl vyšetřován pro zhoršující se dušnost. Potíže měl 3 měsíce před přijetím, postupně se zhoršovaly od námahové dušnosti až po dušnost klidovou, trvale měl produktivní kašel, občas s minimální příměsí krve. V anamnéze pacienta byl nikotinismus (20 let, 1 krabička denně) a dlouhodobá pracovní expozice prachu při práci se sbíječkou.
Na CT plic byly patrné oboustranné difuzní intersticiální změny charakteru „crazy paving“ s hilovou lymfadenopatií a několika zánětlivými kondenzacemi (obr. 1). Na EKG byl patrný blok levého Tawarova raménka neznámého stáří. Echokardiografický nález byl normální. Bronchoskopie ukázala difuzní slizniční změny se zpěněnou hlenovou sekrecí, bronchoalveolární laváž derivovala mléčně zkalenou tekutinu. Provedená transbronchiální biopsie zjistila PAS pozitivní hrudkovitý materiál (obr. 2) a potvrdila diagnózu plicní alveolární proteinózy. Protilátky proti GM‑CSF nebyly vyšetřeny.
Obr. 1. CT plic před léčbou s difuzními intersticiálními změnami charakteru „crazy paving“ 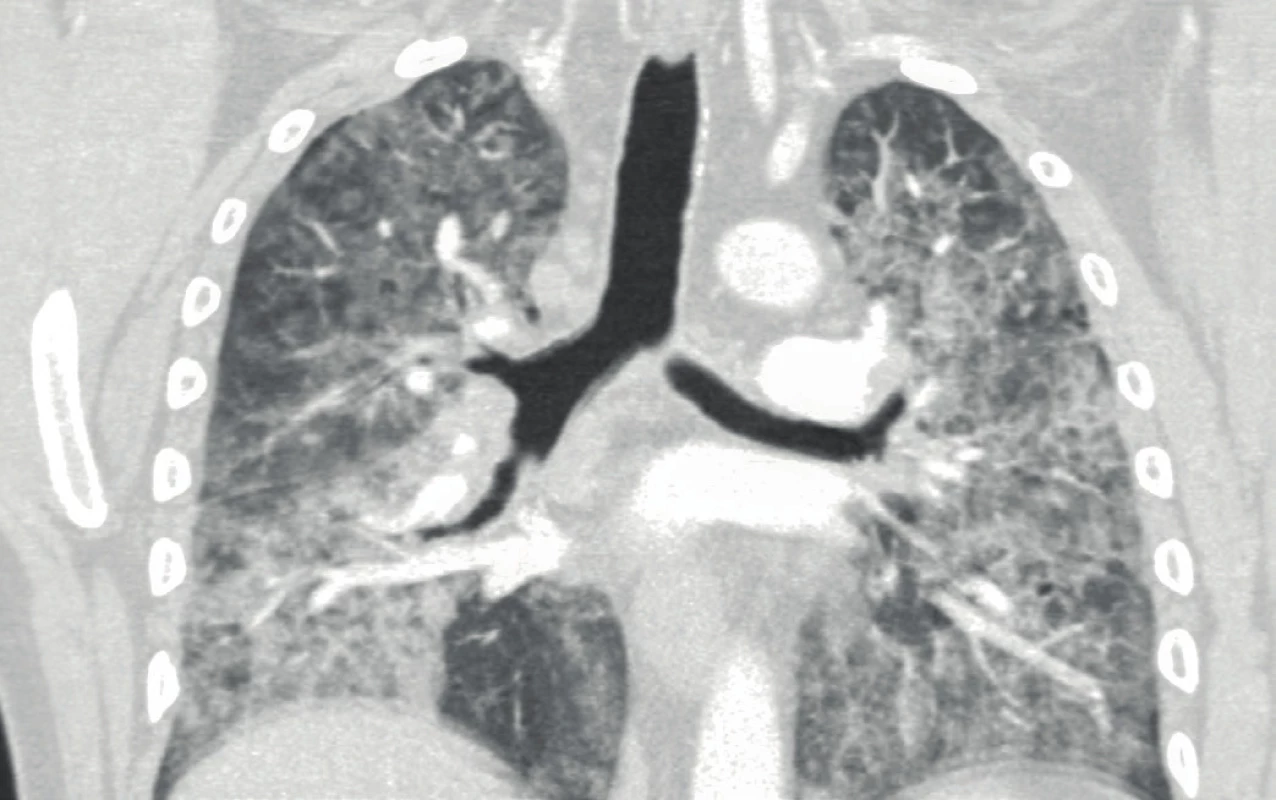
Obr. 2. Plicní alveoly vyplněné PAS pozitivním materiálem, zvětšeno 100× 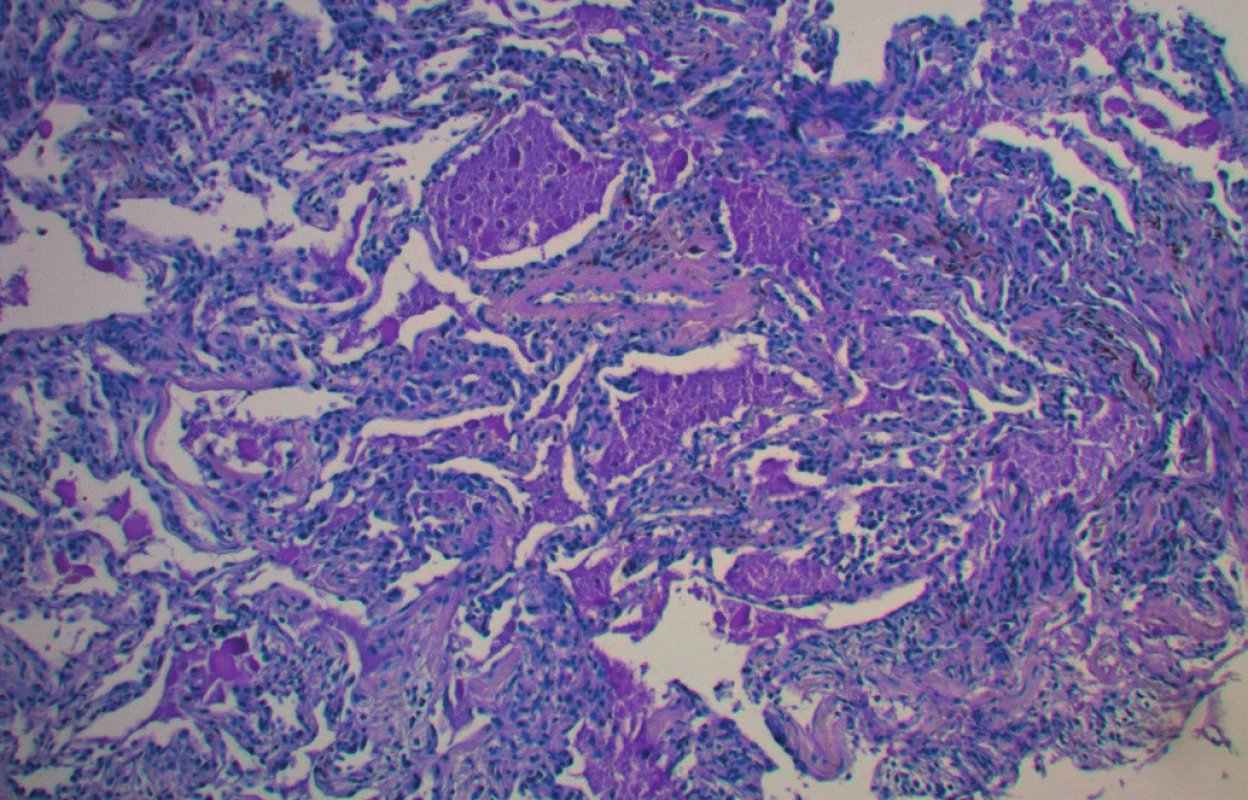
Byla naplánována celoplicní laváž v celkové anestezii. Dva týdny před plánovanou laváží se stav komplikoval pneumonií, pacient byl empiricky léčen ciprofloxacinem, piperacillinem/tazobaktamem a flukonazolem. Postupně byla vysazena imunosupresivní léčba kortikoidy nasazená jako terapeutický pokus před určením správné diagnózy. Po vyléčení plicního infektu byla za pokračující léčby antibiotiky provedena celoplicní laváž. V době plánované plicní laváže byl pacient klidově dušný, závislý na kyslíkové léčbě (SpO2 bylo 90 % při oxygenoterapii průtokem 3 l/min, 83 % na vzduchu). Riziko hypoxemie při ventilaci jedné plíce během laváže bylo zhodnoceno jako příliš vysoké a z toho důvodu jsme se rozhodli provést výkon za podpory mimotělní veno‑venózní membránové oxygenace (VV ECMO). Předpokládali jsme, že mimotělní oxygenace také umožní provést sekvenční laváž obou plic během jedné procedury.
Pacientovy dýchací cesty byly po úvodu do anestezie zajištěny tracheální intubací, byl zaveden vstup do centrálního žilního řečiště a do arterie. Poté byly zavedeny kanyly pro ECMO cestou pravé jugulární žíly (návratová kanyla, 17 Fr, 15 cm) a pravé femorální žíly (drenážní kanyla, 21 Fr, 38 cm). Poloha konců kanyl byla ověřena jícnovou echokardiografií. Anestezie byla udržována sufentanilem a propofolem, myorelaxace cisatrakuriem, antikoagulace heparinem k ACT 150–200 s. Po spuštění mimotělní oxygenace byla provedena selektivní intubace levostrannou biluminální kanylou velikosti 41, bronchoskopicky ověřena poloha kanyly a otestována těsnost při 50 mbar. Laváž byla prováděna v horizontální poloze na zádech fyziologickým roztokem ohřátým na 37 °C v dávkách po 1000 ml. Fyziologický roztok byl do plíce napouštěn během 2 minut gravitačním spádem 30 cm H2 O za poklepové masáže hrudníku a vypouštěn pasivně gravitačním spádem. Celkový objem laváže byl 24 l pro levou plíci a 27 l pro plíci pravou. Zpočátku byla výplachová tekutina kalná, béžové barvy, laváž byla opakována až do vyčeření do mírné opalescence (obr. 3). Během laváže levé plíce byla pravá plíce řízeně ventilována objemem 300 ml, PEEP 5 mbar, Pplat 20 mbar, FiO2 50 %, průtok krve oxygenátorem byl 3,0 l/min. Po ukončení laváže levé plíce byl zvýšen průtok oxygenátorem na 3,4 l/min, byl proveden rekruitment manévr a zahájena ventilace levé plíce (Pplat 30 mbar, PEEP 20, FiO2 0,5). Plicní poddajnost bezprostředně po proplachu byla velmi nízká (5 ml/mbar), během 60 minut se upravila na původní hodnoty okolo 20 ml/mbar. Po ukončení laváže levé plíce byla stejným způsobem provedena laváž plíce pravé. Po dokončení laváže pravé plíce byl proveden její rekruitment a byla zahájena ventilace obou plic. Za 30 minut od ukončení laváže byla dostatečně obnovena funkce plic (Vte 550 ml, Pplat 30, PEEP 12, FiO2 0,6, SpO2 95 %), byla ukončena mimotělní oxygenace a extrahovány kanyly. Peroperačně nedošlo k hypoxii, během anestezie byla podávána infuze noradrenalinu k udržení cílového krevního tlaku. Během laváže se vstřebalo 1300 ml fyziologického roztoku, dalších 800 ml fyziologického roztoku bylo použito jako priming mimotělního oběhu a došlo ke klinicky nevýznamnému vzestupu sérové hladiny chloridového aniontu ze 106 mmol/l na 114 mmol/l. Celková doba výkonu byla 8 hodin 30 minut, mimotělní oxygenace trvala 5 hodin, po 14 hodinách od ukončení výkonu byl pacient nekomplikovaně extubován.
Obr. 3. Výplachová tekutina na začátku a konci procedury. 
5 dní po provedení laváže došlo ke zhoršení respirační insuficience v důsledku pneumonie, byl nasazen empiricky meropenem a cíleně vorikonazol při opakovaném záchytu Aspergillus species v bronchiálním aspirátu. 30 dní po provedené laváži byl pacient propuštěn do domácí péče bez potřeby oxygenoterapie.
Měsíc od propuštění byl při kontrole konstatován nedostatečný efekt léčby a byla indikována další celoplicní laváž. Pacient po první laváži omezil kouření, nicméně s ním nepřestal úplně. Subjektivně se cítil „o trochu lépe“ než před laváží. Na CT plic byla patrná mírná regrese intersticiálních změn, významná regrese mediastinální lymfadenopatie, vymizely původní zánětlivé kondenzace a objevily se tři nové. Pro nedostatečný efekt byla indikována další celoplicní laváž.
Druhá procedura byla provedena 85 dní po první stejným způso ‑ bem, bylo použito celkem 23 litrů fyziologického roztoku pro levou plíci a 26,5 litrů pro pravou. Celková doba výkonu byla 7 hodin. 16 hodin po ukončení laváže byl pacient extubován. 10 dní po výkonu byl propuštěn.
Při kontrole 3 měsíce po poslední laváži došlo k významnému ústupu potíží, pacient byl dušný jen při rychlé chůzi do schodů, schopen běžných činností i návratu do práce. Hodnoty krevních plynů se normalizovaly, spirometrie ukázala již jen lehkou restrikční poruchu (tab. 1). Na RTG byla patrná regrese difuzního zastření i ložiskových změn (rentgenové snímky plic v průběhu léčby jsou na obr. 4). Pacient po druhé laváži zanechal kouření.
Obr. 4. RTG snímky plic před léčbou, po 1. a po 2. laváži 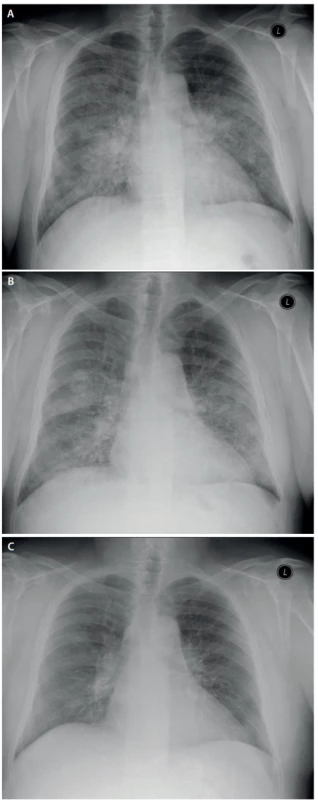
Tab. 1. Vývoj krevních plynů a spirometrických výsledků během léčby 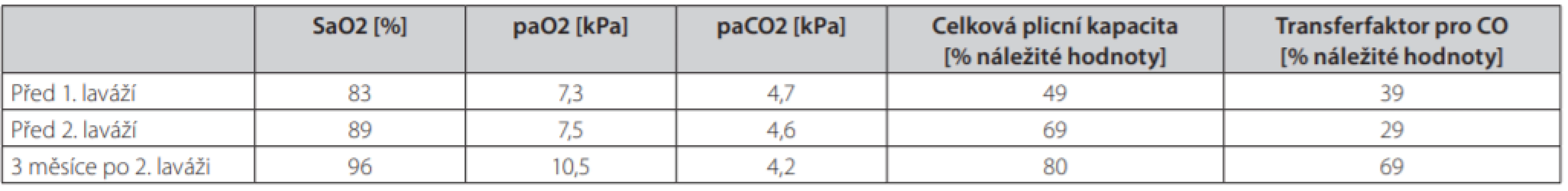
Diskuze
Celoplicní laváž je zlatým standardem léčby plicní alveolární proteinózy. U části pacientů respirační selhání neumožňuje bezpečnou jednostrannou plicní ventilaci a v těchto selektovaných případech je možné provést výkon za podpory mimotělní oxygenace [2, 5]. První publikovaný případ úspěšné léčby celoplicní laváží s podporou ECMO byl v roce 1984 [6] a od té doby bylo publikováno 25 kazuistik nebo souborů kazuistik [7]. Vzhledem k nízké incidenci onemocnění jde tedy o velmi ojediněle prováděný postup. V naprosté většině publikovaných případů se jednalo o pacienty s těžkým hypoxemickým respiračním selháním vylučujícím provedení celoplicní laváže standardním způsobem. V případě námi prezentované kazuistiky se jedná o pacienta z tzv. „šedé zóny“. Respirační selhání nedosahovalo tíže vyžadující umělou plicní ventilaci, pacient byl stabilizován na oxygenoterapii. Nejednalo se tedy o extrémní respirační selhání zjevně znemožňující provedení celoplicní laváže za jednostranné plicní ventilace, nicméně riziko závažné periprocedurální hypoxemie a následné tkáňové hypoxie bylo vyhodnoceno jako vysoké a přesahující rizika spojená s použitím mimotělní oxygenace. Na rozdíl od jiných výkonů provádě ‑ ných při jednostranné plicní ventilaci není v případě celoplicní laváže možné dostatečně rychle řešit periprocedurálně vzniklou závažnou hypoxemii ukončením jednostranné ventilace, neboť lavážovaná plíce není schopna i přes ukončení procedury ještě několik desítek minut plnit svoji okysličovací funkci. Domníváme se tedy, že se stoupající dostupností a bezpečností metod mimotělní podpory ventilace je vhodné zvážit jejich elektivní použití i v situacích, kde by bylo možné provést celoplicní laváž jen za pomoci jednostranné ventilace, nicméně s významným rizikem komplikací v důsledku hypoxie. Objektivní kritéria pro rozhodnutí neexistují, je tedy nutné individuálně zvážit rizika a přínosy použití mimotělní oxygenace. V úvahu je třeba vzít také fakt, že mimotělní oxygenace umožňuje provést laváž obou plic během jedné procedury a tím významně zkrátit čas léčby. Nevýhodou tohoto přístupu jsou kromě rizik spojených s kanylací a mimotělním oběhem i vyšší finanční náklady.
PROHLÁŠENÍ AUTORŮ:
Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Střet zájmů: Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Podíl autorů: Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. PR je autorem úvodu, JB je autorem popisu případu a diskuze.
Financování: Žádné.
Poděkování: Autoři děkují MUDr. Martinu Čaganovi, MIAC, za obrazy z patologického vyšetření bioptovaného materiálu, MUDr. Danielu Doležalovi za snímky lavážové tekutiny a cenné připomínky k textu.
Článek přijat redakcí: 14. 6. 2019; Článek přijat k tisku: 16. 9. 2019; Cit. zkr: Anest intenziv Med. 2020; 31(1–2): 42–45
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Ing. Jan Beneš,
Zdroje
1. Seymour JF, Presneill JJ. Pulmonary Alveolar Proteinosis. Am J Respir Crit Care Med. 2002; 166 : 215–235. doi:10.1164/rccm.2109105.
2. Campo I, Luisetti M, Griese M, Trapnell BC, Bonella F, Grutters J, et al. Whole lung lavage therapy for pulmonary alveolar proteinosis: a global survey of current practices and procedures. Orphanet J Rare, DiS. 2016; 11 : 115. doi:10.1186/s13023-016-0497-9.
3. Ohashi K, Sato A, Takada T, Arai T, Nei T, Kasahara Y, et al. Direct evidence that GM‑CSF inhalation improves lung clearance in pulmonary alveolar proteinosis. Respir Med. 2012; 106 : 284–293. doi:10.1016/j.rmed.2011. 10. 019.
4. Greenhill SR, Kotton DN. Pulmonary alveolar proteinosis: a bench‑to‑bedside story of granulocyte‑macrophage colony‑stimulating factor dysfunction. Chest. 2009; 136 : 571 – 577. doi:10.1378/chest.08-2943.
5. Vymazal T, Krecmerova M. Respiratory Strategies and Airway Management in Pati ‑ ents with Pulmonary Alveolar Proteinosis: A Review. Biomed Res Int. 2015; 2015 : 1–5. doi:10.1155/2015/639543.
6. Zapol WM, Wilson R, Hales C, Fish D, Castorena G, Hilgenberg A, et al. Venovenous bypass with a membrane lung to support bilateral lung lavage. JAMA. 1984; 251 : 3269–3271. doi:10.1001/jama.1984.03340480051028.
7. Krecmerova M, Mosna F, Bicek V, Petrik F, Grandcourtova A, Lekes M, et al. Extracorporeal membrane oxygenation to support repeated whole‑lung lavage in a patient with pulmonary alveolar proteinosis in life threatening dyspnoe – a case report. BMC Anesthesiol. 2015; 15 : 173. doi:10.1186/s12871-015-0152-3.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2020 Číslo 1-2- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Náš článek po 10 letech: Intraoperative fluid optimization using stroke volume variation in high risk surgical patients: results of prospective randomized study
- Sedace v intenzivní péči – část I.
- Historický přehled tekutinové terapie
- Pandemie COVID-19 – jenom rizika a negativní dopady nebo i příležitosti?
- Fasciální prostory trupu ve vztahu k regionální anestezii – část první: fasciální prostory hrudníku ve vztahu k regionální anestezii
- Elevace vysoce senzitivního troponinu u stavů mimo akutní koronární syndrom – výzva pro lékaře urgentního příjmu
- Plicní alveolární proteinóza: opakovaná oboustranná celoplicní laváž s podporou mimotělní membránové oxygenace
- Příjem a třídění pacientů se suspektním nebo potvrzeným COVID-19
- Obecné zásady péče o pacienta s COVID-19 na pracovišti intenzivní péče
- Perioperační péče o pacientky podstupující císařský řez
- Kardiopulmonální resuscitace pacientů se suspektním nebo potvrzeným COVID-19
- Protektivní ventilace u chirurgicky nemocných pacientů: doporučení mezinárodního expertního panelu
- Cílená regulace tělesné teploty: konsenzuální stanovisko mezioborové pracovní skupiny k použití metody „targeted temperature management“ u dospělých pacientů v intenzivní péči
- Zajištění dýchacích cest v přednemocniční péči dospělých – to tube or not to tube?
- Mezinárodní konsenzuální stanovisko k použití uterotonik v průběhu císařského řezu
- Glykemie, mozkové neurotransmitery a možný vztah k pooperační kognitivní poruše?
- Zajímavosti, tipy a triky, informace z jiných oborů
- European Diploma in Regional Anaesthesia and Acute Pain Management – EDRA
- Prof. MUDr. Danuše Táborská, DrSc. 22. 12. 1928 – 6. 4. 2020
- Životní jubileum emeritního primáře MUDr. Jana Řezáče
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sedace v intenzivní péči – část I.
- Zajištění dýchacích cest v přednemocniční péči dospělých – to tube or not to tube?
- Perioperační péče o pacientky podstupující císařský řez
- Obecné zásady péče o pacienta s COVID-19 na pracovišti intenzivní péče
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



