-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
Vyšlo v časopise: Anest. intenziv. Med., 21, 2010, č. 5, s. 281-288
III. VENTILACE MIMO JIP
1. Význam způsobu peroperační umělé plicní ventilace na plicní funkce a pooperační morbiditu
Dostál P.
Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové
V průběhu operačního výkonu prováděného v celkové anestezii dochází vlivem snížení svalového tonu interkostálního svalstva, bránice a chirurgické manipulace ke snížení funkční reziduální kapacity FRC a alteraci výměny plynů v plicích. Výskyt pooperační hypoxémie a respiračních komplikací závisí na typu operačního výkonu a i u předoperačně kardiopulmonálně zdravých pacientů, podstupujících operační výkon v oblasti nadbřišku, může dosahovat až 30 %. Volba způsobu umělé plicní ventilace v průběhu operačního výkonu může ovlivnit rozsah výše popsaných změn. Význam použití vyšších hodnot PEEP a případné použití otevíracího manévru v průběhu operačního výkonu je dlouhodobě kontroverzní otázkou. Bylo velmi dobře prokázáno, že po úvodu do anestezie dochází ke vzniku atelektatických oblastí v dependentních partiích plic, na jejichž vzniku se kromě samotné indukce anestezie a případné svalové relaxace podílí i chirurgická manipulace a inhalační aplikace směsí, které jsou velmi dobře vstřebávány. V oblastech s nízkým poměrem ventilace a perfuze může za těchto okolností dojít rychle ke vzniku atelektáz, které jsou příčinou zvýšení plicního zkratu v průběhu anestezie. Přítomnost atelektáz přetrvává v pooperačním období a může vést k rozvoji respirační insuficience. Aplikace PEEP je schopna v experimentu těmto změnám zabránit, efekt rychle odeznívá po ukončení aplikace PEEP. Studie, hodnotící vliv aplikace PEEP s provedením nebo bez provedení otevíracího manévru, prokazují příznivé ovlivnění oxygenace v průběhu anestezie a operačního výkonu. V experimentálních modelech plicního poškození vznikajícího v průběhu umělé plicní ventilace dochází při nedostatečné hodnotě PEEP k poškození alveolů a malých dýchacích cest. U nemocných s akutním plicním selháním ALI/ARDS je pozorován vzestup prozánětlivých a protizánětlivých cytokinů do 1 hodiny od zahájení umělé plicní ventilace. Naproti tomu u nemocných bez předchozího plicního poškození jsou výsledky studií nesourodé. Je tedy možné, že u nemocných bez preexistujícího plicního poškození, kteří podstupují elektivní nekomplikovaný operační výkon, je vliv použití PEEP nevýznamný. To ovšem neplatí pro vybrané rizikové skupiny nemocných, jako jsou nemocní podstupující hrudní výkon (kardiochirurgické i plicní výkony), obézní nemocní podstupující nitrobřišní výkony a nemocní podstupující vybrané laparoskopické výkony. S určitým zjednodušením je možné konstatovat, že v těchto situacích časné zahájení aplikace přiměření hodnoty PEEP (obvykle v pásmu 5–10 cm H2O) s případným opakovaným použitím otevíracích manévrů příznivě ovlivňuje plicní funkce jak peroperačně, tak snižuje výskyt pooperačních komplikací.
Význam velikosti dechového objemu u nemocných bez předchozí poruchy plicních funkcí je v perioperačním období méně jasný. Výsledky malých prospektivních randomizovaných studií jsou v pásmu použitých dechových objemů 5–15 ml/kg nehomogenní. Pouze některé z nich, prováděné na souborech nemocných s vysokým rizikem pooperační plicní dysfunkce, ukazují zvýšení hladiny cytokinů v bronchoalveolární tekutině a pouze jedna studie zaznamenala kratší dobu pooperační umělé plicní ventilace a snížení výskytu plicních infekcí ve skupině nemocných ventilovaných redukovaným dechovým objemem. Je ale zřejmé, že v žádné studii nebyl pozorován negativní efekt použití redukované velikosti dechových objemů a že použití menších dechových objemů může být spojeno s menší potřebou tekutin v peroperačním období. Z epidemiologických studií je také známo, že použití vysokých dechových objemů může zvyšovat riziko vzniku ALI/ARDS u vybraných skupin nemocných, u kterých byla vnímavost vůči plicnímu poškození zvýšena předchozím inzultem (second hit). Z uvedených důvodů je možné konstatovat, že použití redukované velikosti dechových objemů lze doporučit i pro peroperační období. Vliv ventilačního režimu na plicní funkce, především oxygenační funkci plic, byl předmětem řady studií prováděných na populacích nemocných s vysokým rizikem vzniku peroperační hypoxémie. Z výsledků těchto studií vyplývá, že použití tlakově řízené ventilace je vzhledem k dosažení vyššího středního tlaku v průběhu dechového cyklu spojeno se zlepšením oxygenační funkce plic. Příznivý dopad na pooperační morbiditu ale nebyl dosud přesvědčivě potvrzen. Vzhledem ke skutečnosti, že v úvodu uvedené mechanismy vzniku plicní dysfunkce přetrvávají také v časném pooperačním období, byla publikována řada studií zaměřených na problematiku pooperační ventilace, pooperačního použití otevíracích manévrů (nemocní po kardiochirurgických výkonech), pooperační aplikace kontinuálního přetlaku v dýchacích cestách (CPAP), neinvazivní ventilace nebo respirační fyzioterapie jak v prevenci, tak terapii pooperačního respiračního selhání. Na základě analýzy dostupných dat lze u vybraných rizikových skupin nemocných (anamnéza poruchy plicních funkcí, nitrohrudní nebo rozsáhlý nitrobřišní výkon a obezita, zvláště při použití kapnoperitonea) doporučit rutinní použití některé z uvedených neinvazivních metod prevence pooperační respirační insuficience.
Literatura k dispozici u autora.
2. Možnosti a limity umělé plicní ventilace (UPV) v PNP
Knor, J., Klik, L.
ÚSZS SčK
V posledních desetiletích prošla odborná přednemocniční neodkladná péče velkou kvalitativní přeměnou. Pacienti, jejichž stav by v minulosti znamenal jistou smrt, mají dnes – také díky výrazně zlepšené přednemocniční péči – v mnoha případech šanci na přežití. Velký podíl na této skutečnosti má soudobá Zdravotnická záchranná služba, účast lékaře ve výjezdové skupině (RLP), kvalitní technické vybavení a jeho miniaturizace. Především snaha o odbornou přípravu zdravotnických pracovníků všech úrovní pro práci v terénu však vytváří předpoklady pro dosažení úspěšných výsledků při zvládání kritických stavů. Jedním ze základních postupů urgentní medicíny, které rozhodují o přežití pacienta v přednemocniční fázi, je zajištění dýchání – tedy jedné ze základních životních funkcí (VF). Péče o dýchání má tu výhodu, že jsme jej schopni (většinou) arteficiálně nahradit. Vlastní terapeutický zásah zajištění VF dýchání při jeho selhávání musí být včasný s prevencí ireverzibilního hypoxického postižení (zejména) CNS. Má dva neoddělitelné a nerozlučně spjaté aspekty:
- Adekvátní zajištění dýchacích cest
- Adekvátní arteficiální ventilační režim s možností kontroly
1. Zajištění dýchacích cest
Endotracheální intubace (ETI) je nejdokonalejší neoperační zajištění dýchacích cest. Umožňuje nejenom bezpečné napojení na umělou plicní ventilaci již v časné fázi ošetření, ale zároveň zabezpečuje dýchací cesty proti vniknutí cizího obsahu, např. zvratků či krve. Současně zajišťuje také alternativní vstup do centrálního kompartmentu a umožňuje podávání vybraných farmak alternativní inhalační cestou.
ETI je dokonale zvládnutá metoda v podmínkách plánovaných výkonů v rámci anestezie, s přesně definovanými postupy za standardních podmínek. V terénu se vzhledem k bezpečnému přístupu v drtivé většině případů provádí ústy, proto hovoříme o orotracheální intubaci (OTI). Lékař pracující ve zdravotnické záchranné službě má být schopen provádět OTI u všech pacientů, jejichž stav tento postup vyžaduje, a to i za nepříznivých technických a klimatických podmínek. V terénu se prakticky vždy jedná o stavy bezprostředního ohrožení života pacienta, které vyžadují neodkladné řešení, např. bezvědomí traumatologické a netraumatologické etiologie, KPCR, kardiorespirační selhání, stavy vyžadující dokonalou analgezii, popáleniny či poleptání. Urgentní OTI v terénu je výkon vždy jedinečný, jehož provedení musí respektovat zvláštnosti pacienta a podmínky prostředí. Pro zachránce znamenají situace vyžadující OTI veliké emocionální vypětí, které může být i zdrojem chyb. Jakákoli chyba však za těchto okolností může mít pro pacienty vážné následky. Proto by měl být lékař záchranné služby dokonale vycvičen v provádění OTI i mimo nemocniční prostředí. Přestože postup OTI při zajištění dýchacích cest v PNP zcela dominuje, v současnosti jsou k dispozici další možnosti, které jsou dobře využitelné, např. v paramedických systémech, u lékařů, kteří nemají dostatečnou zručnost a zkušenost s OTI či u pacientů, u kterých nejde OTI provést pro složité anatomické poměry či charakter poranění. Těmito alternativami jsou:
- laryngeální maska,
- laryngeální tubus,
- Combi-Tubus,
- urgentní koniopunkce.
Každý z těchto postupů má své indikace, všechny by měly patřit do standardní výbavy ZZS, nicméně stále platí, že postup OTI má svoji jasnou prioritu.
2. Arteficiální ventilační režim (UPV) s možností kontroly
Nejjednodušší způsob umělé plicní ventilace (UPV) z hlediska přístrojového vybavení je umělé dýchání z plic do plic, popsané již roku 1958. Patří do výuky laické první pomoci. Nejjednodušším způsobem UPV s pomůckou je použití samorozpínacího vaku. Technika zvládnutí UPV pomocí této pomůcky musí být v arzenálu každého záchranáře. Nejlepšího způsobu oxygenace během transportu (nastavené dodávky definované směsi plynů) lze dosáhnout v PNP s použitím transportních ventilátorů.
Požadavky na tyto přístroje jsou dnes v obecné rovině, zejména:
- spolehlivost, malý objem a hmotnost;
- co největší rozpětí minutové ventilace (MV): min. 3–20 l;
- široká provozní teplota (např.-15 až +50 °C);
- režim řízené objemové ventilace;
- volitelná funkce pro FiO2 (min. alespoň 0,5 a 1,0);
- alarmová hlášení pro stenózu, rozpojení, pokles tlaku v dodávce kyslíku;
- chyba systému hlášena formou světelné a zvukové signalizace, viditelné a slyšitelné i v hlučném prostředí bez osvětlení (letecká záchranná služba);
- odolnost proti dešti;
- možnost snadného transportu k pacientovi i se zdrojem O2 („oxybag“).
Při zachovalé spontánní ventilaci jsou ke zvážení možnosti využití neinvazivní ventilace v širším slova smyslu – CPAP (např. u pacientů s plicním edémem), či inhalační léčby s aplikací farmak neinvazivní cestou. V dnešní době miniaturizace monitorovacích přístrojů lze režim UPV dobře kontrolovat nejen pomocí SpO2, ale i pEtCO2, které se postupně stává standardem vybavení sanitních vozů.
UPV jako součást kardiopulmocerebrální resuscitace (KPR)
(intubace areflektorického pacienta)
OTI s následnou UPV je jedním ze čtyř úkonů rozšířené KPR. Výkony charakteristické pro KPCR jsou:
- OTI a UPV
- Zajištění venózního vstupu
- Monitorování EKG
- Elektroimpulzoterapie
Při náhlé zástavě dýchání a oběhu intubujeme co nejdříve od zahájení KPR. Pacient, u kterého došlo k zástavě oběhu před příjezdem posádky záchranné služby, se nachází v bezvědomí, se ztrátou obranných reflexů a svalového tonu. OTI v takovém případě nevyžaduje farmakologickou přípravu a provádíme ji neprodleně. OTI umožňuje převést pacienta co nejdříve na UPV s definovanou dodávkou kyslíku. Při řízené plicní ventilaci se snažíme docílit alespoň těchto základních parametrů:
- Jednotlivý vdech (Vt) se rovná 6–7 ml/kg tělesné hmotnosti.
- Frekvence dýchání = 10/min, u dětí vyšší.
- Frakce inspirovaného kyslíku (FiO2) = 1,0.
- Inspirační tlaky (u zdravých plic) do 2,0 kPa.
- PEEP většinou ponecháváme na 0, či na ještě nižších hodnotách pro možnost negativního ovlivnění venózního návratu.
Obecná empirie záchranářů vycházející z možnosti dokonalého monitorování svědčí většinou pro příliš vysoko nastavené ventilační objemy vedoucí k hyperventilaci. Tato snaha o „zlepšení komfortu“ pacienta bez zpětné vazby však může být kontraproduktivní, s potenciálním sekundárním poškozením pacienta.
UPV jako součást léčby těžkého traumatu v terénu
(intubace pacienta s částečně zachovalými laryngeálními reflexy)
V případech, kdy se nejedná o stav se zástavou oběhu spojenou s úplným vymizením obranných reflexů a svalového tonu, je nutné před OTI zajistit intravenózní přístup a provést farmakologickou přípravu. Získaným žilním přístupem podáváme nejprve preparát s hypnoticko-anestetickým účinkem a poté podáváme vhodná periferní svalová myorelaxancia. Z hypnotik-anestetik volíme samozřejmě taková, která mají co nejméně nežádoucích účinků – nejčastěji benzodiazepiny, eventuálně etomidát či propofol. Z periferních myorelaxancií je stále nejužívanější sukcinylcholinjodid v obvyklé dávce, dále preparáty ze skupiny relaxancií nedepolarizujícího typu, např. vecuronium či atracurium. Při naloženém trakčním límci je OTI bezpečná i v případě poranění krční páteře. Jestliže je spontánní dechová aktivita pacienta dostatečně zachována, pak provádíme OTI teprve po imobilizaci, zajištění venózního katétru, farmakologické přípravě a uložení pacienta do vozu rychlé zdravotnické služby. Před intubací a v jejím průběhu se obvykle snažíme monitorovat vitální funkce, zejména elektrickou aktivitu srdce a saturaci periferních tkání kyslíkem. Ve většině případů provádíme tzv. bleskovou OTI. Její podstatou je preoxygenace čili zvýšení gradientu kyslíku na alveolokapilární membráně při zachovaném spontánním dýchání pomocí kyslíkové venti-masky s přívodem čistého kyslíku. Jako přípravu podáváme hypnotikum i relaxans na jednu oběhovou dobu a při nástupu apnoe řízeně neprodýcháváme. I když tato metoda je více hemodynamicky náročná, používáme ji většinou u pacientů, kde hrozí vdechnutí a zatečení potravy, zvratků či krve do dýchacích cest. Provedení výkonu trvá do 15 sekund. Často nelze jednoduše získat přístup k pacientovi. Pak je nezbytný postup nestandardní a záleží zcela na rozhodnutí a zodpovědnosti lékaře, jak budou tyto extrémní situace zvládnuty. UPV nastavujeme v podobných parametrech a za podobných zásad jako u KPR. Obecné zásady léčby polytraumatu v terénu:
- Analgezie,
- Sedace a relaxace
- OTI s následnou UPV
- Blokátory primárních cytokinů
- Objemová náhrada
- Dokonalá imobilizace
- Monitorování vitálních funkcí
- Šetrný transport
UPV kojenců a malých dětí
Na rozdíl od dospělých, kde život nejčastěji ohrožuje náhlá zástava oběhu, je u dětí mnohem častějším stavem ohrožujícím život postižení dýchacích cest. Postup non-apnoické OTI volíme u malých dětí, u kterých lze zavést lžíci laryngoskopu ke kořeni jazyka při lokální slizniční anestezii.
Hlavní indikace OTI a UPV v dětském věku:
- akutní laryngitida,
- akutní epiglotitida,
- otok dýchacích cest alergického původu,
- aspirace cizího tělesa,
- astmatický stav,
- bezvědomí s křečemi neznámého původu,
- závažné trauma.
Stavy s obstrukcí zejména horních dýchacích cest u kojenců a předškolních dětí patří k častým výzvám k výjezdu lékaře záchranné služby. Nejčastější diagnózou je laryngitida. Většina těchto stavů je zvládána konzervativní léčbou kortikoidy a inhalací kyslíku, popř. adrenalinu. V případě nutnosti provedení OTI je striktně doporučována neapnoická technika s využitím inhalačního úvodu do anestezie. Toto je v PNP nerealizovatelné. Alternativním postupem může být i. v. podání benzodiazepinu s lokální slizniční anestezií krku. Oba autoři mají zkušenost s inhalačním úvodem do anestezie při nutnosti OTI u těchto dětí. Epiglotitida se v současné době vakcinace vyskytuje naštěstí vzácněji. U obou výše uvedených onemocnění musí být lékař připraven k provedení urgentní koniopunkce. Závažnou komplikací bývá aspirace potravy nebo žaludečního obsahu. Takto postižené dítě je při příjezdu záchranné služby cyanotické, s tachykardií, zatahuje jugula, lapavě dýchá. V dutině ústní mohou být zbytky potravy. OTI provádíme s pomocí lokálního anestetika podaného ke kořeni jazyka formou aerosolu. OTI umožňuje také odsátí obsahu z dýchacích cest i bronchiální laváž. Následná UPV je většinou prováděna pomocí samorozpínacího vaku – jednak kvůli možnostem přístrojů, jednak proto, že zkušená a šetrná ruka záchranáře je nejlepší prevencí iatrogenního poškození. Febrilní křeče vznikají často u kojenců, batolat a dětí předškolního věku léčených doma pro virózu. Křeče tlumíme diazepamem v obvyklé dávce, k OTI a následné UPV přistupujeme z důvodu přetrvávající poruchy vědomí, eventuálně pokračujícího křečového stavu. Hlavní zásady ošetření závažného traumatu u dětí se neliší od dospělých s přihlédnutím ke všem specifikům dětského věku.
UPV při akutním kardiogenním plicním edému a akutní exacerbaci CHOPN
Akutní respirační insuficience na podkladě kardiogenního plicního edému či akutní exacerbaci CHOPN je další poměrně častou situací v PNP, nezřídka ústící v nutnost zahájení UPV. Na rozdíl od předchozích situací, kdy rychlé invazivní zajištění dýchacích cest a zahájení UPV má nejvyšší prioritu, je v těchto situacích určitý prostor k využití „konzervativnějšího“ postupu, často umožňujícího překlenutí nejkritičtějšího období s využitím možnosti eliminování OTI a konvenční UPV. V PNP je využívána technika CPAP, o níž lze hovořit jako o neinvazivní plicní ventilaci v širším slova smyslu.
Využití CPAP s těsnící obličejovou maskou má však své podmínky a limity:
- Reverzibilita aktuální dechové nedostatečnosti
- Spolupráce a celková kondice pacienta bez alterace vědomí
- Střední až závažná dechová tíseň s tachypnoí a zapojením pomocných dýchacích svalů
Kontraindikace použití CPAP:
- zástava dýchání;
- neschopnost udržet volné dýchací cesty;
- nespolupráce, neklid, vyčerpání pacienta;
- oběhová nestabilita, akutní ischémie myokardu;
- nadměrná bronchiální sekrece hlenů;
- netěsnost obličejové masky z důvodu anatomických poměrů;
- obezita nad 200 % ideální tělesné hmotnosti.
V podmínkách PNP realizujeme CPAP různými systémy zajišťujícími konstantní průtok směsi a zařazením end-exspiračního přetlaku. Nejlepší zkušenosti jsme získali s využitím systému Boussignac, který je lehký a dobře tolerovatelný. End-exspirační přetlak je vytvářen virtuální chlopní a jeho výše je limitována nastaveným průtokem plynu. Průtok 15 l/min vytváří end-exspirační přetlak 5 cm H2O, k dosažení 10 cm H2O je třeba příkonu 25 l/min. Nevýhodou systému je relativně vysoká cena, poměrně značná zranitelnost a relativně vysoký průtok kyslíku. V případě nutnosti zahájení konvenční UPV mají oba tyto stavy svá specifika vyžadující vysoký stupeň erudice lékaře. Rozhodující roli na samém počátku hraje již polohování nemocného. Orotracheální intubace u selhávajícího myokardu vyžaduje podání anestetika s minimálním kardiodepresivním účinkem. Nastavení parametrů ventilátoru musí být individuální, se zohledněním zejména zvýšené rezistence v dýchacích cestách. Samozřejmostí je využití veškerých v PNP dostupných možností monitorování. I zde může být využití transportních ventilátorů limitováno jejich vlastnostmi.
Limity UPV v PNP
Možnost zajištění vitální funkce dýchání již v přednemocniční fázi ošetření je velmi účinnou zbraní v rukou zkušeného lékaře a velkou šancí pro kriticky nemocného pacienta. UPV v PNP má však své limity, které jsou multifaktoriální:
- Omezená doba UPV po dobu PNP
- Nemožnost monitorování krevních plynů
- UPV poskytovaná nelékaři – použití alternativních pomůcek k zajištění DC (kombitubus, LMA, laryngeální tubus), ventilace samorozpínacím vakem s přívodem kyslíku
- Asynchronní UPV s využitím nervosvalové blokády v iniciální fázi inzultu i během sekundárních převozů pacientů ventilovaných různými režimy včetně weaningu
- Technické vlastnosti transportních přístrojů pro UPV
Výše uvedená omezení UPV zvyšují nároky na lékaře v terénu s ohledem na vznik a řešení případných komplikací. Zde je potřeba zopakovat, že žádná technika ani léčebný postup není zcela bezpečný. Bezpečný pro nemocného může být jen lékař. Akutní stavy v terénu hrozí vystupňováním do krajní nouze. Poukázali jsme pouze na několik konkrétních situací, se kterými se může setkat při své práci lékař záchranné služby. Ten často musí improvizovat a volit vždy co nejlepší řešení ku prospěchu pacienta. Dokonalá příprava lékařů záchranných služeb s prováděním postupů neodkladné péče sníží počet případných pochybení v podmínkách terénu na minimum.
3. Ventilace v mimořádných podmínkách
Jurenka, B.
ARO, Ústřední vojenská nemocnice Praha
Sdělení se zaměřuje na problematiku umělé plicní ventilace prováděné v polních podmínkách a hypobarickém prostředí letounu s „pevnými křídly“.
1. Umělá plicní ventilace v polních podmínkách – logistické problémy
- Nadmořská výška/barometrický tlak
- Klimatické podmínky (teploty, prašnost…)
- Kyslík
- Kvalifikace a psychická odolnost personálu
- Přístrojový park
- Energetické a vodní zdroje
- Laboratorní vyšetření (ABR)
- Regionální bezpečnostní situace, povětrnostní situace, administrativní povolení přeletu při leteckých překladech pacientů
2. Umělá plicní ventilace v letounu s „pevnými křídly“
Při UPV v hypobarickém prostředí letounu nutno brát na zřetel:
- Kabinový tlak letounu
- Akcelerační/decelerační síly
- Délku mise
- Odlišnou patofyziologii v hypobarickém prostředí
- Kabinová výška 2650 m n. m.
- Kabinový barometrický tlak 562,5 mm Hg
- PaO2 55–60 mm Hg při FiO2 0,21
- Hypoxémie obtížně predikovatelná
- Objem plynových bublin – faktor cca 1,5
- Emergency – sestup na 3000 - povětrnostní vlivy + vyšší spotřeba paliva – nebezpečné + nižší dolet
- Kabinu používaného letounu AČR nelze v cestovní letové hladině natlakovat na hladinu moře (760 mm Hg)
Klinické důsledky pro pacienta
- Expanze plynu až air-trapping
- Cave: PNO
- Expanze těsnicí manžety ETR
- Kombinace hypobarické prostředí/pneumopatie
- Shift tekutin během letu s dynamickými ventilačními/perfuzními změnami
Kalkulace spotřeby kyslíku
- (FiO2 – 0,21)/0,79 . MV = l . min-1
- l . min-1 . 60 = l . hod-1
- Čas letu + čas překladů = trvání mise
- Trvání mise . l . hod-1 = celková spotřeba O2
- Tlak v lahvi (bar) . objem (l) = dostupný objem O2
- Bezpečnostní faktor + 2 hod (v míru)
Ventilační management
- Cíl: SPO2 nad 95 %, ETCO2 35–39 mm Hg
- UPV/PCV, LTV concept (max. Vt 7 ml . kg-1) + PEEP
- FiO2 0,4 -0,6
- I : E 1 : 1,5
- Hluboká analgosedace na GCS 3; kontinuálně dávkovačem Opioid + Benzodiazepin i. v.
- Monitorování UPV – standard JIP
4. Ventilace astronautů v kritické situaci na oběžné dráze – současné možnosti
Herold, I.
ARO, Oblastní nemocnice Mladá Boleslav
Pilotované lety na oběžnou dráhu raketoplánem (STS) a delší pracovní pobyty na orbitální stanici (ISS) jsou dnes relativně běžné. Blízkou realitou jsou již i komerčně využívané lety. V nedaleké budoucnosti se chystají i delší mise. Po neblahých zkušenostech s kritickou situací na palubě ruské vesmírné stanice MIR v roce 1997, kdy došlo k požáru a zamoření prostoru toxickými plyny, nabyla hrozba katastrofy reálné podoby a součástí poměrně obsáhlé zdravotnické výbavy se stal i jednoduchý transportní ventilátor, intubační souprava a CMRS (Crew Medical Restraint System), usnadňující resuscitační postupy včetně intubace a KPR v mikrogravitačním prostředí. Kritické situace, které mohou během letu nastat, zahrnují popáleniny a inhalační trauma, dekompresní nemoc, plicní embolii, aspirační pneumonii a traumata. Při extrémních nákladech provázejících dopravu každého zařízení do vesmíru se očekává, že technika bude schopna zajistit podporu základních životních funkcí v různých situacích po dobu urychleného návratu na Zemi, pokud bude reálná naděje na záchranu člena posádky. Součástí zdravotnické technické výbavy posádky (CHeCHS – Crew Health Care Maintenance System), kterou pro ISS zajišťuje NASA, je i Respiratory Support Pack (RSP), jehož součástí je i ventilátor (dosud transportní objemový Autolog 2000) a zásoby kyslíku, umožňující transport z ISS na dobu 72 hod. Jako nejvhodnější se dnes pro tyto účely jeví systémy „closed loop ventilation“, jejíž civilní verze v podobě ASV se používá dnes již klinicky. Snižuje na minimum nutnost průběžného upravování parametrů ventilátoru posádkou a má potenciál urychlit odvykání a eliminovat chybné nastavení posádkou. Cílem je informace anesteziologů a intenzivistů o high-ends kritické péče v extrémním prostředí oběžné dráhy.
Vliv prostředí mikrogravitace na respirační systém
Během dosavadních pilotovaných letů nepozorovali členové posádek větší respirační obtíže. Vlivem mikrogravitace na respirační a kardiovaskulární systém v experimentálních podmínkách při parabolických letech se zabývala od poloviny 90. let skupina slavného fyziologa Johna B. Westa, jenž dosud pracuje pro NASA jako koordinátor výzkumných projektů.
Ve srovnání se statickými podmínkami na Zemi byly v prostředí mikrogravitace pozorovány určité změny fyziologických funkcí (tab. 1), které při vzniku akutního respiračního onemocnění mohou přispět k manifestnímu zhoršení plicních funkcí, např. zhoršení plicního edému při inhalačním poranění. Pokles funkční reziduální kapacity zvyšuje sklon k uzávěru dýchacích cest, pokud by při ventilaci nebyl použit PEEP. Naopak vzestup difuzní kapacity pro CO při pobytu v mikrogravitačním prostředí částečně brání při inhalačním traumatu vzniku těžší hypoxémie.
Tab. 1. Fyziologické změny kardiovaskulárního a respiračního systému při pobytu v mikrogravitaci 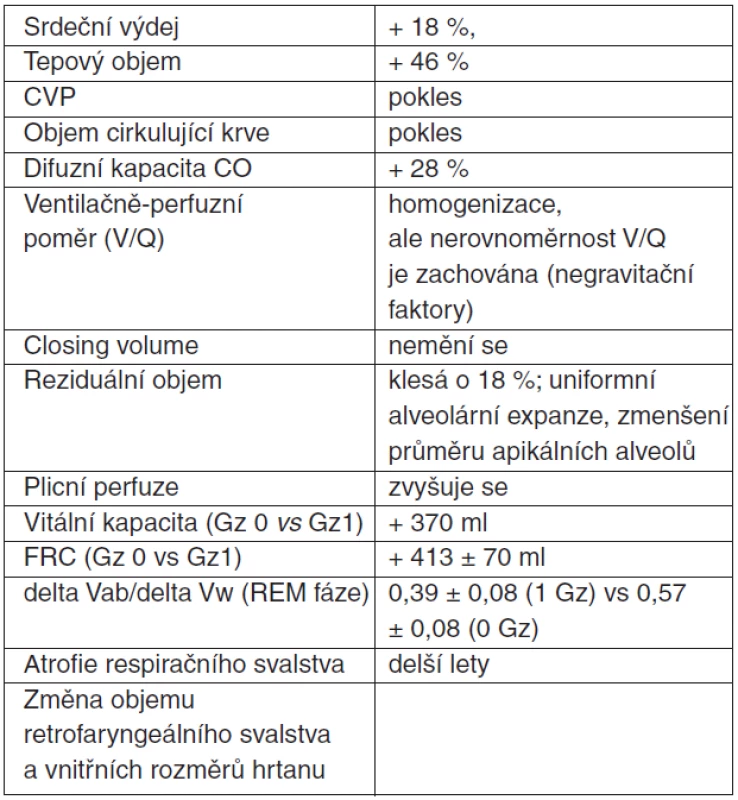
Specifické problémy zajištění UPV v kabině na oběžné dráze
- Hrozí inhalační trauma: CO, NOx, HCN, hydrazin, etylenglykol, amoniak: nutnost monitorování prostředí v kabině, HEPA filtry.
- Častější bakteriální kontaminace prostředí při vyšších teplotách (až 1000 cfu/m3).
- Standardní oxygenoterapie se nemění (k dispozici FiO2 1): nosní brýle, non-rebreathing maska.
- Použití inhalačních aerosolů (MDI) je možné a účinné.
- Nutnost fixace pacienta a resuscitujícího (během zajištění dýchacích cest nebo resuscitace) – CMRS (Crew Member Medical Restraint System).
- Ztížené možnosti běžného klinického monitorování: hlučnost prostředí (auskultace) a horší osvětlení (hodnocení kolorimetrických metod kapnografie).
- Osud vydechované směsi pacientem při FiO2 1: FeO2 0,9 a postupně se zvyšuje koncentrace O2 v kabině (riziko požáru), zvyšuje se obsah CO2 (0,05) a H2O (0,05) v atmosféře (možnost odsávání vydechované směsi).
- EVA situace (Extra Vehicle Activity) – jde často o zdroj komplikací, většinou jde sice o důležité a praktické, nikoliv kritické problémy.
Prostředky UPV
Vybavení RSP obsahovalo dosud pneumatický ventilátor AUTOVENT 2000 (VT 400–1200 ml, df 8‑20/min s možností pouze řízeného (IMV), eventuálně s možností nouzově umožnit i spontánní dýchání mezi řízenými dechy, s tlakovým nebo časovým triggerem, s tlakovým limitem 60 cm H2O (překročení je akusticky signalizováno). PEEP ventil byl výrobcem sice nabízen, ale nebyl součástí RSP na ISS. Ventilátor nemá směšovač nebo kompresor a dodává pouze 100% směs. Nebyl nikdy prakticky použit. Byl primárně určen ke krátkodobé ventilaci < 12 hod a k delší ventilaci nebo k odvykání nebyl ani na Zemi nikdy zkoušen a registrován. Omezený příkon hnacího plynu neumožňuje použití k podpůrné ventilaci. Nebyl vybaven monitorem a jedinou možností monitorování je pulzní oxymetrie, zahrnutá v širší výbavě ISS.
Plán NASA na inovaci
NASA připravila různé scénáře evakuace z ISS: pro orbitální fázi, oddělení od ISS, vstup do atmosféry a přistání. Měla varianty jak pro spontánně dýchajícího pacienta s obličejovou maskou a plicní ventilovou mechanikou, tak i pro astronauty v bezvědomí na řízeném dýchání. Předpokládá se postupné snižování spotřeby kyslíku při stabilizaci stavu. Zásoby medicinálního kyslíku na ISS jsou maximálně na 60 h v 67 kg tanku (51 330 litrů). Celkové zásoby plynů na ISS jsou 2 kyslíkové tanky (po 99 kg) a 2 tanky s dusíkem (po 99 kg) – tabulka 2.
Tab. 2. Odhad spotřeby zásob kyslíku na ISS (podle NASA) 
*hmotnost v librách, přepočet na kg x 0,453 Pro evakuaci raketoplánem se počítá s maximální spotřebou kyslíku během 12 hod ze zásob RSP raketoplánu (28 lbm). V případě evakuace ruským modulem Sojuz není možné použít ventilátor s kyslíkovým pohonem a jedinou možnosti během evakuace by byla ventilace ručním dýchacím vakem ve velmi stísněných podmínkách (třímístný přistávací modul).
NASA se zabývala řešením nevyhovujícího technického zajištění a zvažovala:
- Možnost rozšířeného monitorování pacienta (vitální funkce, ETCO2, SpO2) s telemetrickým přenosem vitálních funkcí a parametrů ventilátoru (zpoždění jen 4–5 s) a s řízením na dálku ze Země operujícím lékařem, předávajícím zpětně pokyny posádce na palubu (mohou po 3–5 min upravovat parametry ventilátoru) a současně chystat návrat; problémem tohoto řešení jsou intermitentní výpadky spojení trvající až 30 min.
- Ventilátory na principu zpětnovazebného měření funkce ventilátoru – experimentálně/klinicky v běžných podmínkách vyzkoušeny různé systémy zpětnovazebné regulace výkonu ventilátoru podle ETCO2, SpO2.
- Ventilátory přizpůsobující výkon podle mechanických vlastností respiračního systému – dnešní ASV (produkty vývoje pro NASA) – eventuálně kombinace s volumetrickou kapnometrií a expertní (knowledge based) systémy.
V podmínkách evakuace z oběžné dráhy jsou nejperspektivnější systémy spoléhající na neinvazivní monitorování plicní mechaniky a ETCO2.
NASA doporučila následující fázovaný upgrade RSP
1. fáze: dovybavení ventilátoru
- směšovačem O2/N2 (časově limitované použití 100% jen pro intoxikace CO) – tabulka 3
- PEEP ventilem
- zvýšení zásob opioidů na ISS (z dřívějších 60 mg morfinu + 300 mg pethidinu pro léčbu popálených na prvních 24 hod na: 240 mg morfinu (10 mg po 4 hod) a 1200 mg pethidinu (50 mg po 4 h)
Tab. 3. Blending směsi O<sub>2</sub>/N<sub>2</sub> během letu v ISS 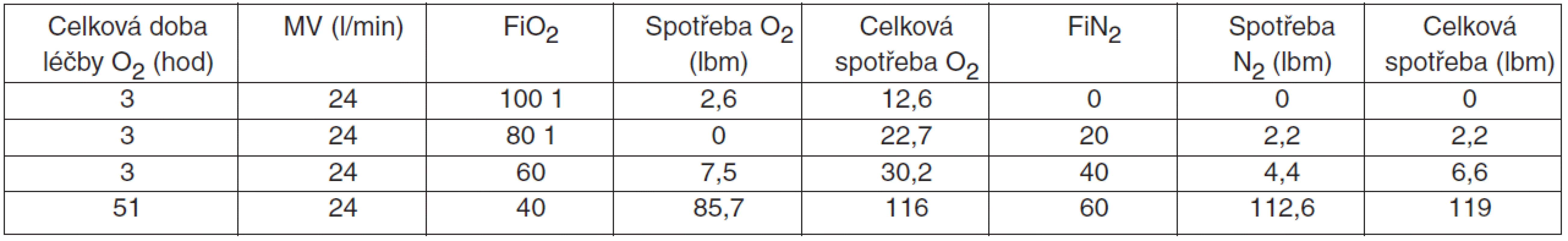
2. fáze: monitorování kapnometrie
3. fáze: ventilátor se zpětnovazebnou regulací
- kompaktní, jednoduchý, odolný
- pneumatický – elektrický pohon s kompresorem (zejména pro evakuaci Sojuzem)
- elektronická regulace
- variabilita režimů
5. Ultradlouhá umělá plicní ventilace – její indikace, výsledky a záludnosti
Drábková, J.
OCHRIP FN Motol, Praha
Akutní dechová nedostatečnost má zásadní protokol postupu zpracován. Selektivní indikace zahrnují oxygenoterapii, neinvazivní ventilaci, invazivní ventilaci – tracheální intubaci s rozvahou o tracheostomii. Snahou je pacienta odpojit; stanovit, zda má rezervu pro trvalé spontánní dýchání, zvážit přechod cestou neinvazivní ventilace; zda je PEFR dostatečný pro vykašlávání, pro převedení na FiO2 0,21 a zda je možno při kvalitním polykacím aktu a vykašlání extubovat, popř. zrušit tracheostomii.
Indikace: 10–15 % pacientů nesplní personalizovaný protokol v čase ± 21–28 dnů; 5 % pacientů je schopno jej splnit do více týdnů, přibližně 3 % nesplní základní kritéria trvale. Problémem se stávají ventilačně a respiračně rizikoví pacienti, opakované extubace a reintubace, nevyužívání přechodové neinvazivní ventilace, popř. pozdní tracheostomie, komplikace ventilátorovou pneumonií a chronickou nebo ventilátorovou produktivní bronchitidou a bronchospastickou složkou.
Diagnózy, vlastní soubor: U akutních pacientů vedou diagnózy ARDS, CAP, progrese CHOPN, náročná operativa, stavy po KPR, neurologická onemocnění, morbidní obezita, spinální a hrudní trauma atd.
K dlouhodobé ventilační podpoře jsou indikováni dospělí pacienti při neúspěšném odpojování a po něm při odeznění akutní dekondice stavu. Po více než 10leté zkušenosti OCHRIP FN Motol lze vycházet ze souboru: 623 přijatých pacientů; přežilo 533 pacientů (85,6 %), domů propuštěno 41 pacientů (7,7 %) se spontánním dýcháním, 8 pacientů s DUPV (1,5 %). Mortalita 14,4 % (90 pacientů); překlady do LDN, RHB zařízení, 45 pacientů s koncentrátory kyslíku. Délka ošetřovací doby je velmi různá, ani mediánem nelze vyjádřit průměr, je vysoce individuální vzhledem k polymorbiditě i ke komplikacím, zejména myopatii, sarkopenii, obezitě, CHOPN a chirurgickým komplikacím. Nejkratší pobyt na OCHRIP – úmrtí do 5 dnů – pokračující sepse, nejčastější odpojení do 4–6 týdnů; přibližný průměr 2–3 měsíce; nejdelší ošetřovací doba s ventilodependencí 9,5 roku po encefalitidě a chronické GB chorobě. Přežívání na DUPV v domácí intenzivní péči – víceleté i u seniorů s kvalitně stabilizovanou komorbiditou a klidným životním režimem bez osamělosti.
Ultradlouhá umělá ventilace se datuje od 50. let 20. století po epidemii poliomyelitidy, zejména ve Skandinávii. Byla zdůrazněna na konci 20. století ve snaze zajistit pacientům přiměřenou QoL v komunitním nebo i v domácím prostředí s transportními ventilátory. V téže době vznikly v USA „long--term facilities“ určené pro dlouho a velmi pozvolna odpojované, popř. pro trvale ventilodependentní pacienty. V roce 1998 bylo založeno první OCHRIP, v roce 2003 převzalo MZ ČR aktivity s DUPV pro dětské i pro dospělé pacienty, které bylo možno vrátit do rodin; do roku 2009 bylo schváleno přibližně 100 vhodných pro tuto péči.
Diagnózy, s nimiž jsou z akutních ARO/KAR/JIP lůžek dospělí pacienti na OCHRIP přijímáni, jsou v zásadě zmíněny výše: převažují dekompenzace chronických kardiopulmonálních chorob, stavy po náročných operacích polymorbidních pacientů, stavy po KPR s přetrvávající těžkou poruchou vědomí s trvající kardioventilační nestabilitou a s neupraveným vnitřním prostředím, progrese CHOPN, diagnózy nervosvalové sekundice a vysoké příčné míšní léze s nutností dechové podpory.
Rozdíly oproti akutním lůžkům: Pacient je veden jako subjekt, postupně bez analgosedace, často s úvodními anxiolytiky a antidepresivy, s léčbou základní diagnózy, pokud možno bez ATB. Oproti akutní fázi jsou častější komplikace: ventilátorová tracheobronchitida, nikoli VAP; MRSA kolonizace a infekce, vzácně GIT problémy s úvodní intoleranci enterální výživy a nálezem Clostridium difficile.
Neurologická symptomatologie se odvíjí od akutního stavu – motorické poruchy bazálních ganglií, kognitiví dysfunkce, výjimečně korová slepota. Přistupuje dlouhodobá sarkopenie, myopatie, syndrom spánkové apnoe centrálního typu, poruchy polykání, po dlouhodobé tracheostomii dyskinézy tracheální stěny. Tracheoezofageální píštěl se vyskytla u 2 pacientů. Pacienti s perzistujícím vegetativním syndromem, s minimálním vědomím mívají hyperventilační sympatomimetické unavující až vyčerpávající bouře, vyžadující specifické medikace.
Odpojování: K odpojování z umělé ventilace se využívají sofistikované ventilátory Servo I, SE 300, středně náročná skupina je ventilována SE 900 C, Galileo. Režimy nejčastěji PCV/PEEP, PSV, CPAP, vzácněji SIMV. Epizody tréninku jsou monitorovány, využívá se Ayre-T i mušle. Speciální pozornost se věnuje zvlhčování dýchacích cest; polykání, oxygenačnímu testu, PEFR, schopnosti odkašlat a vykašlat, mluvení s elektrolaryngem, s fonačními tracheostomickými kanylami, s reflexní dechovou rehabilitací, s vysazováním do křesla a vyjížděním na vozíku s transportním ventilátorem a O2 podle indikace.
Rozdíly v odpojování sledují: pohyby SpO2, EtCO2 při RHB, při spontánním dýchání v jeho úvodu a na jeho konci, tachykardizaci při spontánním dýchání, reakci – desaturaci, eventuálně bradykardizaci při odsávání, fibroskopické kontrole při dekanylaci. Při dysfunkci tracheální stěny se indikuje společně s pneumology Y-dynamický stent; je nevýhodou (typu difficult airway), je-li po ukončení UPV v budoucnosti nutné akutní invazivní zajištění dýchacích cest bez fibroskopické bronchoskopie.
Z akutních lůžek jsou přijímáni, bohužel, pacienti již s tracheostomiemi, takže přechod přes neinvazivní ventilaci po zrušení tracheostomie není nejen běžný, ale ani není pro pacienty vhodný.
Jsou neodpojitelní pacienti? Jaký výsledek možno očekávat?
- Zůstanou závislí na kyslíku – předepsán jeho vyvíječ – možno domů i do ZZ.
- Zůstanou závislí na kyslíku a tracheostomii: otázkou je zvlhčení, fonace, eventuálně PEG – možno domů i do ZZ.
- Zůstanou závislí na UPV; DUPV pouze do rodiny, ZZ typu ODIP, ODIOP, OCHRIP blíže bydliště rodiny.
- Zůstanou závislí na UPV (DUPV) + kyslík kromě transportního ventilátoru (ULTRA) je nutný individuálně koncentrátor/vyvíječ O2.
- Mají zaveden stent trachey – po epitelizaci – jako předchozí skupiny.
Propuštění pacienti mají usnadněné volání ZZS (projekt podobný hluchoněmým), kontroly na ambulanci OCHRIP, akutní zdravotní příhody cestou OUP dospělých FN Motol.
Neodpojitelní pacienti jsou výjimkou v zahraničí i v ČR; u dospělých se nejčastěji jedná o progresi CHOPN – GOLD III., popř. IV., neurologické choroby – chron. GB choroba, ALS, toxické polyradikulneuritidy, vysoké spinální léze traumatické, postradiační, stavy po KPR, dříve i myasthenia gravis.
Délka života a QALY je různá – při DUPV v rodině i u seniorů několik let. V dlouhodobé intenzivní péči se spontánní ventilací se udává celosvětově 42 let při permanentním vegetativním stavu od dětského věku (NEJM 1994 – SZO statistika), v ČR 11,5 roku. Odpojení od ventilátoru může trvat až 1 rok (UK – perzistentní/permanentní vegetativní stav – nezletilá).
Terminální odpojení je vnímáno velmi různě. OCHRIP FN Motol má v protokolu terminální analgosedaci při celkově neřešitelném stavu, daném základní diagnózou a krátkodobým výhledem přežití. Zastává komfortní péči a práci s rodinou. U dlouhodobých pacientů má emocionální vazba rodiny s častými návštěvami, s kontaktem zásadní význam. I ošetřující sestry získávají k pacientům více osobní vztah často vzdor jejich minimálnímu vědomí nebo encefalopatii.
Odlišnosti a výhled: Problematika a nároky dlouhodobé umělé ventilace a vedení celkového stavu pacienta se ve svých specifických nárocích odlišují od režimu akutních lůžek. Požadavek na dlouhodobou ventiloterapii a na dlouhodobou intenzivní péči bude ve společnostech s rozvinutým zdravotnictvím, s prodlouženým průměrným věkem, s komorbiditami dále narůstat, jak je zřejmé z pořadníků pro OCHRIP, ODIP, ODIOP. Je třeba dobudovat kontinuitu – v přejímání pacientů z akutních lůžek, v předávání pacientů do následné péče bez kritizovaného náhlého poklesu kvality, do komunitní medicíny, do rodin. Spolupráce s klinickými psychology, fyzio - a ergoterapeuty, s logopedy, s právníky i sociálními pracovníky, s intenzivně zaměřenou HomeCare péčí i s Komisí MZ ČR pro DUPV atd. je základem systému činností při ultradlouhé umělé ventilaci. Ta představuje nejen metodu, ale je propojena s mnohotvárným lidským subjektem a s jeho rodinou v životní krizi.
6. Domácí umělá plicní ventilace – šance pro pacienty trvale závislé na ventilátoru
Čadová, K.
Oddělení chronické resuscitační a intenzivní péče – OCHRIP Fakultní nemocnice v Motole, Praha
OCHRIP FN Motol pečuje o pacienty, kteří úspěšně překonali akutní kritický stav, ale nadále vyžadují dlouhodobou intenzivní péči včetně umělé plicní ventilace. Naším úkolem je tyto pacienty odpojit od ventilátoru, eventuálně zbavit je tracheostomické kanyly a předat je dále přes rehabilitační oddělení nebo příslušné standardní oddělení do domácí nebo sanatorní péče. Bohužel ne všechny pacienty se podaří odpojit od UPV. I přes pokroky vědy nadále zůstává malá část pacientů, kteří úspěšně překonají akutní fázi onemocnění, ventilodependentní. Základní diagnóza bývá nejčastěji pneumologická (CHOPN) či neurologická (neuromuskulární onemocnění, poranění krční míchy, stav po neuroinfekci atd.). Pacienti jsou při vědomí, oběhově kompenzováni a někteří jsou schopni i několik hodin denně dýchat spontánně. Dříve byli tito pacienti odkázáni na doživotní pobyt na ARO či JIP. Dnes se jim díky existenci moderních transportních dýchacích přístrojů, určených k domácí péči, otevírá možnost téměř „normálního života“ v rodinném prostředí. V roce 2003 byla ustanovena Komise MZ ČR pro provádění domácí umělé plicní ventilace. Komise přiděluje přístroje pro DUPV na základě žádosti, kterou podává po náležitém zvážení situace zdravotnické zařízení. DUPV indikuje ošetřující lékař, v našem případě anesteziolog, ale je samozřejmě nutné posouzení i odborníků těch oborů, kterým náleží základní diagnóza pacienta (pneumologie, neurologie,vnitřní lékařství). Součástí žádosti o DUPV je psychologické vyšetření pacienta a všech osob žijících ve společné domácnosti, zhodnocení sociální situace rodiny a léčebný a ošetřovatelský plán. Pokud Komise žádost schválí, je pacientovi přidělen ventilátor pro DUPV. Pacient má 28 dní na to, aby se na nový přístroj adaptoval a rodina se naučila přístroj obsluhovat. Osoba, která bude zodpovědná za laické ošetřování pacienta, musí absolvovat komplexní zaškolení v ošetřovatelské péči včetně péče o invaze a musí také zvládnout práci s přístroji. Zácvik na oddělení probíhá formou rooming-in. Na úhradě další techniky se spolupodílí zdravotní pojišťovna, pacient sám nebo s pomocí sponzorů. K nutném vybavení patří tepelný zvlhčovač, náhradní zdroj pro ventilátor, výkonná odsávačka, pulzní oxymetr, ambuvak s maskou. Imobilní pacienti mají nárok i na lůžko a vozík. Ventilátor standardně pracuje se vzduchem. Pacienti s plicním onemocněním potřebují navíc vyšší příkon kyslíku, což je vyřešeno buď instalací kyslíkového koncentrátoru, nebo zásobníkem kapalného kyslíku, které lze k ventilátoru jednoduše připojit. Ventilační režim a jeho parametry jsou na přístroji trvale nastaveny a uzamčeny. Nejčastěji se užívá režim PCV, VCV a PSV + PEEP. Pacient přechází do péče svého praktického lékaře, běžnou denní péči provádí zaškolený rodinný příslušník ve spolupráci s personálem agentury domácí intenzivní péče. V případě komplikací je pacient cestou urgentního příjmu směrován na příslušné oddělení (ARO, pneumologie, ORL). Záchranná služba i Oddělení urgentního příjmu jsou o pacientovi před jeho propuštěním do domácí péče informováni. Pacienti dojíždějí na ambulanci OCHRIP na pravidelné kontroly – cca 1krát měsíčně.
Za posledních 5 let připravil OCHRIP FN Motol 8 dospělých pacientů pro DUPV (3krát CHOPN, 2krát progresivní svalová dystrofie – m. Duchénne, 1krát neurofibromatóza – m. Recklingahusen, 2krát polyneuropatie). Věkové rozpětí pacientů je 20–70 let a doba pobytu doma je 2 měsíce až 5 let. V současnosti jsou v domácí péči 4 pacienti. V celkovém počtu pacientů na DUPV v České republice převažují neurologická onemocnění. Pacientů s plicním onemocněním je výrazně méně. Před překladem do domácí péče by pacienti měli být v optimální možné kondici, s minimem invazí a účelně zavedenou medikací, kterou rodina zvládne. Z ekonomického hlediska je DUPV levnější než pobyt na lůžku intenzívní péče – ARO/JIP. Čísla ale nejsou v tomto případě hlavním hlediskem. Pro pacienty je možnost léčby v domácím prostředí finančně nevyčíslitelná. Mohou strávit několik dalších let se svými blízkými ve známém prostředí. Kandidátů splňujících kritéria domácí péče přibývá a DUPV představuje jednu z mála pozitivních motivací pro život.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2010 Číslo 5- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- Rekombinantní aktivovaný faktor VII v léčbě závažného krvácení u nehemofiliků – „vyšetřování (s využitím klinických randomizovných studií) skončilo, zapomeňte?“
- Rekombinantní aktivovaný faktor VII (rFVIIa) v léčbě závažného poporodního krvácení – data z registru UniSeven v České republice
- Aktivovaný rekombinantní faktor VII u závažného krvácení při těžkém poranění jater – kazuistiky
- Efekt časného nasazení vysokofrekvenční oscilace v léčbě dětí s respiračním selháním
- Pacienti s pandemickou chřipkou A (H1N1) 2009 v intenzivní péči
- Spontánní porod během ECMO podpory zahájené pro ARDS u nemocné s H1N1 pneumonií – kazuistika
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- Konference a kongresy
- Výborová schůze ČSARIM
- ZPRÁVY ČSIM
- Za profesorem MUDr. Zdeňkem Kalendou
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- Rekombinantní aktivovaný faktor VII (rFVIIa) v léčbě závažného poporodního krvácení – data z registru UniSeven v České republice
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- Aktivovaný rekombinantní faktor VII u závažného krvácení při těžkém poranění jater – kazuistiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



