-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAktivovaný rekombinantní faktor VII u závažného krvácení při těžkém poranění jater – kazuistiky
Application of recombinant factor VIIa for refractory bleeding in patients with liver trauma – case reports
Surgical treatment is required in unstable trauma patients with liver damage and patients with grade IV–V liver trauma. The practice of damage control surgery has become widely accepted as a standard strategy in the management of these patients. A necessary part of the complex treatment must be the management of coagulopathy. Application of recombinant factor VIIa has shown to be effective when other modalities had failed.
Recombinant factor VIIa (rFVIIa ) treatment in patients with extensive liver damage is presented in three case reports. In the first one, the rFVIIa was administered for the treatment of coagulopathy when standard therapy had failed, in the second case to control refractory bleeding in liver trauma after performing peri-hepatic packing, and the last one in patients with progressive intra-parenchymal hepatic bleeding in whom surgical treatment had not been recommended. Questions remain about the optimal dosing of rFVIIa, the timing of treatment, administration of additional doses and the frequency of thrombo-embolic events.Keywords:
liver trauma – bleeding – coagulopathy – recombinant factor VIIa
Autoři: Mannová Hillová Jitka 1; Seidlová Dagmar 1; Mašek Michal 2; Zimová Iveta 1; Ševčík Pavel 1
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny FN Brno, Lékařská fakulta MU Brno 1; Klinika úrazové chirurgie FN Brno, Lékařská fakulta MU Brno, ČR 2
Vyšlo v časopise: Anest. intenziv. Med., 21, 2010, č. 5, s. 239-244
Kategorie: Intenzivní medicína - Kazuistika
Souhrn
Operační řešení jaterního traumatu je vyhrazeno pro pacienty s rozsáhlým poraněním jater (stupeň IV–V) nebo hemodynamicky nestabilní. Operační management je volen v rámci „damage control surgery“. Součástí komplexní léčby musí být adekvátní hemoterapie a léčba rozvíjející se koagulopatie. Aktivovaný rekombinantní faktor VII (rFVIIa) se ukázal být účinný v případě, že ostatní běžně používané postupy jsou vyčerpány nebo neúčinné.
Ve třech kazuistikách jsou prezentována těžká poranění jater s nutností podání rFVIIa k zástavě krvácení z jater. Rekombinantní faktor VIIa byl podáván u rozvíjející se těžké koagulopatie, u pokračujícího difuzního krvácení z jater po chirurgické perihepatické tamponádě rouškami a u chirurgicky obtížně řešitelné ruptury jater s progresí intraparenchymových hematomů. Stále diskutovanými otázkami zůstává stanovení optimálního dávkování rFVIIa, doby a frekvence podání rFVIIa a míra trombembolického rizika po jeho podání u pacientů s polytraumatem.Klíčová slova:
poranění jater – krvácení – koagulopatie – aktivovaný rekombinantní faktor VIIÚvod
První zmínky o úspěšném ošetření jaterního poranění pocházejí ze 17. století, ale až ve 20. století bylo dosaženo lepších výsledků při chirurgickém řešení jaterního traumatu. Během I. světové války byla preferována operační tamponáda rouškami, která s sebou přinášela velký počet infekčních komplikací, proto ve II. světové válce byla upřednostněna resekce jater. K návratu používání perihepatické tamponády došlo opět v poválečném období. V následujících desetiletích začal být nově prosazován konzervativní postup řešení jaterního traumatu u stabilních pacientů. Díky propracování operačních postupů, novým metodám a četným zkušenostem se během 20. století podařilo dosáhnout významného poklesu mortality z 66 % udávaných v první polovině století až k 10–15 % v současné době [1].
V současnosti se pro stanovení závažnosti jaterního traumatu používá „Hepatic Injury Scale“, vytvořené Americkou traumatologickou společností (AAST: revize 1994), rozlišující I.–VI. stupeň závažnosti jaterního poranění [1–3]. Konzervativní postup je preferován u hemodynamicky stabilních pacientů s menším rozsahem poranění (stupeň I–III). Naopak operační řešení je vyhrazeno pro nestabilní pacienty anebo s rozsáhlým poraněním jater (stupeň IV–V) [4]. Operační management je volen v rámci „damage control surgery“. Součástí komplexní léčby musí být adekvátní hemoterapie a léčba rozvíjející se koagulopatie. Aktivovaný rekombinantní faktor VII (rFVIIa) je efektivní v případě, že ostatní běžně používané postupy jsou vyčerpány nebo neúčinné [1].
Výsledky
V letech 2006–2008 bylo přijato na KARIM FN Brno 34 polytraumatizovaných pacientů s poraněním jater. U 17 pacientů se jednalo o poranění klasifikované jako lehké (I. a II. stupně), řešené konzervativně. Dalších 17 nemocných mělo závažné poranění jater III.–V. stupně vyžadující operační revizi se suturou jater. U 5 nemocných byla nezbytná tamponáda rouškami, u 1 nemocného byla použita k zástavě krvácení nová metoda: vicryl mesh – vstřebatelná síťka. Čtyři pacienti z celkového počtu 34 zemřeli v prvních 24 hodinách (mortalita: 11,7%), u všech byla perioperačně zjištěna rozsáhlá ruptura jater, v jednom případě kombinovaná s poraněním sestupné aorty. U třech nemocných, popsaných v následujících kazuistikách, bylo nezbytné k zástavě krvácení z jater podat rFVIIa (tab. 1).
Kazuistika 1
Poranění jater se závažnou koagulopatií
Pacient (27 let) havaroval jako řidič osobního automobilu. Byl přijat na urgentní příjem KARIM FN Brno, kde u něho bylo diagnostikováno rozsáhlé hemoperitoneum, subarachnoidální krvácení, hemotorax a pneumotorax vpravo, zlomenina 4.–6. žebra vpravo a zlomenina horního raménka stydké kosti. Vzhledem k nálezu krvácení do dutiny břišní a rozvíjejícímu se hemoragickému šoku byl převezen na operační sál, kde byla zjištěna ruptura jater, dilacerace lig. hepatoduodenale s arteriálním krvácením, léze portální žíly. Krvácení z jater bylo stavěno suturou a perihepatickou tamponádou rouškami. Perioperační krevní ztráta, odhadovaná na více než 6000 ml, byla hrazena 18 erytrocytárními koncentráty (EBR) a 20 jednotkami čerstvě zmrazené plazmy (CZP). Na operačním sále byl vyšetřen krevní obraz a koagulační časy (tab. 2). Vzhledem ke zjištěnému poklesu počtu trombocytů (50 . 109 . l-1) a hladiny fibrinogenu (0,8 g . l-1) byl podán 1 trombokoncentrát (TK) a 1 g fibrinogenu. Při současně diagnostikované metabolické acidóze (ABR: pH 7,12; paCO2 6,2 kPa; paO2 12,5 kPa; HCO3-1 14,6 mmol . l-1; BE -14,6 mmol . l-1) bylo indikováno podání bikarbonátu (NaHCO3 8,4 %, 80 ml). Krvácení z jater i po chirurgickém ošetření na operačním sále dále pokračovalo, proto vzhledem k zjištěnému závažnému prodloužení koagulačních časů byl podán rFVIIa (NovoSeven®) v celkové dávce 10,2 mg, tj. 100 μg . kg-1. Po podání NovoSeven® ale došlo pouze k mírné úpravě koagulopatie (tab. 2) a po předání pacienta na KARIM pokračovalo krvácení z jater. Byly indikovány další transfuzní přípravky a krevní deriváty v celkovém množství 10 EBR, 12 CZP, 1 TK. Po šesti hodinách musela být opakována druhá dávka NovoSeven® 10,2 mg (100 μg . kg-1), po které již došlo k zástavě krvácení a korekci hodnot koagulace. Při operační revizi za 48 hodin byla dutina břišní bez známek krvácení, roušky mohly být vytaženy a v následujících dnech bylo postupně zahájeno úspěšné odpojování od ventilátoru. Poúrazová elevace jaterních transamináz dosáhla maxima třetího dne (ALT 34,05 μkat . l-1; AST 28,05 μkat . l-1) s následujícím poklesem až úplnou úpravou jaterních testů při propuštění. Vzhledem k ostatním poraněním byl pacient celkově hospitalizován na KARIM 22 dnů. Během hospitalizace nebyly zaznamenány žádné trombembolické komplikace.
Tab. 2. Poranění jater se závažnou koagulopatií: hodnoty krevního obrazu a parametrů koagulace 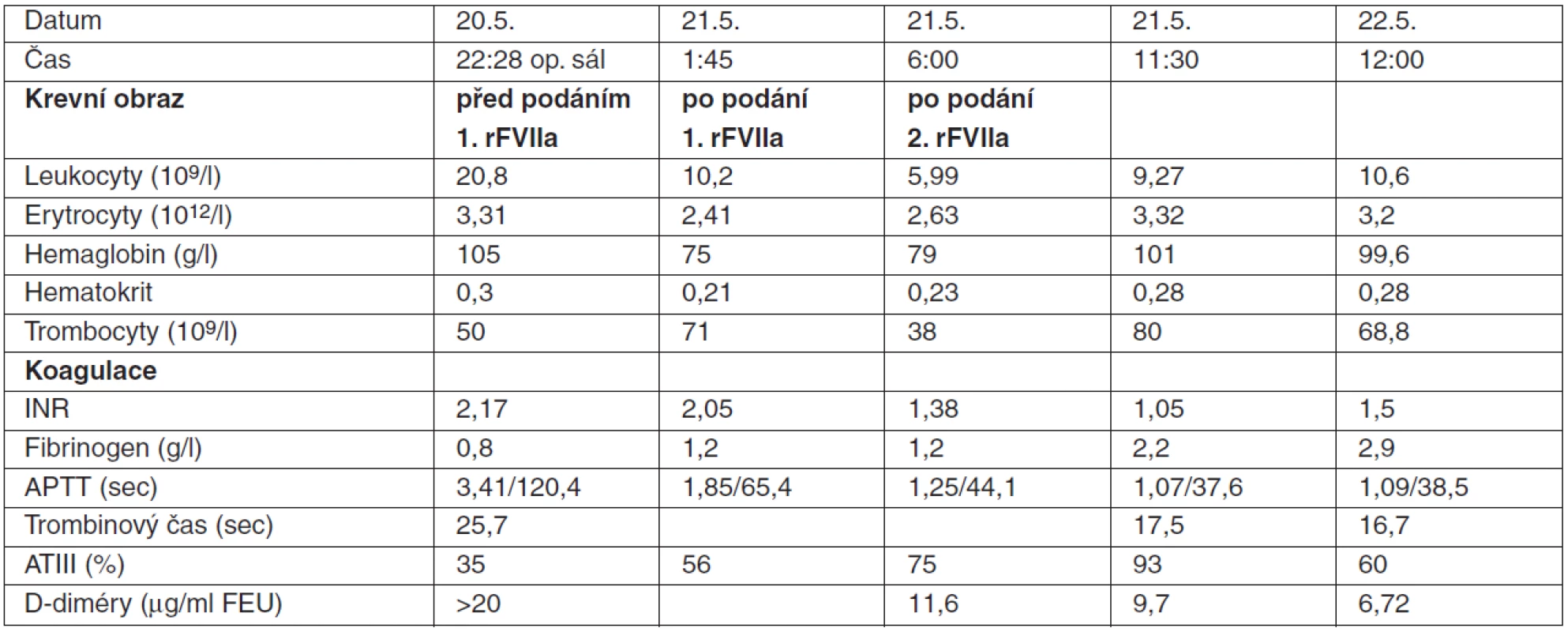
Kazuistika 2
Poranění jater s difuzním jaterním krvácením
Nemocný (41 let) havaroval na motorce. Po úrazu odešel domů, ale za dvě hodiny byl přivezen na ambulanci Kliniky úrazové chirurgie FNBrno. Pro rozvíjející se šokový stav musel být předán na urgentní příjem, kde bylo diagnostikováno hemoperitoneum. Na operačním sále při revizi dutiny břišní byla zjištěna ruptura jater s masivním krvácením z jaterní žíly, které bylo ošetřeno opichem s následnou opakovanou tamponádou dutiny břišní rouškami. Celková krevní ztráta byla hrazena podáním 12 EBR a 10 jednotek CZP. Opakované laboratorní odběry na operačním sále svědčily o úspěšnosti hemoterapie (tab. 3). V operačním poli ale pokračovalo difuzní krvácení ze zhmožděné jaterní tkáně. Proto bylo k zástavě krvácení indikováno podání NovoSeven® v celkové dávce 8,4 mg (100 μg . kg-1). Ještě před jeho podáním bylo provedeno vyšetření ABR (pH 7,41; paCO2 5,4 kPa; paO2 28 kPa ; HCO3- 25,3 mmol . l-1 ; BE 1,9 mmol . l-1) bez zjištění poruchy acidobazické rovnováhy.
Tab. 3. Poranění jater s difuzním krvácením: hodnoty krevního obrazu a parametrů koagulace 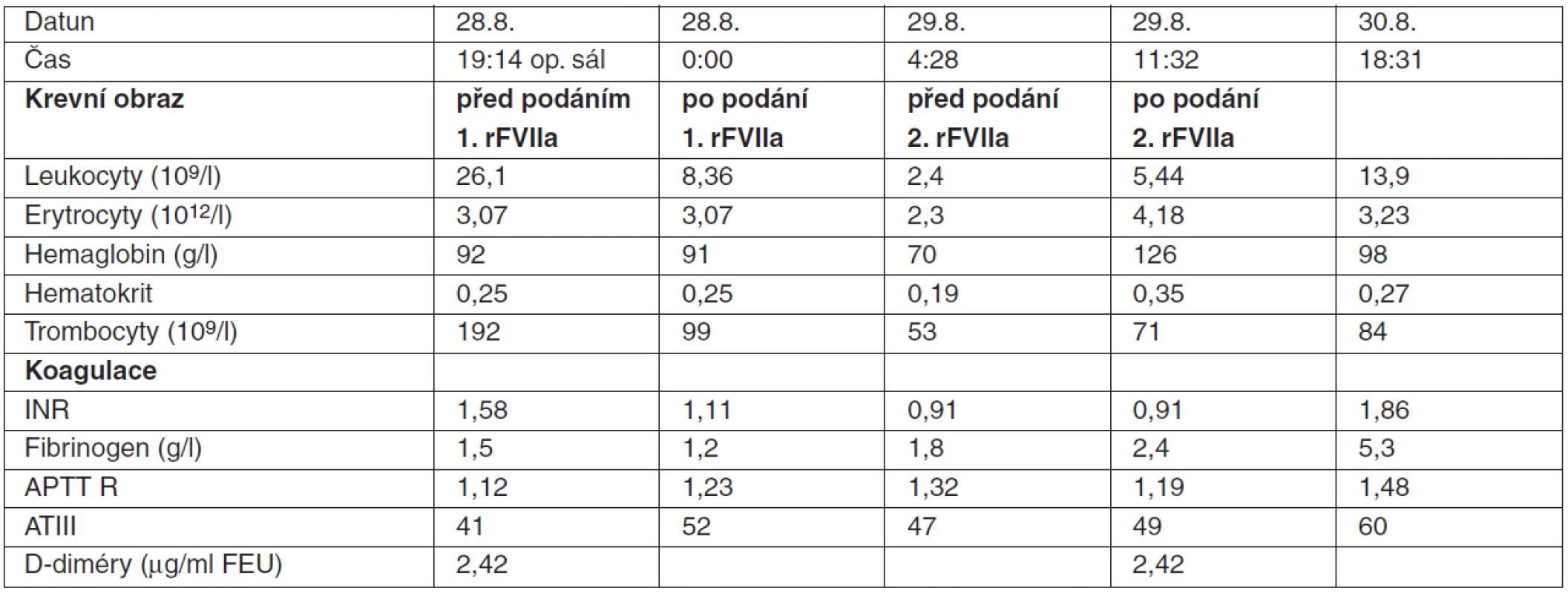
Po skončení operace byl pacient předán na KARIM s ponechanou tamponádou rouškami v dutině břišní. Během následujících 8 hodin pokračovalo krvácení do drénů (1700 ml) a musely být podány další transfuzní přípravky a krevní deriváty (4 EBR, 4 CZP, 1 TK). Za 7 hodin po operaci byla opakována druhá dávka NovoSeven® 8,4 mg (100 μg . kg-1) a po její aplikaci již krvácení z jater plně ustalo. První pooperační den při vyšetření tromboelastografie (TEG) byl zjištěn hyperkoagulační stav, a proto bylo indikováno podání 1 500 jednotek antitrombinu a kontinuální podávání nízkomolekulárního heparinu (1250 j/24 hod). Během operační revize za 48 hod byla dutina břišní již bez známek krvácení a roušky z dutiny břišní mohly být vytaženy. Pacient byl propuštěn z intenzivní péče 14. den. Během hospitalizace nebyly zaznamenány žádné trombembolické komplikace.
Kazuistika 3
Poranění jater s rozsáhlými intraparenchymovými hematomy
Nemocný (21 let) havaroval na motocyklu. Při vyšetření nemocného na urgentním příjmu bylo diagnostikováno rozsáhlé poranění jaterního parenchymu, subarachnoidální krvácení, zlomenina baze lební, lícní kosti a horní čelisti vlevo. Během následujícího vyšetření na CT byla zjištěna rozsáhlá lacerace jater táhnoucí se od hilu pravým lalokem kraniálně k bránici, jaterním parenchymem procházející vícečetné ruptury v okolí cévních struktur portální žíly, dolní duté a jaterní žíly. Při operační revizi bylo nalezeno celistvé jaterní pouzdro, klidný jaterní hilus s pulzací a pouze drobná trhlina na konvexitě pravého laloku. Vzhledem k perioperačnímu nálezu byl zvolen konzervativní postup ošetření jaterního poranění a pacient předán na KARIM. První pooperační den byla na kontrolním CT zjištěna progrese intraparenchymových hematomů. Z chirurgického hlediska nebyla indikována operační revize. Nejen pro pokračující krvácení do jaterního parenchymu, ale i ke korekci koagulopatie (tab. 4) bylo indikováno podáním rFVIIa v jedné dávce 7,2 mg (90 μg . kg-1). Před aplikací NovoSeven® bylo celkem podáno: 7 EBR, 6 CZP, 1 TK a 1 g fibrinogenu a vyšetřena ABR (pH 7,41; PaCO2 5,1 kPa ; PaO2 26 kPa; HCO3- 24,1 mmol . l-1; BE -0,2 mmol . l-1) bez zjištění metabolické acidózy. Po aplikaci rFVIIa došlo k úplné zástavě krvácení do jater a nebyly již indikovány žádné další krevní deriváty a transfuzní přípravky. Přechodná elevace jaterních enzymů dosáhla maxima druhý pooperační den (ALT 8,93 μkat . l-1; AST 7,45 μkat . l-1). Během hospitalizace nebyly zaznamenány žádné trombembolické komplikace a pacient byl propuštěn z intenzivní péče 11. den.
Tab. 4. Poranění jater s rozsáhlými intraparenchymovými hematomy: hodnoty krevního obazu a parametrů koagulace 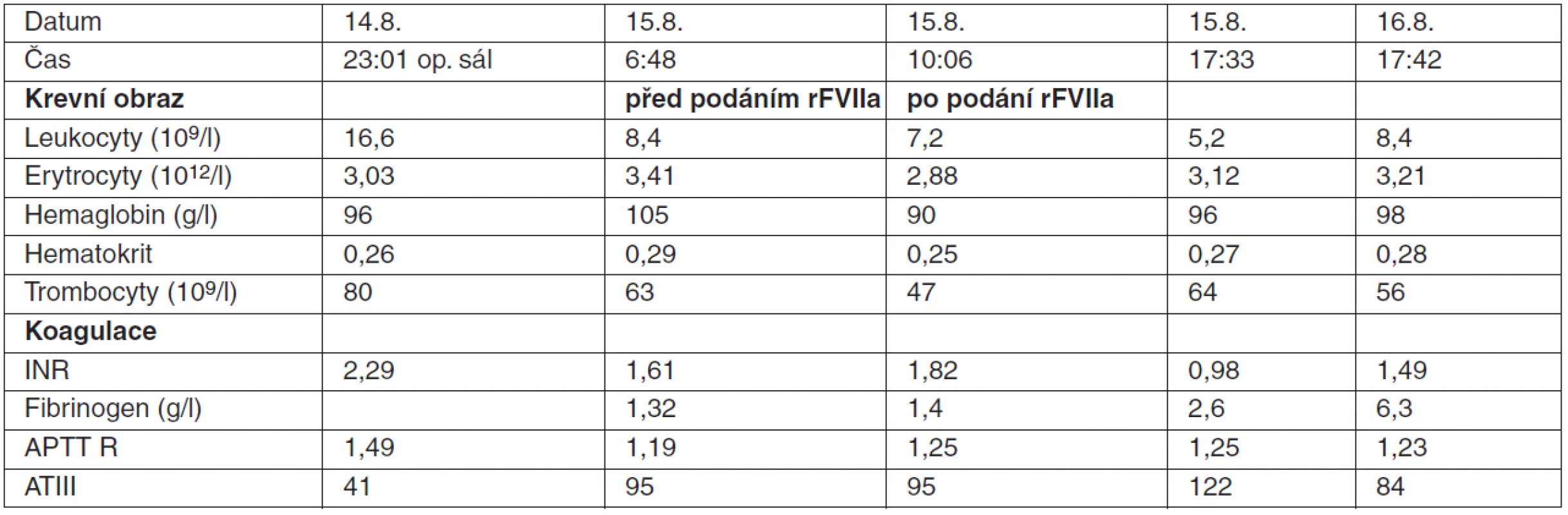
Diskuse
V případě život ohrožujícího krvácení (ŽOK) je na prvním místě dosažení chirurgické kontroly krvácení, korekce hypotermie a acidózy a ostatních parametrů systémové hemostázy. Podpora koagulace je jednou ze základních součástí komplexní terapie. Kromě hrazení krevní ztráty erytrocytárními koncentráty a čerstvě zmrazenou plazmou je často indikováno i podání fibrinogenu a destičkového koncentrátu. Při selhání standardních postupů nebo při jejich nedostatečné účinnosti je možné zvážit podání aktivovaného rekombinantního faktoru VII.
Závažné poranění jater bývá často spojeno s rozsáhlým krvácením a může dojít i k rozvoji závažné koagulační poruchy, a to v důsledku samotného mechanického poranění jater nebo v kombinaci s rozsáhlým krvácením a přidruženou hypotermií a acidózou. Aktivovaný rekombinantní faktor VII se ukázal účinný u pacientů s koagulopatií u tupých i penetrujících poranění [5]. Traumacentra v USA rutinně používají rFVIIa u těžké koagulopatie pacientů s traumatem.
Indikací k podání rekombinantního faktoru VIIa může být i těžko stavitelné krvácení z jater bez závažného prodloužení koagulačních časů. Otázkou zůstává uplatnění rFVIIa v rámci konzervativního postupu u zvětšujících se intraparenchymových hematomů. Ve všech těchto indikacích byl podáván rFVIIa u našich pacientů. Vyjádření k terapii tímto přípravkem je sice součástí národních multioborových doporučení ke kontrole ŽOK, přesto je používání rekombinantního faktoru VIIa mimo registrované hematologické diagnózy považováno za podání off-label. Avšak u pacientů s polytraumatem již byla publikována řada prací dokládajících jeho úspěšné užití u nehemofilických pacientů. V mnoha kazuistikách byla demonstrována velmi dobrá odpověď na podání rFVIIa u tupých i penetrujících poranění s masivním krácením pokračujícím navzdory agresivní hemoterapii [6, 7]. V souhrnné práci o použití rFVIIa u traumatizovaných a chirurgických pacientů je popsáno celkem 117 případů podání rFVIIa [8]. Obnovy účinné hemostázy se podařilo dosáhnout u 85 % (99 ze 117) pacientů. Přežití u nemocných s účinným podáním rFVIIa bylo 77% (76 z 99), v případě úmrtí byla příčinnou sepse nebo MOF. Všichni pacienti, u kterých bylo podání rFVIIa neúčinné, zemřeli v důsledku nezastavitelného krvácení.
Účinné hemostázy a zástavy krvácení bylo dosaženo i u našich pacientů, v prvních dvou případech byl rFVIIa podáván opakovaně ve dvou dávkách, u třetího pacienta byla postačující jedna aplikace rFVIIa. Jak je dokumentováno v tabulce 1, po podání rFVIIa našim pacientům došlo k poklesu počtu spotřebovaných transfuzních přípravků a krevních derivátů. Podobné výsledky jsou prezentovány ve zmíněné práci autorů Barletta et al. [7], kde po podání rFVIIa došlo k poklesu počtu potřebných transfuzních přípravků a krevních derivátů, stejně jako k úpravě koagulopatie. U 117 prezentovaných nemocných pokleslo průměrné množství podaných EBR z 37 ± 26 jednotek před podáním rFVIIa na 2 ±1,5 po aplikaci rFVIIa [8].
Aktuální otázkou stále zůstává volba správného dávkování rFVIIa. V citované souhrnné práci bylo průměrné podávané množství rFVIIa 81 ± 32 μg . kg-1, rozpětí dávky se pohybovalo od 20 do 144 μg . kg-1. Odpověď na podání rFVIIa byla zaznamenána i u dávek nižších než 70 μg . kg-1, kvalitnějšího účinku však bylo dosaženo při podání 70–90 μg . kg-1. Většina nemocných dostala pouze jednu dávku rFVIIa, adekvátní hemostázy bylo možné dosáhnout v průběhu 15–20 minut. Pokud ke zlepšení nedošlo, bylo možné podání opakovat [8]. Avšak v jiné práci z poslední doby je na základě farmakokinetické analýzy navrhována jako klinicky efektivní hemostatická terapie u traumatizovných pacientů se ŽOK mnohem vyšší dávka rVIIa [9]. Toto vyšší dávkování je zdůvodňováno poměrně vysokou individuální variabilitou v distribuci a clearance rFVIIa u nemocných se závažným krvácením při poranění. Navrhované úvodní množství rFVIIa by mělo být 200 μg . kg-1, popř. následované za 1–3 hodiny další dávkou 100 μg . kg-1. Aplikované dávky rFVII našim třem pacientům byly v rozmezí 90–100 μg . kg-1. Jedná se o dávkování rFVIIa shodné s citovaným článkem, ale na základě současných informací by mohly být dávky u polytraumatizovaných nemocných se závažným krvácením i vyšší – 200 μg . kg-1.
Další otázkou je, kdy indikovat podání rFVIIa. V případě našich nemocných byl podáván rFVIIa po 240, 360 a 660 minutách. Pacientům bylo do té doby aplikováno 13–38 transfuzních jednotek (EBR + CZP). Je známo, že lepšího přežití je dosahováno při časnějším podání rFVIIa. To je opět dokladováno v práci Barletta et al. [7], kdy u 19 nemocných byl rFVIIa podán po méně než 40 transfuzních jednotkách a účinné hemostázy bylo dosaženo u většiny – 18 nemocných (95 %), přežilo 17 (89 %). Zatímco u dalších 11 pacientů, kdy byl rFVIIa indikován až po více než 40 TU, u 8 (73 %) nemocných došlo k zástavě krvácení, ale jen 5 (45 %) přežilo (p < 0,05). Jak je dokumentováno i v této práci, rozhodnutí o podání rFVIIa je vždy balancováním mezi správným určením doby, kdy je již adekvátní hemoterapie vyčerpána a kdy ještě může být podání rFVIIa dostatečně účinné. Každopádně současný trend směřuje k dřívějšímu podání účinné dávky rFVIIa.
V případě krvácejících nemocných s polytraumatem je také třeba vždy počítat s dalšími faktory, které mohou ovlivnit úspěšnost podání rFVIIa. Pokud jde o efektivitu rFVIIa při acidóze a hypotermii, bylo zjištěno, že při poklesu teploty a pH je zhoršena jeho účinnost [10]. U našich třech nemocných bylo vždy provedeno vyšetření ABR ještě před podáním rFVIIa a při zjištění metabolické acidózy byl podán bikarbonát. Domníváme se, že snaha o korekci pH před aplikací rFVIIa je racionálním doporučením. Vhodné je i kontrolovat tělesnou teplotu a její udržení nad 33 °C. Tělesná teplota byla u našich pacientů měřena na urgentním příjmu při přijetí. U prvních dvou nemocných byla první dávka rFVIIa podávána na operačním sále a v době podání rFVIIa nebyla tělesná teplota změřena. Pokud byl rFVIIa podáván na KARIM, u všech tří pacientů bylo dosaženo normotermie.
Významným sledovaným parametrem při podání rFVIIa je frekvence trombembolických komplikací, a tedy bezpečnost jeho podání. U našich pacientů nebyly zaznamenány trombembolické komplikace. Obecně je zjišťována jen malá frekvence výskytu TEN po podání rFVIIa [11]. Ve studii, kde byl rFVIIa aplikován celkem 6 500 pacientům (hemofilici i nonhemofilici), bylo zaznamenáno pouze 17 případů trombembolických komplikací [12]. Poměrně dobrá bezpečnost rFVIIa je zdůvodňována působením v místě poranění, což je dáno dvěma mechanismy. Faktor VII není biologicky aktivní, pokud se nenaváže na tkáňový faktor (TF), který je dostupný v místě poranění. Rekombinantní FVIIa může působit i nezávisle na TF přímým zvýšením produkce trombinu na destičkách prostřednictvím faktoru X, ale opět je jeho funkce vázána na aktivované destičky v místě poranění. Pokud se trombotické komplikace po podání rFVIIa objevují, je to častěji u starších nemocných (nad 70 let) se závažnější formou aterosklerózy v anamnéze a s přidruženými komplikacemi, např. se sepsí. Podání rFVIIa v časné fázi u traumatizovaných pacientů se závažným krvácením se tedy zdá být z hlediska výskytu TEN celkem bezpečné.
Závěr
Ve třech kazuistikách je demonstrováno podání aktivovaného rekombinantního faktoru VII u závažného poranění jater. V prvních dvou případech bylo podávání rFVIIa zahájeno na operačním sále. V první kazuistice byl rFVIIa indikován u závažného krvácení z jater u rozvíjející se těžké poruchy koagulace. Ve druhém případě byl rFVIIa aplikován u rozsáhlého jaterního poranění po chirurgickém ošetření s použitím perihepatické tamponády rouškami a s pokračujícím difuzním krvácením z jaterní tkáně. Ve třetí kazuistice byl rFVIIa indikován v rámci konzervativního postupu u jaterního traumatu, u chirurgicky obtížně ošetřitelné ruptury jater s progresí intraparenchymových hematomů.
Došlo dne 11. 12. 2009.
Přijato dne 6. 7. 2010.
Adresa pro korespondenci:
MUDr. Jitka Mannová Hillová
KARIM FN Brno
Jihlavská 20
602 00 Brno
e-mail: j.mann@seznam.cz
Zdroje
1. Ahmed, I., Beckingham, I. J. Liver trauma. Trauma, 2007, 9, p. 171–180.
2. Feliciano, D. V. Surgery for Liver Trauma. Surgical clinics of North America, 1989, 69, p. 273–284.
3. Reed, R. L., Merrell, R. C., Meyers, W. C. Continuing Evolution in the Approach to Severe Liver Trauma. Ann Surg., 1992, p. 216, 524–538.
4. Parks, R. W., Chrysos, E., Diamond, T. Management of liver trauma. BJS, 1999, 86, p. 1121–1135.
5. Holcomb, J. B. Use of Recombinant Activated Factor VII to Treat the Acquired Coagulopathy of Trauma. J. Trauma, 2005, 58, p. 1298–1303.
6. Uhlmann, E. J., Eby, CH. S. Recombinant activated factor VII for non-hemophiliac bleeding patients. Current Opinion in Hematology, 2004, 11, p. 198–204.
7. Haas, T. et al. Successful Reversal of Deleterious Coagulopathy by Recombinant Factor VIIa. Anesth. Analg., 2005, 100, p. 54–58.
8. Barletta, J. F., Ahrens, CH. L., Tyburski, J., Wilson, R. F. A Review of Recombinant Factor VII for Refractory Bleeding in Nonhemophilic Trauma Patients. The Journal of Trauma Injury, Infection and Critical Care, 2005, 58, p. 646–651.
9. Klitgaard, T., Palacios, R. T., Boffard, K. D. et al. Pharmacokinetics of recombinant activated factor VII in trauma patients with severe bleeding. Critical Care, 2006, 10.
10. Gasperi, A. D. Intraoperative use of recombinant activated factor VII (rFVIIa). Minerva Anestesiol., 2006, 72, p. 489–494.
11. Pépion, C., Becq, M. CH., Jacob L. Deep Vein Thrombosis after Recombinant Factor VIIa Infusion to Control Severe Recurrent Postoperative Bleeding. Anesthesiology, 2006, 104, p. 892–893.
12. Roberts, H. R. Recombinant factor VIIa (Novoseven) and the safety of treatment. Semin. Hematol., 2001, 38, p. 48–50.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2010 Číslo 5- Jak souvisí postcovidový syndrom s poškozením mozku?
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Rekombinantní aktivovaný faktor VII v léčbě závažného krvácení u nehemofiliků – „vyšetřování (s využitím klinických randomizovných studií) skončilo, zapomeňte?“
- Rekombinantní aktivovaný faktor VII (rFVIIa) v léčbě závažného poporodního krvácení – data z registru UniSeven v České republice
- Aktivovaný rekombinantní faktor VII u závažného krvácení při těžkém poranění jater – kazuistiky
- Efekt časného nasazení vysokofrekvenční oscilace v léčbě dětí s respiračním selháním
- Pacienti s pandemickou chřipkou A (H1N1) 2009 v intenzivní péči
- Spontánní porod během ECMO podpory zahájené pro ARDS u nemocné s H1N1 pneumonií – kazuistika
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- Konference a kongresy
- Výborová schůze ČSARIM
- ZPRÁVY ČSIM
- Za profesorem MUDr. Zdeňkem Kalendou
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- Rekombinantní aktivovaný faktor VII (rFVIIa) v léčbě závažného poporodního krvácení – data z registru UniSeven v České republice
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- Aktivovaný rekombinantní faktor VII u závažného krvácení při těžkém poranění jater – kazuistiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání