-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
Vyšlo v časopise: Anest. intenziv. Med., 21, 2010, č. 5, s. 275-281
II. PNEUMONIE NA JIP
1. Prevence ventilátorové pneumonie – vybrané postupy
Pařízková R.
Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové
Úvod
Nozokomiální pneumonie ventilovaných nemocných – ventilator associated pneumonia (VAP) je přes vývoj a zdokonalování technik v intenzivní péči nejčastějším typem nozokomiálních infekcí u nemocných s nutností ventilační podpory, který je spojen se zvýšením morbidity, mortality a hospitalizačních nákladů. Prevence, diagnostika, časná a cílená antibiotická terapie jsou základní součásti péče o nemocné s nozokomiálními infekcemi. Cílem práce je poskytnutí přehledu možností v oblasti prevence této komplikace.
Opatření vedoucí k prevenci a snížení incidence VAP
- Prevence tracheobronchiální kolonizace
- Prevence aspirace
- Zvýšení obranyschopnosti organismu
V odborné literatuře byla publikována řada prací, které prokázaly vliv některých preventivních jednoduchých opatření v obecné ošetřovatelské péči na výskyt VAP. Na základě těchto poznatků byla vydávána doporučení ve formě speciálních preventivních balíčků, jejichž důsledným uplatněním v praxi došlo ke snížení incidence VAP. Součástí těchto programů byla edukace ošetřujícího personálu a zavedení do praxe jednotlivých postupů, kde jejich dodržováním došlo ke snížení výskytu VAP o 30–55 %.
Preventivní postupy VAP
K prokázaným preventivním postupům patří:
- Zvýšena poloha nemocného do 30–45 stupňů
- Lokální ústní hygiena 1–2% chlorhexidinem několikrát denně
- Přerušování sedace a denní přehodnocování nutnosti ventilační podpory a zajištění dýchacích cest (tzv. protokolizovaná sedace)
- Kontinuální drenáž ze subglotického prostoru
- Ostatní – profylaxe hluboké žilní trombózy, profylaxe stresového krvácení, kontrola glykémie, mytí rukou, ústní hygiena, časná mobilizace, orogastrické zavedení žaludeční sondy
Význam biofilmu
V patogenezi vzniku VAP se hlavní měrou uplatňuje přítomnost tracheální rourky těmito mechanismy:
- Snížení kašlacího reflexu
- Redukce mukociliárního transportu
- Poranění tracheálního epiteliálního povrchu
Dochází k přímému vlivu na rychlý přestup bakterií z horních do dolních dýchacích cest umožňující tvorbu tzv. „biofilmu“ na povrchu tracheální rourky. Rychlé přerůstání bakterií z GIT v oblasti faryngu, rezervoáry bakterií v sinusech a akumulace sekretu v subglotickém prostoru vedoucí k mikroaspiracím je považováno za vedoucí příčinu kolonizace dýchacích cest a VAP. Tvorba biofilmu záhy po extubaci na povrchu tracheální rourky vede k rezervoáru infekčního agens. Jedná se o strukturovanou komunitu bakterií, které jsou uzavřeny do vlastní polymerické matrix a adherují k cizím povrchům. Jsou tak současně chráněny vůči účinkům antibiotik vytvářením protektivního glykokalyx a biofilm se vyskytuje s maximem na vnitřní třetině rourky.
Snahou preventivních opatření je snížení rizika poranění dýchacích cest, snížení tvorby biofilmu a minimalizace mikroaspirace infikovaného obsahu ze subglotického prostoru do dolních cest dýchacích.
Protektivní mechanismy
- Automatická kontrola tlaku v manžetě rourky
- Aspirace sekretu ze subglotického prostoru
- Dekontaminace subglotického prostoru
- Důsledné užívání antiseptických impregnovaných tracheálních rourek
- Eliminace a prevence vzniku biofilmu
Manipulace s tracheální rourkou (nechtěná extubace s nutností reintubace) vede ke zvýšení incidence VAP [Lassence 2002]. Ke snížení rizika mikroaspirace byly do klinické praxe zavedeny tracheální rourky a tracheostomické kanyly s vysokoobjemovými a nízkotlakými manžetami, nyní i s novými materiály (polyuretan), novým cylindrickým tvarem manžety s ultratenkou stěnou. Provedené studie prokazují sníženou incidenci časné i pozdní VAP, nicméně současně je u těchto rourek umožněno odsávání ze subglotického prostoru a není jasné, která z těchto metod se na snížení incidence více podílí [Dulenkopf 2003]. Trvalé udržování tlaku v manžetě na 20 cm H2O je spojeno se snížením incidence VAP [Rello 1996] aspirace. Současně trvalé odsávání sekretu ze subglotického prostoru je spojeno se nížením výskytu VAP a je doporučeno u nemocných s předpokladem tracheální intubace více než 72 hodin [Dragoumanis 2007], je nutné zvážit riziko poškození sliznice trachey při trvalém podtlaku. Hygiena dutiny ústní chlorhexidinem je spojena s nižší incidencí VAP, naopak zavedení selektivní dekontaminace GIT neprokazuje význam a rutinně není doporučena.
Prevence tvorby biofilmu
- Dekontaminace tracheální rourky pomocí SDD je účinná proti gramnegativním mikrobům, nikoliv grampozitivním kokům a Pseudomonas aeruginosa – popisován významný vliv inhalačně podávaného gentamicinu, který vytváří vysoké koncentrace na stěně rourky.
- Antiseptické impregnované rourky (stříbro, Ag sulfadiazin s chlorhexidinem na polyuretanové rource, stříbrem a chlorhexidinem impregnovaná rourka, gencianová violeť a chlorhexidin) – signifikantní snížení tvorby biofilmu.
- Synchronizovaná aspirace sputa z distálního konce tracheální rourky – nové speciální rourky s mnohočetnými sacími otvory, synchronizace sání se změnami tlaku generovaného ventilátorem.
Neinvazivní ventilace, respektive absence zavedení tracheální rourky je nejlepším preventivním mechanismem. Provedení časné tracheostomie nevede průkazně ke snížení incidence VAP.
Ostatní preventivní opatření
Dlouhodoběji známá další preventivní opatření ke snížení výskytu VAP jsou nadále v platnosti, patří mezi ně především:
- Všeobecná epidemiologická opatření: alkoholová dezinfekce rukou, systém bariérového ošetřování nemocných aj.
- Výměna okruhu ventilátoru pouze mezi pacienty.
- Péče o součásti okruhu ventilátoru.
- Preference neinvazivní ventilace.
- Posílení obranyschopnosti pacienta – nutriční podpora, omezení krevních převodů, vakcinace.
Závěr
Během posledních let mnoho studií prokazuje roli důsledků zavedení tracheální rourky jako hlavní patogenetický mechanismus rozvoje VAP. Vývoj stále dokonalejších typů tracheálních rourek je jednou z možností snížení incidence VAP, současně je prokázán preventivní efekt automatického udržování tlaku v manžetě mezi 20–30 cm H2O k zabránění aspirace sputa ze subglotického prostoru. VAP je nozokomiální plicní infekce, která je více spojena s přítomností tracheální rourky než s ventilátorem per se. Termín ventilator-associated pneumonia by z důvodu poznatků patogeneze mohl být změněn za termín tracheal tube-associated pneumonia.
Literatura u autora.
2. Tuberkulóza v intenzivní péči
Bartáková H.
KARIM, VFN a II. interní klinika, FNKV, Praha
Incidence tuberkulózy (TBC) v České republice je v posledních 5 letech menší než 10/100000, což je příznivá situace, která řadí naši zemi mezi evropské státy s nízkou náloží TBC. Pokud jde o literárních údaje týkající se výskytu TBC na anesteziologicko-resuscitačních odděleních (ARO) a jednotkách intenzivní péče (JIP), pacienti s TBC představují v rozvinutých zemích desetiny procenta až jedno procento všech příjmů. Nejčastějším důvodem přijetí na JIP je akutní respirační selhání (cca 70 %), mortalita tuberkulózních pacientů na JIP je velmi vysoká (60–80%). Z epidemiologického hlediska závažným faktem je, že diagnóza TBC není u naprosté většiny pacientů v čase přijetí známa. Data z ARO pražské fakultní nemocnice ukázala, že během 5 let, kdy bylo přijato téměř 3600 pacientů, se TBC prokázala u 11 pacientů (0,3 %), 5 z nich (45 %)na ARO zemřelo. U dvou zemřelých bylo možné TBC považovat za primární příčinu smrti. Následující stavy jsou nejčastějším důvodem přijetí pacienta s TBC na JIP nebo ARO: masivní hemoptýza, rozsáhlá TBC pneumonie, miliární TBC, tamponující perikarditida, pneumotorax a empyém. Zlatým standardem diagnostiky zůstává mikroskopický a kultivační průkaz tuberkulózních mykobakterií. Nově používané rychlé molekulárně-genetické metody využívající detekce DNA (Amplicor), amplifikace rRNA (Gen Probe MTD), přírůstku DNA v čase (Septifast) jsou vysoce senzitivní i specifické a výsledek lze získat během 2–7 hodin. Nevýhodou je relativně vysoká cena v porovnání s mikroskopickým průkazem. Indikaci molekulárně-genetických metod je tedy vhodné zvažovat a provádět je:
- v případě vysoké časové naléhavosti;
- při negativním mikroskopickém nálezu a vysoké klinické suspekci na TBC;
- při pozitivním mikroskopickém nálezu a vysokém výskytu netuberkulózních bakterií v prostředí.
Léčba aktivní TBC je vždy kombinovaná podle standardních režimů a vedená ftizeologem. Benefit podávání systémových kortikosteroidů byl z hlediska krátkodobého i dlouhodobého efektu prokázán pouze u bazilární meningitidy, v ostatních indikacích je kontroverzní. Existují jednotlivá sdělení o použití mimotělního oběhu k překlenutí akutního respiračního selhání u pacientů s TBC. V diagnostice latentní TBC se donedávna jako nepřímý imunologický test používala výhradně tuberkulinová zkouška Mantoux II. Relativně novou in vitro metodou je Quantiferon, jehož podstatou je měření interferonu γ produkovaného T lymfocyty vyšetřované osoby po stimulaci antigeny Mycobacterium tuberculosis. Výhodou Quantiferonu v diagnostice latentní TBC je, že na rozdíl od tuberkulinové zkoušky zůstává negativní v případě infekce netuberkulózními mykobakteriemi a po očkování, odpadá riziko alergických reakcí, které v případě tuberkulinové zkoušky mohou komplikovat interpretaci.
U imunokompromitovaných jedinců dovoluje odlišit negativní reakci na mykobakteriální antigeny od neschopnosti T lymfocytů reagovat na jakýkoli stimul. Quantiferon je tedy metodou, kterou lze využít jako jednu ze screeningových vyšetřovacích metod u kontaktů a pacientů s rizikem reaktivace TBC. Vzhledem k výše uvedeným výhodám napomáhá lépe stratifikovat osoby ohrožené aktivní TBC, což usnadňuje rozhodnutí o indikaci chemoprofylaxe. Vzhledem k tomu, že zdravotníci jsou jednou z nejvíce ohrožených skupin populace, měli by být o významu Quantiferonu informováni.
3. Pneumonie u imunokompromitovaných pacientů
Rusinová, K., Otáhal, M., Bartáková, H., Balík M.
Klinika anesteziologie, resuscitace a intenzivní medicíny 1. LFUK a VFN Praha
Pneumonie u imunokompromitovaných jedinců může vést k akutní respirační insuficienci (ARI) v 10–50 % případů, a je nejčastějším důvodem přijetí těchto pacientů na ARO/JIP. Jedná se o velmi závažné stavy s mortalitou kolem 50 %, v případě nutnosti umělé plicní ventilace (UPV) až 75 %, u pacientů po alotransplantaci kostní dřeně dosahuje mortalita více než 90 %. Naše sdělení se bude zabývat respiračními komplikacemi v rámci onkologických onemocnění, především u hematologických malignit.
Účinná péče o tyto nemocné je založena na čtyřech hlavních principech:
- Je nezbytné určit příčinu akutní respirační insuficience – a evokovat možnost pneumonie: asi u 25 % pacientů s ARI zůstane příčina dechové tísně i přes řadu cílených vyšetření nejasná. Určení etiologie (pneumonie u imunokompromitovaných pacientů může probíhat skrytě nebo atypicky) má přitom zásadní význam – pacienti s objasněnou příčinou ARI mají mortalitu o 20–25% nižší než nemocní s nejasnou etiologií ARI.
- Důležitá je diferenciální diagnostika pneumonií s ohledem na imunodeficit – nejčastějšími příčinami u těchto nemocných jsou: Bakteriální pneumonie 30 %, invazivní plicní aspergilóza 13 %, pneumocystová pneumonie 9 %, infiltrace plic maligními buňkami 8 %, virová pneumonie 4 %, toxická pneumonie (např. chemoterapie aj.) 4 %, tuberkulóza 2 %.
- Bronchoalveolární laváž je nutno u imunokompromitovaných pacientů indikovat uvážlivě: Její efektivita při určení příčiny pneumonie se pohybuje okolo 50 %, změna léčby následuje však jen v 35 %. Navíc u pacientů po autologním či alogenním převodu kmenových buněk je zatížena až 40% komplikací (nejčastěji nutnost UPV), což prokazatelně zhoršuje celkovou prognózu těchto pacientů.
- Velkým přínosem je neinvazivní ventilace (NIV): Včasné zahájení NIV umožňuje překlenout až v 50 % hypoxémii, a ušetřit tak pacienty před UPV. Další výhodou je možnost provedení bronchoskopie a bronchoalveolární laváže při NIV, což významně snižuje výskyt komplikací, zejména intubace a UPV.
4. Resekční výkony u rozpadových pneumonií
Pelichovská, M., Hlobeňová, T., Cvachovec, K.
KAR 2. LF UK a IPVZ ve FN Motol, Praha
Komunitní pneumonie (KP) je definována jako akutní infekce plicního parenchymu, která je spojena se symptomy akutní infekce, spolu s přítomností akutního infiltrátu na RTG snímku plic a poslechovým nálezem charakteristickým pro pneumonii. Těžká KP je definována jako klinický syndrom, který se vyvine u pacientů s pneumonií a vyžadující přijetí na JIP. Přes zlepšení péče a pokrok v oblasti léčby, KP a chřipka stále zůstávají na sedmém místě v žebříčku mortality ve Spojených státech. Každoročně je diagnostikováno cca 5–6 milionů pacientů, z toho cca 1 milion vyžaduje hospitalizaci s odpovídajícími ekonomickými náklady. I když je celková mortalita hospitalizovaných pacientů kolem 14 %, mortalita pacientů s KP vyžadujících přijetí na JIP (10–36 %) se pohybuje v rozmezí 25–50 % podle charakteru pacientů. Riziko mortality stoupá s potřebou umělé plicní ventilace. V mnoha případech je těžké identifikovat vyvolávající agens, i když Streptococcus pneumoniae je nejčastěji izolovaným patogenem. V rozsáhlé britské metaanalýze byl identifikován jako původce dvou třetin bakteriálních pneumonií S. pneumoniae. U pacientů přijatých na JIP byl příčinou pneumonie v jedné třetině. KP je onemocnění se širokým spektrem prezentace – od zcela lehkého průběhu k fatálnímu. I když neexistuje univerzální definice těžké KP, je obvykle přijímána výše uvedená. Ve většině případů je rozhodnutí o přijetí na JIP provedeno na základě klinického zhodnocení stavu a zvyklostí v daném systému zdravotní péče. Protože bylo prokázáno, že opožděné přijetí na JIP je spojeno se zvýšením mortality, existuje potřeba stanovení validních kritérií k identifikaci těžké KP a k následnému přijetí na JIP. Existuje řada prognostických modelů jako jsou americká doporučení ATS z roku 2007, kritéria britské Thoracic Society a Pneumonia Severity Index. Všechny tyto systémy jsou používány ke zhodnocení závažnosti KP a predikci mortality.
Metody: Retrospektivně byla analyzována data pacientů hospitalizovaných na našem oddělení z důvodů těžké KP a vyžadujících operační intervenci. Rozsah chirurgického výkonu byl určen operatérem. Byla hodnocena PSI score a CURB score spolu se SOFA a APACHE II.
Výsledek: Během 5 let nutná chirurgická intervence u 10 pacientů. Z nich bylo osm mužů, dvě ženy. Průměrný věk byl 38 roků (20–71). Indikací k výkonu byla v 60 % přetrvávající nevzdušnost parenchymu, ve 40 % trvající leak. U osmi pacientů se jednalo o pravostranný výkon. V retrospektivním hodnocení PSI score v 60 % řadilo pacienty do skupiny s vyšším rizikem, CURB pouze jednoho pacienta. Všichni pacienti přežili 28 dní hospitalizace.
Závěr: Skórovací systém zakomponovaný do běžného systému zdravotní péče může být cenným nástrojem při stratifikaci pacientů s těžkou KP.
Literatura u autorů.
5. VAP BUNDLE v praxi
Štětka, P.
ARK, Fakultní nemocnice u svaté Anny v Brně
VAP je nejčastější získaná nozokomiální infekce na JIP, s incidencí 10–40 % vzhledem k ne zcela jednoznačné definici. VAP zvyšuje mortalitu pacientů, prodlužuje délku pobytu na JIP, tzn. že je i ekonomicky zatěžující.
Hlavní mechanismus spočívá v kolonizaci obsahu hypofaryngu bakteriemi a jeho následné mikroaspiraci přes manžetu orotracheální nebo tracheostomické kanyly do plic, kde po překonání obranných mechanismů dochází k rozvoji VAP.
Opatření k redukci VAP
1. skupina obecně antiinfekčních opatření:
- pravidelná edukace personálu o prevenci VAP;
- mít protokol prevence VAP;
- surveillance infekcí = pravidelný odběr mikrobiolog. vzorků
- alespoň 2krát týdně, např. pondělí a čtvrtek;
- přísná hygiena rukou a izolace infekčních pacientů = boxový systém;
- orotracheální dekontaminace chlorhexidinem – 4krát denně vytření dutiny ústní přípravkem Skinsept sol., ideálem je ovšem použití chlorhexidinu (2% gel, asi 2 cm gelu rozetřít rukou v rukavicích na vnitřní stranu obou tváří, zatím u nás není k dispozici).
Chlorhexidin může být kontaminován pseudomonádami, tj. každý pacient má svůj.
2. skupina opatření vedoucích k omezení nebo alespoň zkrácení pobytu na UPV
- NIV = neinvazivní ventilace místo UPV přes tracheální rourku;
- orotracheální místo nazotracheální intubace;
- u každého pacienta denně přehodnoť nutnost analgosedace a UPV.
To znamená u každého pacienta kolem 10 hod dopoledne stop sedace.
Výjimky
- Relaxovaný pacient.
- Kraniocerebrální poranění s možným problémem s ICP.
- Pacient, jehož je obtížné ventilovat pro interferenci s ventilátorem, kašel nebo oxygenační problémy, např. FiO2 nad 70 %, PEEP > 10 cm H2O.
- Pacient s terapeutickou hypotermií.
- Pacient v kategorii paliativní péče = withdraw.
3. skupina opatření redukující možnost mikroaspirace obsahu z hypofaryngu
- uzavřený systém odsávání, výměna po 4 dnech;
- OTK s polyuretanovou manžetou redukující mikroaspirace, které jsou normálně až v 9/10 případů;
- kanyly s možností odsávání nad balonkem, tzv. subglotická drenáž sekretu u pacientů, s předpokladem ventilace déle než 48 hodin;
- udržování stálého tlaku v manžetě tracheální rourky (25–30 cm H2O) → 1. minimalizace traumatizace sliznice, 2. nízký tlak naopak umožní mikroaspirace;
- poloha pacienta v polosedě alespoň 30 st (výjimku tvoří pacienti v šokovém stavu, hypovolemičtí, s vysokou dávkou katecholaminů, nestabilní frakturou pánve nebo páteře, pacienti v kategorii paliativní léčby = withdraw).
4. Další obecná doporučení
- zabránit selfextubacím, které zvyšují riziko VAP 5násobně;
- prevence trombembolismu heparinem;
- prevence stresového vředu H2 blokátory nebo blokátory protonové pumpy;
- preferuj punkční TS místo chirurgické TS = tracheostomie.
Závěr
- Denně zvaž nutnost sedace a eventuálně ji zastav.
- Denně zvaž nutnost ventilace a eventuální možnost extubace.
- Udržuj pacienta v polosedě alespoň 30 st.
- Používej chlorhexidin jako denní součást péče o dutinu ústní.
- Používej kanyly s odsáváním nad balonkem u pacientů s předpokládanou dobou ventilace nad 48 hodin.
6. Virová pneumonie H1N1 na JIP
Michálek, P., Bailie, R., Scott, K., Abraham, A., Leyden P.
Dept of Anaesthetics, Antrim Area Hospital, Antrim, 45 Bush Road, BT41 4RD, United Kingdom/Northern Ireland
První zmínka o novém typu chřipkového viru přišla z Mexika v dubnu 2009. Místní úřady informovaly o zvýšeném výskytu těžké pneumonie v souvislosti s chřipkovým onemocněním u mladých jedinců. Tento vir byl identifikován jako nová varianta chřipkového viru A (H1N1) a označen také jako vir „prasečí chřipky“ z důvodu možného přenosu z vepřového dobytka na člověka. Z Mexika se vir pandemicky rozšířil na severní polokouli v průběhu května až července. Krátce nato došlo k pandemii také v Austrálii a na Novém Zélandu. Onemocnění mělo obvykle lehký až středně těžký průběh, ale u některých jedinců progredovalo rychle do akutního respiračního selhání, které špatně reagovalo na obvyklou léčbu. Tato pandemie způsobila masivní expanzi přijetí na jednotky intenzivní péče a v některých regionech přetížení jejich kapacity.
Epidemiologie H1N1 („swine flu origin“): Nová mutace chřipkového viru A (H1N1) SO-I je směsí genetického materiálů ze tří různých chřipkových virů. Obsahuje geny z lidského chřipkového viru, viru ptačí chřipky a viru prasečí chřipky. Přenos viru je pravděpodobně identický jako přenos viru sezonní chřipky. Nejčastější je přenos z člověka na člověka pomocí kapénkové nákazy. Přenos z vepřového dobytka na člověka je také možný. Neexistuje žádná informace o tom, že by infekce byla přenosná vodou nebo požitím vepřového masa. Osoby nakažené virem jsou obvykle infekční jeden den před rozvojem klinických příznaků až do sedmého dne choroby. Děti, staré osoby, pacienti s defektem imunity a pacienti s infektem dolních cest dýchacích mohou být infekční i déle než 10 dní, což je způsobeno nízkou aktivitou cytotoxických T lymfocytů, které jsou zodpovědné za likvidaci viru. Inkubační perioda je většinou 1–4 dny.
Klinické projevy: Nejčastějšími klinickými projevy onemocnění jsou horečka a kašel. Tyto příznaky se vyskytují u více než 90 % nemocných. K ostatním příznakům patří bolesti v krku, bolesti svalů a kloubů, průjem a zvracení. Tyto symptomy se vyskytují nekonstantně. Důvodem přijetí na jednotku intenzivní péče je téměř vždy pneumonie s respirační insuficiencí.
H1N1 pneumonie a ARDS: Při plicním postižení je interval mezi propuknutím příznaků a přijetím na JIP 3–7 dnů. Pacienti, u nichž je zvýšené riziko komplikací, jsou děti mladší 5 let, staří lidé, těhotné ženy a pacienti s imunosupresí nebo závažným přidruženým onemocněním. Původně virová pneumonie, která se obvykle zpočátku projevuje poruchou oxygenace a relativně zachovanou plicní compliance, může být komplikována sekundárně bakteriální plicní infekcí (Staphylococcus aureus, Pneumococcus, E. coli).
Rentgenový nález na plicích: Na rentgenovém snímku se zpočátku obvykle manifestují intersticiální změny, postupně se mohou objevit změny ložiskové nebo difuzní.
Léčba: Neinvazivní ventilace by neměla být aplikována v první fázi onemocnění z důvodu rizika infekce virem pro zdravotnický personál a ostatní pacienty. U pacientů s těžkým plicním průběhem je indikována tracheální intubace a umělá plicní ventilace s použitím podobné ventilační strategie jako u ARDS. Při výskytu plicní hypertenze může být indikována inhalace oxidu dusnatého nebo prostacyklinu. Pacienti by měli dostávat antivirotika oseltamivir (Tamiflu) nebo zanamivir (Relenza). U nejtěžších případů je indikována extrakorporální membránová oxygenace (ECMO). Kritéria pro použití ECMO jsou obvykle derivována z výsledků studie CESAR (věk pod 65 let, Murray LIS skóre více než 3, retence CO2, nemožnost dosáhnout Pplat pod 3,0 kPa). U velké části těchto pacientů dochází také k selhání dalších orgánových systémů, nejčastěji ledvin. V Británii existuje databáze, která audituje všechny pacienty přijaté na JIP s potvrzenou H1N1 infekcí (www.icnarc.org).
Vlastní zkušenosti: Prezentujeme soubor 7 pacientů, kteří byli přijati s respiračním selháním následkem infekce H1N1 viru na regionální JIP (spád 400.000 obyvatel). Jejich demografická data, přidružená onemocnění, průběh choroby a léčba jsou uvedeny v tabulce 1.
Tab. 1. Prezentace pacientů s H1N1 respiračním selháním na JIP 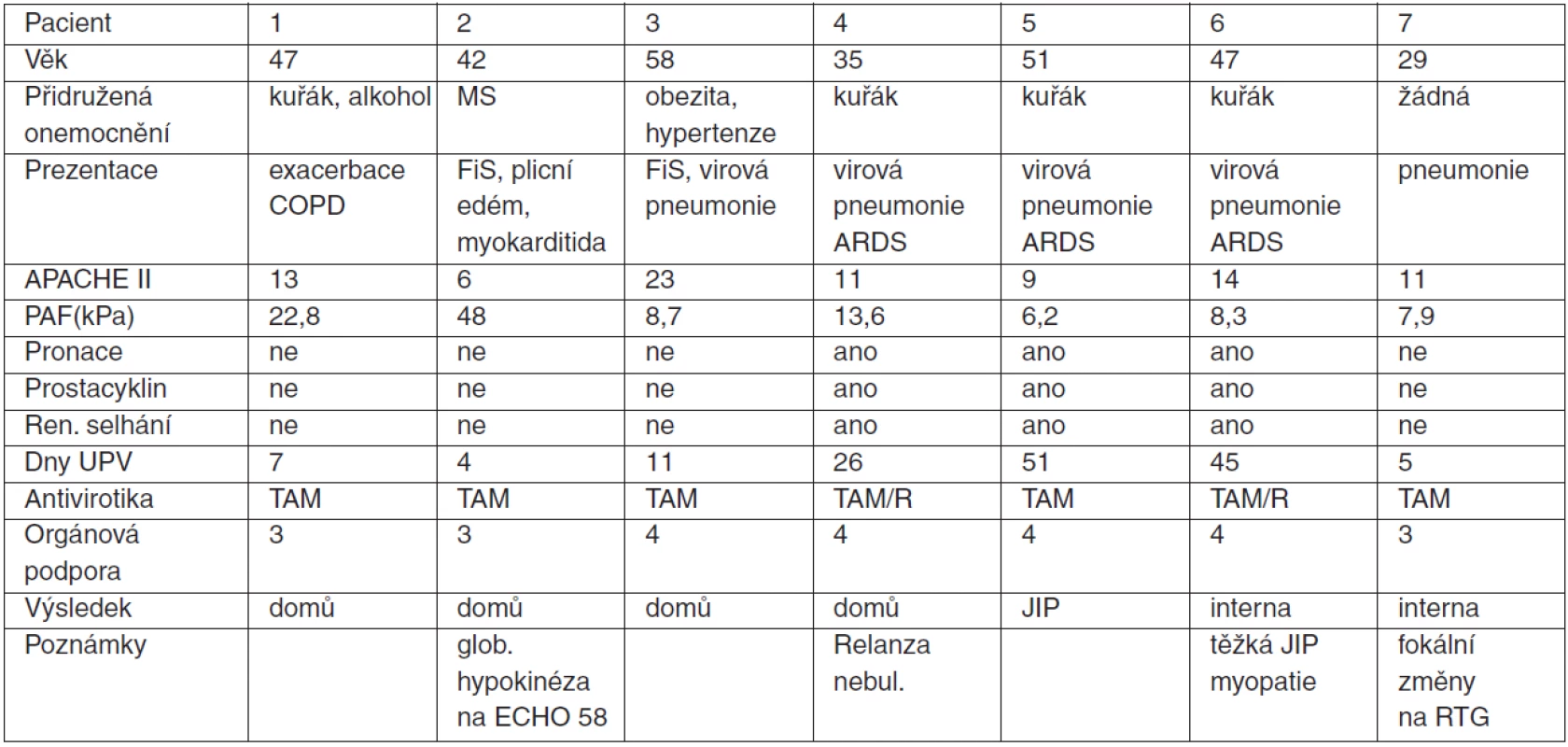
Legenda: MS = roztroušená skleróza, FiS = fibrilace síní, TAM = tamiflu, R = relenza Literatura u autorů.
7. Rescue indikace venovenózního ECMO u těžké virové pneumonie H1N1
Kotulák, T.1, 3, Říha, H.1, 3, Netuka, I.2, 3, Malý, J.2
1Klinika anesteziologie a resuscitace IKEM v Praze
2Klinika kardiochirurgie IKEM v Praze
31. LF Univerzity Karlovy v Praze
Chřipka 2009 H1N1 ve světě – lekce na úvod
Od vzniku světové pandemie chřipkovým virem 2009 H1N1, které v dubnu roku 2009 v Mexiku se v odborné literatuře objevují údaje o těžké virové pneumonii v rámci infekce chřipkovým virem H1N1. Situace v Austrálii a Novém Zélandu nám umožnila, díky jejich datům, se alespoň částečně připravit na pandemii 2009/2010. Již v na začátku chřipkové sezony se množí případy nemocných s nákazou virem H1N1 s neobyčejně těžkým průběhem charakterizovaným zejména těžkým respiračním selháním, které nereaguje na konvenční terapii. Data ANZIC Influenza Investigators studují data 722 pacientů přijatých na JIP s potvrzenou diagnózou infekce chřipkovým virem H1N1 v období od června do srpna 2009 v Austrálii a na Novém Zélandě. Ukazují incidence přijetí s prokázanou infekcí chřipkovým virem H1N1 na jednotku intenzivní péče 28,7 příjmů na milion obyvatel. Potvrzují také nižší průměrný věk pacientů s kritickým onemocněním ve spojitosti s H1N1 infekcí (medián 40 roků). Ze 722 pacientů bylo 376 žen (52,1 %), z toho 66 těhotných (9,1 %). Z hlediska rizikovosti je ještě zajímavé vysoké procento pacientů s BMI nad 35 : 172 (28,6 %). U 601 dospělých pacientů byl údaj o BMI k dispozici. Podle našich současných zkušeností nám první měsíce pandemie v České republice tato data potvrzují. Za stejné období publikuje The Australia and New Zealand Extracorporeal Membrane Oxygenation (ANZ ECMO) Influenza Investigator práci o soubor pacientů (n = 68) s ARDS vzniklým v souvislosti s infekcí virem chřipky H1N1 léčených pomocí ECMO (extracorporeal membrane oxygenation). Tito pacienti činili třetinu všech pacientů s H1N1 infekcí a těžkým respiračním selháním s nutností mechanické ventilace. 68 pacientů léčených pomocí ECMO mělo těžké, chřipkou způsobené ARDS a z toho 61 mělo potvrzenu infekci virem chřipky A(H1N1) (n = 53), nebo nemělo subtyp chřipky A určen (n = 8). Zbývajících 7 pacientů mělo anamnézu chřipkového onemocnění a byl předpoklad, že prodělali chřipku A(H1N1) i bez sérologické specifikace. Autoři uvádějí incidenci ECMO v této souvislosti 2,6 případů na milion obyvatel, respektive 2 u potvrzeného viru A(H1N1). Nejčastějšími komorbiditami byly: obezita (BMI větší než 30), asthma bronchiale a diabetes mellitus. U 94 % pacientů byla iniciálně zahájena enterální cestou léčba antivirotiky (oseltamivir). Celková mortalita během studijní periody byla 21%. Nicméně 16 pacientů zůstávalo na konci sledovaného období stále v nemocnici. Medián trvání ECMO terapie byl 10 dní. Nízkou mortalitu v kontrastu s jinými prácemi popisujícími terapii ECMO vysvětlují autoři mimo jiné nízkým věkem populace, etiologií ARDS (virová pneumonie), technologickým pokrokem a trénovaným personálem. Všichni pacienti v této skupině při napojení na ECMO splnili kritéria nedávno publikované studie CESAR. Z 200 jednotek intenzivní péče ve dvou zemích ECMO provádělo pouze 15 specializovaných center. Autoři usuzují, že USA a EU může počítat s cca 800–1300 případy ECMO v souvislosti s chřipkovou epidemií způsobenou virem A(H1N1) 2009/2010. Podobně Domínguez-Cherit et al. prezentují data u 58 nemocných chřipkou H1N1 během jara 2009 na šesti jednotkách intenzivní péče v Mexico City a stejně jako Kumar et al. v Kanadě 2009 na 168 kriticky nemocných s virem H1N1 poukazují na to, že se často jedná o mladé jedince, bez výrazných komorbidit s rychlou progresí onemocnění, multiorgánové dysfunkce a šokového stavu. Těžká respirační insuficience, spojená s refrakterní a prolongovanou hypoxémií, je velmi častá. Tolik zkušenosti z oblastí, kde již epidemie nebo pandemie chřipky vyvolané virem A(H1N1) proběhly, a díky rychlé analýze dat a jejich zveřejnění nám umožnily se připravit na často velmi závažný průběh onemocnění.
Možnosti terapie těžkého respiračního selhání v souvislosti s chřipkou H1N1
Ventilační strategie u pacientů s H1N1 ARDS se neliší od jiných ventilací u ARDS jiné etiologie. Jedná se o protektivní ventilaci s dodržením pozitivního end-inspiračního tlaku pod 30–35 mm Hg a dechového objemu 6 ml/kg predikované tělesné hmotnosti a nastavení optimálního pozitivního end-exspiračního tlaku (PEEP). Použití recruitment manévrů, pronační polohy a relaxace jako „rescue therapy“. Z ostatních ventilačních režimů můžeme ve studiích z Kanady, Austrálie a Nového Zélandu najít u části pacientů (6–14 %) použití vysokofrekvenční oscilační ventilace. Dále je možné použít inhalační oxid dusný (iNO), který funguje jako potentní vazodilatátor. Zvyšuje průtok ventilovanými oblastmi plic, a tak přispívá ke zlepšení oxygenace. Nevýhodou zůstává jeho vysoká cena. iNO může snižovat tlak v arteria pulmonalis, a tak přispívat ke zlepšení funkce pravé srdeční komory. Podobně lze užít inhalační podání prostaglandinů. Zejména iloprost, který má poločas 20–30 minut a vazodilatační účinek až 90 minut je vhodným preparátem, za předpokladu použití přístroje vhodného pro inhalační terapii.
Indikace použití ECMO
Extracorporeal Life Support Organization (ELSO) vydala v listopadu 2009 dokument „H1N1 Specific Supplements to the ELSO General Guidelines“, který se podrobně zabývá otázkou indikace a načasování zahájení podpory ECMO u těchto pacientů. Doporučení vychází z očekávané mortality a doporučuje uvažovat o zavedení ECMO, pokud je nutno ventilovat pacienta s FiO2 ≥ 0,8 a/nebo potřeba podávání dvou vazoaktivních léků. Indikaci zavedení ECMO při očekávané 80% mortalitě je stav, kdy PaO2/FiO2 pod 80 při FiO2 1,0 a Pplat ≥ 30 cm H2O a/nebo potřebě vazoaktivní terapie. Obezita ani těhotenství nejsou kontraindikací zavedení podpory. Věk sám o sobě není kontraindikací, záleží na zdravotním stavu před infekcí H1N1. Leukopenie může být kontraindikací. V České republice existují doporučení na jednotlivých pracovištích a ČSIM na svých internetových stránkách nedávno zveřejnila doporučení, která uvádějí indikaci zvážení zavedení podpory při reálném riziku úmrtí nad 50 % při Horowitzově indexu pod 150 mm Hg při současném FiO2 ≥ 0,9 a/nebo Murray LIS score 2–3 (kalkulátor je k dispozici na: www.cesar-trial.org). V souladu s ELSO doporučením uvádějí autoři také indikaci při současné nutnosti podávání 2 vazoaktivních látek a FiO2 ≥ 0,8 u pacientů s H1N1. Podpora ECMO je indikována při 80% riziku úmrtí, tedy Horowitzův index pod 80 mm Hg při FiO2 ≥ 0,8 a/nebo Murray LIS score 3–4 a také Horowitzův index pod 80 mmHg při FiO2 1,0 a Pplat ≥ 30 cmH2O a/nebo potřebě vazoaktivní terapie u nemocných H1N1. Mezi dalšími indikacemi uvádějí autoři retenci CO2 nad 80 mmHg nebo neschopnost dosáhnout ventilace bezpečným tlakem do 30 cm H2O a také závažný air leak syndrom (barotrauma, pneumothorax). Jako možnou kontraindikaci zmiňují agresivní umělou plicní ventilaci (FiO2 ≥ 0,8, Pplat nad 30 cm H2O) trvající déle než 7 dní, imunosuprese s neutropenií pod 400/ccm, krvácení do CNS.
Technické vybavení pro ECMO
ECMO je možné použít pouze na pracovištích s příslušným vybavením a dostatečně vyškoleným personálem. V současné době se používá nejčastěji dlouhodobý nízko-odporový oxygenátor Quadrox Maquet, jako pumpa se používá nejčastěji rotační systém Levitronix CentriMag nebo Rotaflow Centrifugal Pump, Maquet. Kanylace veno-venózní (nejčastěji v. femoralis a návrat oxygenované krve cestou v. jugularis interna) nebo může být veno-arteriální, pokud je nutno použít systém i jako náhradu selhaného srdce.
Závěr
ECMO je dostupná a reálná metoda, která může zvýšit šanci na přežití u H1N1 a těžké respirační insuficience. Tato metoda by se měla soustředit do center, která by mohla kopírovat rozmístění kardiocenter. Není vhodné, aby pacienti na ECMO s virem H1N1 byli umístěni na kardiochirurgická pooperační oddělení. Indikace ECMO je poslední volbou v terapii ARDS u těchto pacientů, ale zároveň je potřeba vystihnout správný čas, kdy techniku zavést případně pacienta transportovat do příslušného centra.
Poděkování: Podpořeno výzkumným záměrem MSM 0021620819 „Náhrada a podpora funkce některých životně důležitých orgánů“.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2010 Číslo 5- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Rekombinantní aktivovaný faktor VII v léčbě závažného krvácení u nehemofiliků – „vyšetřování (s využitím klinických randomizovných studií) skončilo, zapomeňte?“
- Rekombinantní aktivovaný faktor VII (rFVIIa) v léčbě závažného poporodního krvácení – data z registru UniSeven v České republice
- Aktivovaný rekombinantní faktor VII u závažného krvácení při těžkém poranění jater – kazuistiky
- Efekt časného nasazení vysokofrekvenční oscilace v léčbě dětí s respiračním selháním
- Pacienti s pandemickou chřipkou A (H1N1) 2009 v intenzivní péči
- Spontánní porod během ECMO podpory zahájené pro ARDS u nemocné s H1N1 pneumonií – kazuistika
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- Konference a kongresy
- Výborová schůze ČSARIM
- ZPRÁVY ČSIM
- Za profesorem MUDr. Zdeňkem Kalendou
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- Rekombinantní aktivovaný faktor VII (rFVIIa) v léčbě závažného poporodního krvácení – data z registru UniSeven v České republice
- 6. CELOSTÁTNÍ KONFERENCE UMĚLÁ PLICNÍ VENTILACE 2010
- Aktivovaný rekombinantní faktor VII u závažného krvácení při těžkém poranění jater – kazuistiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



