-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Krvácivé komplikace a předávkování antikoagulační léčby
Bleeding complications and overdosing of anticoagulant therapy
Anticoagulant therapy is one of the most common forms of medical intervention. It is the mainstay of prevention and treatment of thrombotic events. Omission of adequate anticoagulant prophylaxis at least for moderate-risk and high-risk patients is a widely recognized medical error.
Bleeding is one of the most feared complications of anticoagulant therapy, and is a risk of all anticoagulants. Whereas unfractionated heparin and warfarin, the oldest and most widely used anticoagulants, have specific antidotes for their anticoagulant effect, many of the newer agents (direct and indirect inhibitors of coagulation factors Xa and/or IIa) do not have specific antidotes to reverse their actions. The use of novel anticoagulants is further complicated by a lack of easily available laboratory tests to measure their levels and thereby optimize their benefit and safety in clinical practice.
In this review, we evaluate the risk of bleeding associated with current anticoagulants, review the data available on current and experimental agents used for the reversal of anticoagulation, and provide recommendations for the management of major bleeding associated with anticoagulant therapy and for the management of asymptomatic overdosing of the anticoagulants.Keywords:
anticoagulation – bleeding – warfarin – heparin – low molecular weight heparin – fondaparinux – refludan – dabigatran – rivaroxaban
Autoři: Gumulec Jaromír 1,2; Kessler Petr 3; Procházka Václav 1,4; Brejcha Martin 5; Grundmann Milan; Penka Miroslav; Zänger Mathias; Machytka Evžen 9; Klement Petr 1,10
Působiště autorů: Hematoonkologické a transfuzní centrum FN Ostrava 1; Ústav klinické hematologie FN Ostrava 2; Oddělení hematologie a transfuziologie Nemocnice Pelhřimov 3; Ústav radiodiagnostický, Pracoviště intervenční neuroradiologie a angiologie FN Ostrava 4; Oddělení klinické hematologie Onkologického centra J. G. Mendela Nový Jičín 5; Ústav klinické farmakologie FN Ostrava 6; Oddělení klinické hematologie FN Brno 7; BW, Berlin, Spolková republika Německo 8; Interní klinika FN Ostrava 9; McMaster University and Henderson Research Centre, Hamilton, Kanada 10
Vyšlo v časopise: Anest. intenziv. Med., 20, 2009, č. 6, s. 324-331
Kategorie: Doporučení odborných společností
Souhrn
Antikoagulační léčba je jedna z nejužívanějších terapeutických modalit. Je základem prevence a léčby trombotických příhod. Vynechání adekvátní antikoagulační profylaxe alespoň u středně a vysoce rizikových pacientů je všeobecně považováno za medicínské pochybení.
Krvácení je jedna z nejobávanějších komplikací antikoagulační léčby a toto riziko s sebou nesou všechna antikoagulancia. Zatímco nefrakcionovaný heparin a warfarin, nejstarší a nejužívanější antikoagulancia, mají specifické antidotum rušící jejich antikoagulační účinek, většina nových látek (přímé a nepřímé inhibitory koagulačních faktorů Xa a/nebo IIa) specifické antidotum rušící jejich účinek nemají. Použití nových antikoagulačních látek je navíc komplikované nedostupností snadného laboratorního monitorování jejich účinku, což je nezbytné pro optimalizaci jejich profitu a bezpečnosti v klinické praxi.
V tomto přehledném článku posuzujeme riziko krvácení aktuálně používaných antikoagulancií, shrnujeme dostupné informace o dostupných i experimentálních látkách používaných pro zrušení antikoagulace a navrhujeme doporučení péče o pacienty se závažným krvácením u pacientů s antikoagulační léčbou nebo s symptomatickým předávkováním antikoagulancia.Klíčová slova:
antikoagulační léčba – krvácení – warfarin – heparin – low molecular weight heparin – fondaparinux – refludan – dabigatran – rivaroxabanÚvod
Antikoagulační léčba je hlavní modalitou prevence a léčby venózního tromboembolismu, prevence kardioembolického iktu u pacientů s fibrilací síní, prevence trombotických komplikací u pacientů absolvujících kardiochirurgické operace a léčby akutního koronárního syndromu. Nepodání adekvátní antikoagulační léčby je považováno za medicínské pochybení. Krvácení je komplikací antikoagulační léčby zásadního významu. Standardizace péče o pacienty s hemoragickými komplikacemi antikoagulační léčby nebo s významným, ale asymptomatickým předávkováním antikoagulancia může přispět ke zvýšení bezpečnosti péče.
Závažnost krvácení
Adekvátní řešení klinických situací vyžaduje sjednocení hodnocení závažnosti krvácení.
Těžké krvácení
- Fatální krvácení.
- Symptomatické krvácení do kritické oblasti nebo orgánu jako je intrakraniální, intraspinální, intraokulární, retroperitoneální, intraartikulární, perikardiální nebo intramuskulární s kompartmentovým syndromem.
- Krvácení vedoucí k poklesu koncentrace hemoglobinu o 20 g . l-1 nebo více nebo vyžadující podání transfuze dvou nebo více transfuzních jednotek (TU) erytrocytů.
Život ohrožující (ŽOK) a neztišitelné krvácení
- Ztráta objemu krve v průběhu 24 hodin (ekvivalent cca 10 TU erytrocytů).
- Ztráta 50 % objemu během 3 hodin.
- Pokračující krevní ztráta přesahující objem 150 ml minutu.
- Krevní ztráta v lokalizaci vedoucí k ohrožení životních funkcí (např. krvácení do centrální nervové soustavy).
- Krvácení neztišitelné standardními postupy.
Laboratorní monitorování
Adekvátní přístup k pacientovi s hemoragickými komplikacemi antikoagulační léčby a/nebo s významným asymptomatickým předávkováním antikoagulancia vyžaduje přesné laboratorní monitorování aktuálního účinku léku, respektive aktuálního stavu koagulačního systému.
Základní testy – slouží k základní orientaci o stavu systému hemostázy
- Krevní obraz.
- Protrombinový test (PT).
- Aktivovaný parciální tromboplastinový čas (APTT).
- Fibrinogen (Fbg).
Výsledky základních koagulačních testů v referenčním rozmezí nevylučují závažnou klinickou poruchu koagulace, na kterou nejsou skupinové testy citlivé, nebo která se v případě prudkých změn koagulace vyvinula v době mezi odběrem vzorku a předáním výsledku z laboratoře na klinické pracoviště.
Doplňující testy – slouží k cílenějšímu monitorování v určitých, specifických situacích.
- Test titrace heparinu protaminem pro monitorování neutralizace nefrakcionovaného heparinu (UFH) protamin sulfátem (PS).
- Anti-Xa pro monitorování léčby nízkomolekulárními hepariny (LMWH), fondaparinuxem (nutné využít metody s kalibračním standardem pro fondaparinux) a rivaroxabanem (specifický kalibrační standard zatím neexistuje).
- Ekarinový test pro monitorování léčby lepirudinem nebo dabigatranem.
- Antitrombin a d-dimery v situacích s rozvíjející se trombotickou mikroangiopatií, např. diseminovanou konsumpční koagulopatií.
Komplikace a významné předávkování
Hemoragické komplikace a/nebo významné asymptomatické předávkování nefrakcionovaného heparinu
- Těžké krvácení a/nebo významné předávkování je důvodem pro bezprostřední ukončení aplikace nefrakcionovaného heparinu (UFH) a podání protamin sulfátu (PS) – tabulka 1.
- Laboratorní monitorování neutralizace UFH protamin sulfátem:
– test titrace heparinu protaminem nebo trombinový čas;
– první odběr 5–15 minut po podání PS;
– kontrolní vzorek v intervalu 2–8 hodin pro zachycení rebound fenoménu (popisováno především v kardiochirurgii).
- V případě mírného krvácení a/nebo předávkování UFH stačí přerušení léčby a častější laboratorní monitorování.
- V případě ŽOK je indikovaná komplexní péče. Podání i. v. injekce rFVIIa v úvodní dávce 100–140 μg . kg-1 je doporučeno co nejdříve při selhání standardních postupů nebo předpokladu jejich nedostatečné účinnosti s ohledem na povahu krvácení.
Tab. 1. Dávkování PS při neutralizaci UFH 
*dávka PS vypočtená na každých 100 jednotek podaného nefrakcionovaného heparinu podaná rychlostí pod 5 mg/minutu; †někteří klinici preferují před paušálním podáním fixní dávky PS přístup s výpočtem dávky PS přesně podle množství UFH podaného v několika v posledních hodinách (poločas UFH při aplikaci i. v. infuzí je 60–90 minut). Hemoragické komplikace a/nebo významné předávkování nízkomolekulárních heparinů
- Těžké krvácení nebo významné předávkování je důvodem pro bezprostřední ukončení aplikace nízkomolekulárních heparinů.
- PS není schopen plně neutralizovat antikoagulační efekt nízkomolekulárních heparinů (LMWH), ruší pouze jejich anti-IIa aktivitu – doporučované dávkovací schéma je uvedeno v tabulce 2.
- V případě ŽOK je indikovaná komplexní péče. Podání i. v. injekce rFVIIa v úvodní dávce 100–140 μg . kg-1 je doporučeno co nejdříve při selhání standardních postupů nebo předpokladu jejich nedostatečné účinnosti s ohledem na povahu krvácení.
Tab. 2. Dávkování PS při neutralizaci LMWH 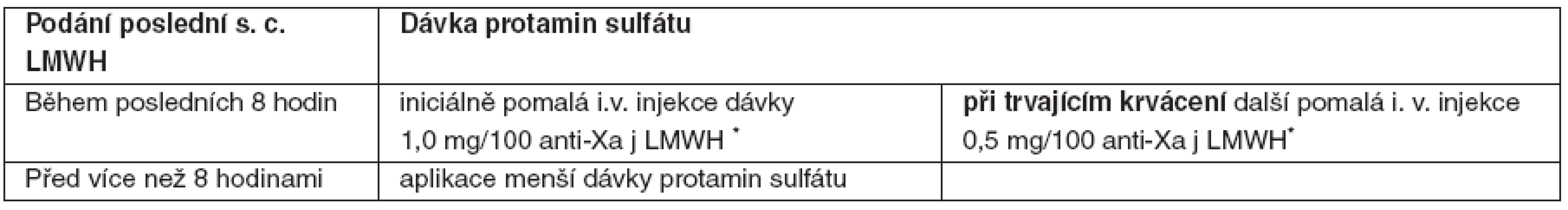
*dávka protamin sulfátu vypočtená na každých 100 anti-Xa jednotek použitého LMWH, podaná rychlostí pod 5 mg/minutu. Hemoragické komplikace a/nebo významné předávkování fondaparinuxu
- Těžké krvácení/významné předávkování je důvodem pro bezprostřední ukončení aplikace fondaparinuxu.
- Antikoagulační efekt fondaparinuxu nelze neutralizovat protamin sulfátem vůbec – specifické antidotum neexistuje.
- V případě ŽOK je indikovaná komplexní péče. Podání i. v. injekce rFVIIa v úvodní dávce 100–140 μg . kg-1 je doporučeno co nejdříve při selhání standardních postupů nebo předpokladu jejich nedostatečné účinnosti s ohledem na povahu krvácení.
Hemoragické komplikace a/nebo předávkování warfarinu
Možnosti řešení situace s INR mimo terapeutické rozmezí:
- Častější monitorování pacienta beze změny dávky warfarinu do stabilizace stavu.
- Úprava udržovací dávky warfarinu o 5–20 % s častějším laboratorním monitorováním do stabilizace stavu (výhodné je počítat tzv. kumulativní týdenní dávku, tu redukovat a výsledek rozdělit do dílčích dávek podávaných v jednotlivých dnech, dlouhý biologický poločas warfarinu umožňuje podávat ob den různou dávkou, rozdíl by ale neměl být větší než jedna polovina tablety).
- Vynechání jedné nebo dvou dávek warfarinu s následným snížením kumulativní týdenní dávky a častějším laboratorním monitorováním do stabilizace stavu.
Aktivní snižování zvýšeného INR:
- Aplikace vitaminu K – perorální aplikace je bezpečná a dobře předvídatelná s účinkem za 24–48 hodin, pomalá i. v. infuze je indikovaná při nutnosti rychlé úpravy zvýšeného INR, účinek se dostavuje po 6 hodinách, dávka vitaminu K nad 10 mg může vést k subterapeutickému snížení INR a/nebo k rezistenci na léčbu trvající týden i déle.
Aplikace koncentrátu faktorů protrombinového komplexu nebo čerstvě zmražené plazmy – dávkování uvádí tabulka 3.
Tab. 3. Dávkování plazmy a koncentrátu faktorů protrombinového komplexu u pacientů léčených warfarinem 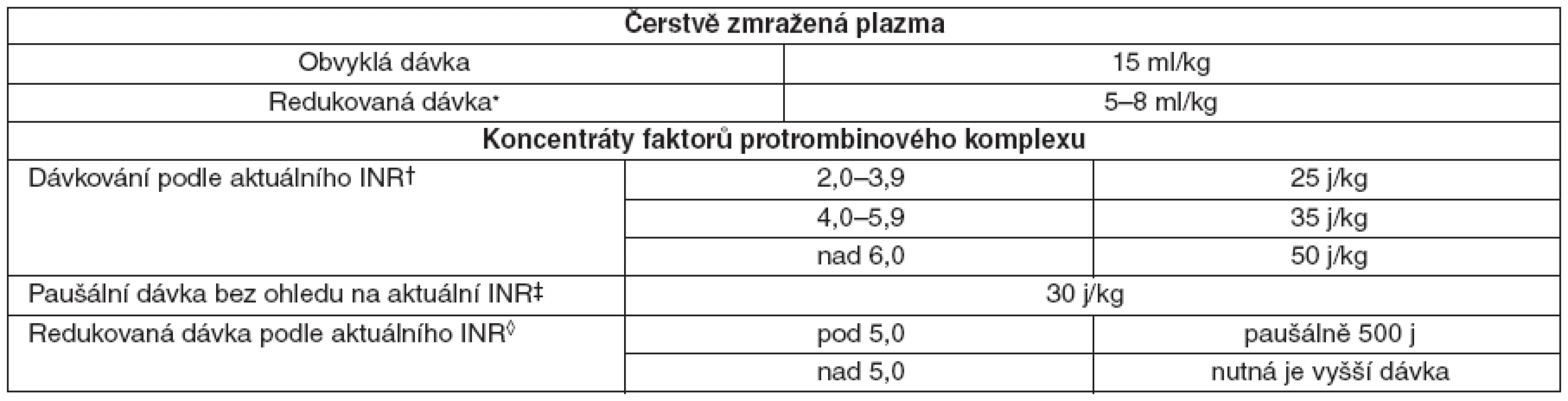
*jen při krvácení a INR v terapeutickém rozmezí (spíše než v supraterapeutickém rozmezí); †kompletní úpravy bylo dosaženo u 30 z 36 pacientů; ‡kompletní úpravy INR [pokles z 20 na 1,1 INR, (průměrné hodnoty)] a zastavení krvácení bylo dosaženo u všech 10 pacientů s těžkým krvácením; ◊u pacientů s INR do 5,0 a těžkým krvácením nebo nutností invazivního výkonu vede podaní 500 j koncentrátu faktorů protrombinového komplexu a vitaminu K během 10 minut ke kompletní úpravě INR přetrvávající v referenčním rozmezí 12–24 hodin. - V případě ŽOK je indikovaná komplexní péče. Podání i. v. injekce rFVIIa v úvodní dávce 100–140 μg . kg-1 je doporučeno co nejdříve při selhání standardních postupů nebo předpokladu jejich nedostatečné účinnosti s ohledem na povahu krvácení.
Stratifikace rizika krvácivých komplikací léčby warfarinem
Při řešení hemoragických komplikací a/nebo asymptomatického předávkování warfarinu je vhodné postupovat podle rizika krvácivých komplikací (tab. 4).
Tab. 4. Stratifikace rizika krvácivých komplikací antikoagulační léčby warfarinem u ambulantních pacientů 
Modelové klinické situace s INR mimo terapeutické rozmezí bez známek krvácení
INR nad terapeutickým rozmezím, ale pod 5,0 bez známek krvácení
Zásah podle aktuální hodnoty INR, rizika krvácení a naléhavosti situace.
Podle hodnoty INR:
- častější laboratorní monitorování beze změny dávky warfarinu (při nepatrném zvýšení INR způsobeném faktorem, který odezněl) nebo
- snížení udržovací dávky warfarinu o 5–20 % s častějším laboratorním monitorováním nebo
- vynechání jedné dávky s následným snížením udržovací dávky warfarinu o 5–20 % a častějším laboratorním monitorováním do stabilizace stavu.
Úpravu lze čekat během několika dní.
INR mezi 5,0–9,0 bez známek krvácení
Zásah podle aktuální hodnoty INR, rizika krvácení a naléhavosti situace.
Nízké riziko krvácení:
- Vynechání jedné nebo dvou dávek s následným snížením udržovací dávky warfarinu o 5–20 % a častějším laboratorním monitorováním do stabilizace stavu.
Úpravu lze čekat během několika dní.
Zvýšené riziko krvácení:
- podání 1–3 mg vitaminu K per os (1–3 kapky KANAVIT gtt),
- vynechání dávky warfarinu,
- následně snížení udržovací dávky warfarinu o 5–20 %.
Častější laboratorní monitorování do stabilizace stavu.
Nutnost rychlého snížení zvýšeného INR:
- podání asi 5 mg vitaminu K per os (5 kapek KANAVIT gtt),
- trvá-li zvýšené INR další den, přidat 1–2 mg vitaminu K per os (1–2 kapky KANAVIT gtt).
Po perorálně podaném vitaminu K lze úpravu čekat během 24 hodin.
INR nad 9,0 bez známek krvácení
Zásah podle aktuální hodnoty INR, rizika krvácení a naléhavosti situace.
Nízké riziko krvácení:
- přerušení léčby warfarinem,
- podání 3–5 mg vitaminu K per os (3–5 kapek KANAVIT gtt),
- trvá-li zvýšené INR další den, opakovat perorální aplikaci vitaminu K,
- laboratorní kontrola nejpozději za 24 hodin,
- po návratu INR do terapeutického rozmezí pokračovat v léčbě warfarinem v udržovací dávce snížené o 5–20 %,
- časté laboratorní monitorování do stabilizace stavu.
Úpravu lze čekat během 24–48 hodin.
Zvýšené riziko krvácení:
- přerušení léčby warfarinem;
- podání 5–10 mg vitaminu K per os (5–10 kapek KANAVIT gtt) nebo formou pomalé i. v. infuze 5–10 mg vitaminu K podané během 20–30 minut;
- laboratorní kontroly v intervalu 6–24 hodin;
- nedojde-li k adekvátnímu snížení INR, lze nízkou dávku vitaminu K opakovat;
- po návratu INR do terapeutického rozmezí pokračovat v léčbě warfarinem v udržovací dávce snížené o 5–20 %;
- časté laboratorní monitorování do stabilizace stavu.
Úpravu lze po parenterálně podaném vitaminu K čekat za 4–6 hodin.
Těžké krvácení se zvýšením INR bez ohledu na míru jeho zvýšení
- Přerušení léčby warfarinem.
- Aplikace pomalé i. v. infuze 10 mg vitaminu K podané během 20–30 minut.
- Substituční léčba podle klinické situace:
– plazma nebo
– koncentrát faktorů protrombinového komplexu.
- Četné laboratorní kontroly do stabilizace stavu pacienta, první bezprostředně po substituční léčbě.
- Nedojde-li k adekvátnímu snížení INR, lze podání vitaminu K opakovat v intervalu 12 hodin.
- Návrat k antikoagulaci warfarinem po stabilizaci stavu, podle rizika trombózy je na zvážení přechodné zajištění antitrombotiky s rychle nastupujícím účinkem (LMWH, fondaparinux).
Život ohrožující nebo neztišitelné krvácení u pacienta se zvýšením INR bez ohledu na míru jeho zvýšení
- Přerušení léčby warfarinem, aplikace pomalé i. v. infuze 10 mg vitaminu K podané během 20–30 minut a substituční léčba podle aktuální hodnoty INR, rizika krvácení a naléhavosti situace:
– koncentrát faktorů protrombinového komplexu nebo
– plazma a/nebo
– i. v. injekce rFVIIa v dávce 100–140 μg . kg-1.
- Četné laboratorní kontroly do stabilizace stavu pacienta, první bezprostředně po substituční léčbě.
- Nedojde-li k adekvátnímu snížení INR, lze podání vitaminu K opakovat v intervalu 12 hodin.
- Návrat k antikoagulaci warfarinem po stabilizaci stavu, podle rizika trombózy je na zvážení přechodné zajištění antitrombotiky s rychle nastupujícím účinkem (LMWH, fondaparinux).
Potřeba rychlého zrušení antikoagulace warfarinem před urgentní operací
- Přerušení léčby warfarinem.
- Aplikace pomalé i. v. infuze 5 mg vitaminu K podané během 20–30 minut.
- Substituční léčba podle aktuální hodnoty INR, rizika krvácení a naléhavosti situace:
– koncentrát faktorů protrombinového komplexu nebo
– plazma a/nebo
– v případě ŽOK i. v. injekce rFVIIa v dávce 100 až 140 μg . kg-1.
- Bezprostřední laboratorní kontrola – operaci je možno zahájit při poklesu INR pod 1,3–1,5.
- Urgentní výkon je možné provést i bez znalosti INR hned po injekci koncentrátu faktorů protrombinového komplexu v dávce 50 j . kg-1.
- Návrat k antikoagulaci warfarinem po stabilizaci stavu, podle rizika trombózy je na zvážení přechodné zajištění antitrombotiky s rychle nastupujícím účinkem (LMWH, fondaparinux…).
Těžké hemoragické komplikace a/nebo předávkování lepirudinu
- V současnosti neexistuje specifické antidotum lepirudinu.
- Bezprostřední přerušení aplikace lepirudinu a odběr vzorku k laboratornímu vyšetření:
– krevní obraz,
– základní koagulační testy,
– eventuálně ekarinový test nebo anti-IIa.
- Podle potřeby substituční hemoterapie. V případě ŽOK je indikovaná komplexní péče. Podání i. v. injekce rFVIIa v úvodní dávce 100–140 μg . kg-1 je doporučeno co nejdříve při selhání standardních postupů nebo předpokladu jejich nedostatečné účinnosti s ohledem na povahu krvácení.
- Zvážit intravaskulární intervenci radiologa, při krvácení z gastrointestinálního traktu endoskopisty, v indikovaných situacích chirurga, gynekologa, urologa apod.
- Zvážit indikaci eliminačních metod k odstranění lepirudinu z organismu (hemodialýzou s použitím high-flux membrán, pomaleji hemofiltrací).
- Zvážit využití nespecifického hemostatického účinku desmopresin acetátu (DDAVP).
- Pomalá i. v. infuze v dávce 0,3 μg . kg-1, eventuálně opakovaně během 12–24 hodin (možnost vzniku tachyfylaxe po 3–4 dávkách).
Těžké hemoragické komplikace a/nebo předávkování dabigatranu
- V současnosti neexistuje specifické antidotum dabigatranu.
- Bezprostřední přerušení podávání dabigatranu a odběr vzorku k laboratornímu vyšetření:
– krevní obraz,
– základní koagulační testy,
– eventuálně ekarinový test nebo anti-IIa.
- Podle potřeby substituční hemoterapie. V případě ŽOK je indikovaná komplexní péče. Podání i. v. injekce rFVIIa v úvodní dávce 100–140 μg . kg-1 je doporučeno co nejdříve při selhání standardních postupů nebo předpokladu jejich nedostatečné účinnosti s ohledem na povahu krvácení.
- Zvážit intravaskulární intervenci radiologa, při krvácení z gastrointestinálního traktu endoskopisty, v indikovaných situacích chirurga, gynekologa, urologa apod.
- Zvážit indikaci eliminačních metod k odstranění dabigatranu z organismu (hemodialýzou).
Těžké hemoragické komplikace a/nebo předávkování rivaroxabanu
- V současnosti neexistuje specifické antidotum rivaroxabanu.
- Bezprostřední přerušení podávání rivaroxabanu a odběr vzorku k laboratornímu vyšetření:
– krevní obraz,
– základní koagulační testy,
– eventuálně anti-Xa (zatím neexistuje specifický kalibrační standard) nebo trombin generační test.
- Podle potřeby substituční hemoterapie. V případě ŽOK je indikovaná komplexní péče. Podání i. v. injekce rFVIIa v úvodní dávce 100–140 μg . kg-1 je doporučeno co nejdříve při selhání standardních postupů nebo předpokladu jejich nedostatečné účinnosti s ohledem na povahu krvácení.
- Zvážit podání aktivního uhlí ke snížení absorpce přípravku.
- Zvážit intravaskulární intervenci radiologa, při krvácení z gastrointestinálního traktu endoskopisty, v indikovaných situacích chirurga, gynekologa, urologa apod.
- Zvážit indikaci eliminačních metod k odstranění rivaroxabanu z organismu (výměnnou plazmaferézou).
Strategie péče o pacienta s těžkým krvácením
Sdělení na toto téma bylo prezentováno 6. listopadu 2008 formou přednášky na III. brněnských hematologických dnech organizovaných v rámci cyklu „Krvácení a trombóza – mezioborový problém“; 27. března 2009 formou přednášky na XV. Pařízkových dnech v Novém Jičíně a publikováno ve sjezdových materiálech z naposledy jmenovaného kongresu formou článku in extenso Gumulec, J., Kessler, P., Procházka, V. et al. Krvácivé komplikace a předávkování antikoagulační léčby. Vnitř. Lék., 2009; 55, 3, s. 277–289.
V aktuálně publikované podobě byl text přijat jako doporučený postup péče Českou společností intenzivní medicíny ČLS JEP, Českou společností anesteziologie, resuscitace a intenzivní medicíny ČLS JEP a Českou společností klinické farmakologie ČLS JEP a v současné době je projednáván dalšími odbornými společnostmi.
Současně je k publikaci připravována zkrácená verze přehledného příručního letáku.Adresa ke korespondenci:
MUDr. Jaromír Gumulec
Ústav klinické hematologie FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: jaromir.gumulec@fnspo.cz
Zdroje
1. Geerts, W. H., Bergqvist, D., Pineo, G. F. et al. Prevention of Venous Thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 381–453.
2. National Institute for Health and Clinical Excellence. Reducing the risk of venous thromboembolism (deep vein thrombosis and pulmonary embolism) in inpatients undergoing surgery. NICE clinical guideline, 2008, 46, p. 1–160. Available at: http://www.nice.org.uk/CG046.
3. Kearon, C., Kahn, S. R., Agnelli, G. et al. Antithrombotic Therapy for Venous Thromboembolic Disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 1, p. 454–545.
4. Singer, D. E., Albers, G. W., Dalen, J. E. et al. Antithrombotic Therapy in Atrial Fibrilation: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 546–592.
5. Harrington, R. A., Becker, R. C., Cannon, Ch. P. et al. Antithrombotic Therapy for Non-ST Segment Elevation Acute Coronary Syndromes. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 670–707.
6. Goodman, Sh. G., Menon, V., Cannon, Ch. P. et al. Antithrombotic Therapy for Non-ST Segment Elevation Acute Coronary Syndromes. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 708–775.
7. Salem, D. N., O`Gara, P. T., Madias, Ch., Pauker, S. G. Valvular and Structural Heart Disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 593–629.
8. Shojania, K. G., Duncan, B. W., McDonald, M. M., Wachter, R. M. Making health care safer: a critical analysis of patient safety practices. Evidence Report/Technology Assessment No. 43 (Prepared by the University of California at San Francisco–Stanford Evidence-based Practice Center under Contract No. 290–97-0013), AHRQ Publication No. 01-E058, Rockville, MD: Agency for Healthcare Research and Quality. July 2001. Dostupné na www: http://www.ahrq. gov/clinic/ptsafety/. Accessed March 15, 2007.
9. Schulman, S., Beyth, R. J., Kearon, C., Levin, M. N. Hemorrhagic Complications of Anticoagulant and Thrombolytic Treatment: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 257–298.
10. Ng, H. J., Crowther, M. A. New anti-thrombotic agents: emphasis on hemorrhagic complications and their management. Semin Hematol., 2006, 43, p. 77–83.
11. Weitz, J. I., Hirsh, J., Samama, M. M. New Antithrombotic Drugs: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 234–256.
12. Hirsh, J., Bauer, K. A., Donati, M. B. et al. Parenteral Anticoagulans: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 141–159.
13. Crowther, M. A., Warkentin, T. E. Bleeding risk and the management of bleeding complications in patients undergoing anticoagulant therapy: focus on new anticoagulant agents. Blood, 2008, 111, p. 4871–4879.
14. Schulman, S., Kearon, C. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in nonsurgical patients. J. Thromb. Haemost., 2005, 3, p. 692–694.
15. Černý, V., Cvachovec, K., Kasal, M. et al. Zásady podpory koagulace u život ohrožujícího a neztišitelného krvácení. Dostupné na www: www.thrombosis.cz.
16. Worley, T. P., Heit, J. A., Pruthi, R. K. Bleeding disorders. In: Oliveira, G. H. M., Nesbitt, G. C., Murphy, J. G. Mayo Clinic Medical Manual. Rochester: Mayo Clinic Scientific Press, 2006, p. 41–54.
17. Laposata, M., Green, K., Elizabeth, M. et al. College of American Pathologists Conference XXXI on Laboratory Monitoring of Anticoagulant Therapy: the clinical use and laboratory monitoring of low-molecular-weight heparin, danaparoid, hirudin and related compounds, and argatroban. Arch. Pathol. Lab. Med., 1998, 122, p. 799–807.
18. Shanafelt, T. D., Fonseca, R. Thrombocytopenia. In: Oliveira, G. H. M., Nesbitt, G. C., Murphy, J. G. Mayo Clinic Medical Manual. Mayo Clinic Scientific Press. 2006, p. 259–269.
19. Fernandez, F., Nguyen, P., van Ryn, J. et al. Hemorrhagic doses of heparin and other glycosaminoglycans induce a platelet defect. Thromb. Res., 1986, 43, p. 491–495.
20. Blajchman, M. A., Young, E., Ofosu, F. A. Effects of unfractionated heparin, dermatan sulfate and low molecular weight heparin on vessel wall permeability in rabbits. Ann. NY Acad. Sci., 1989, 556, p. 245–253.
21. Crowther, M. A., Berry, L. R., Monagle, P. T., Chan, A. K. Mechanisms responsible for the failure of protamine to inactivate low-molecular-weight heparin. Br. J. Haematol., 2002,116, p. 178–186.
22. American Society of Health-System Pharmacists. Protamine sulfate: antiheparin agents: Bethesda, MD: American Society of Health-System Pharmacists, 1999. Dostupné na www:
http://www.ashp.org/mngrphs/Essentials/a382278e. htm.
23. Weiler, J. M., Gellhaus, M. A., Carter, J. G. et al. A prospective study of the risk of an immediate averse reaction to protamine sulfate during cardiopulmonary bypass surgery. J. Allergy Clin. Immunol., 1990, 85, p. 713–719.
24. Hirsh, J., Levine, M. Low molecular weight heparin. Blood, 1992, 79, p. 1–17.
25. Makris, M., Hough, R.E., Kitchen, S. Poor reversal of low molecular weight heparin by protamine. British Journal of Hematology, 2000, 108, p. 884–885.
26. Kessler, C. M. Current and future challenges of antithrombotic agents and anticoagulants: strategies for reversal of hemorrhagic complications. Semin Hematol., 2004, 41, p. 44–50.
27. Warkentin, T. E., Crowther, M. A. Reversing anticoagulants both old and new. Can. J. Anaesth., 2002, 49, p. S11–S25.
28. Deloughery, T. G. Management of acute hemorrhage. In: Colman, R. W., Marder, V. J., Clowes, A. W., George, J. N., Goldhaber, S. Z. eds. Hemostasis and Thrombosis: Basic Principles and Practice (ed 5). Philadelphia, PA: Lippincott, 2006, p. 1159–1171.
29. Levi, M., Bijsterveld, N. R., Keller, T. T. Recombinant factor VIIa as an antidote for anticoagulant treatment. Semin Hematol., 2004, 41, p. 65–69.
30. Lauritzen, B., Hedner, U., Johansen, P. B. et al. Recombinant human factor VIIa and a factor VIIa-analogue reduces heparin and low molecular weight heparin (LMWH)-induced bleeding in rats. J. Thromb. Haemost., 2008, 6, p. 804–811.
31. Crowther, M., Lim, W. Low molecular weight heparin and bleeding in patients with chronic renal failure. Curr. Opin. Pulm. Med., 2007, 13, p. 409–413.
32. Ng, H., Koh, L., Lee, L. Successful control of postsurgical bleeding by recombinant factor VIIa in a renal failure patient given low molecular weight heparin and aspirin. Ann. Hematom., 2003, 82, p. 257–258.
33. Boneu, B., Necciari, J., Cariou, R. et al. Pharmacokinetics and tolerance of the natural pentasaccharide (SR90107/ORG31540) with high affinity to antithrombin III in man. Thromb. Haemost., 1995, 74, p. 1468–1473.
34. Turpie, A. G., Bauer, K. A., Eriksson, B. I. et al. Fondaparinux vs enoxaparin for the prevention of venous thromboembolism in major orthopedic surgery: a metaanalysis of 4 randomized double-blind studies. Arch. Intern. Med., 2002, 162, p. 1833–1840.
35. Yusuf, S., Mehta, S. R., Chrolavicius, S. et al. Comparison of fondaparinux and enoxaparin in acute coronary syndromes. N. Engl. J. Med., 2006, 354, p. 1464–1476.
36. Gerotziafas, G. T., Depasse, F., Chakroun, T. et al. Recombinant factor VIIa partially reverses the inhibitory effect of fondaparinux on thrombin generation after tissue factor activation in platelet rich plasma and whole blood. Thromb. Haemost., 2004, 91, p. 531–537.
37. Lisman, T., Bijsterveld, N. R., Adelmeijer, J. et al. Recombinant factor VIIa reverses the in vitro and ex vivo anticoagulant and profibrinolytic effects of fondaparinux. J. Thromb. Haemost., 2003, 1, p. 2368-2373.
38. Bijsterveld, N., Moons, A., Boekholdt, S. et al. Ability of recombinant factor VIIa to reverse the anticoagulant effect of the pentasaccharide fondaparinux in healthy volunteers. Circulation, 2002, 106, p. 2550–2554.
39. Gumulec, J., Kessler, P., Penka, M. et al. Krvácivé komplikace při léčbě warfarinem. Vnitř Lék., 2006, 52, 1, p. 79–91.
40. Kessler, P. Farmakogenetika warfarinu. Vnitř Lék., 2006, 52, 1, p. 31–34.
41. Kessler, P. Léčba orálními antikoagulancii. Praha: Orion Pharma, 2002.
42. Matýšková, M., Penka, M. Interakce antikoagulačních léků s potravinami a potravinovými doplňky. Přehledný článek. Interní medicína pro praxi, 2000, 5, p. 29–33.
43. Beyth, R. J., Quinn, L. M., Landefeld, C. S. Prospective evaluation of an index for predicting risk of major bleeding in outpatients treated with warfarin. Am. J. Med., 1998, 105, p. 91–99.
44. Ansell, J., Hirsh, J., Hylek, E. et al. Pharmacology and Management of the Vitamin K Antagonists: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 160–198.
45. Gunneman, T., Ruybalid, R. L., Jacobson, A. K. et al. Frequent prothrombin time testing reduces inappropriate warfarin dose changes [abstract]. Thromb. Haemost., 1999, 82, suppl, p. 676.
46. Lousberg, T. R., Witt, D. M., Beall, D. G. et al. Evaluation of excessive anticoagulation in a group model health maintenance organization. Arch. Intern. Med., 1998, 158, p. 528–534.
47. Garcia, D. A., Regan, S., Crowther, M. et al. The risk of hemorrhage among patients with warfarin-associated coagulopathy. J. Am. Coll. Cardiol., 2006, 47, p. 804–808.
48. Hylek, E. M., Regan, S., Go, A. S. et al. Clinical predictors of prolonged delay in return of the international normalized ratio to within the therapeutic range after excessive anticoagulation with warfarin. Ann. Intern. Med., 2001, 135, p. 393–400.
49. Hirsh, J., Fuster, V., Ansell, J. et al. American Heart Association/American College of Cardiology Foundation guide to warfarin therapy. Circulation, 2003, 107, p. 1692–1711.
50. Crowther, M. A., Douketis, J. D., Schnurr, T. et al. Oral vitamin K lowers the international normalized ratio more rapidly than subcutaneous vitamin K in the treatment of warfarin associated coagulopathy. Ann. Intern. Med., 2002, 137, p. 251–254.
51. Baker, R. I., Coughlin, P. B., Gallus, A. S. et al. Warfarin reversal: consensus guidelines, of behalf of the Australasian Society of Thrombosis and Haemostasis. MJA, 2004, 181, p. 492–497.
52. Hanley, J. P. Warfarin reversal. J. Clin. Pathol., 2004, 57, p. 1132–1139.
53. Nitu, I. C., Perry, D. J., Lee, C. A. Clinical experience with the use of clotting factor concentrates in oral anticoagulation reversal. Clin. Lab. Haematol., 1998, 20, p. 363–367.
54. Aguilar, M. I., Hart, R. G., Kase, C. S. et al. Treatment of warfarin associated intracerebral hemorrhage: literature review and expert opinion. Mayo Clin. Proc., 2007, 82, p. 82–92.
55. Lankiewicz, M. W., Hays, J., Friedman, K. D. et al. Urgent reversal of warfarin with prothrombin complex concentrate. J. Thromb. Haemost., 2006, 4, p. 967–970.
56. Pabinger-Fasching, I. Warfarin-reversal: results of a phase III study with pasteurised, nanofiltrated prothrombin complex concentrate. Thromb. Res., 2008, 122, Suppl 2, p. S19–22.
57. Riess, H. B., Meier-Hellmann, A., Motsch, J. et al. Prothrombin complex concentrate (Octaplex) in patients requiring immediate reversal of oral anticoagulation. Thromb. Res., 2007, 121, 1, p. 9–16.
58. Cartmill, M., Dolan, G., Byrne, J. L., Byrne, P. O. Prothrombin complex concentrate for oral anticoagulant reversal in neurosurgical emergencies. Br. J. Neurosurg., 2000, 14, p. 458–461.
59. Makris, M., Greaves, M., Phillips, W. S. et al. Emergency oral anticoagulant reversal: the relative efficacy of infusions of fresh frozen plasma and clotting factor concentrate on correction of the coagulopathy. Thromb. Haemost., 1997, 77, p. 477–480.
60. Dentali, F., Ageno, W., Crowther, M. Treatment of coumarin--associated coagulopathy: a systematic review and proposed treatment algorithms. J. Thromb. Haemost., 2006, 4, p. 1853–1863.
61. DeZee, K. J., Shimeall, W. T., Douglas, K. M. et al. Treatment of excessive Anticoagulation With Phytonadione (Vitamin K): A meta-analysis. Arch. Intern. Med., 2006, 166, p. 391–397.
62. Warkentin, T. E., Greinacher, A., Koster, A., Lincoff, A. M. Treatment and Prevention of Heparin-Induced Thrombocytopenia: American College of Chest Physicians Evidence - -Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 340–380.
63. Preston, F. E., Laidlaw, S. T., Sampson, B. et al. Rapid reversal of oral anticoagulation with warfarin by a prothrombin complex concentrate (Beriplex): efficacy and safety in 42 patients. Br. J. Haematol., 2002, 116, p. 619–624.
64. Evans, G., Luddington, R., Baglin, T. Beriplex P/N reverses severe warfarin induced overanticoagulation immediately and completely in patiens presenting with major bleeding. Br. J. Haematol., 2001, 115, p. 998–1001.
65. Yasaka, M., Sakata, T., Naritomi, H. et al. Optimal dose of prothrombin complex concentrate for acute reversal of oral anticoagulation. Thromb. Res., 2005, 115, p. 455–459.
66. Deveras, R. A., Kessler, C. M. Reversal of warfarin induced excessive anticoagulation with recombinant human factor VIIa concentrate. Ann. Intern. Med., 2002, 137, p. 884–888.
67. Freeman, W. D., Brott, T. G., Barrett, K. M. et al. Recombinant factor VIIa for rapid reversal of warfarin anticoagulation in acute intracranial hemorrhage. Mayo Clin. Proc., 2004, 79, p. 1495–1500.
68. Sorensen, B., Johansen, P., Nielsen, G. L. et al. Reversal of the International Normalized Ratio with recombinant activated factor VII in central nervous system bleeding during warfarin thromboprophylaxis: clinical and biochemical aspects. Blood Coagul. Fibrinolysis, 2003, 14, p. 469–477.
69. Erhardtsen, E., Nony, P., Dechavanne, M. et al. The effect of recombinant factor VIIa (NovoSeven) in healthy volunteers receiving acenocoumarol to an International Normalized Ratio above 2.0. Blood Coagul. Fibrinolysis, 1998, 9, p. 741–748.
70. Mayer, S. A., Brun, M. C., Begtrup, K. et al. Recombinant activated factor VII for acute intracererbral hemorrhage. N. Engl. J. Med., 2005, 352, p. 277–285.
71. Mayer, S. A. Recombinant activated factor VII for acute intracerebral hemorrhagie. Strok, 2007, 38, p. 63–64.
72. Mayer, S. A., Brun, M. C., Begtrup, K. et al. Efficacy and safety of recombinant activated factor VII for acute intracerebral hemorrhagie. N. Engl. J. Med., 2008, 15, p. 2127–2137.
73. Ehrlich, H. J., Henzl, M. J., Gomperts, E. D. Safety of factor VIII inhibitor bypass activity (FEIBA): 10 year compilation of thrombotic adverse events. Haemophilia, 2002, 8, p. 83–90.
74. Makris, M., Watson, H. G. Reversal of coumarin-induced over-anticoagulation: reply to Escobar. Br. J. Haematol., 2002, 118, p. 926.
75. Douketis, J. D., Berger, P. B., Dunn, A. S. et al. The Perioperative Management of Antithrombotic Therapy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest, 2008, 133, p. 299–339.
76. Weitz, J. I., Crowther, M. Direct thrombin inhibitors. Tromb. Res., 2002, 106, p. V275–V284.
77. Bauer, K. A. New Anticoagulants. Hematology Am. Soc. Hematom. Educ. Program. 2006, p. 450–456.
78. Mahdy, A. M., Webster, N. R. Perioperative systemic haemostatic agents. Br. J. Anaesth., 2004, 93, p. 842–858.
79. Mannucci, P. M., Bettega, D., Cattaneo, M. Patterns of development of tachyphylaxis in patients with haemophilia and von Willebrand disease after repeated doses of desmopressin (DDAVP). Br. J. Haematol., 1992, 82, p. 87–93.
80. Ibbotson, S. H., Grant, P. J., Kerry, R. et al. The influence of infusions of 1-desamino-8-D-arginine vasopressin (DDAVP) in vivo on the anticoagulant effect of recombinant hirudin (CGP39393) in vitro. Thromb. Haemost., 1991, 65, p. 64–66.
81. Bove, C. M., Casey, B., Marder, V. J. DDAVP reduces bleeding during continued hirudin administration in the rabbit. Thromb. Haemost., 1996, 75, p. 471–475.
82. Fischer, K. G. Hemodialysis in heparin-induced thrombocytopenia. In: Warkentin, T. E., Greinacher, A., eds. Heparin-Induced Thrombocytopenia (ed 4). New York, NY: Informa Healthcare, 2007, p. 463–485.
83. Stangier, J. Clinical pharmacokinetics and pharmacodynamics of the oral direct thrombin inhibitor dabigatran etexilate. Clin. Pharmacokinet., 2008, 47, p. 285–295.
84. Stangier, J., Stahle, H., Rathgen, K. et al. Pharmacokinetics and pharmacodynamics of the direct oral thrombin inhibitor dabigatran in healthy elderly subjects. Clin. Pharmacokinet., 2008, 47, p. 47–59.
85. Kvasnička, J., Slíva, J. Dabigatran. Farmakoterapie, 2008, 4, p. 359–364.
86. Souhrn údajů o přípravku Xarelto. SÚKL Praha, 2008.
87. Ho, K. M., Ismail, H. Use of intravenous tranexamic acid to reduce allogeneic blood transfusion in total hip and knee arthroplasty: a meta-analysis. Anaesth. Intensive Care, 2003, 31, p. 529–537.
88. Niskanen, R. O., Korkala, O. L. Tranexamic acid reduces blood loss in cemented hip arthroplasty: a randomized, double-blind study of 39 patients with osteoarthritis. Acta Orthop., 2005, 76, p. 829–832.
89. Barthels, M., Poliwoda, H. Gerinnungsanalysen. Interpretation – Schlellorientierung – Therapiekontrollen. 4. überarbeitete und erweiterte Auflage. Thieme, 1993, p. 150–151, 226–234.
90. Chlumský, J. et al. Antikoagulační léčba. Grada: Praha, 2005.
91. Choudari, C. P., Palmer, K. R. Acute gastrointestinal haemorrhage in patients treated with anticoagulant drugs. Gut, 1995, 36, p. 483–484.
92. Vreeburg, E. M., de Bruijne, H. W., Snel, P. et al. Previous use of non-steroidal anti-inflammatory drugs and anticoagulants: The influence on clinical outcome of bleeding gastroduodenal ulcers. European J. Gastroenterol. Hepatol., 1997, 9, p. 41–44.
93. Kim, K. et al. Acute gastrointestinal bleeding – diagnosis and treatment. Humana Press : New Jersey, 2003.
94. Dítě et al. Akutní nevarikózní krvácení do horní části trávicího ústrojí. In:Akutní stavy v gastroenterologii. Praha: Galen, 2005.
95. Palmer, K. Management of haematemesis and melaena. BMJ, 2005, 1, p. 399–404.
96. Thomopoulos, K. C., Theocharis, G. J., Nikolopoulou, V. N. et al. Acute upper gastrointestinal bleeding in patiens on long-term oral anticoagulation therapy: Endoscopic findings, clinical management and outcome. World J. Gastroenterol., 2005, 11, 9, p. 1365–1368.
97. Keil, R. a kol. Gastroskopie. Maxdorf : Praha, 2006.
98. Kohout, P. Vředová choroba. Maxdorf : Praha, 2005.
99. Machytka, E., Ehrmann, J., Svoboda, P. et al. Dlouhodobé sledování pacientů s klinickými známkami krvácení do horní části trávicího traktu a negativním endoskopickým nálezem. Vnitřní lék., 2007, 53, 9, p. 942–946.
100. Machytka, E., Ehrmann, J., Svoboda, P. et al. Incidence krvácení do horní části zažívacího traktu v regionu Ostrava-Poruba v letech 2002–2005. Čes. a Slov. Gastroent. a Hepatol., 2007, 61, 3, p. 124–128.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Co přinesl rok 2009?Článek Primář MUDr. Jiří DostálČlánek Mitigace pandemie chřipkyČlánek JMENNÝ REJSTŘÍKČlánek VĚCNÝ REJSTŘÍK
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2009 Číslo 6- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Co přinesl rok 2009?
- Kam směřuje Česká společnosti intenzivní medicíny v nejbližších letech?
- Perkutánní implantace aortální chlopně z pohledu anesteziologa
- Kontinuální versus intermitentní podání vankomycinu u grampozitivních infekcí rezistentních na beta-laktamová antibiotika u nemocných v intenzivní péči
- Prognostické faktory výsledku léčby komunitní purulentní meningitidy dospělých
- Krvácivé komplikace a předávkování antikoagulační léčby
- Etické problémy při poskytování neodkladné péče
- The development of intensive care medicine in Israel from its creation until today
- Primář MUDr. Jiří Dostál
- Blahopřání doc. MUDr. Adolfě Scheinarové, CSc., k životnímu jubileu
- Mitigace pandemie chřipky
- JMENNÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Krvácivé komplikace a předávkování antikoagulační léčby
- Etické problémy při poskytování neodkladné péče
- Kontinuální versus intermitentní podání vankomycinu u grampozitivních infekcí rezistentních na beta-laktamová antibiotika u nemocných v intenzivní péči
- Primář MUDr. Jiří Dostál
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




