-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaiNO v léčbě akutního respiračního selhání novorozenců – srovnání efektu kombinace s CMV a HFOV
iNO in acute respiratory failure of the newborns. A comparison of its combination with CMV and HFOV
Objective:
To compare the effect of inhaled nitric oxide (iNO) combined with conventional mechanical ventilation (CMV) or high-frequency oscillatory ventilation (HFOV) on oxygenation and ventilation parameters, complications rates and mortality in newborns with acute hypoxic respiratory failure (AHRF).Design:
A prospective observational study.Setting:
The Paediatric Anaesthesia and Intensive Care Clinic, University Hospital Brno, and The Paediatric and Adolescent Medicine Clinic, General University Hospital, Prague.Materials and methods:
We enrolled in the study newborns with persistent pulmonary hypertension (PPHN) or acute respiratory distress syndrome (ARDS) without congenital heart disease in whom CMV or HFOV had failed. The newborns were divided in the CMV or HFOV groups according to the type of ventilation during iNO therapy. We recorded the following characteristics: the demographic data, duration of hospitalization, mechanical ventilation and iNO therapy, ARDS origin, diagnosis, outcome, iNO concentration; oxygenation, ventilation and acid-base parameters, ventilator settings and complications due to iNO.Results:
We enrolled 25 newborns. We recorded a temporary improvement in oxygenation in both the groups and in particular in the HFOV group. We did not record any improvement in the ventilation and acid-base parameters. We did not observe an effect on the ventilator settings except for a comparable decrease of FiO2 in both the groups. We did not record any adverse effects. Total mortality was 4%.Conclusion:
Both the therapeutic combinations improve oxygenation in the newborns with AHRF. HFOV has an additive effect on oxygenation. Either combination did not influence the ventilation or acid-base parameters. Both the methods provided for a similar reduction of FiO2 with no effect on the other ventilator settings. We observed the same low probability of adverse effects of administering iNO up to 20 ppm in both combinations. Either combination did not influence the mortality in neonates with AHRF.Keywords:
nitric oxide, newborns – Acute Respiratory Failure – oxygenation – Conventional Mechanical Ventilation – High Frequency Oscilatory Ventilation
Autoři: Lukáš Marek 1; Vobruba Václav 2; Košut Peter 1; Srnský Pavel 2; Žurek Jiří 1; Koudelková Ludmila 1; Košinová Lucie 1; Fedora Michal 1
Působiště autorů: Klinika dětské anesteziologie a resuscitace Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno 1; Jednotka intenzivní a resuscitační péče Kliniky dětského a dorostového lékařství Všeobecné fakultní nemocnice v Praze 2
Vyšlo v časopise: Anest. intenziv. Med., 20, 2009, č. 4, s. 176-184
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cíl studie:
Porovnat vliv kombinace inhalace oxidu dusnatého (iNO) s konvenční mechanickou ventilací (CMV) a iNO s vysokofrekvenční oscilační ventilací (HFOV) na oxygenační a ventilační parametry, četnost komplikací a letalitu novorozenců s akutním hypoxickým respiračním selháním (AHRF).Typ studie:
Prospektivní observační studie.Název a sídlo pracoviště:
Kliniky dětské anesteziologie a resuscitace.Materiál a metoda:
Do studie byli zařazeni novorozenci s perzistující plicní hypertenzí (PPHN) nebo akutním syndromem dechové tísně (ARDS) bez vrozené srdeční vady, u kterých selhaly CMV nebo HFOV. Novorozenci byli rozděleni podle způsobu ventilace v průběhu iNO na skupinu CMV a HFOV. Zaznamenány byly: demografické údaje, délka hospitalizace, ventilace a iNO, původ ARDS, diagnóza, přežití, koncentrace NO, oxygenační a ventilační parametry, parametry acidobazické rovnováhy (ABR), nastavení ventilačních režimů a komplikace iNO.Výsledky:
Do studie bylo zařazeno 25 novorozenců. V obou skupinách jsme zaznamenali přechodné zlepšení oxygenace, výrazněji u HFOV. Nezaznamenali jsme zlepšení ventilačních ani ABR parametrů. Kromě srovnatelného snižování FiO2 jsme v žádné skupině neprokázali vliv na nastavení ostatních parametrů umělé plicní ventilace (UPV). Nezaznamenali jsme žádné nežádoucí účinky iNO. Celková letalita byla 4%.Závěr:
Kombinace obou metod zlepšuje oxygenaci novorozenců s AHRF. HFOV má na oxygenaci aditivní účinek. Žádná kombinace neovlivňuje ventilační ani ABR parametry. Obě kombinace umožňují srovnatelné snižování FiO2, bez vlivu na nastavení zbývajících parametrů UPV. V koncentracích iNO do 20 ppm je stejně nízké riziko vzniku nežádoucích účinků u obou metod ventilace. Žádná kombinace nemá vliv na letalitu novorozenců s AHRF.Klíčová slova:
oxid dusnatý – novorozenci – akutní respirační selhání – oxygenace – konvenční mechanická ventilace – vysokofrekvenční oscilační ventilaceÚvod
Inhalovaný oxid dusnatý (iNO), jako selektivní plicní vazodilatátor, provází léčbu akutního hypoxického respiračního selhání již od počátku 90. let minulého století. Prvotní nadšení z jeho účinku na oxygenaci [1, 2] vystřídala skepse z výsledků metaanalýz randomizovaných klinických studií prokazujících, že použití iNO nemá vliv na snížení letality pacientů s těžkým respiračním selháním[3]. Stále častěji bylo poukazováno na nemožnost prokázat vliv iNO na letalitu, protože pacienti s respiračním selháním neumírají na samotné respirační selhání, ale většinou pod obrazem multiorgánového selhání či sepse [4]. Primární cíle následujících studií se tak začaly ubírat jiným směrem. Nedávno publikovaná studie měla např. za cíl srovnání novorozenců s respiračním selháním na podkladě perzistující plicní hypertenze (PPHN) léčených iNO s pacienty kontrolních skupin (extrakorporální oxygenace – ECMO, CMV) z hlediska ovlivnění plicních funkcí 1 rok po léčbě [5]. Její výsledky jsou velmi zajímavé a pro inhalovaný oxid dusnatý pozitivní. V tomto smyslu nastává jistá renesance použití inhalovaného oxidu dusnatého v léčbě akutního hypoxického respiračního selhání a do jisté míry i rehabilitace, kterou si tento výjimečný plyn bezesporu zaslouží. Zároveň podobné studie naznačují směr, kterým by se v budoucnu měly ubírat práce hodnotící efekt látek ovlivňujících plicní vaskulární rezistenci.
Primárním cílem naší studie bylo srovnat efekt kombinace iNO s mechanickou ventilací (CMV) a kombinace iNO s vysokofrekvenční oscilační ventilací (HFOV) na oxygenační a ventilační parametry novorozenců s těžkým akutním hypoxickým respiračním selháním (AHRF). Dalšími cíly bylo porovnat četnost komplikací (oběhová nestabilita, plicní edém, methemoglobinémie, netraumatické krvácení) u obou kombinací a porovnat vliv zmíněných kombinací na letalitu pacientů s AHRF.
Soubor pacientů a metoda
Do studie byli zařazeni novorozenci s diagnózou těžkého akutního hypoxemického repiračního selhání (AHRF) na podkladě perzistující plicní hypertenze novorozenců (PPHN) nebo akutního syndromu dechové tísně (ARDS) podle kritérií ACCP Consensus conference z roku 1994 [6]: Náhlý vznik, PaO2/FiO2 < 200 mm Hg, bilaterální plicní infiltráty na RTG a PCWP ≤ 18 mm Hg nebo nepřítomnost levostranného srdečního selhání, u kterých selhaly CMV nebo HFOV. Vylučovacím kritériem studie byla sonograficky prokázaná vrozená srdeční vada.
Studie probíhala souběžně na Klinice dětské anesteziologie a resuscitace FN Brno a Klinice dětského a dorostového lékařství VFN v Praze v letech 1997 až 2007. Všichni novorozenci byli léčeni podle stejného protokolu ALI/ARDS [7] používaného na obou pracovištích od roku 1997.
Protokol zahrnuje konvenční mechanickou ventilaci (tlakově řízenou CMV s PEEP a s recruitment manévry: sigh ventilací) s permisivní hyperkapnií, polohování pacienta (pronační poloha), aplikaci inhalovaného oxidu dusnatého (iNO), tracheální insuflaci vzduchu (TGI), vysokofrekvenční oscilační ventilaci (HFOV), parciální kapalinovou ventilaci (Partial Liquid Ventilation, PLV) a extrakorporální membranózní oxygenaci (ECMO). Strategie konvenční ventilace byla založena na principech protektivní plicní ventilace a vychází z doporučení ACCP (American College of Chest Physicians) z roku 1994 [6].
Oxygenaci jsme ovlivňovali manipulací s FiO2, středním tlakem v dýchacích cestách (Paw), který jsme zvyšovali pomocí PEEP, případně prodloužením doby inspiria, tj. změnou poměru inspiria k exspiriu. Kromě manipulace s PEEP byly k otevření atelektatických plicních oblastí prováděny otevírací (recruitment) manévry ve formě „sigh“ ventilace.
Ventilaci jsme prováděli dechovými objemy Vt < 7 ml/kg, PIP jsme limitovali hodnotou 30 cm H2O. Při nutnosti zvyšovat PEEP a při dosažení maximálního PIP (při snižování rozdílu tlaků v dýchacích cestách) byly tolerovány snižující se hodnoty dechového objemu blížící se 3 ml/kg při pH nad 7,20. Při vzestupu paCO2 > 10 kPa a/nebo poklesu pH pod 7,20 byla aplikována tracheální insuflace plynu (TGI).
Indikací k přepojení pacienta z konvenční mechanické ventilace na vysokofrekvenční oscilační ventilaci byla nutnost použít FiO2 > 0,6 a Paw > 15 cm H2O k dosažení saturace periferní krve ≥ 90 % nebo přetrvávající hyperkapnie a/nebo acidóza při konvenční ventilaci s tracheální insuflací vzduchu.
V případě selhání výše zmíněných metod, tedy v případě, že nedošlo ke zlepšení poměru PaO2/FiO2 nebo došlo k jeho zhoršení (PaO2/FiO2 < 100 mm Hg), jsme provedli (pokud se tak nestalo v předchozím průběhu hospitalizace) echokardiografické vyšetření k vyloučení dosud nediagnostikované zkratové srdeční vady a v negativním případě jsme aplikovali inhalovaný oxid dusnatý (iNO). Tímto okamžikem byl pacient zařazen do naší studie.
Počáteční dávka iNO byla 1 ppm. Následně byla dávka iNO zvyšována po 15 minutách, a to na 5, 10, 15 a 20 ppm s cílem zvýšit PaO2/FiO2 o ≥ 20 %. Limitací zvyšování koncentrace iNO byla hladina methemoglobinu ≥ 5 %, klinické a/nebo RTG známky vzniku či zhoršení plicního edému a/nebo krvácivých projevů. Ukončení iNO (postupné snižování koncentrace) bylo umožněno po dosažení akceptovatelných parametrů oxygenace.
Pacienti byli rozděleni podle způsobu ventilace bezprostředně před nasazením a v průběhu převážné části inhalace iNO na pacienty na konvenční ventilaci (CMV) a na vysokofrekvenční oscilaci (HFOV). U všech pacientů byly zaznamenány: pohlaví (mužské – m, ženské – ž), věk (dny), hmotnost (kg), celková doba hospitalizace (dny), doba ventilace (hodiny), celková doba ventilace (UPV), doba konvenční mechanické ventilace (CMV), doba vysokofrekvenční oscilační ventilace (HFOV), délka iNO (hodiny), původ ARDS (plicní – P, mimoplicní – M), kategorie primární diagnózy (interní – M, chirurgická – S, traumatologická – T, onkologická – O), závažnost stavu s predikcí letality (CRIB – clinical risk index for babies [8]), přežití, koncentrace iNO (ppm), laboratorní měřené parametry (pH, paCO2, paO2, HCO3-), počítané parametry (AaDO2, Horowitzův index – PaO2/FiO2, oxygenační index – OI = Paw . FiO2 . 100/paO2), parametry umělé plicní ventilace (u CMV – FiO2, frekvence RR (min-1), dechový objem Vt (l), PIP (cm H2O), Paw (cm H2O), PEEP (cm H2O) a u HFOV – FiO2, frekvence f (Hz), amplituda tlaku ∆P (cm H2O), Paw (cm H2O)) a komplikace iNO (po nasazení či zvýšení koncentrace – oběhová nestabilita, vznik či zhoršení plicního edému, methemoglobinémie a krvácivé epizody).
Koncentrace iNO, laboratorní měřené parametry, počítané parametry, parametry umělé plicní ventilace a komplikace iNO byly zaznamenávány v čase 0 hod. (nejdéle 1 hodinu před nasazením iNO) a dále pak v čase 1, 6, 12, 24, 36, 48, 72 a 96 h po nasazení iNO. Tyto parametry jsou dále v textu souhrnně označovány jako indexované parametry.
Veškeré testy byly matematicky vyhodnoceny profesionálním statistickým softwarovým nástrojem STATISTICA verze 8.0.
Pro zjištění rozdílů v indexovaných a neindexovaných parametrech mezi výše zmíněnými skupinami jsme použili Mannův-Whitneův U-test. Pro zjištění rozdílů indexovaných parametrů uvnitř jednotlivých skupin průběžně oproti předchozí hodnotě a hodnotě parametru v čase 0 h jsme zvolili Wilcoxonův párový test. Za statisticky významnou byla považována hodnota p < 0,05.
Výsledky
Do studie bylo zařazeno celkem 25 novorozenců. Všichni novorozenci byli zralí, narození v termínu. Výjimkou byl jeden novorozenec narozený téměř v termínu (late-preterm, near-term) zmíněný níže. Lehký stupeň nezralosti tohoto novorozence nebyl kontraindikací použití iNO.
Nejčastější příčinou respiračního selhání (celkem 18 případů) byla perzistující plicní hypertenze novorozenců (PPHN) ve 4 případech spojená s onemocněním hyalinních membrán (Hyaline Membrane Disease – HMD), ve 3 případech spojená se syndromem aspirace mekonia (Meconium Aspiration Syndrome – MAS), ve 3 případech spojená s asfyxií a v jednom případě s prematuritou.
U 3 novorozenců byla příčinou respiračního selhání adnátní pneumonie (z aspirace plodové vody), u dalších 2 novorozenců asfyxie, u 1 novorozence aspirační pneumonie (z aspirace mateřského mléka) a u 1 novorozence plicní apoplexie při renovaskulární hypertenzi.
Základní údaje o všech pacientech uvádí tabulka 1.
Tab. 1. Novorozenci demografická data, délka ventilací, délka iNO, CRIB skóre 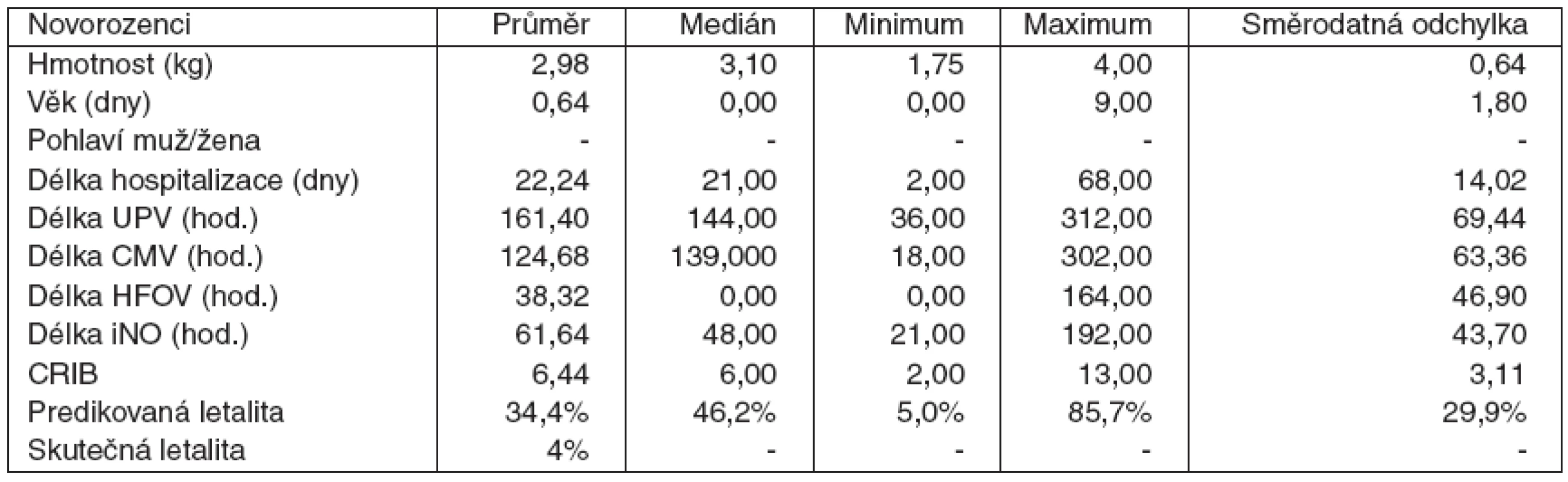
V popisných datech se obě skupiny novorozenců lišily pouze v délce HFOV. Tento rozdíl byl dán samotným rozdělením obou skupin a nemá tudíž žádný klinický význam (tab. 2).
Tab. 2. Rozdíly mezi podskupinami Novorozenci-CMV a Novorozenci-HFOV 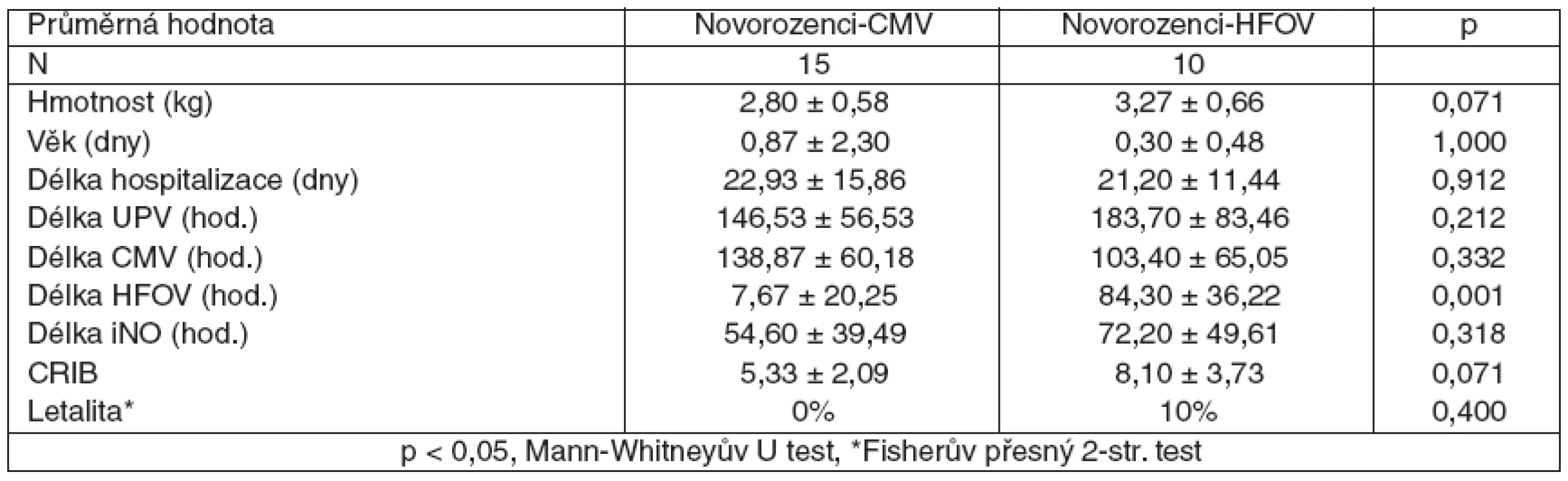
Ve srovnání hladin iNO nebyly mezi oběma skupinami statisticky významné rozdíly (graf 1). U pacientů na CMV jsme mohli postupně snižovat iNO statisticky významně od 6. do 48. hodiny. U pacientů na HFOV bylo snižování iNO statisticky významné ve 12. a 24. hodině.
Graf 1. Srovnání průběhu koncentrací iNO mezi CMV a HFOV 
Ve vývoji FiO2 nebyly mezi oběma skupinami statisticky významné rozdíly (graf 2). U pacientů na CMV jsme mohli po počátečním zvýšení postupně snižovat FiO2, přičemž ve 12. a 36. hodině byla hodnota parametru významně nižší než před nasazením iNO. U pacientů na HFOV jsme rovněž mohli po nasazení iNO postupně snižovat FiO2, přičemž mezi 6. a 36. hodinou byly hodnoty parametru významně nižší než před nasazením iNO.
Graf 2. Srovnání průběhu FiO<sub>2</sub> mezi CMV a HFOV 
Ve vývoji pH nebyly mezi oběma skupinami, ani uvnitř jednotlivých skupin zaznamenány statisticky významné rozdíly (graf 3).
Graf 3. Srovnání průběhu pH mezi CMV a HFOV 
Ve vývoji paCO2 se obě skupiny lišily v 6. a 12. hodině, kdy pacienti na CMV měli hodnotu tohoto parametru významně vyšší než pacienti na HFOV (graf 4). Uvnitř jednotlivých skupin nebyly statisticky významné změny paCO2 v čase.
Graf 4. Srovnání průběhu paCO<sub>2</sub> mezi CMV a HFOV 
Obě skupiny se v paO2 statisticky významně lišily pouze v 1. hodině (graf 5). U pacientů na CMV byla hodnota paO2 významně vyšší ve 12.–36. hodině oproti hodnotě před nasazením iNO. U pacientů na HFOV byla hodnota parametru významně vyšší v 6. a 36. hodině oproti hodnotě před nasazením iNO.
Graf 5. Srovnání průběhu paO<sub>2</sub> mezi CMV a HFOV 
Pacienti na CMV a na HFOV se ve vývoji HCO3- významně lišily pouze v 6. hodině (graf 6). Změny tohoto parametru uvnitř obou skupin nebyly statisticky významné.
Graf 6. Srovnání průběhu HCO<sub>3</sub><sup>-</sup> mezi CMV a HFOV 
Ve vývoji AaDO2 nebyly mezi oběma skupinami statisticky významné rozdíly (graf 7). U pacientů na CMV docházelo po počátečním zvýšení AaDO2 k postupnému snižování tohoto parametru, přičemž v době 12–36 hodin byla hodnota parametru významně nižší než před nasazením iNO. Po 48. hodině pak došlo k opětovnému zvýšení AaDO2. U pacientů na HFOV docházelo k postupnému snižování AaDO2 ihned po nasazení iNO, přičemž v době 6–36 hodin byly hodnota parametru významně nižší než před nasazením iNO.
Graf 7. Srovnání průběhu AaDO<sub>2</sub> mezi CMV a HFOV 
Ve vývoji PaO2/FiO2 nebyl mezi oběma skupinami statisticky významný rozdíl (graf 8). U pacientů na CMV docházelo po počátečním snížení PaO2/FiO2 k postupnému zvyšování tohoto parametru, přičemž v době 12–36 hodin byla hodnota parametru významně vyšší než před nasazením iNO. Po 48. hodině došlo k opětovnému snížení PaO2/FiO2. U pacientů na HFOV docházelo k postupnému zvyšování PaO2/FiO2 ihned po nasazení iNO, přičemž v době 6–36 hodin byla hodnota parametru významně vyšší než před nasazením iNO.
Graf 8. Srovnání průběhu paO<sub>2</sub>/FiO<sub>2</sub> mezi CMV a HFOV 
Pacienti na HFOV měli statisticky významně vyšší vstupní hodnotu OI než pacienti na CMV. Po zavedení iNO se významně lišili znovu až ve 36. hodině (graf 9). U pacientů na CMV po počátečním zvýšení docházelo ke snižování OI až do 48. hodiny, po které se OI opět zvýšilo, přičemž ve 24. a 36. hodině byla hodnota OI významně nižší než před nasazením iNO. U pacientů na HFOV docházelo od počátku iNO ke snižování OI, přerušenému přechodným zvýšením ve 48. hodině, přičemž v době 1–36 hodin byla hodnota OI významně nižší než před nasazením iNO.
Graf 9. Srovnání průběhu OI mezi CMV a HFOV 
Během iNO jsme u oběhově stabilních pacientů obou skupin (CMV, HFOV) nezaznamenali pokles systémového krevního tlaku a u pacientů oběhově nestabilních jsme nezaznamenali potřebu zvyšovat dávky inotropních a vazoaktivních farmak v časové souvislosti s nasazením či zvyšováním koncentrace iNO. Z tohoto pohledu tedy můžeme vyloučit rozdílný vliv iNO s CMV a iNO s HFOV na stabilitu systémového krevního oběhu.
U žádného z pacientů obou skupin nebyl v průběhu inhalace iNO zaznamenán vznik či zhoršení plicního edému. U pacientů, u kterých došlo během iNO ke zhoršení oxygenačních parametrů, neprokázal RTG snímek plic zhoršení nálezu oproti snímku před nasazením iNO.
Hladiny methemoglobinu se u všech pacientů studie v celém průběhu aplikace iNO pohybovaly pod 2 % celkového množství hemoglobinu. Aplikované koncentrace iNO ≤ 20 ppm (výjimečně přechodně u čtyř pacientů 40 ppm) tedy nevedly ke vzniku methemoglobinémie (metHb > 5% celkového hemoglobinu).
U žádného z pacientů studie nebyl v průběhu inhalace NO zaznamenán vznik krvácení nebo zhoršení poruchy hemostázy diagnostikované před nasazením iNO.
Diskuse
Od roku 1992, kdy je oxid dusnatý používán v léčbě novorozenců a dětí s těžkým respiračním selháním, byla publikována celá řada prací prokazujících vliv iNO na zlepšení oxygenačních parametrů. Ve studii Wessel et al. [9] je dokumentováno statisticky významné zlepšení paO2/FiO2 a OI u novorozenců v 15. minutě po nasazení iNO oproti kontrolní skupině a dále statisticky významně nižší hodnota OI v 1., 2., 6., 12. a 24. hodině iNO oproti kontrolní skupině. Studie Davidson et al. [10] uvádí stejné zlepšení oxygenace u novorozenců, a to po 30 minutách od nasazení iNO významně vyšší hodnotu paO2 (bez manipulace s FiO2 a Paw) a dále v rozmezí 1–24 hodin významně nižší hodnotu OI ve skupině iNO oproti kontrolní skupině.
U novorozenců zařazených v naší studii bylo zlepšení OI statisticky významné v době 1–36 hodin (HFOV) a 12–36 hodin (CMV) a zlepšení AaDO2 a PaO2/FiO2 v době 6–36 hodin (HFOV) a 12–36 hodin (CMV). Po 36. hodině již ke zlepšování oxygenace docházelo pouze ve skupině HFOV, nicméně stejně jako u novorozenců skupiny CMV nebyly po této době parametry oxygenace statisticky významně lepší než před nasazením NO. Vzhledem ke statisticky významně vyšší vstupní hodnotě OI a dynamice zlepšování tohoto parametru ve skupině HFOV je nutno přiznat větší benefit kombinaci iNO s HFOV oproti iNO s CMV. Aditivní účinek HFOV na oxygenaci je plně ve shodě s publikovanými pracemi [11]. Zpožděný účinek iNO v kombinaci s CMV oproti jiným studiím (významné zlepšení OI až po 12 hodině), provázený navíc přechodným zhoršením průměrné hodnoty tohoto parametru v 1 hodině po nasazení iNO, nemůžeme uspokojivě vysvětlit.
U obou skupin pacientů studie bez rozdílu inhalovaný NO neovlivňoval ventilační parametry ani acidobazickou rovnováhu (paCO2, pH a HCO3-). V současnosti není dostatek důkazů, že iNO ovlivňuje ventilační parametry v průběhu UPV. Možné vysvětlení lze vyvodit ze schopnosti CO2snadněji difundovat přes alveolokapilární membránu, a tudíž oproti O2 menší závislosti na celkové ploše účastnící se výměny plynů v plicích.
Z hlediska nastavení ventilačních režimů nám iNO prokazatelně umožnil postupně snižovat pouze FiO2 (vztaženo k hodině 0 – před nasazením iNO) jak ve skupině Novorozenci-CMV, tak ve skupině Novorozenci - -HFOV bez významného rozdílu mezi skupinami. V současné době nejsou k dispozici důkazy, že by iNO ovlivňoval nastavení ventilačních režimů. Za tímto výsledkem je nutno spatřovat snahu o co nejčasnější možné snižování koncentrace iNO na úkor manipulace s nastavením ventilátorů upřednostňované většinou autorů podobných studií. Jedinou výjimkou je snižování FiO2 ve snaze vyhnout se toxickým účinkům jeho vysokých koncentrací. Otázkou zůstává, zda-li je vůbec možné prokázat vliv iNO na nastavení ventilačních režimů vzhledem k určité setrvačnosti procesu poškození plicní tkáně mediátory SIRS. V době, kdy se vaskulární plicní aparát zotavuje a postupně se zvyšuje homogenita perfuze, přetrvává postižení zbývající plicní tkáně ve smyslu stále významných rozdílů v regionální plicní poddajnosti a jakákoli snaha o manipulaci s Paw by v tuto chvíli vedla ke zhoršení distribuce ventilace. Opoždění reparace zbývající plicní tkáně za reparací cévní složky tak v podstatě znemožňuje prokázání výše zmíněného vlivu iNO.
Z hlediska komplikací můžeme na základě našich výsledků vyloučit vliv iNO v koncentracích do 20 ppm na stabilitu systémového krevního oběhu. Studie Davidsona et al. [10] sice udává vznik hypotenze u 3 ze 114 novorozenců léčených iNO (u dvou novorozenců při koncentraci iNO 5 ppm a u jednoho novorozence při koncentraci 80 ppm), nicméně zde nebyl statisticky významný rozdíl oproti kontrolní skupině.
Co se týká rizika methemoglobinémie, dávky iNO ≤ 20 ppm s vysokou pravděpodobností nevedou ke vzniku methemoglobinémie (metHb > 5% celkového hemoglobinu). Studie Wessela et al. [9] udává průměrnou maximální hladinu metHb 1,7 %, pouze u jednoho novorozence (z 26) této studie při koncentraci inhalovaného NO 80 ppm byla hladina 17 %, a to ve 25. hodině léčby. Pro srovnání studie Davidsona et al. [10] uvádí hladiny metHb nad 7 % celkového Hb u 13 novorozenců (ze 114) ve skupině zralých novorozenců, která inhalovala NO v koncentraci 80 ppm, a to mezi 8–12 hodinou. Nejvyšší hladina byla 11,9 % v 8. hodině u 1 novorozence. Ve skupinách inhalujících 20 a 5 ppm nepřekročila hladina metHb v průběhu terapie 1,5 % celkového Hb.
Dávky iNO do 20 ppm je možno z hlediska rizika vzniku krvácení považovat za bezpečné. Ve studii Wessel et al. [9] bylo zaznamenáno 8 intrakraniálních krvácení u iNO skupiny (26 novorozenců), oproti 4 krvácením u kontrolní skupiny (23 novorozenců). Ve studii Davidsona [10] bylo zmíněno drobné intrakraniální krvácení (diagnostikované USG mozku) v průběhu iNO u 5 % novorozenců. Ve srovnání počtu krvácení s kontrolními skupinami obou studií nebyl shledán statisticky významný rozdíl.
V průběhu iNO je nepravděpodobný vznik či zhoršení plicního edému. Žádná ze zmíněných studií [9, 10] neudávala vznik či zhoršení plicního edému v průběhu iNO.
V naší studii jsme nezaznamenali výskyt žádné z výše zmíněných komplikací ani u HFOV, ani u CMV. Z tohoto hlediska tedy není mezi oběma způsoby ventilace v kombinaci s iNO rozdíl.
Pro doplnění komplexnosti práce jsme porovnali letalitu všech pacientů naší studie s RCT studii Davidsona z roku 1998 [10], která měla pro srovnání ze všech dostupných studií nejvíce relevantních dat (tab. 3).
Tab. 3. Srovnání letality novorozenců naší studie s RCT studií Davidsona 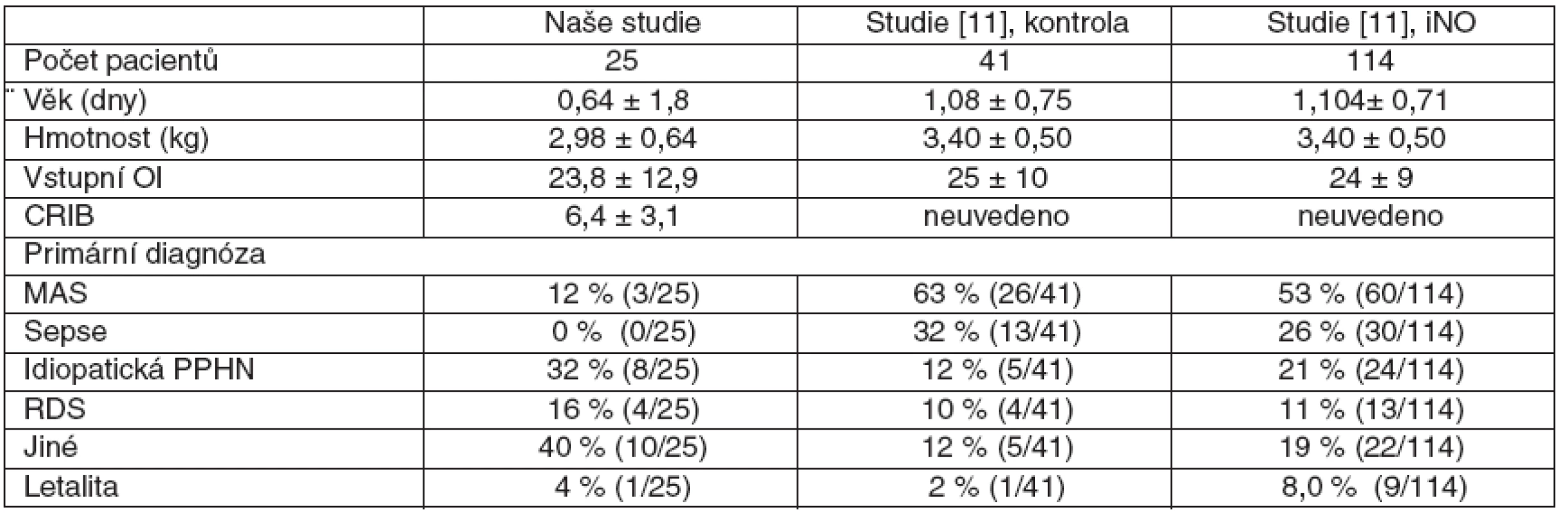
Letalitou pacientů s AHRF je naše studie srovnatelná s vybranou RCT studií. Z důvodů nízké celkové letality pacientů naší studie nelze jednoznačně upřednostnit žádnou ze srovnávaných kombinací UPV s iNO. I když jsme přiznali v ovlivnění oxygenace větší benefit kombinaci HFOV s iNO, v letalitě nebyl oproti kombinaci CMV s iNO statisticky významný rozdíl (CMV 0/15, HFOV 1/10). Tento výsledek potvrzuje, že samotné zlepšení oxygenačních parametrů nemá výraznější vliv na letalitu.
Nízká letalita novorozenců oproti dětem a dospělým pacientům s akutním hypoxickým respiračním selháním je dána charakterem plicního postižení. Zatímco u dětí a dospělých pacientů je ve větší míře zastoupeno nepřímé (extrapulmonární) ARDS jako výsledek poškození mediátory SIRS, u novorozenců se jedná převážně o primární plicní postižení a u novorozenců naší studie navíc primární postižení plicního vaskulárního aparátu (PPHN), tedy o postižení, které nejlépe odpovídá na terapii iNO. Vysvětlení nízké letality novorozenců studie je tak plně v souladu se závěry Eurokonsenzu 2003 [4].
Závěr
Obě kombinace (iNO s CMV a iNO s HFOV) vedou ke zlepšení oxygenace novorozenců s AHRF. HFOV má na oxygenaci aditivní účinek. Žádná z výše zmíněných kombinací neovlivňuje ventilační ani ABR parametry. Obě kombinace umožňují srovnatelné snižování FiO2, bez vlivu na nastavení zbývajících parametrů UPV. V koncentracích iNO do 20 ppm je stejně nízké riziko vzniku nežádoucích účinků u obou metod ventilace. Žádná kombinace nemá vliv na letalitu novorozenců s AHRF.
Došlo 20. 11. 2008.
Přijato 16. 5. 2009.
Adresa pro korespondenci:
MUDr. Lukáš Marek
Rerychova 14
635 00 Brno
e-mail: lmarel@email.cz
Zdroje
1. Roberts, J. D., Polaner, D. M., Lang, P., Zapol, W. M. Inhaled nitric oxide in persistent pulmonary hypertension of the newborn. Lancet, 1992, 3, 340, 8823, p. 818–819.
2. Rossaint, R., Falke, K. J., López, F., Slama, K., Pison, U., Zapol, W. M. Inhaled nitric oxide for the adult respiratory distress syndrome. N. Engl. J. Med., 1993, 11, 328, 6, p. 399–405.
3. Sokol, J., Jacobs, S. E., Bohn, D. Inhaled nitric oxide for acute hypoxic respiratory failure in children and adults: a meta-analysis. Anesth. Analg., 2003, 97, 4, p. 989–998. Review.
4. Macese, D., Field, D., Mercier, J. C., Miller, J. et al. Inhaled nitric oxide therapy in neonates and children: reaching a European consensus. Intensive Care Med., 2004, 30, p. 372–380.
5. Loskote, A. U., Kastle, R. A., Hoo, A. F., Lum, S., Ranganathan, S. C., Mok, Q. Q., Stocks, J. Airway function in infants treated with inhaled nitric oxide for persistent pulmonary hypertension. Pediatr. Pulmonol., 2008, 43, 3, p. 224–235.
6. Skýtsky, A. S. et al. ACCP Consensus Conference: mechanical ventilation. Intensive Care Med., 1994, 20, p. 64–79.
7. Fedora, M. Vliv terapeutického protokolu na mortalitu syndromu akutní respirační tísně v dětském věku. Habilitační práce, 2005, LF MU Brno, p. 44–47.
8. Cockburn, F., Cooke, R. W. I., Gamsu, H. R., Greenough, A., Hopkána, A., Macintosh, N., Ogstont, S. A., Parry, G. J., Silverman, M., Shaw, J. C. L., Tarnow-Mordi, W. O., Wilkinson, A. R. CRIB investigators’ Group and writing committee: The CRIB (clinical risk index for babies) score: a tool for assessing initial neonatal risk and comparing performance of neonatal intensive care units. Lancet, 1993, 342, p. 193–198.
9. Wessel, D. L., Adatia, I., Van Marter, L. J., Thompson, J. E., Kane, J. W., Stark, A. R., Kourembanas, S. Improved Oxygenation in a Randomized Trial of Inhaled Nitric Oxide for Persistent Pulmonary Hypertension of the Newborn. Pediatrics, 1997, 100, 5, p. E7.
10. Davidson, D., Barefield, E. S., Kattwinkel, J., Dudel, G., Damask, M., Straube, R., Rhines, J., Chány, C. T. Inhaled nitric oxide for the early treatment of persistent pulmonary hypertension of the term newborn: a randomized, double-masked, placebo-controlled, dose-response, multicenter study. Pediatrics, 1998, 101, 3 Pt 1, p. 325–334.
11. Kinsella, J. P., Axman, S. H. Inhaled Nitric Oxide Therapy in Children. Pediatric Respiratory Reviews, 2005, 6, 3, p. 190–198. Review.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Seznam doporučení ČSARIMČlánek Zpráva revizní komise
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2009 Číslo 4- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Paliativní péče u nemocných s nezvratným orgánovým selháním
- iNO v léčbě akutního respiračního selhání novorozenců – srovnání efektu kombinace s CMV a HFOV
- Časné vyhledávání kriticky nemocných pomocí Medical Emergency System ve Fakultní nemocnici u svaté Anny v Brně
- Měření transalveolárního tlaku pomocí plícnicového katétru
- Pacientka s těžkou protrahovanou hypoglykémií
- Využití fibrobronchoskopie v intenzivní péči
- 2. ČESKÝ KONGRES INTENZIVNÍ MEDICÍNY
- Doporučený postup vyšetření před diagnostickými nebo léčebnými výkony operační a neoperační povahy s požadavkem anesteziologické péče (tzv. předanestetické vyšetření)
- Zásady bezpečné anesteziologické péče
- Konsenzuální stanovisko k poskytování paliativní péče u nemocných s nezvratným orgánovým selháním (ČSARIM ČLS JEP, ČSIM ČLS JEP)
- Konsenzuální stanovisko k použití terapeutické hypotermie (ČSARIM ČLS JEP, ČSIM ČLS JEP, Společnost urgentní medicíny a medicíny katastrof ČLS JEP)
- Seznam doporučení ČSARIM
- Zpráva revizní komise
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Využití fibrobronchoskopie v intenzivní péči
- Pacientka s těžkou protrahovanou hypoglykémií
- Časné vyhledávání kriticky nemocných pomocí Medical Emergency System ve Fakultní nemocnici u svaté Anny v Brně
- Měření transalveolárního tlaku pomocí plícnicového katétru
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



