-
Medical journals
- Career
Získaná hemofilie A
Authors: P. Smejkal 1,2; A. Buliková 1,2; G. Chlupová 1; J. Zavřelová 1,2
Authors‘ workplace: Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Miroslav Penka, CSc. 1; Lékařská fakulta MU Brno, děkan prof. MUDr. Jiří Mayer, CSc. 2
Published in: Vnitř Lék 2012; 58(7 a 8): 155-162
Category: 60th Birthday prof. MUDr. Miroslav Penka, CSc.
Overview
Získaná hemofilie A je vzácné autoimunitní onemocnění způsobené protilátkami inhibujícími funkci faktoru VIII. Pacienti s touto chorobou jsou ohroženi těžkými krvácivými projevy po celou dobu trvání inhibitoru. Léčba spočívá i v rychlé diagnostice, zvládnutí krvácení a eradikaci inhibitoru pomocí imunosuprese. Zástavy krvácení lze dosáhnout především pomocí rekombinantního faktoru VIIa a aktivovaného protrombinového komplexu, které mají přibližně stejnou účinnost. Imunosuprese je stále založena na kortikoidech v monoterapii nebo v kombinaci s cyklofosfamidem, který může navýšit pravděpodobnost remise. Nové léky jako rituximab či cyklosporin A je možno použít ve druhé linii. V případě život ohrožujícího krvácení může být výhodné použít imunoadsorpci a vysoké dávky faktoru VIII.
Klíčová slova:
získaný inhibitor F VIII – získaná hemofilie A – imunosuprese – krvácení – léčbaDefinice
Získaná hemofilie A (ZHA) je vzácná krvácivá choroba, jejíž příčinou je autologní inhibitor koagulačního faktoru VIII (F VIII), který interferuje s jeho prokoagulačními funkcemi.
Etiopatogeneze
Samotné protilátky proti F VIII byly detekovány až u 17 % zdravé populace, ale jen výjimečně in vivo ovlivní funkční aktivitu F VIII [1]. Mechanizmus, proč u některých jedinců dochází ke vzniku nebo k selhání regulace preexistujících protilátek proti F VIII, není plně objasněn. U pacientů se získaným inhibitorem F VIII (ZiF VIII) byla prokázána vyšší frekvence alel DRB*16 a DQB1*0502 hlavního histokompatibilního komplexu (human leukocyte antigen – HLA) II. třídy a alely +49G antigenu cytotoxických lymfocytů CTLA-4 [2].
Asi v 1/2 případů je vznik inhibitoru idiopatický, u části pacientů je dáván do souvislosti s malignitami, autoimunitním onemocněním, graviditou, léčivy (sulfonamidy, peniciliny, chloramfenikolem, fenytoinem, fludarabinem, interferonem-α) a ojediněle i s dalšími chorobami [3–9]. Shrnutí výskytu jednotlivých chorobných stavů podílejících se na etiologii inhibitoru F VIII je uvedeno v tab. 1.
Table 1. Etiologie získaného inhibitoru F VIII – související základní onemocnění. 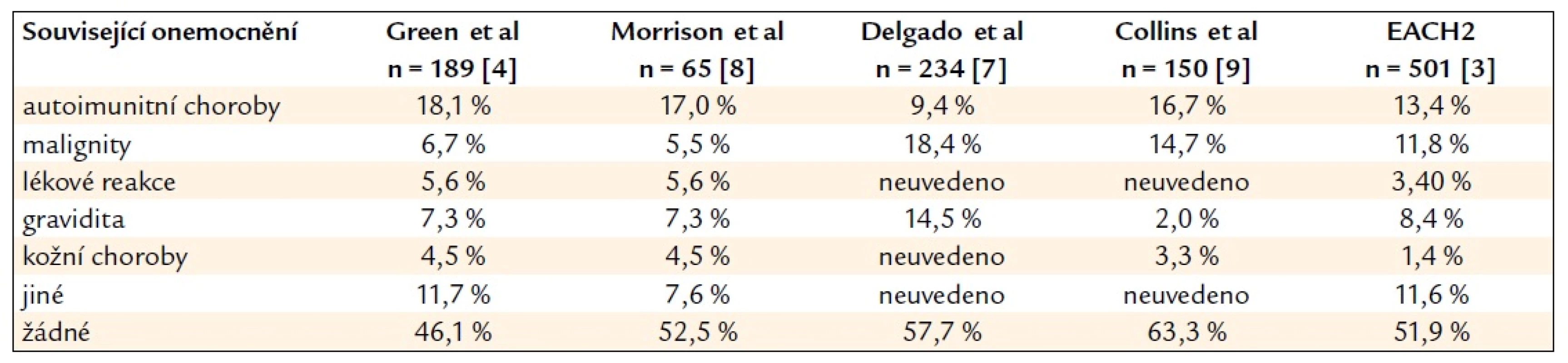
Na rozdíl od alogenního inhibitoru F VIII při hemofilii A nemusí být hladina F VIII zcela nulová a tato hladina nekoreluje s výší inhibitoru ani s krvácivými projevy. Je to v důsledku non-lineární inaktivace F VIII inhibitorem. Jedná se o protilátky IgG, nejčastěji podtřídy IgG4, méně často IgG1. Protilátky jsou většinou (62 %) namířeny pouze proti jednomu epitopu F VIII; asi ve 2/3 případů je vazba na F VIII v doméně A2, přibližně v 1/3 v doméně C2 [5]. Inhibitor má neutralizující funkci, protilátky anti-A2 a anti-A3 brání vazbě F VIII na F IX a F X, protilátky anti-C2 inhibují vazbu F VIII na fosfolipidy a von Willebrandův faktor (VW F) [6].
Asi u 1/3 (25–36 %) pacientů může dojít pozvolna ke spontánnímu vymizení inhibitoru [4,7,10]. Green et al udávají průměrnou dobu do spontánní eradikace inhibitoru 14 měsíců, medián 10 měsíců [4].
Diagnostika
Na diagnózu upozorní většinou klinické projevy, kterými jsou nejčastěji rozsáhlé hematomy v podkoží a svalech (obr. 1). Na rozdíl od hemofílie A dochází ke krvácení do kloubů jen zřídka. Ve screeningových testech je izolované prodloužení aktivovaného parciálního tromboplastinového času (aPTT) bez korekce ve směsném testu po 2hodinové inkubaci s normální plazmou. Při vyšetření testu cirkulujícího antikoagulans je prodloužení aPTT vždy výraznější po inkubaci a u slabého inhibitoru nemusíme ve směsi s normální plazmou před inkubací prodloužení aPTT vůbec zaznamenat. Diagnóza se určí na základě stanovení hladiny F VIII a inhibitoru F VIII Bethesda metodou. Nízké titry inhibitoru je lépe vyšetřit Nijmegen modifikací klasické Bethesda metody [11].
Image 1. Rozsáhlé podkožní krvácení u pacienta se získanou hemofilií A. 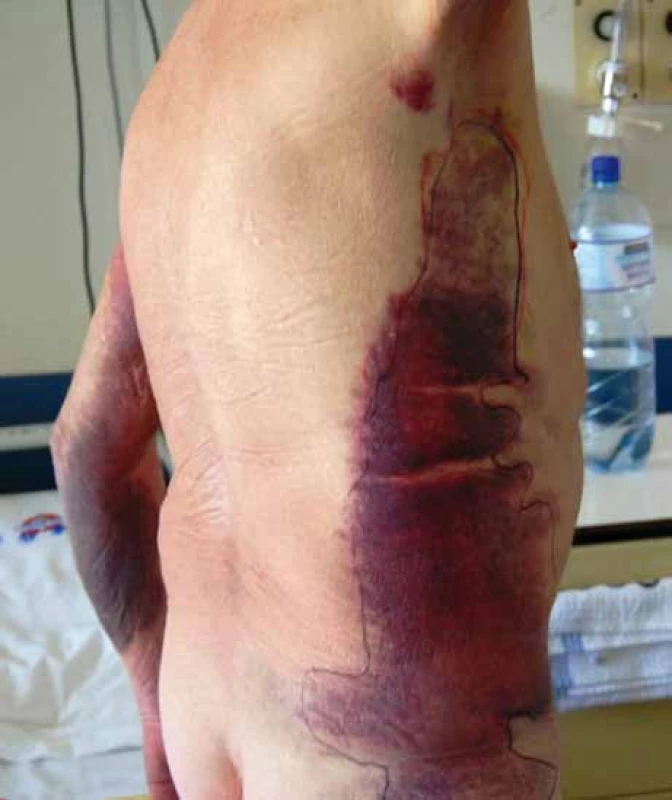
Diferenciálně diagnosticky je nutno odlišit specifický inhibitor F VIII od nespecifického inhibitoru typu lupus antikoagulans. Při stanovení hladiny F VIII ve vyšším ředění klesá vliv nespecifického inhibitoru na stanovení hladiny F VIII, zatímco u specifického inhibitoru F VIII zůstává hladina F VIII i při vyšším ředění nízká. Arteficiálně můžeme při silném inhibitoru F VIII naměřit i nižší hladinu ostatních koagulačních faktorů, které stanovujeme na principu aPTT. Je to způsobeno tím, že inhibitor F VIII neutralizuje F VIII ve faktor deficitní plazmě. Neutralizační vliv inhibitoru F VIII na F VIII ve faktor deficitní plazmě lze zeslabit stanovením faktoru při vyšším ředění vyšetřované plazmy [12–14]. Protože s krvácivými projevy se často setkáváme u pacientů léčených warfarinem, při výskytu pro ZiF VIII typických rozsáhlých podkožních hematomů bychom kromě kontroly protrombinového času měli vyšetřit i aPTT, které neadekvátním prodloužením upozorní na možnost případného ZiF VIII.
Epidemiologie
Roční incidence ZiF VIII je přibližně 1,5/1 000 000 populace. Výrazně se zvyšuje s věkem. U dětí do 16 let věku je roční incidence ZiF VIII 0,045/1 000 000 populace, zatímco nad 85 let věku je 14,7/1 000 000 populace. Peripartální incidence je 1/350 000 porodů [9].
Klinický obraz
Krvácivé projevy vyžadující léčbu jsou popisovány u 67–87 % pacientů [4,10]. Dle registru EACH2 pouze u 7 % pacientů nebylo prvotním krokem k diagnóze ZiF VIII krvácení [3]. Kromě terapie krvácení je nutná i eradikace inhibitoru, která se navozuje pomocí imunosuprese. Mortalita v souvislosti s krvácením během posledních 30 let klesá. Green et al uváděli v roce 1981 úmrtnost na krvácení 22 % v souboru 215 pacientů, z nichž 56 % bylo starších 60 let [4], Morrison et al v roce1993 u 65 pacientů (38 z nich bylo ve věku > 60 let) 14 % [8], Hay et al u 38 pacientů v roce 1997 8 % při mediánu věku 59 let [15], Collins et al uvádějí v nedávno publikovaném britském registru fatální krvácení v 9 % v souboru pacientů při mediánu věku 78 let [9] a analýza EACH2 registru z letošního roku uvádí pouze 3 % fatálních krvácení při mediánu věku 74 let, stejný počet úmrtí na důsledky imunosuprese, 9 % na přidružená onemocnění, úmrtnost při „follow-up“ 75 dnů byla 28 % [3]. Pokud pacienti neměli léčebný pokus o eradikaci inhibitoru, udávají Delgado et al v metaanalýze z roku 2003 v souboru 234 pacientů s mediánem věku 64 let mortalitu v souvislosti s onemocněním 19 %, zatímco u pacientů s imunosupresivní léčbou byla mortalita vztažená k inhibitoru F VIII 10 %. Celková úmrtnost však byla vyšší: u neléčených 41 % a u léčených 20 % [7]. Mortalita tedy nadále zůstává poměrně vysoká, což je při účinnější léčbě krvácení způsobeno nejspíše zvyšujícím se věkem pacientů. Dle analýzy Delgada et al měli pacienti ≤ 65 let mortalitu související přímo s inhibitorem F VIII 4 %, pacienti věku > 65 let 18 %, celková mortalita v uvedených skupinách byla 13 %, resp. 32 %. To potvrzují především data z britského registru (sběr byl prováděn od května roku 2001 až po duben roku 2003), dle kterého byla celková mortalita dle zvolené terapie 38–47 %, i když v důsledku krvácení byla pouze 9 %. Medián věku pacientů se získaným inhibitorem F VIII z Norska v období 1997–2004 byl dokonce až 81 let [16], z nichž 4 (28 %) zemřeli během blíže neupřesněného intervalu doby sledování; žádné úmrtí nebylo v důsledku krvácení, jedno bylo následkem imunosuprese. Na celkovou prognózu má kromě věku podíl i etiologie vzniku inhibitoru. Nejhorší je u malignit. Delgado et al [7] uvádějí 23 % úmrtí souvisejících s inhibitorem při celkové úmrtnosti 49 %, naopak nejpříznivější prognóza popisuje u inhibitoru F VIII provázejícím graviditu, s mortalitou 3 % (1 úmrtí v důsledku inhibitoru z 34 pacientek), v registru EACH2 dokonce mezi 42 pacientkami se ZiF VIII nedošlo k žádnému úmrtí [17]. Inhibitor F VIII při maligním onemocnění bývá v nižším titru ve srovnání s ostatními pacienty [7,18], ale krvácivé projevy u těchto pacientů nejsou mírnější. Navíc je při malignitě v průměru horší odpověď na imunosupresi, která je nezbytná i při radikálním odstranění tumoru – po samotné léčbě tumoru je popsána eradikace inhibitoru pouze u 22 % případů [18].
Svá specifika má inhibitor F VIII v souvislosti s graviditou. Objevuje se většinou během prvních 4 měsíců po porodu [6], méně často v pozdějším období nebo již v průběhu gravidity. Titr inhibitoru je obvykle nižší (medián 20 BU/ml, resp. 8 BU/ml) [7,17], čímž je vysvětlováno časté spontánní vymizení inhibitoru, uvádí se až v 62 % [19]. Doba do negativity inhibitoru je však delší oproti inhibitorům vzniklým bez souvislosti s graviditou, při spontánním poklesu v průběhu 16–30 měsíců [19,20]. Celkové procento vymizení inhibitoru pomocí imunosuprese či spontánně je poměrně vysoké – 74–85 % [17,21,22], s mediánem do remise 8–27 měsíců [20,23]. Příznivější jsou údaje z italského registru, dle kterých bylo dosaženo remise již v mediánu 2,7 měsíců u 78 % pacientek [22,24]. I při vymizení inhibitoru je v následné graviditě riziko jeho znovuobjevení. Vyjádření rizika této recidivy je nejednoznačné. Uvádí se, že při předchozím inhibitoru F VIII < 5 BU/ml a jeho spontánním vymizení v další graviditě k anamnestickému vzestupu inhibitoru F VIII nedochází [6]. Je také nutno počítat s tím, že pokud se ZiF VIII objeví před porodem, můžeme mít vliv i na hladinu F VIII u plodu [25].
Léčba krvácení
Dle EACH2, dosud největšího registru pacientů se ZiF VIII, se alespoň jedna krvácivá epizoda objevila u 474 z 501 pacientů (95 %) a hemostatická terapie byla podána u 70,5 % krvácivých epizod [26]. V léčbě krvácení je většinou nutno použít koncentrát aktivovaného protrombinového komplexu (aPCC) nebo rekombinantní F VIIa (r-F VIIa) s dosažením přibližně stejné pravděpodobnosti zástavy krvácení. V literatuře dle rozsahu krvácení je uváděna účinnost v léčbě krvácení asi 75–100 % [10,26].
Většinou selhává možnost navýšit hladinu F VIII pomocí DDAVP (desmopressin) či vysokých dávek koncentrátu F VIII (jsou efektivní pouze při nízkém inhibitoru F VIII < 3 BU/ml, resp. < 5 BU/ml) [7]. DDAVP v dávce 0,3 µg/kg i.v. zvýší výchozí hladinu F VIII přibližně 2–4krát [5,7]. K dosažení hemostatické hladiny F VIII > 40 % by tedy jeho výchozí hladina musela být alespoň 10 %, navíc vlivem inhibitoru nutno počítat s částečnou okamžitou neutralizací endogenně uvolněného F VIII a s krátkým plazmatickým poločasem F VIII. Doporučovaná dávka koncentrátu F VIII je 20 U/kg na každou Bethesda jednotku inhibitoru k jeho vysycení a dalších 40 U/kg k dosažení hemostatické hladiny F VIII [6,7].
Porcinní koncentrát F VIII je v současnosti nedostupný pro riziko přenosu prasečího parvoviru. Dříve se jednalo o účinnou alternativu v léčbě krvácení, protože byla na rozdíl od hemofilie A (25–35 %) popisována nízká zkřížená reaktivita inhibitoru proti lidskému F VIII a vepřovému F VIII (4–15 %) [5,7,13], dobrá účinnost byla popsána u 78 % epizod (50/64) [8]. V současnosti již probíhají studie s rekombinantním porcinním F VIII s delecí B domény [25].
Hemostatickou hladinu F VIII lze docílit při kombinaci podávání vysokých dávek koncentrátu F VIII s plazmaferézou s imunoadsorpcí a případně se současnou imunosupresivní terapií. Prostá plazmaferéza je při inhibitoru > 10 BU/ml většinou neúčinná vzhledem k velkému extravaskulárnímu poolu inhibitoru F VIII [11,13]. Plazmaferéza se proto doplňuje o imunoadsorpci imunoglobulinů IgG na stafylokokový protein A nebo na polyklonální ovčí protilátky proti lidským imunoglobulinům [7,27]. U získaného inhibitoru F VIII jsou větší zkušenosti s druhou metodikou. Jansen et al dosáhli plazmaferézou pomocí imunoadsorpční kolony za současné imunosuprese prednizolonem 100 mg//den s cyklofosfamidem 200 mg/den a substituce imunoglobulinů 5 g po každé plazmaferéze s imunoadsorpcí eradikace inhibitoru F VIII v mediánu 18 dnů u 6 pacientů z 8 [27]. V souboru bylo 6 pacientů s idiopatickým inhibitorem a po 1 pacientovi s revmatoidní artritidou a s proběhlou graviditou. Eradikace inhibitoru nebyla dosažena u této pacientky a v 1 případě idiopatického inhibitoru. Později byly publikovány výborné zkušenosti s obdobným postupem – tzv. modifikovaným Bonn-Malmö protokolem (MBMP) [28]. Tato léčba zahrnovala velkoobjemovou plazmaferézu 2,5 plazmatického objemu denně s imunoadsorpcí den 1–5, substituci IgG 0,3 g/kg den 5–7, imunosupresi prednizolonem 1 mg/kg a cyklofosfamidem 1–2 mg/kg ode dne 1 do remise s následnou redukcí dávky, substituci F VIII 100 U/kg à 6 hod, u pacientů s BMI > 40 až 200 U/kg à 6 hod. Byla popsána 90% (54/60), resp. 93% (54/58) účinnost na eradikaci inhibitoru. U 2 pacientů musel být protokol přerušen pro ztrátu i.v. přístupu. Negativity inhibitoru bylo dosaženo v průměru za 4,4 dny, normalizace hladiny F VIII bez nutnosti jeho substituce v průměru za 17 dnů a ukončení plazmaferéz s imunoadsorpcí v průměru za 19 dnů. Všichni pacienti měli vstupně závažné krvácivé projevy vyžadující léčbu. U všech 4 neúspěšných pacientů, u kterých bylo dosaženo pouze parciální remise s poklesem inhibitoru < 5 BU/ml a recovery F VIII kolem 30 %, byla diagnostikována malignita. Celková spotřeba F VIII byla u pacientů s dosažením celkové remise 196 000 U a parciální remise 390 000 U. Než bylo dosaženo hemostatické hladiny F VIII, byl k zástavě krvácení podáván r-F VIIa s mediánem kumulativní dávky pouze 13,2 mg. U 3 pacientů došlo k relapsu, který byl úspěšně léčen u 2 pacientů opět plazmaferézou s imunoadsorpcí a imunosupresí a u 1 pacienta jen steroidy po dobu 4 týdnů [28].
Pokud výše uvedenými způsoby nelze dosáhnout hemostatické hladiny F VIII, pak je třeba k léčbě krvácení použít bypassové aktivity: aPCC nebo r-F VIIa. Otázka, který z těchto 2 preparátů je účinnější a bezpečnější, zůstává otevřená [21,25,26]. Zkušenosti s použitím obou preparátů u ZHA byly dříve pouze formou série zpráv o případech z jednotlivých pracovišť [16,29–31].
V literatuře je citována pouze 1 práce hodnotící samostatně ve větším rozsahu použití aPCC u této diagnózy [32]. Jde o retrospektivní data ze 3 pracovišť v USA v průběhu 10 let, kdy byl aPCC podán jako lék první volby v terapii 55 krvácivých epizod u 34 pacientů se ZiF VIII. Dávkování bylo 75 U/kg à 8–12 hod. Jako účinná byla léčba zhodnocena u všech 13 pacientů se středně těžkým krvácením, s mediánem do zástavy krvácení 36 hod a celkovým počtem 6 dávek, zatímco u 21 pacientů s těžkým krvácením bylo podání úspěšné u 16 (76 %), s mediánem do zástavy krvácení 48 hod a počtem dávek 10. Dohromady pak došlo po podání aPCC k zástavě krvácení v 86 %.
O r-F VIIa v léčbě krvácení při ZiF VIII je literatuře více systematicky zpracovaných údajů. V italském registru, hodnotícím podání rF VIIa u 15 pacientů se ZiF VIII, kdy u 19 krvácivých epizod šlo o postup první volby a v jednom případě o záchrannou terapii, bylo krvácení zastaveno v 90 % (18/20). Aplikace byla v bolusech i v kontinuální infuzi, s mediánem první dávky 90 µg/kg, resp. 98 µg/kg, následné dávky 90 µg/kg à 2–6 hod, resp. 15–30 µg/kg/hod, s mediánem délky terapie 2,75, resp. 4 dny, s celkovou dávkou do zástavy krvácení 309 µg/kg, resp. 474,5 µg/kg a celkovým počtem dávek 10 v případě bolusového použití (byly aplikovány další bolusy po dosažení zástavy krvácení) [33]. V tzv. „NovoSeven compassionate-use program“ byla zahrnuta multicentrická data z let 1990–1995 shrnující 74 krvácivých epizod u 38 pacientů [15]. Medián první dávky r-F VIIa byl 90,4 µg/kg, další dávkování bylo à 2–6 hod, s mediánem počtu dávek 28 během 3,9 dne. Krvácení bylo zastaveno u všech 14 epizod, kde bylo použito jako postup první volby, a v 75 % (45/60), kde bylo použito jako záchranná terapie, s částečnou odpovědí na léčbu u dalších 10 epizod (17 %). Neúčinné tedy bylo u 5 zbývajících pacientů (8 %). Zajímavým zjištěním je, že u 33 krvácivých epizod byla v léčbě použita antifibrinoilytika, která byla podána jen u jednoho z 5 pacientů se selháním terapie. Pro srovnání, u pacientů z italského registru bylo antifibrinolytikum použito jen u 1 z nich. Přehled dostupné literatury o použití r-F VIIa v léčbě krvácení při ZHA provedli v roce 2007 Sumner et al [34], kteří zahrnuli data z „NovoSeven compassionate-use program“ [15], „Hemophilia and Thrombosis Research Society“ (HTRS) registru a z dosud publikované ostatní literatury. Shrnuli tak údaje o 182 krvácivých epizodách, kdy léčba krvácení pomocí r-F VIIa byla účinná při aplikaci jako postup první volby v 83 %, jako záchranná terapie v 66 %, částečně účinná ve 12 %, resp. 14 % krvácivých epizod. V případě operačních výkonů (n = 57) byla léčba účinná v 63 %, částečně ve 23 %, u nechirurgického krvácení (n = 124) byla účinnost v 80 % a částečná v 10 % epizod. Použitá definice účinnosti však nebyla přesná: obecně jako efektivní byly hodnoceny epizody, kdy došlo k zástavě krvácení; jako částečně efektivní, kdy došlo ke zmírnění krvácení.
V posledních letech jsou robustní data získávána z registrů. V EACH2 registru bylo r-F VIIa léčeno 170 epizod a aPCC 61 epizod, krvácení bylo zastaveno v 91 %, resp. 94 %, s mediánem kumulativní spotřeby na epizodu pro r-F VIIa 90 mg a aPCC 30 000 U. Pokud byl k léčbě krvácení použit koncentrát F VIII či desmopressin (60, resp. 20 epizod), byla účinnost nižší – 71 %, s mediánem kumulativní dávky F VIII na epizodu 20 000 U [26]. V HTRS registru bylo r-F VIIa léčeno 71 epizod a aPCC 38. Zástavy krvácení bylo při léčbě r-F VIIa dosaženo v 75 % (53/71), při léčbě aPCC v 74 % (28/38) a krvácení bylo zmírněno v 18 % (13/71), resp. 13 % (5/38). Kumulativní dávka na epizodu byla publikována pouze u r-F VIIa – medián 536 µg/kg [35]. V evropském registru (EACH2) je tedy reportována vyšší účinnost bypassových aktivit v léčbě krvácení oproti registru americkému (HTRS), v obou registrech je však účinnost r-F VIIa i aPCC přibližně stejná. Vyšší účinnost léčby krvácení v registru EACH2 oproti HTRS by mohla být dána jednak nejednotnou definicí kritérií účinnosti a jednak vyšší použitou dávkou na epizodu v Evropě – data jsou dostupná pouze pro r-F VIIa, kdy kumulativní dávka na epizodu byla v EACH2 registru přibližně 2násobná (90 mg) oproti americkému HTRS registru (536 µg/kg).
Ve srovnání s léčbou hemofilie u ZHA byl popsán vyšší výskyt trombotických komplikací při léčbě bypassovými aktivitami, což je nejspíše dáno vyšším věkem léčených pacientů, a tedy i pokročilejšími aterosklerotickými změnami u pacientů se ZHA. V EACH2 registru byla při této léčbě zaznamenána tepenná či žilní trombóza ve 4 % případů, častěji to byla trombóza tepenná, resp. srdeční infarkt [3]. Klinicky nezávažná podkožní krvácení proto není doporučeno bypassovými aktivitami léčit a v případě r-F VIIa je nutno mnohem uvážlivěji, na rozdíl od hemofilie, používat megadávku 270 µg/kg. Přesné zhodnocení frekvence trombotických komplikací u ZHA zvlášť pro aPCC a r-F VIIa na základě dostupné literatury není možné, protože nejsou reportovány zdaleka všechny případy. Dle metaanalýzy r-F VIIa v léčbě ZHA bylo popsáno 12 trombotických příhod u 10 pacientů z celkového počtu 139 (7 %); také převažovaly tepenné okluze, nejvíce mozkové příhody [34].
Eradikace inhibitoru
Nedílnou součástí terapie ZiF VIII je léčba cílená na jeho eradikaci. Kromě již zmíněného kombinovaného postupu dle MBMP [28] lze vymizení inhibitoru dosáhnout různými způsoby imunosupresivní léčby: nejčastěji je užíván prednison (prednisolon) v dávce 1 mg/kg/den samostatně s kladným efektem v souborech o minimálně 10 pacientech ve 44–90 % nebo v kombinaci s cytotoxickými látkami (nejčastěji s cyklofosfamidem 1–2 mg/kg/den) s efektem ve 45–92 %, opět v souborech o minimálně 10 pacientech [25].
Prospektivně se snažili tyto postupy porovnat v multicentrické studii Green et al [36]. Jednatřicet pacientů dostávalo 3 týdny prednison 1 mg/kg/den, pak byl stav zhodnocen – u 32 % (10/31) pacientů inhibitor F VIII vymizel, 1 pacient zemřel. Zbývajících 20 pacientů bylo dalších 6 týdnů léčeno dle randomizace: 1. pokračování v prednisonu 1 mg/kg/den; remise bylo dosaženo v 75 % (3/4). 2. monoterapie cyklofosfamidem 2 mg/kg/den; remise byla v 50 % (3/6). 3. kombinace prednisonu a cyklofosfamidu v uvedeném dávkování docílila remise v 50 % (5/10). Dle současné literatury se však jeví, že zvolený interval 3 týdnů ke zhodnocení účinnosti terapie nebyl vhodný, protože medián dosažení remise se pohybuje většinou kolem 5 týdnů [9,25].
Podrobnou metanalýzu v literatuře dobře zdokumentovaných 234 kazuistik z let 1985–2002 provedli Delgado et al [7] se závěrem, že po steroidech v monoterapii bylo dosaženo remise v 70 % a po podání cyklofosfamidu ± ± steroidy došlo k remisi v 89 %. Celková doba přežití však u obou skupin nebyla statisticky významně odlišná. O rok později Collins provedl obdobnou metanalýzu [22] s tím, že zahrnul navíc některé další kazuistiky a naopak vyloučil ty, při kterých byla použita imunoadsorpční plazmaferéza a/nebo byl k potenciaci imunosuprese podáván i F VIII. Dospěl tak k mírně nižší úspěšnosti v eradikaci inhibitoru – u steroidů 66 % a u cytotoxických léků ± ± steroidy 77 %. Britský doporučený postup [10] na základě metaanalýzy Delgada et al a vlastní britské analýzy za 2leté období udává účinnost prednizolonu 1 mg/kg/den 60–70 % a cyklofosfamidu 50–150 mg/den v kombinaci s prednisolonem 70–80 %; u obou možností se stejným intervalem do dosažení remise (35 dnů) a shodným celkovým přežitím. Dle dat z britského registru [9] byl efekt steroidů samostatně a steroidů společně s cytotoxickými léky (především cyklofosfamidem, pouze 3 pacienti měli azatioprin) obdobný. Eradikace inhibitoru bylo dosaženo v 76 % (26/34), resp. 78 % (35/45), v mediánu do remise 49, resp. 39 dnů, celková mortalita v těchto souborech byla 47 %, resp. 38 %, medián přežití byl 767 dnů, resp. 975 dnů. Samostatná léčba cyklofosfamidem v tomto registru byla použita pouze u 7 pacientů, remise bylo dosaženo u 4 z nich (57 %). Pacienti léčení pouze steroidy měli nižší medián hladiny inhibitoru F VIII (8 BU/ml) a vyšší F VIII (5 %) oproti druhé uvedené skupině léčené steroidy současně s cytotoxickými léky (medián inhibitoru F VIII byl 18 BU/ml a hla-diny F VIII 2 %).
Nejrecentnější metaanalýzu výsledků imunosupresivní terapie ZHA provedli v roce 2011 opět Collins et al, kteří shrnuli data z dostupné literatury včetně EACH2 registru [25]. Celkové remise (CR) bylo mimo EACH2 registr při léčbě steroidy dosaženo v 72 % (96/134), při kombinované léčbě steroidy a cytotoxickými látkami v 78 % (165/211); při zpracování pouze prací zahrnujících obě tyto léčebné strategie pak bylo CR steroidy dosaženo v 76 % (68/90) a kombinovanou léčbou v 78 % (109/139). Co se týče dat z EACH2 registru, bylo CR při léčbě steroidy dosaženo v 58 % (83/142) s negativitou inhibitoru v mediánu 34 dnů a s 19 % relapsů, při léčbě steroidy s cytotoxickými látkami bylo CR dosaženo v 77 % (68/88) s negativitou inhibitoru v mediánu 32 dnů a se 14 % relapsů. Podrobněji udává výsledky imunosuprese z EACH2 registru tab. 2., ve které jsou i data o režimech zahrnujících rituximab. S ohledem na frekvenci relapsů ZiF VIII byla setrvalá remise nejčastěji dosažena při kombinaci steroidů a cytotoxických léků (67 %) a při léčbě rituximabem společně s dalšími imunosupresivními léky (64 %) a méně často pak při léčbě samotnými kortikoidy (48 %) či samotným rituximabem (42 %). Celkové přežití při medianu „follow-up“ 246 dnů však ve všech uvedených skupinách bylo obdobné – 60 %, 61 %, 60 % a 70 % (v poslední skupině léčené pouze rituximabem bylo zahrnuto pouze 12 pacientů) [37]. Ke stejnému závěru, že délka přežití nebyla vyšší při vyšším procentu CR ZHA, dospěli v metaanalýzách i Delgado et al [7] a Collins [22]. Počet relapsů je v literatuře udáván až 20 % v mediánu 7,5 měsíců [9].
Table 2. Výsledky imunosuprese různými režimy dle EACH2 registru. 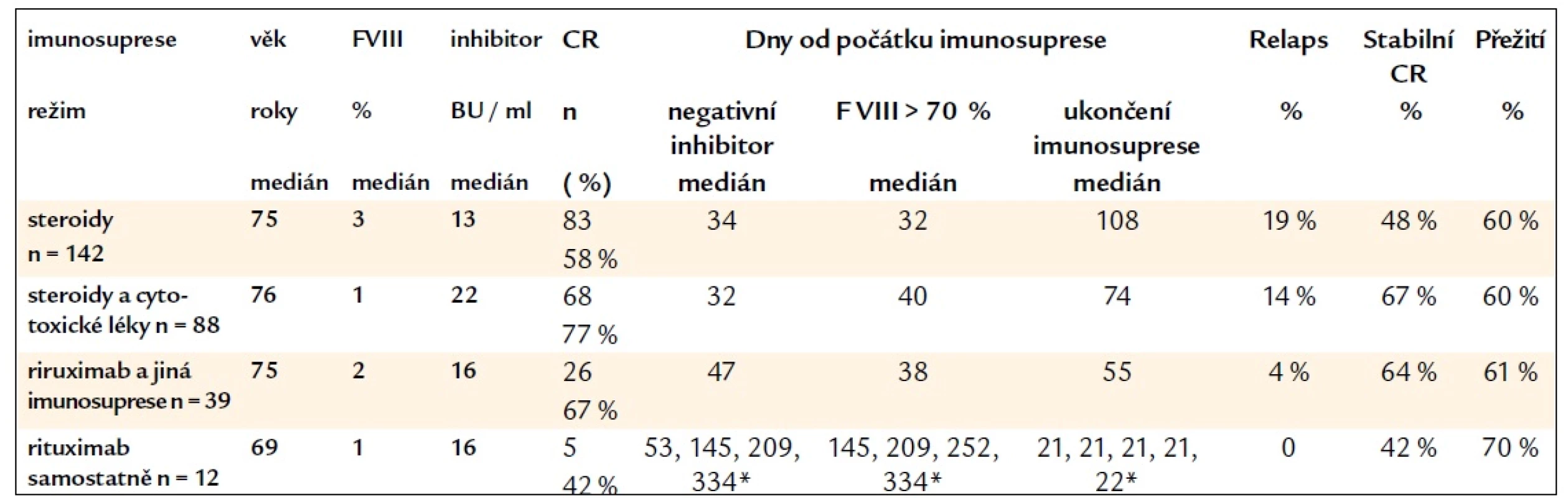
CR – kompletní remise, F VIII – faktor VIII, *konkrétní počet dnů pro nízký počet pacientů Green et al [4] doporučovali při současném výskytu revmatoidní artritidy kromě steroidů vždy použít i cytotoxické látky; dle jejich analýzy 14 pacientů s revmatoidní artritidou nebylo dosaženo eradikace inhibitoru u 2 pacientů léčených pouze prednisonem, zatímco při léčbě cyklofosfamidem a/nebo azatioprinem ± prednizon byla remise dosažena v 80 % (8/10); 1 pacient nebyl léčen vůbec a 1 jiným způsobem. Naopak dle britského registru byla u revmatoidní artritidy úspěšnost eradikace inhibitoru při léčbě pouze steroidy 100% (4/4), není však již uvedeno, jak bylo léčeno zbývajících 7 pacientů s touto diagnózou [9]. Efekt azatioprinu byl zaznamenán také Greenem et al [4]: z 28 pacientů léčených dávkou 100–200 mg/den byly popsány eradikace nebo pokles inhibitoru u 19 z nich, bez udání zastoupení kompletní eradikace inhibitoru. V kazuistikách byly s úspěchem k imunosupresi použity i další léky: 6-merkaptopurin, vincristin [5,13,22], interferon-α [13,38], cyklosporin A [6,10,13,22], tacrolimus, mykofenolát mofetil, sirolimus [6].
S klasickou imunosupresí byl podáván i koncentrát F VIII se záměrem senzibilizovat patologický klon lymfocytů k cytotoxické medikaci. Lian et al podávali modifikaci COP protokolu (cyklofosfamid, vinkristin, prednizon) s bolusem koncentrátu F VIII 1. den léčby a popsali remisi v 92 % (11/12) [39], avšak se stejným protokolem, ale bez aplikace F VIII popsali později 83 % remisí (5/6) [40]. Výborné výsledky byly dosaženy dle tzv. Budapešťského protokolu (F VIII 30 U/kg/den 1. týden, 20 U/kg/den 2. týden a 15 U/kg/den 3. týden + i.v. cyklofosfamid 200 mg denně do dávky 2–3 g + i.v. metylprednisolon 100 mg denně 1. týden a pak v klesající dávce další 2 týdny), po kterém bylo původně popsáno 93 % remisí (13/14) dosažených v mediánu 4,6 týdne; historická kontrolní skupina měla medián do remise 28,3 týdne, což je abnormálně dlouhý interval [41]. Později s větším počtem pacientů v souboru bylo dosaženo remise v 88 % (23/26) [42].
Vysokodávkované imunoglobuliny v monoterapii nejsou v současnosti k eradikaci inhibitoru doporučovány [6], ne zcela jednoznačný je i jejich přínos v kombinaci s prednizonem a cytotoxickými látkami [10], i když byly popsány případy jejich efektu v monoterapii u pacientů s velmi nízkým titrem inhibitoru F VIII [43] i v kombinaci s prednizonem [44]. Svoje místo mají imunoglobuliny v MBMP.
Dosud neujasněné postavení v imunosupresi mají cyklosporin A a monoklonální protilátka anti-CD20 (rituximab). Tyto léky jsou doporučovány k eradikaci inhibitoru v druhé linii, po selhání imunosuprese prednisonem ± ± cyklofosfamidem [10,45].
S cyklosporinem A jsou publikovány kazuistiky eradikace získaného inhibitoru F VIII již od roku 1988 [46], ale i v recentní literatuře se jedná nadále o popisy jednotlivých úspěšných případů léčby cyklosporinem A při selhání imunosuprese první linie [47,48] a při použití v první linii byl podáván společně s prednizolonem [49,50].
Nověji je zkoušen k navození imunosuprese rituximab v dávkách doporučovaných k léčbě lymfoproliferací (375 mg/m2 týdně 4krát). Stasi et al v poměrně homogenním souboru 10 pacientů (6 pacientů bez předchozí imunosuprese a pouze 1 pacient měl s rituximabem i prednison a cyklofosfamid) udávají v 80 % (8/10) celkovou remisi dosaženou v průběhu 2–12 týdnů. Na rozdíl od úspěšně léčených pacientů měli non-respondéři inhibitor F VIII > 100 BU/ml (160 a 250). U 3 pacientů (37,5 %) však došlo v rozmezí 10–20 týdnů k relapsu inhibitoru a následně k navození 2. trvalé remise stejnou dávkou rituximabu [51]. Aggarwalová et al sumarizovali literární data od 25 pacientů (včetně souboru Stasiho et al); remise bylo dosaženo u 17 (68 %), u 3 pacientů došlo k parciální remisi se vzestupem hladiny F VIII > 25 %, doba do remise byla 2–16 týdnů, kromě 2 pacientů, kteří dosáhli remise až za 56 a 104 týdnů. Lepší výsledky byly u pacientů s nižším titrem inhibitoru. Na základě toho doporučuje následující postup: pacienty s minimálním krvácením a s inhibitorem F VIII < 5 BU/ml léčit pouze prednisonem, pacientům se závažným krvácením nebo inhibitorem F VIII 5–30 BU/ml podávat prednison + + rituximab a pacientům s inhibitorem F VIII > 30 BU/ml k terapii přidat i cyklofosfamid [52]. Největší analýzu literárních údajů o využití rituximabu v léčbě ZHA pak udělal Franchini [53], který shromáždil údaje o 65 pacientech takto léčených, s dosažením kompletní remise u 57 z nich (88 %). Většina nemocných měla souběžně i další imunosupresiva. Úspěšnost v dosažení celkové remise se tedy u cyklosporinu A i rituximabu zdá vyšší. Problematické v jejich hodnocení je to, že ve většině případů byly tyto léky kombinovány i s další imunosupresí (převážně prednison, méně často i cyklofosfamid či další cytotoxické léky). Na základě v současnosti dostupných dat o léčbě rituximabem dosud nebylo prokázáno, že by bylo dosaženo eradikace ZiF VIII při této léčbě častěji či rychleji [25]. Výše uvedený postup navržený Agarwalovou et al tedy nemá výrazné opodstatnění [52].
Pozitivní roli by mohl rituximab sehrát v léčbě peripartální ZHA, kdy jsou cytotoxické léky prakticky kontraindikovány. Dle nejnovějších údajů o ZiF VIII v graviditě, které jsou z EACH2 registru, bylo dosaženo vymizení inhibitoru u 71 % (22/31) případů v mediánu 47 dnů po léčbě steroidy, v 83 % (5/6) po léčbě steroidy společně s cytotoxickými látkami v období 9–261 dnů a u obou pacientek léčených steroidy a rituximabem za 11 a 76 dnů [17]. Mazzucconi et al shrnuli publikace z let 2004–2009 a našli 8 případů postpartální ZHA léčených rituximabem, z nichž 1/2 byla primoléčba a 1/2 po selhání předchozí imunosuprese, vždy 1 pacientka z obou těchto skupin měla rituximab samostatně a ostatní s kortikosteroidy či cyklofosfamidem, 1krát navíc i s azatioprinem a 1krát navíc i s imunoglobuliny. U všech pacientek byl ZiF VIII eradikován, u primoléčby v intervalu 2–3 týdnů (titr ZiF VIII byl pouze 4–10 BU/ml), u záchranné terapie v intervalu 39–48 týdnů (titr ZiF VIII byl velmi vysoký 470–3 075 BU/ml), u 1 pacientky z obou skupin údaj o době do CR nebyl znám [54].
V souladu s doporučením UKHCDO (UK Haemophilia Centre Doctors Organisation) z roku 2006 [10], které vychází z metaanalýzy 234 pacientů provedené Delgadem et al [7] a dat z britského registru od 151 pacientů [9], metaanalýzy Collinse [25] a EACH2 registru [37] i dle mezinárodního doporučení z roku 2009 [45] zůstává nadále doporučovaným standardem imunosuprese kortikoidy v monoterapii nebo v kombinaci s cyklofosfamidem. Při selhání tohoto postupu během 6 týdnů je v druhé linii vhodná léčba rituximabem nebo cyklosporinem A či kombinovanou imunosupresí. Modifikovaný Bonn-Malmö protokol je vhodný při život ohrožujícím krvácení. Vysokodávkované imunoglobuliny k eradikaci ZiF VIII již nejsou doporučovány vůbec. Po úspěšné eradikaci inhibitoru je doporučeno sledovat ZiF VIII prvního 1/2 roku měsíčně, druhého 1/2 roku každé 2–3 měsíce a pak v půlročních intervalech [45].
Závěr
Získaný inhibitor F VIII je sice vzácné onemocnění, avšak nepoznaný může závažnými krvácivými projevy ohrozit pacienta na životě. Při jeho včasné diagnóze ve 3. tisíciletí sice došlo k redukci úmrtí v důsledku krvácení na 3–9 % [3,9], ale celková úmrtnost zůstává v Evropě vysoká – 28 % [3]. Je to kvůli věku pacientů (začínají převažovat nemocní v našich podmínkách nad hranicí průměrné délky života) a přidružených onemocnění i smrtelných komplikací následkem imunosuprese. Léčba by proto měla probíhat ve specializovaných centrech, která mají zkušenosti s léčbou hemofiliků s inhibitorem a současně i s imunokompromitovanými pacienty a mají dostatečné laboratorní zázemí, což jsou hemofilická centra typu HTC (Haemophilia Treatment Centre) a především pak typu CCC (Comprehensive Care Centre), ve kterých by měla být tato péče soustředěna [55,56]. Stručnou informaci o ZHA lze získat z webových stránek podporovaných firmou NovoNordisk [57].
Poděkování
Dovolte mi na závěr poděkovat přednostovi OKH FN Brno profesoru MUDr. Miroslavu Penkovi, CSc., za to, čemu jsem se od něho mohl přiučit po stránce odborné, ale i lidské, za jeho podporu a možnost věnovat se na pracovišti nejen rutinní činnosti.
MUDr. Petr Smejkal, Ph.D.
www.fnbrno.cz
e-mail: psmejkal@fnbrno.cz
Doručeno do redakce: 18. 5. 2012
Sources
1. Collins PW, Percy CL. Advances in the understanding of acquired haemophilia A: implication for clinical practice. Br J Haematol 2009; 148 : 183–194.
2. Oldenburg J, Zeitler H, Pavlova A. Genetic markers in acquired haemophilia. Haemophilia 2010; 16 (Suppl 3): 41–45.
3. Knoebl P, Marco P, Baudo F et al. EACH2 Registry Contributors. Demografic and clinical data in acquired hemophilia A: results from the European Haemophilia Registry (EACH2). J Thromb Haemost 2012; 10 : 622–631.
4. Green D, Lechner K. A Survey of 215 Non-Hemophilic Patients with Inhibitors to Factor VIII. Thromb Haemost 1981; 45 : 200–203.
5. Hay CR. Acquired haemophilia. Baillieres Clin Haematol 1998; 11 : 287–303.
6. Sood SL, Kessler CM. Acquired inhibitors to factor VIII. In: Lee CA, Berntorp EE, Hoots WK (eds). Textbook of Hemophilia. Oxford: Blackwell Publishing 2010 : 81–87.
7. Delgado J, Jimenez-Yuste V, Hernandez-Navarro F et al. Acquired haemophilia: Review and meta-analysis focused on therapy and prognostic factors. Br J Haematol 2003; 121 : 21–35.
8. Morrison AE, Ludlam CA, Kessler C. Use of porcine factor VIII in the treatment of patients with acquired hemophilia. Blood 1993; 81 : 1513–1520.
9. Collins PW, Hirsch S, Baglin TP et al. UK Haemophilia Centre Doctors’ Organisation. Acquired hemophilia A in the United Kingdom: a 2-year national surveillance study by the United Kingdom Heamophilia Centre Doctors’ Organisation. Blood 2007; 109 : 1870–1877.
10. Hay CR, Brown S, Collins PW et al. The diagnosis and management of factor VIII and IX inhibitors: a guideline from the United Kingdom Haemophilia Centre Doctors Organisation. Br J Haematol 2006; 133 : 591–605.
11. Feinstein DI, Green D, Federici AB et al. Diagnosis and Management of Patients with Spontaneously Acquired Inhibitors of Coagulation. American Society of Hematology Education Programm Book Hematology 1999 : 192–208.
12. Goldsmith JC. Diagnosis of Factor VIII versus Nonspesific Inhibitors. Semin Hematol 1993; 30 (Suppl 1): 3–6.
13. Cohen AJ, Kessler CM. Acquired inhibitors. Baillieres Clin Hematol 1996; 9 : 331–354.
14. Buliková A, Zavřelová J, Penka M. Antifosfolipidový syndrom v roce 2009. Vnitř Lék 2009; 55 : 253–262.
15. Hay CR, Negrier C, Ludlam CA. The Treatment of Bleeding in Acquired Haemophilia with Recombinant Factor VIIa: A Multicentre Study. Thromb Haemost 1997; 79 : 1463–1467.
16. Holme PA, Brosstad F, Tjønnfjord GE. Acquired haemophilia: management of bleeds and immune therapy to eradicate autoantibodies. Haemophilia 2005; 11 : 510–515.
17. Nemes L, Tengborn L, Collins PW et al. Acquired Haemophilia A and Pregnancy/Postpartum – a Report From a European Registry. Blood 2010; 116: Abstract 717.
18. Sallah S, Wan JY. Inhibitors against factor VIII in patients with cancer. Analysis of 41 patients. Cancer 2001; 9 : 1067–1074.
19. Michiels JJ. Acquired Hemophilia A in Women Postpartum: Clinical Manifestations, Diagnosis, and Treatment. Clin Appl Thromb Hemost 2000; 6 : 82–86.
20. Hauser I, Schneider B, Lechner K. Post-partum factor VIII inhibitors. A review of the literature with special reference to the value of steroid and immunosuppressive treatment. Thromb Haemost 1995; 73 : 1–5.
21. Collins PW. Management of acquired haemophilia A – more questions than answers. Blood Coag Fibrionol 2003; 14 (Suppl 1): 23–27.
22. Collins PW. Acquired haemophilia A: immunine suppression. Haematologica 2004; 89: (Suppl 5): 3–7.
23. Solymoss S. Postpartum acquired factor VIII inhibitors: results of a survey. Am J Hematol 1998; 59 : 1–4.
24. Baudo F, de Cataldo F. Italian Association of Haemophilia Centres (AICE): Register of acquired factor VIII inhibitors (RIIA). Acquired factor VIII inhibitors in pregnancy: data from the Italian Haemophila Register relevant to clinical practice. BJOG 2003; 110 : 311–314.
25. Collins PW. Management of acquired haemophilia A. J Thromb Haemost 2011; 9 (Suppl 1): 226–235.
26. Knoebl P, Baudo F, Collins PW et al. EACH2 Registry Contributors. Management of Bleeding In Acquired Hemophilia: Results of the European Acquired Hemophilia Registry (EACH2). Blood 2010; 116: Abstract 716.
27. Jansen M, Schmaldienst S, Banyai S et al. Treatment of coagulation inhibitors with extracorporeal immunoadsorption (Ig-Theasorb). Br J Haematol 2001; 112 : 91–97.
28. Zeitler H, Ulrich-Merzenich G, Goldmann G et al. The prevalence of the bleeding severity in the treatment of acquired hemophilia – an update of a single-centre experience with 67 patients. Haemophilia 2010; 16 : 95–101.
29. Söhngen D, Specker C, Bach D et al. Acquired factor VIII inhibitors in nonhemophilic patiens. Ann Hematol 1997; 74 : 89–93.
30. Grünewald M, Beneke H, Güthner C et al. Acquired haemophilia: experience with a standardized approach. Haemophilia 2001; 7 : 164–169.
31. Ji L, Yang R, Yang D et al. Prednisone and low-dose activated prothrombin complex concentrates for FVIII inhibitor in nonhaemophilic patients. Haemophilia 1998; 4 : 721–724.
32. Sallah S. Treatment of acquired haemophilia with factor eight inhibitor bypassing activity. Haemophilia 2004; 10 : 169–173.
33. Baudo F, de Cataldo F, Gaidano G. Italian registry of acquired hemophilia. Treatment of acquired factor VIII inhibitor with recombinant activated factor VIIa: data from the Italian registry of acquired hemophilia. Haematologica 2004; 89 : 759–761.
34. Sumner MJ, Geldziler BD, Pedersen M et al. Treatment of acquired haemophilia with recombinant activated FVII: a critical appraisal. Haemophilia 2007; 13 : 451–461.
35. Sood SL, Konkle BA, Kessler CM et al. Treatment of Acute Bleeds in acquired Hemophilia: An Updated Analysis From the Hemophilia and Thrombosis Research Society (HTRS) Registry. Blood 2009; 115: Abstract 3499.
36. Green D, Rademaker AW, Briët E. A prospective, randomised trial of prednisone and cyclophosphamide in the treatment of patients with factor VIII autoantibodies. Thromb Haemost 1993; 70 : 753–757.
37. Collins PW, Baudo F, Knoebl P et al. Inhibitor Eradication In Acquired Haemophilia A: Final Results of European Acquired Haemophilia Registry (EACH2). Blood 2010; 116: Abstract 715.
38. Boggio LN, Green D. Acquired hemophilia. Rev Clin Exp Hematol 2001; 5 : 389–404.
39. Lian EC, Larcada AF, Chiu AY. Combination immunosuppressive therapy after factor VIII infusion for acquired factor VIII inhibitor. Ann Intern Med 1998; 110 : 774–778.
40. Lian EC, Villar MJ, Noy LI et al. Acquired factor VIII inhibitor treated with cyclophosphamide, vincristine, and prednisone. Am J Hematol 2002; 69 : 294–295.
41. Nemes L, Pitlik E. New protocol for immune tolerance induction in acquired hemophilia. Haematologica 2000; 85 (Suppl 10): 64–68.
42. Nemes L. The use of immune tolerance induction regimes for acquired hemophilia. Haemophilia 2004; 10 (Suppl 3): 54.
43. Schwarz RS, Gabriel DA, Aledort LM et al. A prospective study of treatment of acquired (autoimmune) factor VIII inhibitors with high-dose intravenous gammaglobulin. Blood 1995; 86 : 797–804.
44. Dykes AC, Walker ID, Lowe GD et al. Combined prednisolone and intravenous immunoglobulin treatment for acquired factor VIII inhibitors: a 2-year review. Haemophilia 2001; 7 : 160–163.
45. Huth-Kühne A, Baudo F, Collins P et al. International recommendations on the diagnosis and treatment of patients with acquired hmophilia A. Haematologica 2009; 94 : 566–575.
46. Hart HC, Kraaijenhagen RJ, Kerckhaert LA et al. A patient with spontaneous factor VIII:C autoantibody: successful treatment with cyclosporine. Transplant Proc 1988; 20 (Suppl 4): 323–328.
47. Au WY, Lam CC, Kong YL. Successful treatment of acquired factor VIII inhibitor with cyclosporine. Haemophilia 2004; 10 : 98–100.
48. Wano Y, Kang Y, Masaki H et al. Cyclosporine A as an effective treatment for a patient with acquired hemophilia A complicated with diabetes mellitus and ischemic heart disease. Japan J Clin Hematol 2005; 46 : 1100–1104.
49. Leinøe EB, Jørgensen M, Nielsen JD. Acquired factor VIII deficiency treated with cyclosporine. Ugeskr Laeger 1999; 161 : 4762–4763.
50. Mikami T, Masauzi N, Niwa J et al. Acquired factor VIII inhibitors in patient associated with neurosurgery: case report and review of the literature. Neurosurgery 2005; 57 : 595.
51. Stasi R, Bruneti M, Stipa E et al. Selective B-cell depletion with rituximab for the treatment of patients with acquired hemophilia. Blood 2004; 103 : 4424–4428.
52. Aggarwal A, Grewal R, Green RJ et al. Rituximab for autoimmune haemophilia: a proposed treatment algorithm. Haemophilia 2005; 11 : 13–19.
53. Franchini M. Rituximab in the treatment of adult acquired hemophilia A: A systematic review. Crit Rev Oncol Hematol 2007; 63 : 47–52.
54. Mazzucconi MG, Biondo F, Santoro C. Rituximab in the Treatment of Postpartum Acquired Hemophilia A. Journal of coagulation disorders 2009; 1 : 47–54.
55. Penka M, Blatný J, Matýšková M et al. Hemofilie z pohledu zajištění péče o nemocné. Vnitř Lék 2009; 55 (Suppl 1): 48–54.
56. Český národní hemofilický program. http://cnhp.registry.cz.
57. http://www.novoseven.cz/proHCP/ziskhem.html.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 7 a 8-
All articles in this issue
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Chronický zánět a metabolický syndrom
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Získaná hemofilie A
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Trojkombinační léčba chronické hepatitidy C
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

