-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
První bezkontrastní PCI vedená intrakoronárním ultrazvukem v České republice
First zero contrast PCI guided by intracoronary ultrasound in the Czech Republic
Contrast induced nephropathy is associated with worse clinical outcome in patients undergoing coronary intervention. The most profound risk factor is advanced chronic renal insufficiency. Due to the increasing number of coronary interventions on severally ill patients, there is a need of modern therapeutic approach that could reduce the volume of contrast media to minimum or even zero. Herein, the authors present a case report of a 68-year-old patient with chronic kidney disease, who required elective coronary intervention (PCI) due to a significant lesion of the left anterior descending coronary artery. During this intervention, maximum emphasis was given on reduction of contrast media. To the best of our knowledge, this was the first similar intervention performed in the Czech Republic. Minimum contrast PCI guided by the intracoronary ultrasound, i.e. the IVUS-guided zero-contrast PCI may serve as a potential alternative to standard, angiography-guided PCI.
Keywords:
acute kidney injury – ultralow contrast PCI – contrast induced nephropathy – IVUS‑guided PCI – chronic kidney insufficiency
Autoři: Marek Sůva 1,2; Roman Štípal 1,2; Martin Poloczek 1,2; Jan Kaňovský 1,2; Otakar Boček 1; Petr Jeřábek 1; Martin Hudec 1,2; Vojtěch Brázdil 1,2; Petr Kala 1,2
Působiště autorů: Fakultní nemocnice Brno 1; Lékařská fakulta Masarykovy Univerzity, Brno 2
Vyšlo v časopise: Vnitř Lék 2021; 67(7): 433-437
Kategorie: Kazuistiky
Souhrn
Kontrastem indukovaná nefropatie je asociována s horšími klinickými výsledky u pacientů podstupujících koronární intervence. Největší riziko je pak u pacientů s pokročilou chronickou renální insuficiencí. Vzhledem k rostoucí četnosti intervenčních zákroků i u výrazně polymorbidních pacientů je snaha najít moderní přístupy redukující množství podané kontrastní látky téměř na absolutní minimum. Autoři zde prezentují kazuistiku 68letého pacienta s chronickou renální insuficiencí vyžadující elektivní perkutánní koronární intervenci (PCI) pro nález významné léze na ramus interventricularis anterior. Důraz při této intervenci byl kladen na maximální redukci množství kontrastní látky během PCI, při které bylo využito přesného posouzení koronárního postižení pomocí intrakoronárního ultrazvuku jako alternativy konvenčně vedené intervence („IVUS‑zero PCI“). Dle našeho průzkumu literatury se jednalo o první takovou intervenci na území České republiky.
Klíčová slova:
PCI s použitím velmi nízkého množství kontrastu – kontrastem indukovaná nefropatie – IVUS‑guided PCI – akutní ledvinné poškození – chronická ledvinná insuficience
Úvod
Podání kontrastní látky může u rizikové populace vyvolat kontrastem indukovanou nefropatii. V některých specifických podtypech populace, například u pacientů akutně hospitalizovaných na lůžku intenzivní péče, může incidence této choroby dosahovat až 16 % (1). Základním preventivním opatřením je hydratace fyziologickým roztokem či jiným roztokem z řady balancovaných roztoků před výkonem a po něm, vysazení nefrotoxických léčiv, jakými jsou diuretika, nefrotoxická antibiotika či metformin, a případně odložení výkonu do období relativní renální stability. Největší redukce incidence kontrastem indukované nefropatie lze však docílit výběrem správné kontrastní látky (nízko‑osmolární nebo iso‑osmolární) a zvláště pak maximální redukcí množství kontrastní látky. V nedávné době byly publikovány možné přístupy využívající intrakoronární zobrazovací metody namísto kontrastní látky. V této práci sdílíme naši první zkušenost s metodou PCI (perkutánní koronární intervence) řízené intravaskulárním – intrakoronárním ultrazvukem (IVUS), a to s užitím minimálního množství kontrastní látky.
Popis případu
V naší kazuistice se jednalo o 68letého pacienta s anamnézou diabetes mellitus 2. typu na inzulinovém intenzifikovaném režimu a s terminální renální insuficiencí na podkladě diabetické nefropatie a solitární ledviny v důsledku komplikované urátové lithiázy. Dialyzován je pro terminální renální insuficienci od roku 2015 2x týdně se zbytkovou průměrnou diurézou mezi dny dialýzy 200 ml. Pacient byl odeslán na naši kliniku pro klinické obtíže bolestí na hrudi charakteru anginy pectoris 2. stupně dle kanadské klasifikace trvající tři měsíce s dobrou reakcí na sublinguální nitráty. Pro tyto obtíže byla dne 27. 9. 2018 provedena invazivní selektivní koronarografie (SKG) s obrazem významného difuzního postižení proximálního a středního segmentu ramus interventricularis anterior (RIA) (Obr. 1A, 1B). Při samotné SKG byl použito 100 ml kontrastní látky. Vzhledem k postižení prognosticky významné tepny a trvající angině pectoris navzdory optimální farmakoterapii byl pacient indikován k provedení elektivní IVUS‑guided PCI s užitím minimálního množství kontrastní látky. V České republice se jednalo o první takto provedený výkon, a to dne 11. října 2018. Očekávaným výsledkem byla kompletní revaskularizace RIA s ústupem symptomatologie a především zachování reziduálních renálních funkcí (zbytkové diurézy 200 ml/den mezi jednotlivými dialýzami) a stávajícího počtu 2 dialýz týdně. Po předléčení duální protidestičkovou terapií (kyselina acetylsalicylová + clopidogrel) byl pacient s odstupem 2 týdnů od SKG pozván k provedení elektivní PCI.
Obr. 1. A, 1B. Nativní koronarogram ACS, ukazující angiograficky hraniční tubulární stenózu proximální RIA (červená šipka) a proximální RD (modrá šipka) 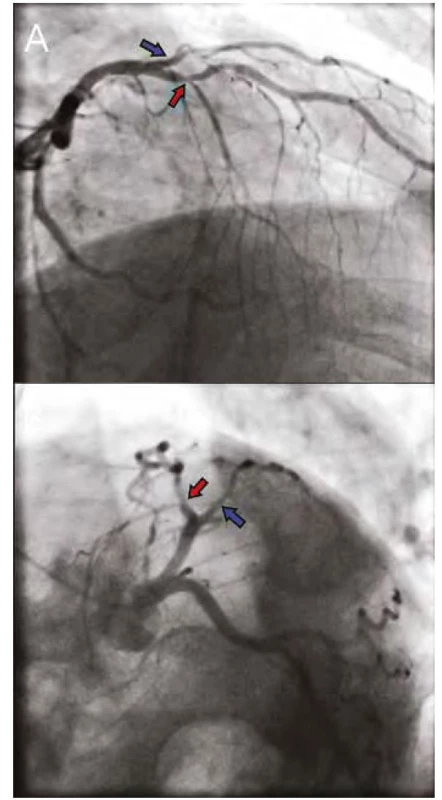
Pozn. ACS – arteria coronaria sinistra, ACD – arteria coronaria dextra , RIA – ramus interventricularis anterior, RD – ramus diagonali Obr. 1C. ACD s neobturující nástěnnou aterosklerózou 
Vlastní průběh zákroku
Výkon byl netypicky proveden cestou společné femorální tepny z důvodu nadměrného vinutí a. radialis. Ústí levé koronární tepny bylo selektivně nasondováno 6 French vodicím katétrem (guidingem) typu Judkins left 4. Správná poloha guidingu byla ověřena pomocí nástřiku koronární tepny fyziologickým roztokem, který byl provázen změnami ST úseku na EKG. Předcházející koronarografické snímky byly použity jako reference a po celou dobu intervence byly přítomny na obrazovce před intervenčním lékařským týmem. Do povodí RIA byly následně zavedeny dva koronární vodiče – první do periferie RIA a druhý do septální větve (Obr. 2). Vodič v RIA byl využit pro zavedení IVUS katétru Opticross s mechanickou sondou (Boston Scientific corp, NY, USA). Následně byl pořízen obrazový záznam intravaskulárního ultrazvuku při automatickém stahování katétru rychlostí 0,5 mm/s. Pohyb IVUS katétru byl sledován pod kontinuální fluroskopií, a to až do guidingu. Distální referenční diametr pro bezpečné umístění koronárního stentu byl změřen na 3 mm, difuzní postižení proximálně zasahovalo až nad odstup silné diagonální větve (RD), jejíž vlastní odstup nebyl postižen. Po tomto zjištění byl zaveden třetí „chránící“ koronární vodič do RD a vodič ze septální větve byl přemístěn do ramus circumflexus (RC) (ilustrační Obr. 3). Po predilataci celého úseků non‑kompliantním balonkem (NC) 2,75 x 18 mm až na 18 atmosfér (Obr. 4A, 4B) byl technikou tzv. buddy‑wires úspěšně implantován everolimem potažený lékový stent 3,0 x 48 mm (Obr. 4C). Stent byl poté postdilatován NC balónkem 3,0 x 22 mm na 18–20 atmosfér a proximálně od odstupu RD byla provedena proximální optimalizace stentu (POT) NC balonkem 3,5 x 6 mm na 18 atmosfér.
Obr. 2. IVUS katétr zavedený do RIA (červená šipka), vodič v septální větvi (modrá šipka) slouží jako orientační bod při absenci kontrastní látky. Červená a modrá hvězdička značí distální bod IVUS katétru, resp. IVUS sondu, která je místem začátku IVUS záznamu 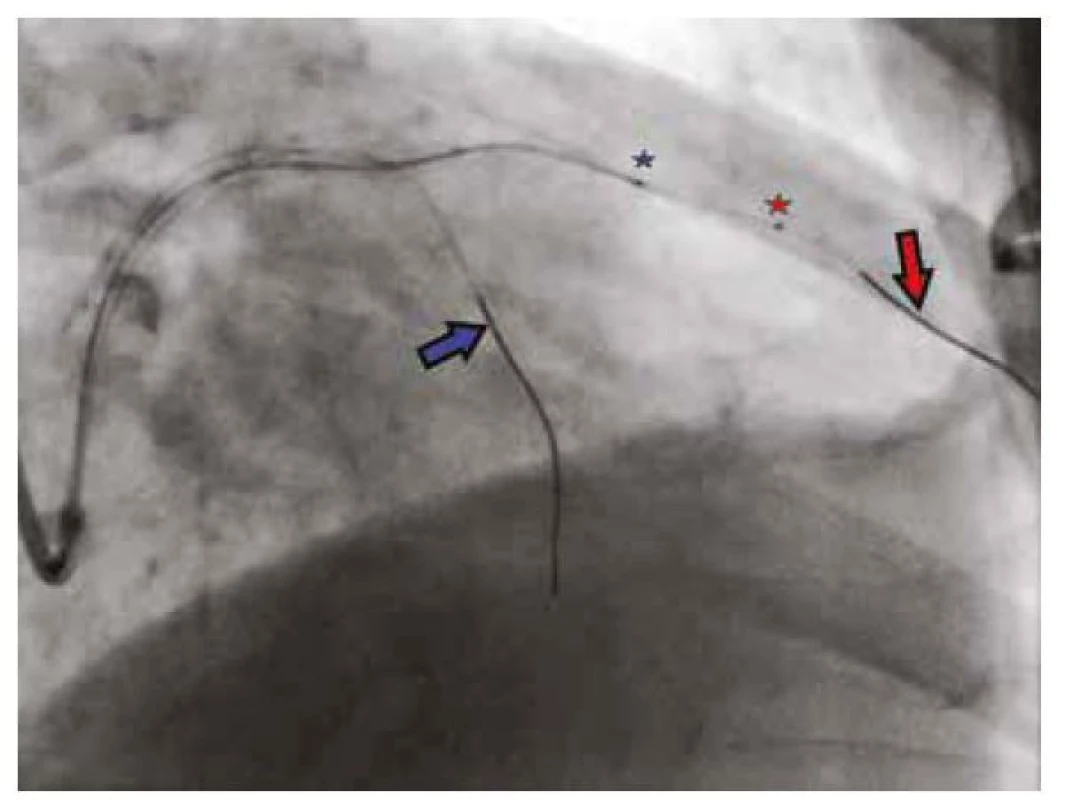
Pozn.: IVUS – intrakoronární ultrazvuk; RIA ramus interventricularis anterior Obr. 3. IVUS záznam umožňující analýzu rozsahu koronárního postižení, referenčního diametru tepny a délky postiženého úseku. Červená šipka značí příčný řez koronární tepnou, modrá šipka značí záznam z řezu podélného. Červenou hvězdou je pak označen nejdistálnější bod, fialovou místo zájmu zobrazené i na příčném řezu a žlutou oblast proximální 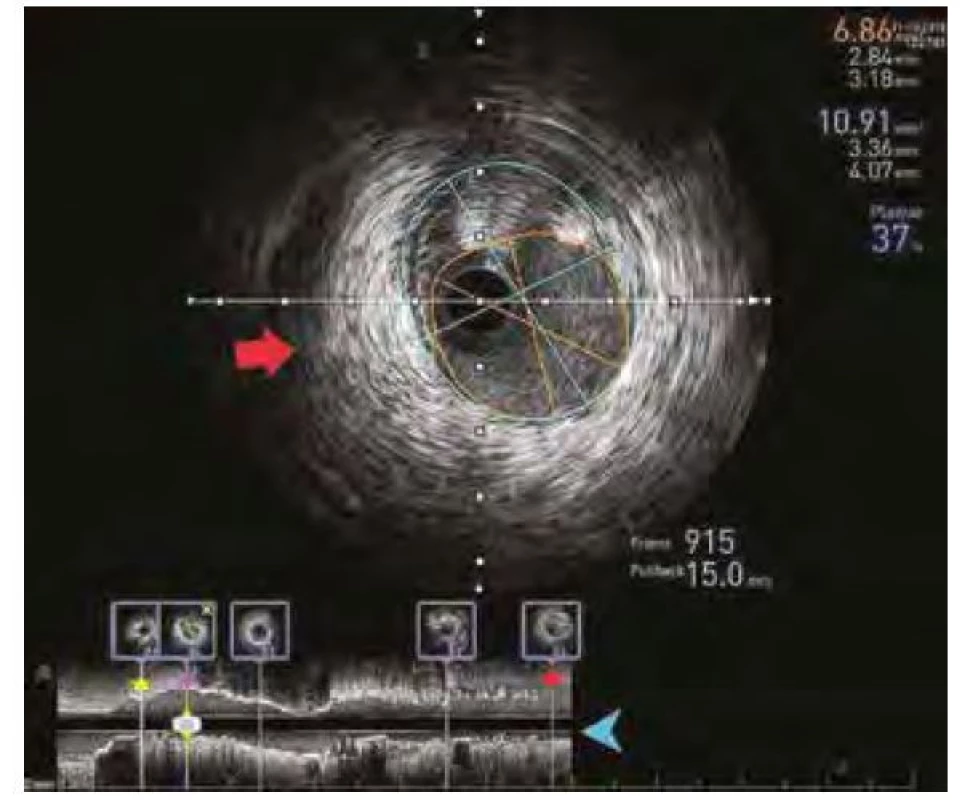
Pozn.: IVUS – intrakoronární ultrazvuk Obr. 4. A. Predilatace úseku proximálního RIA NC balonkem se zavedeným vodičem v RC (červená šipka) 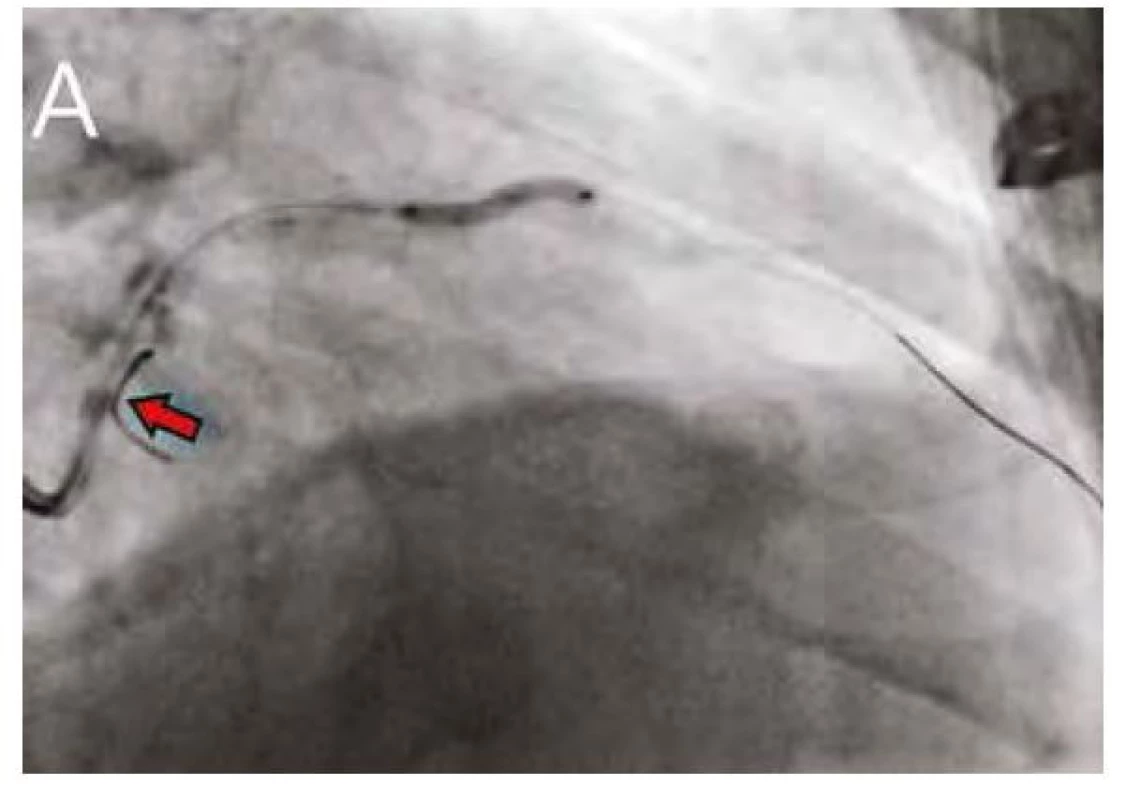
Obr. 4B. Predilatace středního úseku NC balonkem 2,75 x 18 mm 
Obr. 4C. Implantace everolimem potaženého lékového stentu 3,0 × 48 mm, patrný vodič v RD větvi (zelená šipka) 
Pozn. NC – non kompliantní, RIA – ramus interventricularis anterior, RC – ramus circumflexus, RD – ramus diagonalis Jediný nástřik 4 ml kontrastní látky na konci výkonu potvrdil optimální výsledek v intervenované tepně zjevný i z IVUS se zachovaným tokem do odstupujících tepen (Obr. 5A, 5B, ilustrační Obr. 6). Pacient byl propuštěn do domácího ošetřování bez nutnosti akutní hemodialýzy či zhoršení renálních funkcí v průběhu dvoudenní hospitalizace. V odstupu několika měsíců proběhla ambulantní kontrola s vymizením symptomatologie anginy pectoris a zachováním reziduální diurézy 200 ml. V průběhu psaní článku pak proběhla telefonická kontrola pacienta a HD centra kam dochází. Zbytková diuréza nyní je maximálně 100 ml se stávající frekvencí hemodialýz 2x týdně. Pacient se stran kardiovaskulárního systému těší dobrému zdraví s tolerancí běžné zátěže. Zhoršení zbytkové diurézy bylo bohužel v rámci těžké virové infekce respiračního traktu, etiologie SARS-CoV-2, pro kterou byl pacient hospitalizován na jednotce intenzivní péče.
Obr. 5. Finální angiografie RIA po PCI
5A. Angiografie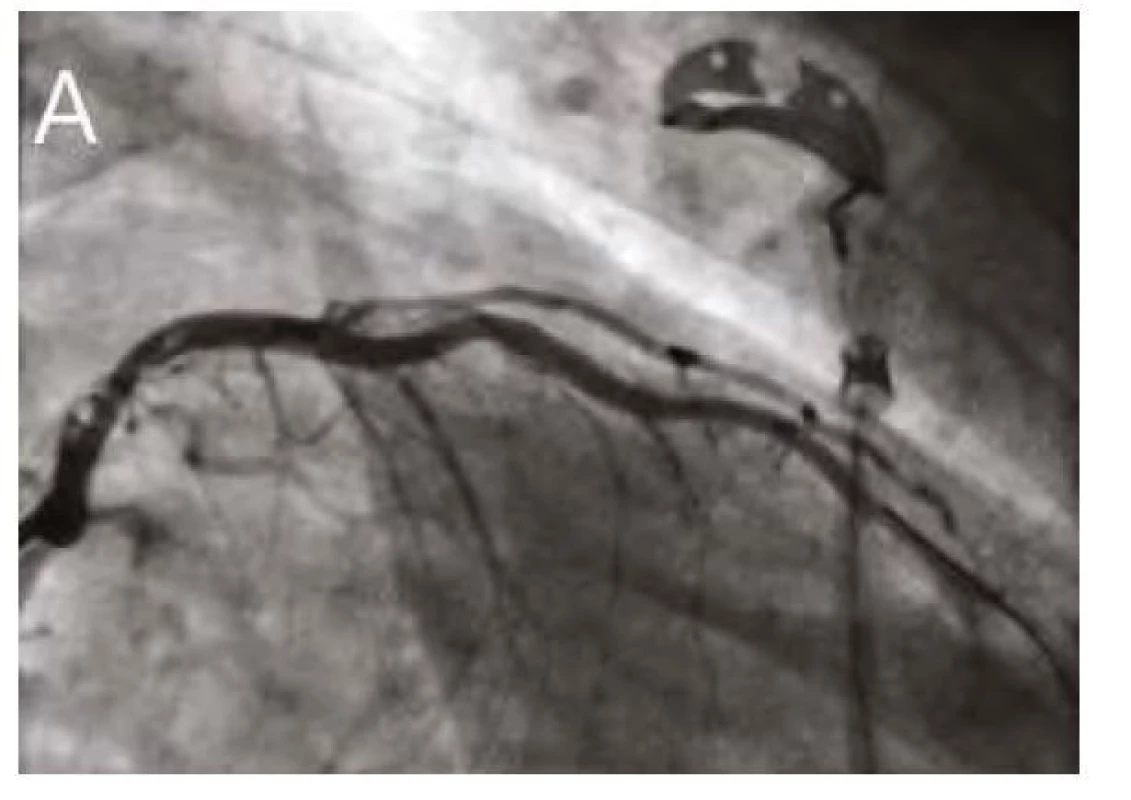
5B. Plná expanze stentu s využitím ClearStent technologie
(Siemens Healthcare GmbH, Německo)
Pozn. PCI – perkutánní koronární intervence, RIA – ramus interventricularis anterior Obr. 6. Kontrolní IVUS s vizualizací optimálního uložení, expanze a apozice koronárního stentu. Červené šipky ukazují struty koronárního stentu 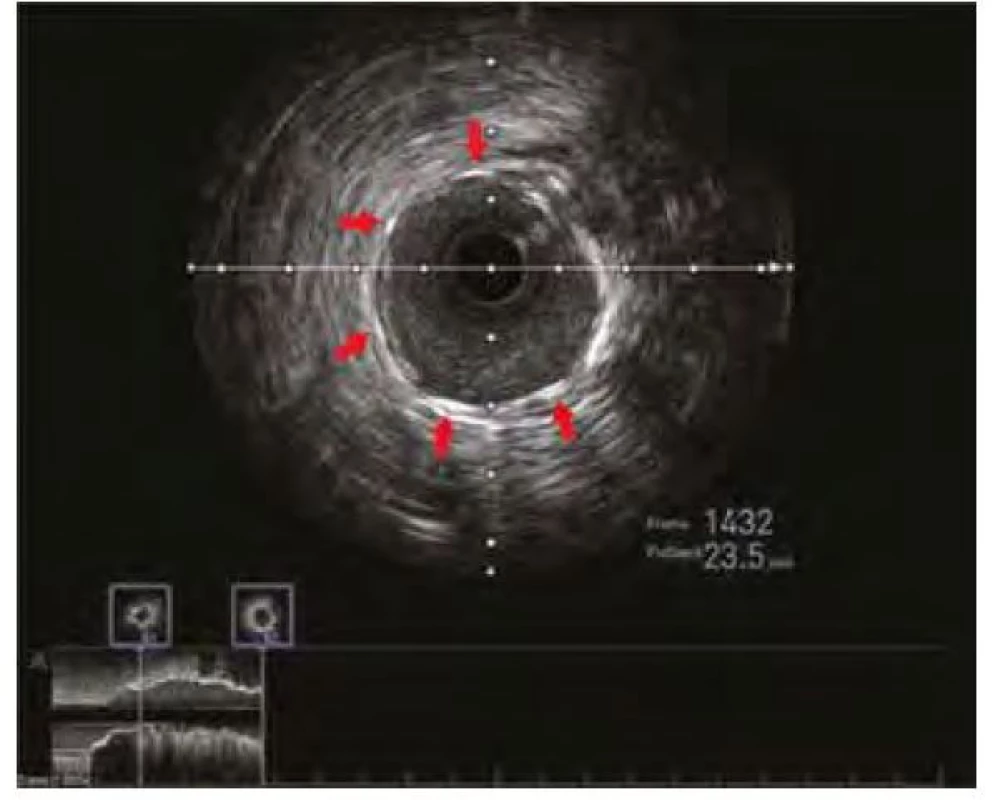
Pozn. IVUS – intrakoronární ultrazvuk Diskuze a závěr
Kontrastem indukovaná nefropatie (CIN) je aktuálně intenzivně řešenou problematikou. Je tomu tak pro zvýšenou četnost intervenčních zákroků na poli intervenční kardiologie či intervenční radiologie, tak také pro zvýšenou frekvenci užívání kontrastní látky na poli diagnostickém. Dle základní a nejčastěji používané definice vytvořené pracovní skupinou „The Kidney Disease Improving Global Outcomes (KDIGO)“ se jedná buď o akutní nárůst hodnoty kreatitininu o 26,4 μmol/l v horizontu 48 hodin, nebo elevaci kreatininu nad 1,5–2,0násobek bazální hodnoty, případně pokles diurézy pod hodnotu 0,5 ml/ kg/h (2). K vyslovení podezření na kontrastem indukovanou nefropatii pak musejí být tato kritéria splněna do 7 dnů od podání kontrastní látky. Riziko CIN je zvýrazněné zvláště u pacientů s chronickou renální insuficiencí. Jako další rizikové faktory působí především diabetes mellitus, akutní srdeční selhání v čase intervence či výrazná anémie. Po podání kontrastní látky dochází typicky k elevaci kreatininu, jehož maximálních hodnot je dosaženo 4. až 7. den po výkonu. Většina post‑kontrastních akutních renálních poškození se v rámci několika týdnů spontánně upraví. Nicméně u malého procenta pacientů dochází k přetrvávajícímu renálnímu poškození a rozvinutí chronické renální insuficience, v některých případech dokonce k nutnosti zahájení dialyzační léčby (3).
V patofyziologickém procesu CIN figurují alespoň tři významné procesy na úrovní celulárního a makrocelulárního metabolismu. Jedná se o vazokonstrikci v oblasti dřeně ledviny, která způsobí medulární hypoxii. Kontrastní látka zároveň působí přímou toxicitu na renální tubulární buňky, a nakonec dochází k narušení rovnováhy mezi vazodilatačními a vazokonstrikčními působky (4). Posouzení individuálního rizika CIN je velmi obtížné. V zásadě se lze opřít o nejdéle působící stratifikační model rizik od Mehranové et al. (5), který byl také využit ve velkých multicentrických studiích. Jedná se o aditivní skórovací systém sestávající z přítomnosti hypotenze, akutního srdečního selhání, chronické renální insuficience, diabetu, anémie, věku nad 75 let, užití kontrapulzace a množství kontrastní látky.
Jedinou prokázanou farmakologickou prevencí CIN je dle doporučení ESC (European society of cardiology) hydratace izotonickým fyziologickým roztokem (1–1,5 ml/kg/h po dobu 3–12 hodin před výkonem a následně 1–1,5 ml/kg/h po dobu 12–24 hodin po výkonu). Toto dávkovací schéma lze urychlit při ad hoc výkonu na 3 ml/kg/h po dobu 1–3 hodin před výkonem a stejného množství po dobu 4–6 hodin po výkonu. Dávku fyziologického roztoku je však třeba upravit na 0,5 ml/kg/h při HFrEF s EF ≤ 35 % (6, 7). Jistou úpravou dávkování tekutin vyžaduje i přítomnost samotné chronické renální insuficience, zvláště pak v terénu end stage renal disease (ESRD). Dávkovácí schéma by pak mělo vzniknout ve spolupráci s nefrology a dialyzačním centrem. Tato doporučení jsou souznačná s aktuálními doporučeními francouzské nefrologické a radiologické společnosti z roku 2021, liší se pouze v tom, že se klaní spíše k rychlejší aplikaci roztoku, případně v aplikaci NaHCO3 jako alternativa fyziologického roztoku (8).
Paušální podávání acetylcysteinu nelze dle výsledků studie PRESERVE a ACT doporučit, neboť nebyl prokázán klinický benefit ani po tříměsíčním sledování pacientů (9, 10). Profylaktické předléčení rosuvastatinem ve vysoké dávce prokázalo v některých studiích (PRATO‑ACS) (11) významné snížení incidence kontrastem indukované nefropatie, naopak ve studii PROMISS (12) tento efekt prokázán nebyl. Není‑li tedy jiná indikace pro léčbu statinem, paušálně jejich podání před SKG/PCI nelze doporučit. Preventivní hemodialýza u pacientů podstupujících SKG/PCI je také bez efektu, a to i u pacientů s CHRI ve stadiu G4. Není tedy nutné koordinovat dialýzu a výkon se zatížením kontrastní látkou (13, 8).
Technika výkonu popsaná v této kazuistice využívá intravaskulární ultrazvuk a minimálního množství kontrastní látky a vychází z předchozí SKG. Koronární vodiče v postranních větvích slouží jako orientační body při implantaci stentu a nezbytnou podmínkou těchto výkonů je vysoká erudice katetrizačního týmu. Výhodou tohoto přístupu je možnost nabídnout bezpečnou intervenci koronárních stenóz i subpopulaci pacientů trpících těžkou renální insuficiencí, případně i pacientům alergickým na kontrastní látku. Na poli intervenční kardiologie bylo v posledních letech publikováno několik studií, které se touto problematikou zabývají. Jedná se buď o využití OCT (optical coherence tomography), IVUS (intravascular ultrasound), případně měření FFR/iFR (Fractional flow reserve/Instantaneous wave‑free ratio) (14). V poslední době jsou první publikované zkušenosti s těmito technikami i u pacientů akutních, u kterých není možná odpovídající hydratační příprava (15).
K ozřejmění dlouhodobé bezpečnosti a cenové efektivity budou třeba velké multicentrické studie, nicméně již nyní je zřejmé, že se jedná o důležitou oblast intervenční kardiologie zasahující a vyžadující spolupráci dalších oborů. V současnosti jsou kandidáty této terapie především pacienti s pokročilou renální insuficiencí, a to včetně pacientů s reziduální diurézou v chronickém dialyzačním programu.
Podpořeno MZ ČR – RVO (FNBr, 65269705)
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Petr Kala, Ph.D., FESC, FSCAI
Interní kardiologická klinika FN a LF MU Brno Jihlavská 340/20, 625 00 Brno-Bohunice
Cit. zkr: Vnitř Lék 2021; 67(7): 433–437
Článek přijat redakcí: 29. 8. 2021
Článek přijat po recenzích: 20. 10. 2021
Zdroje
1. Nash K, Hafeez A, Hou S. Hospital‑acquired renal insufficiency. Am J Kidney, DiS. 2002.
2. Bellomo R, Ronco C, Kellum JA, Mehta RL, Palevsky P. Acute Dialysis Quality Initiative workgroup. Acute renal failure – definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care [Internet]. Srpen 2004; 8(4): R204–R212. Dostupné z: http://www.ncbi.nlm.nih.gov/pubmed/15312219
3. Thomsen HS, Morcos SK. Contrast media and the kidney: European Society of Urogenital Radiology (ESUR) guidelines. British Journal of Radiology. 2003.
4. Mehran R, Dangas GD, Weisbord SD. Contrast‑Associated Acute Kidney Injury. Ingelfinger JR, editor. N Engl J Med [Internet]. 30. květen 2019; 380(22): 2146–2155. Dostupné z: http://www.nejm.org/doi/10.1056/NEJMra1805256
5. Mehran R, Aymong ED, Nikolsky E, Lasic Z, Iakovou I, Fahy M et al. A simple risk score for prediction of contrast‑induced nephropathy after percutaneous coronary intervention. J Am Coll Cardiol [Internet]. Říjen 2004; 44(7): 1393–1399. Dostupné z: https://linkinghub. elsevier.com/retrieve/pii/S0735109704014457
6. Neumann FJ, Sousa‑Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. European Heart Journal 2019.
7. Victor S, Sankardas MA. Contrast Induced Nephropathy – An update. e‑journal ESC Counc Cardiol Pract Vol13 No4. 2014.
8. de Laforcade L, Bobot M, Bellin M‑F, Clément O, Grangé S, Grenier N et al. c. Diagn Interv Imaging [Internet]. Březen 2021; 102(3): 131–139. Dostupné z: https://linkinghub.elsevier. com/retrieve/pii/S2211568421000280
9. Berwanger O. Acetylcysteine for prevention of renal outcomes in patients undergoing coronary and peripheral vascular angiography: Main results from the randomized acetylcysteine for contrast‑induced nephropathy trial (ACT). Circulation. 2011
10. Weisbord SD, Gallagher M, Jneid H, Garcia S, Cass A, Thwin S‑S et al. Outcomes after Angiography with Sodium Bicarbonate and Acetylcysteine. N Engl J Med. 2018.
11. Leoncini M, Toso A, Maioli M, Tropeano F, Villani S, Bellandi F. Early high‑dose rosuvastatin for contrast‑induced nephropathy prevention in acute coronary syndrome: Results from the PRATO‑ACS study (protective effect of rosuvastatin and antiplatelet therapy on contrast‑induced acute kidney injury and myocardial damage. J Am Coll Cardiol. 2014.
12. Jo S‑H, Koo B‑K, Park J‑S, Kang H‑J, Cho Y‑S, Kim Y‑J et al. Prevention of radiocontrast medium–induced nephropathy using short‑term high‑dose simvastatin in patients with renal insufficiency undergoing coronary angiography (PROMISS) trial a randomized controlled study. Am Heart J [Internet]. Březen 2008; 155(3): 499.e1–499.e8. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0002870307010393
13. Kawashima S, Takano H, Iino Y, Takayama M, Takano T. Prophylactic Hemodialysis Does Not Prevent Contrast‑Induced Nephropathy After Cardiac Catheterization in Patients With Chronic Renal Insufficiency. Circ J [Internet]. 2006; 70(5): 553–558. Dostupné z: http://www.jstage.jst.go.jp/article/circj/70/5/70_5_553/_article
14. Ali ZA, Karimi Galougahi K, Nazif T, Maehara A, Hardy MA, Cohen DJ et al. Imagingand physiology‑guided percutaneous coronary intervention without contrast administration in advanced renal failure: a feasibility, safety, and outcome study. Eur Heart J [Internet]. 21. říjen 2016; 37(40): 3090–3095. Dostupné z: https://academic.oup.com/ eurheartj/article‑lookup/ doi/10.1093/eurheartj/ehw078
15. Rozenbaum Z, Benchetrit S, Rozenbaum E, Neumark E, Mosseri M, Pereg D. Ultra‑Low Contrast Volume for Patients with Advanced Chronic Kidney Disease Undergoing Coronary Procedures. Nephron 2018.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Co přinášejí pro klinickou praxi mezinárodní aktivity Less is more a Choosing wisely?
- Cesty ke správnému rozhodování ve všeobecné interně, nefrologii a revmatologii
- Kdy nadbytek péče může poškodit nemocné v oblasti zájmu generalistů?
- Metabolické a endokrinní choroby – je náš přístup vždy racionální?
- Expertní konsenzus k praktickým aspektům spolupráce kardiologa a diabetologa v péči o pacienty s chronickým srdečním selháním s redukovanou ejekční frakcí
- Kardiovaskulární prevence: časná a důsledná prevence versus pozdní intervence, komplexní přístup k léčbě ovlivnitelných rizikových faktorů: hypertenze a dyslipidemie
- Hereditární hemoragická teleangiektázie (syndrom Osler‑Weber‑Rendu) – Díl II. Medikamentózní léčba a mezinárodní doporučení pro léčbu z roku 2020
- Adekvátní a neadekvátní terapie u pacientů s implantabilním kardioverterem‑defibrilátorem
- První bezkontrastní PCI vedená intrakoronárním ultrazvukem v České republice
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hereditární hemoragická teleangiektázie (syndrom Osler‑Weber‑Rendu) – Díl II. Medikamentózní léčba a mezinárodní doporučení pro léčbu z roku 2020
- Adekvátní a neadekvátní terapie u pacientů s implantabilním kardioverterem‑defibrilátorem
- První bezkontrastní PCI vedená intrakoronárním ultrazvukem v České republice
- Metabolické a endokrinní choroby – je náš přístup vždy racionální?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



