-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaHereditární hemoragická teleangiektázie (syndrom Osler‑Weber‑Rendu) – Díl II. Medikamentózní léčba a mezinárodní doporučení pro léčbu z roku 2020
Hereditary hemorrhagic telangiectasia (Osler‑Weber‑Rendu syndrome) – Part II. Pharmacological therapy and international guidelines for the therapy 2020
Hereditary hemorrhagic telangiectasia also known as Osler-Weber-Rendu syndrome, is an disorder that causes abnormal blood vessel formation with bleeding. Inhibition of angiogenesis amelioretes bleeding complication. Anti-angiogenic agents such as bevacizumab, aflibercept, thalidomid, lenadomid and other new anti-angiogenic thyrosinkinase inhibitors, as well as sirolimus and takrolimus have emerged as a promising systemic or local therapy in reducing bleeding complications but are not curative. Other pharmacological agents include iron supplementation, antifibrinolytics and hormonal treatment. This review concentrates on new anti-agioproliferative drugs with effect in HHT - discusses the new biology of HHT, management issues that face the practising hematologist, and considerations of future directions in HHT treatment.
Keywords:
sirolimus – bevacizumab – aflibercept – thalidomid – tacrolimus – hereditary hemorrhagic telangiectasia – lenadomid anti‑angiogenic thyrosinkinase inhibitors
Autoři: Zdeněk Adam 1; Dagmar Brančiková 1; Gabriela Romanová 2; Luděk Pour 1; Marta Krejčí 1; Jiří König 3; Tomáš Nebeský 4; Zuzana Adamová 5; Martin Štork 1; Martin Krejčí 1; Sabina Ševčíková 4; Michal Eid 1; Viera Sandecká 1; Zdeněk Král 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Oddělení klinické hematologie FN Brno 2; Oddělní krční, nosní, ušní FN Brno 3; Klinika radiologie a nukleární medicíny – FN Brno 4; Ústav patologické fyziologie LF MU a FN Brno 5; Chirurgické oddělení nemocnice Vsetín 6
Vyšlo v časopise: Vnitř Lék 2021; 67(7): 419-424
Kategorie: Přehledové články
Souhrn
Hereditární hemoragická teleangiektázie (HHT) je choroba s abnormální tvorbou cév, což vede ke krvácivým komplikacím. Zmenšit jejich intenzitu či zcela jim zabránit mohou antiangiogenní léky, jako je bevacizumab, aflibercept, thalidomid, lenalidomid a další ze skupiny antiangiogenních inhibitorů tyrosinkináz. Jsou účinné jak při systémovém, tak při lokálním podání. Tyto nové léky přibyly ke klasické terapii, jako je suplementace železa, antifibrinolytika a hormonální léčba. Tento přehled se koncentruje na nové antiangioproliferativní léky účinné u HHT, které mohou být dnes použity pro léčbu, ale naznačuje i které léky se možná po ověření klinickými studiemi dostanou brzy do praxe.
Klíčová slova:
sirolimus – bevacizumab – thalidomid – lenalidomid – aflibercept – takrolimus – antiangiogenní tyrosinkinázové inhibitory
Úvod
Tento text navazuje na předchozí s názvem Hereditární hemoragická teleangiektázie (HHT) neboli syndrom Osler‑Weber‑Rendu. Klinické projevy nemoci a z nich plynoucí nutnost skríninku arteriovenózních malformací. Tato část se soustředí pouze na léčbu a informuje o závěrech mezinárodního doporučení pro léčbu HHT (1, 2).
HHT je spojena s krvácením, a tak je pochopitelné, že pacienti se obracejí na hematologa s prosbou o pomoc (3). Důležitá role připadá ORL lékařům s jejich metodami lokální léčby epistaxe (4, 5). Na léčbě HHT se však musí podílet lékaři mnoha specializací (3).
Ale kdo z lékařů má vést medikamentózní léčbu a organizovat kontrolní zobrazovací vyšetření, případně domlouvat zákroky s intervenčními radiology? Naše pracoviště pečuje o tyto pacienty nejméně již dvě desetiletí. První léky s antiangiogenním potenciálem byly používány pro léčbu mnohočetného myelomu (interferon alfa, thalidomid a lenalidomid), proto péči o tyto nemocné převzali lékaři ambulance pro mnohočetný myelom. V pozdějších letech se nové a ještě účinnější léky inhibující neoangiogenezi (bevacizumab a další) dostaly do rukou lékařům pracujícím v ambulancích solidní onkologie, a proto léčba těchto pacientů přešla do rukou lékařů zaměřených na medikamentózní léčbu solidních tumorů. Literatura vždy doporučuje multidisciplinární přístup, to je sice pravda, ale vždy musí být nějaký lékař tím motorem, který pacienta přes multidisciplinární přístup aktivně protlačí a který bude o tyto nemocné po dlouhé roky pečovat. Následující text navazuje na naše již dříve publikované zkušenosti s léčbou této choroby u našich pacientů (6) a na nedávno publikovaný stručný přehled nových léků pro tuto nemoc (7), v němž jsou umístěny i obrázky našich pacientů.
Cílem tohoto textu je předložit závěry mezinárodních doporučení z roku 2020 (1–5), stručně formulované ve třech tabulkách a s podrobnějším vysvětlením v textu. Doporučení, které bylo publikováno v časopise Blood v roce 2021, sumarizuje tabulka 1.
Tab. 1. Léčba krvácení při HHT – sumarizované léčebné postupy publikované v časopise Blood v roce 2021 (1) 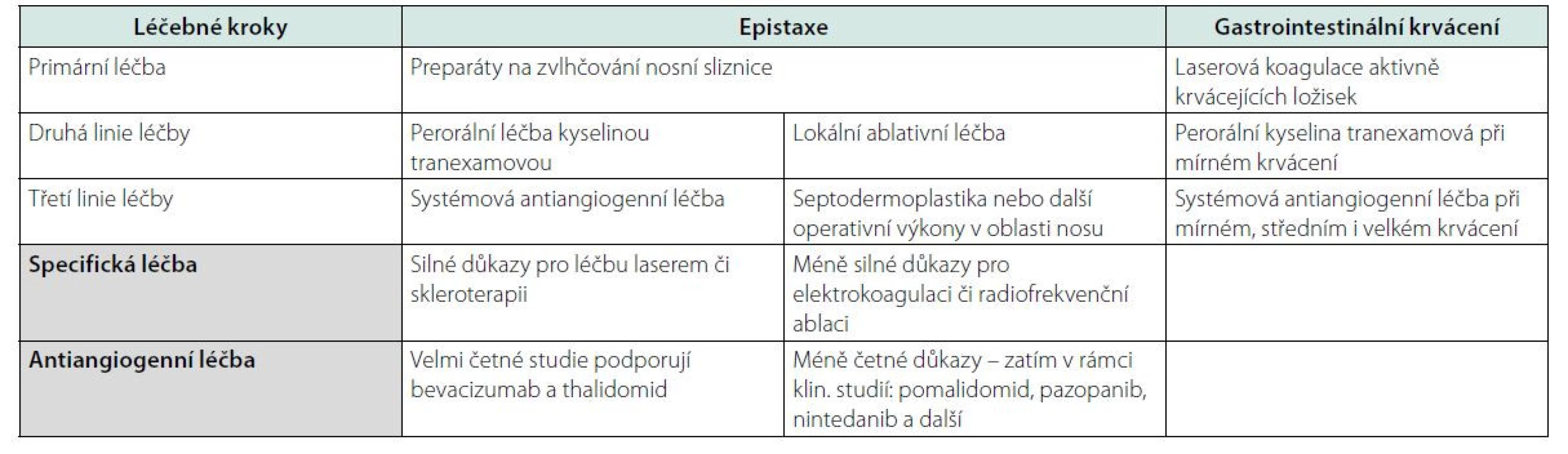
Léčba epistaxe
V první fázi nemoci, kdy dominujícím problémem jsou ztráty krve epistaxí, je léčba lokální. Jako prevence se doporučuje udržování sliznice ve vlhkém stavu aplikací fyziologického roztoku či gely anebo krémy pro nosní použití. Při krvácení tampon s antifibrinolytikem. Pokud přesto dochází k častému krvácení, je dalším doporučeným krokem použití tamponády. Dále je pak na ORL specialistech, zda použijí elektrokauterizaci krvácejících cévek, nebo stavění krvácení s pomocí laseru. Náročnější metodou je pak embolizace nazální arterie. Při refrakterních epistaxích lze aplikovat do nosních průchodů balonkovou tamponádu, výjimečně se provádí i ligatura arteria karotis externa, a to nad odstupem arteria tyreoidea superior. Dalším operačním řešením je náhrada fragilní nazální sliznice bukální sliznicí (dermoplastika, septodermoplastika) (1–5). Lokální postupy při léčbě opakované epistaxe byly opakovaně shrnuty českými ORL specialisty (8–10).
V randomizované studii vedlo podávání kyseliny tranexamové v dávce 1 g 3x denně ke snížení počtu epistaxí o 54 % ve srovnání s placebem, ačkoliv neměla statisticky signifikantní vliv na zvýšení hemoglobinu (11).
Pokud lokální léčba selhává, je doporučována aplikace bevacizumabu, který se osvědčil v četných studiích, a tuto léčbu uvádějí i citovaná guidelines pro léčbu krvácení z nosu (1, 4). Tabulka 2 shrnuje doporučení pro léčbu epistaxe (1).
Tab. 2. Léčebná doporučení pro pacienty s epistaxí při HHT publikovaná v časopise Blood 2021 (1) 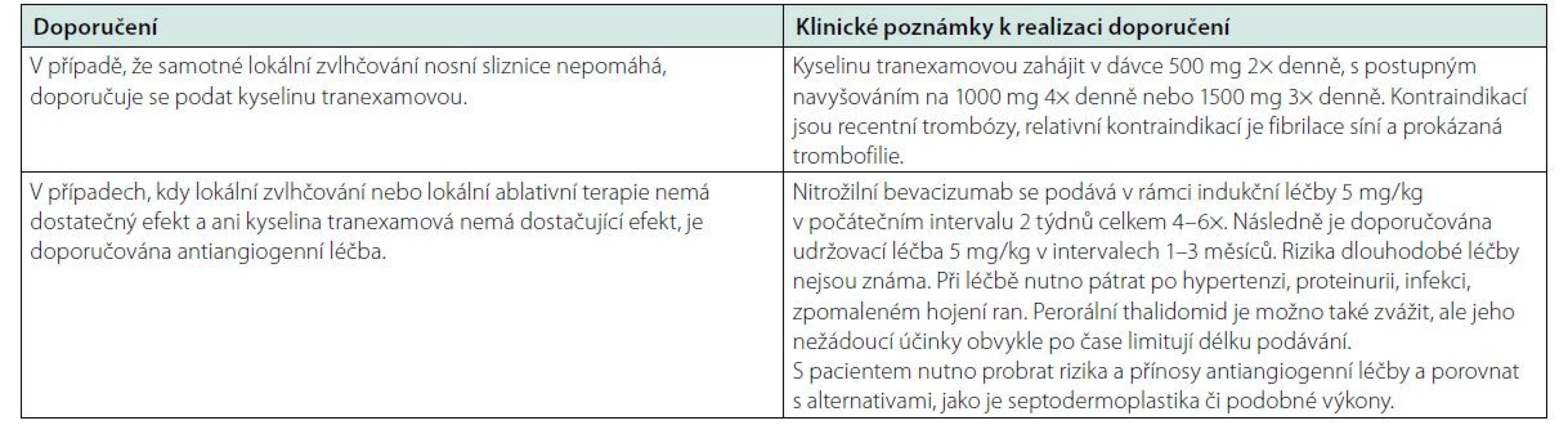
Léčba krvácení z gastrointestinálního traktu (GIT)
Na krvácení z GIT je nutno vždy myslet při anemizaci bez epistaxe či jen s mírnou epistaxí. Pak je na místě vždy vyšetření zažívacího traktu endoskopickými metodami jak s diagnostickým, tak léčebným cílem. K diagnostice lze použít také videokapsli. Teleangiektázie mohou být přítomny v jícnu, žaludku, ale i v tenkém střevě a tlustém střevě. Pokud je možné, provádí se lokální léčba. Při změnách většího rozsahu, které nelze ošetřit lokální léčbou, je pak indikována farmakologická léčba. Na prvním místě je nutno zmínit oktreotid, který dle citovaných prací snižuje krevní ztráty (12–15). Dále pak podobně jako u epistaxe antifibrinolytika a antiangiogenní léky (1–4). A pokud se podaří lokalizovat krvácení, lze použít laserovou koagulaci. Operační výkony jsou výjimečné, ale nelze je vyloučit (16). Postup léčby shrnuje tabulka 3 (1).
Tab. 3. Léčebná doporučení pro pacienty s HHT a ztrátami krve gastrointestinálním traktem, publikovaná v časopise Blood 2021 (1) 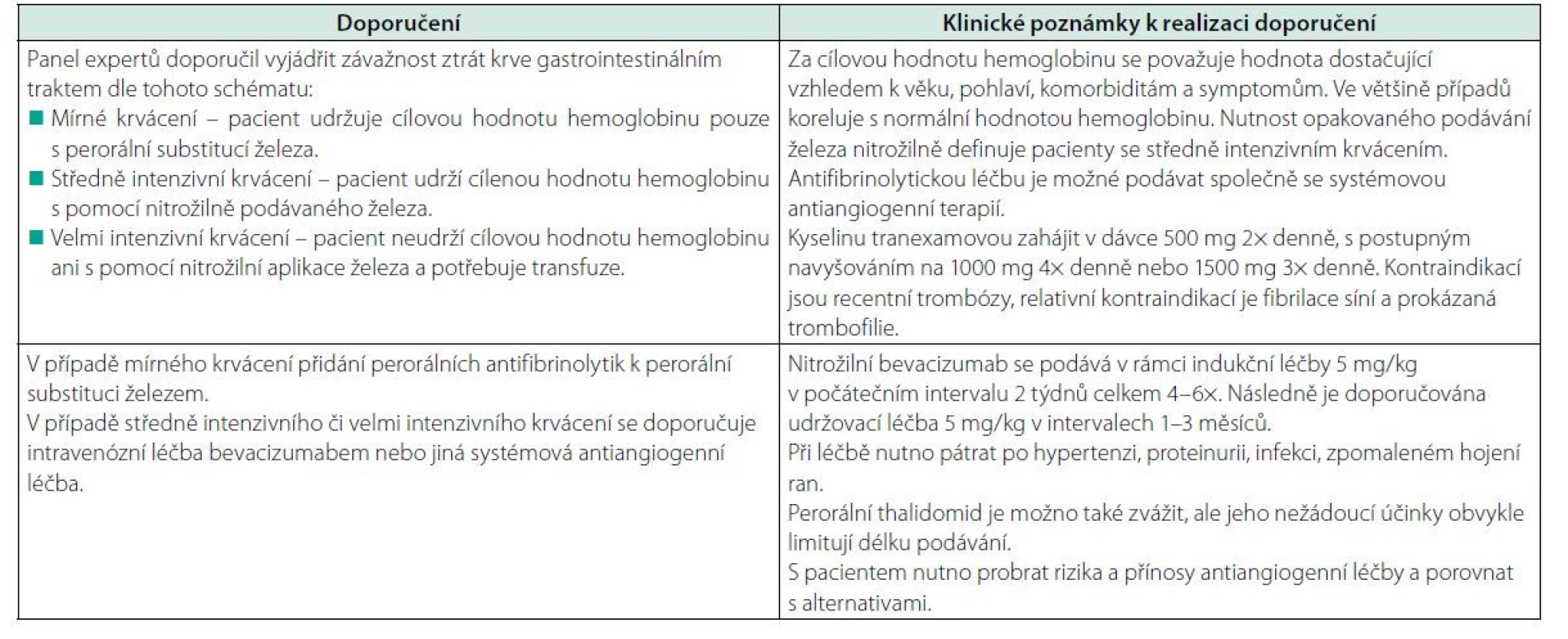
Léčba arteriovenózních malformací (AVM)
Pro lokální léčbu AVM se používají embolizační techniky, lze použít ale také operační řešení či radioterapii, pokud je ložisko dobře radioterapeuticky ošetřitelné. To je nutné provádět ve spolupráci se specialisty na jednotlivé orgány a specialisty na intravaskulární výkony a případně probrat s odborníky na radioterapii. Zásadní je však provádění skríninkových vyšetření na tyto AVM u všech pacientů s HHT (1–3). Nejčastěji způsobují komplikace HAVM, a proto stručně zmíníme jejich léčbu. Pro léčbu HAVM lze použít angiografie. Angiografie a selektivní embolizace má však nepřehlédnutelné komplikace (17, 18). Jako nejčastější z nich se popisuje ischemické poškození jater (19). Intravaskulárním léčebným postupům se již roky velmi intenzivně věnují na Radiologické klinice v Hradci Králové v čele s profesorem Krajinou (20–23). Operační řešení je výjimečné (24).
A proto další alternativa je transplantace jater. Metaanalýza všech údajů publikovaných v anglické literatuře byla zveřejněna v roce 2017. Autoři z Oxfordu nalezli v anglické medicínské literatuře údaje od 57 pacientů, kteří podstoupili transplantaci jater z těchto důvodů. Zjistili, že desetiletí přežití pacienta i graftu bylo dosaženo u 82,5 %. Proto doporučují zvážit tuto alternativu léčby u vhodných pacientů (25). K podobným závěrům došla i recentní analýza pacientů z USA (26). Překvapivě byla však popsána i recidiva v transplantovaných játrech (27). Pokud již je rozvinutá plicní hypertenze, zvyšuje to riziko transplantační léčby, a proto je vhodné k tomuto kroku přistoupit ještě před rozvinutím této komplikace (18). Játra k transplantaci však nejsou ihned k dispozici, a proto je třeba interval do transplantace jater překlenout vhodnou léčbou. Literatura uvádí, že pravidelné aplikace bevacizumabu, který bude podrobněji zmíněn v dalším odstavci, snížily průtok jaterními cévními malformacemi, snížily plicní hypertenzi a umožnily tak pacientovi dožít se transplantace jater (29, 30).
Léky snižující krevní ztráty u HHT
Rutin a kyselina askorbová
Bioflavonoid je důležitý pro normální funkci kapilár. Je obsažen v mnoha kompozitních preparátech, z nichž nejznámější je asi Ascorutin (3). Vitamin C je důležitý pro normální permeabilitu kapilár. Obě látky, rutin a vitamin C, účinně upravují zvýšenou fragilitu a permeabilitu kapilár. V případě krvácivých potíží lze podávat preparát Ascorutin v dávce až 3x dvě tablety, toto lze i dlouhodobě. Mimo krvácení je udržovací dávka 2–3x denně jednu tabletu (3).
Etamsylát (Dicynone)
Je syntetická látka s antihemoragickým a angioprotektivním účinkem, zvyšuje adhezivitu trombocytů a zkracuje dobu krvácení. Nemá vazokonstrikční účinek. V případě krvácení se podávají 2 ampulky nitrožilně po 4–6 hodinách, v případě perorálního podání 1 tobolka à 500 mg à 4–6 hodin, případně udržovací léčba 1 tableta 2–3x denně (3).
Kyselina tranexamová (Exacyl)
Antihemoragický účinek kyseliny tranexamové spočívá v inhibici fibrinolytické aktivity plazminu. Indikací podání jsou krvácení z gastrointestinálního traktu, dolních cest močových, ORL a stomatologické oblasti. K inhibici fibrinolytické aktivity jsou dostatečné dávky 2 g po 8 hodinách (11).
Substituce železa
Pokud lokální léčba epistaxe přestane plnit svůj cíl, epistaxe způsobí hypochromní anémii. Příčinou hypochromní anémie jsou však také ztráty střevním traktem. Prvním léčebným krokem je perorální substituce železa. A pokud podávání perorálních preparátů železa nestačí, lze zvážit nitrožilní aplikaci nových bezpečných nitrožilních preparátů železa, které mohou ušetřit transfuze erytrocytů (3). V roce 2021 jsou v ČR dostupné tyto preparáty železa:
Ferinject, což je carboxymaltosum ferricum (komplex železa a maltózy), může dodat celkovou potřebnou dávku 1000 mg železa v jedné 15minutové infuzi.
Venofer, což je ferri oxidatum saccharatum (oxid železitý se sacharózou).
Ferlecit, což je ferri natrii gluconas. Ferlecit a Venofer jsou určeny k i.v. injekci 200 mg železa v jedné dávce.
Estrogeny a antiestrogeny
V předchozích desetiletích lékaři marně hledali léky, které by zpomalily progresi této nemoci a snížily krevní ztráty. První účinnou léčbou, dle limitovaných zkušeností staršího data, byla aplikace kombinované hormonální léčby estrogen–progesteron (etinylestradiol 0,05 mg + 1 mg noretisteron). Ve srovnání s placebem snížila tato hormonální léčba počet potřebných transfuzí v prospektivní randomizované kontrolované studii (1). Hormonální léčba deriváty estrogenu a progesteronu však může způsobit komplikace, zvláště pokud je podávána mužům. Proto je tato hormonální léčba dnes považována za vhodnou pro ženy, které jsou po menopauze a po hysterektomii.
Hypotéza, že stimulace estrogenních a progesteronových receptorů může zmenšit míru krevních ztrát, je však stále živá. V posledních letech byl v této indikaci testován raloxifen (31). Dále se objevily výsledky prospektivní randomizované klinické studie, v níž byl se stejným cílem použit antiestrogen tamoxifen. Výsledkem této prospektivní studie bylo snížení krevních ztrát ve skupině dostávající pravidelně tamoxifen (32).
Preparáty ze skupiny antiestrogenů mají svoji slabou vnitřní aktivitu (intrinsic acitivity), a proto u žen, které po menopauze užívají tamoxifen, dochází k hypertrofii endometria, ale také ke zpomalení progrese HHT. Dříve se používal v této indikaci také danazol 200 mg 3–4x denně, tamoxifen 20 mg denně nebo raloxifen 60 mg denně (3). Dnes se však objevily účinnější antiangiogenní léky, a proto již estrogeny a antiestrogeny nejsou tak často používané (1, 3).
Thalidomid
Thalidomid je lék, který výrazně potlačuje angiogenezi (33), stimuluje maturaci cév a brzdí novotvorbu cév nových. Thalidomid ovlivňuje expresi jednotlivých komponent signálních cest angiogeneze, včetně tvorby vaskulárního endoteliálního růstového faktoru – VEGF. Thalidomid velmi intenzivně působí na endoteliální buňky nezralých cév a indukuje jejich maturaci, a tím zmenšuje jejich křehkost. Jedním z problémových účinků thalidomidu je prokoagulační efekt, který zodpovídá za trombembolické komplikace.
Díky svému inhibičnímu vlivu na angiogenezi a díky indukci maturace již vytvořených cévních struktur se thalidomid osvědčil u léčby cévních malformací. Trávicí trakt může být postižen drobnými angiodysplaziemi, které způsobují krvácení. Tyto střevní angiodysplazie mohou být projevem HHT, ale mohou vzniknout i bez genetického podkladu HHT, jako vícečetné střevní agiodysplazie. Střevní angiodysplazie mohou být součástí poměrně agresivně se chovající angiomatózy.
U všech těchto nemocných s angiodysplaziemi různé morfologické klasifikace byl použit thalidomid s pozitivním výsledkem. Obvyklá dávka používaná pro léčbu pacientů s angiodysplaziemi, hemangiomy a angiomatózou je stejná dávka jako u mnohočetného myelomu, tedy 100 až 200 mg denně, tedy 1–2 tablety večer (34–36).
Lenalidomid
Lenalidomid je novější derivát thalidomidu. Na rozdíl od thalidomidu nezpůsobuje neurotoxicitu, ale zato způsobuje myelosupresi. Antiangiogenní účinek si lenalidomid ponechává, udává se však, že v menší intenzitě než thalidomid. Zatím o indikaci lenalidomidu v této indikaci je podstatně méně publikací než o thalidomidu. Lze z nich usoudit, že lenalidomid určitý klinicky zjevný antiangiogenní efekt má a je možné jeho indikaci v těchto případech otestovat (37–39).
Bevacizumab
Bevacizumab je monoklonální protilátka namířená proti vaskulárnímu endoteliálnímu růstovému faktoru – VEGF. Tento lék je pod názvem Avastin používán u některých karcinomů. Tím, že v nádoru zablokuje novotvorbu cév, zastaví růst nádoru.
Z cévních novotvarů jsou to právě malformace typu HHT, u nichž byl popsán pozitivní účinek bevacizumabu u poměrně velkého počtu pacientů. A pro jeho značný přínos jej zahraniční autoři nazvali blessing for the bleeder (40).
Při nitrožilní aplikaci se obvykle používal bevacizumab v dávce 5–10 mg/kg v nitrožilní infuzi v intervalu 2–4 týdnů obvykle do 6 cyklů. Dle farmakokinetických studií byla suprese vaskulárního endoteliálního růstového faktoru prokazatelná i při dávce 0,3 mg/kg.
Autoři, kteří popisují léčbu HHT bevacizumabem, podávali tento lék obvykle jen po několik měsíců, do dosažení klinické léčebné odpovědi, pak jeho aplikaci přerušili. V případně recidivy potíží se k léčbě bevacizumabem vrátili. Důležité je, že v popisech případů HHT léčených bevacizumabem se uvádějí jeho obvyklé nežádoucí účinky: hypertenze, proteinurie, tromboembolické komplikace a zhoršené hojení ran. Paradoxně epistaxe, která je zmiňována jako vedlejší nežádoucí účinek tohoto léku, nebyla problémem při jeho aplikaci pacientům s HHT. Přínos bevacizumabu u pacientů s HHT se však neomezuje pouze na zmenšení krevních ztrát. V průběhu léčby bevacizumabem došlo ke zmenšení průtoku krve cévními malformacemi v játrech a zmenšila se tak intenzita hyperkinetického oběhu. Léčba bevacizumabem v některých popisovaných případech odstranila nutnost transplantace jater. Samozřejmě je možná synergická kombinace bevacizumabu a thalidomidu (41–44). Našli jsme jednu práci, kde se popisuje i jeho podání pediatrickým pacientům (45).
Poměrně hodně je prací, které popisují značný přínos bevacizumabu při lokální aplikaci v nazálním spreji (46–49). Větší množství citací má za úkol dokreslit, že účinek bevacizumabu byl prověřen v této indikaci opravdu na velkém počtu pacientů.
Interferon alfa
Interferon alfa se často používá pro léčbu hemangiomů. V celosvětovém písemnictví jsou pouze dvě publikace popisující pozitivní účinek interferonu alfa na HHT u pacientů, u nichž byl interferon podán z jiného důvodu (50). S interferonem alfa je tedy u HHT podstatně méně zkušeností, než je tomu s hormonální léčbou, thalidomidem a bevacizumabem.
Aflibercept
Nejvýznamnějším růstovým faktorem cévního endotelu je vaskulární endoteliální růstový faktor (VEGF), který se váže na receptory na povrchu cévních endotelových buněk (VEGFR) a podporuje tak vznik nových cév. Dalším faktorem je placentární růstový faktor (Placental Growth Factor – PlGF), který přispívá k růstu cév. Aflibercept je uměle vytvořená bílkovina, jejímž základem je lidská protilátka, na kterou jsou přidány vazebné části receptorů VEGFR a PlGRR. Aflibercept „vychytává“ VEGF a PlGF, váže je na sebe a brání tak jejich účinkům na endotelové cévní buňky, proto bývá označován jako VEGF‑TRAP (past). Podání tohoto léku pacientům s nádorem vede k regresi nádorové cévní sítě, normalizuje přetrvávající cévní síť a brání vzniku nových nádorových cév, a tím inhibuje růst nádoru. V případě HHT aflibercept brání tvorbě nových teleangiektatických morf a také brání rozvoji A‑V malformací.
V léčbě malignit je aflibercept účinný prakticky u stejných diagnóz jako bevacizumab. Jsou s ním i pozitivní zkušenosti s léčbou angiodysplazií (51). V indikaci HHT je o aflberceptu méně publikovaných zpráv než obevacizumabu. Ale v databázi PubMed jsou velmi četné publikace popisující jeho úspěšné použití antiangiogenního účinku afliberceptu v oftalmologii, takže lze očekávat, že bude fungovat i u HHT.
Tyrozinkinázové inhibitory (TKI) s antiangiogenním účinkem
Také některé léky ze skupiny TKI mají antiangiogenní účinek, inhibují signální dráhu vaskulárního endoteliálního růstového faktoru (VEGF). Tyto látky se podávají perorálně. Některé TKI již byly testovány u pacientů s HHT anebo testovány alespoň na zvířecím modelu této nemoci (52). Sorafenib a pazopanib vedly ke vzestupu koncentrace hemoglobinu. Dalším TKI, zvažovaným pro použití v této indikaci, je nintedanib, který působí na platelet‑derived growth factor, fibroblast growth factor a vascular endothelial growth factor receptors, a byl již použit u dvou pacientů s HHT. Ve Francii probíhá ověřování účinku nintedanibu v rámci klinické studie (52).
Pazopanib patří mezi TKI, které mimo jiné blokují i rodinu VEGFR. Jedná se o perorálně podávaný preparát, který je vyzkoušen jako velmi úspěšný v léčbě metastatického renálního karcinomu a v léčbě některých sarkomů měkkých tkání. Tento preparát byl odzkoušen v multicentrické studii s pacienty s krvácením při hereditární teleangiektázii na sedmi pacientech, kteří byli předléčeni bevacizumabem, a již při dávce 50 až 400 mg pro die byla zjištěna redukce krvácení u všech pacientů bez závažných nežádoucích účinků. Dalšími preparáty s vyzkoušeným efektem na snížení počtu a intenzitu epistaxí jsou sunitinib a buparlisib (53–58).
Systémové podání malých dávek TKI bude pravděpodobně vhodnou léčebnou varientou pro snížení krvácení obecně i epistaxí. V průběhu několika dalších let by měly být publikovány výsledky klinických studií.
Sirolimus a takrolimus
K testovaným lékům patří také sirolimus a takrolimus, které byly používány jako imunosupresiva po alogenních transplantacích. Při použití po transplantacích byla pozorována regrese cévních malformací, pokud u těchto pacientů před transplantací existovaly (59), a tato zkušenost vedla k podání těchto léků pacientům s HHT a dalšími cévními malformacemi, zatím je ale podstatně méně publikací o jejich účinnosti u HHT, než je o účinku bevacizumabu u HHT. Byla popsána i úspěšná lokální aplikace do nosu (60–64). Nově testované nadějné léky shrnuje tabulka 4.
Tab. 4. Nové léky použité pro pacienty s hereditární hemoragickou teleangiektázií 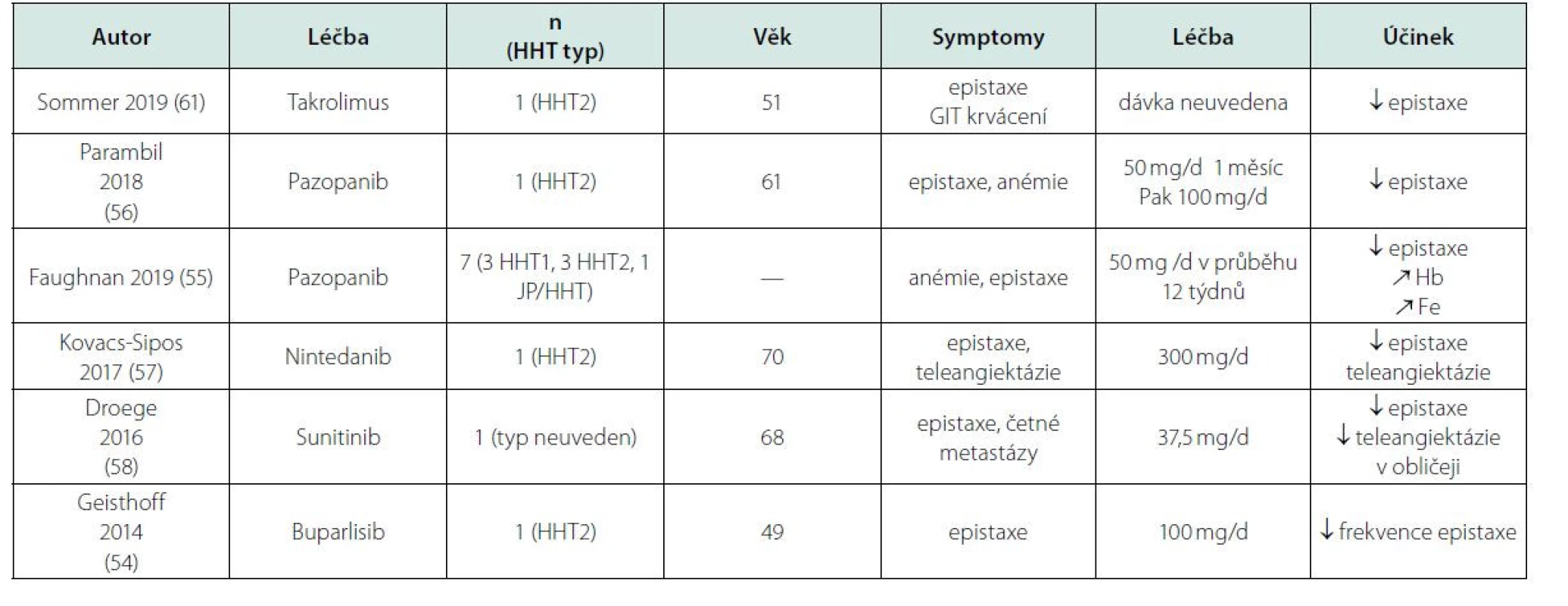
Tromboembolické komplikace a jejich léčba
HHT je sice krvácivá choroba, ale sama o sobě nechrání proti trombotickým komplikacím. Riziko trombembolických komplikací může být u těchto pacientů mírně zvýšené, je spojené se snížením hladin železa a vzestupem koncentrace faktoru VIII (65, 66). V případně nutnosti je prokázáno, že pacienti s HHT tolerují antikoagulační a antitrombotickou léčbu (67, 68). V případě nutnosti současná léčebná doporučení upřednostňují heparin a případně antagonisty vitaminu K před přímo působícími novými antikoagulancii.
Závěr pro praxi
HHT je vzácná choroba a její léčba se postupně vyvíjí a spektrum léků pro tyto nemocné se v posledním desetiletí podstatně rozšířilo. Před rokem 2000 bylo možné použít pouze antifibrinolytika, při krvácení z GIT sandostatin. Z léků, které alespoň mírně inhibovaly angioneogenezi, byly k dispozici jen estrogeny, případně antiestrogeny, danazol a interferon alfa. Po roce 2000 se spektrum léků výrazně rozšířilo. Přibyly dva léky ze skupiny IMIDs, thalidomid, lenalidomid a pak nové léky s antiangiogenním účinkem, které se používají pro léčbu solidních tumorů: bevacizumab, aflibercept, dále pak nové léky ze skupiny tyrozinkinázových inhibitorů s antiangioproliferativním efektem. Nově bylo také zjištěno, že léky, které se používají s imunosupresivním účinkem u pacientů po orgánových transplantacích, sirolimus a takrolimus, lze s úspěchem použít také u pacientů s HHT. Tyto léky lze však použít v této indikaci zatím pouze se schválením plátce zdravotní péče.
U pacientů s HHT se nepoužívají glukokortikoidy, které se podávají u dětských hemangiomů. Důvod je jasný, anemičtí pacienti s HHT obvykle mají teleangiektázie v žaludku a proulcerózní efekt glukokortikoidů by zvyšoval riziko krvácení ze žaludečních teleangiektázií. Nicméně názory na léčbu se v posledních rocích rychle vyvíjejí. Testován byl nový nosní gel, přibývá zkušeností jak postupovat při plicní hypertenzi, znovu se ověřuje efekt tamoxifenu, upřesňují se medikace při mozkových AVM. To vše je třeba zohlednit u pacientů, kteří jsou v ČR léčeni s touto chorobou (69–74).
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika, LF MU a FN Brno Jihlavská 20, 625 00 Brno
Cit. zkr: Vnitř Lék 2021; 67(7): 419–424
Článek přijat redakcí: 5. 5. 2021
Článek přijat po recenzích: 28. 7. 2021
Zdroje
1. Al‑Samkari H. Hereditary hemorrhagic telangiectasia: systemic therapies, guidelines, and an evolving standard of care. Blood 2021; 137(7): 888–895. doi: 10.1182/blood. 2020008739.
2. Faughnan ME, Mager JJ, Hetts SW et al. Second International Guidelines for the Diagnosis and Management of Hereditary Hemorrhagic Telangiectasia. Ann Intern Med. 2020; 173(12):989–1001. doi: 10.7326/M20-1443.
3. Kritharis A, Al‑Samkari H, Kuter DJ. Hereditary hemorrhagic telangiectasia: diagnosis and management from the hematologist’s perspective. Haematologica 2018; 103 (9): 1433–1443.
4. Tunkel DE, Anne S, Payne SC et al. Clinical Practice Guideline: Nosebleed (Epistaxis). Otolaryngol Head Neck Surg 2020; 162(1_suppl): S1–S38. doi: 10.1177/0194599819890327.
5. Kühnel T, Wirsching K, Wohlgemuth W et al. Hereditary Hemorrhagic Telangiectasia. Otolaryngol Clin North Am. 2018; 51 (1): 237–254.
6. Adam Z, Chlupová G, Neuman A et al. Teleangiectasia hereditaria haemorrhagica – syndrom Osler‑Weber‑Rendu. Popis případu a zkušeností s léčbou. Vnitřní lékařství 2012; 58(6): 477–489.
7. Brančíková D, Eid M, Král Z et al. Hereditární hemoragická teleangiectasie nebo syndrom Oslerův‑Renduův‑Weberův Klinický obraz a léčba. Acta Medicinae 2021, 3.
8. Kastner J, Betka J, Kuchyňková Z - Youngova modifikovaná operace v terapii recidivující epistaxe u hereditární hemorhagické teleangiektazie (Kazuistika). Otorinolaryngologie a foniatrie 2001; 50(4): 253–255.
9. Knížek Z, Vodička J, Vincent O et al. Hereditární hemoragická teleanginektázie – naše zkušenosti. Otorinolaryngologie a foniatrie 2020; 69(4):166–171.
10. Štastný B, Krošlák M. Skúsenosti s chirurgickou liečbou epistaxy pri m. Osler‑Rendu‑Weber. Československá otolaryngologie 1981; 30(1): 53–56.
11. Geisthoff UW, Seyfert UT, Kubler M et al. Treatment of epistaxis in HHT with tranexamic acid - double blind placebo controllet cross over phase IIIB study. Thromb Res 2014; 134 : 565–571.
12. Kroon S, Snijder RJ, Mager JJ et al. Octreotide for gastrointestinal bleeding in hereditary hemorrhagic telangiectasia: A prospective case series. Am J Hematol 2019; 94(9):E247–E249. doi: 10.1002/ajh.25563.
13. Houghton KD, Umar B, Schairer J. Successful Treatment of Hereditary Hemorrhagic Telangiectasia With Octreotide. ACG Case Rep J 2019; 6 (6): e00088. doi: 10.14309/ crj.0000000000000088.
14. Jeanneret S, Regazzoni L, Favrat B. Rendu‑Osler disease: treatment with oestrogen/ progestagen versus octreotide. BMJ Case Rep 2011; 2011: bcr1120103534. doi: 10.1136/ bcr.11.2010.3534
15. Lee BL, Turner J, Hurley J et al. Two for the price of one: a dual treatment benefit of long‑acting octreotide in occult bleeding and diuretic intractable ascites. Frontline Gastroenterol 2011; 2 (4): 226–229.
16. Kopáčová M, Bureš J, Vykouřil L et al. Intraoperative enteroscopy: ten years‘ experience at a single tertiary center. Surgical endoscopy 2007; 21(7):1111–1116.
17. Harwin J, Sugi MD, Hetts SW et al. The Role of Liver Imaging in Hereditary Hemorrhagic Telangiectasia. J Clin Med 2020; 9(11):3750. doi: 10.3390/jcm9113750.
18. Ernes J, Kramplová V, Charvát F. Oční komplikace po embolizaci v povodí arteria carotis interna – kazuistika. Česká a slovenská oftalmologie 2008; 64(5): 202–206.
19. Lantz KE, Armstrong SQ, Butt F et al. Arteriovenous Malformations in the Setting of Osler‑Weber‑Rendu: What the Radiologist Needs to Know. Curr Probl Diagn Radiol 2021 Mar 11:S0363-0188(21)00046-3. doi: 10.1067/j.cpradiol.2021. 03. 009. Epub ahead of print.
20. Krajina A, Koblížek V, Lojík M et al. Endovaskulární léčba plicních arteriovenózních zkratů. Česká radiologie 2012; 66(2): 125–132.
21. Krajina A, Peregrin JH. Intervenční radiologie: miniinvazivní terapie. vyd. Hradec Králové 2005; 835.
22. Krajina A, Nožička J, Malý J. Embolizace plicni arteriovenózní malformace. Intervenční radiologie. Hradec Králové: Radiodiagnostická klinika 1996; 173–175.
23. Krajina A, Lojík M, Česák T et al. Endovaskulární léčba intrakraniálních aneuryzmat – metodika, indikace, komplikace. Česká a slovenská neurologie a neurochirurgie 2012; 75(5): 552–560.
24. Ozawa H, Ohki T, Kanaoka Y et al. Open arterial reconstruction of multiple hepatic artery aneurysms in a patient with hereditary hemorrhagic telangiectasia: A case report. Medicine (Baltimore) 2016; 95(46): e5430. doi:10.1097/MD.0000000000005430.
25. Felli E, Addeo P, Faitot F et al. Liver transplantation for hereditary hemorrhagic telangiectasia: a systematic review. HPB (Oxford). 2017; 19(7): 567–572. doi: 10.1016/j. hpb.2017. 03. 005.
26. Iyer VN, Saberi B, Heimbach JK et al. Liver Transplantation Trends and Outcomes for Hereditary Hemorrhagic Telangiectasia in the United States. Transplantation 2019; 103(7): 1418–1424.
27. Dumortier J, Dupuis‑Girod S, Valette PJ et al. Recurrence of Hereditary Hemorrhagic Telangiectasia After Liver Transplantation: Clinical Implications and Physiopathological Insights. Hepatology 2019; 69(5): 2232–2240.
28. Ejiri K, Akagi S, Nakamura K et al. H. Liver transplantation in a patient with hereditary haemorrhagic telangiectasia and pulmonary hypertension. Pulm Circ. 2019; 9(4): 2045894019896677. doi 10.1177/2045894019896677.
29. Chavan A, Schumann‑Binarsch S, Schmuck B et al. Emerging role of bevacizumab in management of patients with symptomatic hepatic involvement in Hereditary Hemorrhagic Telangiectasia. Am J Hematol 2017; 92 (11): E641–E644. doi: 10.1002/ajh.24878.
30. Vázquez C, Gonzalez ML, Ferraris et al. Bevacizumab for treating Hereditary Hemorrhagic Telangiectasia patients with severe hepatic involvement or refractory anemia. PLoS One 2020; 15(2): e0228486. doi: 10.1371/journal.pone.0228486.
31. Albiñana V, Bernabeu‑Herrero ME et al. Estrogen therapy for hereditary haemorrhagic telangiectasia (HHT): Effects of raloxifene, on Endoglin and ALK1 expression in endothelial cells. Thromb Haemost 2010; 103(3): 525–534.
32. Yaniv E, Preis M, Shevro J et al. Anti‑estrogen therapy for hereditary hemorrhagic telangiectasia - a long‑term clinical trial. Rhinology 2011; 49(2): 214–2146.
33. D‘Amato RJ, Loughnan MS, Flynn E et al. Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci 1994; 91 : 4082–4085.
34. Buscarini E, Botella LM, Geisthoff U et al. Safety of thalidomide and bevacizumab in patients with hereditary hemorrhagic telangiectasia. Orphanet J Rare Dis 2019; 14(1):28. doi: 10.1186/s13023-018-0982-4.
Další literatura u autora a na www.casopisvnitrnilekarstvi.cz
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Co přinášejí pro klinickou praxi mezinárodní aktivity Less is more a Choosing wisely?
- Cesty ke správnému rozhodování ve všeobecné interně, nefrologii a revmatologii
- Kdy nadbytek péče může poškodit nemocné v oblasti zájmu generalistů?
- Metabolické a endokrinní choroby – je náš přístup vždy racionální?
- Expertní konsenzus k praktickým aspektům spolupráce kardiologa a diabetologa v péči o pacienty s chronickým srdečním selháním s redukovanou ejekční frakcí
- Kardiovaskulární prevence: časná a důsledná prevence versus pozdní intervence, komplexní přístup k léčbě ovlivnitelných rizikových faktorů: hypertenze a dyslipidemie
- Hereditární hemoragická teleangiektázie (syndrom Osler‑Weber‑Rendu) – Díl II. Medikamentózní léčba a mezinárodní doporučení pro léčbu z roku 2020
- Adekvátní a neadekvátní terapie u pacientů s implantabilním kardioverterem‑defibrilátorem
- První bezkontrastní PCI vedená intrakoronárním ultrazvukem v České republice
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hereditární hemoragická teleangiektázie (syndrom Osler‑Weber‑Rendu) – Díl II. Medikamentózní léčba a mezinárodní doporučení pro léčbu z roku 2020
- Adekvátní a neadekvátní terapie u pacientů s implantabilním kardioverterem‑defibrilátorem
- První bezkontrastní PCI vedená intrakoronárním ultrazvukem v České republice
- Metabolické a endokrinní choroby – je náš přístup vždy racionální?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



