-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Postavení bronchologie v pneumologické diagnostice
The role of bronchology in pneumological diagnostics
Bronchoscopic examination has a key role in diagnosing or further specifying of a broad spectrum of respiratory diseases. Although classic bronchoscopy with its rigid instrumentation still upholds its position, the vast majority of procedures are performed with flexible bronchoscopes. Diagnostic possibilities are broadened by new technical findings and procedures, such as endobronchial ultrasonography, examination through autofluorescence, navigated bronchoscopy and others. The material for cytological, microbiological or other examinations can be sampled through a whole number of procedures using specialized instruments. In the hands of an experienced bronchologist it is a safe method accompanied by only a minimum serious complications.
Key words:
bronchoalveolar lavage – diagnostic bronchoscopy – endobronchial ultrasonography – flexible bronchoscope
Autoři: František Salajka
Působiště autorů: Plicní klinika LF UK a FN Hradec Králové
Vyšlo v časopise: Vnitř Lék 2017; 63(11): 895-899
Kategorie: Přehledné referáty
Souhrn
Bronchoskopické vyšetření zaujímá klíčovou úlohu ve stanovení nebo upřesnění diagnózy širokého spektra onemocnění dýchacího ústrojí. I když klasická bronchoskopie rigidním instrumentáriem má stále své místo, naprostá většina výkonů se v současnosti provádí flexibilními bronchoskopy. Diagnostické možnosti rozšiřují nové technické poznatky a postupy, jako je endobronchiální ultrasonografie, vyšetření pomocí autofluorescence, navigovaná bronchoskopie a další. Materiál na cytologické, mikrobiologické či jiné vyšetření je možné odebrat celou řadou postupu pomocí specializovaných nástrojů. V rukou zkušeného bronchologa se jedná o bezpečnou metodu zatíženou jen minimem závažných komplikací.
Klíčová slova:
bronchoalveolární laváž – diagnostická bronchoskopie – endobronchiální ultrasonografie – flexibilní bronchoskopÚvod
Od 30. března 1897, kdy ve Freiburgu prof. Kilian poprvé zavedl ezofagoskop do bronchiálního stromu s cílem vytáhnout vdechnutou kůstku u dusícího se sedláka, urazila bronchologie obrovský kus cesty [1]. Postupně se stala jednou z hlavních diagnostických metod v pneumologii a okrajově našla uplatnění i v dalších oborech, především otorinolaryngologii a intenzivní medicíně. V souladu se svým prvním použitím se kromě diagnostických výkonů její použití rozšířilo i na řadu terapeutických intervencí, takže v současné době je moderní pneumologie bez rozvinutého bronchologického zázemí nemyslitelná.
Z původního bronchoskopu, tedy kovového tubusu, do nějž bylo světlo přiváděno z vnějšího světelného zdroje, se vyvinul současný tubus s distálním osvětlením zajišťovaným pomocí světlovodného kabelu. Broncholog již není odkázán na pozorování endobronchiálních poměrů zmíněným tubusem, ale má k dispozici teleskopické optiky, které se do bronchoskopického tubusu zasunou a díky kterým získává přesný a jasný obraz pozorované oblasti. Přes tyto pokroky se však bronchoskopie prováděná rigidní technikou dostala na okraj zájmu a naprostá většina bronchoskopií je v současné době prováděna flexibilní technikou.
Flexibilní bronchoskop
První flexibilní bronchoskop představil prof. Ikeda na mezinárodním kongresu v srpnu roku 1966 [2]. Nový nástroj podnítil doslova explozivní rozvoj bronchologie díky výraznému rozšíření pozorované oblasti, zvýšení bezpečnosti a komfortu nemocných během vyšetření a snazšímu zvládnutí ovládání nástroje lékařem.
Původní koncept vycházel z přenosu světla i obrazu pomocí tenkých skleněných vláken, od konce 80. let 20. století jsou tyto fibrobronchoskopy z větší části nahrazovány videobronchoskopy s miniaturní televizní kamerou na distálním konci, což vedlo k významnému zlepšení obrazové kvality. Základní konstrukce flexibilního bronchoskopu však zůstala zachována – lékař drží v ruce hlavici s páčkou ovládající distální konec bronchoskopu a s vyústěním pracovního kanálu, jehož průměr závisí na celkovém průměru bronchoskopu. Součástí bronchoskopu jsou dále obvykle dva světlovodné kabely a kabel přenášející obraz buď cestou skleněných vláken, nebo digitálního signálu.
Autofluorescenční bronchoskop
Díky digitalizaci obrazového signálu se otevřela celá řada technik rozšiřujících možnosti vizuálního posouzení hodnocení oblasti. Jednou z nich je použití autofluorescenčního bronchoskopu. Princip autofluorescence vychází z poznatku, že zdravá bronchiální sliznice při ozáření světlem určité vlnové délky vyzařuje světlo jiné vlnové délky, zatímco patologicky změněná sliznice tuto schopnost ztrácí (obr. 1).
Obr. 1. Nádorová tkáň v bílém světle a v autofluorescenčním zobrazení 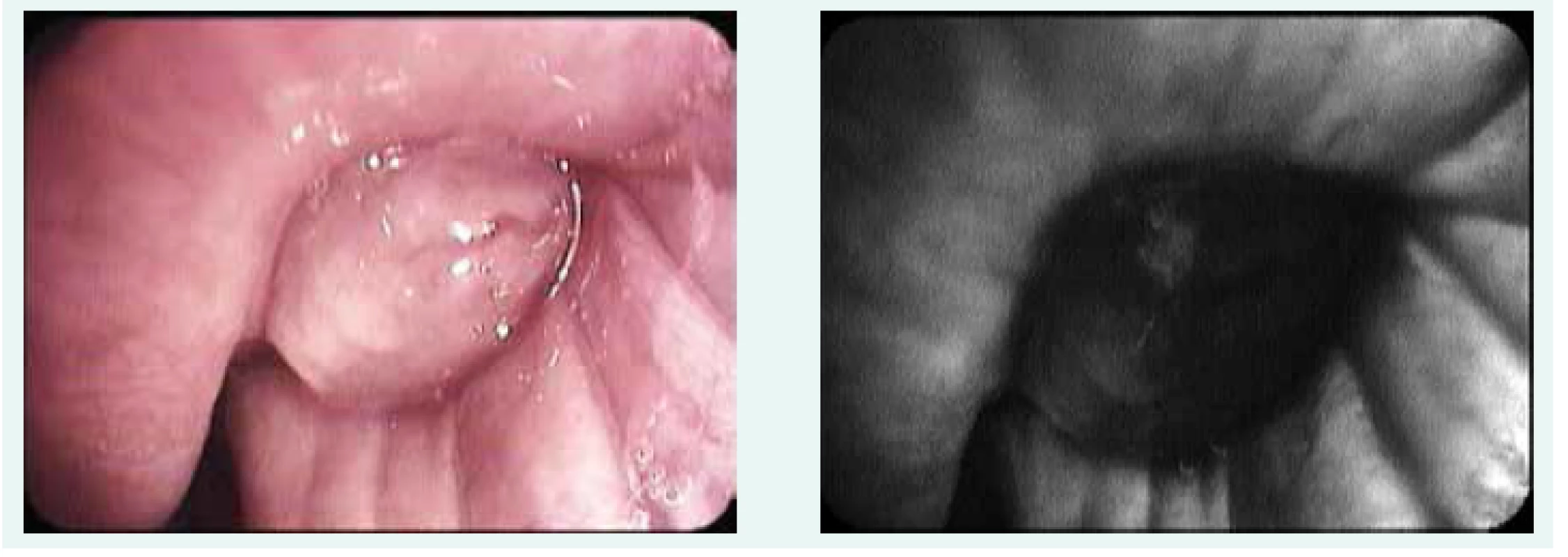
Zdrojem autofluorescence ve zdravé sliznici jsou intracelulární NADH, riboflavin, kolagenní a elastická vazivová vlákna [3]. Jednotlivé systémy tuto skutečnost využívají různým způsobem.
V systému SAFE 3000 (Pentax) je po ozáření sliznice světlem o vlnové délce 408 nm excitované světlo zobrazeno v černobílém spektru, přičemž v oblasti s výpadkem autofluorescence se místo obrazu normální sliznice objevuje jen temná skvrna.
V systému AFI (Olympus) je pomocí rotačních filtrů vyzařováno a následně detekováno světlo v červené, zelené a modré části spektra a signál je následně převeden do spektra arteficiálních barev, v němž zelená značí normální sliznici a červená absenci autofluorescence.
Klinický význam této metody spočívá v časné detekci (pre)neoplastických endobronchiálních lézí a hledání satelitních ložisek u známých nádorů v situaci, v níž ještě nejsou tyto změny dostatečně patrné při vyšetření v bílém světle. S její pomocí lze lépe určit optimální místa odběru materiálu na vyšetření při podezření na maligní proces. V rámci předoperačního vyšetření upřesní doporučenou resekční linii, která může být významně proximálněji uložená, než se jeví v bílém světle. Umožňuje také lepší kontrolu rozsahu cílové oblasti při léčebných endobronchiálních intervencích jako např. použití elektrokauteru [4].
Ultratenký bronchoskop
Snaha zpřístupnit bronchoskopickému vyšetření i periferní oblasti bronchiálního stromu vedla k vývoji tzv. ultratenkých bronchoskopů, jejichž vnější průměr se pohybuje okolo 3 mm. Jimi je možné proniknout do oblastí periferněji od subsegmentálního větvení, a tím vizualizovat a zpřístupnit cíleným odběrům pod kontrolou zraku periferní patologické procesy. Jistým omezením může být malá velikost dostupného instrumentária daná průměrem pracovního kanálu (typicky 1,2 mm), a tím malá velikost získaných vzorků, přesto je tato metoda při použití v návaznosti na běžnou flexibilní bronchoskopii hodnocena jako přínosná [5].
Vláknová konfokální fluorescenční mikroskopie
Dalším krokem ve snaze o miniaturizaci bronchoskopických přístrojů je vláknová konfokální fluorescenční mikroskopie (fibered confocal fluorescence microscopy – FCFM), která umožňuje zobrazení tenké povrchové vrstvy tkáně, přičemž objektiv mikroskopu je v tomto případě nahrazen velmi tenkou (0,3–2 mm) flexibilní sondou, která může být zavedena do pracovního kanálku flexibilního bronchoskopu. Princip metody je spíše, než na odrazu světla založen na buněčné a tkáňové autofluorescenci po laserové excitaci. Hlavním zdrojem autofluorescence stěny dýchacích cest je v tomto případě subepiteliální vrstva elastinových vláken, jejíž poškození může být pozorováno v neinvazivních a časných invazivních nádorových lézí; tato metoda ale rovněž umožňuje prokázat např. alteraci alveolárních a acinárních elastinových vláken u kuřáků [6].
Optická koherentní tomografie
Optická koherentní tomografie (OCT) pracuje na podobném principu jako ultrasonografie – vyhodnocuje odraz světla o dlouhé vlnové délce, z téměř infračervené oblasti, od povrchové vrstvy bronchiální stěny do hloubky až 2–3 mm. Jedná se o nekontaktní metodu založenou na tom, že zdroj světla a senzor odraženého signálu jsou umístěny na tenké sondě, kterou je možné do vyšetřované oblasti zavést kanálkem flexibilního bronchoskopu. Získané výsledky umožňují analýzu bronchiální stěny s rozlišením 3–15 μm s detekcí nemaligních a maligních epiteliálních změn – odtud někdy užívaný název „optická biopsie“ [7]. Obě zmíněné metody zatím nepatří mezi běžně používané.
Navigovaná bronchoskopie
Velmi sofistikovanou metodou diagnostiky periferních plicních lézí je tzv. navigovaná bronchoskopie, která se sestává z několika na sebe navazujících kroků. Záznam dříve provedeného CT vyšetření je zpracován příslušným počítačovým programem tak, že se vytvoří trojrozměrný model pacientových plic s vyznačením základních anatomických orientačních bodů jako je hlavní karina, kariny odstupů obou horních bronchů apod. Pomocí těchto orientačních bodů je naplánována cesta bronchiálním stromem přímo k vyšetřované lézi. Tento plán je nahrán do navigačního počítače. Při bronchoskopii prováděné běžným bronchoskopem, při které ale nemocný leží na speciální elektromagnetické navigační desce, je dotekem zvláštní sondy zavedené pracovním kanálem bronchoskopu určena poloha jednotlivých výše zmíněných orientačních bodů. Takto je možné průběžně kontrolovat a korigovat polohu pracovního katétru, do něhož je sonda zavedena, tak, aby dosáhl přesně vyšetřované oblasti. Poté je sonda vytažena a ponechaným katétrem jsou přímo do vyšetřovaného útvaru zavedeny odběrové nástroje [8]. Diagnostická výtěžnost biopsií periferních lézí prováděných tímto způsobem se pohybuje kolem 70 % (obr. 2).
Obr. 2. Vyšetření pomocí navigované bronchoskopie 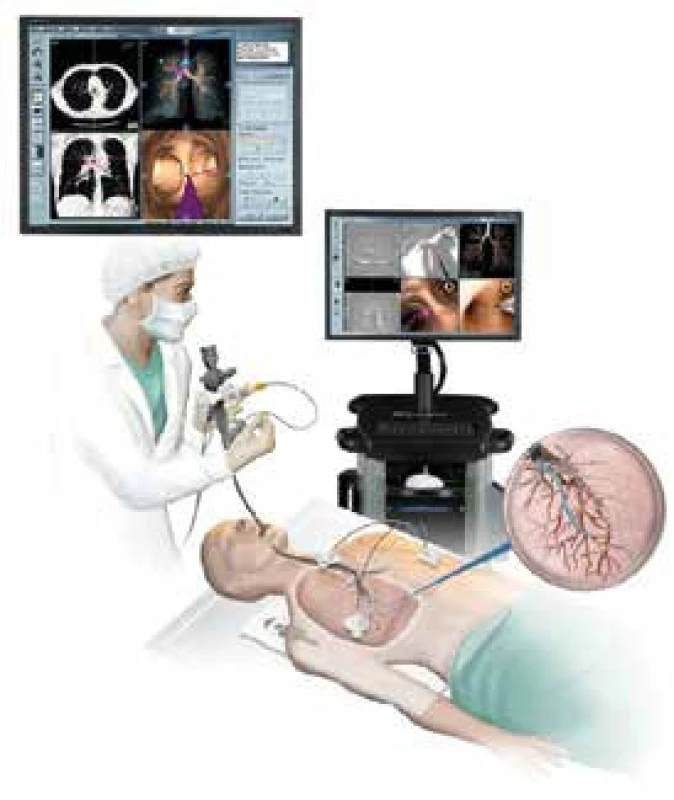
Endobronchiální ultrasonografie
Pozorovat struktury uložené v okolí dýchacích cest umožňuje endobronchiální ultrasonografie (EBUS). Omezení této metody, spočívající v tom, že vzduch je pro šíření ultrazvuku překážkou, se podařilo vyřešit tak, že sonda – zdroj ultrazvukového signálu – je obklopena balónkem, který se naplní fyziologickým roztokem tak, aby se dotýkal bronchiální stěny. Při radiálním zobrazení, při němž se sonda s balónkem zavádí kanálkem flexibilního bronchoskopu, je získán obraz bronchiální stěny a přilehlých struktur v rovině kolmé na průběh bronchu. Takto je možné rozeznat patologické, především (pre)maligní procesy jak v bronchiální stěně, tak i v extrabronchiální lokalizaci. Lineární zobrazení vyžaduje použití speciálního bronchoskopu, který je zakončen ultrazvukovou sondou. Bronchoskop je uzpůsoben tak, že jeho pracovním kanálkem je možné prostrčit punkční jehlu, kterou je po proniknutí bronchiální stěnou získán vzorek přímo z vyšetřované tkáně; během tohoto výkonu je poloha jehly kontrolována v reálném čase pomocí ultrazvuku (obr. 3).
Obr. 3. Použití EBUS k cílené biopsii uzliny 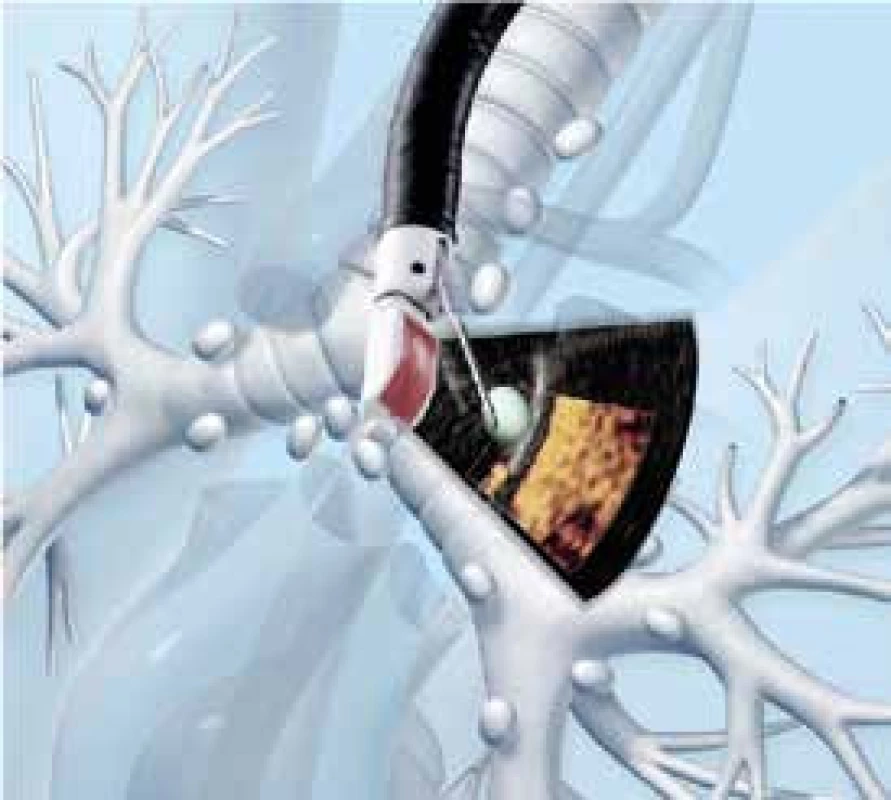
Srovnání bronchoskopických metod
Kromě pozorování endobronchiálních poměrů v „bílém světle“ je tedy v současné době k dispozici celá řada metod lišících se detailností zobrazení a hloubkou penetrace pod úroveň bronchiální sliznice. Jejich vzájemné srovnání přináší graf 1. (podle [3]).
Graf 1. Rozlišení a hloubková penetrace jednotlivých diagnostických metod. 
AF – autofluorescence FCFM – konfokální mikroskopie OCT – optická koherentní tomografie EBUS – endobronchiální ultrasonografie Upraveno podle [3] Metody odběru materiálu pro vyšetření
Samozřejmým cílem diagnostické bronchoskopie je nejen vyhodnocení viditelného nálezu v dýchacích cestách, ale i odběr materiálu pro různá vyšetření – nejčastěji patologicko-anatomická (z cytologických či histologických vzorků), mikrobiologická, imunologická a další. K získání těchto vzorků slouží celá řada odběrových metod, z nichž broncholog během vyšetření volí podle aktuálního nálezu a zamýšleného diagnostického zaměření. Nejšetrnější metodou je aspirace bronchiálního sekretu, případně výplach malým (10–20 ml) množstvím fyziologického roztoku. Získaný materiál je nejčastěji vyšetřen mikrobiologicky a/nebo cytologicky. Bronchoalveolární laváž (BAL) se od výplachu bronchu liší jednak polohou bronchoskopu, jehož distální konec je zaklíněn v periferii vyšetřované oblasti (na rozdíl od konce volně se pohybujícího ve velkých dýchacích cestách při aspiraci či výplachu), jednak použitým množstvím fyziologického roztoku, které v několika frakcích dosahuje nejméně 200 ml. Tímto způsobem je možné získat vzorky ze samé periferie dýchacích cest a z alveolární oblasti, což je vysoce přínosné v diagnostice patologických procesů zde probíhajících – např. alveolitida u intersticiálních plicních procesů, průkaz adenokarcinomu s lepidickým růstem (podle dřívější nomenklatury bronchoalveolárního karcinomu) nebo diagnostika intraparenchymatózně probíhajících infekcí (např. cytomegalovirových, pneumocystových a jiných).
Pro odběr patologicko-anatomicky hodnocených vzorků je bronchologovi k dispozici celá řada speciálních nástrojů. Bioptické klíšťky umožňují získat histologicky hodnotitelný vzorek, a to buď klasickou biopsií endobronchiálně přítomné patologické struktury pod kontrolou zraku, nebo získat vzorek plicního parenchymu při transbronchiální biopsii, při níž jsou klíšťky zavedeny do periferie, a odběr se provádí naslepo. Další metodou, jak získat vzorek k histologickému vyšetření, je použití kryosondy. Při použití této metody se kolem konce kryosondy vytvoří „bal“ zmrazené tkáně, který je vytažen a po roztátí vyšetřen. Pomocí bronchoskopického kartáčku je možné získat cytologický vzorek z endobronchiálních útvarů, zatímco jehla umožňuje proniknout skrz bronchiální stěnu do přilehlých extrabronchiálních struktur – typicky lymfatických uzlin.
Bronchoskopie – možnosti a omezení využití
Vyzbrojení výše zmíněnými přístrojovými a nástrojovými možnostmi umožňuje bronchologovi provést diagnostické bronchoskopické vyšetření ve stále se rozšiřujícím spektru indikací. Stále platí výrok Chevaliera Jacksona, jednoho ze zakladatelů bronchologie: „Jsme-li na pochybách, má-li být bronchoskopie provedena nebo ne, tak má být provedena“ [9]. Indikaci diagnostické bronchoskopie pneumolog obvykle staví na anamnestických údajích (např. podezření na aspiraci, opakované pneumonie), klinických příznacích (kašel, hemoptýza aj.) a patologických výsledcích provedených vyšetření, nejčastěji RTG snímku hrudníku.
Úloha bronchoskopie
Úloha bronchoskopie je nezastupitelná v diagnostice infekcí a nádorů dýchacího ústrojí, intersticiálních plicních procesů a dalších stavů. V diagnostice infekcí má broncholog na výběr, jestli s cílem získat mikrobiologicky hodnotitelný materiál provede bronchiální výplach, zacílený na infekci lokalizovanou především v dýchacích cestách (exacerbace CHOPN, akutní tracheobronchitida a další), nebo bronchoalveolární laváž. Ta je indikovaná především v diagnostice pneumonií, a to jak u imunokompetentních, tak především u imunokompromitovaných pacientů. V pneumoonkologii je cílem vyšetření nejen získat materiál k histologickému a/nebo cytologickému vyšetření, ale také velmi pečlivé posouzení endobronchiálního rozsahu přímých a nepřímých nádorových změn, které se může zásadně lišit od rozsahu hodnoceného pomocí RTG a CT. Současně broncholog zváží případnou indikaci endobronchiální intervence, která může být jako paliativní výkon provedena nezávisle na další plánované léčbě. Klíčovou roli hraje bronchoskopické vyšetření v diagnostice intersticiálních plicních procesů. Z oblasti s maximálním výskytem patologických změn podle CT nálezu se provádí jednak bronchoalveolární laváž, sloužící ke zjištění aktivity procesu průkazem přítomnosti alveolitidy a umožňující základní diagnostickou rozvahu v závislosti na typu alveolitidy, jednak odběr plicního parenchymu k histologickému vyšetření. Tento odběr se provádí pomocí transbronchiální plicní biopsie (transbronchial lung biopsy – TBLB) s odběrem několika vzorků plicní tkáně pomocí bioptických klíštěk, v poslední době se množí velmi dobré zkušenosti s odběrem zmražených vzorků pomocí kryobiopsie [10]. Kromě těchto nejčastějších situací je bronchoskopie určující diagnostickou metodou v celé řadě dalších indikací.
Bronchoskopie také nachází široké použití v indikacích, které bychom mohli nazvat kontrolní. Jedná se o průběžné vyhodnocování úspěšnosti léčby nebo kontroly po již proběhlé léčbě. Nejčastěji jde o pacienty s nádory plic, ať již po resekci, u nichž je snaha o co nejvčasnější záchyt případné recidivy, nebo po paliativní léčbě. U nich je úlohou bronchologa potvrdit podezření na progresi vyslovené na základě RTG/CT vyšetření a současně posoudit, jestli nejsou vhodné podmínky pro některou z endobronchiálních intervencí. U nemocných s intersticiálními plicními procesy nám kontrolní BAL ukáže, jestli léčbou bylo dosaženo poklesu aktivity procesu a normalizace stavu. Existuje ještě řada dalších indikací podobného typu, jako jsou kontroly po provedených endobronchiálních intervencích a jiné.
Kontraindikace bronchoskopie
Kontraindikace jsou ve srovnání se seznamem indikací zřídkavé. Obvykle se mezi ně počítají stavy kardiovaskulární nestability jako závažné arytmie nebo velmi závažná hypoxemie nereagující na podávání kyslíku, jejíž příčina není bronchoskopicky odstranitelná. Bronchoskopie se rovněž nemá provádět u nespolupracujícího pacienta. Častěji se setkáváme s kontraindikací týkající se dílčích výkonů, např. invazivních odběrů u nemocných s poruchou hemokoagulace. Mezi další situace spojené se zvýšeným rizikem výkonu patří nestabilní angina pectoris, infarkt myokardu prodělaný během posledních 4 týdnů, závažná uremie, plicní hypertenze nebo syndrom horní duté žíly.
Komplikace bronchoskopie
Bronchoskopie je samozřejmě zatížena rizikem komplikací, které narůstá spolu s náročností použitých metod nebo se závažností klinického stavu nemocného. U zkušeného vyšetřujícího a s dobře vybaveným zázemím je toto riziko malé, nicméně i v sestavách nemocných z vysoce erudovaných pracovišť se objevují i fatální komplikace – na toto riziko je tedy nutné vždy myslet a udělat vše pro jeho minimalizaci. Mezi relativně běžné a snadno zvládnutelné komplikace patří vazomotorický kolaps vyvolaný kombinovaným působením stresu z vyšetření a premedikace. Naopak závažný průběh mohou mít srdeční arytmie nebo známky ischemie myokardu. S alergickou reakcí na podávaná lokální anestetika se díky pečlivé anamnéze setkáváme jen výjimečně.
Přítomnost bronchoskopu v dýchacích cestách představuje překážku ventilace, což spolu s působením premedikace a případně některými diagnostickými výkony (BAL) může zejména u nemocných s malou ventilační rezervou vést až k závažné hypoxemii – nezbytné je průběžné sledování saturace perkutánním oxymetrem. Malé krvácení po invazivních odběrech je zcela běžnou součástí výkonu; někdy, při poškození větší cévy může ale nabýt až život ohrožující intenzity. Další komplikace jsou již v podstatě výjimečné, nicméně broncholog na ně musí být připraven a pracoviště vybaveno k jejich zvládnutí.
Závěr
Bronchoskopie v rukou vyškoleného pneumologa představuje v současné době diagnostickou metodu s výjimečnou šíří uplatnění v diagnostice nejrůznějších onemocnění dýchacího ústrojí. Navíc je možné očekávat, že v budoucnu s technickým rozvojem přístrojového vybavení její důležitost ještě poroste.
doc. MUDr. František Salajka, CSc.
františek.salajka@fnhk.cz
Plicní klinika LF UK a
FN v Hradci Králové
www.fnhk.cz
Doručeno do redakce 3. 8. 2017
Přijato po recenzi 26. 9. 2017
Zdroje
1. Becker HD. A short history of bronchoskopy. In: Ernst A (ed.): Introduction to Bronchoscopy. Cambridge University Press 2009 : 1–16. ISBN 9780511575334. Dostupné z DOI: https://doi.org/10.1017/CBO9780511575334
2. Miyazawa T. History of the Flexible Bronchosope. In: Bolliger CT, Mathur PN (eds): Interventional Bronchoscopy. Karger 2000 : 16–21. ISBN 978–3-8055–6851–7. e-ISBN 978–3-318–00415–1.
3. Wagner M, Ficker JH (eds). Autofluorescence Bronchoscopy. UNI-MED Verlag: Bremen, Germany 2007. ISBN 978–3-89599–956–7.
4. Sutedja TG, Codrington H, Risse EK et al. Autofluorescence Bronchoscopy Improves Staging of Radiographically Occult Lung Cancer and Has an Impact on Therapeutic Strategy. Chest 2001; 120(4): 1327–1332.
5. Rooney CP, Wolf K, McLennan G. Ultrathin Bronchoscopy as an Adjunct to Standard Bronchoscopy in the Diagnosis of Peripheral Lung Lesions. Respiration 2002; 69(1): 63–68.
6. Thiberville L, Salaün M, Bourg-Heckly G. In vivo confocal microendoscopy: from the proximal bronchus down to the pulmonary acinus. In: Strausz J, Bolliger CT (ed): Interventional pulmonology. Eur Respir Mon 2010; 48 : 73–89.
7. Whiteman SC, Yang Y, van Pittius DG et al. Optical coherence tomography: real-time imaging of bronchial airways microstructure and detection of inflammatory/neoplastic morphologic changes. Clin Cancer Res 2006; 12(3 Pt 1): 813–818.
8. Edell E, Krier-Morrow D. Navigational Bronchoscopy. Overview of Technology and Practical Considerations – New Current Procedural Terminology Codes Effective 2010. Chest 2010; 137(2): 450–454. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.09–2003>.
9. Jackson C. Bronchoscopy and Esophagoscopy. W. B.Saunders: 1922. Project Gutenberg. e-books.Dostupné z WWW: <https://www.gutenberg.org>.
10. Vašáková M, Polák J, Matěj R. Intersticiální plicní procesy. Od etiopatogeneze přes radiologický obraz k histopatologické diagnóze. Maxdorf Jessenius: Praha 2011. ISBN 978–80–7345–251–3.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Současná náplň pneumologieČlánek Nozokomiální pneumonieČlánek Cystická fibróza dospělýchČlánek Nemalobuněčný karcinom plicČlánek Neinvazivní ventilace
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Současná náplň pneumologie
- Cílené vyhledávání nemocných s chronickou obstrukční plicní nemocí: stručný přehled
- Asthma bronchiale v kontextu vnitřního lékařství
- Diagnostika a léčba komunitní pneumonie – v jednoduchosti je klíč k úspěchu
- Nozokomiální pneumonie
- Pneumonie u imunokompromitovaných
- Idiopatická plicní fibróza. Umíme ji vždy správně diagnostikovat a léčit?
- Exogenní alergické alveolitidy: minimum pro praxi
- Sarkoidóza – nadále záhadné onemocnění
- Současný přístup k diagnostice, léčbě a prevenci tuberkulózy
-
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně - Cystická fibróza dospělých
- Kardiovaskulární riziko spánkové apnoe a kazuistika
- Komplikace po transplantaci plic
- Nemalobuněčný karcinom plic
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
- Maligní mezoteliom pleury – dosud nepokořený nádor
- Spirometrie – základní vyšetření funkce plic
- Postavení bronchologie v pneumologické diagnostice
- Ultrasonografické vyšetření hrudníku v rukou lékaře klinika
- Neinvazivní ventilace
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Spirometrie – základní vyšetření funkce plic
- Neinvazivní ventilace
- Pneumonie u imunokompromitovaných
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



