-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Exogenní alergické alveolitidy: minimum pro praxi
Extrinsic allergic alveolitis: minimum for clinical practice
Extrinsic allergic alveolitis (EAA) represent a group of diseases, that develop in susceptible individuals after repeated exposure to usually organic inhalation antigen. Patient may be in contact with these agents both in occupational and in home environment, as well as during free time activities and hobbies. The course of the disease is highly variable – EAA may have dramatic symptoms with fever, cough and severe dyspnoea as well as may be presented with slowly increasing dyspnoea and chronic cough. The more inconspicious are the symptoms of chronic EAA, the more problematic its treatment may be. Treatment options must be sought individually and respect potential risks and benefits for the patient. Avoiding further contact with offending antigens as well as optimizing patients nutritional status and starting pulmonary rehabilitation should be emphasized.
Key words:
corticosteroids – extrinsic allergic alveolitis – environmental exposure
Autoři: Martina Šterclová
Působiště autorů: Pneumologická klinika 1. LF UK a Thomayerovy nemocnice, Praha
Vyšlo v časopise: Vnitř Lék 2017; 63(11): 802-806
Kategorie: Přehledné referáty
Souhrn
Exogenní alergické alveolitidy představují skupinu chorob vzniklých u vnímavých jedinců na podkladě opakované expozice většinou organickému inhalačnímu antigenu. Ke kontaktu s vyvolávajícím agens může docházet jak v rámci pracovního prostředí, tak v rámci domova pacienta nebo při vykonávání zájmových činností a koníčků. Průběh onemocnění je značně variabilní – od dramaticky probíhajícího onemocnění s teplotami, kašlem a výraznou dušností až po plíživě se rozvíjející dušnost a chronický kašel. Oč jsou příznaky chronického onemocnění nenápadnější, o to svízelnější je jeho léčba. K té je nutno přistupovat uvážlivě a individuálně zvážit její možný přínos, ale i rizika rozvoje vedlejších účinků, pokud volíme léčbu farmakologickou. Opomíjena nesmí být režimová opatření – nezbytné je zamezení dalšímu kontaktu s vyvolávajícím antigenem, optimalizace tělesné hmotnosti a plicní rehabilitace.
Klíčová slova:
environmentální expozice – exogenní alergická alveolitida – kortikosteroidyÚvod
Exogenní alergické alveolitidy (EAA) jsou skupina intersticiálních plicních procesů, které vznikají v příčinné souvislosti s expozicí organickým inhalačním antigenům u predisponovaných jedinců. Je zřejmé, že s pacienty trpícími těmito chorobami se setkávají pneumologové, ale mohou zajímat i lékaře jiných odborností?
Jednoznačná odpověď na tuto otázku je ANO. A to zejména proto, že EAA představují jeden z nejčastějších intersticiálních plicních procesů, navíc podezření na onemocnění dýchacího traktu u nemocného obvykle vysloví jako první jiný lékař než pneumolog a tento lékař pak pacienta případně k pneumologickému vyšetření odesílá.
Jak se může EAA prezentovat?
Kromě příznaků onemocnění respiračního traktu se lze u některých nemocných s EAA setkat i se systémovými příznaky – onemocnění se může prezentovat jako horečnatý stav s bolestmi svalů a kloubů, v tom případě bývají obtíže pacientů vázány na expozici organickým inhalačním antigenům (4–8 hod) a po zamezení dalšího kontaktu mizí. Pokud je nemocný opět exponován vyvolávajícímu antigenu, dojde znovu k manifestaci příznaků. V literatuře bývá tento stav (v případě expozice v rámci zaměstnání pacienta) někdy označován jako horečka pondělního rána (monday morning fever) [1]. Obtíže jsou nejčastěji popisovány u osob, které zpracovávají bavlnu (bysinóza). Někteří autoři je přičítají spíše kontaminujícímu endotoxinu (obdoba toxického syndromu z inhalace organického prachu u pracovníků na silech), jindy se označení používá pro horečku z kovových par, kterou mohou trpět svářeči (nejčastěji při práci se zinkem) [2].
U některých osob jsou systémové příznaky vyjádřeny méně – pacient se „necítí dobře“, má zvýšenou teplotu, hubne. U velké skupiny osob systémové příznaky úplně chybí a dominují obtíže vyvolané postižením respiračního traktu – dušnost a kašel.
U nemocných se systémovými příznaky je časná úvaha o souvislosti obtíží s expozicí organickým antigenům velmi důležitá, protože zamezení další expozice může předejít rozvoji nevratného fibrotického plicního postižení.
Jaká expozice může vést k rozvoji EAA?
Obecně se může jednat o jakýkoliv organický inhalační antigen. U části pacientů je onemocnění vyvoláno i anorganickými antigeny, které působí jako hapteny. Některé syndromy jsou ale popisovány častěji (tab).
Tab. Synonyma pro exogenní alergickou alveolitidu podle vyvolávajícího antigenu 
Jak je z výše uvedeného patrné, je nezbytně nutné, aby lékař odebral pečlivě pracovní anamnézu. Pokud pacient na otázku: „Jaké je vaše zaměstnání?“ odpoví: „OSVČ“, nelze se s touto odpovědí spokojit. Stejně tak pokud pacient uvede, že je zámečníkem, je třeba získat podrobnější informace o tom, co přesně v zaměstnání dělá (kovoobrábění – možná expozice chladicí kapalině, která bývá často zdrojem bakterií a hub, svařování – horečka z kovových par).
Je dobré mít alespoň rámcovou představu o koníčcích a bydlení pacienta, protože i tyto informace mohou být v případě zdravotních obtíží užitečné. Minimálně majitelé větších zahrad, skleníků, chovatelé ptactva nebo zvířectva mívají s organickými inhalačními antigeny významný kontakt. Organickým inhalačním antigenům jsou vystaveni též majitelé a uživatelé vířivek, horkých koupelí, zvlhčovačů vzduchu a klimatizací, stejně tak hráči na dechové nástroje nebo pěstitelé pokojových rostlin.
Kromě exogenních alergických alveolitid jsou s expozicí environmentálním vlivům spojena i jiná plicní onemocnění – endemickými mykózami počínaje (blastomykóza u osob exponovaných prachu z půdy – např. stavební dělníci, zemědělci – v Severní a Střední Americe, pneumokoniózy pracovníků černouhelných dolů, pracovníků keramického průmyslu, brusičů skla apod). Dobře odebraná pracovní a sociální anamnéza by tedy měla být nedílnou součástí dobře provedeného celkového vyšetření pacienta.
Jaká vyšetření by měla být u nemocného se suspekcí na EAA provedena?
Jak bylo zmíněno výše, základem je pečlivě odebraná anamnéza. Diagnóza nemůže být stanovena na základě jednoho vyšetření, připomíná spíše mozaiku, která je složena z anamnézy expozice inhalačnímu antigenu, příznaků, radiologického obrazu, nálezů v tekutině získané bronchoalveolární laváží ev. výsledků histologického vyšetření plicní tkáně.
Laboratorní vyšetření
Laboratorní vyšetření využíváme spíše v rámci diferenciální diagnostiky (vyšetření autoprotilátek, vyšetření stavu imunitního systému); u vybraných pacientů bez jednoznačné anamnézy expozice organickým inhalačním antigenům lze zvážit i vyšetření specifických imunoglobulinů G v krvi, vysoké koncentrace těchto protilátek mohou totiž pomoci u některých nemocných zdroj odhalit [3].
Zobrazovací metody
Skiagram hrudníku sám o sobě není dostačující vyšetření, které může jednoznačně vyloučit intersticiální plicní proces, u pacientů s podezřením na EAA je nutné vždy doplnit vyšetření hrudníku výpočetní tomografií s vysokou rozlišovací schopností (HRCT), která probíhá v řezech 1 mm silných, s užitím ostře kreslícího výpočetního algoritmu (tzv. ultraspharp kernel) pro rekonstrukci CT obrazů ze získaných dat [4]. Důležité je, aby indikující lékař požadoval HRCT vyšetření a radiolog jeho žádost respektoval! EAA mohou odpovídat rozmanité radiologické nálezy počínaje centrilobulárními noduly, opacitami charakteru mléčného skla, přes cystické změny nebo emfyzém až po obraz nespecifické intersticiální pneumonie či obvyklé intersticiální pneumonie (obr. 1 a 2). Výrazná nitrohrudní lymfadenopatie, ložiskové léze nebo fluidotorax do obrazu EAA nepatří.
Obr. 1. HRCT obraz mnohočetných nodulů u nemocné s EAA 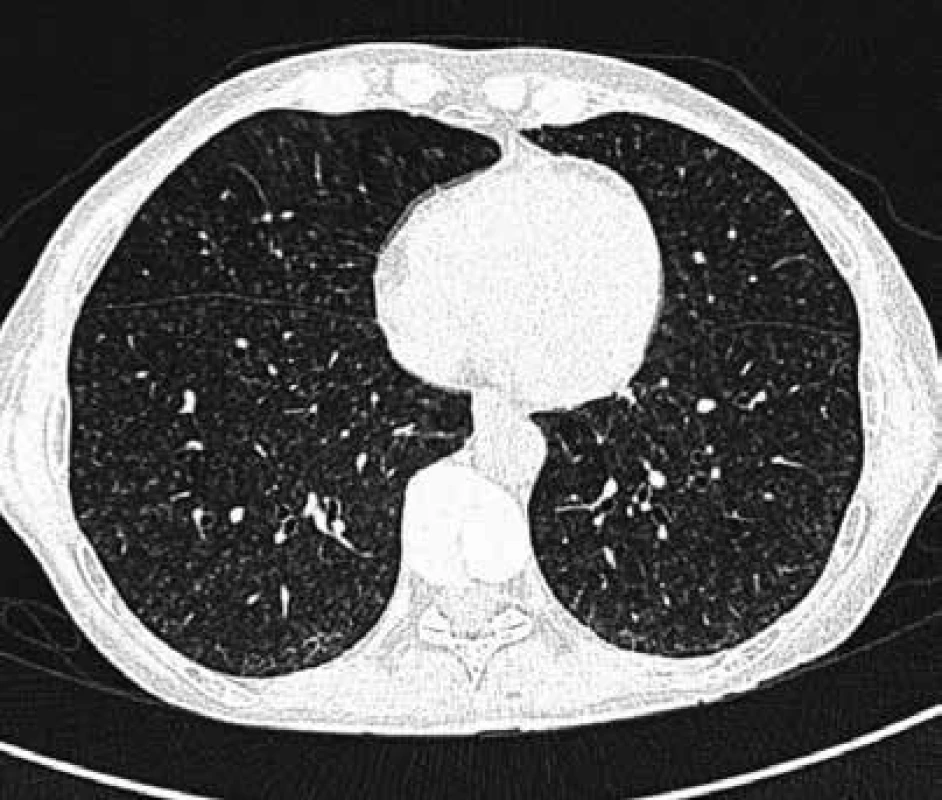
Obr. 2. HRCT obraz charakteru obvyklé intersticiální pneumonie u pacienta s EAA 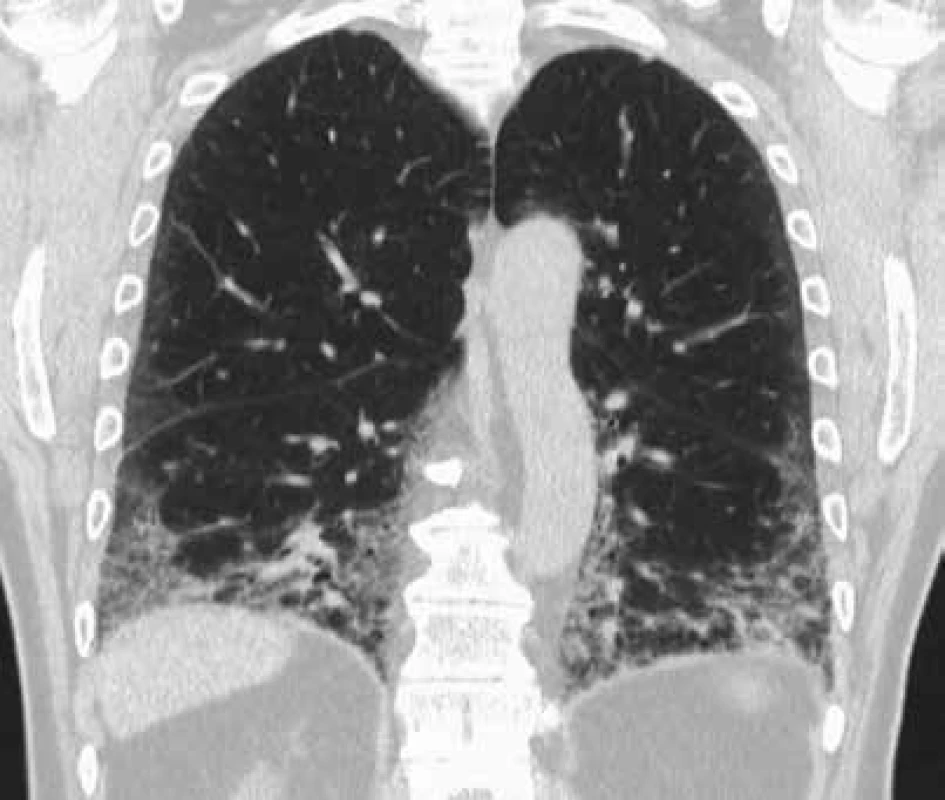
Bronchoskopie
U většiny nemocných s EAA se setkáváme s vyšším procentuálním zastoupením lymfocytů v tekutině získané bronchoalveolární laváží, výjimkou jsou kuřáci a pacienti s fibrotickým plicním postižením charakteru obvyklé intersticiální pneumonie (UIP – usual interstitial pneumonia). U těchto nemocných může procentuální zastoupení lymfocytů v tekutině získané bronchoalveolární laváží (BALT) dosahovat zcela normálních hodnot, při bronchoskopii lze kromě bronchoalveolární laváže provést v indikovaných případech i transbronchiální plicní biopsii s odběrem plicní tkáně k histologickému vyšetření. Vyšetření bývá diagnostické u nemocných s centrilobulárními mikronoduly a s peribronchiálně lokalizovanými změnami, u nemocných s emfyzémem dle HRCT hrudníku nebo s obrazem UIP nebývá vyšetření výtěžné. Z uvedeného vyplývá, že u pacienta s podezřením na intersticiální plicní proces by mělo proběhnout nejprve HRCT vyšetření hrudníku a až následně bronchoskopie s BAL nebo odběrem tkáně k histologickému vyšetření. Další možnost odběru většího vzorku plicní tkáně transbronchiálně přináší kryobiopsie [5].
Vyšetření plicních funkcí
Metody vyšetření plicních funkcí nejsou diagnostické, ale pomáhají stanovit tíži plicního postižení a objektivizovat postižení funkce plic. U pacientů s EAA nestačí provést prostou spirometrii a na základě normálních parametrů vyloučit plicní onemocnění nebo na základě obstrukční ventilační poruchy stanovit diagnózu chronické obstrukční plicní nemoci (CHOPN). Nemocný by měl vždy podstoupit i vyšetření transfer faktoru, při podezření na restrikční ventilační poruchu pak bodypletyzmografii, zejména u pacientů s diskrepancí mezi obtížemi a výsledky funkčního vyšetření a nálezy zobrazovacích vyšetření je na místě doplnit zátěžové vyšetření – spiroergometrii. Koincidence EAA a nemocí s bronchiální obstrukcí je samozřejmě možná, pacienta je vždy třeba pečlivě vyšetřit.
Chirurgická plicní biopsie
Indikace chirurgické plicní biopsie patří do rukou multidisciplinárního týmu, který zváží, s jakou mírou pravděpodobnosti lze na základě známých skutečností stanovit diagnózu EAA a jaké přínosy v porovnání s potenciálními riziky přináší tento vyšetřovací postup pro konkrétního pacienta.
Možný přínos chirurgické plicní biopsie: jednoznačné stanovení diagnózy může pacienta přimět k zamezení dalšího kontaktu s vyvolávajícím organickým antigenem. Pokud nejsou výsledky laboratorního vyšetření, zobrazovacích metod ani bronchoskopie typické, může být chirurgická plicní biopsie jedinou cestou, jak se diagnózy dobrat. U pacientů s možnou profesní EAA je přesně stanovená diagnóza důležitá také pro další práci odborníků z oboru pracovní lékařství. U pacientů s fibrotickým plicním postižením může být důležitý i negativní nález, tzn. výsledek nesvědčí pro EAA (nejsou patrny vágně formované granulomy, lymfoidní peribronchiální infiltráty, ložiska organizující se pneumonie s Massonovými polypy) [6]. Zejména nemocní s radiologickým obrazem možné UIP a možnou expozicí organickému inhalačnímu antigenu, pokud jsou na základě výsledků histologického vyšetření vyloučeny jiné příčiny jejich onemocnění, mohou být kandidáty antifibrotické léčby.
Možná rizika chirurgické plicní biopsie: část rizik chirurgické plicní biopsie je spojena s celkovou anestezií. Pokud je celková anestezie na základě komorbidit nemocného příliš riziková, obvykle k chirurgické plicní biopsii (a v tomto případě ani ke kryobiopsii, která se provádí též v celkové anestezii) nepřistupujeme. Další skupinu pacientů, pro které může být chirurgická plicní biopsie spojena s vysokým rizikem komplikací, představují nemocní s fibrotickým plicním postižením a těžkým poklesem plicních funkcí. Výkon u nich může být spojen s rizikem akutní exacerbace EAA [7].
Jak postupovat v léčbě u pacienta se stanovenou diagnózou EAA?
Základem úspěšné léčby u velké části pacientů je zamezení další expozice vyvolávajícímu inhalačnímu antigenu. Tento postup mívá výrazný efekt zejména, pokud se onemocnění projevuje i systémovými příznaky, teplotou, radiologicky dominují mikronoduly nebo opacity mléčného skla. Pokud má pacient výrazné obtíže s dušností, která jej limituje a kašlem, lze rezoluci postižení urychlit podáním systémových kortikosteroidů.
Na druhé straně u skupiny nemocných, obvykle spíše s fibrotickým plicním postižením, nevede zamezení další expozici a někdy ani systémová kortikoterapie ke zlepšení stavu [8].
Kdy tedy podat systémové kortikosteroidy, v jaké dávce a jak dlouho?
Na tuto otázku neexistuje bohužel jednoznačná a správná odpověď, protože se touto problematikou systematicky v rámci klinické studie nikdo nezabýval. Když se rozhodujeme, zda indikovat systémovou kortikoterapii, je třeba položit si několik otázek:
Jaké má nemocný obtíže?
Můžeme se setkat s pacienty, kteří navzdory prokazatelnému poklesu plicních funkcí hodnotí svůj zdravotní stav jako dobrý a nepociťují významné omezení. Pokud jsme schopni identifikovat vyvolávající agens a nemocný je ochoten zamezit další expozici, mohou být tato opatření dostačující [9]. U pacientů s minimálními symptomy je třeba vzít v potaz nejčastější vedlejší účinek systémové kortikoterapie – vzestup tělesné hmotnosti, pacienty bývá tento efekt hodnocen negativně, navíc pokud nemocný výrazně přibere ne váze, obvykle pociťuje výraznější námahovou dušnost a diskomfort.
Jaký je radiologický charakter plicního postižení?
Pokud radiologicky dominuje intersticiální plicní proces charakteru fibrotické nespecifické intersticiální pneumonie (NSIP – non-specific interstitial pneumonia) nebo UIP, je opět na místě zvážit, zda rizika systémové kortikoterapie u konkrétního pacienta nepřevažují potenciální benefit. Jistě je na místě zvážit 4týdenní terapeutický pokus s postupným snižováním dávky kortikosteroidů a následnou kontrolou klinického stavu pacienta, radiologického nálezu a plicních funkcí. Pokud nezaznamená pacient ani lékař významné zlepšení, není důvodem kortikoterapii prodlužovat. I v těchto případech je třeba vzít v potaz především časté vedlejší účinky systémové kortikoterapie počínaje výše zmíněným vzestupem tělesné hmotnosti, zvýšením krevního tlaku, až k riziku rozvoje steroidního diabetu, katarakty, osteoporózy a dalších.
Jaké má pacient komorbidity?
Tato informace určitě není tou hlavní, podle které by se řídila léčba EAA, ale např. při rozhodování o dávce systémových kortikosteroidů, která bude nemocnému podána. V literatuře se nejčastěji setkáme s doporučenou dávkou 0,5–1 mg/kg tělesné hmotnosti v úvodu léčby [10], ale jinou dávku budeme ale volit u pacienta s diabetem, který váží 120 kg a u kterého i dávka 0,5 mg/kg představuje 60 mg prednisonu, a jinou u pacientky bez komorbidit se systémovými příznaky, febriliemi a váhovým úbytkem, s aktuální hmotností 50 kg a těžkou respirační insuficiencí. Zatímco v prvním případě jsou vzestup hmotnosti pacienta a dekompenzace diabetu jistotou, v druhém případě můžeme použít prakticky tutéž dávku 60 mg prednisonu s postupnou detrakcí.
Jaká je odpověď na léčbu?
Jelikož optimální doba systémové kortikoterapie u nemocných s EAA není známa, v klinické praxi se řídíme především odpovědí na podanou léčbu, hodnotíme změnu subjektivních obtíží pacienta, případnou změnu plicních funkcí nebo radiologického nálezu. Pokud se stav pacienta při léčbě zlepší a je odstraněn zdroj vyvolávajícího antigenu, může být systémová kortikoterapie postupně vysazena, stejně tak lze ale o vysazení uvažovat u nemocných, u nichž podávání systémových kortikosteroidů nevede k subjektivnímu ani objektivnímu zlepšení.
Před dlouhodobým podáváním systémové kortikoterapie v neindikovaných případech varují sdělení řady autorů, kteří se zabývali vedlejšími účinky této léčby. Za nejčastější vedlejší účinek byla označena osteoporóza s rizikem fraktur a dále nežádoucí účinek v oblasti žaludeční sliznice [11]. Léčba těchto komplikací je spojena s nemalými náklady – podle některých prací je systémovými kortikosteroidy léčeno 0,9 % obyvatel Velké Británie, náklady na léčbu vedlejších účinků na jednoho pacienta za rok představují £ 165 [12]. Při současném počtu obyvatel Velké Británie 65,64 milionu osob by se náklady na léčbu vedlejších účinků systémové kortikoterapie mohly vyšplhat na £ 97,5 milionů, což je v přepočtu asi 276 milionů českých korun za rok.
Počet pacientů v ČR, kteří trpí EAA, znám není, v tomto ohledu lze pouze spekulovat – podle údajů z jiných zemí je EAA 2. nebo 3. nejčastější příčinou intersticiálního plicního procesu a pacienti s EAA tvoří asi 7–15 % všech nemocných s intersticiálními plicními procesy [13]. Ve Velké Británii je ročně diagnostikováno asi 600 nových případů EAA [14]. Pokud by byli všichni tito pacienti dlouhodobě léčeni systémovými kortikosteroidy, mohly by se náklady na léčbu vedlejších účinků vyšplhat k £ 99 000, tedy asi 2,9 milionu korun za rok.
Jakou jinou léčbu kromě systémové kortikoterapie lze u nemocných s EAA doporučit?
Studií zkoumajících efekt jiné léčby, zejména léčby jinými imunosupresivy, je k dispozici pouze několik [15]. Pokud se u některých nemocných nedaří identifikovat zdroj inhalačního antigenu, a tudíž ani nelze zamezit další expozici, může stav pacienta skutečně vyžadovat dlouhodobou systémovou kortikoterapii. Ke snížení rizika rozvoje vedlejších účinků lze zvážit použití kombinace glukokortikoidu s jiným imunosupresivem. Zažitá kombinace s azatioprinem nejspíše kopíruje doporučené postupy pro léčbu idiopatické plicní fibrózy ATS/ERS z roku 2000 [16]. Nakolik je tento postup u pacientů bez klinické odpovědi na systémovou kortikoterapii přínosný, je otázkou, na kterou v současné době neexistuje správná odpověď. Zejména u pacientů s fibrotickým plicním postižením, bez radiologických známek aktivity procesu, je třeba dobře uvážit, jaký efekt a jaká rizika má kombinovaná imunosupresivní terapie v porovnání se sledováním bez farmakologické léčby, případně s léčbou symptomatickou.
V současné době probíhá v National Jewish Institute v Coloradu studie zkoumající efekt léčby pirfenidonem u nemocných s fibrotickým plicním postižením na podkladě EAA. Dále probíhá studie zabývající se postižením malých dýchacích cest u nemocných s chronickou EAA a vlivem salbutamolu na toto postižení. V literatuře se objevují kazuistická sdělení dokumentující příznivý efekt rituximabu u vybraných pacientů s EAA [17].
Každopádně kromě informací o nutnosti zamezení kontaktu s vyvolávajícím antigenem a případně výše uvedené farmakologické léčby je zcela na místě nemocnému nabídnout i léčbu nefarmakologickou. Ta představuje optimalizaci tělesné hmotnosti (obvykle míváme v rámci ČR problém spíše s pacienty s nadváhou než s kachektickými nemocnými), plicní rehabilitaci s cílem zlepšení celkové kondice, posílení dechových svalů, nácvik dechového cyklu, expektoračních, ale i relaxačních technik, předcházení a důsledná léčba respiračních infektů a komorbidit. U nemocných léčených systémovými kortikosteroidy v dávce vyšší než 20 mg prednisonu/den je kontraindikováno očkování živými a živými oslabenými vakcínami [18]. Očkování neživými vakcínami je možné i u pacientů léčených systémově podávanými kortikosteroidy nebo kombinovanou imunosupresí, může ale dojít k redukci účinku očkování. Všichni pacienti s EAA, kteří kouří, by měli být vyzváni, aby kouření zanechali, a to při každé návštěvě lékaře!
U vybraných pacientů s respirační insuficiencí, kteří splňují indikační kritéria České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně pro dlouhodobou domácí oxygenoterapii, je možné doporučit podávání kyslíku. Naději na zlepšení kvality života nemocných s respiračním selháním na podkladě fibrotického plicního postižení při EAA přináší také plicní transplantace, problematika výběru vhodných kandidátů však přesahuje rozsah tohoto sdělení.
Závěr
Nemoci dýchací soustavy vzniklé na podkladě environmentálních expozic nejsou vzácné. EAA je skupina chorob, které mezi tyto nozologické jednotky patří. U některých pacientů může mít EAA sebelimitující průběh, obtíže nemocného vyřadí z kontaktu s vyvolávajícím antigenem a v čase dojde ke kompletní rezoluci postižení. Část nemocných ale vyvine fibrotické plicní postižení, které významně snižuje kvalitu jejich života. Minimálně praktický lékař, internista a pneumolog by měli dobře znát pracovní a sociální anamnézu svých pacientů včetně rizika možných expozic a v případě rozvoje symptomů onemocnění dýchacího traktu vyslovit podezření na možnou souvislost. Včasná diagnostika a individuální léčebný přístup mohou pomoci snížit dopad onemocnění na pacienta.
MUDr. Martina Šterclová, Ph.D.
martinasafrankova@seznam.cz
Pneumologická klinika 1. LF UK a Thomayerovy nemocnice,
Praha
www.ftn.cz
Doručeno do redakce 27. 8. 2017
Přijato po recenzi 26. 9. 2017
Zdroje
1. Kateman E, Heederik D, Pal TM et al. Relationship of airborne microorganisms with the lung function and leucocyte levels of workers with a history of humidifier fever. Scand J Work Environ Health 1990; 16(6): 428–433.
2. Greenberg MI, Vearrier D. Metal fume fever and polymer fume fever. Clin Toxicol (Phila) 2015; 53(4): 195–203. Dostupné z DOI: <http://dx.doi.org/10.3109/15563650.2015.1013548>.
3. Merget R, Sander I, van Kampen V et al. Hypersensitivity pneumonitis due to metalworking fluids: how to find the antigens. Adv Exp Med Biol 2013; 788 : 335–340. Dostupné z DOI: <http://dx.doi.org/10.1007/978–94–007–6627–3_45>.
4. Chudáček Z. HRCT plic – technika vyšetření, CT anatomie, základní typy patologických nálezů. Med Pro Praxi 2010; 7(6–7): 299–302.
5. Morell F, Villar A, Ojanguren I et al. Hypersensitivity Pneumonitis: Challenges in Diagnosis and Management, Avoiding Surgical Lung Biopsy. Semin Respir Crit Care Med 2016; 37(3): 395–405. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0036–1580692>.
6. Vasakova M, Morell F, Walsh S et al. Hypersensitivity Pneumonitis: Perspectives in Diagnosis and Management. Am J Respir Crit Care Med 2017; 196(6): 680–689. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201611–2201PP>.
7. Spagnolo P, Wuyts W. Acute exacerbations of interstitial lung disease: lessons from idiopathic pulmonary fibrosis. Curr Opin Pulm Med 2017; 23 : 411–417. Dostupné z DOI: <http://dx.doi.org/10.1097/MCP.0000000000000405>.
8. Kouranos V, Jacob J, Nicholson A et al. Fibrotic Hypersensitivity Pneumonitis: Key Issues in Diagnosis and Management. J Clin Med 2017; 6(6): E62. Dostupné z DOI: <http://dx.doi.org/10.3390/jcm6060062>.
9. Tsutsui T, Miyazaki Y, Okamoto T et al. Antigen avoidance tests for diagnosis of chronic hypersensitivity pneumonitis. Respir Investig 2015; 53(5): 217–224. Dostupné z DOI: <http://dx.doi.org/10.1016/j.resinv.2015.04.003>.
10. Miyazaki Y, Tsutsui T, Inase N. Treatment and monitoring of hypersensitivity pneumonitis. Expert Rev Clin Immunol 2016; 12(9): 953–962. Dostupné z DOI: <http://dx.doi.org/10.1080/1744666X.2016.1182426>.
11. van der Goes MC, Jacobs JW, Bijlsma JW. The value of glucocorticoid co-therapy in different rheumatic diseases – positive and adverse effects. Arthritis Res Ther 2014; 16(Suppl 2): S2. Dostupné z DOI: <http://dx.doi.org/10.1186/ar4686>.
12. Manson SC, Brown RE, Cerulli A et al. The cumulative burden of oral corticosteroid side effects and the economic implications of steroid use. Respir Med 2009; 103(7): 975–994. Dostupné z DOI: <http://dx.doi.org/10.1016/j.rmed.2009.01.003>.
13. Riario Sforza GG, Marinou A. Hypersensitivity pneumonitis: a complex lung disease. Clin Mol Allergy 2017; 15 : 6. Dostupné z DOI: <http://dx.doi.org/10.1186/s12948–017–0062–7>.
14. Solaymani-Dodaran M, West J, Smith C et al. Extrinsic allergic alveolitis: incidence in the general population. QJM 2007; 100(4): 233–237.
15. Morisset J, Johannson KA, Vittinghoff E et al. Use of Mycophenolate Mofetil or Azathioprine for the Management of Chronic Hypersensitivity Pneumonitis. Chest 2017; 151(3): 619–625. Dostupné z DOI: <http://dx.doi.org/10.1016/j.chest.2016.10.029>.
16. [American Thoracic Society]. Idiopathic pulmonary fibrosis: diagnosis and treatment. International consensus statement. American Thoracic Society (ATS), and the European Respiratory Society (ERS). Am J Respir Crit Care Med 2000; 161(2 Pt 1): 646–664.
17. Lota HK, Keir GJ, Hansell DM et al. Novel use of rituximab in hypersensitivity pneumonitis refractory to conventional treatment. Thorax 2013; 68(8): 780–781. Dostupné z DOI: <http://dx.doi.org/10.1136/thoraxjnl-2013–203265>.
18. Kosina P, Rumlarová Š. Vakcinace u imunokompromitovaných osob. Remedia 2014; 24(5): 363–369.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Současná náplň pneumologieČlánek Nozokomiální pneumonieČlánek Cystická fibróza dospělýchČlánek Nemalobuněčný karcinom plicČlánek Neinvazivní ventilace
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Současná náplň pneumologie
- Cílené vyhledávání nemocných s chronickou obstrukční plicní nemocí: stručný přehled
- Asthma bronchiale v kontextu vnitřního lékařství
- Diagnostika a léčba komunitní pneumonie – v jednoduchosti je klíč k úspěchu
- Nozokomiální pneumonie
- Pneumonie u imunokompromitovaných
- Idiopatická plicní fibróza. Umíme ji vždy správně diagnostikovat a léčit?
- Exogenní alergické alveolitidy: minimum pro praxi
- Sarkoidóza – nadále záhadné onemocnění
- Současný přístup k diagnostice, léčbě a prevenci tuberkulózy
-
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně - Cystická fibróza dospělých
- Kardiovaskulární riziko spánkové apnoe a kazuistika
- Komplikace po transplantaci plic
- Nemalobuněčný karcinom plic
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
- Maligní mezoteliom pleury – dosud nepokořený nádor
- Spirometrie – základní vyšetření funkce plic
- Postavení bronchologie v pneumologické diagnostice
- Ultrasonografické vyšetření hrudníku v rukou lékaře klinika
- Neinvazivní ventilace
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Spirometrie – základní vyšetření funkce plic
- Neinvazivní ventilace
- Pneumonie u imunokompromitovaných
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



