-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPneumonie u imunokompromitovaných
Pneumonia in immunocompromised persons
In the broadest sense, the term immunocompromised individual means a person with any impairment of infection resistance, whether it is deficiency or impairment of innate resistance (by another name impairment of non-specific resistance), or impairment of acquired resistance (impairment of specific immunity). Pneumonia in immunocompromised patients is characterized by a different microbiological spectrum. Apart from common pathogens there are also opportunistic agents involved in this group of patients. Management of pneumonia in immunocompromised patients is often decisive for their future fate. Very rare are innate immune deficiencies. Acquired immune deficiencies are far more common. They are often combined with disorders of non-specific resistance. The most frequent cause of acquired immune deficiency is another illness or a medical treatment. The diagnosing and treatment of pneumonias in immunocompromised patients are usually highly specialized and they unquestionably require a collaboration with microbiologists who are concerned with these problems.
Key words:
diagnostics – etiology – pneumonia in immunocompromised patients – prophylaxis – treatment
Autoři: Jana Skřičková
Působiště autorů: Klinika nemocí plicních a TBC LF MU a FN Brno, pracoviště Bohunice
Vyšlo v časopise: Vnitř Lék 2017; 63(11): 786-795
Kategorie: Přehledné referáty
Souhrn
V nejširším slova smyslu se termínem imunokompromitovaný jedinec myslí osoba s jakýmkoliv postižením protiinfekční odolnosti, ať se jedná o nedostatečnost či poruchu odolnosti vrozené (neboli o postižení nespecifické rezistence), nebo o poruchu odolnosti získané (čili o postižení specifické imunity). Pneumonie u imunokompromitovaných nemocných se vyznačuje odlišným mikrobiologickým spektrem. U této skupiny nemocných se vedle běžných patogenů uplatňují i oportunní agens. Zvládnutí zánětu plic u imunokompromitovaných nemocných je často pro jejich další osud rozhodující. Velmi vzácné jsou vrozené imunodeficity. Získané imunodeficity jsou daleko běžnější. Často jsou kombinovány s poruchami nespecifické rezistence. Nejčastější příčinou získaného imunodeficitu je jiné onemocnění nebo léčebný zákrok. Diagnostika a léčba pneumonií u imunokompromitovaných nemocných je obvykle vysoce specializovaná, není možná bez spolupráce s mikrobiology, kteří se touto problematikou zabývají
Klíčová slova:
diagnostika – etiologie – léčba – pneumonie u imunpokompromitovaných nemocných – profylaxeÚvod
V 80. letech 20. století se pozornost soustředila na pneumonie u imunokompromitovaných nemocných (pneumonia in immunocompromised host – PIIH), především HIV pozitivních, u kterých byl zánět plic nečastější komplikací ve stadiu klinicky rozvinutého AIDS. Závažným problémem posledních let jsou i záněty plic u imunokompromitovaných HIV negativních nemocných, jejichž počet stoupá v souvislosti s rozvojem orgánových transplantací, se zaváděním intenzivních chemoterapeutických a radioterapeutických schémat u onkologicky nemocných, s rozšířením transplantací krvetvorných buněk, s imunosupresivní léčbou systémových onemocnění. Zvládnutí zánětu plic u imunokompromitovaných nemocných je často pro jejich další osud rozhodující [1].
V nejširším slova smyslu se termínem imunokompromitovaný jedinec myslí osoba s jakýmkoliv postižením protiinfekční odolnosti, ať se jedná o nedostatečnost či poruchu odolnosti vrozené (neboli o postižení nespecifické rezistence), nebo o poruchu odolnosti získané (čili o postižení specifické imunity). V tomto širokém pojetí můžeme rozeznávat postižení vrozené odolnosti při poškození vnějších bariér (kůže a sliznic), při defektech komplementu a při poruchách fagocytů. Postižení specifické imunity se označují jako imunodeficity [1,2].
Vrozené imunodeficity jsou velmi vzácné. Mohou se dělit na defekty T buněčné imunity, na poruchy v sérii buněk B vyznačující se vadnou tvorbou protilátek a na imunodeficity smíšené. U nejtěžších kombinovaných forem umírají postižené děti během několika měsíců po narození na generalizované infekce. Z vrozených defektů humorální imunity je známa např. Brutonova agamaglobulinemie. Častější bývá selektivní deficit IgA, který se projevuje spíše opakovanými sinusitidami a otitidami než pneumoniemi. Defekty komplementu jsou relativně vzácné. U jedinců neschopných tvořit některé složky komplementu lze čekat pneumonie vyvolané stafylokoky, streptokoky, pneumokoky a hemofily [1,2].
Získané imunodeficity jsou daleko běžnější. Často jsou kombinovány s poruchami nespecifické rezistence. Nejčastější příčinou získaného imunodeficitu je jiné onemocnění nebo léčebný zákrok. Často je u získaného imunodeficitu současně porušena nespecifická rezistence i specifická imunita [1,2].
Se získanými hypogamaglobulinemiemi se setkáváme i při stavech vedoucích ke ztrátám proteinů (nefrotický syndrom, popáleniny), dále při maligním postižení buněk tvořících imunoglobuliny (mnohočetný myelom, chronická lymfocytární leukemie) a po transplantaci kostní dřeně. Nedostatek imunoglobulinů znemožňuje účinnou opsonizaci a fagocytózu opouzdřených bakterií. Nejčastějšími infekcemi u zmíněných stavů jsou právě opakující se záněty respiračního traktu vyvolané především Streptococcus pneumoniae, ale i Haemophilus influenzae, Klebsiella pneumoniae, dalšími enterobakteriemi a Staphylococcus aureus [1,2].
Významnou úlohu v humorální imunitě hraje dále slezina, jednak jako zdroj B buněk účastnících se ve tvorbě protilátek, jednak jako nejdůležitější orgán pro odstraňování opsonizovaných mikrobů z krevního oběhu. U splenektomovaných osob hrozí fulminantní infekce zvláště pneumokokové a hemofilové [1,2].
Získané defekty buněčné imunity, tedy poruchy ve funkci nebo počtu makrofágů a T-lymfocytů, vedou ke zvýšenému riziku infekcí způsobených intracelulárně se množícími agens – zvláště mykobakterii, viry, houbami a prvoky [1,2].
V prvním měsíci po cytotoxické chemoterapii nebo po transplantacích se setkáváme s pneumoniemi způsobenými běžnými bakteriemi a kandidami. V posledních letech nabývají na významu především grampozitivní mikroby (stafylokoky, a to spíše koaguláza-negativní, enterokoky a kvasinky, nejen Candida albicans, ale i Candida krusei a jiné), obr. 1.
Obr. 1. CT sken nemocného s kvasinkovou pneumonií 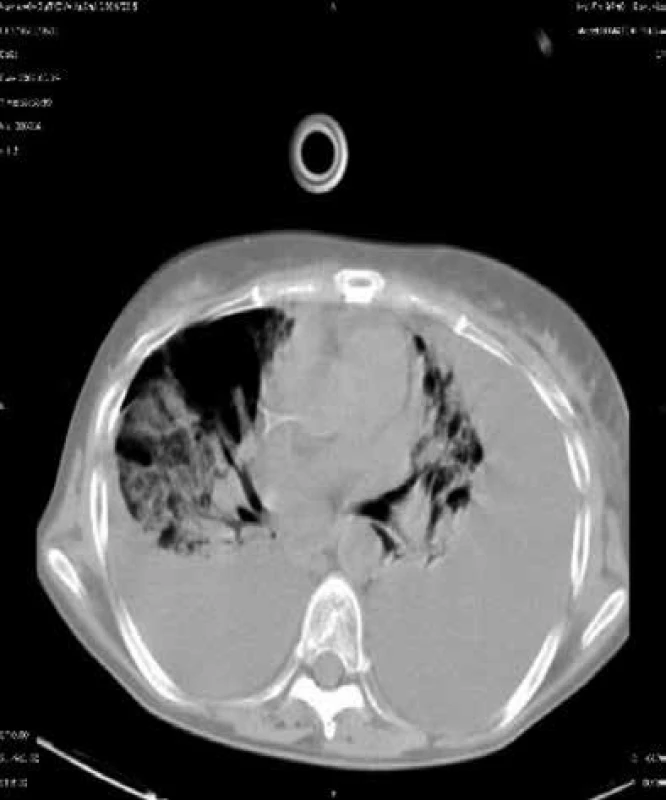
Během prvního měsíce se může dostavit i zánět plic způsobený reaktivovaným virem Herpes simplex. Od 2. do 6. měsíce po transplantacích se objevují plicní infekce vyvolané typickými intracelulárními patogeny. Na prvním místě je to Cytomegalovirus (CMV), obr. 2.
Obr. 2. Zadopřední skiagram hrudníku nemocného s cytomegalovirovou pneumonií 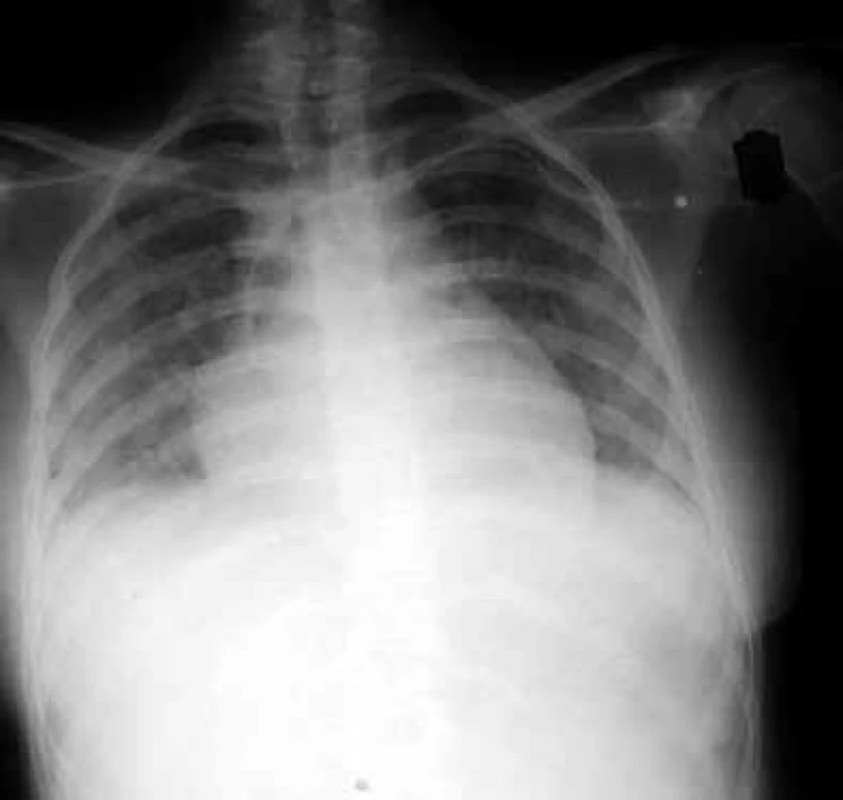
Kromě toho, že vyvolává intersticiální pneumonitis, postihuje celou řadu dalších orgánů, poškozuje transplantovaný štěp a podporuje jeho rejekci, CMV svým množením v buňkách imunitního systému prohlubuje imunosupresi a zvyšuje vnímavost příjemce vůči oportunním infekcím. Dalším agens, jež v tomto období postihuje plíce, je Pneumocystis jiroveci (dříve Pneumocystis carinii), obr. 3.
Obr. 3. Zadopřední skiagram hrudníku nemocného s pneumocystovou pneumonií 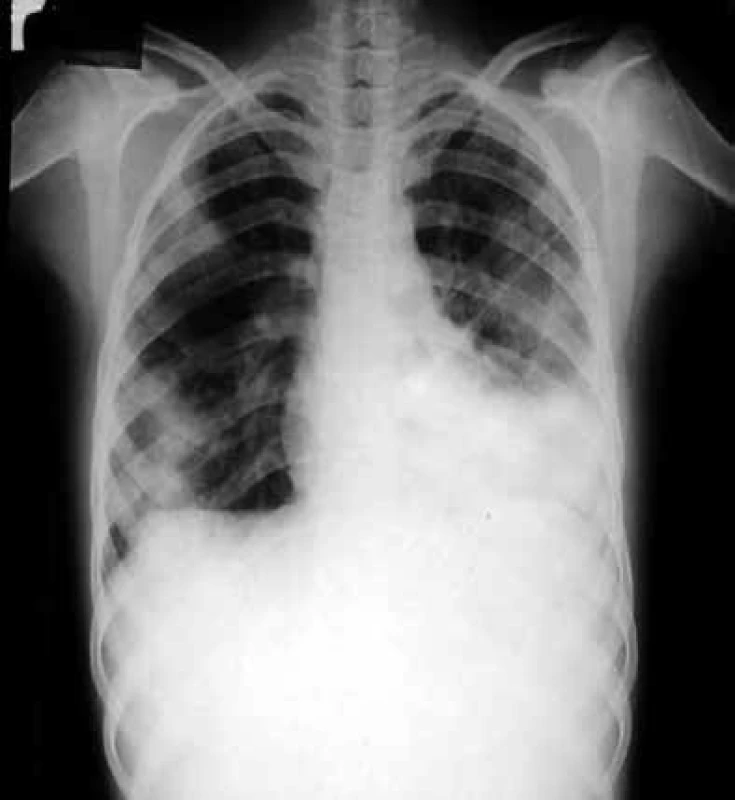
Tento mikrob je pojmenován podle akademika Jírovce, který popsal jeho vztah k onemocnění u člověka. Výskyt těchto infekcí lze omezit chemoprofylaxí. Problémem začínají být plicní infekce vyvolané plísněmi z rodu Aspergillus (např. Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger aj), obr. 4, jejichž spory se vyskytují ve vzduchu zejména v prostředí, kde se provádějí stavitelské práce. Dalším častým původcem plicních postransplantačních lézí jsou nokardie, nejčastěji Nocardia asteroides. Kdykoli po transplantacích mohou vzniknout pneumonie způsobené legionelami (nejčastěji Legionella pneumophila) a Cryptococcus neoformans, kvasinkou vyskytující se v zevním prostředí. Vzácnější jsou pneumonie vyvolané Listeria monocytogenes, viry varicelly-zosteru a snad i EB virem. Popsány byly dále pneumonie vyvolané adenoviry, virem chřipky a RS virem. Zygomycetické pneumonie (vyvolané příslušníky rodů Rhizopus, Mucor a Absidia) jsou časté u diabetiků. Plicní mykózy způsobené Histoplasma capsulatum a příbuznými endemickými dimorfními houbami se vyskytují i po 6 měsících od transplantace a jsou zatím problémem Spojených států. Infekce Mycobacterium tuberculosis v tomto období po transplantaci bývají výsledkem reaktivace latentní infekce [2,3].
Obr. 4. CT sken nemocného s aspergilovou pneumonií 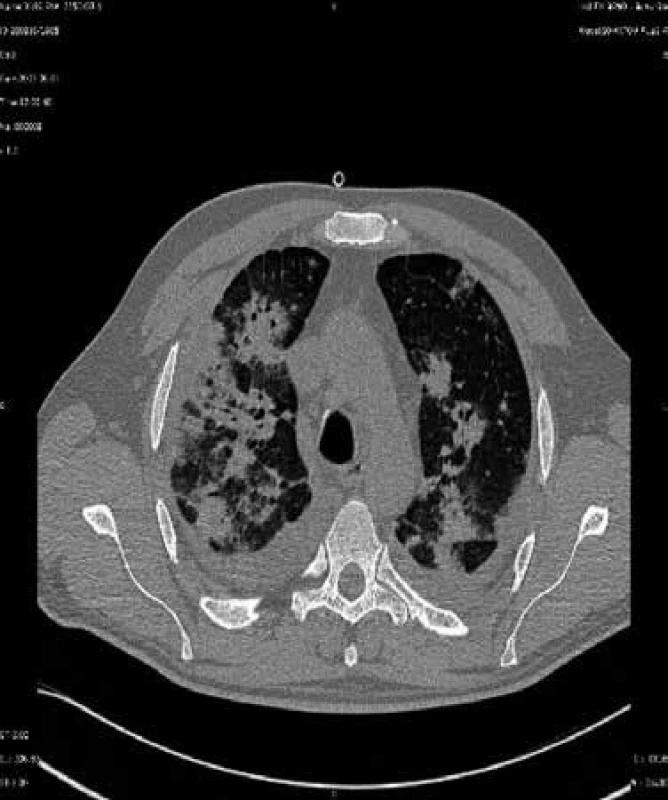
Další závažnou poruchou nespecifické imunity jsou neutropenie. Infekce u neutropenických nemocných se vyznačují náhlým začátkem, perakutním průběhem a závažnými následky. Typické klinické projevy zánětu respiračního traktu (kašel, expektorace hnisavého sputa) bývají v těchto případech potlačeny, často je jediným zjevným projevem zvýšená teplota a přítomnost bakteriemie. Primární neutropenie jsou vzácné. Sekundární snížení počtu hodnotných neutrofilů je známo u leukemií a u některých infekcí, zejména spalniček, a v důsledku protinádorové chemoterapie [1,2].
Termínem febrilní neutropenie se označuje stav, pokud u nemocného s počtem neutrofilních granulocytů < 0,5 × 109/l naměříme 2krát v průběhu 12 hod tělesnou teplotu vyšší než 38 °C. Dochází k tomu ve 2–3 prvních týdnech po chemoterapii nádorových onemocnění, resp. po transplantaci kostní dřeně. Prakticky bezbranný hostitel je ohrožován jednak generalizovanými bakteriálními a mykotickými infekcemi, jednak intersticiálními pneumoniemi. V etiologii generalizovaných infekcí se u febrilní neutropenie uplatňují především zlaté stafylokoky, pneumokoky, enterobakterie, pseudomonády, kvasinky a plísně. Plicní komplikace u těchto nemocných vyvolávají v prvních dnech asi 2krát častěji grampozitivní koky než gramnegativní bakterie. Později podíl grampozitivních koků klesá a vzrůstá podíl mykotických mikroorganizmů, především Candida albicans a Aspergillus fumigatus. V posledních letech se objevují nejen další druhy kandid (např. Candida crusei, Candida dubliniensis aj) a aspergilů (Aspergillus niger, Aspergillus flavus, Aspergillus terreus), ale i příslušníci řady dalších rodů mikromycet. Celkem vzácné jsou u neutropenických nemocných plicní infekce legionelové, mykobakteriové a pneumocystové. Po alogenní transplantaci krvetvorných buněk se může vyskytnout i intersticiální zánět plic vyvolaný cytomegalovirem (CMV). Dalším virem, který může poměrně často vyvolat u těchto nemocných postižení dýchacích orgánů, je virus herpes simplex (HSV) [4].
V době, kdy nebyla ještě k dispozici účinná retrovirová léčba, byly pneumonie vyvolané oportunními infekcemi mnohem častější než nyní u osob nakažených HIV. Často to byla právě pneumonie, která upozornila na to, že nemocný má toto onemocnění [5].
Typické pro nemocné ve stadiu rozvinutého AIDS jsou pneumocystóza a mykobakterióza. Infekce Pneumocystis jiroveci představuje v současné době díky možnosti účinné chemoprofylaxe jen asi čtvrtinu všech případů respiračních infekcí. U 50 % pacientů s pokročilým AIDS a počtem CD4+ T buněk < 100/μl se rozvíjí infekce vyvolaná komplexem Mycobacterium avium-Mycobacterium intracellulare. U jedinců ve stadiu rozvinutého AIDS jsou rovněž časté pneumonie vyvolané běžnými bakteriemi. S jejich častým výskytem se setkáváme u HIV infikovaných intravenózních narkomanů. Spektrum bakteriálních původců je obdobné jako u osob HIV neinfikovaných: zpočátku opakované infekce vyvolané Streptococcus pneumoniae a Haemophilus influenzae, u pokročilejšího AIDS Staphylococcus aureus a gramnegativními tyčinkami. Těžký průběh ve stadiu rozvinutého AIDS mají pneumonie pseudomonádové. Infekce Mycobacterium tuberculosis může představovat reaktivaci latentního procesu, rychlou progresi primární infekce nebo exogenní reinfekci. Plicní tuberkulóza u osob HIV pozitivních může probíhat atypicky, zejména v pozdních stadiích jsou častá postižení dalších orgánů. K dalším původcům plicních zánětů u AIDS patří především CMV, ale i Virus herpes simplex, Candida albicans a Cryptococcus neoformans, Nocardia asteroides, Aspergillus fumigatus a jiná, i méně obvyklá agens (např. Rhodococcus equi aj.) [5].
Veškeré patogeny, které mohou vyvolat zánět plic u normálního jedince, mohou postihnout též imunokompromitovaného hostitele, a to s daleko závažnějším průběhem a následky. Dále je třeba mít na zřeteli, že u těchto jedinců může mít plicní postižení smíšenou etiologii a někdy se můžeme setkat i s kombinací postižení infekčního a neinfekčního [6].
Mezi neinfekční příčiny plicního postižení patří nejčastěji postižení vlastním nádorovým procesem (solidními nádory, leukemiemi, lymfomy, myelomem), amyloidózou, plicní hemoragií, léky a léčebnými zákroky: lékové postižení, postižení radioterapií, transfuzemi (TRALI – transfusion-related acute lung injury), případně kyslíkem, dále plicním edémem (kardiálním, ARDS), plicní embolizací a dalšími – viz též kapitola Diferenciální diagnostika pneumonií [6].
Diagnostika
Diagnostika pneumonie je opřena o anamnézu, fyzikální a RTG nález, o výsledky mikrobiologického vyšetření vzorků z respiračního traktu, hemokultury, vyšetření pleurálního výpotku, sérologického vyšetření, potřebné je i vyšetření moči (např. průkaz antigenu Legionella pneumophila typ I), hematologické a biochemické vyšetření [2].
V anamnéze jsou podstatné informace o dalších plicních onemocněních, vrozených nebo získaných a samozřejmě údaje o onemocněních, která mohou být příčinou imunoideficitu. Svůj význam v diagnostice pneumonií u imunokompromitovaných mají i základní laboratorní nálezy a jejich interpretace. Počet leukocytů může být normální nebo zvýšený s posunem doleva. U neutropenických nemocných se setkáváme naopak s nápadným snížením. Na bakteriální infekci pomýšlíme při leukocytóze ≥ 15 × 109/l. Na těžkou infekci upozorňuje počet leukocytů > 30 × 109/l nebo < než 4 × 109/l. Pozornost věnujeme nemocným s poklesem neutrofilů < 1 × 109/l, s poklesem lymfocytů < 1 × 109/l a s poklesem CD4+ lymfocytů < 1 × 109/l. Důležité je i vyšetření koagulace (INR, TT, APTT a fibrinogen). Pokles trombocytů pod 80 × 109/l je jednou z indikací hospitalizace na lůžku intenzivní medicíny. Zvýšené hodnoty jaterních enzymů bývají častým nálezem u rozsáhlých pneumonií s těžkým průběhem i u jedinců bez předchozího postižení jater [2].
Pokud pneumonie vedla k dehydrataci, setkáváme se se zvýšením hodnot urey a u velmi těžkých stavů může dojít k rozvratu vnitřního prostředí. Zvýšenou pozornost je zapotřebí věnovat nemocným se vzestupem urey > 11 mmol/l, vzestup > 20,0 mmol/l je jednou z indikací k přijetí na lůžko intenzivní medicíny, nemocným se vzestupem sodíku > 150 mmol/l a poklesem < 130 mmol/l, se vzestupem glykemie > 14 mmol/l [2].
Důležitá pro určení závažnosti pneumonie a při sledování vývoje onemocnění je hodnota C-reaktivního proteinu (CRP), která bývá u nemocných s těžkou pneumonií obvykle mnohonásobně zvýšena. Pro hodnocení závažnosti stavu se doporučuje sledovat hodnoty prokalcitoninu, jehož zvýšení předchází vzestupu CRP [2,7].
Velmi důležité je u nemocných s pneumoniemi vyšetření krevních plynů a acidobazické rovnováhy, protože se jedná o jedno z vyšetření, na jehož základě rozhodujeme o hospitalizaci na lůžku intenzivní medicíny a o dalších terapeutických postupech. Ke kontinuální oxygenoterapii jsou indikováni nemocní s poklesem parciálního tlaku kyslíku < 8 kPa a k úpravě vnitřního prostředí nemocní s pH nižším < 7,35 [2].
V diagnostice pneumonií jsou podstatné i zobrazovací metody. Zobrazení změn v souvislosti s etiologií plicního zánětu je málo specifické. Současně probíhající jiná onemocnění než plicní projevující se změnami v plicním obraze mohou modifikovat již tak málo patognomické obrazy zánětlivých procesů plic. Nález na zadopředním skiagramu hrudníku má zásadní význam pro potvrzení diagnózy. Pomáhá rovněž rozlišit komplikace pneumonie (rozpady, pleurální výpotek). Umožňuje vyslovit podezření na onemocnění, která se mohou projevovat klinicky podobně (tuberkulóza, intersticiální plicní fibróza, exogenní alergická alveolitida, bronchogenní karcinom, plicní embolizace a další [8,9].
Při interpretaci musíme pečlivě rozlišovat, zda bylo vyšetření provedeno vleže na lůžku nebo vestoje na rentgenovém pracovišti. Na zadopředním skiagramu hrudníku vleže jsou srdce a mediastinum zobrazeny přibližně o 15 % širší, než by tomu bylo na snímku vestoje. Pozornosti může na snímku vleže uniknout pleurální výpotek, hůře se zobrazují cévní struktury, patologické nálezy v kostofrenických úhlech [8,9].
Indikací CT vyšetření může být pátrání po rozpadovém procesu, po ohraničených výpotcích, případně ohraničeném pneumotoraxu či bulách, posuzování rozsahu nevzdušnosti plic, odlišení infiltrace parenchymu od pleurálního výpotku, podezření na disekující aneuryzma aorty, nejasné rozšíření mediastina nebo zvětšení hilových uzlin [8,9].
Provedení HRCT je indikováno u imunokompromitovaných nemocných s nepřesvědčivým nálezem na zadopředním skiagramu hrudníku [8,9].
Ultrasonografické (USG) vyšetření je dostupné, levné a neohrožující pacienta radiační zátěží. Pomocí USG lze diagnostikovat poměrně snadno tekutinu v pohrudniční dutině, která doprovází často bronchopneumonii. Její výhodou je i snadná opakovatelnost bez radiační zátěže [9].
Odběry materiálu na mikrobiologické vyšetření
Při podezření na infekční i neinfekční plicní postižení imunokompromitovaného pacienta a při rozhodování o biologickém materiálu, který budeme odebírat a vyšetřovat, musíme nemocného vždy pečlivě vyšetřit. Velmi důležitá je anamnéza, při které se zaměřujeme na možnost infekčního i neinfekčního plicního postižení. Nezbytná je rovněž veškerá dokumentace o předchozí léčbě. Až na základě nelepšícího se klinického stavu a nedostatečné reakce na empirickou a preemptivní léčbu nebo léčbu na základě výsledků dosud provedených vyšetření (sputa, hemokultur, moči) indikujeme invazivní vyšetření (fibrobronchoskopii s bronchoalveolární laváží, transbronchiální plicní biopsii, transparietální plicní biopsii, případně otevřenou plicní biopsii) [2,6].
Vyšetření sputa je nejčastěji používaným vyšetřením k určení etiologického agens pneumonie. Problémem je kvalita jeho odběru, rychlost transportu do laboratoře a kvalita vyšetření. Význam má nejen kultivační, ale i mikroskopické vyšetření sputa. Nález grampozitivních protáhlých diplokoků při mikroskopickém vyšetření může svědčit pro infekci Streptococcus pneumoniae. Význam má i nález leukocytů ve sputu při mikroskopickém vyšetření. Kultivační vyšetření sputa slouží nejen ke stanovení etiologického agens, ale i ke stanovení citlivosti izolovaného agens k antimikrobiální léčbě. Je potřebné určovat i koncentraci bakterií. Za signifikantní je považována koncentrace ≥ 105 CFU v 1 ml sputa (1 CFU – colony forming unit čili kolonii tvořící jednotka odpovídá přibližně 1 živé mikrobiální buňce). Podle současných studií se však nepodaří ve sputu prokázat etiologické agens u 50 % nemocných s pneumonií a v rutinní praxi je uváděno dokonce jen 25 % pneumonií, u kterých se podařilo prokázat etiologii. Problém spočívá v rychlosti transportu sputa po jeho odebrání do laboratoře. Pokud není sputum zpracováno do 4 hod po odběru, ztrácí jeho vyšetření význam. Dalším problémem je to, že některá agens jsou nezachytitelná při běžné kultivaci a vyžadují kultivaci na zvláštních půdách (Legionella pneumophila), nebo izolaci na tkáňových kulturách (cytomegalovirus) [2,6].
Vyšetření sputa má jen omezenou hodnotu, protože mnoho nemocných není schopno vykašlat a mikrobiologický nález ve sputu nemusí vypovídat o situaci v dolních dýchacích cestách a v plicním parenchymu. Diagnostickou cenu má jedině nález mikroorganizmů, které se za žádných okolností nevyskytují jako organizmy kolonizující dutinu ústní – např. Legionella, Mycobacterium tuberculosis a Pneumocystis jiroveci. Naproti tomu nález běžných bakteriálních patogenů a kvasinek je pro etiologickou diagnostiku plicního postižení téměř bezcenný, neboť tyto mikroorganizmy mohou běžně sídlit v dutině ústní i ve velkých dýchacích cestách. Podezření by mohl vyvolat nález aspergilů [2,6].
Materiál z dolních dýchacích cest lze bez bronchoskopické kontroly získat rovněž endotracheálním odsátím (velmi často používaná odběrová metoda u intubovaných nebo tracheostomovaných pacientů) a případně transtracheální punkcí u neintubovaných nemocných, kterou však nelze provádět u nespolupracujícího, hypoxického pacienta, při úporném kašli a při riziku krvácení (koagulopatie, léčba antikoagulancii) [9].
U hospitalizovaných nemocných s teplotou a třesavkou je nezbytné odebrat krev na hemokulturu 2krát před zahájením antibiotické léčby a opakovaně v průběhu antibiotické léčby, pokud tato léčba selhává. Centrální ani periferní žilní katétry či kanyly nemají být k odběru hemokultur používány. Vždy je nutné provést odběr jednorázovou punkcí periferní žíly [9].
V diagnostice pneumonií lze využít i vyšetření pleurálního výpotku (cytologického, biochemického, kultivačního na nespecifickou bakteriální flóru i na mykobakterie). Ve výpotku můžeme detekovat i antigeny Streptococcus pneumoniae [2].
V moči lze prokazovat antigeny Streptococcus pneumoniae a Legionella pneumophila [9].
V současné době jsou často využívány bronchoskopické techniky odběru, které omezují možnost kontaminace bakteriální flórou přítomnou v horních partiích dýchacích cest. Jedná se o vyšetření, která mají za určitých podmínek vysokou senzitivitu i specificitu. Jelikož se jedná o invazivní techniku, spojenou s možností iatrogenního poškození pacienta, je nutno vždy vážit přínos a rizika.
Mikrobiologické vyšetření bronchoskopicky odebraného materiálu je zaměřeno na určení bakterií (včetně legionel a mykobakterií), virů, houbových mikroorganizmů (včetně Pneumocystis jiroveci) a parazitů.
Při podezření na infekční postižení průduškového stromu se provádějí odběry biologického materiálu především flexibilním bronchoskopem [10].
Pokud chceme vyloučit kontaminaci mikroorganizmy, které jsou i za normálních podmínek v dýchacích cestách, můžeme provést odběr speciálním chráněným kartáčkem (protected specimen brush – PSB). Chráněný kartáček je uložený ve speciálním dvojobalu a vysunut z flexibilního bronchoskopu až v distálních partiích bronchiálního stromu, kde je odběr proveden pod kontrolou zraku. Kartáček je odeslán na mikrobiologické vyšetření ve zkumavce se známým množstvím tekutiny. Tím je umožněno spolehlivé kvantitativní hodnocení při dodržení správné techniky odběru a dopravy vzorku do laboratoře a jeho zpracování. Za hraniční je považována koncentrace bakterií > 103 cfu/ml. Senzitivita se pohybuje mezi 56 % a 100 % a specifita mezi 86 % a 100 %. K podobným úsporám vede i správná interpretace bronchoalveolární laváže [10,11].
Chráněný distální odběr katétrem (combicath) – jedná se o chráněný tenký katétr sterilně zaváděný pod kontrolou zraku do míst předpokládaného maximálního postižení plíce. Materiál je nasát do katétru a ten je po vyjmutí a odstřižení distální části propláchnut 1 ml fyziologického roztoku. Technika je uváděna jako levnější alternativa PSB s podobnými výsledky i výhradami. Katétr je použitelný i pro odběry naslepo [10,11].
Jako transbronchiální plicní biopsie je označován odběr bioptickými klíšťkami z periferie bronchiálního stromu. V našich podmínkách se provádí pod RTG kontrolou, nejlépe pod kontrolou C ramenem, z místa největšího postižení. Vzhledem k tomu, že ne v každém odběru musí být zachycen reprezentativní vzorek, doporučuje se odběrů několik, nejlépe 7–10. Získaný materiál se odesílá především k histologickému vyšetření. Při podezření na infekční postižení plic může být materiál získaný transbronchiální plicní biopsií vyšetřen i mikrobiologicky [10,11].
Transbronchiální punkcí se myslí punkce tenkou jehlou přes bronchiální stěnu. Získaný materiál je vyšetřován především cytologicky, v indikovaných případech jej lze vyšetřit mikrobiologicky [10].
Bronchiálním výplachem rozumíme instilaci 10–20 ml fyziologického roztoku do určité části bronchiálního stromu a jeho zpětnou aspiraci. Fyziologický roztok se vstřikuje kanálem flexibilního bronchoskopu. Jeho zpětná aspirace se provádí buď stříkačkou přes spojovací hadičku vzduchotěsně nasazenou na vstup do kanálu bronchoskopu, nebo pomocí odsávačky do sterilní zkumavky připojené na hlavici flexibilního bronchoskopu. Získanou tekutinu můžeme použít k cytologickému i mikrobiologickému vyšetření. Při hodnocení významu výsledků vyšetření materiálu získaného bronchiálním výplachem si musíme být vědomi toho, že bronchiálním výplachem jsme získali materiál, jehož vyšetření nepodává přesné informace o povaze patologického procesu v plicním parenchymu [6].
Bronchoalveolární laváž (BAL) je metoda, která má pro stanovení etiologie u nemocných s pneumoniemi nereagujícími na zavedenou antimikrobiální léčbu zásadní význam. Je důležitá i v diferenciální diagnostice infekčního a neinfekčního patologického procesu v plicním parenchymu. BAL s následným vyšetřením bronchoalveolární tekutiny (BALT) je cenná vyšetřovací metoda nejen pro stanovení etiologie pneumonií, ale i celé řady jiných plicních onemocnění. Na základě včas provedené BAL a na základě komplexního vyšetření bronchoalveolární tekutiny (BAT) lze v mnoha případech zahájit správnou léčbu [6,12,13].
Jako všeobecné indikace k provedení BAL jsou uváděny intersticiální nebo difuzní plicní procesy (jejich diagnostika, monitorování průběhu a léčby), zánětlivé postižení plic, periferní plicní léze nejasné etiologie. Zvláštní indikaci představuje podezření na plicní postižení u imunokompromitovaných nemocných a u nemocných s nozokomiálními pneumoniemi, včetně pneumonie ventilátorové, vzhledem k tomu, že stanovení etiologie plicního postižení a zahájení správné léčby má pro záchranu života nemocného zásadní význam. U této skupiny nemocných jsou provedení BAL a vyšetření BALT indikovány, pokud jsou přítomny teplota, dušnost, kašel, bolest na hrudníku, patologický poslechový nález na hrudníku, patologický nález na skiagramu hrudníku nebo HRCT, příznaky neustupují při zavedené antimikrobiální či jiné léčbě, na základě provedených vyšetření není známa etiologie výše uvedených příznaků. Za kontraindikace provedení BAL jsou u těchto nemocných považovány: stav, v němž je jasné, že stanovení etiologie a zahájení správné léčby nepovede k oddálení úmrtí, krvácivé projevy nezvládnutelné odpovídající léčbou (těžké krvácení z nosu, hematemeza, krvácení ze střev, masivní hemoptoe), počet trombocytů a hodnoty hemokoagulačních vyšetření nejsou při rozhodování o provedení BAL rozhodující, čerstvý infarkt myokardu, závažné nebo čerstvě vzniklé poruchy srdečního rytmu, přes inhalaci kyslíku přetrvávající těžká hypoxemie < 6 kPa [6,13].
BAL provádíme z té oblasti bronchiálního stromu, která ventiluje nejvíce postiženou oblast plic. Řídíme se nálezem na zadopředním a bočném skiagramu hrudníku, v některých případech i nálezem na HRCT. Fibrobronchoskop se zavádí co nejdistálněji, tedy do segmentálního nebo subsegmentálního bronchu tak, aby byl vzduchotěsně zaklíněn o stěny bronchu a opticky bylo patrno další bronchiální větvení. K BAL se používá fyziologický roztok (FR) ohřátý na 37 °C. Chladnější i teplejší roztok dráždí bronchiální sliznici, což komplikuje průběh BAL. Množství FR se řídí především návratností a počtem požadovaných vyšetření BAT. Abychom mohli mluvit opravdu o BAL, musí být její celkový objem nejméně 150 ml. Pokud požadujeme pouze vyšetření diferenciálního rozpočtu, které by mělo být při podezření na infekční postižení plic provedeno vždy, stačí při návratnosti > 50 % 150 ml [6].
Důležitá je i mikrobiologická diagnostika pneumonií u imunokompromitovaných nemocných. K metodám přímého průkazu patří zejména klasické postupy, totiž mikroskopie a kultivace. Nedílnou součástí kultivace je bližší určení neboli identifikace vypěstovaného mikroba a stanovení jeho citlivosti na antibiotika. Postupně se uplatňují i další metody, zejména nové rychlé nekultivační postupy, jako jsou průkaz antigenů, průkaz nukleových kyselin a průkaz jiných typických chemických složek mikroba přímo ve vyšetřovaném vzorku. Z nových rychlých postupů mikrobiologické diagnostiky se ve vyšetření respiračních infekcí uplatnily dvě, a to průkaz mikrobiálních antigenů a průkaz mikrobiální nukleové kyseliny [2].
Při postižení plic se mikrobiální antigeny dají prokázat ve vzorcích z respiračního traktu, v moči (legionelový antigen, pneumokokový antigen) a v krvi a také BALT.
Aspergilový antigen galaktomannan (GM) je lipopolysacharid buněčné stěny hub, který je uvolňován do okolí během růstu houby. Množství uvolněného GM je závislé na velikosti mykotické nálože a na imunitním stavu hostitele. Pro detekci aspergilového antigenu galaktomannanu lze využít sérum a BALT [15,16].
Falešná pozitivita GM je nejčastěji nalézána při podávání betalaktamových antibiotik a při podání infuzních roztoků s obsahem glukonátu sodného, z nichž je nejvýznamnější PlasmaLyte. Panfungální antigen – β-D-glukanu (BDG) – je polysacharid buněčné stěny mnoha druhů mikromycet a je uvolňován do okolí v počátečních fázích růstu houby [16]. S malými výjimkami (Mucorales a Cryptococcus spp.) může být BDG detekován u většiny oportunních hub (Candida spp., Trichosporon spp., Aspergillus spp., Fusarium spp., Acremonium spp. Pneumocystis jiroveci a dalších), proto hovoříme o tzv. panfungálním antigenu. Jeho přítomnost v séru pacientů signalizuje blíže neurčenou mykotickou infekci, kterou je následně nutné specifikovat použitím dalších testů [16].
Úseky nukleové kyseliny specifické pro příslušného mikroba lze v klinickém materiálu prokazovat buď hybridizací s genetickou sondou, nebo po jejich předchozím zmnožení (amplifikaci). Obecně jsou tyto molekulárně diagnostické techniky vhodné pro průkaz agens, která nelze pěstovat in vitro, nebo jejichž kultivace je málo citlivá nebo příliš složitá a zdlouhavá. V diagnostice respiračních infekcí se uplatňují většinou jen amplifikační postupy, a to polymerázová řetězová reakce (PCR). V případě imunokompromitovaných pacientů je nález cytomegalovirové DNA v krevních leukocytech natolik citlivější než průkaz antigenu, že praktické využití má jen negativní výsledek PCR k vyloučení aktivní plicní infekce. U legionelóz by mohlo být výhodou PCR, že je rodově specifická (na rozdíl od průkazu antigenu, jenž je nejen druhově, ale i typově specifický, to znamená, že příslušné reagens zachytí např. jen antigeny Legionella pneumophila sérotyp 1). V případě infekcí Chlamydia pneumoniae prodělává v současnosti metodika PCR určitý rozvoj, ale výsledky zatím nejsou plně uspokojivé. Poměrně dobře se PCR uplatnila v diagnostice infekcí vyvolaných Mycoplasma pneumoniae. V případě Mycobacterium tuberculosis amplifikační techniky v žádném případě nemohou nahradit kultivační postupy, ale přesto jsou využívány především v případě nejednoznačné diagnózy. Molekulárně diagnostické postupy zatím klasickou kultivační diagnostiku nenahradily, ale využívají se v diagnostice hub, včetně Pneumocystis jiroveci [2].
Nepřímý průkaz infekce je obvykle založen na průkazu protilátek, resp. na stanovení změn jejich titru. Protože se k nepřímému průkazu obvykle vyšetřuje sérum pacienta, často se hovoří o průkazu sérologickém. Nevýhodou nepřímého průkazu je, že pouhý nález protilátek obvykle k diagnóze nestačí. K diagnóze čerstvé infekce je třeba prokázat signifikantní pohyb hladiny protilátek, většinou tedy 4násobný vzestup titru, což předpokládá vyšetřit 2 vzorky krve odebrané v intervalu nejméně 10 dnů. To ovšem praktický význam sérologického průkazu infekce poněkud snižuje [2].
V laboratorní diagnostice pneumonií si nepřímý průkaz uchovává význam v případě infekcí vyvolaných viry, mykoplazmaty a chlamydiemi. O sérologii je třeba se pokusit v případě podezření na pneumonie vyvolané viry chřipky a parainfluenzy, respiračním syncyciálním virem a adenoviry. Před transplantacemi je třeba vyšetřit stav imunity pacienta např. proti herpesvirům, zejména vůči cytomegaloviru.
Na sérologickém vyšetření je zatím postavena diagnostika většiny „atypických agens“.
Léčba
Antibiotická léčba
Současný přístup k antibiotické léčbě závažných infekcí u kriticky nemocných se snaží co nejvíce omezovat polypragmatickou empirickou terapii a nahrazuje ji neodkladnou terapií úvodní, která vychází z kvalifikovaného zhodnocení některých epidemiologických, klinických a diagnostických kritérií. Je zahajována zásadně po zajištění klinicky relevantních vzorků na mikrobiologické vyšetření. Na základě jeho kvalifikovaně interpretovaných výsledků je úvodní léčba s širším antimikrobiálním spektrem neprodleně měněna na léčbu cílenou, jejíž spektrum je zúženo na prokázaného původce infekce. Tato strategie nezbytně vyžaduje úzkou rutinní spolupráci mezi klinikem a zkušeným klinickým mikrobiologem [16].
Léčba pneumonie u imunokompromitovaných nemocných vyžaduje vždy dávkování na horní hranici možného rozmezí, což v praxi znamená dávky několikrát vyšší, než se doporučuje pro léčbu běžných, nekomplikovaných infekcí. Je třeba si uvědomit, že biologická dostupnost antibiotik v plicním parenchymu může být u kriticky nemocného omezena řadou komplikujících faktorů souvisejících s různorodým poškozením plic. Ty ovlivňují hlavně perfuzi plíce krví obsahující účinnou koncentraci antibiotika. Ve špatně perfundovaných oblastech plicní tkáně zasažených současně infekcí je dosažení optimálního antimikrobiálního účinku problematické a pouze použití vysokých dávek antibiotika zvyšuje naději na úspěch. Délka léčby je u těžkých infekcí individuální a nelze nikdy stanovit univerzálně platný postup. Doporučená délka podávání je vždy pouze orientační a v konkrétních případech se řídí individuálním vývojem klinického stavu nemocného. Současný trend spíše preferuje razantní léčbu vyššími dávkami antibiotik po kratší dobu. Konkrétní délka léčby závisí pochopitelně na závažnosti a průběhu onemocnění, včetně výskytu komplikací [17].
Léčba pneumonie způsobené houbovými mikroorganizmy
U imunokompromitovaných nemocných se nejčastěji jako etiologická agens infekčních houbových plicních komplikací uplatňují mikroorganizmy Candida a Aspergillus, méně často Mucorraceae, Cryptococcus, případně další. Z HIV negativních imunokompromitovaných nemocných jsou mykotickými infekcemi nejvíce ohroženy osoby s nádorovými chorobami. V důsledku intenzivní chemoterapie, ale i dlouhodobého podávání širokospektrých antibiotik stoupá výskyt těžkých mykotických infekcí [15–18].
Léčba spočívá v podávání antimykotik, která jsou rozdělena podle léčebného dosahu na lokální a systémová a podle struktury na polyenová antibiotika a azolové deriváty [15–18].
Amfotericin B je polyenové antimykotikum s nejširším spektrem účinku. Jeho aplikace je však často provázena projevy nesnášenlivosti, jako jsou horečka, třesavka, bolesti kloubů, svalů a hlavy, nevolnost a zvracení. Intenzitu těchto nežádoucích účinků lze redukovat nesteroidními antirevmatiky a kortikosteroidy. Nejzávažnějším projevem orgánového postižení může být nefrotoxicita. Té se dá předejít důsledným sledováním sérových koncentrací iontů a jejich močových odpadů a plným hrazením ztrát. Amfotericin B je lékem volby u aspergilóz a mukormykóz, kryptokokózy i těžkých kandidóz. Jednoznačnou indikací k podání amfotericinu B je prokázaná aspergilová infekce. Dále je podání amfotericinu B indikováno při podezření na plísňové postižení plic. Jeho užití klesá s příchodem vorikonazolu [15–18].
5-fluorocystein, 5-FC, flucytosin, je systémové antimykotikum s úzkým spektrem účinku (kandidy). Při monoterapii vzniká velmi časně rezistence, a proto je podáván výhradně v kombinaci s amfotericinem B nebo triazoly. Indikací k jeho podání v kombinaci jsou těžké orgánové mykózy, včetně pneumonie [15–18].
Mezi azolová antimykotika patří starší imidazolové deriváty (mikonazol, ketokonazol), nové triazoly (flukonazol, itrakonazol) a skupina zcela nových triazolů (vorikonazol, ravukonazol, prosakonazol), které mají výhodu v tom, že vykazují účinnost i u některých flukonazol rezistentních kmenů kandid a aspergilů. Flukonazol je vysoce účinné antimykotikum. Jeho indikační spektrum zahrnuje všechny klinické formy kandidózy, včetně pneumonie, s výjimkou kandidových infekcí způsobených Candida crusei a Candida glabrata. Dále je účinný u kryptokokózy. Není vhodný k léčbě aspergilových infekcí a mukormykózy.
Itrakonazol má podobné spektrum účinnosti jako flukonazol a je navíc účinný proti flukonazol rezistentním kmenům kandid a aspergilům [15–18].
Ketokonazol se v léčbě mykotického postižení plic u nemocných na lůžku intenzivní medicíny nepoužívá. Jeho místo je především v profylaxi [15–18].
Z nově zaváděných antimykotik je nejvíce zkušeností s kaspofunginem. Jde o přípravek ze skupiny echokandinů. Mechanizmus jeho účinku není cílen na steroly, jak je tomu u jiných antimykotik, ale na jiné struktury buněčné membrány hub. Blokuje syntézu β-(1,3)-D-glukanu, který má klíčový význam pro udržení integrity buněčné stěny. Má velmi široké spektrum účinku zahrnující kandidy i aspergily. Dalšími skupinami léků jsou sordariny, které inhibují syntézu proteinů, nikomyciny, které působí jako selektivní inhibitory chitinu ve stěně hub, a paradimiciny a benanomyciny, působící disrupci buněčné membrány [15–18].
Léčba pneumonie způsobené Pneumocystis jiroveci (carinii)
V léčbě pneumonie vyvolané zvláštním druhem houby Pneumocystis jiroveci je stále na prvním místě kotrimoxazol (kombinace trimetoprimu se sulfametoxazolem v poměru 1 : 5). Léčebná dávka je 15–20 mg/kg/den trimetoprimu a 75–100 mg/kg/den sulfametoxazolu. Při snížené funkci ledvin musí být dávka redukována. Vzhledem k vysoké dávce je vhodné podávat trimetoprim se sulfametoxazolem intravenózně ve 3–4 denních dávkách, nejlépe v 500 ml 5% glukózy [18].
Dalším preparátem v léčbě pneumocystové infekce je pentamidin. Podává se obvykle v dávce 4 mg/kg/den 1krát denně v roztoku 5% glukózy po dobu 60–90 min. Použít lze také dapson, což je chemoterapeutikum užívané především v léčbě lepry. Zpravidla se podává v kombinaci s trimetoprimem. Dalšími léky, které mohou být použity, jsou autovaquon a kombinace klindamycinu a primaquinu. Účinný v léčbě pneumonie vyvolané Pneumocystis jiroveci je i kaspofungin a při intoleranci kotrimoxazolu lze použít i trimetrexat.
Léčba toxoplazmové pneumonie
U toxoplazmózy je indikován pyrimetamin, spiramycin a sulfadiazin nebo vzájemné kombinace těchto léků [18].
Léčba zánětů plic způsobených viry
V léčbě zánětů plic vyvolaných viry užíváme virostatika. Aciklovir je účinný zvláště u infekcí vyvolaných herpetickými viry. Proti cytomegaloviru je účinný až ve vysokých dávkách. Podává se v dávce 250 mg/m2 každých 8 hod v infuzi fyziologického roztoku po dobu 5–7 dní. Vylučuje se převážně ledvinami, proto je potřeba při poruše renálních funkcí snižovat jeho dávku. Podobné vlastnosti má valaciklovir (5 mg/kg p.o. po dobu 5 dnů), což je perorální analog acikloviru. Především v léčbě herpetických infekcí jsou účinné preparáty penciklovir (5 mg/kg 2–3krát denně v i.v. infuzi po dobu 5–7 dní) a famciklovir (500 mg 3krát denně p.o.) [18].
Ganciklovir je účinný i u cytomegalovirové infekce. Podává se intravenózně 2,5–5 mg/kg i.v. po 8–12 hod v infuzi fyziologického roztoku nebo 5% glukózy po dobu alespoň 2 hod. Při snížení renálních funkcí je nutná jeho redukce. Uplatnění dalšího preparátu foskaviru (60 mg/kg 3krát denně) je především u nemocných s leukopenií a s výskytem ganciklovir rezistentních CMV kmenů. Pro léčbu cytomegalovirové infekce je možno použít i cidovir (1 mg/kg 3krát týdně) a valganciklovir (900 mg/kg/den p.o.) [18].
Největším terapeutickým problémem je léčba rozvinutých a pokročilých cytomegalovirových infekcí. Aby se předešlo těžkým cytomegalovirovým infekcím, jsou pacienti ohrožení touto infekcí, což jsou především pacienti po alogenní transplantaci krvetvorných buněk, pravidelně sledováni po dobu prvních 3–4 měsíců [18].
Různá pracoviště postupují různě. Obvykle jsou vyšetřovány moč, výtěry z hrdla a krev. Za nejužitečnější je považováno sledování antigenemie. Zpravidla se provádí 1krát týdně a při pozitivním výsledku se zahajuje léčba ganciklovirem, která trvá obvykle 3 týdny. Tato časná léčba má zabránit dalšímu šíření infekce [18].
Dalším užitečným vyšetřením je provedení bronchoalveolární laváže u séropozitivních nemocných 35. den po transplantaci. Pokud se v bronchoalveolární tekutině prokáže CMV, je po dobu 14 dní podáván denně ganciklovir v dávce 5 mg/kg po 12 hod intravenózně, a to i těm nemocným, kteří jsou bez známek pneumonie. V léčbě se pokračuje 1krát denně po dobu 5 dní v týdnu do 120. dne po transplantaci.
Komplikovanější je léčba rozvinuté cytomegalovirové pneumonie. Samotná léčba ganciklovirem nestačí. Ukázalo se, že úspěch má až kombinace gancikloviru s vysokými dávkami polyvalentních imunoglobulinů. V případě rezistentních cytomegalovirových infekcí lze zkusit léčbu foskavirem, ale také s podáním polyvalentních imunoglobulinů. V případě séronegativního příjemce i séronegativního dárce je zásadním přínosem podávání buněčných krevních derivátů séronegativních dárců. V jiném případě nemá význam. Pokud nelze zajistit séronegativní dárce buněčných krevních derivátů, je možno podávat deleukotizované krevní deriváty. Deleukotizace snižuje množství leukocytů, a tedy i zdrojů CMV natolik, že dochází ke zmírnění infekce. Důležité je vědět, že čerstvá zmražená plazma nemůže být zdrojem CMV, a to ani tehdy pochází-li od CMV pozitivního dárce [18].
Shrnutí zásad antimikrobiální léčby pneumonií
Léčba pneumonií u imunokompromitovaných nemocných je obvykle vysoce specializovaná, měla by být poskytována na odděleních, která se zabývají základním onemocněním, které k imunosupresi vedlo, nebo na lůžkách intenzivní medicíny pneumologických oddělení. Úspěšná antimikrobiální léčba u imunokompromitovaných není možná bez spolupráce s mikrobiology, kteří se touto problematikou zabývají. Počáteční léčba je obvykle empirická, cílená na aerobní bakterie. Znamená to podávání kombinace aminoglykosidu a aminopenicilinu s inhibitorem betalaktamázy nebo cefalosporinu 2. a 3. generace. Pokud nedochází při antibiotické léčbě během 48–72 hod ke zlepšení, je indikováno přidání antimykotik. Makrolidy se do léčby zařazují dle lokální prevalence legionely. V případě pneumonie vyvolané Pneumocystis jiroveci je indikováno podání vysokých dávek kotrimoxazolu, často provázené vedlejšími účinky (zarudnutí, zažívací potíže), proto je doporučováno zahájení této léčby až po průkazu Pneumocystis carinii, obvykle v bronchoalveolární tekutině. Pokud stav nemocného nedovoluje bronchoskopické vyšetření s provedením bronchoalveolární laváže, je na místě protipneumocystová léčba, selhává-li léčba antibiotická s antimykotickou.
Léčba febrilní neutropenie
Mezi HIV negativními imunokompromitovanými nemocnými jsou nejvíce ohroženi infekčními komplikacemi nemocní s leukopenií, resp. granulocytopenií, která vzniká nejčastěji jako následek chemoterapie nebo radioterapie. Nejvyšší riziko je u nemocných s koncentrací granulocytů ≤ 0,1 × 109/l. Jako febrilní neutropenie je označován stav, kdy u nemocného s počtem neutrofilních granulocytů < 0,5 × 109/l naměříme 2krát v průběhu 12 hod tělesnou teplotu vyšší než 38 °C [4].
U febrilní neutropenie je od počátku indikována kombinovaná antibiotická léčba. Volba antibiotik a dalších antimikrobiálních léků se řídí stupněm rizika. Nízkému riziku je vystaven nemocný bez přítomnosti známek sepse s neutropenií < 0,1 × 109/l, která trvá méně než 7 dnů a předpokládá se, že nebude trvat déle než 10 dnů. Vysokému riziku je vystaven klinicky nestabilní nemocný (hypotenze, tachykardie) s teplotami > 39 °C a s neutropenií < 0,1 × 109/l, u kterého se předpokládá doba trvání neutropenie déle než 10 dnů [4].
V případě febrilní neutropenie u nemocného s nízkým rizikem je doporučován potencovaný aminopenicilin v kombinaci s gentamicinem nebo ciprofloxacin [4].
V případě febrilní neutropenie u nemocného s vysokým rizikem je doporučován cefalosporin 4. generace, cefoperazon/sulbaktam nebo piperacilin/tazobaktam (případně karbapenem) s amikacinem (event. aztreonamem). Karbapenemy (meropenem, imipenem) je doporučováno ponechat jako rezervu pro ESBL pozitivní klebsiely (ESBL – extended-spectrum b-lactamases/širokospektré b-laktamázy). Podání ceftazidimu je indikováno, pokud je podezření na infekci Pseudomonas aeruginosa. Nezjistí-li se u nemocného s vysokým rizikem po 72 hod etiologické agens a teploty > 38 °C trvají, je doporučováno přidání vankomycinu. Alternativou vankomycinu je teikoplanin [4].
Pokud trvají teploty, neutropenie přetrvává a neznáme infekční agens, doporučuje se přidat po 96 hod antimykotika (amfotericin B, vorikonazol). Pokud ani po přidání antimykotik nedochází ke zlepšení, je nutné pomýšlet na možnou infekci způsobenou Pneumocystis jiroveci nebo Cytomegalovirem. Pokud máme na tuto etiologii podezření, je vhodné zahájit odpovídající léčbu protipneumocystovou a virostatickou (viz výše) a provést vyšetření k průkazu etiologie (především BAL) [4].
Ukončení antibiotické léčby u febrilní neutropenie je doporučováno až nejméně po 5 afebrilních dnech, pokud je počet neutrofilních granulocytů > 0,5 × 109/l [4].
Při léčbě febrilní neutropenie je zapotřebí zohlednit epidemiologickou situaci na konkrétním oddělení a vyhodnotit informace o kolonizaci nemocného a rezistenci bakteriálních kmenů, které jej kolonizují. Velmi úzká spolupráce s mikrobiologem je v případě léčby febrilní neutropenie neodmyslitelná!
Podpůrná léčba pneumonie u imunokompromitovaných
Podávání antimikrobiálních léků musí být vždy doplněno odpovídající léčbou podpůrnou, která zahrnuje podávání mukolytik, antitusik, analgetik (při pleurálním dráždění), antipyretik a bronchodilatancií. Dále je nutná dostatečná hydratace a výživa nemocných. Je zapotřebí dohlížet také na dostatečnou oxygenaci a udržení stability vnitřního prostředí.
Pokud je u nemocného s pneumonií přítomna obstrukční ventilační porucha, je zapotřebí po vyhodnocení anamnézy a rizikových faktorů podání systémových kortikosteroidů [14].
Závěr
Pneumonie u imunokompromitovaných nemocných se vyznačuje odlišným mikrobiologickým spektrem. U této skupiny nemocných se vedle běžných patogenů uplatňují oportunní agens. Zvládnutí zánětu plic u imunokompromitovaných nemocných je často rozhodující pro jejich další osud. Diagnostika a léčba pneumonií u imunokompromitovaných nemocných je obvykle vysoce specializovaná, není možná bez spolupráce s mikrobiology, kteří se touto problematikou zabývají.
prof. MUDr. Jana Skřičková, CSc.
skrickova.jana@fnbrno.cz
Klinika nemocí plicních a TBC LF MU a
FN Brno,
pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 26. 8. 2017
Přijato po recenzi 26. 9. 2017
Zdroje
1. Mayer J, Skřičková J, Vorlíček J. Postižení plic u imunokompromitovaných nemocných. Diferenciální diagnostika a využití bronchoalveolární laváže. IDVPZ: Brno: 1995. ISBN 80–7013–199–3.
2. Votava M, Jindrák V. Mikrobiologická diagnostika pneumonií a její interpretace. In: Ševčík P, Skřičková J, Šrámek V et al. Záněty plic v intenzivní medicíně. Galén: Praha 2004. ISBN 80–7262–278–1.
3. Fishman JA, Rubin RH. Infection in organ-transplant recipients. New Engl J Med 1998; 338(24): 1741–1751.
4. Pohlreich D. Febrilní neutropenie u dospělých pacientů s maligním onemocněním. Postragudální medicína 2010; 12(9): 993–1001.
5. Snopková S, Chalupa P. Postižení plic u infekce HIV/AIDS. In: Ševčík P, Skřičková J, Šrámek Vet al. Záněty plic v intenzivní medicíně. Galén: Praha: 2004. ISBN 80–7262–278–1.
6. Skřičková J, Mayer J, Vorlíček J et al. Využití bronchoalveolární laváže v diagnostice infekčního postižení plic u imunokompromitovaných nemocných. Remedia Klinická mikrobiologie 1999; 3(3): 80–86.
7. Hausfater P, Garric S, Ben Ayed S et al. Usefulness of procalcitonin as a marker of systemic infection in emergency department patients: a prospective study. Clin Infect Dis 2002; 34(7): 895–901.
8. Decramer M, Roussos C. Imaging in lung disease. Eur Respir J Suppl 2002; 35 : 1s-2s.
9. Skřičková J, Votava M, Jindrák V et al. Projevy zánětů plic a jejich vyšetřování. In: Ševčík P, Skřičková J, Šrámek V et al. Záněty plic v intenzivní medicíně. Galén: Praha 2004.
10. Straus J. Pulmonary Endoscopy and Biopsy Techniques. European Respiratory Society Journals: 1998. ISBN 978–1904097105.
11. Dooms C, Seijo L, Gasparini S et al. Diagnostic bronchoskopy: state of the art. Eur Respir Rev 2010; 19 : 117, 229–236. Dostupné z DOI: <http://dx.doi.org/10.1183/09059180.00005710>.
12. Bulpa PA, Dive AM, Mertens L et al. Combined bronchoalveolar lavage and transbronchial lung biopsy: safety and yield in ventilated patients. Eur Respir J 2003; 21(3): 489–494.
13. Tasbakan SM, Gurgun A, Basoglu O et al. Comparison of Bronchoalveolar Lavage and Mini-Bronchoalveolar Lavage in the Diagnosis of Pneumonia in Immunocompromised Patients. Respiration 2011; 81(3): 229–235. Dostupné z DOI: <http://dx.doi.org/10.1159/000323176>.
14. Marik PE. Handbook of Evidence-Based Critical Care. Springer; New York-Berlin - Heidelberg 2001. ISBN 978–0387951539.
15. Kocmanová I. Invazivní mykotické infekce. Onkologie 2014; 8(4): 167–168.
16. Haber J, Vašáková M, Mallátová N et al. Plicní aspergilové syndromy – diagnostika a léčba, doporučené postupy odborných společností. Studia Pneumologica et Phthiseologica 2016; 76(3): 82–106.
17. Dellinger RP, Levy MM, Carlet JM et al. Surviving Sepsis Campaign: International Guidelines or Management of Severe Sepsis and Septic Shock: 2008. Crit Care Med 2008; 36(1): 296–327. Erratum in Crit Care Med 2008; 36(4): 1394–1396.
18. Murray JF, Nadel JA. Textbook of Respiratory Medicine. 6th ed. Saunders: Philadelphia 2015. ISBN 978–1455733835.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Současná náplň pneumologieČlánek Nozokomiální pneumonieČlánek Cystická fibróza dospělýchČlánek Nemalobuněčný karcinom plicČlánek Neinvazivní ventilace
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 11- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Současná náplň pneumologie
- Cílené vyhledávání nemocných s chronickou obstrukční plicní nemocí: stručný přehled
- Asthma bronchiale v kontextu vnitřního lékařství
- Diagnostika a léčba komunitní pneumonie – v jednoduchosti je klíč k úspěchu
- Nozokomiální pneumonie
- Pneumonie u imunokompromitovaných
- Idiopatická plicní fibróza. Umíme ji vždy správně diagnostikovat a léčit?
- Exogenní alergické alveolitidy: minimum pro praxi
- Sarkoidóza – nadále záhadné onemocnění
- Současný přístup k diagnostice, léčbě a prevenci tuberkulózy
-
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně - Cystická fibróza dospělých
- Kardiovaskulární riziko spánkové apnoe a kazuistika
- Komplikace po transplantaci plic
- Nemalobuněčný karcinom plic
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
- Maligní mezoteliom pleury – dosud nepokořený nádor
- Spirometrie – základní vyšetření funkce plic
- Postavení bronchologie v pneumologické diagnostice
- Ultrasonografické vyšetření hrudníku v rukou lékaře klinika
- Neinvazivní ventilace
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Spirometrie – základní vyšetření funkce plic
- Neinvazivní ventilace
- Pneumonie u imunokompromitovaných
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



