-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vzťah polymorfizmov génov CDKAL1 a KCNQ1 k veku diagnózy diabetu 2. typu v populácii Slovenska
Relationship of the CDKAL1 and KCNQ1 gene polymorphisms to the age at diagnosis of type 2 diabetes in the Slovakian population
Background/aims:
The association of CDKAL1 and KCNQ1 genes with type 2 diabetes mellitus (DM2T) was confirmed by several genome-wide association studies in both Caucasian and Asian populations. For both genes, it is supposed that the risk of DM2T development is related to impaired insulin secretion. Based on assumption that the presence of risk allele might predispose to an earlier onset of DM2T, the aim of the present study was to assess the frequency of risk alleles of CDKAL1 rs7756992 and KCNQ1 rs163184 polymorphisms and to analyze their association with the age at DM2T diagnosis in the Slovakian population.Methods:
CDKAL1 rs7756992 A/G and KCNQ1 rs163184 G/T polymorphisms were genotyped using asymmetric PCR with subsequent melting curve analysis in a group of 538 patients with DM2T. Anthropometric and laboratory parameters were determined by using standard methods. Since two genes were analysed, the required level for statistical significance was defined as p < 0.025.Results:
Risk homozygotes (GG) for KCNQ1 polymorphism had higher mean age of DM2T diagnosis by 2 years when compared to T-allele carriers (GT + TT) in a recessive model, but the difference did not reach the predefined level of statistical significance. No relationship of CDKAL1 polymorphism to the age at onset of DM2T diagnosis was observed.Conclusions:
In the present study, no relationship of CDKAL1 and KCNQ1 polymorphisms to the earlier onset of type 2 diabetes was observed.Key words:
type 2 diabetes mellitus – gene polymorphisms – CDKAL1 – KCNQ1 – age at diagnosis of diabetes
Autoři: M. Dobríková 1; M. Javorský 1; V. Habálová 2; L. Klimčáková 2; M. Kozárová 1; J. Židzik 2; J. Halušková 2; J. Šalagovič 2; I. Tkáč 1
Působiště autorů: IV. interná klinika Lekárskej fakulty UPJŠ a Centra excelentnosti pre výskum aterosklerózy a jej komplikácií – srdcového a mozgového infarktu (CEVA) Lekárskej fakulty UPJŠ Košice, Slovenská republika, prednosta prof. MUDr. Ivan Tkáč, PhD. 1; Ústav lekárskej biológie Lekárskej fakulty UPJŠ a Centra excelentnosti pre výskum aterosklerózy a jej komplikácií – srdcového a mozgového infarktu (CEVA) Lekárskej fakulty UPJŠ v Košice, Slovenská republika, prednosta prof. RNDr. Ján Šalagovič, PhD. 2
Vyšlo v časopise: Vnitř Lék 2011; 57(2): 155-158
Kategorie: Původní práce
Souhrn
Úvod/cieľ:
Asociácia génov CDKAL1 a KCNQ1 s diabetes mellitus 2. typu (DM2T) bola potvrdená viacerými celogénomovými asociačnými štúdiami v kaukazskej aj ázijskej populácii. U oboch génov sa predpokladá vplyv na riziko rozvoja DM2T prostredníctvom poruchy inzulínovej sekrécie. Vychádzali sme z predpokladu, že prítomnosť rizikovej alely môže predisponovať k skoršiemu nástupu DM2T. Cieľom našej štúdie bolo zistiť frekvenciu rizikových alel polymorfizmov rs7756992 génu CDKAL1 a rs163184 génu KCNQ1 a analyzovať ich vzťah k veku stanovenia diagnózy DM2T v populácii Slovenska.Metódy:
V súbore 538 pacientov s DM2T boli určené genotypy polymorfizmu rs7756992 A/G génu CDKAL1 a polymorfizmu rs163184 G/T génu KCNQ1 metódou asymetrickej PCR s následnou analýzou krivky topenia. Antropometrické a laboratórne parametre boli vyšetrené štandardnými metódami. Vzhľadom na analýzu 2 génov bola definovaná požadovaná hladina štatistickej významnosti na hladine p < 0,025.Výsledky:
Rizikoví homozygoti (GG) polymorfizmu KCNQ1 mali v recesívnom modeli o 2 roky vyšší priemerný vek diagnózy DM2T ako nosiči alely T (GT + TT), ale hodnota štatistickej významnosti nedosiahla preddefinovanú úroveň. Pri polymorfizme génu CDKAL1 nebol pozorovaný signifikantný rozdiel vo veku diagnózy DM2T medzi jednotlivými genotypmi.Záver:
V tejto štúdii sme nezistili vzťah medzi sledovanými polymorfizmami génov CDKAL1 a KCNQ1 a skorším vekom nástupu DM2T v populácii Slovenska.Kľúčové slová:
diabetes mellitus 2. typu – génové polymorfizmy – CDKAL1 – KCNQ1 – vek diagnózy diabetuÚvod
Diabetes mellitus 2. typu (DM2T) je komplexné ochorenie. Na jeho etiopatogenéze sa podieľajú viaceré gény s malým účinkom, medzigénové interakcie, ako aj environmentálne vplyvy. V minulosti sa na zisťovanie genetických faktorov komplexných ochorení používali prístupy identifikácie kandidátskych génov a väzobnej analýzy. Posledné roky sa do popredia dostali celogenómové asociačné štúdie (genome-wide association studies), ktoré umožnili identifikovať veľké množstvo významných asociácií medzi určitými chromozómovými lokusmi a komplexnými ochoreniami. Prostredníctvom nich boli potvrdené asociácie DM2T s predtým identifikovanými kandidátskymi génmi – TCF7L2, PPARG, KCNJ11 a bolo objavených viac ako 20 nových génov, ktorých polymorfizmy sú spojené so zvýšeným rizikom rozvoja DM2T, medzi nimi aj gény CDKAL1 a KCNQ1.
CDKAL1 kóduje inhibítor cyklín dependentnej kinázy 5 (CDK5). Aktívny komplex p35/CDK5 znižuje inzulínovú expresiu. Inhibícia aktivity tohto komplexu bráni deštrukcii β-buniek počas glukotoxických stavov [1]. Niektorí vedci predpokladajú, že patomechanizmus vedúci k rozvoju DM2T je v prítomnosti rizikových polymorfizmov tohto génu sprostredkovaný prostredníctvom porušenej regulácie bunkového cyklu [2]. Viaceré štúdie dokázali vplyv jeho polymorfizmov na zníženie inzulínovej sekrécie [3–6]. Niektoré publikácie poukazujú u určitých variácií tohto génu na porušenú konverziu proinzulínu na inzulín [7,8].
Gén KCNQ1 kóduje podjednotku napätím regulovaného (voltage-dependent) draslíkového kanála nachádzajúceho sa v pankreatických a myokardiálnych bunkách. Práce Unokiho et al poukazujú na najväčšiu expresiu KCNQ1 v srdci, pankrease, vo vnútornom uchu a v menšom množstve aj v placente, pľúcach, pečeni a obličkách [9]. Tento draslíkový kanál sa nachádza aj v bunkových kultúrach INS-1 produkujúcich inzulín, keďže inhibícia tohto kanála sulfónamidovým analógom spôsobuje zvýšenie inzulínovej sekrécie v prítomnosti tolbutamidu [10]. U laboratórnych zvierat so zníženou funkciou tohto génu sa nepozorovala hyperglykémia ani glukózová intolerancia. Preto sa predpokladá, že za rozvoj DM2T je zodpovedná zvýšená expresia tohto génu v pankreatických β-bunkách.
Polymorfizmy KCNQ1 boli asociované s DM2T vo východoázijskej aj kaukazskej populácii, pričom vyšší vplyv na riziko DM2T bol dokumentovaný v ázijskej populácii [9,11,12]. V jednej štúdii bola pozorovaná asociácia niektorých polymorfizmov KCNQ1 so znížením inkretínovej sekrécie [13].
Pri géne TCF7L2, ktorý je tesne asociovaný s DM2T, bolo zistené, že nosiči rizikových alel majú skorší vek nástupu diabetu [14–16]. Vo vzťahu ku génom CDKAL1 a KCNQ1 nám štúdie analyzujúce vzťah genotypu ku veku diagnózy diabetu nie sú známe. Cieľom našej štúdie bolo zistiť frekvenciu rizikových polymorfizmov a analyzovať vzťah polymorfizmu rs7756992 génu CDKAL1 a polymorfizmu rs163184 génu KCNQ1 na vek nástupu DM2T v populácii Slovenska.
Metódy
Pacienti
Do štúdie bolo zaradených 538 pacientov s DM2T dispenzarizovaných v 3 ambulanciách východného Slovenska (Košice, Prešov). Diagnóza bola založená na diagnostických kritériách Americkej diabetologickej spoločnosti [17]. Do štúdie neboli zaradení diabetici s dokázanou autoimunitnou etiológiou alebo špecifickými typmi diabetu.
Anamnestické údaje boli získané zo zdravotnej dokumentácie a antropometrické vyšetrenie (výška, váha, obvod pása, bokov, systolický a diastolický krvný tlak) bolo doplnené v rámci bežnej diabetologickej kontroly. Ďalej bol odobratý materiál na zistenie laboratórnych údajov (glykémia nalačno, glykovaný hemoglobín, lipidový profil) a materiál na stanovenie DNA. Klinická charakteristika subjektov štúdie je uvedená v tab. 1. Účastníci vyjadrili informovaný súhlas s účasťou v štúdii a štúdia bola schválená etickou komisiou Fakultnej nemocnice L. Pasteura v Košiciach.
Tab. 1. Klinická charakteristika pacientov s DM2T. 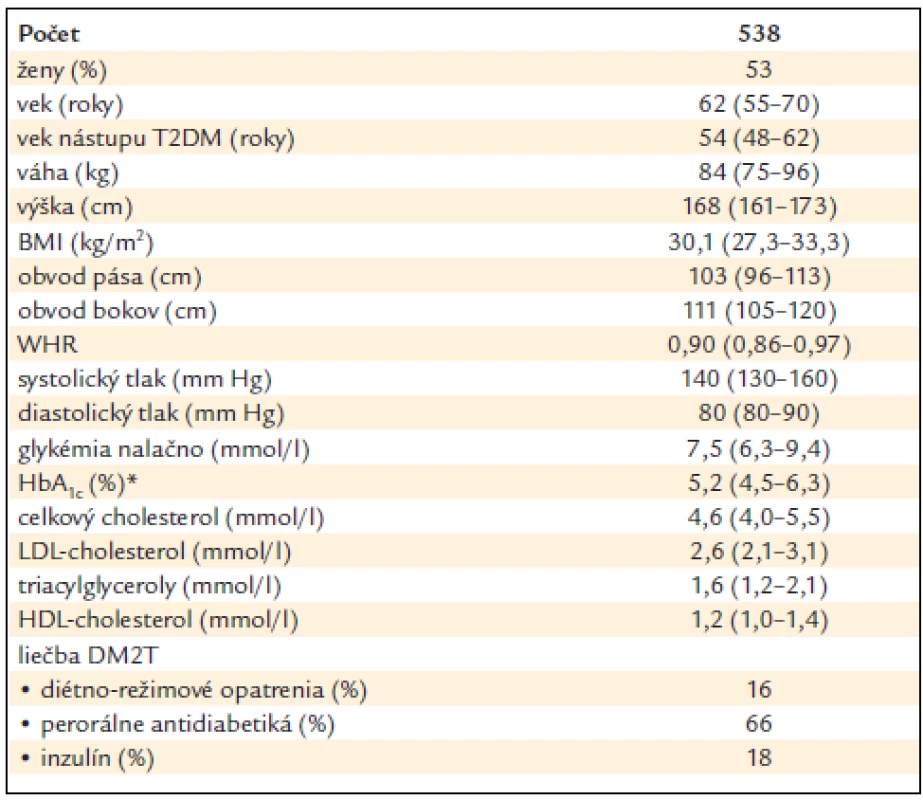
Údaje sú uvedené ako medián (25.–75. percentil) alebo v %. *HbA1c – podľa štandardu IFCC: horná hranica normy 4,2 % (zodpovedá 6,0 % podľa štandardu DCCT). Genotypizácia
Genomická DNA bola izolovaná z periférnych leukocytov použitím súpravy Wizard Genomic DNA Purification Kit (Promega, Madison, WI, USA).
Genotypizácia pri polymorfizme rs7756992 CDKAL1 bola realizovaná pomocou PCR-RFLP za použitia primerov: forward-primer: 5´-CACTTCAGCCTCCCTAGTATCTA-3´; reverse-primer: 5´-TTTAACACACAAGAATCCATAATCC-3´. Produkt PCR sa štiepil reštrikčnými endonukleázami Bgl II (New England BioLabs). Produkty štiepenia boli separované na 2% agarózovom géli, G alela bola detekovaná ako fragment dĺžky 599 bp, A alela v podobe fragmentov 463 bp a 136 bp.
Genotypizácia polymorfizmu rs163184 génu KCNQ1 bola realizovaná na prístroji LightCycler 1.5 (Roche Applied Science, Nemecko) asymetrickou polymerázovou reťazovou reakciou s neznačenou sondou v prítomnosti farbiva LC Green Plus, s následnou analýzou krivky topenia. Boli použité primery: forward-5´-CTTTGCTCTGTAACGGACTGGACCA-3´; reverse-5´-TCTGTGGAAAGGGGTTGCCATGC-3´. V reakcii bola aj neznačená sonda blokovaná na 3´ konci fosfátom prekrývajúca polymorfné miesto: 5´-TATGGAGTTTGGAGTAAAGAGAGA[Phos]3´. Heterozygoti boli rozpoznávaní na základe odlišného tvaru krivky topenia a rôzne typy homozygotov na základe odlišnej teploty topenia (Tm), pričom genotyp GG mal nižšiu teplotu topenia ako genotyp TT.
Štatistická analýza
Pri analýze štatistickej sily štúdie sme vychádzali z očakávaného rozdielu 3 rokov vo veku diagnózy diabetu medzi nosičmi rizikových alel sledovaných génov. Na dosiahnutie štatistickej sily nad 80 % pri tomto rozdiele bolo potrebné zaradenie 500 pacientov do štúdie. Vzhľadom na fakt, že sme vykonali analýzu 2 génov, sme po Bonferroniho korekcii definovali požadovanú štatistickú významnosť na hladine p < 0,025. Hardyho-Weinbergovu rovnováhu sme testovali pomocou χ2-testu. Porovnanie priemerného veku nástupu diabetu pri jednotlivých polymorfizmoch bolo vykonané za použitia analýzy rozptylu (ANOVA) alebo nepárového t-testu. Na výpočty boli použité programy SPSS v.15 (SPSS, Chicago, IL, USA) a SNPstats [18].
Výsledky
Frekvencie jednotlivých genotypov sledovaných polymorfizmov génov CDKAL1 a KCNQ1 boli v Hardy-Weinbergovej rovnováhe. Frekvencia rizikovej alely G polymorfizmu rs7756992 CDKAL1 bola 31 %, kým pri polymorfizme rs163184 KCNQ1 bola frekvencia rizikovej alely G 51 % (tab. 2).
Tab. 2. Frekvencie genotypov a rizikových alel pri polymorfi zmoch génov CDKAL1 a KCNQ1 u pacientov s DM2T. 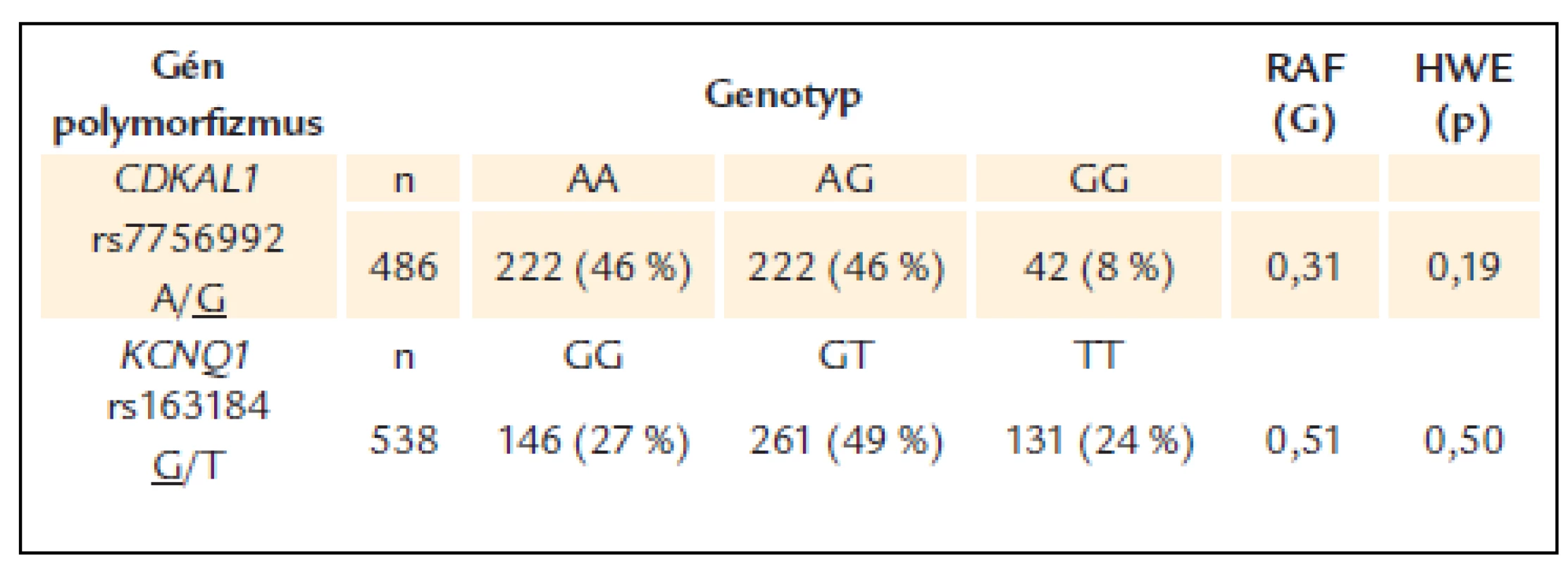
Podčiarknutá alela je riziková v asociácii s DM2T, RAF – frekvencia rizikovej alely, HWE – Hardy-Weinbergova rovnováha Pri oboch polymorfizmoch nebol zistený vplyv rizikovej alely na včasnejší vek diagnózy DM2T v žiadnom z testovených genetických modelov – aditívnom, dominantnom ani recesívnom.
Pri polymorfizme rs163184 génu KCNQ1 bol v recesívnom modeli u rizikových homozygotov (GG) pozorovaný v rozpore s predpokladom o 2 roky vyšší priemerný vek nástupu DM2T ako u nosičov alely T (GT + TT), ale tento rozdiel nedosiahol preddefinovanú hladinu štatistickej významnosti. Podobne aj pri polymorfizme génu CDKAL1 nedosahovali rozdiely v priemernom veku nástupu DM2T medzi jednotlivými genotypovými skupinami štatistickú významnosť v žiadnom z testovaných genetických modelov (tab. 3).
Tab. 3. Vek diagnózy DM2T v jednotlivých genotypových skupinách sledovaných polymorfi zmov. 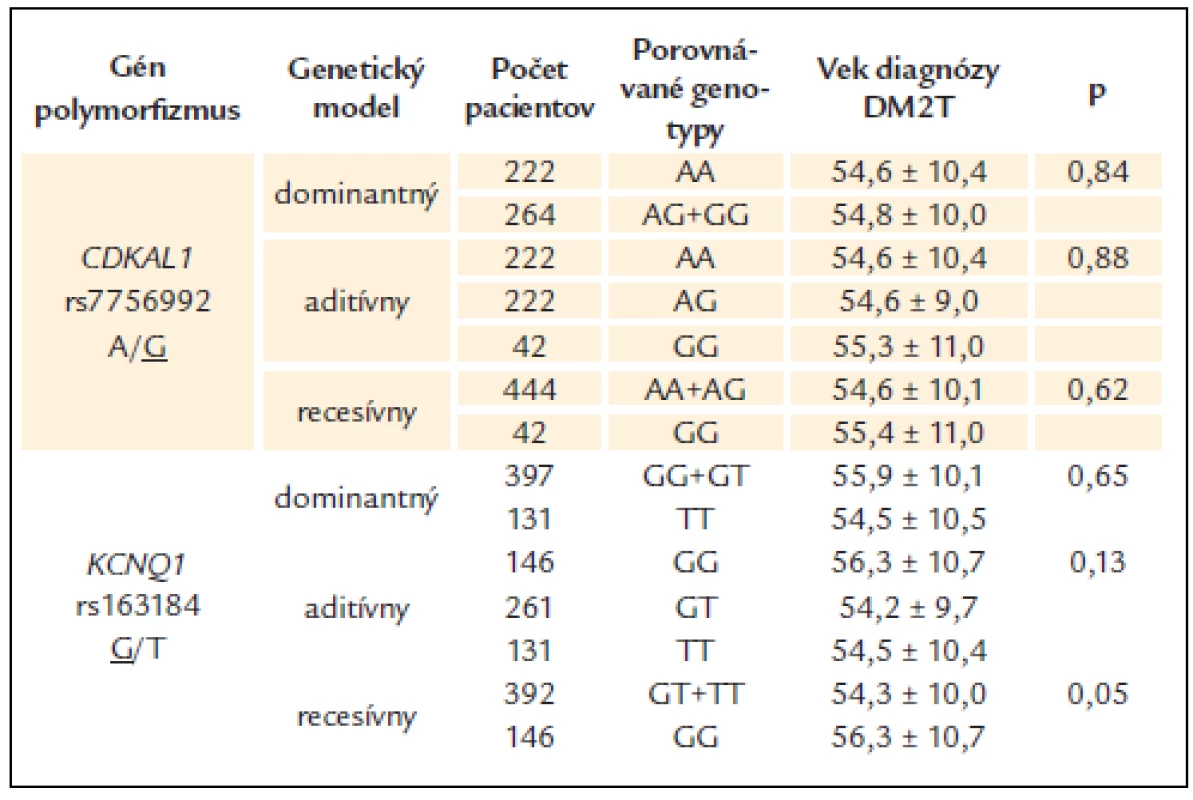
Podčiarknutá alela je riziková. Údaje sú uvedené ako priemer ± štandardná odchýlka. Diskusia
V tejto štúdii sme nezistili signifikantnú asociáciu rizikových alel polymorfizmov génov KCNQ1 a CDKAL1 s včasnejším vekom diagnózy DM2T v populácii Slovenska.
Polymorfizmus rs163184 génu KCNQ1 bol podľa dostupnej literatúry sledovaný len v japonskej populácii, v ktorej bola frekvencia rizikovej alely 58 %, čo bolo spojené so zvýšením rizika rozvoja DM2T o 33 % [11]. Frekvencia rizikovej alely v našej vzorke pacientov s DM2T (51 %) bola o trochu nižšia ako frekvencia v japonskej populácii.
Riziková alela polymorfizmu rs756992 génu CDKAL1 bola asociovaná so zvýšeným rizikom rozvoja DM2T v kaukazskej populácii o 20 % [6], kým v ázijskej populácii o 25–38 % [3,4]. V kaukazskej populácii bola táto alela zastúpená v 25 % a v ázijskej populácii dosahovala jej frekvencia 42–50 % [3,4,6]. Zastúpenie rizikovej alely polymorfizmu rs756992 v našej populácii (31 %) je podobné frekvencii rizikovej alely referovanej v kaukazskej populácii.
Z doteraz identifikovaných génov bol v predchádzajúcich štúdiách pozorovaný signifikantný efekt génu TCF7L2 na nižší vek nástupu DM2T [14–16]. Vo francúzskej populácii mali rizikoví homozygoti TT v priemere o 2,4 roka skorší nástup DM2T v porovnaní s nerizikovými homozygotmi CC [14]. Podobne v štúdii GoDARTs, vykonanej na škótskej populácii, bol zistený signifikantný rozdiel medzi homozygotmi TT a CC génu TCF7L2 vo veku diagnózy DM2T, ktorý predstavoval v priemere 1,4 roka [16].
Vysvetlenie chýbania efektu sledovaných polymorfizmov na včasnejší vek nástupu DM2T môže súvisieť so slabšou asociáciou týchto génov s DM2T ako pri géne TCF7L2, ktorý má zo všetkých doteraz identifikovaných kandidátskych génov najtesnejšiu asociáciu s DM2T, keď riziko per alellam pri polymorfizme rs7901346 bolo v celogenómových asociačných štúdiách zvýšené skoro o 40 % [19].
Obmedzením tejto štúdie môže byť jej nedostatočná štatistická sila vyplývajúca z faktu, že pozorované rozdiely v priemerných hodnotách veku diagnózy DM2T boli nižšie ako očakávané rozdiely. Keďže gény CDKAL1 a KCNQ1 majú výraznejší vplyv na rozvoj DM2T v ázijskej populácii ako v kaukazskej (vyššia frekvencia rizikovej alely, vyššie riziko per allelam), na dôkaz asociácií v našej populácii môžu byť potrebné vyššie počty sledovaných subjektov. Ďalšiu limitáciu by mohla predstavovať skutočnosť, že vek diagnózy DM2T sa nemusel vždy zhodovať s vekom nástupu ochorenia. Vplyv tejto chyby však bol pravdepodobne rovnaký vo všetkých genotypových skupinách.
Záver
V súhrne možno konštatovať, že v prezentovanej štúdii nebol pozorovaný vzťah medzi polymorfizmami génov CDKAL1 a KCNQ1 a skorším vekom nástupu DM2T v populácii Slovenska.
Táto publikácia bola vytvorená za podpory grantu VEGA 1/0380/10 (50 %) a realizáciou projektu „Centrum excelentnosti pre výskum aterosklerózy a jej komplikácií – srdcového a mozgového infarktu (CEVA)“ na základe Operačného programu výskum a vývoj financovaného z Európskeho fondu regionálneho rozvoja (50 %).
prof. MUDr. Ivan Tkáč, PhD.
www.fnlp.sk
e-mail: ivantkac@lf.upjs.skDoručeno do redakce: 15. 4. 2010
Přijato po recenzi: 23. 11. 2010
Zdroje
1. Ubeda M, Rukstalis JM, Habener JF. Inhibition of cyclin-dependent kinase 5 activity protects pancreatic beta cells from glucotoxicity. J Biol Chem 2006; 281 : 28858–28864.
2. Ridderstråle M, Groop L. Genetic dissection of type 2 diabetes. Mol Cell Endocrinol 2009; 297 : 10–17.
3. Tabara Y, Osawa H, Kawamoto R et al. Replication study of candidate genes associated with type 2 diabetes based on genome-wide screening. Diabetes 2009; 58 : 493–498.
4. Wu Y, Li H, Loos RJ et al. Common variants in CDKAL1, CDKN2A/B, IGF2BP2, SLC30A8, and HHEX/IDE genes are associated with type 2 diabetes and impaired fasting glucose in a Chinese Han population. Diabetes 2008; 57 : 2834–2842.
5. Horikoshi M, Hara K, Ito C et al. Variations in the HHEX gene are associated with increased risk of type 2 diabetes in the Japanese population. Diabetologia 2007; 50 : 2461–2466.
6. Steinthorsdottir V, Thorleifsson G, Reynisdottir I et al. A variant in CDKAL1 influences insulin response and risk of type 2 diabetes. Nat Genet 2007; 39 : 770–775.
7. Kirchhoff K, Machicao F, Haupt A et al. Polymorphisms in TCF7L2, CDKAL1 and SLC30A8 genes are associated with impaired proinsulin conversion. Diabetologia 2008; 51 : 597–601.
8. Stančáková A, Kuulasmaa T, Paananen J et al. Association of 18 confirmed susceptibility loci for type 2 diabetes with indices of insulin release, proinsulin conversion, and insulin sensitivity in 5327 non-diabetic Finnish men. Diabetes 2009; 58 : 2129–2136.
9. Unoki H, Takahashi A, Kawaguchi T et al. SNPs in KCNQ1 are associated with susceptibility to type 2 diabetes in East Asian and European populations. Nat Genet 2008; 40 : 1098–1102.
10. Ullrich S, Su J, Ranta F et al. Effects of I( Ks) channels inhibitors in insulin-secreting INS-1 cells. Pflugers Arch 2005; 451 : 428–436.
11. Yasuda K, Miyake K, Horikawa Y et al. Variants in KCNQ1 are associated with susceptibility to type 2 diabetes mellitus. Nat Genet 2008; 40 : 1092–1097.
12. Lee Y, Kang ES, Kim SH et al. Association between polymorphisms in SLC30A8, HHEX, CDKN2A/B, IGF2BP2, FTO, WFS1, CDKAL1, KCNQ1 and type 2 diabetes in the Korean population. J Hum Genet 2008; 53 : 991–998.
13. Müssig K, Staiger H, Machicao F et al. Association of type 2 diabetes candidate polymorphisms in KCNQ1 with incretin and insulin secretion. Diabetes 2009; 58 : 1715–1720.
14. Cauchi S, Meyre D, Dina C et al. Transcription factor TCF7L2 genetics study in the French population: expression in human beta-cells and adipose tissue and strong association with type 2 diabetes. Diabetes 2006; 55 : 2903–2908.
15. Lehman DM, Hunt KJ, Leach RJ et al. Haplotypes of transcription factor 7-like 2 (TCF7L2) gene and its upstream region are associated with type 2 diabetes and age of onset in Mexican Americans. Diabetes 2007; 56 : 389–393.
16. Kimber CH, Doney AS, Pearson ER et al. TCF7L2 in the Go-DARTS study: evidence for a gene dose effect on both diabetes susceptibility and control of glucose levels. Diabetologia 2007; 50 : 1186–1191.
17. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 1997; 20 : 1183–1197.
18. Solé X, Guinó E, Valls J et al. SNPStats: a web tool for the analysis of association studies. Bioinformatics 2006; 22 : 1928–1929.
19. Tong Y, Lin Y, Zhang Y et al. Association between TCF7L2 gene polymorphisms and susceptibility to type 2 diabetes mellitus: a large Human Genome Epidemiology (HuGE) review and meta-analysis. BMC Med Genet 2009; 10 : 15.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2011 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Chronická tromboembolická plicní hypertenze – editorial
- Výskyt infekční endokarditidy a některé problémy její diagnostiky – editorial
- Genetická determinace věku diagnózy diabetes mellitus 2. typu? Revidovaná koncepce „střádavého genotypu“ – editorial
- Pankreatický karcinom – vztah k diabetes mellitus a kouření – editorial
- Význam a možnosti screeningu v diagnostice celiakie – editorial
- Diagnostika a léčba BCR/ABL-negativních myeloproliferativních onemocnění – editorial
- Chronická tromboembolická pľúcna hypertenzia v spádovej nemocnici
- Endokarditidy 2007: Výsledky multicentrické studie o výskytu a vlastnostech infekční endokarditidy
- Vzťah polymorfizmov génov CDKAL1 a KCNQ1 k veku diagnózy diabetu 2. typu v populácii Slovenska
- Pankreatický karcinom – vztah k diabetes mellitus a kouření
- Alkoholová kardiomyopatia – diagnóza stále aktuálna
- Hodnotenie kvality života a funkčného stavu u pacientov s reumatoidnou artritídou
- Bikuspidální aortální chlopeň – etiopatogeneze a přirozený vývoj
- Význam a možnosti skríningu v diagnostike celiakie
- Diagnostika a léčba BCR/ABL-negativních myeloproliferativních onemocnění – principy a východiska doporučení CZEMP
- Selhání ledvin u pacientky s chronickou B-lymfocytární leukemií (B-CLL) vzniklé na podkladě tvorby odlitkových válců v tubulech ledvin z monoklonálních volných lehkých řetězců (cast nephropathy). Přínos stanovení volných lehkých řetězců imunoglobulinů pro
- Profesor Pavel Bravený jubilant
- Nedožité devadesátiny prof. MUDr. Jiřího Šonky, DrSc.
- Haškovcová H. Fenomén stáří (vydání druhé, podstatně přepracované a doplněné). Praha: Havlíček Brain Team 2010, 365 s. ISBN 978-80-87109-19-9.
- Češka R et al. Interna 1. vydání. Praha/Kroměříž: Triton 2010, 855 stran. ISBN: 978-80-387-423-0.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Bikuspidální aortální chlopeň – etiopatogeneze a přirozený vývoj
- Alkoholová kardiomyopatia – diagnóza stále aktuálna
- Diagnostika a léčba BCR/ABL-negativních myeloproliferativních onemocnění – principy a východiska doporučení CZEMP
- Hodnotenie kvality života a funkčného stavu u pacientov s reumatoidnou artritídou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



