-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaHyperlipoproteinemie a dyslipoproteinemie II. Terapie: Nefarmakologická a farmakologická léčba
Hyperlipoproteinaemia and dyslipoproteinaemia II. Therapy: Non-pharmacological and pharmacological approaches
At present, literally no one disputes hyperlipoproteinaemia and dyslipidemia (HLP and DLP) treatment as a rational therapeutic approach in the prevention of cardiovascular diseases (CVD). This approach is in line with the current principles of evidence-based medicine (EBM) and is sufficiently evidenced particularly by the results of large intervention studies. Nevertheless! When the results of the recent studies are critically appraised, these by no means are (mostly, there, obviously, are exceptions) as conclusive as the studies conducted in 1980s and 1990s. Consequently, positive results are being sought in subanalyses, subgroup evaluations and multiple-study metaanalyses. This paper is not intended as a critique of new drugs. These certainly are developed to be safe, effective and well-tolerated. However, the newer studies suffer from a range of issues: the populations studied are already very well managed, it is not possible to compare against placebo and sometimes, let us be honest, the trial design itself is problematic (often it is an uncritical effort to treat as wide as possible range of patients as well as new groups of patients who might not be suitable for the given treatment). Certainly, we should not start disputing the well-evidenced hypotheses and seek alternatives to the long-established arguments and approaches as a consequence to some less convincing studies. We must not overlook the most robust results of statin studies as well as ‘positive’ studies with other hypolipidemics. There is no doubt that the effect of statins on LDL-cholesterol represents a significant move towards cardiovascular disease prevention. Despite this, we currently recognise with increased intensity that this very effective and well-evidenced treatment has its limits and that a high proportion of patients dies or are faced with cardiovascular diseases even though they are treated with a correct dose of a statin and a target LDL-C level is achieved. This remaining risk (represents more than 50% of events) has been termed ‘RESIDUAL RISK’. The issue of residual risk is crucial in patients with type 2 diabetes mellitus (DM2T) or in all patients with HDL-C-low DLP. As was repeatedly emphasised, a statin will be a cornerstone of pharmacological treatment of a DLP. However, a question arises what to combine it with. The most convincing data exist for niacin (combination of niacin with laropiprant minimising the incidence of unwanted flushes). We surely should not marginalize other hypolipidemics used mainly in combinations: resin and ezetimibe to treat LDL-C, niacin, fibrates and possibly ω-3-fatty acids to manage the residual risk (HDL and TG). Last but not least we should not forget non-pharmacological treatment as the pivotal treatment approach in all patients.
Key words:
diet – statins – niacin – resin – ezetimibe - fibrates
Autoři: R. Češka; S. Krutská; L. Kašná; G. Šmelková; L. Zlatohlávek; M. Vráblík
Působiště autorů: Centrum preventivní kardiologie III. interní kliniky 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2010; 56(7): 647-654
Kategorie: 80. narozeniny předsedy České lékařské společnosti J. E. Purkyně prof. MUDr. Jaroslava Blahoše, DrSc.
Souhrn
V současné době téměř nikdo nezpochybňuje léčbu hyperlipoproteinemií a dyslipidemií (HLP a DLP) jako velmi racionální terapeutický postup v prevenci kardiovaskulárních onemocnění (KVO). Tato léčba odpovídá současným principům medicíny založené na důkazech (EBM) a je dostatečně „evidence based“, zejména je ověřena důkazy z velkých intervenčních studií. A přesto! Když se podíváme kriticky na výsledky studií z posledních let, nejsou (v převážné většině – výjimky samozřejmě existují) zdaleka tak přesvědčivé jako výsledky studií z 80. a 90. let minulého století. Pozitivní výsledek pak hledáme dodatečně v subanalýzách, v hodnoceních podskupin a v metaanalýzách několika studií současně. To není v žádném případě kritika nových léků. Jsou jistě vyvinuty jako bezpečné, účinné a dobře tolerované přípravky. Problém současných klinických studií je především v tom, že studované populace jsou velmi dobře léčené, není možné srovnávat účinnou látku s placebem a někdy, buďme upřímní, je problém i design „klinického trialu“ (často je za ne optimálním uspořádáním studií nekritická snaha léčit co nejširší okruh pacientů a stále nové skupiny nemocných, kteří třeba nemusí být pro léčbu vhodní). Rozhodně bychom neměli na základě některých ne zcela přesvědčivých studií začít znovu zpochybňovat hypotézy již dávno ověřené a hledat alternativy k dávno prokázaným tvrzením a důkazům. Rozhodně a v žádném případě nelze přehlédnout robustní výsledky studií se statiny ani výsledky dalších „pozitivních“ studií s ostatními hypolipidemiky. Není pochyb o tom, že především ovlivnění LDL‑cholesterolu statiny je významným krokem v prevenci kardiovaskulárních onemocnění. V současné době si však stále více uvědomujeme, že i tato velmi účinná a přesvědčivě dokumentovaná léčba má své limity a vysoké procento nemocných umírá, nebo se u nich alespoň manifestuje kardiovaskulární onemocnění navzdory tomu, že jsou léčeni správnou dávkou statinu a že je dosaženo cílové hodnoty LDL‑C. Pro toto přetrvávající nebo zbytkové riziko (které ale představuje více než 50 % příhod) se v poslední době vžil pojem „REZIDUÁLNÍ RIZIKO“. Otázka tohoto reziduálního rizika je kruciální právě u nemocných s diabetes mellitus 2. typu (DM2T) nebo u všech nemocných s DLP charakterizovanou především nízkým HDL‑C. Jak bylo opakovaně zdůrazněno, základem farmakologické léčby DLP bude statin. Ale nyní se otevírá otázka, jaký lék užít do kombinace. Nejpřesvědčivější data najdeme jistě pro niacin (kombinace niacinu s laropiprantem, který snižuje na minimum výskyt nežádoucího flushe). Samozřejmě nebudeme opomíjet ani další hypolipidemika, která využíváme především v kombinaci: pryskyřice a ezetimib pro léčbu LDL‑C, niacin, fibráty a částečně i ω‑3-mastné kyseliny k ovlivnění reziduálního rizika (HDL a TG). Konečně nelze opomíjet nefarmakologickou léčbu, která je vždy základem terapie u všech nemocných.
Klíčová slova:
dieta – statiny – niacin – pryskyřice – ezetimib – fibrátyV současné době téměř nikdo nezpochybňuje léčbu hyperlipoproteinemií a dyslipidemií (HLP a DLP) jako velmi racionální terapeutický postup v prevenci kardiovaskulárních onemocnění (KVO). Tato léčba odpovídá současným principům medicíny založené na důkazech (EBM) a je dostatečně „evidence based“, zejména je ověřena důkazy z velkých intervenčních studií.
Nefarmakologická léčba
Zvýšení pohybové aktivity
Mezi režimová opatření patří pravidelná fyzická aktivita (aerobní cvičení 20–30 min 4–5krát týdně nebo 45–60 min 2–3krát týdně). Druh cvičení volíme podle věku, předchozích onemocnění, fyzické kondice i stavu pohybového ústrojí pacienta. Doporučuje se běh, indiánský běh, procházky rychlou chůzí, jízda na kole, ale i doma na ergometru, běh na lyžích, plavání, veslování, intenzivní tanec. Cvičení by mělo být pro nemocného příjemné a měl by při něm dosahovat 60–75 % maximální tepové frekvence pro daný věk. Zdá se, že v prevenci kardiovaskulárních onemocnění není dokonce nutné ani příliš intenzivní cvičení! Osoby, které provozují pravidelné procházky rychlou chůzí (3–5krát týdně 30 min), sníží svoje kardiovaskulární riziko stejně jako ty, které intenzivně cvičí v posilovně! Zajímavé je, že obézní, který pravidelně cvičí („FIT‑FAT“), je v nižším riziku než osoba s ideální hmotností a minimální fyzickou aktivitou („NONFIT‑NONFAT“).
Kouření
Kouření samo o sobě násobí kardio-vaskulární riziko 2–4násobně a tento efekt je dále zvýrazněn a násoben při současné HLP (hypertenzi, inzulinové rezistenci apod.). Kouření u vysoce rizikového nemocného s HLP iniciuje a akceleruje nejen rozvoj aterosklerózy (endoteliální poškození s následným usazováním LDL partikulí ve stěně cévní), ale hraje významnou úlohu při vzniku akutních koronárních příhod, jako je infarkt myokardu, angina pectoris, arytmie i náhlá smrt. Tento účinek je závislý jak na počtu cigaret, tak na délce kouření. Kouření vede ke zvýšení aktivity sympatiku. Ta má za následek zvýšení lipolýzy. Usnadněná lipolýza vede ke zvýšenému uvolňování volných mastných kyselin. Není proto překvapením vyšší koncentrace volných mastných kyselin, kterou epidemiologické studie u kuřáků rovněž prokazují.
Dieta
Strava doporučovaná pro prevenci ICHSs maximálním zaměřením na léčbu HLP, ale i obezity a hypertenze by měla být respektována celou populací jako racionální dieta. Pro nemocné s HLP je její respektování imperativem. Různé poruchy tukového metabolizmu vyžadují v podrobnostech odlišná dietní opatření. Je však možno uvést základní principy, platné obecně. Vycházejí vesměs z diety doporučované americkou kardiologickou společností. Shrnout je lze do několika následujících bodů:
- Restrikce energie, má‑li nemocný nadváhu.
- Nasycené (tedy živočišné) tuky nesmí tvořit více než 7 % denního energetického přísunu. Preferujeme nenasycené tuky, polyenové mastné kyseliny do 10 % energie a monoenové mastné kyseliny (např. kyselinu olejovou) do 20 % energie za den.
- Obsah cholesterolu v potravě by neměl být vyšší než 200 mg/den.
- Zvýšení obsahu vlákniny, včetně potravinových výrobků s jejím zvýšeným obsahem.
- Zvýšení konzumace potravin s dostatečným obsahem některých vitaminů s předpokládaným antioxidačním účinkem. Doporučená dávka zeleniny a ovoce je 400 g/den. Arteficiální doplňování diety vitaminy (A, E, C) se obecně nedoporučuje.
- U nemocných s hypertenzí je vhodné omezit příjem soli na 7–8 g/24 hod.
- Je třeba vyloučit nadměrnou konzumaci alkoholu, zejména u hypertoniků, obézních a u osob s hyper-triglyceridemií.
- Národní cholesterolový program v USA doporučuje i zvýšení přísunu rostlinných sterolů na 2 g/den.
Uvedená dietní a režimová opatření by měla vést u většiny našich nemocných minimálně k dosažení limitu normální hmotnosti, za kterou je považován BMI do 25 kg/m2.
Dieta ke zvýšení HDL‑cholesterolu
Obvykle doporučovaná „antisklerotická“ (nízkotuková, nízkocholesterolová) dieta, doporučovaná ke snižování cholesterolu a LDL‑cholesterolu, může vést ke snížení HDL‑cholesterolu až o 20 %. A to samozřejmě není žádoucí zejména u nemocných s nižší koncentrací HDL‑cholesterolu již na počátku léčby. Základní dietní opatření je redukce energetického příjmu, pokud má nemocný nadváhu. Pokud jde o kvalitativní složení stravy, respektujeme základní doporučení a tuky hradíme, jak je uvedeno i výše, maximálně 25–35 % energie za den, omezíme přísun cholesterolu a živočišných tuků. Snažíme se zvýšit přísun monoenových mastných kyselin, ty by měly hradit až 20 % celkového energetického příjmu za den a z nich pak zvláště kyselině olejové. Pro zvyšování HDL‑cholesterolu se také doporučuje rybí tuk (tři rybí jídla týdně), i když je třeba počítat s tím, že může dojít k mírnému vzestupu LDL‑cholesterolu. Vzestup HDL‑cholesterolu lze docílit i tím, že maso a masné výrobky nahradíme výrobky ze sóji.
LDL‑cholesterol jako primární cíl terapie. Místo pryskyřic
Výsledky epidemiologických studií i výsledky studií intervenčních prokázaly zcela jednoznačně, že snížení LDL‑cholesterolu (LDL‑C) je provázeno snížením výskytu KV příhod, KV mortality, a dokonce i mortality celkové. Lze dokonce uzavřít, že snížení LDL‑C o každé jedno procento vede ke snížení výskytu KV onemocnění o 1–2 %. Samozřejmě, že kromě epidemiologických studií máme v současnosti nejvíce důkazů pro pozitivní účinky snižování LDL‑C ze studií se statiny. Jinou evidenci nám ale nabízí sama příroda. Primitivní kmeny Homo sapiens, u kterých můžeme předpokládat stejné hodnoty LDL‑C jako u našich historických předků, mají LDL‑C pod 2 mmol/l. Stejně tak primáti mají podobné koncentrace LDL‑C. A jestli přidáme i hodnotu nalezenou u novorozence (LDL‑C okolo 1,8 mmol/l), zdá se, že k této hodnotě bychom měli při terapii směřovat. Asi by bylo nošením dříví do lesa připomínat, že jsou autoritami (např. NCEP anebo evropské společnosti) stanoveny cílové hodnoty LDL‑C (které jsou podle rizika nemocného uváděny od 1,5 mmol/l do 3,0 mmol/l) a že v současné době je pro snižování LDL‑C přijímána hypotéza „čím níže, tím lépe“.
Z výše uvedeného vyplývá, že LDL je racionální snižovat, že se musíme snažit dosáhnout co nejnižších hodnot LDL‑C. V praxi k tomu využíváme samozřejmě především terapii statiny. Co ale za situace, když ani statinem nedosáhneme cílové hodnoty? Samozřejmě, že využijeme dalšího léku (ten můžeme použít i v případě intolerance statinu a v podobných situacích). Podívejme se v následujících řádcích, jakou roli by mohly hrát pryskyřice.
Na začátku si připomeňme, že v letošním roce slavíme čtvrt století od publikace výsledků první velké intervenční studie prokazující pozitivní vliv hypolipidemické léčby na KV onemocnění. A byla to právě cholestyraminová studie (LRC‑LCCP, 1984) (obr. 1), která nejen ukázala, že snižování LDL‑C cholestyraminem vede ke snížení výskytu KV příhod, ale jako první potvrdila i hypotézu „čím níže, tím lépe“.
Obr. 1. Cholestyraminová studie (LCR-LCCP). 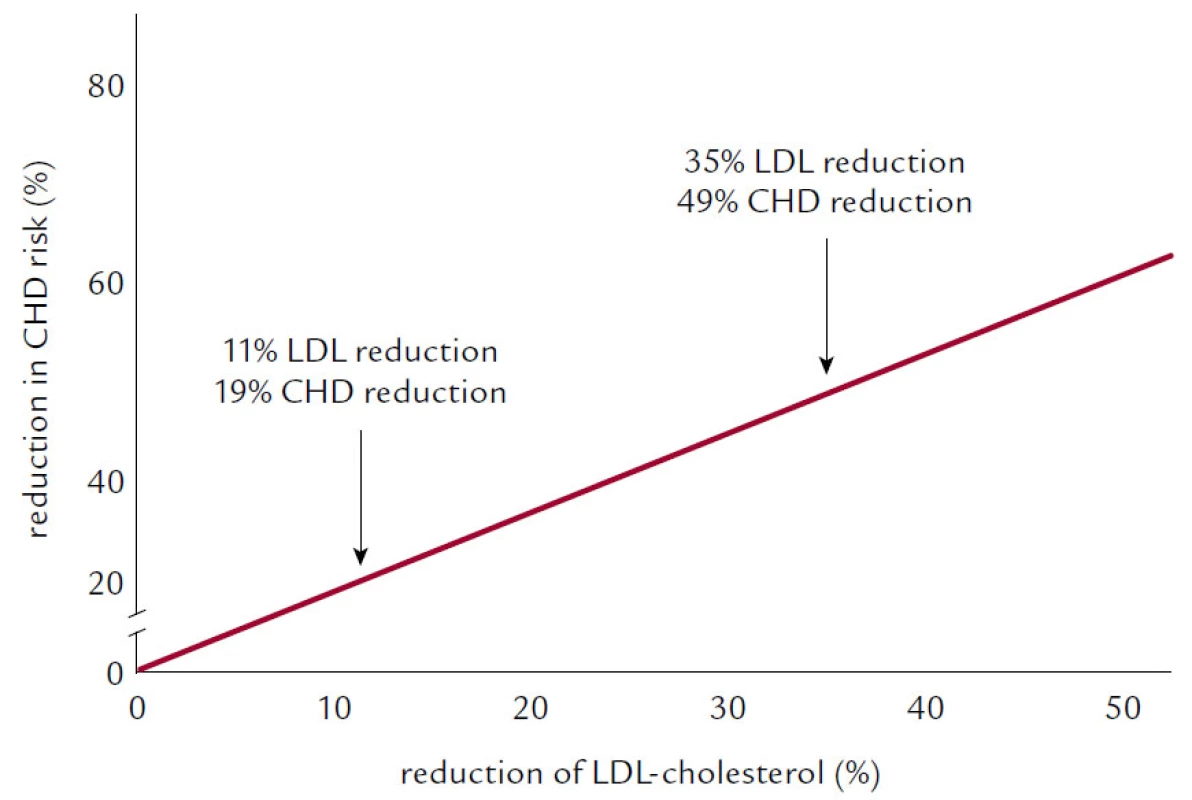
Tento výsledek nebyl překvapivý a byl předcházen a posléze i potvrzen výsledky angiografických studií, ve kterých bylo popsáno zpomalení progrese a v některých i navození regrese aterosklerózy. Za všechny jmenujme Blankenhornovy práce s colestipolem nebo studii NHLBI Type II s cholestyraminem. Studie STARS potvrdila výsledky s cholestyraminem v roce 1992.
Je třeba připomenout, že pryskyřice jsou ze všech hypolipidemik nejbezpečnějšími léky (jsou nevstřebatelné ze zažívacího traktu a působí lokálně ve střevě), bohužel také léky nejhůře tolerované. Nová data ukazují, že u diabetiků zlepšuje podání pryskyřic hladiny glykovaného hemoglobinu.
V realitě si bohužel musíme připomenout, že v ČR skončila v letošním roce dostupnost pryskyřic s ukončením dovozu cholestyraminu. Snad i nová data povedou ke znovuzavedení těchto léků na náš trh, na kterém by se možná mohla objevit nejnovější pryskyřice – colesevelam.
Statiny – základ hypolipidemické léčby
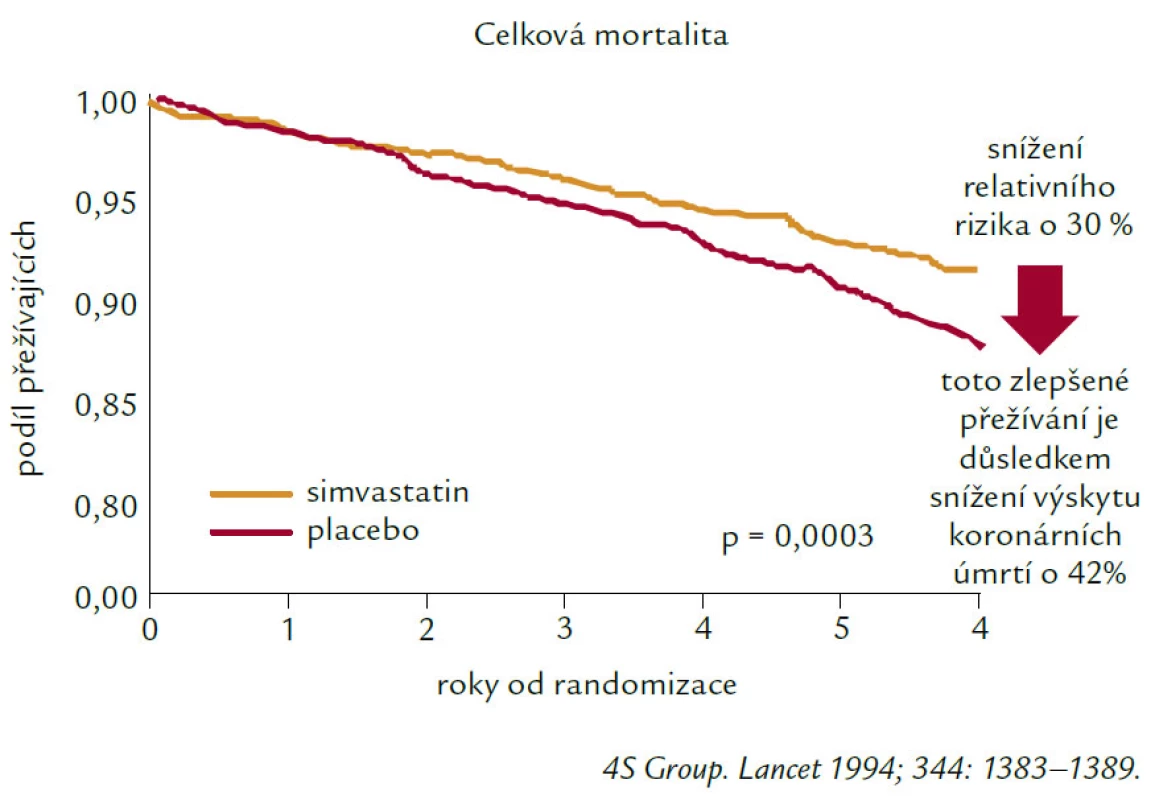
Těžko bychom hledali, a to nejen v oblasti preventivní kardiologie, skupinu léků, která by tak dramaticky změnila terapeutické postupy, ale především prognózu, kvalitu i délku života našich nemocných jako skupina inhibitorů 3-HMGCoA reduktázy, statinů. Když v roce 1976 objevil Akira Endo mevastatin, těžko mohl předpokládat, že statiny budou psát jednu z nejúspěšnějších kapitol medicíny ve druhé polovině 20. století. Historie statinů však nebyla jednoduchá a hlavně výsledky se nedostavily ihned. Nejdříve trvalo více než 10 let, než společnost MSD uvedla na trh první lék této skupiny, lovastatin. Posléze pak, již poměrně brzy simvastatin, který je na trhu i v současnosti (a v řadě zemí světa navzdory příchodu léků novějších stále jako statin nejužívanější). Největším zlomem v pohledu na terapii statiny, ale v širším kontextu na prevenci a léčbu kardiovaskulárních onemocnění ovlivněním hladin lipidů vůbec, byla skandinávská studie „4S“ (Scandinavien Simvastatin Survival Study – publikovaná v The Lancet 1994).
Zkusme se zastavit u studie „4S“ a podívejme se na její význam, výsledky, poselství. I na to, co nám stále může (nebo nemůže?) přinášet v současnosti.
Studie 4S byla první studií s hypolipidemiky (nechci zapomínat ani na významné studie předchozí, jako byla studie cholestyraminová, či CDP s niacinem, nicméně jejich význam byl přeci jen menší), která prokázala, že léčbou hypolipidemikem, statinem nejen významně ovlivníme hladinu celkového a LDL‑cholesterolu, ale především snížila kardiovaskulární morbiditu, kardiovaskulární mortalitu a dokonce (nebo především?) mortalitu celkovou u pacientů s hypercholesterolemií v sekundární prevenci ICHS. Stala se tak základní podporou pro léčbu HLP a DLP ve snaze o zlepšení prognózy nemocných s kardiovaskulárním onemocněním nebo u nemocných s vysokým globálním kardiovaskulárním rizikem. Současně vedla prezentace „4S“ i její další rozbory a diskuze o výsledcích k prosazování a podpoře v současné době nezpochybnitelného trendu k léčbě založené na důkazech tak, jak to vyžaduje „Evidence based medicine“ neboli medicína založená na důkazech. Výsledky studie 4S shrnuje obr. 2.
Samozřejmě, že v současné době je na trhu široké spektrum statinů, lova‑, prava‑, simva‑, atorva ‑ a rosuvastatin. V Japonsku je dostupný ještě pitavastatin, který je v současné době schvalován pro použití v Evropě.
Všechny statiny mají více nebo méně důkazů z intervenčních studií – pyramida statinových studií je uvedena na obr. 3.
Obr. 3. Pyramida statinových studií. 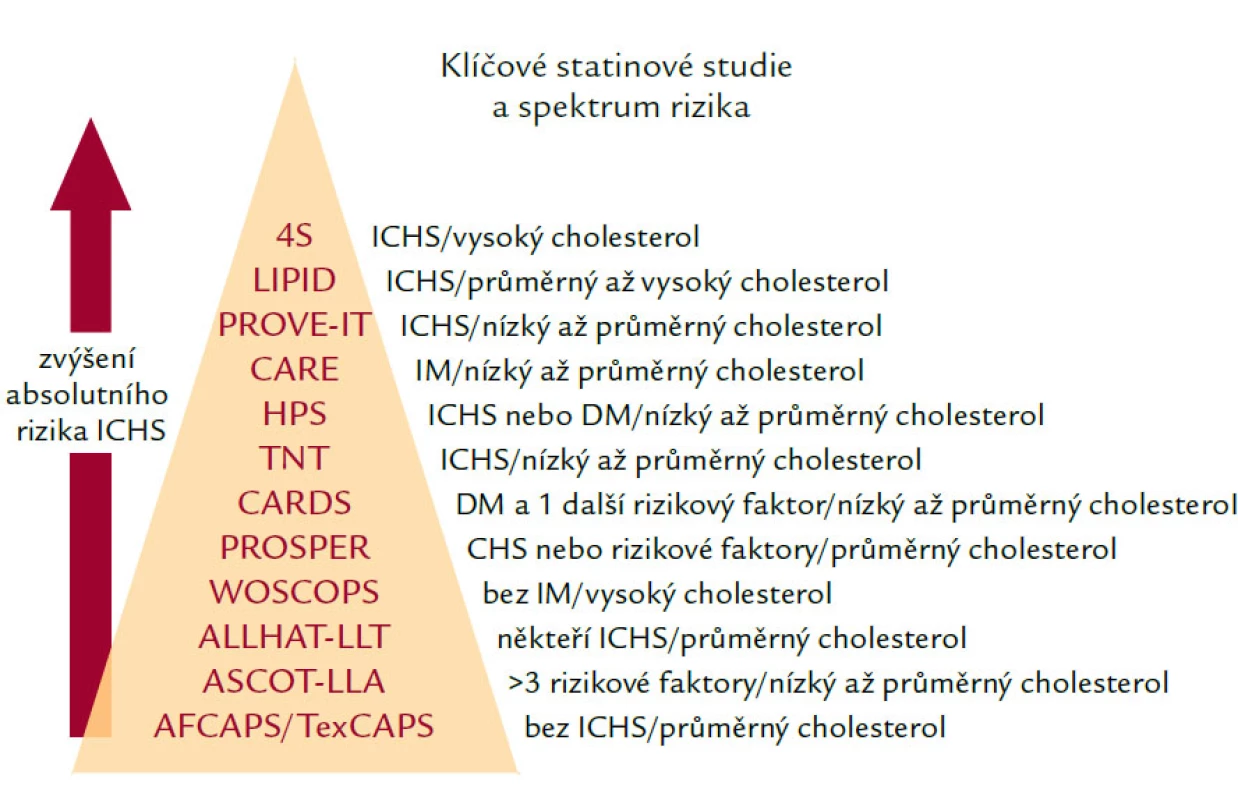
Ezetimib – inhibitor vstřebávání cholesterolu
Ezetimib inhibuje absorpci cholesterolu a představuje v současné době největší novinku v léčbě HLP/DLP. Mechanizmus jeho účinku je znázorněn na obr. 4. Ezetimib blokuje absorpci cholesterolu pravděpodobně přímou blokádou předpokládaného transportéru cholesterolu v kartáčovém lemu buněk intestinální mukózy. Snížení absorbce cholesterolu ve střevě povede ke zvýšené jaterní syntéze cholesterolu! Tomuto nežádoucímu účinku můžeme zabránit blokádou jaterní syntézy statinem. Tento kombinovaný postup nazýváme duální inhibicí. Ezetimib se užívá v uniformní dávce 10 mg a snižuje LDL‑cholesterol o 15–20 %. I když je tak zjevně méně účinný než statiny, lze předpokládat jeho využití především v kombinaci s těmito léky. Kombinace ezetimibu s 10 mg simvastatinu vedla ke snížení LDL‑cholesterolu o více než 50 %!
Obr. 4. Mechanizmus účinku ezetimibu. 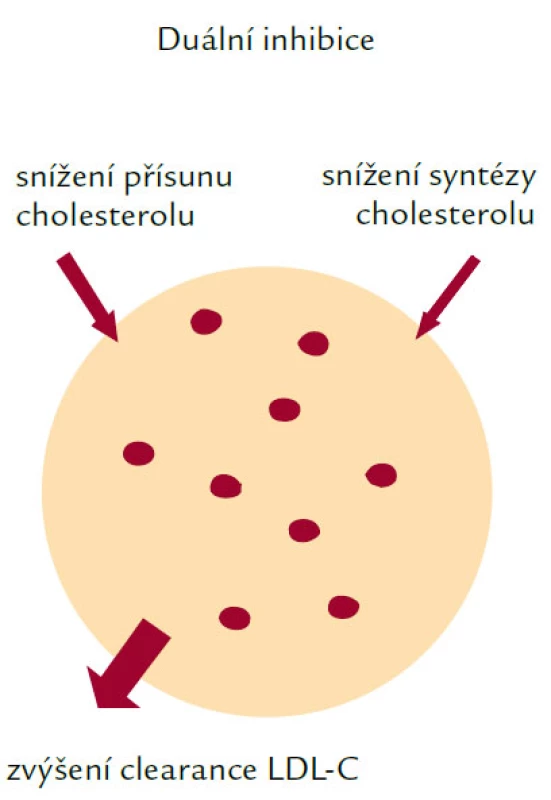
Pravdou bohužel je, že zatím musíme u ezetimibu čekat na výsledky velkých morbiditně mortalitních studií, jejichž publikace se očekává až za 2 či 3 roky. V každém případě je vhodné využívat ezetimib do kombinace se statiny.
Reziduální riziko – ovlivnění HDL‑C a TG
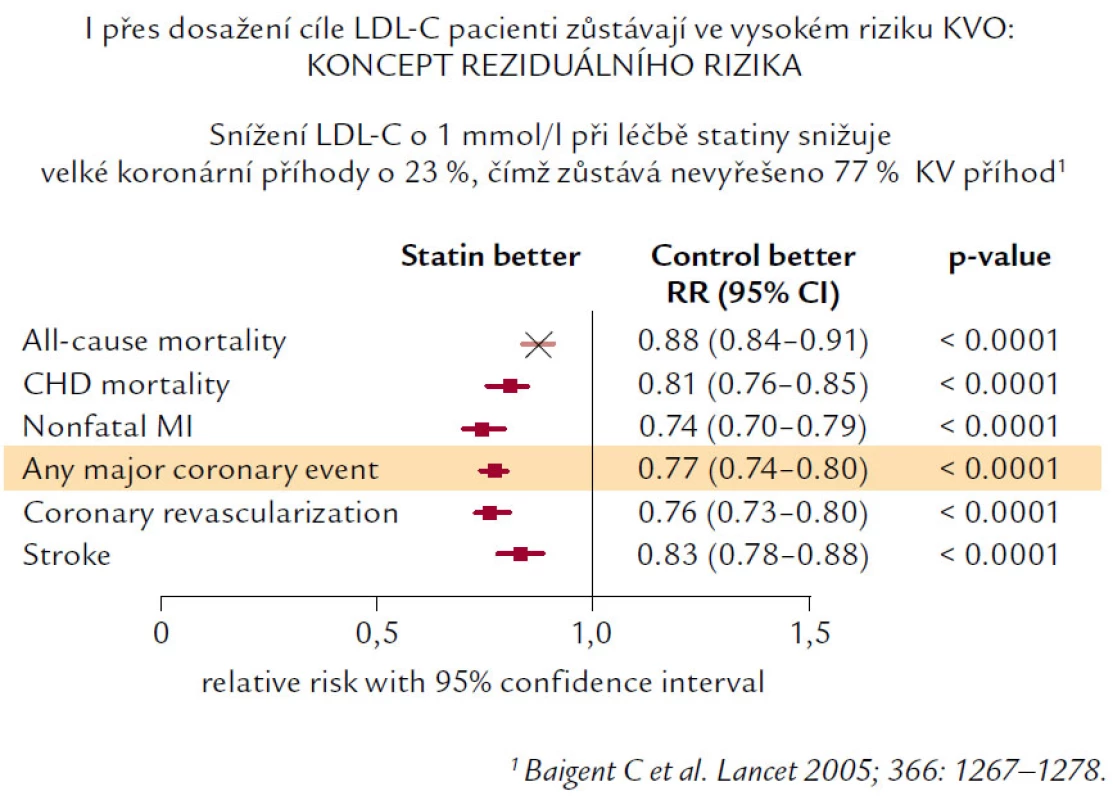
Navzdory jednoznačnému a nezpochybnitelnému snížení KV morbidity a mortality statiny mnoho nemocných i v aktivně léčené skupině prodělá KV příhodu. A právě proto, že u pacientů přetrvává stále navzdory léčbě KV riziko, vznikl koncept reziduálního rizika a současně i snaha o jeho redukci. Reziduální KV riziko je definováno jako KV riziko, které zůstává po léčbě statiny (obr. 5).
Zdrojem reziduálního rizika jsou samozřejmě další rizikové faktory (hypertenze, diabetes, kouření cigaret atd.), ale i HLP a DLP – zejména jejich neovlivněné nebo nedostatečně ovlivněné složky. Jedná se především o patologické koncentrace HDL‑C a triglyceridů. Z hlediska nemocných s obezitou, především centrálního typu, stejně jako z hlediska nemocných s metabolickým syndromem je důležitý fakt, že právě u nich se typicky vyskytuje „diabetická“ DLP, charakterizovaná nízkou hladinou HDL‑C a zvýšenými hladinami triglyceridů, navíc pak i změnou kvality lipoproteinových částic (ve prospěch malých, denzních LDL, ale i aterogenních malých denzních HDL částic).
Redukce reziduálního rizika se dostává v současné době mezi nejdůležitější úkoly v preventivní kardiologii, především pak právě u nemocných s metabolickým syndromem, abdominální obezitou a DM 2. typu.
Ovlivnění HDL‑C – niacin
Samozřejmě, že velká pozornost je věnována zvýšení HDL‑C. Nejúčinněji ze všech současných léků zvyšuje HDL‑C niacin. Niacin je lékem velmi tradičním, jako hypolipidemikum je užíván již více než půl století. Niacin má i přesvědčivá data. Zvyšuje HDL‑C o 20–30 % velmi konzistentně ve všech studiích. A stařičký Coronary Drug Project (obr. 6) pak přináší pozitivní data z hlediska mortality, KV příhod (IM, CMP), tak i redukce potřeby kardiovaskulární chirurgie.
Obr. 6. Coronary Drug Project (niacin). 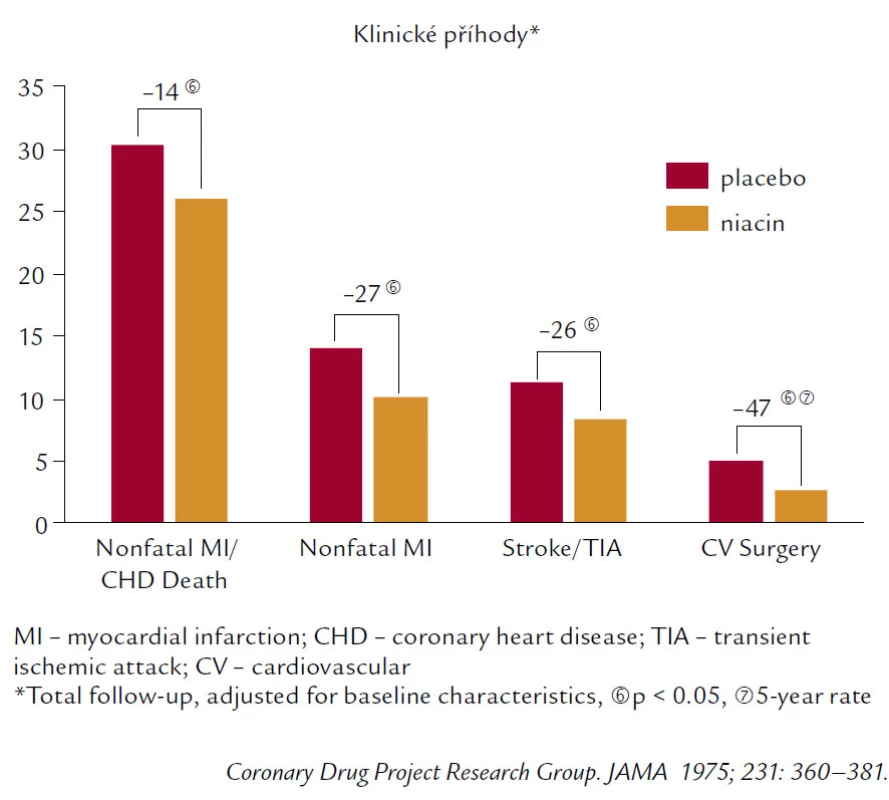
Jediným zásadním problémem a limitací podávání niacinu byl dosud především vysoký výskyt nežádoucích účinků, zejména flushe – zrudnutí a svědění obličeje a někdy celé horní části těla. Kombinace niacinu s laropiprantem zajišťuje výrazné omezení nežádoucích účinků, které dosud limitovaly jeho podání.
Po několika týdnech léčby flush, který se vyskytuje u nižšího procenta nemocných, prakticky vymizí. Musíme ale vědět, že se vyskytnout může. A zde je největší problém. Jako lékaři jsme nyní naučení lék předepsat, podat a rozhodně není naší prioritou začít vysvětlovat nemocnému že: „…zrudne, bude ho svědit kůže, ale že se to vše možná u něj vůbec neprojeví a když tak že příznaky v historicky krátké době vymizí.“ A hlavně! Že to pacientovi stojí za to vydržet, že je to lék, který mu opravdu může zachránit (prodloužit) kvalitní život! Je velkou výhodou, máme‑li vyškolený tým (sestry dokážou být velmi empatické a nemocnému vysvětlit mnohé lépe než my), který i v oblasti nežádoucích účinků může zásadně prospět.
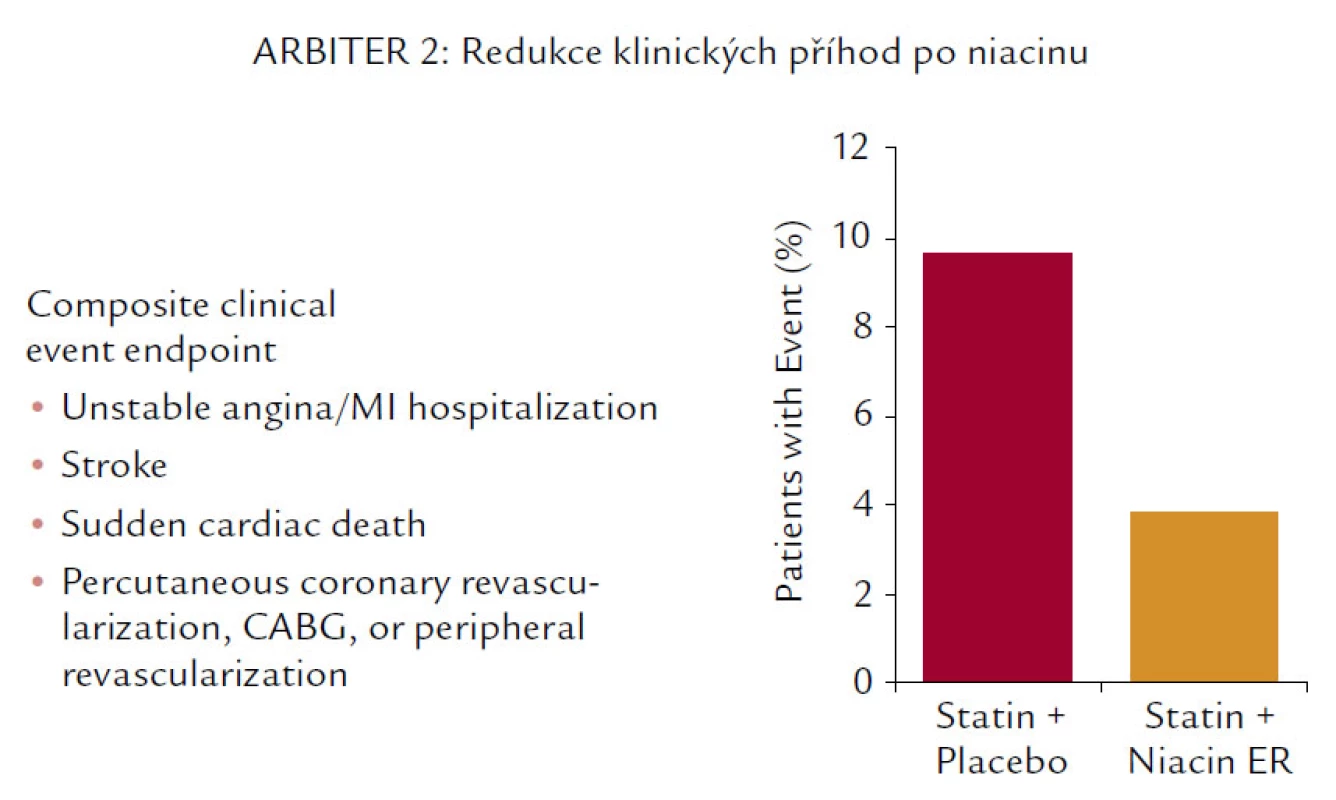
Nejen studie ARBITER 2 (obr. 7) prokázala (i když na menším počtu pacientů) redukci KV příhod.
Přehled konzistentně pozitivně vycházejících studií s niacinem shrnuje tab. 1.
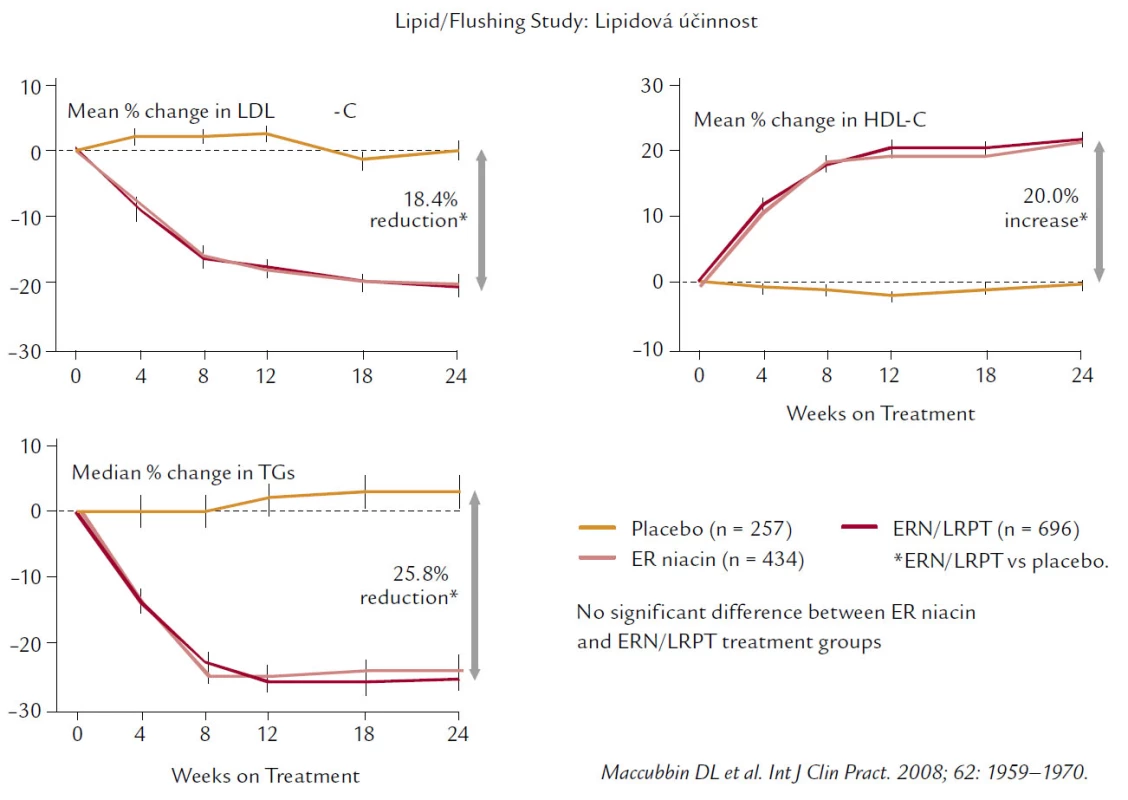
Neměli bychom zapomínat na to, že niacin ovlivňuje nejen HDL‑C, ale významně snižuje TG (o 20–30 %) i LDL‑C (asi o 20 %) (obr. 8).
Navíc snižuje i koncentraci Lp(a). Není proto divu, že studie (i když pohříchu menší, pouze několik set nemocných zahrnující) vycházejí až neuvěřitelně dobře. Ve studii HATS je prokázán nejen pozitivní účinek na progresi, resp. regresi aterosklerózy, ale i neuvěřitelná, statisticky významná (i když zatížená malými čísly) 80% redukce KV mortality. 60% pokles KV příhod ale popisuje i studie ARBITER 2, která byla primárně zaměřena na sledování intimo‑mediální tloušťky karotických arterií. A konečně poslední studie s hypolipidemiky, studie ARBITER 6 HALTS, která srovnávala účinky kombinace statin + ezetimib vs statin + niacin, opět prokázala (sledována byla intimo‑mediální tloušťka), že komplexní ovlivnění LDL‑C, HDL‑C a TG bylo účinnější než maximální snížení LDL‑C (obr. 9).
Obr. 9. Studie ARBITER 6 HALTS. 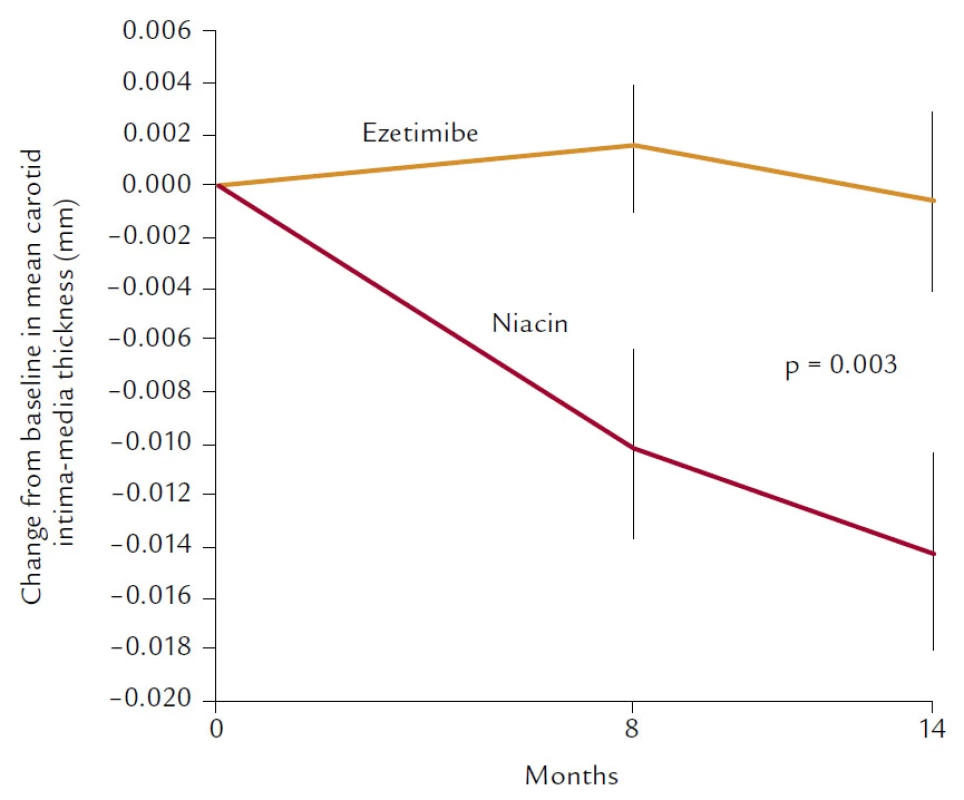
Právě studii ARBITER 6 HALTS bychom právě proto mohli považovat za důkaz účinnosti snižování reziduálního rizika.
Jestliže hovoříme o niacinu (a ostatně v kontextu ovlivnění reziduálního rizika to platí dvojnásob), měli bychom uvést, že v současné době se niacin podává prakticky vždy „on top“ zavedené statinové terapie. A tak se vlastně dostáváme k poslední části tohoto sdělení, ke kombinační léčbě. Ale ještě pár slov k léčbě fibráty.
Fibráty – ovlivnění triglyceridů a také HDL‑C
To, že léčba nemocných s hypertriglyceridemií fibráty snižuje KV riziko, je prokázáno v řadě studií. Přesto zcela přesvědčivý je výsledek studie BIP, která u celé populace nevyšla (pozitivní trend ke snížení rizika nebyl významný), u podskupiny nemocných s hypertriglyceridemií byl pokles KV příhod téměř 40 %!
Tento výsledek ale velmi dobře koresponduje s výsledky předchozích „ryze fibrátových“ studií, které vždy vycházely pozitivně buď pouze, nebo výrazněji pozitivně právě u nemocných s nízkým HDL‑C a zvýšenými triglyceridy. Stejně tak dopadla i studie ACCORD, ve které byl fenofibrát kombinován se simvastatinem (tab. 2).
V medicíně a v léčbě HLP/DLP prostě neexistují úplně jednoduchá řešení. Existují skupiny nemocných, pro které důkazy máme a kteří budou ze specifické léčby mít užitek, zatímco jiní tuto léčbu nemají užívat. Ale i v tom je krása medicíny, sami musíme najít správné léky pro správného pacienta.
Kombinační léčba
Již opakovaně jsme uváděli, že problematika HLP a DLP je za velmi podobnými diagnózami v různých aspektech zpožděna o desítku(y) let. Stále je velmi rozšířené tvrzení, že máme statiny, a ty řeší vše. Velmi bych statiny přirovnal k ACE inhibitorům a léčbě hypertenze. Statiny jsou skvělé. Ale podobně jako 70 % hypertoniků potřebuje kombinační léčbu, bude využití kombinační léčby přibývat i v oblasti terapie HLP a DLP. Pokusili jsme se to, jak by kombinační léčba mohla vypadat, shrnout do tab. 3.
Závěry pro praxi – trochu subjektivně:
- Statiny jsou základem léčby HLP/DLP,protože LDL‑C je základním cílem terapie v prevenci KVO.
- Stále častěji budeme používat kombinační léčbu. Základem kombinace je vždy statin a pak následuje:
- Kombinace pro komplexní ovlivnění lipidového spektra: niacin, fibráty.
- Kombinace pro prohloubení účinku na LDL‑C: niacin, ezetimib, pryskyřice.
- Budeme využívat kombinací 3 i více léků (znáte nějaké onemocnění, kde 1 lék vyléčí vše, jak se čeká od statinů? 70 % hypertoniků má kombinaci!)
V léčbě HLP/DLP je primárním cílem ovlivnění LDL‑C, nezbytné je však vždy zvažovat i reziduální riziko a jeho ovlivnění. Kombinační léčba bude mít zásadní roli v obou situacích.
Zcela závěrem se omlouvám kolegům, kteří hledali úplné novinky. Ale mipomersen, darapladib, eprotirom i nové CETP inhibitory ještě čeká dlouhá cesta několika let do klinické praxe.
Práce byla podpořena granty: IGA MZ ČR 10589-3, IGA MZ ČR 10579-3 a záměrem MŠMT 00216 208 07.
Doručeno do redakce: 31. 5. 2010
prof. MUDr. Richard Češka, CSc.
www.vfn.cz
e‑mail: rcesk@lf1.cuni.cz
Zdroje
1. Kassan M, Montero MJ, Sevilla MA. Chronic treatment with pravastatin prevents early cardiovascular changes in spontaneously hypertensive rats. Br J Pharmacol 2009; 158 : 541–547.
2. Ridker PM, Rifai N, Pfeffer MA et al. Inflammation, pravastatin, and the risk of coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events (CARE) Investigators. Circulation 1998; 98 : 839–844.
3. Ridker PM, Morrow DA, Rose LM et al. Relative efficacy of atorvastatin 80 mg and pravastatin 40 mg in achieving the dual goals of low‑density lipoprotein cholesterol < 70 mg/dl and C‑reactive protein < 2 mg/l: an analysis of the PROVE‑IT TIMI‑22 trial. J Am Coll Cardiol 2005; 45 : 1644–1648.
4. Vetrugno V, Di Bari MA, Nonno R et al. Oral pravastatin prolongs survival time of scrapie‑infected mice. J GenVirol 2009; 90 : 1775–1780.
5. Redecha P, van Rooijen N, Torry D et al. Pravastatin prevents miscarriages in mice: role of tissue factor in placental and fetal injury. Blood 2009; 113 : 4101–4109.
6. Executive summary of the third report of the NCEP expert panel on detection, evaluation and treatment of high blood cholesterol in adults (Adult treatment panel III). JAMA 2001; 285 : 2486–2497.
7. Haffner SM. Coronary heart disease in patients with diabetes. N Engl J Med 2000; 342 : 1040–1042.
8. Keech AC, Mitchell P, Summanen PA et al. Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study): a randomised controlled trial. Lancet 2007; 370 : 1687–1697.
9. Svačina Š. Metabolický syndrome. Praha: Triton 2001.
10. ADA, NHLBI, AHA et al. Diabetes mellitus: A major risk factor for cardiovascular disease. Circulation 1999; 100 : 1132–1133.
11. O’Keefe JH Jr, Miles JM, Harris WH et al. Improving the adverse cardiovascular prognosis of type 2 diabetes. Mayo Clin Proc 1999; 74 : 171–180.
12. Češka R et al. Cholesterol a ateroskleróza. Léčba dyslipidémií. Praha: Triton 2005.
13. Shepherd J. Combined lipid lowering drug therapy for the effective treatment of hypercholesterolemia. Eur Heart J 2003; 24 : 685–689.
14. Brousseau ME, Schaefer EJ, Wolfe ML et al. Effects of an inhibitor of cholesteryl ester transfer protein in HDL cholesterol. N Engl J Med 2004; 350 : 1505–1515.
15. Mazzone T. HDL cholesterol and atherosclerosis. Lancet 2007; 370 : 107–108.
16. Qin S, Koga T, Ganji SH et al. Rosuvastatin selectively stimulates apo A‑I but not apo A‑II synthesis in Hep G2 cells. Metabolism 2008; 57 : 973–979.
17. Ballantyne CM, Raichlen JS, Nicholls SJ et al. Effect of rosuvastatin therapy on coronary artery stenoses assessed by quantitative coronary angiography: a study to evaluate the effect of rosuvastatin on intravascular ultrasound‑derived coronary atheroma burden. Circulation 2008; 117 : 2458–2466.
18. Robins SJ, Collins D, Wittes JT et al. Relation of gemfibrozil treatment and lipid levels with major coronary events, VA‑HIT: A randomized controlled trial. JAMA 2001; 285 : 1585–1591.
19. Jones PH, Davidson MH, Stein EA et al. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin and pravastatin across doses (STELLAR Trial). Am J Cardiol 2003; 93 : 152–160.
20. Law MR, Wald NJ, Rudnicka AR. Quantifying effect of statins on low density lipoproteid cholesterol, ischaemic heart disease and stroke: systematic review and meta‑analysis. BMJ 2003; 326 : 1423.
21. Sacks FM. Low‑density lipoprotein lowering therapy: an analysis of the option. J Am Coll Cardiol 2002; 40 : 2135–2138.
22. Shepherd J. Combined lipid lowering drug therapy for the effective treatment of hypercholesterolemia. Eur Heart J 2003; 24 : 685–689.
23. Davidson MH, McGarry T, Bettis R et al. Ezetimibe coadministered with simvastatin in patients with primary hypercholesterolemia. J Am Coll Cardiol 2002; 40 : 2125–2134.
24. Keating GM, Robinson DM. Rosuvastatin: a review of its effect on atherosclerosis. Am J Cardiovasc Drugs 2008; 8 : 127–146.
25. Fruchart JC, Sacks F, Hermans MP et al. The residual risk reduction initiative: a call to action to reduce residual vascular risk in patients with dyslipidemia. Am J Cardiol 2008; 102 (Suppl 10): 1K–34K.
26. Fruchart JC, Sacks F, Hermans MP et al. The residual risk reduction initiative: a call to action to reduce residual vascular risk in dyslipidaemic patients. Diab Vasc Dis Res 2008; 5 : 319–325.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Veda a medicína
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Pregabalin je účinné léčivo s příznivým bezpečnostním profilem pro pacienty s neuropatickou bolestí
-
Všechny články tohoto čísla
- K významnému životnímu jubileu prof. MUDr. Jaroslava Blahoše, DrSc.,
- Prof. MUDr. Jaroslav Blahoš, DrSc., jubilující
- Váženému pánovi prof. MUDr. Jaroslavovi Blahošovi, DrSc.
- Váženému pánovi profesorovi MUDr. Jaroslavovi Blahošovi, DrSc.
- Veda a medicína
- Hyperlipoproteinemie a dyslipoproteinemie II. Terapie: Nefarmakologická a farmakologická léčba
- Chronická pankreatitida a skelet
- Nezbytnost soustavného rozvoje rozsáhlého systému péče o zdraví
- Elektrokardiografické markery u pacientov s hypertrofickou kardiomyopatiou
- Mezinárodní kurz NATO pro nácvik a výuku řešení situací s hromadným výskytem raněných
- Přežití a kvalita života u popálenin
- 12 rokov kontinuálneho medicínskeho vzdelávania na Slovensku
- Hypofyzární adenomy – kam směřuje léčba na počátku 21. století?
- Kyselina oxalová – významný uremický toxín
- Vplyv testosterónu na kardiovaskulárne ochorenia u mužov
- Současné možnosti a principy patomorfologické diagnostiky nádorů
- Nátriuretické peptidy pri aortovej stenóze
- Kardiovaskulárne ochorenia u reumatoidnej artritídy
- Zásady péče o pacienty s intermitentními klaudikacemi
- Trnitá cesta metabolického syndromu prosadit se v praxi
- Diabetická osteopatie: onemocnění kdysi sporné a pravděpodobně významné
- Dočkáme se protinádorových vakcín?
- Současné možnosti léčby osteoporózy
- Technika zaťažovania skeletu so spätnou väzbou v rehabilitácií osteoporotického pacienta (Biomechanická analýza)
- Index pevnosti femuru versus hustota kostného minerálu: nové poznatky (Slovenská epidemiologická štúdia)
- Laboratorní diagnostika a endokrinologie
- Infekcia parvovírusom B19 – príčina závažnej anémie po transplantácii obličky
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Laboratorní diagnostika a endokrinologie
- Vplyv testosterónu na kardiovaskulárne ochorenia u mužov
- Infekcia parvovírusom B19 – príčina závažnej anémie po transplantácii obličky
- Chronická pankreatitida a skelet
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání