-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infekce tepenných rekonstrukcí: praktický pohled
Blood vessel reconstruction infections: a practical view
Infection represents a serious complication in vascular surgery. The average of 2-3 % of reconstructions are involved. The article offers a review of current diagnosis and treatment of infection after vascular reconstruction. Emphasis is put on early diagnosis and its impact on prognosis of patients. We summarize the practical potential of surgical treatment. The situation is illustrated by our results from the years 2004-2006. During the last 3 years 19 patients were operated on for infection of the arterial reconstruction (15ways aorto-femoral and 4ways femoro-popliteal bypass). The main agent was Staphylococcus aureus (9 patients, i.e. 47.4 %). In most cases explantation of the whole infected reconstruction was performed (13 patients). The early mortality rate is 26.3 %. Amputation was necessary in 6 patients (i.e. 31.5 %). Our results are fully comparable to those from other centres of vascular surgery.
Key words:
infection - vascular prosthesis - reconstruction - sepsis
Autoři: M. Krejčí; Z. Gregor; Z. Kříž; J. Podlaha; Z. Konečný; M. Dvořák
Působiště autorů: II. chirurgická klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MUDr. Zdeněk Gregor, CSc.
Vyšlo v časopise: Vnitř Lék 2008; 54(2): 178-182
Kategorie: Přehledný referát
Souhrn
Infekce představuje vážnou komplikaci v cévní chirurgii. Postihuje v průměru 2-3 % rekonstrukcí. Předkládaný článek podává ucelený pohled na současnou diagnostiku a léčbu infekce cévních rekonstrukcí. Důraz je kladen na časnou diagnostiku a její vliv na prognózu nemocných. Shrnujeme reálné možnosti operačního řešení infekce. Situaci ilustrují naše výsledky v letech 2004–2006. Během uplynulých 3 let bylo operováno 19 pacientů pro infekci tepenné rekonstrukce (15krát aorto-femorální a 4krát femoro-popliteální bypass). Původcem byl nejčastěji Staphylococcus aureus (9 pacientů, tedy 47,4 %). Nejčastěji byla provedena explantace celé infikované rekonstrukce (13 pacientů). Časná mortalita dosahuje 26,3 %. Amputace byla nutná u 6 pacientů (tj. 31,5 %). Naše výsledky jsou srovnatelné s jinými centry cévní chirurgie.
Klíčová slova:
infekce - cévní protéza - rekonstrukce - sepseÚvod
Cévní chirurgie představuje vysoce specializované odvětví medicíny. Při diagnostice a řešení akutních i chronických onemocnění cév hraje důležitou roli úzká spolupráce s interními obory, zejména angiology a diabetology. Zvláštní postavení má radiodiagnostika a rozvoj perkutánních angioplastik. Na léčbě se významně podílejí také anesteziologové.
Množství angiochirurgických výkonů i přes perkutánní intervence neustále narůstá. Mnohdy jde o pacienty, kteří pro komorbidity, přítomnosti endogenní infekce a věku ještě před několika lety nebyli operováni. S tím je spojen i výskyt širokého spektra komplikací. Možnosti jejich řešení jsou často omezené. Mezi nejzávažnější a prognosticky nepříznivé stavy patří infekce tepenných rekonstrukcí.
Infekce
Infekce komplikuje asi 2-3 % angiochirurgických výkonů [5,8]. Jde o multifaktoriální onemocnění, při němž jen některé faktory lze ovlivnit. Řešení těchto komplikací je často velice obtížné. Je spojeno s rizikem ztráty končetiny nebo i úmrtím. Komplikace mají vysokou morbiditu a mortalitu v důsledku sepse [15]. Proto je vhodné soustřeďovat tyto pacienty do specializovaných center cévní chirurgie, která mají dostatečné zkušenosti, diagnostické a terapeutické možnosti.
Rekonstrukční cévní výkony
Primární tepenné rekonstrukční výkony zahrnují zejména aorto-femorální rekonstrukce (pro aterosklerotické postižení či pro aneuryzma břišní aorty, včetně ruptury), femoro-popliteální, krurální a pedální bypassy, operace karotid. Velkou skupinou cévních rekonstrukcí je zakládání arteriovenózních spojek pro hemodialýzu. Významnou část operativy představují také reoperace, plastiky anastomóz, trombembolektomie.
Je-li to možné, je k rekonstrukci periferních cév vždy využita autologní v. saphena magna jako záplata či bypass. Alternativu představuje použití cévní náhrady (pletená protéza z polyesterového hedvábí, protéza z expandovaného polytetrafluoretylenu apod). Implantace umělých cévních náhrad je však spojena s vyšším rizikem infekce. Před použitím protézy je proto nutno pečlivě uvážit indikace výkonu, naléhavost a nevyhnutelnost operace. Další možnost představuje použití zmrazených či čerstvých tepenných aloštěpů [1]. Jejich aplikace v primární rekonstrukční cévní chirurgii jsou, stejně jako použití biosyntetických náhrad, limitované. Využití cév připravených uměle metodami molekulárního inženýrství je ve stadiu výzkumu [4].
Před tepennou rekonstrukcí je důležitá sanace eventuální chronické infekce v organizmu. Velké riziko pozdní infekce představuje zejména přítomnost defektu končetiny v době cévní rekonstrukce. Proto se preferuje užití autologní žíly. Významné jsou i komorbidity pacienta, zejména generalizované aterosklerotické postižení, diabetes mellitus, renální insuficience, abúzus nikotinu, kompliance pacienta [9]. Samostatnou kapitolu představuje infekční nebo mykotické aneuryzma [11].
Samozřejmostí je přísné dodržování perioperační asepse a antiseptických opatření. Při implantaci cévní protézy je podáváno profylakticky antibiotikum (dnes nejčastěji cefalosporiny I. generace). Operuje se v prostředí chráněného koagula, jde o snahu zabránit kolonizaci rekonstrukce bezprostředně po implantaci. Právě toto období je totiž považováno za vulnerabilní z hlediska možného infikování cévní protézy, která má k infekci zvýšenou afinitu [15]. I přes snahy výrobců cévních náhrad dosud nebyla vyrobena cévní protéza rezistentní vůči infekci.
Z pohledu operační lokality je největším rizikem infekce zatížen výkon v třísle (preparace a. femoralis communis, superficialis a profunda z podélného řezu). Jde o oblast častého intertriga, mykotického postižení. Hojení rány je silně rušeno ohybem kůže a potom probíhá per secundam intentionem. Riziko infekce se zvyšuje s reoperacemi ve stejné oblasti.
Význam má také operační čas při tepenné rekonstrukci, a tedy doba expozice tepen. Zřetelně méně infekčních komplikací se objevuje po operacích magistrálních tepen na krku v porovnání s delšími operacemi abdominální aorty a tepen dolních končetin [10,13]. Jistou výjimku tvoří laparoskopicky či roboticky asistované cévní operace. U těchto postupů ještě nebyla - vzhledem k relativně krátké době klinického využití - přesně stanovena rizika infekčních komplikací.
Infekční komplikace
Pacienty po cévních rekonstrukčních výkonech sledujeme v pravidelných intervalech v naší cévní ambulanci.
Zdravotnický personál v první linii (ošetřující lékař) i pacient mají myslet na možnost infekce rekonstrukce v následujících situacích: febrilní stavy, bolesti, zarudnutí a hnisavá sekrece v ranách, hematemeze nebo meléna, ev. trombóza rekonstrukce (není při infekci pravidlem!) s projevy končetinové ischemie. Nemocný musí být odeslán na specializované pracoviště cévní chirurgie k došetření.
Mezi nesprávné postupy se řadí např. léčba pacienta na neurologii či urologii pro bolesti zad při infekci aortofemorální rekonstrukce. Jiným příkladem je pacient, vyšetřovaný pro hematemezi a melénu. Přestože byly jasně viditelné jizvy po střední laparotomii a preparaci v obou tříslech, byla provedena gastrofibroskopie, během níž endoskopista popsal ulceraci duodena a snažil se odebrat biopsii z cizího materiálu, viditelného skrze defekt ve stěně duodena. Pacienta by měl urgentně překládat na pracoviště cévní chirurgie s diagnózou aorto-duodenální píštěle, hrozící exsangvinací. Je znám i případ, při jehož řešení se ambulantní lékař pokoušel o repozici domnělé tříselné kýly. Pacient byl následně operován pro pseudovýduť v anastomóze infikované cévní rekonstrukce v třísle.
Infekce se může projevit zcela nespecifickými obtížemi. Důležitá je vždy pečlivá anamnéza a klinické vyšetření pacienta. Nezbytné je na tuto možnou komplikaci pomyslet. Pokud se správně a včas stanoví diagnóza infekce, získává pacient doslova šanci na přežití.
Po vyšetření pacienta a vyslovení podezření na infekci cévní náhrady je nutno pečlivě zvažovat další postup. Aplikace někdy i vysokých dávek nízkomolekulárního heparinu (ve snaze zabránit trombóze rekonstrukce) může zkomplikovat další diagnostický i terapeutický postup.
Diagnostika
V diagnostice infekce hraje vedle klinického vyšetření hlavní roli ultrasonografie. Odhalí retenci tekutiny v okolí rekonstrukce a potvrdí její průchodnost. V oblasti aorty a pánevních tepen využíváme CT vyšetření s kontrastní látkou. Alternativou je zobrazení magnetickou rezonancí, je indikována výjimečně. Angiografie je využívána k plánování terapeutického postupu.
K potvrzení protézo-kutánní píštěle lze využít klasickou fistulografii. Nezastupitelnou roli hraje kultivační vyšetření k nasazení antibiotické terapie dle citlivosti. Při podezření na aorto-enterickou píštěl může v diagnostice pomoci i akutní gastrofibroskopické vyšetření celé horní etáže trávicího traktu až po distální úsek duodena [5]. Trvá-li podezření na infekci rekonstrukce při negativitě uvedených vyšetření, lze využít PET (pozitronovou emisní tomografii), ev. v kombinaci s CT (obr. 1). Možné je i vyšetření radioaktivně značenými leukocyty [3].
Obr. 1. PET (pozitronová emisní tomografie) – zvýšený metabolizmus v retroperitoneu při infekci bifurkační cévní protézy. 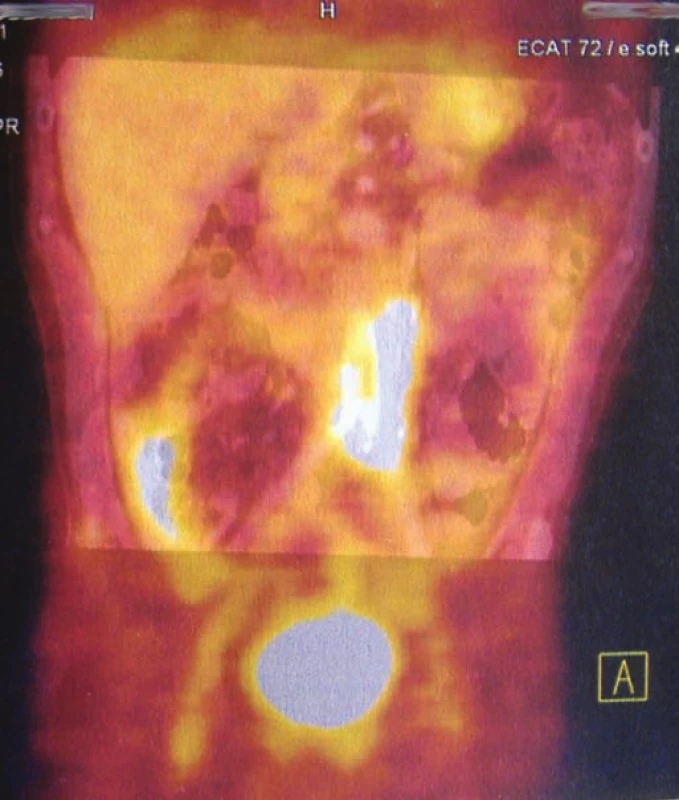
Klasifikace infekce
V praxi se nejčastěji užívá modifikovaná klasifikace dle Szilágyiho z roku 1972 [14]:
- I. stupeň - infekce kůže
- II. stupeň - infekce zasahuje do podkoží nad rekonstrukcí
- III. stupeň - infekce postihuje cévní rekonstrukci
Do 30 dnů po primární cévní operaci se infekce označuje jako časná, po 1 měsíci od implantace jako pozdní. Infekce rekonstrukce se může objevit i v odstupu 10 a více let po primární operaci.
Bakteriologie
Původcem infekce je nejčastěji Staphylococcus aureus, Staphylococcus epidermidis a gramnegativní bakterie, především Escherichia coli. V literatuře se objevují již informace o infekci MRSA (Methicilin-rezistentní Staphylococcus aureus). Ve čtvrtině až polovině případů jsou výsledky kultivace negativní i přes makroskopicky jasnou infekci rekonstrukce (Szilágyi III).
Terapie
Ačkoliv některé práce referují o možnosti léčby infekce dlouhodobou laváží dané lokality (dezinfekčními roztoky či antibiotiky), obecně je přijímán názor, že infikovanou cévní protézu není možné infekce zbavit a tyto postupy infekci jen dočasně potlačí [12].
Pacient je léčen antibiotiky, zpočátku empiricky (nejčastěji cefalosporiny 1. a 2. generace) s úpravou dle citlivosti. Do operace je udržován klidový režim a sledování. V případě krvácení z anastomózy je nutná urgentní operace, zatížená vysokou mortalitou.
V duchu zásady „ubi pus, ibi evacua“ je nejčastěji provedena incize v místě retence purulentní tekutiny a drenáž. Eventuálně je v této fázi založena kontinuální laváž infikované lokality dezinfekčním roztokem. Po interním došetření a kompenzaci stavu pacienta následuje v druhé době explantace cévní rekonstrukce [9]. Není-li prokrvení končetiny dostatečné, je založena extra-anatomická rekonstrukce [8]. Nejvíce využíváme axilo-femorální bypass, ev. doplněný o cross-over (zkřížený) bypass femoro-femorální. V případě nepříznivého stavu periferních tepen je nevyhnutelná amputace těžce ischemické končetiny (obr. 2).
Obr. 2. Infikovaná bifurkační cévní protéza (peroperační foto). 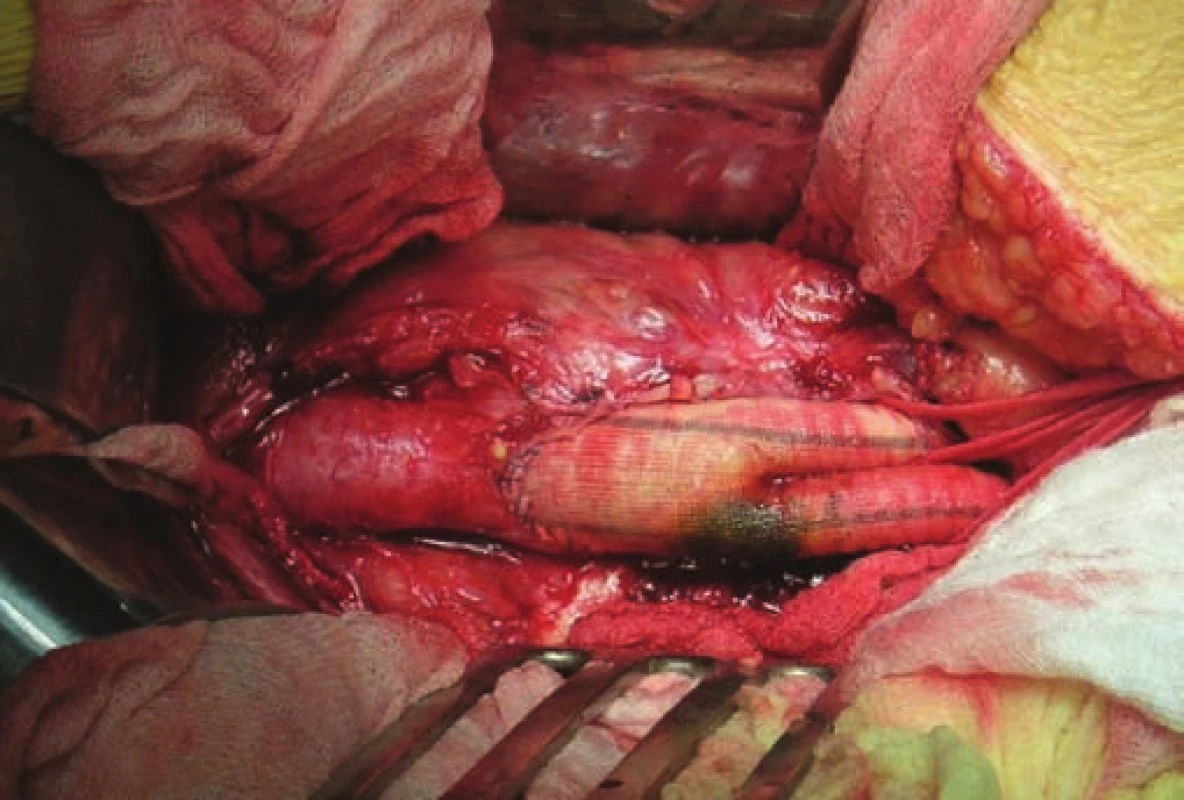
V literatuře je často zmiňován pokus o zachování části rekonstrukce. Z hlediska dlouhodobého sledování může ale infekce pokračovat ve zbytku rekonstrukce dále, se všemi přidruženými riziky [12]. Možností je náhrada novou rekonstrukcí in situ. Po explantaci infikované rekonstrukce používáme pro revaskularizaci končetin také hlubokého žilního systému dolní končetiny - v. femoralis superficialis a v. poplitea [2,6,7,15]. Výsledky použití tepenných alograftů a protéz impregnovaných solí stříbra či antibiotikem (rifampicin) jsou stále sporné.
Další léčba po explantaci rekonstrukce závisí na stavu pacienta. Nezbytná je multidisciplinární spolupráce. Dlouhodobě podáváme antibiotika po konzultaci s antibiotickým střediskem, léčíme reperfuzní syndrom [5].
Podle stupně postižení tepenného systému podáváme po explantaci infikované rekonstrukce nefrakcionovaný či nízkomolekulární heparin. Následně je pacient převeden na antiagregační terapii, nebo, při těžším cévním postižení, na perorální antikoagulaci warfarinem. Pak jsou nutné pravidelné ambulantní kontroly koagulačních parametrů (Quick mezi 0,25 - 0,35, odpovídá INR 2,2 - 2,8). Nověji mohou pacienti využívat i osobní monitory koagulace.
Antiagregační terapie je dnes doporučována k prevenci trombózy tepenných rekonstrukcí. V případě extraanatomické rekonstrukce a těžkého postižení končetinových tepen je však krevní průtok tak nízký, že antiagregace nemusí udržet průchodnosti cév. Je využívána zejména u pacientů, jejichž snížená kompliance či interní a hematologické kontraindikace znemožňují užívání kumarinových derivátů.
Prognóza
Všichni nemocní jsou před propuštěním důkladně poučeni. Zejména extra-anatomické rekonstrukce jsou zatíženy vysokým rizikem trombózy (a to i při účinné warfarinizaci). Opakované trombektomie jsou zde běžnou součástí terapie a jsou odpovědné za příznivé výsledky sekundární průchodnosti těchto rekonstrukcí. Ojedinělá není ani infekce extra-anatomicky vedeného bypassu s nutností jeho explantace. Pacient je trvale léčen vazodilatancii, efekt mají i pravidelné série vazodilatačních infuzí.
Prognosticky nejméně příznivá je infekce aorto-femorální cévní protézy po resekci aneuryzmatu abdominální aorty. Zde jsou anastomózy provedeny metodou end-to-end. Původní ilické řečiště je tedy zcela vyřazeno vzhledem k riziku progrese, ev. aneuryzmatické dilatace pánevního řečiště (na rozdíl od operace pro aterosklerotické postižení, při níž je tepenný systém v pánvi zachován). V případě explantace cévní protézy pro infekt není pak možné dostatečné prokrvení končetin původním řečištěm. K záchraně dolních končetin (pomineme-li zatím omezeně užívané tepenné alografty či impregnované cévní náhrady) je nutná u těchto pacientů extra-anatomická rekonstrukce.
Pokud není možné extra-anatomickou rekonstrukci založit (stenóza a. subclavia oboustranně, infekce v zamýšleném průběhu protézy na laterální straně trupu) či dojde k infikaci této protézy s nutností její explantace, je často nevyhnutelná vysoká amputace obou dolních končetin až exartikulace v kyčelních kloubech. Jde o silně mutilující výkony, extrémně náročné mimo jiné i na psychiku pacientů a spojené s vysokou morbiditou a mortalitou.
V případě infekce rekonstrukce pod tříselným vazem je často prokrvení končetiny po explantaci cévní náhrady dostatečné. I zde je možno vést nový bypass extra-anatomicky - nejčastěji na laterální straně stehna čistým podkožím. Kolaterální oběh často zlepší operační plastika a. femoralis profunda. V extrémním případě je nutná amputace ve stehně, obvykle s dobrým hojením rány.
Během celé léčby je nutno pacienta, ve spolupráci s rodinou, klinickým psychologem i psychiatrem, motivovat k trpělivosti. Léčba je dlouhá a velmi náročná fyzicky i psychicky pro pacienta i ošetřující personál.
Naše výsledky
V letech 2004-2006 bylo na našem pracovišti provedeno 277 primárních rekonstrukčních výkonů v aorto-femorální oblasti. Z toho 130 pro stenózující aterosklerotické postižení tepen a 147 pro aneuryzma aorto-ilické oblasti (z nich 41 urgentně pro rupturu, tj. 27,9 %). Ve stejném období bylo implantováno 242 femoro-popliteálních bypassů (151 venózních, 91 cévní protézou), 14 krurálních bypassů a 28 pedálních rekonstrukcí. Bylo také provedeno 195 operací karotid a založeno 363 arterio-venózních píštělí pro potřeby hemodialýzy.
Ve stejném období let 2004-2006 bylo nově diagnostikováno 19 infekcí tepenných rekonstrukcí. Šlo o 15 aorto-femorálních rekonstrukcí (3 implantovány pro aneuryzma, 12 pro Lerichův syndrom) a 4 femoro-popliteální bypassy (všechny cévní protézou). Z toho v 5 případech byla primární rekonstrukce (vždy šlo o aorto-femorální či bifemorální cévní protézu) implantována extramurálně. Infekce v jiných oblastech tepenného systému, zejména karotického řečiště, nebyla v tomto období zaznamenána. U 3 pacientů jsme řešili infekci arterio-venózní píštěle.
Infekce aorto-femorální rekonstrukce se projevila retencí hnisavé tekutiny v třísle 11krát, uzávěrem rekonstrukce s ischemií končetin 2krát a krvácením do GIT 2krát. V subingvinální oblasti byly projevy infekce lokalizovány u 2 pacientů do třísla, u zbylých 2 pacientů do operačních ran mimo tříslo. U 5 pacientů došlo k manifestaci infekce do 30 dnů po poslední cévní rekonstrukci.
Původcem infekce byl 9krát Staphylococcus aureus (47,4 %), 3krát Escherichia coli, 2krát Streptokoky, 1krát Pseudomonas aeruginosa. Ve 4 případech (21 %) byla kultivace negativní.
U 15 pacientů byla provedena explantace infikované rekonstrukce, 2 další odmítli po incizi a drenáži infikovaného třísla další léčbu. Jeden pacient po drenáži třísla a amputaci těžce ischemické končetiny umírá v důsledku multiorgánového selhání. V 1 případě byla infekce MRSA léčena úspěšně lavážemi postiženého třísla roztoky Betadine a Lavanid. Tento pacient je dosud bez známek relapsu infekce tepenné náhrady.
Zemřelo celkem 5 pacientů, všichni na septické komplikace do 30 dnů po operaci. Časná mortalita dosahuje tedy 26,3 %. V 8 případech byla použita extra-anatomická rekonstrukce a 1krát in situ náhrada horní anastomózy aorto-bifemorální protézy novou protézou, dosud bez známek reinfekce. U 6 pacientů byla nevyhnutelná amputace končetiny pro těžkou ischemii. Zachování končetiny dosahuje 68,5 %.
Ve sledovaném období 2004 - 2006 bylo primárně operováno 8 z uvedených 19 pacientů s infekci cévní rekonstrukce. Z toho 1 pacient primárně operován extramurálně a 7 na naší klinice. Současně jsme provedli celkem 561 primárních cévních rekonstrukcí v oblasti aorty a tepen dolních končetin. Tomu odpovídá incidence infekce 1,24 %.
Závěr
Výsledky naší léčby jsou plně srovnatelné s jinými angiochirurgickými pracovišti. Jako naprosto nezbytná se ukazuje úzká spolupráce s ostatními obory medicíny a se zdravotníky v první linii. Jen tak lze zajistit včasnou a dostatečnou péči, což představuje významný prognostický faktor v léčbě infekce cévních rekonstrukcí.
MUDr. Miroslav Krejčí
II. chirurgická klinika LF MU a FN u sv. Anny
www.fnusa.cz
e-mail: miroslav.krejci@fnusa.cz
Doručeno do redakce: 4. 9. 2007
Přijato po recenzi: 8. 10. 2007
Zdroje
1. Castier Y, Francis F, Cerceau P et al. Cryopreserved arterial allograft reconstruction for peripheral graft infection. J Vasc Surg 2005; 41 : 30-37.
2. Clagett GP, Bowers BL, Lopez-Viego MA et al. Creation of a neo-aortoiliac system from lower extremity deep and superficial veins. Ann Surg 1993; 218 : 239-249.
3. De la Cueva L, Plancha MC, Reyes MD et al. Vascular Graft Thrombózes: 99mTc-HMPAO Leukocyte Scintigraphy False Positive Result in Diagnosis of Infection. EJVES Extra 2005; 9 : 82-83.
4. Edelman ER. Vascular tissue engineering: designer arteries. Circ Res 1999; 85 : 1115-1117.
5. Firt P, Hejnal J, Vaněk I. Cévní chirurgie. 2. ed. Praha: Karolinum 2006.
6. Franke S, Voit R. The Superficial Femoral Vein as Arterial Substitute in Infections of the Aortoiliac Region. Ann Vasc Surg 1997; 11 : 406-412.
7. Gordon LL, Hagino RT, Jackson MR et al. Complex Aortofemoral Prosthetic Infection. The Role of Autogenous Superficial Femoropopliteal Vein Reconstruction. Arch Surg 1999; 134 : 615-621.
8. Krajíček M, Peregrin JH, Roček M et al. Chirurgická a intervenční léčba cévních onemocnění. Praha: Grada Publishing 2007.
9. Petrik J, Roubal P, Kořístek V et al. Indikační problémy u cévních rekonstrukčních operací. Vnitř Lék 1991; 37 : 336-341.
10. Podlaha J. Chirurgie extrakraniálního karotického řečiště. Praha: Grada Publishing 2006.
11. Raupach J, Lojík M, Krajina A et al. Infekční salmonelové aneuryzma břišní aorty: diagnostika, endovaskulární léčba. Rozhl Chir 2002; 81 : 150-153.
12. Seeger JM, Pretus HA, Welborn MB et al. Long-term outcome after treatment of aortic graft infection with staged extra-anatomic bypass grafting and aortic graft removal. J Vasc Surg 2000; 32 : 451-459.
13. Staffa R. Záchrana kriticky ischemické končetiny. Pedální bypass. Praha: Grada Publishing 2004.
14. Szilagyi ED, Smith RF, Elliott JP et al. Infection in Arterial Reconstruction with Synthetic Grafts. Ann Surg 1972; 176 : 321-332.
15. Šefránek V et al. Ochorenia končatinových artérií a ich chirurgická liečba. Bratislava: Bratislava: Slovak Academy Press 2001.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Z odborné literatury
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2008 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Monitorace 24hodinového krevního tlaku - editorial
- Může mít význam stanovení hladin natriuretických peptidů u nemocných bez zjevného srdečního selhání? - editorial
- Invazivní aspergilóza: je čas na optimismus?- editorial
- Je dyslipidemie rizikovým faktorem pro nemocné léčené antiretrovirovými léky? - editorial
- Infekce tepenných rekonstrukcí - editorial
- Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
- Stanovení hodnot 24hodinového ambulantního monitorování krevního tlaku odpovídajících kazuálnímu tlaku 130/80 mm Hg
- Faktory se vztahem k hodnotám NT-proBNP u hemodynamicky stabilních pacientů s normální systolickou funkcí levé komory
- Invazivní aspergilové infekce u hematoonkologických nemocných: význam jednotlivých diagnostických metod, léčebných postupů a nástin finanční náročnosti léčby
- Dyslipidemie indukovaná antiretrovirovými léčivy
- Infekce tepenných rekonstrukcí: praktický pohled
- Současné možnosti zobrazení magnetickou rezonancí v kardiologii
- Význam endokanabinoidního systému v regulaci energetické rovnováhy
- Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
- Každý den u nás umírá zbytečně nejméně 60 osob!
- Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózní malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafie s 99mTc-makroagregatem humánního sérového albuminu: kazuistika
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Odporúčania pre diagnostiku a liečbu periférneho artériového ochorenia končatín (PAO)
- Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózní malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafie s 99mTc-makroagregatem humánního sérového albuminu: kazuistika
- Faktory se vztahem k hodnotám NT-proBNP u hemodynamicky stabilních pacientů s normální systolickou funkcí levé komory
- Sledování protinádorové buněčné imunitní odpovědi u nemocných s renálním karcinomem, porucha proliferace T-lymfocytů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



