-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nové poznatky v genetice autoimunitního diabetu
(1): Monogenně podmíněné typy autoimunitního diabetu
New knowledge in the heredity of autoimmune diabetes.
1st part – Monogenetically determined types of autoimmune diabetesThe incidence of type 1 diabetes (DM1) varies greatly among different nations and ethnic groups. Precise mapping of DM1 incidence and its trends is useful in the study of the interaction of genetic and non-genetic factors which influence the manifestation and course of the disease. Important progress has been made in the understanding of the mechanisms of autoimmune diabetes by the study of genes and autoimmune forms of monogenetic diabetes.
Key words:
monogenetic autoimmune diabetes mellitus – heredity – APS-I + II – IPEX
Autoři: J. Vavřinec; J. Vosáhlo
Působiště autorů: Klinika dětí a dorostu 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta doc. MUDr. Felix Votava, Ph. D.
Vyšlo v časopise: Vnitř Lék 2007; 53(6): 694-701
Kategorie: Přehledné referáty
Předneseno na Diabetologickém dnu 23. listopadu 2006 ve Zlíně k příležitosti významného životního jubilea prof. MUDr. Jaroslava Rybky, DrSc.
Souhrn
Incidence diabetu 1. typu (DM1T) se významně liší mezi jednotlivými národy a etnickými skupinami. Přesné mapování incidence DM1T a jejích trendů pomáhá při studiu interakce genetických a negenetických faktorů, které ovlivňují manifestaci a průběh onemocnění. Významný pokrok v porozumění mechanizmům autoimunitního diabetu přineslo studium genů u autoimunitních forem monogenně podmíněného diabetu.
Klíčová slova:
monogenní autoimunitní diabetes mellitus - genetika - APS-I + II - IPEXÚvod
Diabetes mellitus představuje jedno z nejzávažnějších a nejčastějších chronických onemocnění i v dětském věku a naprostou většinu pacientů tvoří děti s diabetes mellitus 1. typu (DM1T). Na vzniku DM1T se zčásti podílí faktory prostředí a zčásti genetické vlivy, z nichž je zatím definována jen část. Rovnováha mezi protektivními a rizikovými vlivy prostředí a protektivními a rizikovými vlivy genetickými určuje, zda jedinec onemocní autoimunitní inzulitidou a dostane diabetes. Podíl genetické predispozice a faktorů zevního prostředí se mění s věkem a pro některé genotypy je zřejmě závislý i na pohlaví postiženého jedince. Žádný z takzvaně diabetogenních genotypů není jednoznačnou patologickou odchylkou, všechny se běžně vyskytují v dané populaci. Nadto i ten nejrizikovější z definovaných HLA-genotypů přináší pro svého nositele v obecné populaci celoživotní riziko pro DM1T jen okolo 15-20 %, ale toto riziko se podstatně zvyšuje u osob s anamnézou DM1T v blízkém příbuzenstvu.
Odlišná dědičnost, rozdílný klinický průběh a různé riziko klinických komplikací nás nutí přesněji klasifikovat diabetický syndrom u dětí i dospělých. Etiopatogenetická klasifikace pak má zcela zásadní význam pro predikci a prevenci DM1T. Výbor expertů pro klasifikaci a diagnózu diabetu Americké diabetologické společnosti (ADA) navrhl rozdělit diabetes mellitus 1. typu do 2 podtypů [1,2]:
- diabetes mellitus 1. typu A (autoimunitní typ diabetu) a
- diabetes idiopatický (nonimunitní) typu B
Pro potřeby praktické diabetologie je uvedené rozdělení určitým přínosem, podtyp B však není přesně definován a užívaná klasifikace se tak oprávněně stává předmětem kritiky řady diabetologů. Idiopatický typ je definován jako inzulinodependentní diabetes bez přítomnosti autoprotilátek. Autoprotilátky však nejsou u destruktivní formy inzulitidy hlavním efektorovým systémem, naprostá většina z detekovaných autoprotilátek není cytotoxická, a proto jejich nepřítomnost autoimunitní inzulitis nevylučuje. I z těchto důvodů je uvedená klasifikace ADA především pro potřeby výzkumu nepostačující.
Zatímco u malých dětí je k manifestaci DM1T nezbytná destrukce 70-80 % B-buněk Langerhansových ostrůvků, u starších dětí a mladých dospělých postačí destrukce 40-50 % B-buněk a u starších osob je při manifestaci DM1T ireverzibilně zničeno jen 30-40 % B-buněk. Tento známý fakt je způsoben vzestupem inzulinové rezistence v závislosti na věku postiženého jedince [3]. Provedené zahraniční pilotní studie ukazují, že u necelých 40 % osob s DM1T se onemocnění manifestuje před 20. rokem věku. Incidence DM1T se snižuje ve 4. dekádě života a znovu se zvyšuje v 5. až 7. dekádě, takže osoby s DM1T tvoří asi 10 % všech diabetických pacientů [4,5].
Obr. 1. Procentuální výskyt hlavních typu mutací AIRE genu u APS-I (podle Halonena). 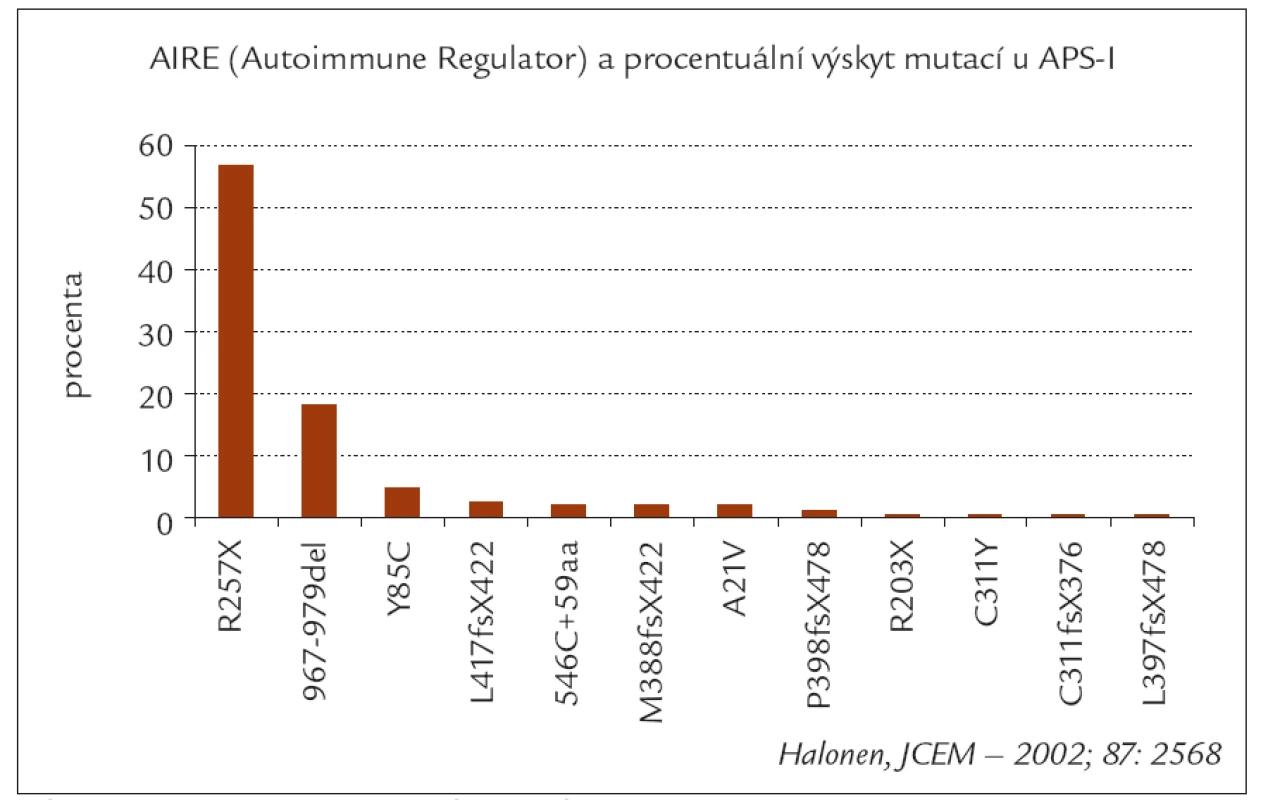
Obr. 2. Hlavní mutace XPID syndromu (modifikováno podle Patela). 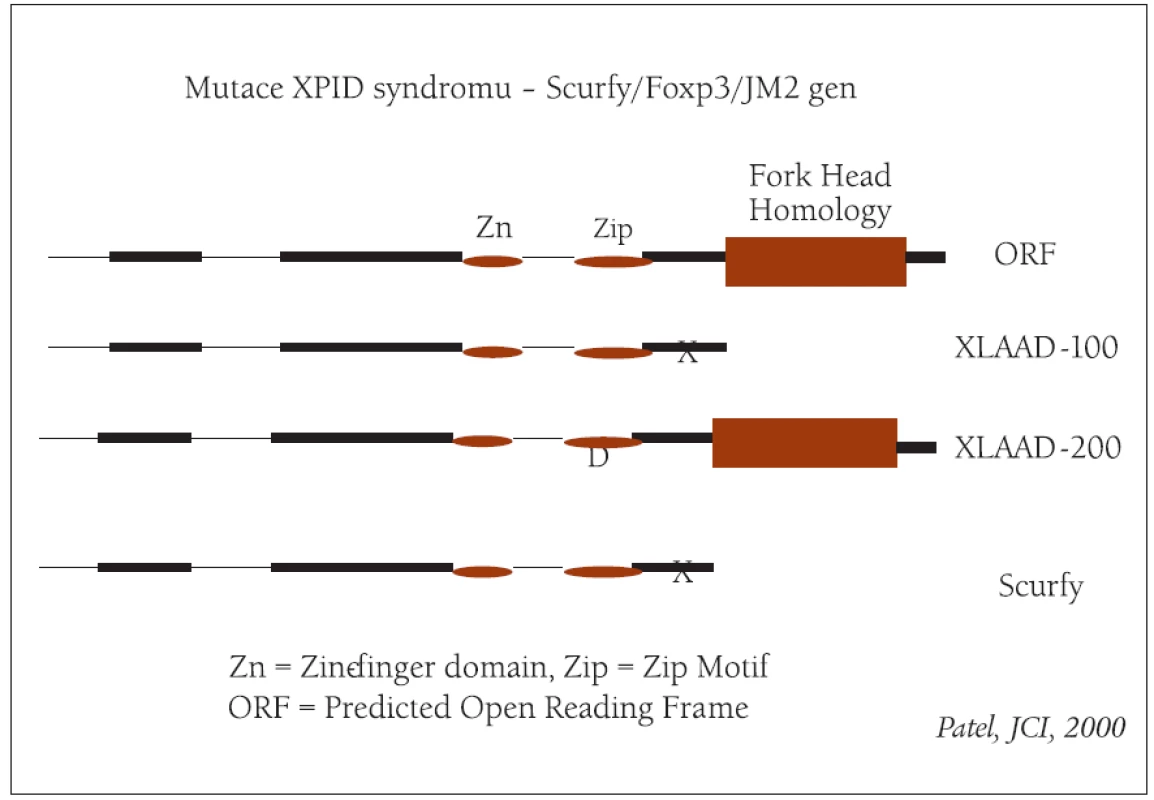
DM1T má převážně nonfamiliární výskyt a pouze 5-10 % nově manifestovaných pacientů jsou sourozenci diabetických pacientů či děti diabetických rodičů [6]. Riziko pro dítě diabetického otce nebo matky, která dostala diabetes po těhotenství, činí asi 6-7 %. Riziko dítěte matky, u níž se diabetes manifestoval již před těhotenstvím, se však snižuje na 1-2 %. Je tedy zřejmý vliv faktorů zevního prostředí na manifestaci a průběh autoimunitní inzulitis. Snížení genetického rizika u dětí matek s manifestací diabetu před těhotenstvím nepochybně svědčí pro významnou imunologickou interakci mezi matkou a plodem při prenatálním navozování imunologické tolerance vůči autoantigenům.
Významný pokrok v porozumění mechanizmům autoimunitního diabetu přineslo studium genů u autoimunitních forem monogenně podmíněného diabetu. Tyto geny ve vztahu k charakteru onemocnění lze studovat u experimentálních zvířat a nebo na přirozených lidských modelech.
Monogenní formy autoimunitního diabetu
V současnosti je známo u lidí několik monogenně podmíněných syndromů, které mohou být provázeny inzulinodependentním diabetem.
APS-I (Autoimmune Polyendocronne Syndrome Type I), synonymum APECED (Autoimmmune Polyendocrinopathy-candidiasis-ectodermal dystrophy), OMIM (Online Mendelian Inheritance in Man) 240 300
Tento syndrom je způsoben mutací tzv. AIRE genu (Autoimmune Regulator), který hraje klíčovou roli v navozování centrální tymové imunologické tolerance vůči periferním proteinům [7]. Především v prenatálním životě dochází k navození centrální tymové tolerance vůči vlastním proteinům a tento proces pokračuje i v postnatálním životě prakticky až do dospělosti. Dendritické buňky, které migrují z kostní dřeně do tymu, exprimují postupně jednotlivé strukturální geny a syntetizují malá množství nejrůznějších proteinů. Ty jsou vázány HLA-antigeny I. a II. třídy, exprimovány na povrchu dendritických buněk a na dvojici HLA-epitop daného proteinu se váží TCR receptory CD4+ nebo CD8+ T-lymfocytů. Podle síly vazby jsou v procesu pozitivní a následně negativní tymové selekce apoptoticky eliminovány ty lymfocyty, které triplet HLA-epitop-TCR buď nevytvoří vůbec (pozitivní tymová selekce), nebo naopak vytvoří příliš silnou vazbu (negativní tymová selekce, která následně probíhá v anatomicky odlišných partiích tymu). Poruchy v navozování centrální imunologické tolerance hrají klíčovou roli u všech autoimunitních onemocnění, zejména se uplatňuje příliš nízká eliminace autoagresivních T-lymfocytů v procesu negativní tymové selekce (u DM1T hlavně autoagresivní T-lymfocyty proti inzulinu/proinzulinu a dalším autoantigenům) [8].
AIRE gen kóduje na chromozómu 21 (21q22.3) transkripční protein, který ovlivňuje transkripci strukturálních genů v dendritických buňkách a je exprimován právě v tymu [9].
Jeho nedostatečná exprese je provázena defektem syntézy různých strukturálních proteinů pro triplet HLA-epitop-TCR, a tedy i špatně navozenou centrální imunologickou tolerancí vůči nejrůznějším autoantigenům. Proto jsou u APS-I postiženy autoimunitním procesem nejrůznější orgány a tkáně.
Dědičnost je autozomálně recesivní, a přestože bylo již identifikováno několik desítek mutací AIRE-genu, negativní výsledek molekulárně genetického vyšetření nevylučuje přítomnost tohoto syndromu [10].
APS-I je vzácné onemocnění, ale jeho incidence je velmi rozdílná u různých věkových skupin. Jeho prevalence je například ve Finsku odhadována na 1/25 000, na Sardinii 1/14 000 a u jemenských Židů na 1/9 000. Prevalence v naší populaci známa dosud není, i když u řady našich pacientů byl tento syndrom geneticky verifikován. Poměr žen k mužům je v literatuře udáván mezi 0,8-2,4 : 1 [11].
Syndrom byl v plně rozvinuté formě popsán poprvé v roce 1946, ale genetická příčina onemocnění byla objasněna až koncem minulého století.
V klinickém průběhu je v popředí Addisonova choroba, která vzniká na podkladě autoimunitní adrenalitis, dále hypoparatyroidizmus, mukokutánní kandidóza a autoimunitní hepatitis [12].
U APS-I se může manifestovat i tyroiditis, malabsorpční syndrom, vitiligo, perniciózní anémie, alopecie, primární hypogonadizmus a aplastická anémie. Vzácně byla u tohoto syndromu popsána asplenie [13-15].
Syndrom se nejčastěji manifestuje již v časném dětském věku a prvním symptomem bývá mukokutánní kandidóza následovaná postupným rozvojem nadledvinkové insuficience.
Ostatní uvedená symptomatologie se může objevit postupně i během několika let. I když se inzulinodependentní diabetes manifestuje asi u 18 % pacientů s APS-I, nebyl zatím diagnostikován u žádného z českých pacientů [16]. Nebyla zjištěna žádná asociace vlastního APS-I s HLA molekuly II. třídy, nicméně haplotyp DR3 zvyšuje a alela DQB1*0602 snižuje riziko manifestace diabetu u tohoto syndromu [17]. Diabetes je téměř vždy inzulinodependentní s přítomností různých autoprotilátek (IAA, GAD65, IA2 a řada dalších) [18].
Vzácněji se u APS-I může manifestovat i Gravesova choroba, IgA deficience, keratokonjunktivitis, uveitis či hypogonadizmus. Častá je i gastrointestinální symptomatologie, průjmy či zácpy, steatorea, které jsou způsobeny ztrátou chromafinních střevních buněk [19].
K méně obvyklým projevům APS-I patří například panhypopituitarizmus, revmatoidní artritis, Sjögrenův syndrom, hemolytická anémie, atrofie optického nervu, retinální degenerace, glomerulonefritidy, myokarditida, bronchiolitis obliterans či metafyzeální dysostosis [20].
Sami sledujeme dnes již 24letou pacientku, u níž se manifestoval APS-I ve věku 2 let jako nadledvinková krize. V době manifestace byla přítomna mukokutánní kandidóza a onychodystrofie, autoimunitní hepatitida a intracelulární hypokalcemie. (Zde je vhodné upozornit, že u Addisonovy choroby může zůstat hladina celkového kalcia v mezích normy i při pokročilém stupni hypoparatyreózy. Známky intracelulární hypokalcemie na EKG však bývají přítomny).
Kromě substituční terapie gluko - i mineralokortikoidy byla zahájena i imunosupresní léčba, protože bioptický jaterní nález vykazoval aktivní hepatitidu s periportální fibrózou, anulární přestavbou a centroacinózní cholestázou.
Imunosupresní terapie byla zahájena bolusovými dávkami metylprednisolonu (až 1 000 mg/m2 ve 4 týdenních intervalech), vysokodávkovanými imunoglobuliny (až 2,0 g/kg ve 4 týdenních intervalech) a cyklosporinem A. Postupně byly bolusové dávky sníženy, imunoglobuliny vysazeny a cyklosporin A byl po 10 letech vyměněn za metotrexát.
Stav se stabilizoval, ale v roce 2005 se manifestovala oboustranná katarakta, oboustranná uveitis a začaly se objevovat nadledvinkové krize při běžných respiračních infektech. Protilátky proti B-buňkám Langerhansových ostrůvků jsou i nadále negativní, katarakty odoperovány.
Kromě autoprotilátek proti B-buňkám ostrůvků se mohou u pacientů objevit i další autoprotilátky: proti 21-hydroxyláze (nadledvinková insuficience), 17-hydroxyláze, CYP450scc (hypogonadizmus, nadledvinková insuficience), tryptofan hydroxyláze (ztráta chromafinních střevních buněk), H/K ATPáze a „intrinsic“ faktoru (perniciózní anémie), tyreoidální peroxidáza (hypotyreóza) [21-23]. Proto je doporučeno vyšetřovat tyto protilátky u pacientů s APS-I alespoň 2krát ročně.
U pacientů byly opakovaně prokázány změny v subpopulacích lymfocytů a řada dalších imunologických odchylek.
Prognóza onemocnění je nejistá a závisí na typu mutace, na zatím neidentifikovaných faktorech zevního prostředí (například na typu a průběhu lymfotropních infekcí) i na typu imunosupresní léčby při významnějším orgánovém postižení. Imunosupresní léčba je indikována především u pacientů s autoimunitní hepatitidou.
Mortalita je dána stupněm orgánového postižení a závažností a četností komplikací.
Je nutno připomenout, že každý pacient s autoimunitním onemocněním má vysoké riziko manifestace další autoimunity.
Kauzální léčba neexistuje, teoretickou nadějí pro budoucnost je genová terapie. Kromě substituční hormonální terapie je třeba intenzivně léčit mukokutánní kandidózu, keratokonjuktivitidu a uveitidu [24,25]. U asplenických pacientů je nezbytná vakcinace proti kokovým infekcím, profylaktické podávání antibiotik při interkurentních infekcích je u těchto jedinců běžné [26]. Pacienti s APS-I patří na specializovaná pracoviště, nicméně jejich záchyt je vázán především na zdravotníky v primární péči.
APS-II (Autoimmune Polyendocrinne Syndrome Type II), synonyma Schmidtův syndrom, Blizzardův syndrom, OMIM 269 200
I když APS-II není podmíněn monogenně, ale podobně jako DM1 je asociován s haplotypy DR3/DR4, uvádíme tento syndrom pro jeho podobnost s APS-I.
Syndrom byl popsán Schmidtem v roce 1926 jako kombinace tyroiditis a Addisonovy choroby [27]. Časem se však ukázalo, že autoimunitním procesem může být postižena řada orgánů a tkání. U APS-II se postupně může manifestovat: diabetes mellitus 1. typu, Gravesova choroba, celiakie, vitiligo, polyserositis, IgA deficience, primární hypogonadizmus, stiff-man syndrom, alopecie, perniciózní anémie, myasthenia gravis a Parkinsonova choroba. Orgánově specifické autoprotilátky mohou se mohou vyskytovat i u prvostupňových příbuzných bez klinické manifestace onemocnění [28-32].
V literatuře jsou někdy uváděny i APS-III (autoimunitní onemocnění štítné žlázy + další autoimunita, ale bez diabetu a Addisonovy choroby) a APS-IV (dvě nebo více jiných autoimunit). Protože však se může další orgánově specifická autoimunita manifestovat v jakémkoliv věku, ztrácí tato klasifikace praktický význam.
Na rozdíl od 1. typu je u APS-II prokázána úzká asociace s alelami HLA II. třídy.
Rizikové haplotypy jsou DR3/DQ2 (DQ2 = DQA1*0501, DQB1*0201), dále DR4/DQ8 (DQ8 = DQA1*0301, DQB1*0302), zvláště s alelou DRB1*0404 [33,34].
Některé z klinických manifestací APS-II nejsou ve všeobecné populaci asociovány s alelami HLA II. třídy: vitiligo, perniciózní anémie či autoimunitní uzlová tyroiditis.
Na modifikaci vlastního klinického průběhu onemocnění se podílejí i další non-MHC geny: CTLA 4 (G/A polymorfizmus) či MIC-A5.1 [35,36]. Hlavní kandidátní gen, jehož funkce odlišuje APS-II od DM1, však dosud identifikován nebyl. Prevalence APS-II je vysoká a je závislá na prevalenci rizikových alel, haplotypů a genotypů. Počet postižených jedinců je v USA odhadován na 14-20/1 milion, nicméně s rozvojem diagnostických metod je stále jasnější, že prevalence subklinických forem onemocnění je daleko vyšší [37].
Spouštěcí a modifikující faktory zevního prostředí nejsou samozřejmě dostatečně prozkoumány a podobně jako u DM1T je studován vliv stravy (hovězí či obilné bílkoviny v časném období života), vliv virových infekcí či různých léků na manifestaci APS-II [38].
Syndrom se manifestuje obvykle u starších dětí či dospělých, mezi manifestací jednotlivých orgánových autoimunit může uplynout řada let a syndrom se v rodině vyskytuje často v několika generacích.
Z orgánově specifických autoprotilátek lze často nalézt protilátky i u řady prvostupňových příbuzných, podobně jako je tomu u APS-I. Navíc se mohou u postiženého jedince objevit v průběhu života i další autoprotilátky, a to i bez klinickém manifestace vlastního onemocnění. Proto pravidelný screening protilátek u pacienta, ale i u jeho příbuzných (zvláště s haplotypy DR3/DQ2 nebo DR4/DQ8), je nezbytný.
Sami jsme ošetřovali dnes již 30letou ženu, u níž se DM1T manifestoval v 7 letech, Hashimotova tyroiditis ve 12 letech a ve 14 letech nadledvinková krize. Je léčena inzulinovou pumpou, substitucí hormony štítné žlázy a gluko - i mineralokortikoidy. Po ukončení studia na VŠ porodila ve 26 letech zdravého chlapce, který je však nositelem rizikového haplotypu DR3/DQ2. Podle dostupných informací je naše pacientka první ženou s kompletně manifestovaným APS-II, která porodila zdravé dítě. Kompletní syndrom se totiž manifestuje obvykle až ve vyšším věku.
Pravidelným screeningem anti-TPO, anti-TG a 21-hydroxylázových protilátek jsme mezi našimi pacienty s DM1T objevili další 4 dívky, které mají kromě diabetu i Hashimotovu tyroiditis a pozitivní protilátky proti 21-hydroxyláze. Zatím se u žádné z nich klinicky nemanifestovala Addisonova choroba, i když u nejstarší z nich, dnes již 19leté, je ACTH test hraniční a manifestaci nadledvinkové insuficience je třeba pečlivě monitorovat.
Prognóza je relativně příznivá, závisí na množství i na stupni orgánových postižení.
Léčba je substituční, kauzální terapie známa není [39].
IPEX (Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked), synonymum XPID (X linked Polyendocrinopathy, Immune Dysfunction and Diarrhea), OMIM 304 790
Tento syndrom je způsoben mutací Foxp3 genu, který je důležitý pro diferenciaci regulačních T lymfocytů (Foxp3+ CD4+ CD25+) [40-43].
Jak ukazuje řada studií, je jejich množství snížené i u DM1T, ale u IPEX-u je jejich defekt mnohonásobně větší. Regulační T-lymfocyty „drží na uzdě“ autoagresivní T-lymfocyty a jejich podání zabrání rozvoji diabetu u experimentálních zvířat.
Onemocnění postihuje výhradně chlapce a diabetes se u nich manifestuje velmi často již v novorozeneckém období či v útlém dětském věku [44]. Protože je onemocnění často provázeno úpornými průjmy, bývají pacienti často vyšetřovány na nejrůznější formy malabsorpčních syndromů.
Syndrom lze zatím vyléčit pouze alogenní transplantací kmenové hemopoetické buňky [45]. Dlouhodobá imunosupresní léčba je u lehčích forem nezbytná [46].
Prevalence IPEX-u dosud známa není, a to z několika důvodů. Genetická podstata tohoto syndromu je známa pouze několik let a interindividuální variabilita je vysoká. Ve vztahu k typu mutace se může tento syndrom manifestovat pouze jako malabsorpční syndrom s těžkou atopií. U těchto abortivních forem může být dokonce počet regulačních T-lymfocytů normální, ale jejich funkce je významně abnormální. Genetické potvrzení diagnózy u českých pacientů lze provést pouze v zahraničí. V neposlední řadě hraje roli i malá znalost klinického obrazu a postižení chlapci (či muži) umírají pod různými diagnózami.
Ošetřovali jsme chlapce s manifestací malabsorpčního syndromu v kojeneckém věku. V dětství se opakovaně manifestovaly respirační infekty a infekce GIT. Postupně se prohluboval obraz malnutrice. Diabetes mellitus s diabetickou ketoacidózou se manifestoval ve věku 10 let po prodělané virové meningoencefalitidě. Chlapec byl léčen inzulinovou pumpou, ale podvýživa progredovala i přes kompletní parenterální výživu. Regulační lymfocyty CD4+ CD25+ téměř vymizely. Genetický defekt v té době ještě známý nebyl, ale z klinického i laboratorního vyšetření soudíme na IPEX syndrom. Zvažovali jsme i alogenní transplantaci kostní dřeně, ale ani jedna z obou sester nebyla HLA identická. Vzhledem k těžkému celkovému stavu jsme se k nepříbuzenské alogenní transplantaci neodhodlali a chlapec zemřel ve věku 14 let.
Systémová autoimunitní onemocnění asociovaná s protilátkami proti inzulínovým receptorům (např. SLE)
Syndrom je charakterizován vysokou inzulinovou rezistencí, ale paradoxně se u diabetických pacientů vyskytují i těžké hypoglykemie [47]. Asi 1/3 pacientů má kromě diabetu ještě další orgánově specifickou autoimunitu.
Diabetes se však může manifestovat i u jiných systémových autoimunit, například u c-ANCA i p-ANCA pozitivních vaskulitid, u dermatomyozitidy a pod.
Tumory tymu
Tymomy a některé formy hyperplazie tymu jsou často provázeny různými autoimunitními chorobami. Nejčastěji se vyskytuje myasthenia gravis, aplastická anémie, ale také Addisonova choroba, DM1T a Gravesova choroba.
Zvláštní nozologické podjednotky představuje kombinace myasthenia gravis a alopecia arreata či výskyt protilátek proti acetylcholinovému receptoru u pacientů s tymomy [48,49].
POEMS syndrom (Plasmocytom, endokrinopatie, monoklonální gamapatie, kožní změny), OMIM 192 240
Pacienti se nejčastěji manifestují jako senzorická či motorická polyneuropatie, DM1T (asi v 50 % případů), primární hypogonadizmus (asi v 70 %) a plazmocytom se sklerotizujícími kostními lézemi [50-53]. Ve světové literatuře jsou popsány stovky pacientů s tímto syndromem [54].
Léčba: radioterapie, alogenní transplantace kmenové hemopoetické buňky [55].
Hiratův syndrom (Insulin Autoimmune Syndrome)
Manifestuje se u pacientů s Gravesovou chorobou, kteří jsou léčeni methimazolem či podobnými preparáty se sulfhydrylovou skupinou [56]. U postižených jedinců se vytvářejí polyklonální protilátky proti inzulinu a manifestuje se diabetes mellitus. Tvorba protilátek je silně asociována s alelami DR 4, především s alelou DRB1*0406. Protože se tato alela vyskytuje poměrně zřídka u kavkazoidní populace, je incidence syndromu mnohonásobně vyšší u asijské populace - především v Japonsku [57].
U některých pacientů jsou však vytvářeny protilátky monoklonální a u takto postižených jedinců se kombinuje diabetes a spontánní hypoglykemie.
Kearnsův-Sayrův syndrom
Manifestuje se většinou před 20. rokem věku a součástí syndromu je externí oftalmoplegie, pigmentární retinální degenerace, AV bloky, ataxie a hyperproteinemie v mozkomíšním moku. U řady pacientů se může postupně manifestovat i Hashimotova tyroiditis, hypoparatyreóza, diabetes mellitus, Addisonova choroba a encefalopatie [58-60].
Onemocnění je podmíněno mutací mitochondriální DNA, a dědičnost je tedy maternální [61].
Jeho incidence známa není, protože řada pacientů uniká diagnóze. Ke genetickému potvrzení diagnózy totiž nestačí jaderné buňky z periferní krve, ale obvykle je nutno odebrat přímo postiženou tkáň.
Wolframův syndrom (DIDMOAD - Diabetes insipidus, diabetes mellitus, atrofie optiku a hluchota]
Tento syndrom nemá čistý charakter autoimunitního onemocnění, přestože některé známky autoimunity mohou být přítomny. Je způsoben mutací wolframinu na 4p16, dědičnost je tedy autozomálně recesivní [62,63]. Jsou však známy i formy s maternální dědičností, které jsou podmíněny mutací mitochondriální DNA [64-66].
Sami jsme v minulosti ošetřovali několik pacientů s tímto syndromem. Velmi nepříjemná je postupná progrese smyslového postižení, které se nedá předejít.
Léčba je jen symptomatická, u forem s maternální dědičností je třeba pečlivě monitorovat případný rozvoj hypertrofické kardiomyopatie.
Ve světové literatuře jsou popsány desítky rodin s tímto syndromem. U forem s maternálním typem dědičnosti je opět nutno odebrat postiženou tkáň ke genetické analýze, takže tato forma Wolframova syndromu uniká často diagnóze [67].
Kongenitální rubeolový syndrom
U řady dětských i dospělých pacientů s kongenitální rubeolou se může kromě Hashimotovy tyroiditis manifestovat i diabetes mellitus [68].
Byl identifikován rubeolový protein, který je vysoce homologní s některými proteiny B-buněk ostrůvků. Při iniciaci autoimunitní inzulitis u těchto pacientů hraje pravděpodobně roli fenomén antigenních mimikrů, to znamená zkřížená imunitní reakce mezi aloantigeny a autoantigeny.
Závěr
Autoimunitní polyendokrinní syndromy slouží jako vhodný model pro studium patogenetických mechanizmů DM1T. Umožňují zkoumat vliv jednotlivých genů systému specifické imunity na manifestaci a průběh autoimunitní inzulitis. Zároveň dovolují hledání účinných preventivních metod pro DM1T.
Podpořeno VZ MSMT 002162081.
prof. MUDr. Jan Vavřinec, DrSc.
www.fnkv.cz
e-mail: vavrinec@fnkv.cz
Doručeno do redakce: 5. 12. 2006
Přijato po recenzi: 17. 1. 2007
Zdroje
1. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 1997; 20 : 1183-1197.
2. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 1999; 22 : 5-19.
3. Rewers M, Norris J, Dabelea D. Epidemiology of type I diabetes. In: Eisenbarth GS. Type I diabetes: Molecular, cellular, and clinical immunology. Barbara Davis Center for Childhood Diabetes, Online Edition Version, 2. ed. 2004 : 56-87.
4. Libman I, Songer T, LaPorte R. How many people in the U.S. have IDDM? Diabetes Care 1993; 16 : 841-842.
5. Rewers M. The changing face of the epidemiology of insulin-dependent diabetes mellitus: Research designs and models of disease causation. Ann Med 1991; 23 : 419-426.
6. Vavřinec J, Cinek O. Autoimunitní inzulitida a diabetes mellitus 1. typu. In: Perušičová J. Trendy soudobé diabetologie. Praha: Galén 2000; 4 : 129-158.
7. Kumar PG, Laloraya M, She JX. Population genetics and functions of the autoimmune regulator (AIRE). Endocrinol Metab Clin North Am 2002; 31 : 321-338.
8. Cavadini P, Vermi W, Facchetti F et al. AIRE deficiency in thymus of 2 patients with Omenn syndrome. J Clin Invest 2005; 115 : 728-732.
9. Aaltonen J, Björses P, Sandkuijl L et al. An autosomal locus causing autoimmune disease: autoimmune polyglandular disease type I assigned to chromosome 21. Nat Genet 1994; 8 : 83-87.
10. Myhre AG, Halonen M, Eskelin P et al. Autoimmune polyendocrine syndrome type 1 (APS I) in Norway. Clin Endocrinol (Oxf) 2001; 54 : 211-217.
11. Aldasouqi SA, Akinsoto PA, Jabbour SA. Polyglandular autoimmune syndrome Type I. eMedicine 2006, www.emedicine.com
12. Ahonen P, Myllarniemi S. Clinical variation of autoimmune polyendocrinopathy - candidiasis - ectodermal dystrophy (APECED) in a series of 68 patients. N Engl J Med 1990; 322 : 1829-1836.
13. Mandel M, Etzioni A, Theodor R et al. Pure red cell hypoplasia associated with polyglandular autoimmune syndrome type I. Isr J Med Sci 1989; 25 : 138-141.
14. Hara T, Mizuno Y, Nagata M et al. Human gamma delta T-cell receptor-positive cell-mediated inhibition of erythropoiesis in vitro in a patient with type I autoimmune polyglandular syndrome and pure red blood cell aplasia. Blood 1990; 75 : 941-950.
15. Friedman TC, Thomas PM, Fleisher TA et al. Frequent occurrence of asplenism and cholelithiasis in patients with autoimmune polyglandular disease type I. Am J Med 1991; 91 : 625-630.
16. Perheentupa J, Miettinen A. Autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy. In: Eisenbarth GS (ed). Endocrine and Organ Specific Autoimmunity. Austin: RG Landes 1999 : 19-40.
17. Halonen M, Eskelin P, Myhre AG et al. AIRE Mutations and Human Leukocyte Antigen Genotypes as Determinants of the Autoimmune Polyendocrinopathy-Candidiasis-Ectodermal Dystrophy Phenotype. J Clin Endocrinol Metab 2002; 87 : 2568-2574.
18. Perniola R, Falorni A, Clemente MG et al. Organ-specific and non-organ-specific autoantibodies in children and young adults with autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy (APECED). Eur J Endocrinol 2000; 143 : 497-503.
19. Hogenauer C, Meyer RL, Netto GJ et al. Malabsorption due to cholecystokinin deficiency in a patient with autoimmune polyglandular syndrome type I. N Engl J Med 2001; 344 : 270-274.
20. Barker JM, Eisenbarth GS. Type 1 diabetes: Mollecular, Cellular, and Clinical Immunology. Online edition, Version 23,5, www.uchs.edu.
21. Soderbergh A, Rorsman F, Halonen M et al. Autoantibodies against aromatic L-amino acid decarboxylase identifies a subgroup of patients with Addison’s disease. J Clin Endocrinol Metab 2000; 85 : 460-463.
22. Gylling M, Tuomi T, Bjorses P et al. ss-Cell autoantibodies, Human Leukocyte Antigen II Alleles, and Type 1 Diabetes in Autoimmune Polyendocrinopathy-Candidiasis-Ectodermal Dystrophy. J Clin Endocrinol Metab 2000; 85 : 4434-4440.
23. Ekwall O, Hedstrand H, Haavik J et al. Pteridin-dependent hydroxylases as autoantigens in autoimmune polyendocrine syndrome type I. J Clin Endocrinol Metab 2000; 85 : 2944-2950.
24. Merenmies L. Chronic bilateral keratitis in autoimmune polyendocrinopathy-candidiadis-ectodermal dystrophy (APECED). Acta Ophthalmol Scand 2000; 78 : 532-535.
25. Ahonen P, Myllarniemi S, Kahanpaa A et al. Ketoconazole is effective against the chronic mucocutaneous candidosis of autoimmune polyendocrinopathy-candidosis-ectodermal dystrophy (APECED). Acta Med Scand 1986; 220 : 333-339.
26. Starzyk J, Kumorowicz-Kopiec M, Kowalczyk M et al. Natural history of asplenism in APECED-patient report. J Pediatr Endocrinol Metab 2001; 14 : 443-449.
27. Schmidt MB. Eine biglandulare Erkrankung (Nebennieren und Schilddruse) bei Morbus Addisonii. Verh Dtsch Ges Pathol 1926; 21 : 212-221.
28. Landin-Olsson M, Karlsson FA, Lernmark Å et al. Islet cell and thyrogastric antibodies in 633 consecutive 15 - to 34-yr-old patients in the diabetes incidence study in Sweden. Diab 1992; 41 : 1022-1027.
29. Savilahti E, Simell O, Koskimies S et al. Celiac disease in insulin-dependent diabetes mellitus. J Pediatr 1986; 108 : 690-693.
30. Torrelo A, España A, Balsa J et al. Vitiligo and polyglandular autoimmune syndrome with selective IgA deficiency. Int J Dermatol 1992; 31 : 343-344.
31. Tucker WS jr, Niblack GD, McLean RH et al. Serositis with autoimmune endocrinopathy: clinical and immunogenetic features. Medicine 1987; 66 : 138-147.
32. Turkington RW, Lebovitz HE. Extra-adrenal endocrine deficiencies in Addison’s disease. Am J Med 1967; 43 : 499-507.
33. Eisenbarth GS, Wilson PW, Ward F et al. The polyglandular failure syndrome: disease inheritance, HLA - type and immune function. Ann Intern Med 1979; 91 : 528-533.
34. MacLaren NK, Riley WJ. Inherited susceptibility to autoimmune Addison’s disease is linked to human leukocyte antigens-DR3 and/or DR4, except when associated with type 1 autoimmune polyglandular syndrome. J Clin Endocrinol Metab 1986; 62 : 455-459.
35. Vaidya B, Imrie H, Perros P et al. The cytotoxic T lymphocyte antigen-4 is a major Graves’ disease locus. Hum Mol Genet 1999; 8 : 1195-1199.
36. Gambelunghe G, Falorni A, Ghaderi M et al. Microsatellite polymorphism of the MHC Class I Chain-related (MIC-A and MIC-B) genes marks the risk for autoimmune Addison’s disease. J Clin Endocrinol Metab 1999; 84 : 3701-3707.
37. Sivarajan S, Fan CY, Akinsoto PA. Polyglandular autoimmune syndrome Type II. eMedicine 2006, www.emedicine.com
38. Norris JM, Barriga K, Hoffenberg EJ et al. Risk of celiac disease autoimmunity and timing of gluten introduction in the diet of infants at increased risk of disease. JAMA 2005; 293 : 2343-2351.
39. Oelkers W, Diederich S, Bahr V. Therapeutic strategies in adrenal insufficiency. Ann Endocrinol (Paris) 2001; 62 : 212-216.
40. Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science 2003; 299 : 1057-1061.
41. Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat Immunol 2003; 4 : 330-336.
42. Le Bras S, Geha RS. IPEX and the role of Foxp3 in the development and function of human Tregs. J Clin Invest 2006; 116 : 1473-1475.
43. Bachetta R, Passerini L, Gambieri E et al. Defective regulatory and effector T cell functions in patients with FOXP3 mutations. J Clin Invest 2006; 116 : 1713-1722.
44. Wildin RS, Freitas A. IPEX and FOXP3: clinical and research perspectives. J Autoimmun 2005, 25(Suppl): 56-62.
45. Rao A, Kamani N, Filipovich A et al. Successful bone marrow transplantation for IPEX syndrome after reduced-intensity conditioning. Blood 2007; 109 : 383-385.
46. De Benedetti F, Insalaco A, Diamanti A et al. Mechanistic association of a mild phenotype of immunodysregulation, polyendocrinopathy, enteropathy, x-linked syndrome. Clin Gastrol Hepatol 2006; 4 : 653-659.
47. Flier JS, Bar RS, Muggeo M et al. The evolving clinical course of patients with insulin receptor autoantibodies: Spontaneous remission or receptor proliferation with hypoglycemia. J Clin Endocrinol Metab 1978; 47 : 985-995.
48. Marx A, Wilisch A, Schultz A et al. Pathogenesis of myasthenia gravis. Virchows Arch 1997; 430 : 355-364.
49. Mygland A, Aarli JA, Matre R et al. Ryanodine receptor antibodies related to severity of thymoma associated myasthenia gravis. J Neurol Neurosurg Psychiatr 1995; 57 : 843-846.
50. Amiel LL, Machover D, Droz JP. Dyscrasie plasmocytaire avec arteriopathie, polyneuropathie, syndrome endocrinien. Ann Intern Med 1975; 65 : 745-749.
51. Kim DE, Kim HJ, Kim YA et al. Kaposi’s sarcoma herpesvirus-associated Castleman’s disease with POEMS syndrome. Muscle Nerve 2000; 23 : 436-439.
52. Uchigata Y, Hirata Y. Insulin Autoimmune Syndrome. In: Eisenbarth G (ed). Molecular Mechanisms of Endocrine and Organ Specific Autoimmunity. Austin (TX): RG Landes 1999 : 133-148.
53. Dispenzieri A. POEMS Syndrome. Hematology Am Soc Hematol Educ Program 2005; 25 : 360-367.
54. Dispenzieri A, Kyle RA, Lacy MQ et al. Poems syndrome: definitions and long-term outcome. Blood 2003; 101 : 2496-2506.
55. Dispenzieri A, Gertz MA. Treatment options for POEMS syndrome. Expert Opin Pharmacother 2005; 6 : 945-953.
56. Uchigata Y, Kuwata S, Tsushima T et al. Patients with Graves’ disease who developed insulin autoimmune syndrome (Hirata disease) possess HLA-Bw62/Cw4/DR4 carrying DRB1*0406. J Clin Endocrinol Metab 1993; 77 : 249-254.
57. Uchigata Y, Hirata Y, Omori Y et al. Worldwide differences in the incidence of insulin autoimmune syndrome (Hirata disease) with respect to the evolution of HLA-DR4 alleles. Hum Immunol 2000; 61 : 154-157.
58. Berio A, Piazzi A. A case of Kearns-Sayre syndrome with autoimmune thyroiditis and possible Hashimoto encephalopathy. Panminerva Med 2002; 44 : 265-269.
59. Katsanos KH, Elisaf M. Severe hypomagnesemia and hypoparathyroidism in Kearns-Sayre syndrome. Am J Nephrol 2001; 21 : 150-153.
60. Artuch R, Pavia C, Playan A et al. Multiple endocrine involvement in two pediatric patients with Kearns-Sayre syndrome. Horm Res 1998; 50 : 99-104.
61. Remes AM, Majamaa-Voltti K, Karppa M et al. Prevalence of large-scale mitochondrial DNA deletions in an adult Finnish population. Semin Neurol 2005; 64 : 976-981.
62. Inoue H, Tanizawa Y, Wasson J et al. A gene encoding a transmembrane protein is mutated in patients with diabetes mellitus and optic atrophy (Wolfram syndrome). Nat Genet 1998; 20 : 143-148.
63. Pennings RJ, Dikkeschei LD, Cremers CW et al. From gene to disease; mutations in the WFS1-gene as the cause of juvenile type 1 diabetes mellitus with optic atrophy (Wolfram syndrome). Ned Tijdschr Geneeskd 2002; 146 : 985-987.
64. Khanim F, Kirk J Latif F et al. WFS1/wolframin mutations, Wolfram syndrome, and associated disesases. Hum Mutat 2001; 17 : 357-367.
65. Domenech E, Gomez-Zaera M, Nunes V. Study of the WFS1 gene and mitochondrial DNA in Spanish Wolfram syndrome families. Clin Genet 2004; 65 : 463-469.
66. Hardy C, Khanim F, Torres R et al. Clinical and molecular genetic analysis of 19 Wolfram syndrome kindreds demonstrating a wide spectrum of mutations in WFS1. Am J Hum Genet 1999; 65 : 1279-1290.
67. Giuliano F, Bannwarth S, Monnot S et al. Wolfram syndrome in French population: characterization of novel mutations and polymorphisms in the WFS1 gene. Hum Mutat 2005; 25 : 99-100.
68. Viskari H, Paronen J, Keskinen P et al. Humoral beta-cell autoimmunity is rare in patients with the congenital rubella syndrome. Clin Exp Immunol 2003; 133 : 378-383.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Délka antikoagulační léčby a riziko recidiv u TEN - editorial
- Klinické zkušenosti s léčbou dlouhodobým inzulinovým analogem glargin v diabetologickém centru
- Vliv dlouhodobé terapie inzulinovou pumpou (CSII) u pacientů s diabetes mellitus 1. typu na metabolickou kompenzaci a výskyt hypoglykemií. Porovnání s intenzifikovanou konvenční inzulinovou terapií (MDI)
- Subpopulace CD34+buněk a jejich význam pro přihojení štěpu u příbuzenských alogenních transplantací periferních kmenových buněk
- Esenciální trombocytemie a další myeloproliferace s trombocytemií v údajích registru pacientů léčených Thromboreductinem® do konce roku 2006
- Optimální délka antikoagulační léčby po žilní tromboembolické příhodě: obecný či individualizovaný přístup?
- Kardiotoxicita antracyklínovej liečby vo svetle nových biochemických diagnostických možností
- Genetické faktory a riziko kardiovaskulárnych ochorení
-
Nové poznatky v genetice autoimunitního diabetu
(1): Monogenně podmíněné typy autoimunitního diabetu - Je familiární hypercholesterolemie v České republice pod kontrolou?
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Postavení neoadjuvantní chemoterapie v léčbě nemalobuněčného plicního karcinomu
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Ojedinělá komplikace při pokusu o zavedení dočasné kardiostimulace
- Zlepšování výsledků léčby vybraných krevních chorob a změny nákladů na tuto léčbu. Otázky pro ekonomy a další odborníky
- Jsou nezbytná kvalifikovaná rozhodnutí vycházející z věrohodných dat
- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Príspevok nefrológie vo Fakultnej nemocnici L. Pasteura a Lekárskej fakulty Univerzity P. J. Šafárika v Košiciach ku histórii českej nefrológie
- Zamrazil V. Hypotyreóza. Průvodce ošetřujícího lékaře.
- Vondráček L, Dvořáková V. Pochybení a sankce při poskytování lékařské péče.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Genetické faktory a riziko kardiovaskulárnych ochorení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



