-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zlepšování výsledků léčby vybraných krevních chorob a změny nákladů na tuto léčbu. Otázky pro ekonomy a další odborníky
Improvement in the results of treatment of selected blood diseases and changes in the costs of such treatment. Issues for economists and other experts
The text maps the changes in treatment results and costs for three haematological diseases; multiple myeloma; diffuse large B-cell lymphoma and chronic myeloid leukaemia. At the beginning of the 1990’s, the alkeran – prednisone combination was the golden standard in the treatment of myeloma. In the mid 1990’s, the treatment results in younger patients were dramatically improved by high-dose chemotherapy with autologous transplantation. The first decade of the new millennium has brought about even better results after the introduction of thalidomide in the initial treatment in patients not indicated for transplantation. Improvement is also expected in patients of a younger age group thanks to the combination of new drugs with autologous transplantation. A breakthrough in the treatment of patients with diffuse large cell lymphoma was the introduction in the treatment regimen of high-dose chemotherapy with autologous transplantation, and primarily the introduction of a new drug – a monoclonal antibody antiCD20, rituximab, in initial treatment. The golden standard for patients with chronic leukaemia in the early 1990’s was hydroxyurea treatment. This was replaced by a new golden standard – interferon α, which was, in turn, replaced by the specific blocker of bcr-abl thyrosine kinase – imatinib. The text contains tables and charts showing the therapeutic benefit of the options mentioned above and the related costs.
Key words:
multiple myeloma – malignant lymphoma – chronic myeloid leukaemia
Autoři: Z. Adam 1; J. Vorlíček 1; Z. Kořístek 1; Z. Adamová 2
Působiště autorů: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 1; Zdravotní středisko pro děti a dorost, Brno, Obilní trh 9, vedoucí MUDr. Zdenka Adamová 2
Vyšlo v časopise: Vnitř Lék 2007; 53(6): 735-749
Kategorie: Diskuzní fórum
Souhrn
Text dokumentuje změny v léčebných výsledcích i nákladech u třech hematologických nemocí, mnohočetného myelomu, difuzního velkobuněčného B lymfomu a chronické myeloidní leukemie. Počátkem 90. let 20. století byla zlatým léčebným standardem u myelomu kombinace Alkeran a prednison. V polovině 90. let minulého století léčebné výsledky u mladších nemocných výrazně zlepšila vysokodávkovaná chemoterapie s autologní transplantací. V prvním desetiletí následujícího tisíciletí se zlepšily výsledky po zavedení talidomidu do iniciální léčby u pacientů nevhodných pro transplantaci a očekává se zlepšení i ve skupině mladších nemocných díky kombinaci nových léků s autologní transplantací. Pro nemocné s difuzním velkobuněčným lymfomem bylo jednak průlomem zavedení vysokodávkované chemoterapie s autologní transplantací do léčebného postupu, ale hlavně zavedení nového léku - monoklonální protilátky antiCD20, rituximabu, do iniciální léčby. Pro nemocné s chronickou leukemií byla zlatým standardem počátkem 90. let 20. století léčba hydroxyureou. Ta ustoupila novému zlatému standardu - interferonu α, a ten byl počátkem nového tisíciletí nahrazen specifickým blokátorem bcr-abl tyrozinové kinázy - imatinibem. Text dokladuje v tabulkách i grafech léčebný přínos jednotlivých jmenovaných alternativ a náklady na tyto léky.
Klíčová slova:
mnohočetný myelom - maligní lymfom - chronická myeloidní leukemieÚvod
Financování zdravotnictví je v posledních letech velmi často diskutovaným tématem. Ve formě diskusí, které na toto téma proběhly, bylo možné vystopovat všechny odstíny lidského chování, od agresivity spojené s obviňováním, přes neemotivně podaná přesná fakta až po pasivitu, spojenou s mlžením a dezinformováním či budováním Potěmkinových vesnic. Forma podání obvykle souvisela jak s cíly autora, tak s jeho odvahou.
Naším cílem je iniciovat širší diskusi o faktech spojených se zdravotnictvím a vývojem léčebných postupů. Chceme předložit fakta, skutečnosti (náklady na léčebné postupy), které tu prostě jsou a které mohou být těžce akceptovatelné. Tyto skutečnosti přinesl vědeckotechnický vývoj, není přínosné k nim zaujímat jakákoliv emotivní stanoviska. Ještě škodlivější je popírat problém plynoucí z divergentnosti vývoje nákladů na léčebné postupy a ekonomického růstu společnosti, podobně jako je škodlivé popírat problémy plynoucí z globálního oteplování způsobeného lidskou činností.
Naopak je důležité o těchto skutečnostech neemotivně hovořit a diskutovat o tom, kterými cestami může jít vývoj zdravotní politiky a kterou cestu vybrat.
V dalším textu budeme ilustrovat vývoj nákladů na léčbu u vybraných 3 maligních krevních chorob.
Cíl práce
Cílem tohoto článku je zdokumentovat změny ve výsledcích léčby a změny v nákladech na protinádorové léky. Záměrně používáme zjednodušení, oproti změnám v léčebných výsledcích stavíme pouze náklady na protinádorové léky, nikoliv tedy veškeré náklady na léčbu a náklady na vyšetřovací postupy.
Tento segment představuje tu nejdůležitější část nákladů na léčbu. V průběhu času také podstatně narůstají náklady na ostatní součásti komplexní léčby, tedy na vyšetřování, léčbu podpůrnou, léčbu komplikací, léčbu infekcí, náklady na hospitalizaci. Zahrnutí veškerých nákladů by činilo text méně přehledným.
Fakta, ilustrující změny ve výsledcích léčby a nákladech na ni, chceme předložit ekonomům, obeznámeným se zdravotní politikou, a dalším odborníkům s žádostí o komentář, o úvahy, spekulace a návrhy řešení. V závěru jen humornou formou ilustrujeme možná řešení. Zdůrazňujeme, že analýza možných řešení není cílem naší práce, to ponecháváme ekonomům a odborníkům na zdravotnické systémy.
Možných řešení je vždy více, každé přináší pozitiva i negativa, přičemž hodnocení každé vývojové cesty, navržené ekonomy, může mít jak kladná, tak negativní hodnocení v závislosti na úhlu pohledu a ekonomické situaci toho, kdo uvedené návrhy bude hodnotit.
Standardní farmakoekonomické parametry: náklady na prodloužení života o 1 měsíc, případně 1 rok v tomto článku neuvádíme, neboť jejich výpočet není cílem našeho sdělení.
Metody výpočtu
Náklady jsou vypočteny z maximální možné úhrady pojišťovnou (cena „MAX“) dle Číselníku VZP platného od 1. 8. 2006. Ceny léků, které byly použity k výpočtu, uvádíme i v tabulkách.
Dávky léků jsou počítány pro dospělého člověka průměrné postavy, což je jedinec o povrchu těla 2,0 m2. Léčebná schémata jsou uvedena v textu či v tabulkách.
Nemocniční lékárny mohou mít jiné smluvní ceny a ceny se také mění v čase.
Mnohočetný myelom
Charakteristika nemoci
Mnohočetný myelom je choroba, která typicky způsobuje destrukci kostí. To se projeví postupně se zhoršujícími bolestmi páteře.
Nemoc dále způsobuje chudokrevnost, která způsobuje únavu, nevýkonnost, dušnost, zprvu jen při sportu či jiné námaze, později i v klidu.
Někdy nemoc poškozuje ledviny, což se projeví buď omezenou tvorbou moči s neschopností vyloučit odpadní látky z těla, nebo symetrickými otoky nohou, které způsobuje nízká koncentrace bílkovin. Ta je způsobena ztrátami bílkovin poškozenými ledvinami.
Později se k těmto základním příznakům připojuje zhoršená obrana proti infekcím (opakované infekce), případně odchylky ve srážení krve, krvácivé komplikace, nebo naopak trombózy a plicní embolie.
Ročně tato nemoc postihne 3-4 osoby/100 000 obyvatel ČR. Je častější ve věku nad 50 let, takže pokud by se měl uvést výskyt pouze ve skupině osob nad 50 let, byl by výskyt (incidence) této nemoci podstatně vyšší. Se zavedením složitějších a nákladnějších diagnostických postupů [1-5] je možné tuto chorobu diagnostikovat včas, dříve než dojde k nevratnému poškození organizmu, pokud je ovšem pacient k tomuto vyšetření odeslán.
Léčba klasickou chemoterapií
První účinná chemoterapie byla použita v 60. letech minulého století, jednalo se o kombinaci tabletového alkylačního cytostatika melfalanu (firemní název Alkeran) a prednisonu. Melfalan se podával po dobu 4-7 dnů v dávce 1 mg/kg na 1 cyklus, ve 4-6týdenních cyklech. Dávky prednisonu kolísaly mezi 1-2 mg/kg/den po 4-7 dní vždy s melfalanem.
Nástup léčebného účinku byl pozvolný, takže zahajovací (iniciální) léčba trvala 9 [6-12] měsíců.
V dalších letech byla vyvinuta četná další cytostatika a byla testována v rámci klinických studií s nadějí, že vícelékové postupy povedou rychlejšímu nástupu léčebné odpovědi, vyššímu počtu léčebných odpovědí a hlavně, že signifikantně prodlouží život. Výsledky několik desetiletí klinických studií byly shrnuty ve 2 metaanalýzách, dle nichž mají opravdu vícelékové kombinace rychlejší nástup léčebné odezvy, což je velmi důležité pro nemocné s agresivní formou této nemoci. Při analýze celé skupiny všech nemocných nebylo prokázáno signifikantní prodloužení délky života, tento trend byl prokázán pouze v podskupině mladších nemocných s agresivní chorobou.
Takže počátkem 90. let minulého století se za standardní léčebný postup považovala léčba 9 cykly chemoterapie melfalan a prednison nebo vícelékovou kombinací - např. 6 cykly kombinované chemoterapie, obsahující vinkristin (0,4-0,5 mg i.v. 1.-4.den), doxorubicin, synonymem adriamycin (9 mg/m2 1.-4. den) a dexametazon (40 mg p.o. 1.-4., 10.-13. a 20.-23. den), akronymem VAD [6,7].
Vysokodávkovaná chemoterapie s autologní transplantací
Od poloviny 90. let minulého století se stala standardním léčebným postupem pro iniciální léčbu po stanovení diagnózy chemoterapie VAD, zkrácená na 3-4 cykly, následovaná vysokodávkovanou chemoterapií s transplantací autologních krvetvorných buněk.
O co je tento postup výhodnější oproti klasické chemoterapii? Odpověď na tuto našly klinické studie, v nichž byli pacienti rozděleni do srovnatelných skupin dle prognostických ukazatelů, jedna skupina byla léčena klasickou chemoterapií, druhá skupina pak vysokodávkovanou chemoterapií s autologní transplantací. Pacienti, kteří byli léčeni vysokodávkovanou chemoterapií, měli prodloužen medián přežití průměrně o 1,5 roku oproti nemocným, kteří dostávali pouze klasickou chemoterapii.
Zahájení léčby klasickou chemoterapií VAD s následující vysokodávkovanou chemoterapií (melfalan 200 mg/m2) s autologní transplantací se tedy od poloviny 90. let 20. století považuje za optimální léčebný postup [8-12]. Přínos vysokodávkované chemoterapie ilustrují tab. 1 a 2 a v českém odborném písemnictví prodloužení přežití vlivem vysokodávkované chemoterapie s autologní transplantací zdokumentoval prof. Ščudla se svým kolektivem [13].
Tab. 1. Srovnání léčebných výsledků vysokodávkované chemoterapie s autologní transplantací s léčebnými výsledky klasické chemoterapie na příkladu několika velkých randomizovaných klinických studií 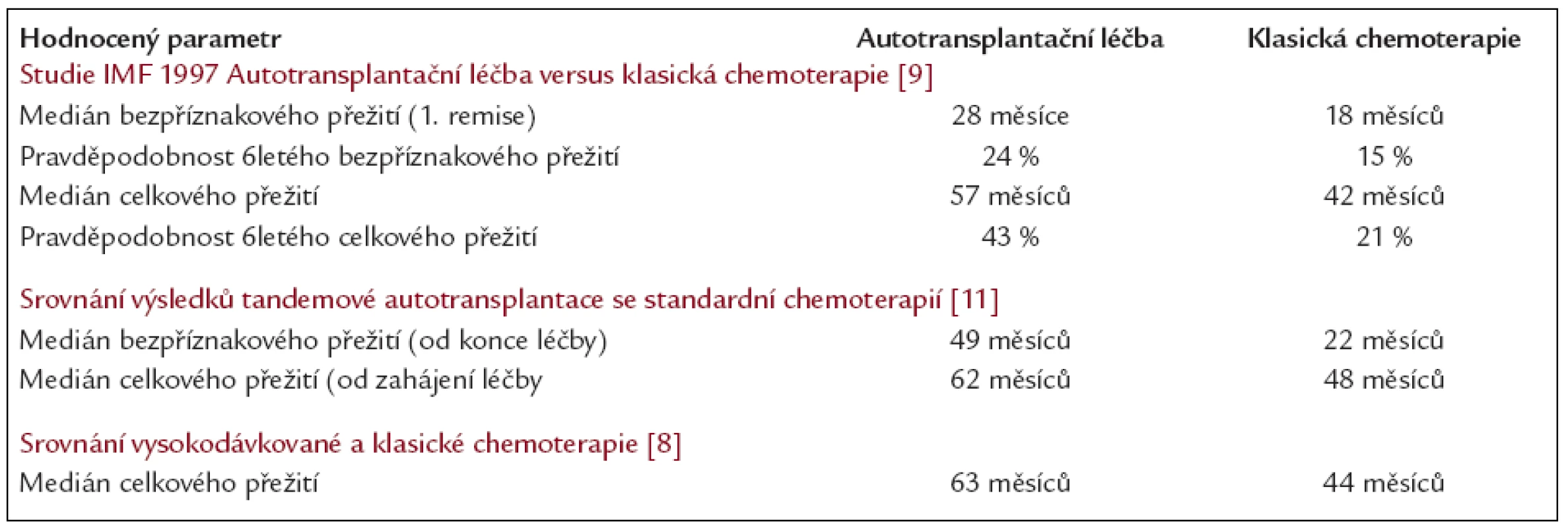
Tab. 2. Věk, způsob léčby a mezinárodní stagingový systém (ISS) [12]. Analýza dle způsobu léčby. ![Věk, způsob léčby a mezinárodní stagingový systém (ISS) [12]. Analýza dle způsobu léčby.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b0f2cabef6971bd4abb881ffff05ef72.png)
Přechod z běžné chemoterapie na vysokodávkovanou chemoterapii s autologní transplantací umožnily leukocytární růstové faktory, které farmaceutický průmysl uvedl na trh počátkem 90. let 20. století a technologický rozvoj krevních separátorů, přístrojů pro sběr kmenových buněk krvetvorby z periferní krve a samozřejmě také technologie kryoprezervace těchto buněk.
Začlenění talidomidu do iniciální léčby u osob nevhodných k vysokodávkované chemoterapii
Po mnoha klinických studiích, ověřujících přínos talidomidu v situaci recidivující nemoci, začal být tento lék testován v rámci kombinované iniciální léčby. Její výsledky pak byly srovnávány s výsledky doposud platného zlatého standardu.
Palumbo et al publikoval výsledky italské klinické studie fáze III, která srovnávala zlatý standard, melfalan + prednison s novou kombinací, melfalan + prednison + talidomid 100 mg denně kontinuálně až do známek relapsu či do známek progrese nemoci. Výsledky této studie jsou natolik důležité, že je uvedeme v přehledné tab. 3. Do studie byly zařazováni pacienti ve věku 60-85 let [14,15].
Tab. 3. Srovnání výsledků léčby při použití melfalanu + prednisonu anebo melfalanu + prednisonu + talidomidu (18). 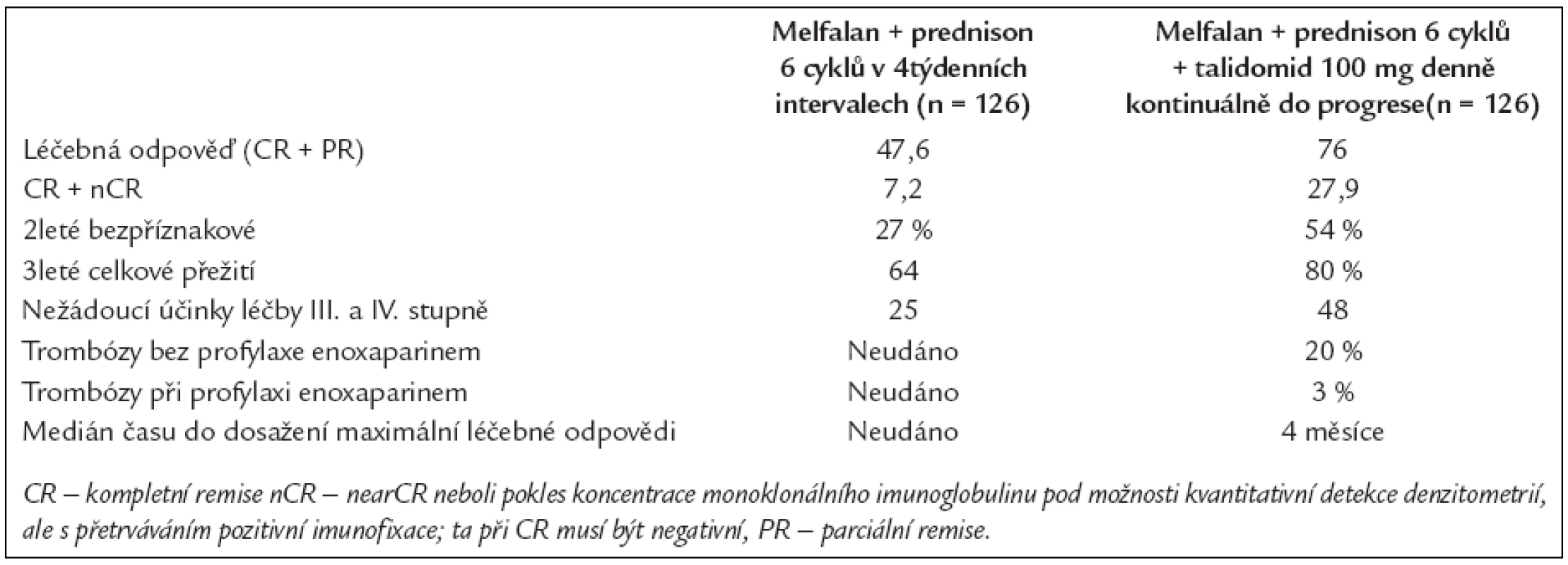
Druhá studie, testující rozšíření melfalanu a prednisonu o talidomid, pochází z francouzsky mluvících zemí. Tato studie rozdělila nemocné do 3 skupin, první byla léčena podle zlatého standardu melfalan + prednison, další měla melfalan + prednison + talidomid a třetí ve stejné populaci starších pacientů měla v léčebném plánu vysokodávkovanou chemoterapii s melfalanem v poloviční dávce oproti klasickému postupu, tedy jen 100 mg/m2. Věk pacientů, zařazených do studie, se pohyboval v rozmezí 65-75 let. Výsledky léčby opět shrneme v tab. 4. Autoři francouzské studie došli ke stejnému závěru: „Pro pacienty nevhodné ke klasické vysokodávkované chemoterapii s autologní transplantací (pacienti > 65 let) je melfalan + prednison + talidomid (MPT) optimální léčbou.“ Výsledky MPT jsou lepší než výsledky MP a také lepší než výsledky středně dávkovaného melfalanu [16].
Tab. 4. Výsledky francouzské studie, testující léčebné postupy u pacientů nevhodných ke klasické vysokodávkované chemoterapii s autologní ransplantací (16). 
Začlenění bortezomibu do iniciální léčby u osob nevhodných k vysokodávkované chemoterapii
Po mnoha klinických studiích, které prokázaly účinnost bortezomibu při recidivě nemoci, byla v roce 2006 byla in extenso zveřejněna první klinická studie I./II. fáze, v níž byl použit bortezomib + melfalan + prednison v rámci iniciální léčby.
Do studie bylo začleněno 60 nemocných starší 65 let, horní limit není udán. Výsledky byly srovnány s výsledky podobné skupiny nemocných, léčených v předchozích letech melfalanem a prednisonem neboli s historickou kontrolní skupinou [17]. Tato studie zmapovala toxicitu léčebného režimu a bude jistě východiskem dalších studií fáze III, které budou hledat optimální začlenění bortezomibu do indukční léčby. Výsledky kombinace bortezomibu s melfalanem a prednisonem byly výrazně lepší než výsledky dosažené v kontrolní skupině. Výsledky klinických studií fáze I a II však nelze brát jako průkaz superiority určitého léčebného postupu, to je až cílem klinických studií fáze III, které jsou v běhu. V roce 2006 nebyly zveřejněny in extenso žádné výsledky klinické studie fáze III, testující bortezomid v kombinované léčbě první linie.
Testování nových režimů pro nemocné schopné podstoupit vysokodávkovanou chemoterapii s autologní transplantací
V roce 2007 jsou v běhu klinické studie, hledající optimální skloubení nových léků: bortezomibu, talidomidu, lenalidomidu, s vysokodávkovanou chemoterapií s autologní transplantací [18]. Zatím žádný z těchto testovaných postupů není tak dalece zhodnocen, aby mohl být nazván novým standardem pro mladší nemocné. Je však pravděpodobné, že vhodně kombinovaná léčba obsahující jak vysokodávkovanou chemoterapii s autologní transplantací, tak i nové cílené léky (bortezomib, lenalidomid či talidomid), bude mít lepší výsledky než v současnosti standardně používané postupy vysokodávkované chemoterapie.
Shrnutí vývoje léčby mnohočetného myelomu
- V letech 1990-1995 optimální iniciální léčbu představovalo v průměru 9 cyklů melfalanu a prednisonu nebo 6 cyklů chemoterapie VAD či jiné polychemoterapie.
- Po roce 1995 se optimálním režimem pro pacienty mladší 65 let, bez dalších závažných chorob, stala vysokodávkovaná chemoterapie s autologní transplantací. Pro nemocné, nevhodné pro tuto léčbu, se způsoby iniciální léčby neměnily, zůstávala léčba melfalanem a prednison nebo polychemoterapií VAD a dalšími kombinacemi.
- V roce 2006 zůstala klasická vysokodávkovaná chemoterapie s autologní transplantací stále zlatým standardem, zatímco probíhají klinické studie, testující různé kombinace vysokodávkované chemoterapie s autologní transplantací v součinnosti s novými léky (lenalidomid, bortezomib, talidomid).
- Ke změně došlo u pacientů, kteří nejsou vhodní pro vysokodávkovanou chemoterapii, byla prokázána superiorita začlenění talidomidu do klasické chemoterapie.
- Po roce 2006 se očekává, že klinické studie prokáží přínos kombinací nových léků (bortezomibu, lenalidomidu, talidomidu) s klasickou chemoterapií či vysokodávkovanou chemoterapií. Očekává se, že budou definovány nové optimální postupy (zlaté standardy).
Vývoj nákladů na léčbu mnohočetného myelomu
Výpočet cen těchto léčebných postupů se odvíjí od číselníku VZP, platného od 1. 8. 2006, které uvádí tab. 5.
Tab. 5. Ceny za 1 balení léků, používaných pro léčbu mnohočetného myelomu dle číselníku VZP platného od 1. 8. 2006. 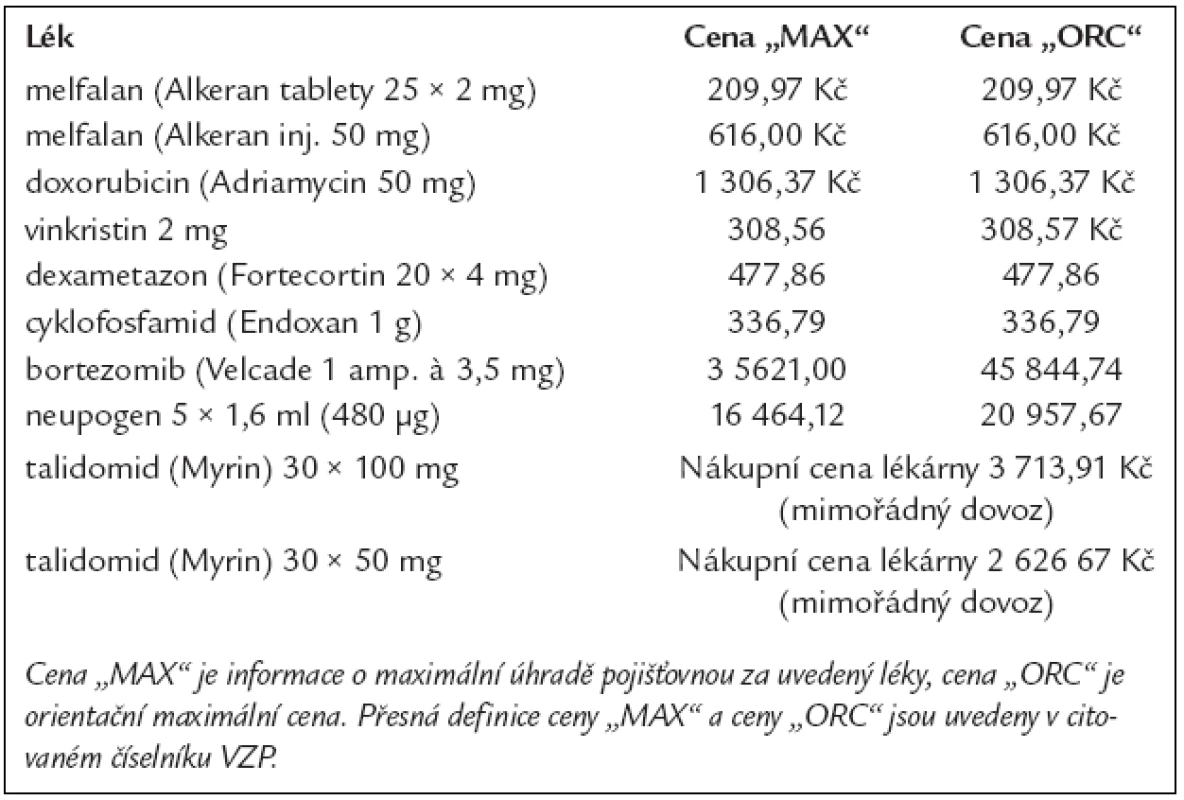
Cenu, resp. náklady spojené s odběrem periferních kmenových buněk (PBSC) a autologní transplantací, nelze v podmínkách českého zdravotnictví vyčíslit přesně. Ceny léčiv se napříč jednotlivými pracovišti sice nemění, ale cena lůžkodne výrazně kolísá.
Náklady na odběr kmenových buněk krvetvorby z periferní krve (peripheral blood stem cells - PBSC) se výrazně odvíjí od použité mobilizační chemoterapie a dávkování leukocytárního růstového faktoru - G-CSF - v rámci mobilizace. Intenzivnější mobilizační chemoterapie (tedy u mnohočetného myelomu dávka cyklofosfamidu pro mobilizaci více než 4-5 g/m2) znamená poměrně malý přínos pro pacienta, ale výrazně vyšší riziko nežádoucích účinků, které mimo jiné léčbu prodražují.
Rovněž náklady na provedení vysokodávkované chemoterapie s autologní transplantací PBSC se zase do velké míry odvíjejí od zkušeností transplantačního týmu, optimální přípravy pacienta a vhodně volené podpůrné terapie.
Pokud jsme zprůměrovali náklady spojené se sběrem PBSC a autologní transplantací u několika desítek pacientů s mnohočetným myelomem ve FN Brno, pak lze tento postup vyčíslit přibližně částkou 200 000 Kč. Protože mobilizace a odběr PBSC může z velké části proběhnout ambulantně, nezapočítali jsme zde do nákladů lůžkodny. Vysokodávkovaná chemoterapie a autologní transplantace probíhá v našich podmínkách vždy za hospitalizace, a proto jsou zde započítány i lůžkodny. Do uvedených nákladů jsou zahrnuty hlavní položky, běžné léky a vyšetření jsou zahrnuty do platby za lůžkoden.
Náklady na mobilizaci a odběr PBSC a autologní transplantaci shrnují tab. 6 a 7.
Tab. 6. Průměrné náklady na sběr krvetvorných buněk pro autologní transplantaci u pacientů s mnohočetným myelomem. 
Tab. 7. Průměrné náklady na vysokodávkovanou chemoterapii s autologní transplantací. 
V tab. 8 uvádíme vypočítanou cenu za léčebné postupy, používané v letech 1990-2006, ať již v rámci iniciální léčby nebo léčby relapsu.
Tab. 8. Změny v nákladech na iniciální léčbu pacienta s nově diagnostikovaným mnohočetným myelomem a na léčbu relapsu bortezomibem v monoterapii. Cena sběru kmenových buněk a následné vysokodávkované chemoterapie s autologní transplantací je zde odhadnuta na 200 000 Kč. 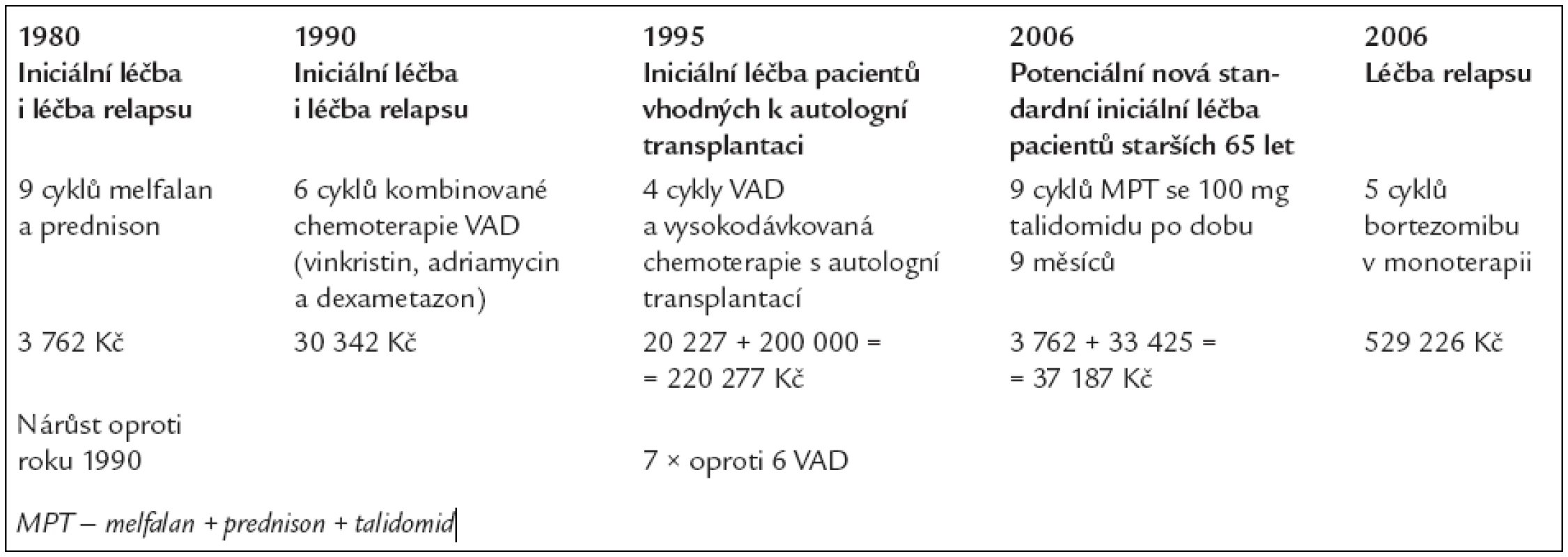
Chemoterapie melfalan a prednison, stejně jako chemoterapie VAD, zakončená vysokodávkovanou chemoterapií, se v ČR běžně používá v rámci iniciální léčby. Podání bortezomibu nebo talidomidu v rámci iniciální léčby nebylo v roce 2006 hrazeno v rámci iniciální léčby. Vyhláška Ministerstva zdravotnictví u z 1. 8. 2006 tuto léčbu připouští pouze v případě relapsu nemoci.
Výpočty tedy ukazují, kolik by stála léčba kombinací talidomid + melfalan + prednison.
Preparát bortezomib (Velcade) není v iniciální léčbě standardně používán mimo klinické studie a zatím není ani definován optimální režim s bortezomibem pro iniciální léčbu. Nicméně, protože chceme ukázat, jak se vyvíjí náklady, tak do tabulky zahrneme náklady na léčbu relapsu bortezomibem monoterapií v dávkách, které jsou tč. používány pro léčbu relapsu nemoci. V průměru se v ČR aplikuje 5 cyklů, a proto uvádíme náklady s tímto spojené v tab. 9.
Tab. 9. Náklady na léčbu mnohočetného myelomu preparátem bortezomib dle dávkování, které bylo použito v klinických studiích a které lze použít pro léčbu relapsu. 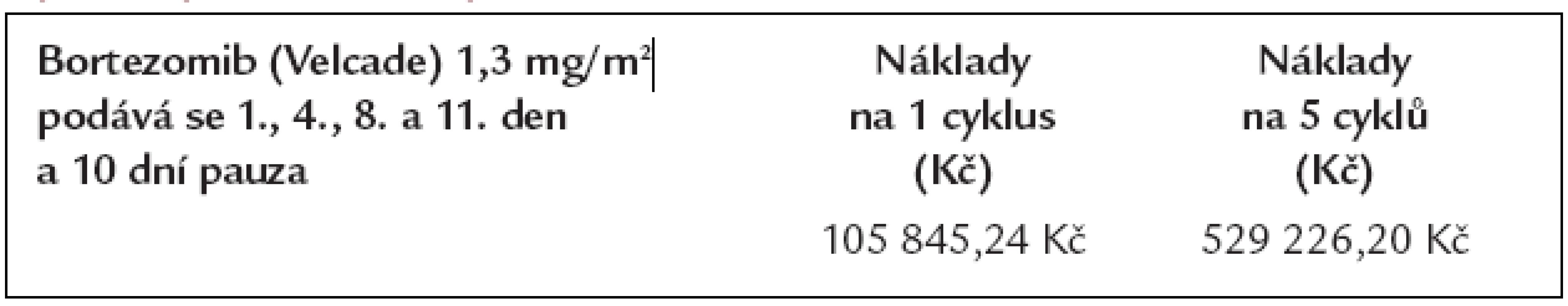
Difuzní velkobuněčný B-lymfom
Charakteristika nemoci
Tato choroba se odvíjí od nádorové změněných lymfocytů. Onemocnění začíná v 70 % zvětšováním mízních (lymfatických) uzlin, ve 30 % začíná v mimouzlinové tkáni. Prakticky může postihnout kterýkoliv orgán. Pokud je to na povrchu těla, přichází člověk, postižený touto chorobou, k lékaři s tím, že si nahmatal zvětšenou uzlinu či infiltrát. Když ke zvětšování uzlin dochází v dutině hrudní, pramení příznaky z útlaku orgánů: postupně se zhoršující kašel, pocity tlaku na hrudníku, zvětšování obvodu krku, problémy se zapínáním límečku košile. Pokud nádorově změněné uzliny expandují v dutině břišní, způsobuje to pocity zhoršeného trávení, zvětšování objemu břicha. Někdy nemocného přivedou k lékaři zvýšené teploty či horečky (trvající déle než 3 týdny) bez průkazu infekčního původu, nebo noční pocení, případně úbytek hmotnosti. Maligní tkáň poměrně rychle roste a bez léčby je schopna zahubit nositele řádově v měsících.
Vzhledem k rychlému růstu a rychlé syntéze nukleových kyselin je možno tuto chorobu alespoň u části postižených vyléčit. Podívejme se, jak se měnily léčebné postupy.
Vývoj účinnosti léčebných postupů u difuzního velkobuněčného B-lymfomu
Do roku 2000 představovala kombinace cytostatik s akronymem CHOP (doxorubicin 50 mg/m2 1. den, vinkristin 1,4 mg, max. 2,0 mg i.v. 1. den, cyklofosfamid 750 mg/m2 i.v. 1. den a prednison 1-2 mg/m2 1.-5. den) optimální léčebný postup. Byly testovány i četné jiné chemoterapeutické kombinace, ale žádná z nich se neukázala lepší.
Příchod humanizované monoklonální protilátky proti antigenu CD20 do klinické praxe znamenal průlom. Antigen CD20 je přítomen pouze na B-lymfocytech, od nichž jsou maligní buňky odvozeny, a tento znak si ponechávají. Rituximab (firemním názvem Mabthera) je lék, který se váže pouze na tento antigen a způsobuje destrukci buněk, na něž se naváže. Konečně magická střela (kulka), která si sama hledá cíl.
Jako první byly zveřejněny výsledky velké prospektivně randomizované studie, provedené ve francouzsky mluvících zemích. Musíme zdůraznit, že do studie byly zařazováni pacienti starší 60 let a mladší 80 let. Při hodnocení po 5 letech bylo beze známek progrese nemoci 54 % nemocných, léčených chemoterapií v kombinaci s rituximabem (R-CHOP). Ve skupině nemocných, léčených pouhou chemoterapií, bylo beze známek progrese pouze 30 % z nich. To se samozřejmě promítlo i do prodloužení celkového přežití při použití rituximabu, jak ilustrují graf 1 a 2 [19]. V těchto grafech je názorně zřetelný rozdíl výsledků dle použitých statistických metod hodnocení. Prodloužen je interval celkového přežití (overall survival - OS), dále také interval event free survival - EFS, čili délka přežití bez jakékoliv nepříznivé změny zdraví (relaps nemoci, ale i úmrtí na zcela jinou nemoc, například infarkt apod.) a progression free survival - PFS čili hodnocení délky přežití, kdy z hodnoceného souboru jsou vyloučeny osoby s úmrtím z jiné příčiny než je progrese nemoci nebo komplikace léčby. Parametr PFS byl snad nejvýrazněji prodloužen vlivem rituximabu.
Graf 1. R-CHOP zlepšil celkové přežití (OS) v rámci léčby prvé linie difuzního velkobnuněčného B-lymfomu (DLBCL) (GELA-LNH 98.5) u pacientů starších 65 let. Při vyhodnocení celkového přežití jsou hodnocení všichni nemocní zařazení do klinické studie. 
Graf 2. R-CHOP zlepšil 5leté EFS and PFS v rámci léčby prvé linie DLBCL (GELA-LNH 98.5). Jde o tu samou studii jako v grafu 1, parametr EFS (event free survival) charakterizuje přežití bez jakékoliv závažné komplikace (úmrtí na nemoc, nebo jinou příčinu, či relaps nemoci). Rozdělení dle parametru PFS (progression free survival) vylučuje osoby zemřelé z jiného důvodu než je progrese lymfomu či komplikace léčby. Rozdíly ve výsledcích léčby z hlediska PFS jsou u této skupiny nemocných nejvýraznější. 
Prodloužení doby bez příznaků i prodloužení celkového přežití bylo potvrzeno také v podskupině mladších pacientů (studie MINT) [20-22], jak ukazuje graf 3.
Graf 3. Přidání rituximabu k chemoterapii signifikantně prodloužilo celkové přežití (overall survival – OS; MInT studie). Do této studie byly zařazováni prognostiky příznivé formy difuzního velkobuněčného lymfomu. 
Velmi ilustrativně prokázala přínos rituximabu analýza údajů o trvání remise a přežití pacientů s touto maligní nemocní, léčených jak v rámci velkých center, tak i menších praxí. Výsledky léčby byly hlášeny do centrálního registru a v něm pak byly podrobeny analýze. Tato analýza je průkazem superiority tohoto léčebného postupu pro všechny nemocné a nejen pro ty, které splňují vstupní podmínky pro zařazení do klinických studií, jak ilustrují grafy 4 a 5. Analýza proběhla ve státě Britská Kolumbie v Kanadě [23].
Graf 4. Výsledky analýzy registru pacientů s difuzním velkobuněčným lymfomem v Britské Kolumbii. Délka celkového přežití před zavedením rituximabu do léčby a po jeho zavedení do léčby tohoto lymfomu (n = 292). 
Graf 5. Celkové (OS) přežití dle populačního registru Britské Kolumbie (n = 292) a vliv věku na výsledek léčby (věk ≥ 60 nebo < 60 let) Sehn J Clin Oncol 2005; 23: 5027–5033. 
V roce 2006 lze tedy považovat kombinaci rituximabu s cytostatickou léčbou za standardní postup pro nově diagnostikované nemocné. Pokud není dosažena kompletní remise, je možné zakončit léčbu vysokodávkovanou chemoterapií s autologní transplantací [24].
Vývoj nákladů na léčbu difuzního velkobuněčného B-lymfomu
A jak se vyvíjely náklady na léčbu? To doložíme tab. 10, v níž jsou ceny použitých léků, a tab. 11, v níž jsou spočítány náklady na medikamenty.
Tab. 10. Cena 1 balení léků používaných pro léčbu difuzního velkobuněčného lymfomu dle číselníku VZP platného od 1. 8. 2006. 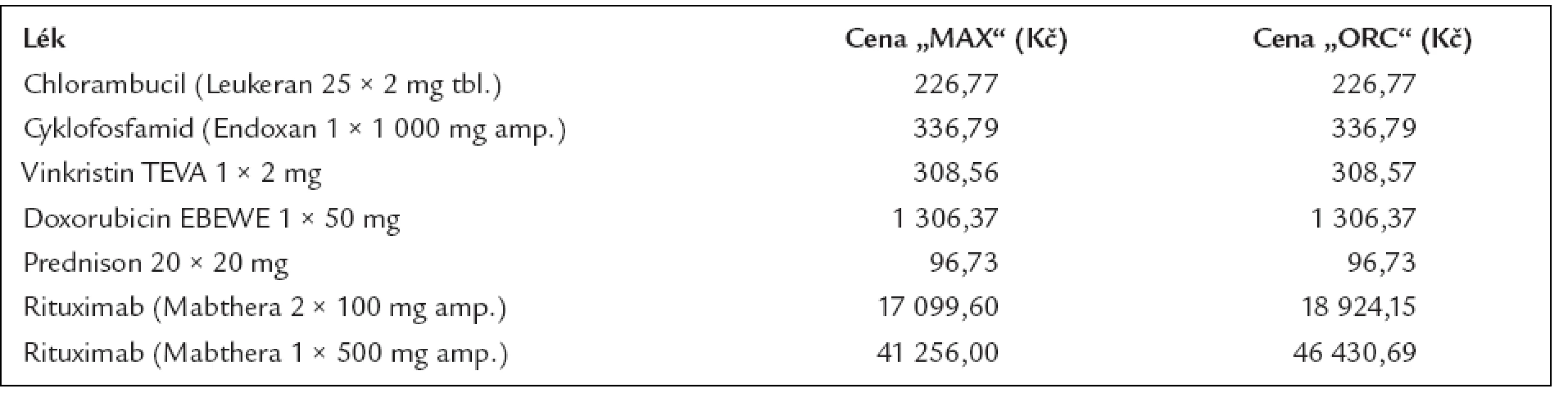
Tab. 11. Vývoj nákladů na léčbu difuzního velkobuněčného B-lymfomu. 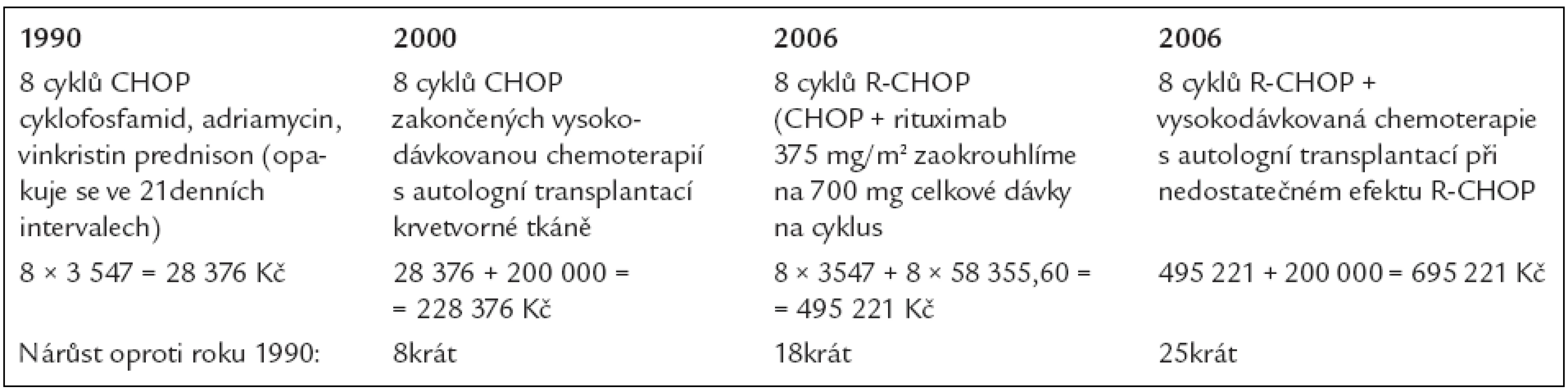
A jaké nové postupy k dalšímu zlepšování jsou testovány? Jedním z nich je navýšení rituximabu v prvním cyklu na 4 aplikace, R-denzní CHOP, což znamená zvýšení nákladů o dalších 175 066,80 Kč ke standardním 8 cyklům R-CHOP, čímž se dostaneme na cenu 670 021,6 Kč za protinádorové léky, použité v rámci indukční léčby.
Chronická myeloidní leukemie
Charakteristika nemoci
Chronická myeloidní leukemie je choroba postihující osoby starší 20 let. Prvním příznakem je nejčastěji tlak v levém podžebří, způsobený velkou slezinou. Prvním příznakem může být také noční pocení nebo zvýšená teplota až horečka bez přítomnosti infekce nebo úbytek hmotnosti a případně patologická únava, charakteristická slovy: „Jsem unaven, a nevím po čem.“ Při vysokém počtu bílých krvinek vzniká trvalá erekce (priapismus), která je velmi bolestivá.
Nemoc má 3 fáze:
- Chronická fáze: Nemoc může být zcela bez příznaků a náhodné vyšetření krevního obrazu ji odhalí, nebo jsou přítomny jen nezávažné, výše uvedené příznaky. Nemoc však postupně získává na agresivitě a přechází do dalšího stadia.
- Fáze akcelerace: Pod vlivem změn v genetické informaci maligních buněk nemoc získává na agresivitě a postupně přechází do stadia blastického zvratu. Příznaky nemoci se zintenzivňují.
- Fáze blastického zvratu - nemoc se chová jako akutní leukemie a projevuje se těžkými infekcemi nereagujícími na antibiotickou léčbu, spontánním krvácením či krvácením po minimálním poranění, slabostí, dušností, spavostí a únavností.
Vývoj účinnosti léčebných postupů u chronické myeloidní leukemie
Tato nemoc se v roce 1990 léčila cytostatikem hydroxyureou (firemní název Litalir), dříve busulfanem (Mylecytan). V polovině 90. let 20. století se zjistilo, že o něco lepší výsledky než hydroxyurea dosahuje interferon α.
Interferon α se stal u této nemoci, respektive u celé skupiny myeloproliferativních chorob, lékem první volby, pokud pacient nebyl směřován k alogenní transplantaci. Interferon α na rozdíl od předchozích léčebných postupů u části pacientů navodil cytogenetickou remisi, jejíž dosažení bylo předpokladem signifikantního prodloužení délky přežití.
V roce 2001 se do klinické praxe dostal zcela nový lék, který nepůsobí na genetickou informaci jako léky ze skupiny cytostatik, který ale zasahuje do signálního systému maligní buňky tím, že inhibuje bcr-abl tyrozinovou kinázu. Ta má pro vývoj této nemoci klíčovou úlohu. Bcr-abl tyrozinová kináza je přítomna pouze v leukemických buňkách, její kompletní zablokování vede k ústupu (remisi) chronické myeloidní leukemie. Tento lék progresi nemoci brzdí, nevede k jejímu odstranění, proto je nutno jej užívat stále. V průběhu nemoci se může na něj vyvinout rezistence. V některých případech může být již zpočátku nemoci přítomna mutace bcr-abl tyrizonové kinázy, kterou imatinib ve standardní dávce není schopen zablokovat.
Vzhledem k tomu, že lék je používám teprve od roku 2001, nejsou pro tak krátkou dobu sledování v roce 2006 retrospektivní data popisující, do jaké míry tato nová léčba prodloužila medián přežití.
K dispozici je pouze kvalifikovaná extrapolace publikovaných dat, která vychází z již zjištěné skutečnosti, že imatinib dosahuje podstatně vyššího počtu cytogenetických remisí, než tomu bylo u interferonu α. Rozdíl v počtu kompletních cytogenetických remisí byl základem pro kvalifikované odhady míry prodloužení mediánu přežití vlivem imatinibu. Znázorňují to grafy 6 a 7.
Graf 6. Imatinib vs interferon + cytosinarabinosid: imatibin dosahuje podstatně vyššího počtu léčebných odpovědí, než je tomu u interferonu α v kombinaci s cytosinarabinosidem. 
Graf 7. Křivka přežití při imatinibu je podstatně příznivější než tomu bylo při předchozích léčebných postupech. 
Medián přežití nemocných léčených imatinibem od časné fáze nemoci je odhadován na 15,3 roky. Medián přežití stejné skupiny chorých léčených interferonem α s nízkými dávkami cytosinarabinosidu dosáhne maximálně 9,07 roku [25-27].
Ne všechny mutace bcr-abl tyrozinových kináz si však dlouhodobě uchovávají senzitivitu na imatinib. V některých případech může být bcr-abl tyrozinová kináza již zpočátku rezistentní či rezistenci může získat. Pro tyto případy jsou vyvíjeny další blokátory tyrozinových kináz, které by byly účinné i v těchto případech.
Prvním z preparátů, který se dostává na trh, je dasatinib s firemním jménem Sprycel. Je to první z takzvaných duálních inhibitorů (ABL-SRC inhibitor), jejichž cílem je inhibovat jak abl kinázu, tak také src kinázu. Předpokládá se totiž, že tato src kináza má důležitou roli v patogenezi vzniku CML a v progresi nemoci. Dasatinib má in vitro 100-300krát vyšší afinitu k bcr-abl kináze ve srovnání s imatinibem,. Dále má signifikantní aktivitu proti c-kit a k dalším kinázám.
První studie prokázaly, že dasatinib v dávce 2krát denně 70 mg pomůže u pacientů, u nichž imatinib v dávce 400 mg denně neúčinkuje. Je účinnější než imatinib v dávce 800 mg denně (zvýšením dávky imatinibu lze překonat rezistenci). Z nežádoucích účinků tohoto léku je nutno jmenovat zažívací problémy a tvorbu serózních výpotků v 10-15 % případů (tab. 12).
Tab. 12. Výsledky fáze II studie s dasatiniben u pacientů v chronické fázi CML, jejichž nemoc nereagovala na imatinib, nebo kteří jej netolerovali (Baccarani M, et al. ASH 2006. Abstract 164). 
Ve fázi zkoušení je preparát nilotinib.
Zdůrazňujeme, že cílem těchto blokátorů bcr-abl tyrozinované kinázy je dlouhodobě brzdit rozvoj nemoci. Při přerušení léčby dochází k recidivě. Proto je tyto léky nutno podávat trvale, dokud je nemoc na ně senzitivní.
Vývoj nákladů na léčbu u chronické myeloidní leukemie
A nyní si ukážeme v tab. 13, co stojí léky používané pro léčbu chronické myeloidní leukemie, a následně v tab. 14, co stojí roční léčba, neboli jak se zlepšující se léčebné výsledky odrážejí v nákladech na léčbu.
Tab. 13. Ceny 1 balení léků, používaných pro léčbu chronické myeloidní leukemie dle číselníku VZP, platného od 1. 8. 2006, s výjimkou preparátu dasatinib, u něhož byla cena stanovena až v dubnu roku 2007. 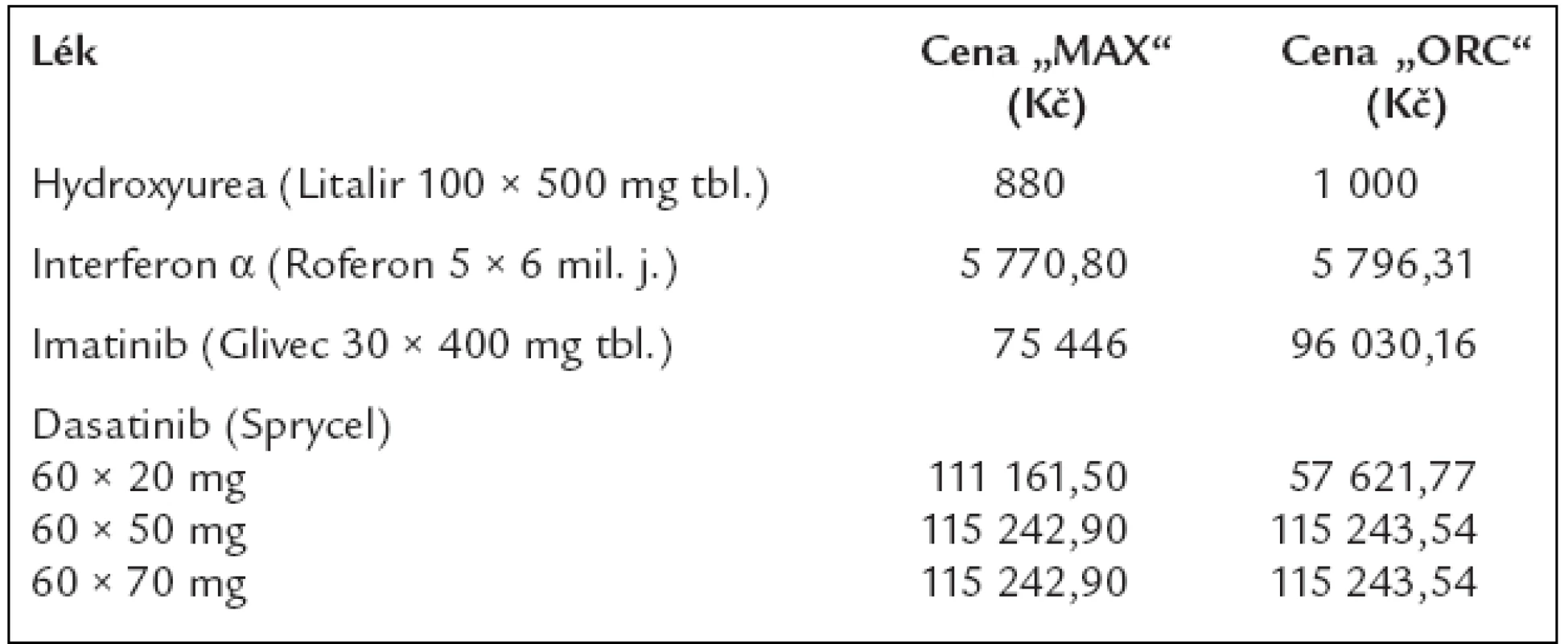
Tab. 14. Vývoj nákladů na roční léčbu pacienta s chronickou myeloidní leukemií. 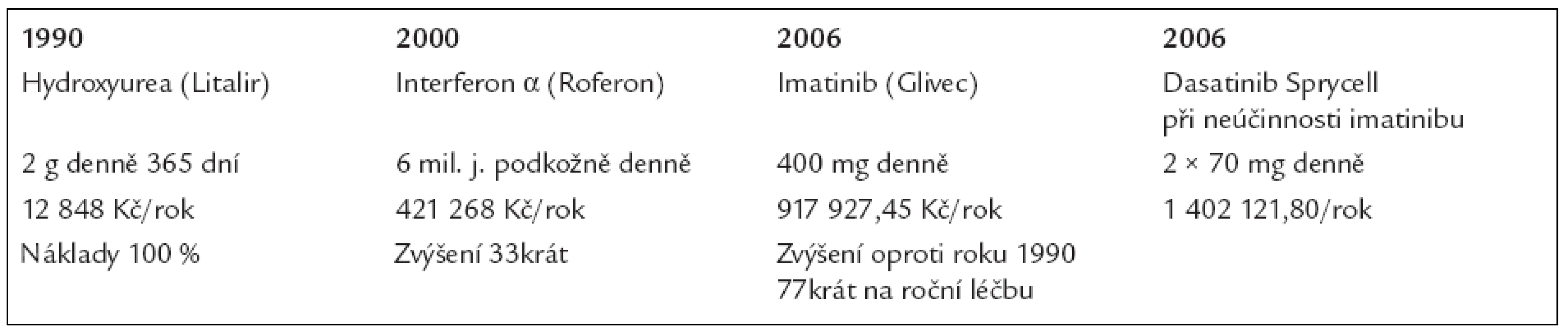
Vzhledem k prodloužení délky života dochází v ČR ke kumulaci těchto pacientů, protože jich neumírá tolik jako dříve. Proto je zapotřebí stále větší sumy peněz na imatinib (firemní název Glivec), případně jiné blokátory tyrozinových kináz, aby se u této zvětšující se skupiny nemocných udržela nemoc pod kontrolou.
Zobecnění údajů o vývoji nákladů na léčbu
Uvedené ne příliš četné choroby jsem zvolili jako příklady, protože s vývojem jejich léčby jsem dobře obeznámeni a můžeme na nich dobře ilustrovat změny, které však platí obecně pro celou hematoonkologii, ale jen pro ni.
Indukční léčba maligních chorob preparáty ze skupiny cytostatik, které byly vyvinuty v 60. a 70. letech minulého století, se dnes pohybuje řádově v tisících korunách na celou indukční léčbu.
Indukční léčba preparáty ze skupiny cytostatik, které byly vyvinuty v 90. letech minulého století a později, se dnes pohybuje řádově v desítkách tisíc a může přesáhnout sumu 100 tisíc.
Po roce 2000 se do praxe dostávají necytostatické léky, které mají buď formu malých molekul, které blokují určité signální cesty (molekuly) v buňce (např. imatinib, dasatinib, bortezomib), nebo monoklonální protilátky proti některým strukturám buňky (rituximab, alemtuzumab). Náklady na indukční léčbu těmito léky, nebo na roční léčbu, se pohybují mezi půl miliónem a jedním miliónem Kč.
U některých diagnóz již byly zveřejněny příznivé výsledky léčebného postupu, v němž byly kombinovány 2 nové molekuly, například monoklonální protilátka rituximab a bortezomib. Náklady na tuto léčbu si lze odvodit z výše uvedených čísel.
A lze si představit léčbu pomocí 3 léčiv ze skupiny cílených léků. A tak se ptejme, jak může na tento vývoj reagovat zdravotní politika ČR?
Možných řešení je jistě více. Je nutno je přesně popsat, poukázat na jejich přednosti i zápory, a diskutovat o nich. Je nutno předvídat další prudký vývoj možností medicíny i nákladů na ni, modelovat možné cesty zdravotní politiky, mluvit o nich bez emocí, ale také předvídat dopady jednotlivých řešení na společnost.
Zvolení politici mají právo rozhodnout, kterou cestou se bude ubírat zdravotní politika, ale mají také povinnost za svá rozhodnutí nést zodpovědnost, jako nakonec každý člověk musí nést zodpovědnost za svá rozhodnutí.
Zde by teoreticky měla být uvedena střízlivá úvaha o možnostech řešení. Jak již v úvodu bylo řešeno, cílem článku je zdokumentovat a popsat vývoj výsledků léčby a nákladů na ni a tato fakta předložit odborníkům na ekonomii a zdravotnické systémy.
Proč jsou náklady na nová léčiva taková, jaká jsou? Úhel pohledu farmaceutických firem.
Zde použijeme údaje z brožury vydané organizací European Federation of Pharmaceutical Industrie and Associations, zvané The Pharmaceutical Industry in Figures. Argumenty farmaceutických firem uvedeme heslovitě.
Průměrné náklady na uvedení jedné nové léčivé látky na trh byly v roce 2000 868 000 000 Euro.
Náklady na výzkum exponenciálně rostou, stejně jak rostou náklady na klinické zkoušení a administrativu s tím spojenou.
Pravděpodobnost, že nová, teoreticky perspektivní substance, se dostane na trh, je 1 : 5 000 až 1 : 10 000.
Klesá počet nových léčiv uváděných na trh. V letech 1996-2000 to bylo 211 léků, v roce 2001-2005 jen 149 léků.
Délka vývoje léku je průměrně 10 let, délka schvalovacího řízení 2-3 roky, zbývá krátká doba do vypršení patentové ochrany, která je celkem 20 let od doby patentování molekuly. Během této doby musí zisky pokrýt náklady na vývoj léku, ale i dalších substancí, které nebyly úspěšné.
Křivky vývoje cen léčebných postupů a ekonomické síly společnosti
Tempora mutantur, et nos mutamur in illis - ano - časy se mění a my v nich. A mění se ceny nejen léčebných postupů, ale také základní parametry, charakterizující ekonomický vývoj společnosti, tedy hrubý domácí produkt, a takzvaná průměrná mzda, která představuje opravdu průměr, nikoliv medián příjmu. Tyto základní údaje uvádí tab. 15 a z této tabulky je zřetelné, že nárůst hrubého domácího produktu i průměrného platu je za stejné období podstatně pomalejší než je nárůst nákladů na léčbu zde vyjmenovaných maligních chorob.
Tab. 15. Změny ekonomického potenciálu ČR u uvedených letech. 
Upozornění na tento zásadně divergentní vývoj křivek nákladů na léčbu a ekonomického vývoje tohoto státu je hlavní výpovědí tohoto textu a na tuto námi přeložená fakta by měli v dalších článcích reagovat odborníci z oblasti ekonomie a organizace zdravotnictví.
Diskuse
Informační exploze vede k tomu, že pacienti přicházejí k lékaři s informací o nejnovějších léčebných postupech, většinou staženou z internetu. Tyto postupy pak po lékaři vyžadují. Lékaři jsou tedy denně konfrontování s otázkou, jak léčit v době, kdy existují extrémně drahé léky, mající u konkrétního pacienta tu větší a tu menší potenciál pomoci.
Z pozice lékařů neerudovaných v ekonomii a v modelech zdravotních systémů vidíme následující možnosti řešení.
Ve zdravotním systému se nezvýší objem financí
Přerozdělení toku peněz
Někde ušetřit, nějakou léčbu neposkytnout zdarma, ale za finanční úhradu, třeba léčbu časově limitovaných, samovolně odeznívajících chorob (self limiting disease) jako je bronchitida nebo rýma. Neposkytovat třeba zdarma logopedickou péči o děti. Ta je často vyžadována rodiči, ale po iniciaci logopedy, a často dle mínění pediatrů asi zbytečně. Příkladů by se dalo najít více. Takto ušetřené peníze by se následně přesunuly do jiných oblastí, konkrétně do oblastí s velmi nákladnými léčebnými postupy.
Pouze přesná evidence indikací a nákladů na jejich zvládání pomůže zmapovat, kolik peněz by se tímto způsobem ušetřilo v jedné oblasti a bylo připraveno na přesunutí do oblastí jiných.
Je to řešení dle příkladu: Tatínek rozhoduje o financích rodiny a chce nejnovější horské kolo a rodinný rozpočet na to nestačí. Takže dětem kolo nekoupí, nekoupí jim nové oblečení, ušetří na učebnicích, a tak díky přerozdělenému rozpočtu si otec rodiny koupí nové horské kolo.
Přidělovat finanční limit na zařízení a rok - kontrola korunou
Přidělení peněz na časové období a ponechání na rozhodování lékařů, jakým způsobem přidělené peníze použijí, komu podají nákladnou léčbu, a komu ji nepodají. Tento způsob staví lékaře do nepříjemné pozice rozhodčího (komu ano, a komu ne). A jako vždy, když je po něčem poptávka a přitom je objem zboží omezen, vytváří to korupční prostředí.
Je to řešení dle příkladu: Čtyři kluci a manželka chtějí po tatínkovi, který ovládá rodinné finance, nová a nejlepší horská kola. Otec rodiny může buď koupit všem po průměrném kole, nebo tomu nejsilnějšímu koupit to nejlepší kolo, pak manželce kolo v poloviční ceně a ostatní budou muset čekat další rok do dalšího rozpočtu. Členové rodiny to vědí. Budou na otce nějak působit, nebo ne?
Řešení pomocí restrikce vytvořené Ministerstvem zdravotnictví
Vyhláškou MZ ČR se omezení indikace, a tím počet situací, v nichž je možno podat drahý lék. Tento systém snímá z lékaře břemeno rozhodování, ponechává mu pouze břemeno vysvětlování pacientovi, proč nedostane lék, který si našel na internetu jako nejlepší.
Pokud vezmeme výše uvedené přirovnání, tak „Ministerstvo pro poklidný rodinný život“ vydá vyhlášku, že kola je možno kupovat dětem starším 20 let. Tím se nároky na útratu z rodinného rozpočtu zmírní na reálně možnou sumu, děti budou bez bicyklu, ale příčinou nebude malý rozpočet rodiny, ale zákon, takže se otec vyhne nepříjemnému rozhodování jaké kolo komu koupit a následné kritice svého rozhodnutí.
Maximální snaha o účelné podání léků - vytváření kompetenčních sítí
Změny v nákladech na léčbu zvyšují nutnost racionální léčby a optimální indikace nákladných vyšetřovacích a léčebných postupů. S tímto cílem vznikají v celé Evropě kooperační skupiny lékařů různých odborností z různých pracovišť. V některých zemích se tyto kooperační skupiny nazývají kompetenčními sítěmi (www.lymphoma.de, www.leukemia.de, www.myeloma.cz).
Připomínáme, že termín je odvozen od slova kompetence - schopnost řešit určitý problém, a ne od slova kompetice - soutěžení. Cílem těchto kompetenčních sítí je jednak realizace optimální péče na principu společné péče o nemocného regionálním odborníkem (např. hematolog okresní nemocnice) a odborníky ze specializovaného centra (hematologická klinika FN). Aby taková horizontální péče fungovala ke spokojenosti pacientů, je nutná dobrá vzájemná komunikace zúčastněných lékařů. Systém péče v rámci kompetenční sítě regionálních a specializovaných center napomáhá k podání optimální léčby a k optimální a tedy i racionální péči a racionálnímu rozhodování o nákladných vyšetřovacích a léčebných postupech. Dalším cílem těchto kompetenčních sítí je rychlé přenášení poznatků vědy do klinické praxe. V rámci onkologické společnosti vznikají v ČR komplexní onkologická centra a komplexní onkologické skupiny a již mnoho let takto funguje Česká myelomová skupina.
Vidíte ještě další možnosti?
My jsme se zeptali ekonomů a v následujícím článku máte možnost se seznámit s jejich pohledem. Pokud vidíte další reálné možnosti, napište je jako dopis redakci.
Zvýšení toku peněz do zdravotního systému
Tok peněz do zdravotnictví souvisí s ekonomickým potenciálem země, což je fenomén mimo kompetenci ministerstev zdravotnictví zemí EU. A protože lidé tuší, že ekonomický růst nebude mít nikdy potenciál pokrýt všechny možné léčebné výdaje, objevují se názory o vhodnosti komerčního připojištění, které by umožnilo té části národa, který by si je platila (asi střední a vyšší příjmová třída), získat účinnější a nákladnější léčbu, než chudší část obyvatel ČR. O vhodnosti zavedení tohoto systému jsou někteří zdravotníci přesvědčeni. Jiní argumentují proti komerčnímu připojištění ekonomickou úvahou - pokud by komerční připojištění mělo hradit léčbu řádově za milióny korun, musela by být částka značně vysoká, takže by si ji mohl platit jen omezený počet osob. Druhým argumentem je neetičnost kvality péče o lidi dle toho, kolik jsou schopni si vydělat peněz.
Závěr
V průběhu let 1990-2007 se výrazně zlepšily výsledky léčby mnohočetného myelomu, difuzního velkobuněčného B-lymfomu a chronické myeloidní leukemie. Mediány přežití se zlepšily řádově o roky, jak dokazují uvedené tabulky a grafy.
V průběhu uvedeného období se však také mnohonásobně zvýšily náklady na tuto léčbu. Pro srovnání jsme za stejné období uvedli v tab. 15 změny v průměrné mzdě a hrubém domácím produktu. Divergentnost vývojů nákladů na léčbu a ekonomického potenciálu této země jasně zřetelná.
Diskuse uvádí humornou formou některé směry řešení. Není však opravdovým zamyšlením nad řešením divergentnosti vývoje nákladů na léčebné postupy a růstu ekonomického potenciálu této země, tak jak by standardní diskuze měla být. To proto, že o analýzu možných řešení problému, který plyne z prokázané divergentnosti vývoje ekonomické síly této země a nákladů na léčení, jsme požádali odborníky z oblasti ekonomie a teorie zdravotních. Ti se pokusí najít či nastínit v následujících článcích možná řešení tohoto vývoje.
Naším přesvědčením je, že trend zlepšování léčebných výsledků a zvyšování nákladů na ně povede ke změnám ve zdravotnictví a o nich je nutno diskutovat, aby se nakonec došlo ke konsenzu a vybrala ta optimální varianta.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 12. 3. 2007
Přijato po recenzi: 12. 4. 2007
Zdroje
1. Ščudla V, Nekula J, Bačovský Z et al. Nukleární magnetická rezonance v hodnocení páteře u mnohočetného myelomu. Čs Revmatol 1997; 5 : 51-52.
2. Mysliveček M, Nekula J. Bačovský J. Zobrazovací metody v diagnostice a sledování mnohočetného myelomu. Vnitř Lék 2006; 52(Suppl 2): 46-54.
3. Neubauer J, Adam Z, Pour L. Jak rozlišit, zda je kompresivní fraktura obratle způsobena osteoporózou nebo mnohočetným myelomem? Vnitř Lék 2006; 52(Suppl 2): 83-87.
4. Neubauer J, Reptko M. Metodika kostních biopsií perkutánním způsobem za navigace CT. Vnitř Lék 2006; 52(Suppl 2): 71-73.
5. Tichý M, Maisnar V. Laboratorní průkaz monoklonálních imunoglobulinů. Vnitř Lék 2006; 52(Suppl 2): 41-45.
6. Gregory WM, Richards MA, Malpas JM et al. Combination chemotherapy versus melphalan and prednisolon in the treatment of multiple myeloma: an overview of published trials. J Clin Oncol 1992; 82, 334-342.
7. Myeloma Trialists’ Collaborative Group. Combination Chemotherapy versus melphalan plus prednisone as treatment for multiple myeloma: an overview of 6633 patients from 27 randomized trials. J Clin Oncol 1998; 16 : 3832-2840.
8. Lenhoff S, Hjorth M, Turesson I et al. Intensive therapy for multiple myeloma in patient younger then 60 years Long term results focusing on the effect on the degree of response on survival and relapse pattern after transplantation. Hematologica 2006; 91 : 1228-1233.
9. Attal M, Harousseau JL, Stoppa AM et al. A prospective randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. N Engl J Med 1996; 335 : 91-94.
10. Child JA, Morgan GJ, Davies FE et al. High dose chemotherapy with hematopoietic stem cell rescues for multiple myeloma. N Engl J Med 2003; 348 : 1875-1883.
11. Barlogie B, Jagannath S, Vesole DH et al. Superiority of tandem autologous transplantation over standard therapy for previously untreated multiple myeloma. Blood 1997; 89 : 789-793.
12. Greipp PR, San Miguel J, Durie BG et al. International staging system for multiple myeloma. J Clin Oncol 2005; 23 : 3412-3420.
13. Ščudla V, Bačovský J, Indrák K et al. Výsledeky léčby a změna prognózy nemocných s mnohočetným myelomem v období předchozích 40 let v oblasti střední a severní Moravy. Rozbor 562 nemocných. Vnitř Lék 2002; 48 : 707-717.
14. Palumbo A, Bertola A, Musto P et al. Oral melphalan prednisone and thalidomide for newly diagnosed patients with multiple myeloma. Cancer 2005; 104 : 1428-1433.
15. Palumbo A, Bringhen S, Caravita T et al. Oral melphalan and prednisone chemotherapy plus thalidomide compared with melphalan and prednisone alone elderly patients with multiple myeloma: randomized controlled trial. Lancet 2006; 367 : 825-831.
16. Facon T, Mary J, Harousseau F et al. Superiority of melphalane prednisone (MP) + thalidomid over MP and autologous stem cell transplantation in the treatment of newly diagnose elderly patients with multiple myeloma. J Clin Oncol 2006; 24 : 1, Part I of II, Abstr. 1 s 1.
17. Mateos MV, Hernandéz JM, Hernandéz MT et al. Bortezomib plus melphalan and prednisone in elderly untreated patients with multiple myeloma: results of multicenter phase 1-2 study. Blood 2006; 108 : 2165-2172.
18. Palumbo A, Falco P, Benevolo G et al. Oral lenalidomide plus melphalan and prednisone (R-MP) for newly diagnosed multiple myeloma. J Clin Oncol 2006; 24 : 426.
19. Feugier P, Van Hoof A, Seeban C et al. Long-term results of the R-CHOP study in the treatment of elderly Patients with diffuse large B-cell lymphoma: A study by the group d’Etude des lymphomas de l’Adulte. J Clin Oncol 2005; 23 : 4117-4126.
20. Pfreundschuh M, Truemper L, Gill D et al. Fist analysis of the completed mabthera international (MINT) trial in young patients with low-risk diffuse large B-cell lymphoma: addition of rituximab to a CHOP-like regimen significantly improves outcome of all patients with the identification of very favorable subgroup with IPI´0 and no bulky disease. Blood 2004; 104 : 48A.
21. Pfreundschuh M, Truemper L, Osterborg A et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good prognosis diffuse large B-cell lymphoma: a randomized controlled trial by the Mabthera International Trial (MInT) Group. Lancet Oncol 2006; 7 : 379-391.
22. Held G, Poschel V, Pfreundschuh M. Rituximab for the treatment of diffuse large B-cell lymphomas. Expert Rev Anticancer Ther 2006; 6 : 1175-1186.
23. Sehn LH, Donaldson J, Chababhai M et al. Introduction of combined CHOP plus rituximab therapy dramatically improved outcome of diffuse large B-cell lymphoma in British Columbia. J Clin Oncol 2005; 23 : 5027-5033.
24. Habermann TM, Weller EA, Morrison VA et al. Rituximab-CHOP versus CHOP alone or maintenance rituximab in older patients with diffuse large B-cell lymphoma. J Clin Oncol 2006; 24 : 3121-3127.
25. Kantarjian HM, Talpaz M, O’Brien S et al. Survival benefit with imatinib mesylate versus interferon alpha-based regimens in newly diagnosed chronic-phase chronic myeloid leukemia. Blood 2006; 108 : 1835-1840.
26. Reed SD, Anstrom KJ, Ludmer JA et al. Cost-effectiveness of imatinib versus interferon alpha plus low dose cytarabine for patients with newly diagnosed chronic phase myeloid leukemia. Cancer 2004; 101 : 2574-25583.
27. Roy L, Guilhot J, Krahnke T et al. Survival advantage from imatinib compared with the combination interpheron alpha plus cytarabine in chronic phase chronic myelogenous leukemia. Historical comparison between two phase III trials. Blood 2006; 108 : 1478-1484.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Délka antikoagulační léčby a riziko recidiv u TEN - editorial
- Klinické zkušenosti s léčbou dlouhodobým inzulinovým analogem glargin v diabetologickém centru
- Vliv dlouhodobé terapie inzulinovou pumpou (CSII) u pacientů s diabetes mellitus 1. typu na metabolickou kompenzaci a výskyt hypoglykemií. Porovnání s intenzifikovanou konvenční inzulinovou terapií (MDI)
- Subpopulace CD34+buněk a jejich význam pro přihojení štěpu u příbuzenských alogenních transplantací periferních kmenových buněk
- Esenciální trombocytemie a další myeloproliferace s trombocytemií v údajích registru pacientů léčených Thromboreductinem® do konce roku 2006
- Optimální délka antikoagulační léčby po žilní tromboembolické příhodě: obecný či individualizovaný přístup?
- Kardiotoxicita antracyklínovej liečby vo svetle nových biochemických diagnostických možností
- Genetické faktory a riziko kardiovaskulárnych ochorení
-
Nové poznatky v genetice autoimunitního diabetu
(1): Monogenně podmíněné typy autoimunitního diabetu - Je familiární hypercholesterolemie v České republice pod kontrolou?
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Postavení neoadjuvantní chemoterapie v léčbě nemalobuněčného plicního karcinomu
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Ojedinělá komplikace při pokusu o zavedení dočasné kardiostimulace
- Zlepšování výsledků léčby vybraných krevních chorob a změny nákladů na tuto léčbu. Otázky pro ekonomy a další odborníky
- Jsou nezbytná kvalifikovaná rozhodnutí vycházející z věrohodných dat
- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Príspevok nefrológie vo Fakultnej nemocnici L. Pasteura a Lekárskej fakulty Univerzity P. J. Šafárika v Košiciach ku histórii českej nefrológie
- Zamrazil V. Hypotyreóza. Průvodce ošetřujícího lékaře.
- Vondráček L, Dvořáková V. Pochybení a sankce při poskytování lékařské péče.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Genetické faktory a riziko kardiovaskulárnych ochorení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



