-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kardiotoxicita antracyklínovej liečby vo svetle nových biochemických diagnostických možností
Cardiotoxicity of antracycline treatment in the light of new biochemical diagnostic options
Oncologic patients often receive treatment which is potentially cardiotoxic. Cardiotoxic complications range from fairly mild (relatively benign arrhythmias) to life threatening conditions (ischemia/myocardial infarction, heart failure, cardiomyopathy). The toxic effect of chemotherapy drugs may impair the integrity of the sarcomere, cause the release of bioactive substances into both tissues and the circulatory system and, consequently, cause necrosis/apoptosis of myocytes. A marker of the scope and severity of damage to the myocardium can be assessed by measuring the levels of cardiac markers in the serum. Cardiologic research is currently focused on the identification of new biochemical markers with a high degree of specificity, sensitivity and predictive value that might be used in the timely detection of myocardial abnormalities. The informative value of currently measured cardiac markers (myoglobin, CK-MB mass, CK-MB, and partly CK) is insufficient. There is growing evidence of the usefulness of natriuretic peptides and cardiac troponins in the diagnosing and monitoring of early and late, clinical and subclinical cardiotoxiticy resulting from anti-tumour therapy. The article summarises clinical studies concerning the diagnosis and monitoring of cardiotoxicity with the use of natriuretic peptides and cardiac troponins in former oncological patients.
Key words:
cardiotoxicity – anthracyclines – cardiac troponins – natriuretic peptides
Autoři: D. Urbanová; B. Mladosievičová
Působiště autorů: Ústav patologickej fyziológie, Oddelenie klinickej patofyziológie Lekárskej fakulty UK Bratislava, Slovenská republika, prednosta doc. MUDr. Marián Bernadič, CSc., mim. prof.
Vyšlo v časopise: Vnitř Lék 2007; 53(6): 669-677
Kategorie: Přehledné referáty
Souhrn
Onkologickí pacienti sú často liečení potenciálne kardiotoxickou liečbou. Ku kardiotoxickým komplikáciám patria menej závažné (relatívne benígne arytmie) až život ohrozujúce stavy (ischémia/infarkt myokardu, zlyhanie srdca, kardiomyopatia). Toxickým vplyvom chemoterapeutík môže dochádzať k porušeniu integrity sarkolémy, uvoľneniu bioaktívnych látok do tkanív a cirkulácie a v konečnom dôsledku k nekróze/apoptóze myocytov. Korelátom rozsahu a závažnosti poškodenia myokardu môžu byť hladiny kardiomarkerov v sére. V súvislosti s včasnou detekciou abnormalít myokardu sa v súčasnosti kardiologický výskum zameriava na hľadanie biochemických markerov s vysokou špecificitou, senzitivitou a prediktívnou hodnotou. Výpovedná hodnota štandardne stanovovaných kardiomarkerov (myoglobínu, CK-MB masy, CK-MB, sčasti aj CK) nie je dostatočná. Pribúdajú dôkazy o užitočnosti nátriuretických peptidov a kardiálnych troponínov v diagnostike a monitorovaní skorej a neskorej, klinickej a subklinickej kardiotoxicity v dôsledku protinádorovej liečby. Článok sumarizuje klinické štúdie týkajúce sa diagnostiky a sledovania kardiotoxicity pomocou nátriuretických peptidov a kardiálnych troponínov u bývalých onkologických pacientov.
Kľúčové slová:
kardiotoxicita - antracyklíny - kardiálne troponíny - nátriuretické peptidyÚvod
Akútne, chronické a neskoré kardiovaskulárne komplikácie môžu zapríčiňovať zníženú kvalitu života onkologických pacientov. Vznik kardiotoxicity si môže ojedinele vyžiadať predčasné ukončenie protinádorovej liečby. Najväčšia pozornosť sa sústreďuje na kardiotoxicitu antracyklínov (doxorubicínu, daunorubicínu, epirubicínu, idarubicínu) a rádioterapiu na oblasť srdca. Poškodenie srdca môže indukovať aj podávanie cyklofosfamidu, ifosfamidu, cisplatiny, busulfánu, mitomycínu, vinka alkaloidov, fluorouracilu, cytarabínu, amsakrínu, asparaginázy, etopozidu, tenopozidu, paklitaxelu, docetaxelu, trastuzumabu, imatinibu, interferónov a interleukínu 2 [1,2]. Toxické účinky cytostatík na srdce sa môžu klinicky prejaviť ako arytmie, myokarditída, perikarditída, tamponáda srdca, kardiogénny šok, ischémia/infarkt myokardu, kardiomyopatia a zlyhanie srdca. U bývalých onkologických pacientov je 25 rokov po liečbe riziko smrti z kardiálnych príčin viac ako 8-násobne vyššie ako v zdravej populácii [3].
Na vznik cytostatickej kardiotoxicity môže predisponovať viacero faktorov: kumulatívna dávka (antracyklíny, mitomycín), celková denná dávka (cyklofosfamid, ifosfamid, 5-fluorouracil, cytarabín, karmustín), rýchlosť podávania (antracyklíny, 5-fluorouracil), dávkovacie schémy (antracyklíny), predchádzajúce ožiarenie mediastína, ženské pohlavie, vek v čase začatia liečby (menej ako 6 rokov alebo viac ako 65 rokov], preexistujúce ochorenie srdca (ischemická choroba srdca, poškodenie srdca pri hypertenzii, diabete, pri chlopňovej chybe), rasa (antracyklíny), elektrolytová dysbalancia (hypokalémia, hypomagnezémia), hepatálna a obličková dysfunkcia v čase chemoterapie [4,5].
Antracyklínová kardiotoxicita
Záujem o riziká antracyklínových cytostatík vyplýva z ich významného postavenia v liečbe širokého spektra malignít. V súčasnosti je liečených antracyklínmi 60 % pediatrických onkologických pacientov [6]. Antracyklíny sú pre svoju efektívnosť používané aj u dospelých pacientov v liečbe karcinómov prsníka, lymfómov, leukémií, sarkómov a iných malignít. Tieto cytostatiká budú používané aj v ďalších rokoch, pretože ich benefit je vyšší ako potenciálne riziko [7-10].
Patogenéza antracyklínovej kardiotoxicity
Za najdôležitejší mechanizmus poškodenia kardiomyocytov sa pokladá voľnoradikálový mechanizmus. Reaktívne metabolity kyslíka spôsobujú poškodenie jednotlivých bunkových štruktúr, bunkových membrán a vedú k peroxidácii lipidov, čo spôsobuje nedostatočnú produkciu energie a zároveň intracelulárnu kalciovú dysbalanciu s následnou aktiváciou proteáz, fosfolipáz a endonukleáz. Kľúčovú úlohu v tvorbe toxických metabolitov kyslíka hrajú ióny železa. Myocyty sú na pôsobenie reaktívnych metabolitov kyslíka zvlášť citlivé, pretože obsahujú iba malé množstvá antioxidačných enzýmov - katalázy a superoxiddismutázy [6,11]. V patogenéze poškodenia myocytov má úlohu aj vysoká afinita antracyklínov ku kardiolipínu [12].
Ďalším mechanizmom poškodenia myocytu je inhibícia expresie génov kódujúcich troponín I, myozínové reťazce, desmín, downregulácia expresie proteínov sarkomér prostredníctvom downregulácie transkripčného faktora GATA 4, inaktivácia mRNA génov, ktoré kódujú kľúčové enzýmy potrebné pre produkciu energie v myocyte [13]. Antracyklíny potláčajú expresiu mRNA pre Ca2+-adenozíntrifosfatázu pôsobiacu v sarkoplazmatickom retikule, čo môže viesť k zníženiu kontraktility [14]. Produkcia reaktívnych metabolitov kyslíka môže pokračovať aj po ukončení podávania antracyklínov. Produkcia radikálov môže viesť k uvoľňovaniu cytochrómu c z mitochondrií, čo môže viesť k apoptóze buniek v srdci. Antracyklíny tiež alterujú adrenergné mechanizmy v srdci a indukujú uvoľňovanie TNFα a IL-1, ktoré pôsobia kardioinhibične [15]. Tiež poškodenie sulfhydrylových skupín membránových proteínov antracyklínmi vedie k poruche funkcie bunkových membrán. K ďalším patogenetickým mechanizmom patrí abnormálna produkcia kolagénu [16].
Zložité subcelulárne procesy indukované kardiotoxickým pôsobením môžu vyústiť až do zániku myocytov (nekrózou alebo apoptózou) s následnou tvorbou fibrózy v myokarde. Difúzne roztrúsená fibróza v myokarde môže prispievať k dysfunkcii myokardu a zároveň vytvárať substrát pre nehomogénne šírenie aktivačného frontu v srdci, čo môže viesť ku vzniku komorových reentry tachyarytmií [17].
Antracyklíny môžu indukovať aj endoteliálnu dysfunkciu, čo môže viesť k predčasnej ateroskleróze [18].
Možnosti biochemickej diagnostiky antracyklínovej kardiotoxicity
Myokardiálne poškodenie po protinádorovej liečbe je možné diagnostikovať s využitím viacerých metód. Najčastejšie používaná metóda pri detekcii kardiotoxicity - echokardiografia má viaceré nevýhody. Nie je spoľahlivým prediktorom kardiomyopatie, nemá dostatočnú senzitivitu pre odhaľovanie minimálnych potenciálne progredujúcich abnormalít, echokardiografické metrické a funkčné zmeny myokardu sa prejavujú po akumulácii mikroštruktúrnych abnormalít. Navyše echokardiografické parametre môžu byť ovplyvnené viacerými extrakardiálnymi faktormi, čo môže viesť k nesprávnej interepretácii, najmä pri detekcii akútnej toxicity. Detekciu akútnej toxicity komplikuje aj skutočnosť, že významný počet onkologických pacientov je neechogénnych. Funkcia srdca po protinádorovej liečbe býva dlho zachovaná, avšak jej zhoršenie môže byť dramaticky rýchle. Napriek kritike a obmedzeniam sa echokardiografia používa vo väčšine štúdií zaoberajúcich sa akútnou, subakútnou aj neskorou kardiotoxicitou.
Aj z týchto skutočností vyplýva potreba nových diagnostických možností subklinickej kardiotoxicity. Perspektívnou sa javí stanovovanie biochemických kardiálnych markerov, ktoré dokážu odrážať abnormality na úrovni myocytov. Medzi štandardne stanovované kardiomarkery poškodenia srdca patria myoglobín, CK-MB masa, CK-MB, sčasti aj CK, ktorých špecificita, senzitivita a výpovedná hodnota je však nedostatočná.
Predmetom intenzívneho výskumu v súčasnosti je posúdenie špecificity a senzitivity kardiálnych troponínov (cTn) a nátriuretických peptidov (NP), ako aj ďalších nových biochemických parametrov (endotelín-1, big endotelín-1, ultrasenzitívny C-reaktívny proteín - hsCRP a tiež markery oxidačného stresu). CTn a NP zatiaľ nie sú rutinne používané na určenie kardiovaskulárneho rizika u pacientov liečených potenciálnou kardiotoxickou liečbou. Podľa niektorých autorov však v uvedenej indikácii poskytujú dostatočnú diagnostickú presnosť [19-21].
Kardiálne troponíny a ich prínos pre diagnostiku kardiotoxicity antracyklínovej liečby
Kardiálnym troponínom (cTn) sa ako prví venovali vo svojich originálnych prácach autori Katus et al [22]. Tieto práce znamenali prelom v laboratórnej diagnostike akútneho infarktu myokardu. Definovanie ich štruktúry, funkcie a v neposlednom rade zdokonaľovanie analytických metód otvorili nový priestor v ich využívaní pri detekcii kardiálneho poškodenia.
V roku 1971 Ebashi et al separovali pomocou gélovej elektroforézy tri samostatné polypeptidové proteíny troponínového komplexu: troponín T - TnT, troponín I - TnI a troponín C - TnC [23]. Rozpustná cytoplazmatická frakcia troponínov predstavuje približne 5 %, zvyšok je viazaný vo vnútri sarkoméry. Po poškodení svaloviny myokardu cirkuluje uvoľnený troponín v jednej z troch nasledovných foriem: ako ternárny komplex zložený zo všetkých troch typov troponínov: cTnI-C-T, ako binárny komplex zložený z cTnI a TnC, a ako voľné formy s predominantným výskytom cTnT. Identifikácia kardiálnych izoforiem je v súčasnosti možná len u dvoch troponínov: cTnI a cTnT [24].
Zvýšené hladiny kardiálnych troponínov boli potvrdené aj pri neischemickom poškodení srdca, napr. pri kardiochirurgickej operácii, myokarditíde, chronickom srdcovom zlyhaní, pri chronickej renálnej insuficiencii, popáleninách, sepse [25]. Ďalšiu skupinu predstavujú elevácie, ktoré sú dôsledkom farmakologického poškodenia srdca. K nárastu sérovej koncentrácie cTn dochádza účinkom sympatomimetík, etanolu, katecholamínov, chemoterapeutík (antracyklínov) a ďalších látok [26,27]. Zvyšovanie hladín cTn v súvislosti s protinádorovou liečbou potencuje rádioterapia na oblasť hrudníka.
Uvažuje sa o viacerých mechanizmoch vyplavovania kardiálnych troponínov do cirkulácie - nekrózou a/alebo apoptózou myokardiálnych buniek, poklesom subendokardiálnej perfúzie pri koronárnej mikrovaskulopatii, pri hypertrofii ľavej komory (ĽK), zisťuje sa aj pri endoteliálnej dysfunkcii [28]. Bezprostredne po poškodení myocytov dochádza k vyplavovaniu voľného troponínu. Zvýšenie po niekoľkých dňoch odzrkadľuje kontinuálne uvoľňovanie proteínov z deštruovaných myofibríl.
V súčasnosti je zrejmé, že k uvoľňovaniu troponínov dochádza aj pri apoptóze. Autori Communal et al [29] dokázali, že aktivácia kaspázy spôsobuje štiepenie kardiálneho troponínového komplexu a ďalších myofibrilárnych proteínov, vrátane cTnT, s následnou poruchou kontraktility kardiomyocytov, pred úplným zánikom bunky [29]. Keďže v procese apoptózy nedochádza k porušeniu integrity sarkolémy, ostáva predmetom ďalšieho výskumu sledovať, akým mechanizmom sa štiepené proteíny uvoľňujú do cirkulácie.
Hladiny vyplavovaných kardiálnych troponínov sú odlišné pri ischemickom a pri kardiotoxickom poškodení myocytov. Vyplavovanie cTn v kontexte kardiotoxicity protinádorovej liečby vzniká v rámci oxidačného poškodenia kardiomyocytov a chronických zápalových zmien myokardu. K progresívnemu úbytku myofibríl, uvoľňovaniu troponínov dochádza ďalej aj po ukončení chemoterapie v rámci tzv. neskorej kardiotoxicity (napr. pri zlyhaní srdca). V patogenéze srdcového zlyhávania sa uvažuje o tzv. „calpain digestion“ - o proteolytickej deštrukcii tropomyozínového komplexu závislej od rozpustného kalcia [30].
Pre poškodenie myokardu účinkom protinádorovej liečby sú typické nízke elevácie cTn v sére. Rádovo desatiny, stotiny v závislosti od kvality použitej diagnostickej analýzy. K spoľahlivej identifikácií cTn je potrebné použiť vysokosenzitívne testy 3. a 4. generácie. Tieto redukujú, použitím špecifických monoklonálnych protilátok proti kardiálnym epitopom, limitácie starších setov - skríženú reaktivitu kardiálnych a skeletálnych izoforiem troponínov. Menšia variabilita výsledkov sa zdá byť pri použití analytického setu pre cTnT, ktorý vyrába len jedna spoločnosť. Test využíva monoklonálne protilátky proti stabilnej centrálnej časti molekuly cTnT, pričom voľný cTnT a cTnT viazaný v komplexoch (binárny, ternárny) sa nelíšia imunoreaktivitou a reagujú ekvimolárne [21]. Naproti tomu na detekciu cTnI je možné použiť viacero testov, ktoré identifikujú rozličné epitopy molekuly cTnI, rozličné komplexy (binárny, ternárny) a tiež rozličné štádiá biotransformácie (cTnI je významne menej stabilný ako cTnT). Hladiny „cut-off“ pre cTnI nie sú štandardizované, sú závislé od daného výrobcu. Najsprávnejšie by teda bolo porovnávať výsledky cTnI len v rámci tej istej biochemickej analýzy. Jednoznačný konsenzus priority cTnT pred cTnI alebo naopak však doposiaľ nebol definovaný.
Kardiálny troponín T
Na potenciálny prínos kardiálnych troponínov v identifikácií závažnosti antracyklínovej kardiotoxicity upozornili experimentálne štúdie [31-35]. Tieto práce demonštrovali u zvierat poškodenie myokardu, ktoré korelovalo so sérovými hladinami kardiálnych troponínov. Predčasná smrť bola zaznamenaná u 43 % zvierat v korelácii s eleváciami cTnT [27].
Lipshultz et al sa zameriavali na využitie cTnT v súvislosti s poškodením srdca v detskej populácii, a to v skupine pacientov po kardiochirurgickej operácii, nekardiochirurgickej operácii a tiež v skupine pacientov po liečbe antracyklínovými cytostatikami (doxorubicínom) [36]. V skupine 15 detí liečených pre akútnu lymfoblastickú leukémiu chemoterapiou obsahujúcou doxorubicín (s kumulatívnou dávkou 45 - 222 mg/m2) hladiny cTnT stúpali v závislosti od počtu cyklov a kumulatívnej dávky doxorubicínu. Analýza u týchto pacientov potvrdila štatisticky významnú koreláciu medzi hladinou cTnT a dilatáciou ĽK a hrúbkou zadnej steny ĽK. Okrem toho autori zistili absenciu zvýšenia cTnT po podávaní nekardiotoxickej liečby a na druhej strane - zvýšenie cTnT, ak boli pacienti liečení doxorubicínom. Uvedená práca demonštruje, že elevácie cTnT u detí môžu súvisieť aj s kardiotoxicitou doxorubicínu.
V ďalšej práci tí istí autori nadviazali na predchádzajúce závery [37]. Pomocou cTnT zisťovali vplyv potenciálne kardiotoxického doxorubicínu podávaného s kardioprotektívnou látkou - dexrazoxanom a bez neho na myokard. V skupine 206 detí s ALL sa zvýšené hladiny cTnT vyskytli u 15 % pacientov už v čase diagnózy pred podávaním doxorubicínu (čo mohlo byť zapríčinené sepsou, anémiou, objemovým preťažením) a u 35 % pacientov počas liečby doxorubicínom. Kardioprotektívum dexrazoxan preukázal štatisticky významnú redukciu poškodenia srdca po antracyklínoch, do jedného roka po liečbe, čo korelovalo so znížením hladín cTnT (obr. 1). Premenné parametre ako vek, pohlavie a kumulatívna dávka doxorubicínu nemali signifikantný vplyv na hladinu cTnT.
Obr. 1. Percentuálne zastúpenie pacientov s najmenej jednou eleváciou cTnT > 0,01 ng/ml pred a počas liečby doxorubicínom. Počet pacientov, u ktorých bol cTnT meraný najmenej jeden krát v danom časovom intervale, je uvedený v každom stĺpci (upravené podľa [37]). ![Percentuálne zastúpenie pacientov s najmenej jednou eleváciou cTnT > 0,01 ng/ml pred a počas liečby doxorubicínom. Počet pacientov, u ktorých bol cTnT meraný najmenej jeden krát v danom časovom intervale, je uvedený v každom stĺpci (upravené podľa [37]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3424edfbcf0e4117422ff3a1a9f92eb9.png)
cTnT – kardiálny troponín T Autori Auner et al vo svojej práci podrobne rozpracovali dynamiku vyplavovania cTnT [38]. Trvanie kontinuálneho uvoľňovania cTnT predstavuje šírku jeho diagnostického okna [21]. Uvedení autori zistili, že u dospelých pacientov (n = 78) počas antracyklínovej liečby došlo k zvýšeniu hladiny cTnT u 15 % pacientov. K eleváciám nad hranicu detekcie (0,01 ng/ml) došlo medzi 4. a 35. dňom (medián 18. deň) od začiatku liečby, s vrcholom medzi 6. a 35. dňom (medián 21,5 deň). 63 % elevácií trvalo viac ako 3 dni. Presné poznanie kinetiky troponínov vo vzťahu k protinádorovej liečbe by umožnilo stanoviť optimálnu dobu odberu vzoriek. Vo všeobecnosti sa odbery realizujú pred, počas a po ukončení chemoterapie, v rozlične dlhých intervaloch, v závislosti od dizajnu jednotlivých prác. Autori súčasne zaznamenali v skupine pacientov so zvýšenou hladinou cTnT výraznú redukciu ejekčnej frakcie ľavej komory (EF ĽK) v priemere až o 10 % počas 6-mesačného sledovania po ukončení protinádorovej liečby. V skupine pacientov s nezvýšenou hladinou cTnT k poklesu EF došlo len v 2 %.
Autori Kilickap et al zisťovali v skupine 41 dospelých pacientov vzájomnú koreláciu koncentrácie cTnT a funkcie srdca [39]. CTnT bol zvýšený u tretiny sledovaných pacientov. Echokardiografické parametre systolickej funkcie srdca sa v priebehu sledovania výrazne nemenili. Diastolická dysfunkcia však bola prítomná u dvojnásobného počtu pacientov s pozitívnou hodnotou cTnT v porovnaní s negatívnou skupinou (49 % vs 21 %).
Kardiálny troponín I
Stanovením prediktívnej hodnoty cTnI ako včasného markera poškodenia srdca po agresívnej chemoterapii sa zaoberala štúdia autorov Cardinale et al [40]. U dospelých pacientov (n = 204) stredného veku, liečených vysokodávkovou chemoterapiou obsahujúcou epirubicín, autori sledovali koreláciu medzi maximálnou hodnotou cTnI a zmenami echokardiografických parametrov (EF ĽK, koncovo-diastolického a koncovo-systolického objemu ĽK) počas sledovania 7 mesiacov od aplikácie liečby. Biochemická imunofluorescenčná analýza plazmatických koncentrácií cTnI bola realizovaná pred, ihneď po skončení cyklu chemoterapie a po časovom intervale 12, 24, 36 a 72 hodín od ukončenia chemoterapie. U tých pacientov, u ktorých boli hladiny cTnI normálne, sa v priebehu sledovania nevyvinulo žiadne kardiálne postihnutie alebo len prechodná subklinická dysfunkcia ĽK. Hladiny cTnI (v rozmedzí 0,35 - 0,5 ng/ml) identifikovali skupinu jedincov, u ktorých bola v 3. mesiaci prítomná signifikantná redukcia EF ĽK, ktorá sa však na konci sledovaného obdobia upravila na východzie hodnoty. V skupine pacientov, kde aj po 7. mesiacoch pretrvávala klinicky evidentná systolická dysfunkcia ĽK, hodnoty cTnI presahovali 0,5 ng/ml. Na základe uvedených výsledkov štúdia potvrdila významnú koreláciu medzi maximálnou hodnotou cTnI a maximálnou redukciou EF ĽK po vysokodávkovej chemoterapii (obr. 2). Títo autori zároveň upozornili na fakt, že zvýšené hodnoty cTnI v kontexte chemoterapie môžu byť považované za včasný marker rizika vývoja signifikantnej a pretrvávajúcej ľavokomorovej dysfunkcie. Pozitivita cTnI bola častejšia u tých pacientov, ktorí už v minulosti absolvovali predchádzajúcu liečbu antracyklínmi. Hladiny cTnI významne stúpali aj so zvyšujúcim sa počtom chemoterapeutických cyklov. Pred liečbou mali všetci pacienti negatívne hodnoty cTnI.
Obr. 2. EF ĽK pred liečbou a počas 7 mesačného sledovania cTnI pozitívnych (cTnI+, cTnI > 0,4 ng/ml) a cTnI negatívnych (cTnI–, cTnI ≥ 0,4 ng/ml) pacientov. 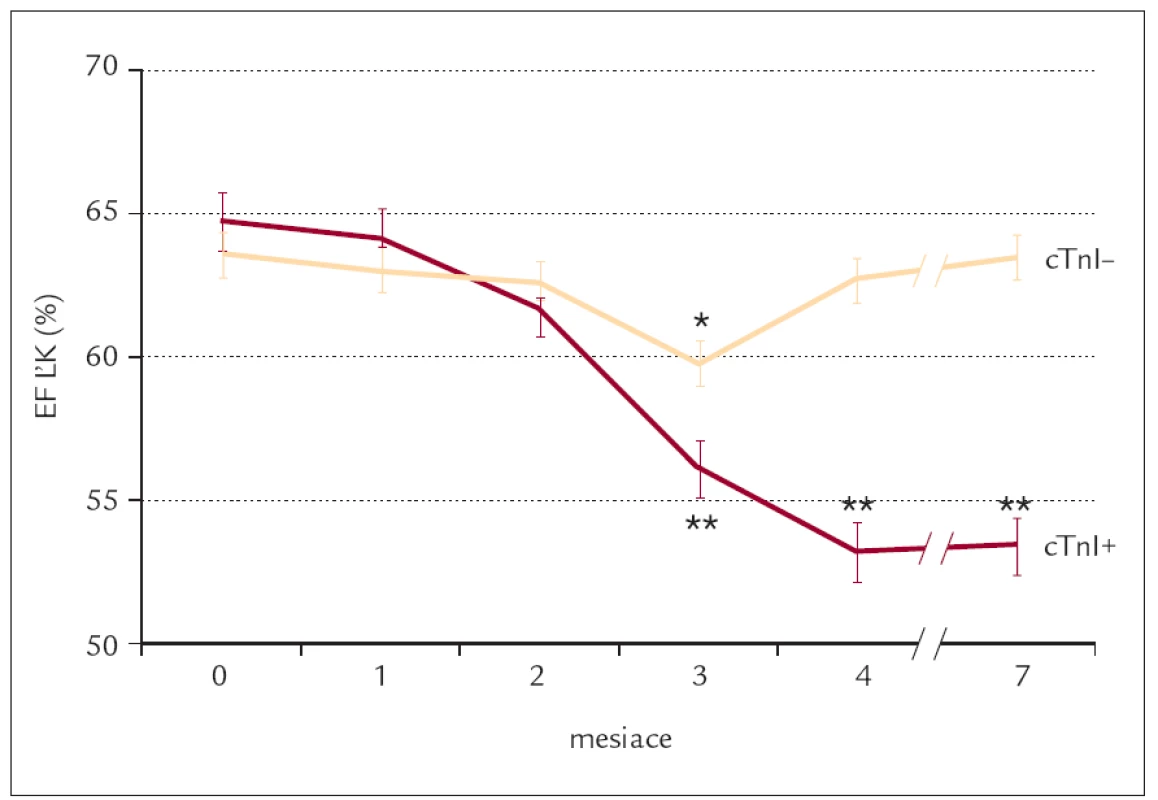
*p < 0,001 vs pred liečbou (mesiac 0); **p < 0,001 vs cTnI- skupina. Údaje sú zobrazené ako stredné hodnoty ± 95 % konfidenčného intervalu (upravené podľa [40]). EF ĽK – ejekčná frakcia ľavej komory srdca, cTnI – kardiálny troponín I Výsledky pri použití cTnI ako parametra kardiotoxického poškodenia srdca však nie sú jednoznačné. Niektorí autori nezaznamenali signifikantné zvýšenia jeho hladín počas alebo po ukončení kardiotoxickej chemoterapie ani u detí, ani u dospelých, a to aj napriek abnormálnym echokardiografickým parametrom [41-43].
Nátriuretické peptidy a ich prínos pre diagnostiku kardiotoxicity antracyklínovej liečby
Srdcové nátriuretické peptidy (NP) sa tvoria v predsieňach (átriálny nátriuretický peptid - ANP) a v komorách (mozgový nátriuretický peptid - BNP). Skupinu štrukturálne podobných, ale geneticky odlišných peptidov, dopĺňajú nátriuretický peptid typ C (CNP) prítomný v endotelových bunkách, urodilatín syntetizovaný tubulárnymi bunkami obličiek a nátriuretický peptid dendroaspis (DNP) [44].
ANP podobne ako BNP vznikajú z prekurzorových molekúl pro-ANP a pro-BNP. Molekula pro-BNP sa po stimulácii kardiomyocytov (napr. vplyvom tenzie steny myokardu) štiepi účinkom serínovej proteázy corinu na biologicky aktívny hormón BNP a N-terminálny fragment BNP: NT-proBNP. Biologický polčas NT-proBNP je dlhší než u BNP (60 - 120 minút vs 20 minút) a niekoľkonásobne dlhší ako ANP, čo je jeden z dôvodov častejšieho stanovovania NT-pro BNP [44].
NP boli identifikované v 80. rokoch 20. storočia [45,46]. V roku 2000 bolo ich diagnostické využitie schválené aj Food and Drug Administration [47]. Ich diagnostický a prognostický potenciál sa využíva najmä v kontexte srdcového zlyhávania. Stanovenie správnej diagnózy pri miernych formách srdcového zlyhávania pri použití štandardných postupov je problematické. Polovica pacientov s chronickým zlyhávaním srdca v štádiu NYHA I zostáva nediagnostikovaná, a naopak až u polovice pacientov liečených pre túto diagnózu ide o falošnú pozitivitu [48]. Stanovovanie NP umožňuje zjednodušenie a spresnenie diagnostiky zlyhávania srdca. Na základe Odporúčaní Európskej kardiologickej spoločnosti z roku 2005 sa hladina BNP a NT-proBNP považuje za užitočný marker v diagnostike a diferenciálnej diagnostike srdcového zlyhávania [49]. Najdôležitejším zistením je jeho vysoká negatívna prediktívna hodnota, t.j. pravdepodobnosť prítomnosti zlyhávania srdca u pacientov s normálnymi hodnotami je minimálna [50]. Analýza ekonomickej efektívnosti vyšetrenia BNP a NT-proBNP poukazuje na to, že normálny výsledok môže znížiť potrebu ďalších kardiologických vyšetrení (echokardiografie a iných nákladnejších vyšetrení).
Hladina NT-proBNP môže byť zvýšená nielen u pacientov so zlyhaním srdca, ale aj u pacientov s hypertrofiou ĽK, ischemickou chorobou srdca, akútnym koronárnym syndrómom, u pacientov s cor pulmonale, ktoré je sprevádzané pľúcnou hypertenziou alebo pľúcnou embóliou, šokom, predsieňovými arytmiami, renálnou insuficienciou, závažnou pneumóniou, chronickou hepatálnou insuficienciou, preeklampsiou alebo anémiou.
V ostatnom období prebieha intenzívny výskum týkajúci sa NP ako včasných markerov subklinickej kardiálnej dysfunkcie u pacientov liečených kardiotoxickými cytostatikami. Doteraz sa iba na pomerne malých súboroch dokázala koincidencia medzi zvýšenými plazmatickými hladinami NP a poškodením srdca u detských aj dospelých pacientov po liečbe antracyklínovými cytostatikami. Jedna z prvých prác v oblasti výskumu kardiotoxicity pomocou NP u detských onkologických pacientov bola práca Baucha et al [51]. Významné elevácie ANP boli zaznamenané tri týždne po ukončení antracyklínovej liečby u takmer polovice (6/16) pacientov. U 2 z nich sa vyvinulo kongestívne zlyhanie srdca, a to bez predchádzajúceho poklesu EF ĽK. V štúdii Hayakawa et al bolo dokumentované signifikantné zvýšenie hladín ANP aj BNP u 23,5 % (8/34) detských pacientov liečených doxorubicínom s echokardiograficky dokázanou systolickou dysfunkciou ĽK [52]. Pozitívnu koreláciu medzi systolickou dysfunkciou ĽK a eleváciami aktuálne najsenzitívnejšieho NT-proBNP potvrdila aj práca Sokera et al u 12,9 % (4/31) detí počas liečby doxorubicínom [42]. Na základe uvedených výsledkov autori predpokladajú, že stanovovanie hladín NP už počas samotnej kardiotoxickej chemoterapie umožňuje včasnú identifikáciu rizikových pacientov.
Lipshultz et al demonštrovali zvýšenie pro-BNP v rámci neskorej kardiotoxicity u bývalých detských onkologických pacientov (n = 176) s odstupom 5 a viac rokov po ukončení protinádorovej liečby [53]. K zvýšeniu parametra došlo v skupine detí s liečbou obsahujúcou antracyklíny a/alebo rádioterapiu zasahujúcu oblasť srdca ako aj v skupine detí s inou (nekardiotoxickou) protinádorovou liečbou (obr. 3).
Obr. 3. Hladiny Pro BNP (pg/ml) u vyliečených pacientov po kardiotoxickej liečbe, u bývalých onkologických pacientov, ktorí neboli liečení kardiotoxickou liečbou a zdravých súrodencov pacientov. Rozdiel medzi pacientami po kardiotoxickej liečbe a ich súrodencami bol signifikantný (p < 0,001) (upravené podľa [53]). ![Hladiny Pro BNP (pg/ml) u vyliečených pacientov po kardiotoxickej liečbe, u bývalých onkologických pacientov, ktorí neboli liečení kardiotoxickou liečbou a zdravých súrodencov pacientov. Rozdiel medzi pacientami po kardiotoxickej liečbe a ich súrodencami bol signifikantný (p < 0,001) (upravené podľa [53]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6b836d425ab56b87df0e0128971db09d.png)
Pro BNP – prekurzorová molekula mozgového nátriuretického peptidu Autori Germanakis et al zistili prevalenciu redukcie masy ĽK vo vzťahu k zmenám plazmatických koncentrácii NT-proBNP u detí bez klinických príznakov poškodenia srdca, bezprostredne po skončení antracyklínovej liečby [54]. Stenčenie steny ĽK bolo väčšie v skupine detských onkologických pacientov, v porovnaní s kontrolnou skupinou zdravých detí. Vyššie hladiny NT-proBNP korelovali s redukciou masy ĽK stanovovanej echokardiograficky.
Sledovania Nousianena et al, Okumura et al, uskutočnené u dospelých pacientov, dokázali, že zvýšené hladiny ANP a BNP s dostatočným predstihom identifikujú pacientov, u ktorých sa neskôr vyvinie klinicky manifestné systolické zlyhávanie srdca [55,56].
Nárasty hladín NT-ANP, BNP boli sledované aj u pacientok s karcinómom prsníka po adjuvantnej liečbe obsahujúcej epirubicín a následnej rádioterapii na oblasť hrudníka [57]. V období do jedného roka po začatí liečby sa u sledovaných pacientok vyvinula kardiálna dysfunkcia mierneho stupňa bez klinických príznakov. Vyšetrenie EF ĽK rádionuklidovou ventrikulografiou potvrdilo ĽK dysfunkciu u sledovaných pacientok.
Autori Daugaard et al porovnávali prediktívnu hodnotu BNP a NT-ANP (N-terminálneho proátriálneho nátriuretického peptidu) [58]. Pozitívnu koreláciu dokázali medzi zvýšenými hodnotami oboch NP a výskytom redukovanej EF ĽK pod 50 %. U pacientov s nezmenenou funkciou ĽK sa zmeny hladín NP nepozorovali.
Podobné výsledky zaznamenali vo svojej práci aj autori Elbl et al [59]. Títo autori sledovali BNP v korelácii s parametrami systolickej a diastolickej funkcie srdca u pacientov (n = 55) niekoľko rokov po ukončení liečby doxorubicínom. Zvýšené hodnoty BNP boli zaznamenané len u pacientov s EF ĽK < 50 %. Táto práca zároveň potvrdila vysokú negatívnu prediktívnu hodnotu hladiny BNP u pacientov bez subklinického poškodenia myokardu.
Sledovaniam akútnej a subakútnej kardiotoxicity idarubicínu u pacientov (n = 15) s akútnou myeloidnou leukémiou (AML) pomocou biochemických markerov NT-proBNP, cTnT, CK-MB mass sa venovali autori Horáček et al [60]. U väčšiny sledovaných pacientov k zvýšeniu hladín NT-proBNP (o viac ako dvojnásobok priemernej bazálnej hodnoty) došlo len po prvej indukčnej dávke idarubicínu. Elevácie boli prechodné, reflektujúce neurohumorálnu aktiváciu v rámci akútnej subklinickej kardiotoxicity a do 4 týždňov sa hodnoty upravili na počiatočné hladiny. Tendencia rastu hladín po ďalších dávkach už nebola prítomná.
V štúdii Suzuki et al jedine hladiny BNP spomedzi mnohých neurohumorálnych látok a kardiomarkerov (ANP, renín, aldosterón, angiotenzín II, norepinefrín, epinefrín, CK-MB, ľahké reťazce myozínu) dokázali nasledovať vývoj echokardiografických zmien [61]. Názory na prediktívnu hodnotu zmien NP u pacientov v súvislosti s antracyklínovou kardiotoxicitou však nie sú jednoznačné. V niektorých štúdiách boli elevácie NP skorým markerom indukovanej kardiomyopatie, v iných boli zvýšenia hladín NP len dočasné a charakterizovali prechodné zmeny [61].
Viaceré práce zisťovali vzájomnú koreláciu cTn a NP v detekcii antracyklínovej kardiomyopatie. V experimentálnom modely včasnej adriamycínovej kardiotoxicity bola dokumentovaná signifikantná korelácia zvýšených hodnôt BNP a cTnT s funkčnými zmenami myokardu [35]. Analýzou prediktívnej hodnoty kardiomarkerov počas 12 týždňového „follow-up“ sa ako viac senzitívny uplatnil cTnT. Odlišné výsledky prináša práca Sokera et al realizovaná u detí počas doxorubicínovej chemoterapie. Popri signifikantných eleváciách NT-proBNP hodnoty cTnI nepresahovali referenčné hranice [42].
Využitie NP ako diagnostického ukazovateľa pri dlhodobom monitorovaní potenciálnej kardiálnej dysfunkcie v súvislosti s podávaním antracyklínov, prípadne pri sledovaní efektivity kardiologickej liečby, je potrebné kriticky overiť aj vzhľadom na nedávno publikované údaje o pomerne vysokej (viac ako 30%) intraindividuálnej biologickej variabilite NP [62,63]. Pri interpretácii výsledkov týkajúcich sa týchto markerov je potrebné venovať osobitnú pozornosť pacientom v staršom veku (s vekom hodnoty NP stúpajú). Okrem problémov s interpretáciou NP v starobe je potrebné zohľadniť aj vplyv pohlavia (vyššie hodnoty sú u žien), renálnych funkcií, telesnej hmotnosti (nižšie hodnoty sa zisťujú u obéznych pacientov). Zvýšenie hladín NP môže súvisieť aj s biochemickou stimuláciou, NP bývajú vyššie aj v súvislosti s podávaním estrogénov a niektorých liekov (ACEI). Pri interpretácii výsledkov štúdií nie sú doriešené ani problémy s jednotkami a „cut-off“ hodnotami.
Záver
Biochemické markery - kardiálne troponíny a nátriuretické peptidy - sú podľa viacerých štúdií považované za parametre subklinického poškodenia srdca, ktoré vzniká ako následok toxického pôsobenia antracyklínovej chemoterapie.
Podľa niektorých autorov je možné považovať zvýšené hladiny kardiálnych troponínov za užitočné prediktory kardiologických komplikácií v súvislosti s protinádorovou liečbou. Zvýšenie ich hladín sa môže vyskytovať s niekoľko mesačným predstihom pred klinickými prejavmi kardiomyopatie indukovanej chemoterapiou. Na druhej strane, pacienti, u ktorých nie sú zistené zvýšené hladiny troponínov, majú nízke riziko vzniku kardiomyopatie (negatívna prediktívna hodnota sa udáva 99 %).
Definitívny dôkaz o diagnostickej a prognostickej užitočnosti nátriuretických peptidov v súvislosti s poškodením srdca chemoterapiou nebol doposiaľ (podľa dostupných informácií) publikovaný. Najdôležitejším zistením je ich vysoká negatívna prediktívna hodnota (97 %). Analýza ekonomickej efektívnosti vyšetrenia nátriuretických peptidov poukazuje na to, že normálny výsledok môže znížiť potrebu ďalších kardiologických vyšetrení.
Viacerí autori dokázali koreláciu biochemických markerov s echokardiografickými parametrami systolickej aj diastolickej dysfunkcie ĽK a v súčasnosti sa obidve metódy vzájomne dopĺňajú.
Aj keď viaceré publikované štúdie potvrdili prínos kardiálnych troponínov a nátriuretických peptidov pri detekcii a predikcii kardiotoxicity, ich stanovovanie nie je zatiaľ súčasťou diagnostických algoritmov uvádzaných v odporúčaniach medzinárodných onkologických spoločností pre sledovanie kardiotoxicity.
Poďakovanie
Práca bola čiastočne financovaná z grantu VEGA MŠ SR a SAV 01/1160/04.
Práca vznikla s podporou firmy Roche Slovensko, s.r.o., Diagnostics Division.
Za technickú spoluprácu pri príprave rukopisu ďakujeme Silvii Aziriovej.
MUDr. Dagmar Urbanová
www.fmed.uniba.sk
e-mail: dagmar.urbanova@fmed.uniba.sk
Doručeno do redakce: 4. 11. 2006
Přijato po recenzi: 29. 1 - 2007
Zdroje
1. Mladosievičová B. Patofyziológia a klinika kardiotoxicity cytostatík. Acta chemotherapeutica 2003; 5 : 67-76.
2. Kerkela R, Grazette L, Yacobi R et al. Cardiotoxicity of the cancer therapeutic agent imatinib mesylate. Nat Med 2006; 12 : 908-916.
3. Mertens A, Yasui Y, Neglia JP et al. Late mortality experience in five-year survivors of childhood and adolescent cancer: the Childhood Cancer Survivors Study. J Clin Oncol 2001; 19 : 3163-3172.
4. Singal PK, Iliskovic. N Doxorubicin-induced cardiomyopthy. N Engl J Med 1998; 339 : 900-905.
5. Giantris A, Abdurrahman L, Hinkle A et al. Anthracycline-induced cardiotoxicity in children and young adults. Crit Rev Oncol Hematol 1998; 27 : 53-68.
6. Simbre VC, Duffy SA, Dadlani GH et al. Cardiotoxicity of cancer chemotherapy: implications for children. Paediatr Drugs 2005; 7 : 187-202.
7. Weiss RB. The anthracyclines: will we ever find a better doxorubicine? Semin Oncol 1992; 19 : 670-686.
8. Wilson KS. Anthracyclines in early breast cancer. N Engl J Med 2006; 355 : 845.
9. Elbl L, Vášová I, Krejčí M et al. Vliv vysokodávkované chemoterapie s následnou transplantací krvetvorných buněk na funkci levé komory srdeční u nemocných s maligními lymfomy léčenými doxorubicinem v primární chemoterapii. Vnitř Lék 2006; 52 : 221-231.
10. Elbl L, Vášová I, Navrátil M et al. Pozdní kardiotoxicita u nemocných léčených pro maligní lymfomy chemoterapií s doxorubicinem. Vnitř Lék 2006; 52 : 328-338.
11. Herman EH, Ferrans VJ Pathophysiology of anthracyclines cardiotoxicity, 25-34. In: Bricker JT, Green DM, D’Angio GJ Cardiac toxicity after treatment for childhood cancer. Wiley-Liss, New York 1993.
12. Parker MA, King V, Howard KP et al. Nuclear magnetic resonance study of doxorubicin binding to cardiolipin containing magnetically oriented phospholipid bilayers. Biochim Biophys Acta 2001; 1514 : 206-216.
13. Kim Y, Ma AG, Kitta K et al. Anthracycline-induced suppression of GATA-4 transcription factor: implication in the regulation of cardiac myocyte apoptosis. Mol Pharmacol 2003; 63 : 368-377.
14. Arai M, Yoguchi A, Takizawa T. Mechanisms of doxorubicin-induced inhibition of sarcoplasmic reticulum Ca-ATPase gene transcription. Mol Med 2000; 86 : 8-14.
15. Tolba K, Deliargyris EN. Cardiotoxicity of cancer therapy. Cancer Invest 1999; 17 : 408-422.
16. Caulfield JB, Bittner V. Cardiac matrix alterations induced by adriamycin. Am J Pathol 1988; 133 : 298-230.
17. Elliott P. Pathogenesis of cardiotoxicity induced by anthracyclines. Semin Oncol 2006; 33: S2-S7.
18. Wolf MB, Baynes JW. The anticancer drug, doxorubicin, causes oxidant stress-induced endothelial dysfunction. Biochim Biophys Acta 2006; 1760 : 267-271.
19. Dolci A, Dominici R, Cardinale D et al. Biochemical markers for predicting chemotherapy-induced cardiotoxicity: systematic review of the literature and recommendations for use. G Ital Cardiol 2006; 7 : 604-611.
20. Urbanova D, Urban L, Carter A et al. Cardiac troponins - biochemical markers of cardiac toxicity after cytostatic therapy. Neoplasma 2006; 53 : 183-190.
21. Adamcova M, Sterba M, Simunek T et al. Troponin as a marker of myocardial damage in drug-induced cardiotoxicity. Expert Opin Drug Saf 2005; 4 : 457-472.
22. Katus HA, Remppis A, Looser S et al. Enzyme linked immuno assay of cardiac troponin T for the detection of acute myocardial infarction in patients. J Mol Cell Cardiol 1989; 21 : 1349-1353.
23. Ebashi S, Wakabayashi T, Ebashi F. Troponin and its components. J Biochem 1971; 69 : 441-445.
24. Špirková Z, Daňová K, Pecháň I et al. Interferencie v analýzach kardiálnych troponínov, 32. In: Kardiomarkery. Bratislava: Phonec Agency 2005.
25. Wallace TW, Abdullah SM, Drazner MH et al. Prevalence and determinants of troponin T elevation in the general population. Circulation 2006; 113 : 1958-1965.
26. Wallace KB, Hausner E, Herman E et al. Serum troponins as biomarkers of drug-induced cardiac toxicity. Toxicol Pathol 2004; 32 : 106-121.
27. Adamcova M, Geršl V, Hrdina R et al. Cardiac troponin T as a marker of myocardial damage caused by antineoplastic drugs in rabbits. J Cancer Res Clin Oncol 1999; 125 : 268-274.
28. Horwich TB, Patel J, MacLellan WR et al. Cardiac troponin I is associated with impaired hemodynamics, progressive left ventricular dysfunction, and increased mortality rates in advanced heart failure. Circulation 2003; 108 : 833-838.
29. Communal C, Sumandea M, de Tombe P et al. Functional consequences of caspase activation in cardiac myocytes. Proc Natl Acad Sci USA 2002; 99 : 6252-6256.
30. Adamcova M, Sterba M, Simunek T et al. Myocardial regulatory proteins and heart failure. Eur J Heart Fail 2006; 8 : 333-342.
31. Seino Y, Tomita Y, Nagae Y et al. Cardioprotective effeects of ACE-inhibitor (Cilazapril) on adriamycin cardiotoxicity in spontaneously hypertensive rats. Circulation 1993; 88 : 1633.
32. O’Brien PJ, Dameron GW, Beck ML et al. Cardiac troponin T is a sensitive, specific biomarker of cardiac injury in laboratory animals. Lab Anim Science 1997; 47 : 486-495.
33. Herman EH, Zhang J, Lipshultz SE et al. Correlation between serum levels of cardiac troponin T and the severity of the chronic cardiomyopathy induced by doxorubicin. J Clin Oncol 1999; 17 : 2237-2243.
34. Bertinchant JP, Polge A, Juan LM et al. Evaluation of cardiac troponin I and T levels as markers of myocardial damage in doxorubicin-induced cardiomyopathy in rats and their relationship with echocardiographic and histological findings. Clin Chim Acta 2003; 329 : 39-51.
35. Koh E, Nakamura T, Takahashi H. Troponin-T and brain natriuretic peptide as predictors for adriamycin induced cardiomyopathy in rats. Circ J 2004; 68 : 163-167.
36. Lipshultz SE, Rifai N, Sallan SE et al. Predictive value of cardiac troponin T in pediatric patients at risk for myocardial injury. Circulation 1997; 96 : 2641-2648.
37. Lipshultz SE, Rifai N, Dalton VM et al. The effect of dexrazoxane on myocardial injury in doxorubicin-treated children with acute lymphoblastic leukemia. N Engl J Med 2004; 351 : 145-153.
38. Auner HW, Tinchon C, Linkesch W et al. Prolonged monitoring of troponin T for the detection of anthracycline cardiotoxicity in adults with hematological malignancies. Ann Hematol 2003; 82 : 218-222.
39. Kilickap S, Barista I, Akgul E et al. CTnT can be a useful marker for early detection of anthracycline cardiotoxicity. Ann Oncol 2005; 16 : 798-804.
40. Cardinale D, Sandri MT, Martinoni A et al. Left ventricular dysfunction predicted by early troponin I release after high-dose chemotherapy. JACC 2000; 36 : 517-522.
41. Koseoglu V, Berberoglu S, Karademir S et al. Cardiac troponin I: is it a marker to detect cardiotoxicity in children treated with doxorubicin? Turk J Pediatr 2005; 47 : 17-22.
42. Soker M, Kervancioglu M Plasma concentrations of NT-pro-BNP and cardiac troponin-I in relation to doxorubicin-induced cardiomyopathy and cardiac function in childhood malignancy. Saudi Med J 2005; 26 : 1197-1202.
43. Mathew P, Suarez W, Kip K et al. Is there a potential role for serum cardiac troponin I as a marker for myocardial dysfunction in pediatric patients receiving anthracycline-based therapy? A pilot study. Cancer Invest 2001; 19 : 352-359.
44. Špirková Z, Daňová K, Pecháň I et al. Kardiomarkery pri srdcovom zlyhaní - natriuretické peptidy, 101-107. In: Kardiomarkery. Bratislava: Phonec Agency 2005.
45. Sudoh T, Kangawa K, Minamino N et al. A new natriuretic peptide in porcine brain. Nature 1988; 332 : 78-81.
46. Mair J Role of cardiac natriuretic peptide testing in heart failure (Editorial). Clin Chem 2002; 48 : 977-978.
47. Ricciardi G, Pieragnoli P, Colella A et al. Role of natriuretic peptides in heart failure patients with special reference to those on cardiac resynchronization therapy. Minerva Cardioangiol 2006; 54 : 743-752.
48. Remes J, Miettinien H, Reunanen A et al. Validity of clinical diagnosis of heart failure in primary health care. Eur Heart J 1991; 12 : 315-321.
49. Guidelines for the diagnosis and treatment of chronic heart failure: executive summary. The Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur Heart J 2005; 26 : 1115-1140.
50. Murín J, Kamenský G, Goncalvesová E et al. Komentár k Odporúčaniam Európskej kardiologickej spoločnosti pre diagnostiku a liečbu pacientov s chronickým srdcovým zlyhávaním. Cardiol 2006; 15 : 55-59.
51. Bauch M, Ester A, Kimura B et al. Atrial natriuretic peptide as a marker for doxorubicin-induced cardiotoxic effects. Cancer 1992; 69 : 1492-1497.
52. Hayakawa H, Komada Y, Hirayama M et al. Plasma levels of natriuretic peptides in relation to doxorubicin-induced cardiotoxicity and cardiac function in children with cancer. Med Pediatr Oncol 2001; 37 : 4-9.
53. Lipshultz SE, Hinkle AS, French CA et al. Accelerated atherosclerosis contributes to elevated global risk for premature symptomatic cardiovascular disease in survivors of childhood cancer. Abstract No: 3203, 2003; ASCO Annual Meeting
54. Germanakis I, Kalmanti M, Parthenakis F et al. Correlation of plasma N-terminal pro-brain natriuretic peptide levels with left ventricle mass in children treated with anthracyclines. Int J Cardiol 2006; 108 : 212-215.
55. Nousiainen T, Jantunen E, Vanninen E et al. Natriuretic peptides as markers of cardiotoxicity during doxorubicin treatment for non-Hodgkin's lymphoma. Eur J Haematol 1999; 62 : 135-141.
56. Okumura H, Iuchi K, Yoshida T et al. Brain natriuretic peptide is a predictor of anthracycline-induced cardiotoxicity. Acta Haematol 2000; 104 : 158-163.
57. Meinardi MT, van Veldhuisen DJ, Gietema JA et al. Prospective evaluation of early cardiac damage induced by epirubicin-containing adjuvant chemotherapy and locoregional radiotherapy in breast cancer patients. J Clin Oncol 2001; 19 : 2746-2753.
58. Daugaard G, Lassen U, Bie P et al. Natriuretic peptides in the monitoring of anthracycline induced reduction in left ventricular ejection fraction. Eur J Heart Fail 2005; 7 : 87-93.
59. Elbl L, Vášová I, Navrátil M et al. Srovnání plazmatických hladin B-natriuretického peptidu s echokardiografickými ukazateli funkce levé komory srdeční po léčbě doxorubicinem. Vnitř Lék 2006; 52 : 563-570.
60. Horacek JM, Pudil R, Tichy M et al. The use of biochemical markers in cardiotoxicity monitoring in patients treated for leukemia. Neoplasma 2005; 52 : 430-434.
61. Suzuki T, Hayashi D, Yamazaki T et al. Elevated B-type natriuretic peptide levels after anthracycline administration. Am Heart J 1998; 136 : 362-363.
62. Wu AH. Serial testing of B-type natriuretic peptide and NTpro-BNP for monitoring therapy of heart failure: the role of biologic variation in the interpretation of results. Am Heart J 2006; 152 : 828-834.
63. Clerico A, Zucchelli GC, Pilo A et al. Clinical relevance of biological variation: the lesson of brain natriuretic peptide (BNP) and NT-proBNP assay. Clin Chem Lab Med 2006; 44 : 366-378.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Délka antikoagulační léčby a riziko recidiv u TEN - editorial
- Klinické zkušenosti s léčbou dlouhodobým inzulinovým analogem glargin v diabetologickém centru
- Vliv dlouhodobé terapie inzulinovou pumpou (CSII) u pacientů s diabetes mellitus 1. typu na metabolickou kompenzaci a výskyt hypoglykemií. Porovnání s intenzifikovanou konvenční inzulinovou terapií (MDI)
- Subpopulace CD34+buněk a jejich význam pro přihojení štěpu u příbuzenských alogenních transplantací periferních kmenových buněk
- Esenciální trombocytemie a další myeloproliferace s trombocytemií v údajích registru pacientů léčených Thromboreductinem® do konce roku 2006
- Optimální délka antikoagulační léčby po žilní tromboembolické příhodě: obecný či individualizovaný přístup?
- Kardiotoxicita antracyklínovej liečby vo svetle nových biochemických diagnostických možností
- Genetické faktory a riziko kardiovaskulárnych ochorení
-
Nové poznatky v genetice autoimunitního diabetu
(1): Monogenně podmíněné typy autoimunitního diabetu - Je familiární hypercholesterolemie v České republice pod kontrolou?
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Postavení neoadjuvantní chemoterapie v léčbě nemalobuněčného plicního karcinomu
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Ojedinělá komplikace při pokusu o zavedení dočasné kardiostimulace
- Zlepšování výsledků léčby vybraných krevních chorob a změny nákladů na tuto léčbu. Otázky pro ekonomy a další odborníky
- Jsou nezbytná kvalifikovaná rozhodnutí vycházející z věrohodných dat
- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Príspevok nefrológie vo Fakultnej nemocnici L. Pasteura a Lekárskej fakulty Univerzity P. J. Šafárika v Košiciach ku histórii českej nefrológie
- Zamrazil V. Hypotyreóza. Průvodce ošetřujícího lékaře.
- Vondráček L, Dvořáková V. Pochybení a sankce při poskytování lékařské péče.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Genetické faktory a riziko kardiovaskulárnych ochorení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



