-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Postavení neoadjuvantní chemoterapie v léčbě nemalobuněčného plicního karcinomu
The position of neoadjuvant chemotherapy in the treatment of non-small-cell lung carcinoma
Surgical treatment of patients with non-small-cell lung carcinoma (NSCLC) offers greatest chances for long-term survival. However, the treatment is applicable only to patients diagnosed at an early stage of the disease, i.e. at stage I or II. The five year survival rate of patients operated at stage IIIA is as low as 23 %. Hence there is a great need for improving survival results, especially in the sphere of systemic chemotherapy, as most tumour relapses involve the formation of metastases. Even though neoadjuvant chemotherapy in the operable stages of NSCLC still appeared very promising as a method of treatment a couple of years ago, recently published results have shown that its role has not yet been fully clarified and is still a subject of research. Additional results from randomised studies are necessary before neoadjuvant therapy may become a treatment standard. The dilemma as to whether or not to apply adjuvant, neoadjuvant or both types of chemotherapy in patients operated on for NSCLC therefore remains unsolved. On the whole, the positive role of neoadjuvant chemotherapy does not appear to be proven in the treatment of operable stage I and II NSCLS. In contrast, results of randomised studies first published in 2004 were in favour of post-surgical adjuvant chemotherapy as opposed to surgical treatment alone in NSCLC stage IB, II and IIIA. The question of whether it is better to apply chemotherapy prior to or after surgery can only be answered by the extensive randomised studies underway. The role of neoadjuvant chemotherapy in patients with NSCLC at clinical stage IIIA remains uncertain. The most rational approach to such patients appears to be neoadjuvant chemotherapy or chemotherapy with subsequent surgery.
Key words:
non-small-cell lung carcinoma – NSCLC – neoadjuvant chemotherapy of NSCLC – induction chemotherapy of NSSCLC – adjuvant chemotherapy of NSCLC – surgical treatment of NSCLC
Autoři: I. Špásová
Působiště autorů: Pneumologická klinika 2. lékařské fakulty UK a FN Motol, Praha, přednosta doc. MUDr. Jaromír Musil, Ph. D.
Vyšlo v časopise: Vnitř Lék 2007; 53(6): 715-723
Kategorie: Přehledné referáty
Souhrn
Chirurgická léčba u nemocných s nemalobuněčným plicním karcinomem (NSCLC) poskytuje největší šanci na dlouhodobé přežití. Tato léčba je však vyhrazena pouze pro nemocné diagnostikované v časném stadiu onemocnění, tj. ve stadiu I a II. Pětileté přežití nemocných operovaných ve stadiu IIIA je pouze 23 %. Existuje zde tudíž velká potřeba zlepšení výsledků přežití, zvláště v oblasti systémové chemoterapie, neboť většina nádorových relapsů se projevuje tvorbou metastáz. Ačkoliv se neoadjuvantní chemoterapie u operabilních stadií NSCLC ještě před několika málo lety zdála být velmi slibnou metodou léčby, z výsledků prací publikovaných v poslední době je zřejmé, že její role není doposud zcela jasná a nadále zůstává oblastí výzkumu. Je potřeba dalších výsledků z randomizovaných studií, než by se neoadjuvantní léčba stala léčbou standardní. Dilema, zda aplikovat adjuvantní, neoadjuvantní nebo oba typy chemoterapie nemocným operovaným pro NSCLC, tedy zůstává nerozřešené. Souhrnně se nezdá být prokázána pozitivní role neoadjuvantní chemoterapie v léčbě operabilního NSCLC stadia I a II. Naopak výsledky randomizovaných studií prezentovaných poprvé v roce 2004 prokázaly prospěch pooperační adjuvantní chemoterapie oproti samotné chirurgické léčbě u NSCLC stadia IB, II a IIIA. Na otázku, zda je chemoterapii lépe aplikovat před, nebo po chirurgické léčbě, mohou odpovědět pouze rozsáhlé randomizované studie, jejichž výsledky jsou očekávány. Role neoadjuvantní chemoterapie u nemocných s NSCLC v klinickém stadiu IIIA zůstává nejistá. Nejracionálnějším přístupem k těmto nemocným se jeví neoadjuvantní chemoterapie nebo chemoradioterapie s následnou chirurgickou léčbou.
Klíčová slova:
nemalobuněčný plicní karcinom - NSCLC - neoadjuvantní chemoterapie NSCLC - indukční chemoterapie NSCLC - adjuvantní chemoterapie NSCLC - chirurgická léčba NSCLCÚvod
Chirurgická léčba, radioterapie a chemoterapie jsou 3 základní léčebné modality užívané v léčbě nemalobuněčného plicního karcinomu (NSCLC). Mohou být použity samostatně nebo v kombinaci v závislosti na rozsahu nádorového onemocnění a celkovém klinickém stavu nemocného.
Chirurgická léčba u NSCLC
Chirurgická léčba u nemocných s NSCLC poskytuje největší šanci na dlouhodobé přežití. Tato léčba je však vyhrazena pouze pro nemocné diagnostikované v časném stadiu onemocnění, tj. ve stadiu I a II dle TNM klasifikace: 5leté přežití po chirurgické léčbě samotné činí přibližně 70 % v pooperačně určeném stadiu IA, 60 % ve stadiu IB, 55 % ve stadiu IIA a 40 % ve stadiu IIB; 5leté přežití radikálně operovaných nemocných v pooperačním stadiu IIIA je pouze 23 % (stadium pT1-3 pN2 M0) a 25 % (stadium pT3 pN1 M0) [1]. Existuje zde tudíž velká potřeba zlepšení výsledků přežití, zvláště v oblasti systémové chemoterapie, neboť většina nádorových relapsů se projevuje tvorbou metastáz. Studie prováděné v minulosti prokazovaly relaps nádoru v podobě metastáz po radikální resekci NSCLC až u 80 % nemocných [2]. Tyto výsledky ukazují na potřebu rozvinout účinnou adjuvantní a neoadjuvantní systémovou léčbu u chirurgicky léčených nemocných.
Indikovat chirurgickou léčbu u nemocných ve stadiu III je možné, i když výsledky jsou obvykle špatné v důsledku progrese mikrometastáz. Úspěšná terapie lokálně pokročilého NSCLC závisí jednak na kontrole klinicky zřetelného nitrohrudního nádorového onemocnění a jednak na kontrole klinicky němých nádorových mikrometastáz, které jsou u 3. stadia NSCLC v době diagnózy obvykle přítomné [3]. U nemocných bývá lokálně pokročilé onemocnění diagnostikováno velmi často. Stadium III bylo ve studii Bulzebrucka et al zjištěno u 44 % nově diagnostikovaných nemocných s NSCLC, rovným dílem stadium IIIA a IIIB [4]. Léčba ozářením byla v minulosti u těchto nemocných s pokročilým nádorovým onemocněním bez prokázaných metastáz standardní léčbou. Při použití radioterapie však bylo 5leté přežití obvykle nižší než 5 % a většina nemocných zemřela v důsledku vzdálených metastáz [1]. Chemoterapie, tj. léčba cílená i na extratorakální složku onemocnění, je logickým základem ve snaze prodloužit přežití.
Chemoterapie u NSCLC
Léčba cytostatiky se může uplatnit v různých etapách léčby nádorů, buď jako samostatná léčba u metastazujícího NSCLC, nebo jako adjuvantní či neoadjuvantní chemoterapie v kombinaci s dalšími léčebnými modalitami. Adjuvantní chemoterapie, která obecně doplňuje nebo zvyšuje účinnost jiné základní léčebné metody, navazuje obvykle na chirurgickou léčbu. Cíl adjuvantní chemoterapie je ve všech případech shodný: likvidovat zbytkovou populaci nádoru, tj. nádorové buňky, které nebyly zničeny primární lokoregionální léčbou, a zajistit tím definitivní uzdravení nemocného nebo alespoň prodloužit jeho přežití. Neoadjuvantní chemoterapií rozumíme podání cytoreduktivní chemoterapie ve 2-4 cyklech před konečnou chirurgickou nebo radiační léčbou.
NSCLC představuje asi 70-80 % všech případů plicní rakoviny. Tato nemalobuněčná varianta je slabě chemosenzitivní nádor. Dlouhou dobu panovala skepse ohledně využití chemoterapie v léčbě tohoto typu nádoru, především proto, že alkylující látky, úspěšně užívané v chemoterapii jiných nádorových typů, vykazovaly u NSCLC jen nízké procento odezvy, a nadto byly značně toxické. Tyto látky zhoršovaly přežití ve všech stadiích, a to dokonce, i když byly použity jako pooperační adjuvantní chemoterapie [5]. Léčba NSCLC se významně zlepšila až v průběhu 80. let 20. století, kdy byla do klinické praxe zavedena chemoterapie založená na platinových derivátech. Cisplatina se stala součástí moderní léčby NSCLC a její dominantní postavení se potvrdilo rozsáhlými retrospektivními analýzami publikovanými v roce 1990 [6], v roce 1993 [7], a zejména pak v roce 1995, kdy byla publikována rozsáhlá metaanalýza 52 klinických studií [5].
V 90. letech minulého století vyvolalo zavedení 5 nových cytostatických preparátů, které vykazují v monoterapii četnost odezvy přes 20 %, značný optimizmus. Nazýváme je preparáty 3. generace. Mezi tyto látky se řadí vinca alkaloid vinorelbin, taxany paklitaxel a docetaxel, nukleozidový analog gemcitabin a inhibitor topoizomerázy I irinotecan. Každý z nich v monoterapii vykazoval vyšší odezvu na léčbu a delší přežití než cisplatina [8]. Bylo prokázáno, že chemoterapie založená na kombinaci s platinovými deriváty u nemocných s NSCLC ve stadiu III a IV prodlužuje přežití a zlepšuje kvalitu života [5]. Pozitivní účinky chemoterapie těmito novými cytostatiky později začaly být využívány i v multimodální léčbě nejen pokročilých, ale i časnějších stadií NSCLC. V průběhu 90. let 20. století bylo provedeno obrovské množství klinických studií zabývajících se hledáním standardní terapie pro jednotlivá stadia tohoto onemocnění.
Časná stadia NSCLC ve srovnání s nádory jiných lokalizací mají relativně nepříznivou prognózu i v případě, že se nemocní podrobí radikální operační léčbě. 5leté přežití nemocných ve stadiu IA a IB po chirurgické léčbě je pouze 61 % a 57 % [1]. Většina nemocných umírá na rozvoj vzdálených metastáz. Nejpravděpodobnější příčinou této skutečnosti je přítomnost klinicky nedetekovatelných mikrometastáz již v době resekce, i když je veškerý makroskopicky viditelný nádor chirurgicky odstraněn. Mikrometastázy byly detekovány imunohistochemicky a polymerázovou řetězovou reakcí v kostní dřeni [9] i v patologicky normálních nitrohrudních lymfatických uzlinách [10]. V periferní krvi nemocných v časném stadiu NSCLC byly zjištěny cirkulující nádorové buňky [11]. Tyto mikrometastázy jsou pravděpodobně zdrojem nádorových recidiv. Chemoterapie je teoreticky nejúčinnější u nádorů malých rozměrů. Vyšší účinek je ovlivněn vyšším procentem aktivně se dělících buněk, snadnějším průnikem cytostatika k nádorovým buňkám a malou možností vzniku chemorezistence. Aplikace adjuvantní nebo neoadjuvantní chemoterapie proto teoreticky umožňuje likvidaci mikrometastáz, zatímco u klinicky detekovatelných metastáz nemá chemoterapie téměř nikdy kurativní účinek. U nádorových buněk, které jsou geneticky nestabilní, dochází při mnohonásobném dělení k náhodným mutacím, které vedou k vyšší rezistenci k chemoterapii. Z tohoto důvodu jsou nádory u nemocných s klinicky ověřitelnými metastázami obvykle alespoň částečně rezistentní k chemoterapii.
Neoadjuvantní chemoterapie u NSCLC
Úsilí zlepšit výsledek chirurgické léčby časných stadií nemocných s NSCLC se proto soustředilo na neoadjuvantní předoperační a adjuvantní pooperační chemoterapii. I méně pokročilé nádory I. a II. klinického stadia NSCLC jsou v době operace často spojeny s metastatickým, i když klinicky nedetekovatelným, rozsevem onemocnění. Systémová terapie může postihnout tyto mikroskopické metastázy a zvýšit pravděpodobnost trvalého vyléčení. Lokální rozsah nádoru III. stadia limituje možnost radikální chirurgické léčby. Navíc toto lokální rozšíření nádoru obvykle předpovídá existenci mikroskopických nádorových metastáz. Tyto skutečnosti vytvářejí racionální základ pro podávání neoadjuvantní chemoterapie jako prevenci inoperability a pooperační recidivy onemocnění.
Neoadjuvantní předoperační chemoterapie má oproti adjuvantní pooperační chemoterapii celou řadu teoretických výhod: jsou jimi především většinou velmi dobrá tolerance chemoterapie ze strany nemocného, časná kontrola mikrometastáz, snadnější průnik cytostatika při intaktním cévním zásobení nádoru oproti situaci po operaci či po radiační léčbě a dále též zmenšení velikosti primárního nádoru před operací [12]. Na druhé straně tento léčebný přístup znesnadňuje provedení přesného chirurgického stagingu, chirurgická léčba je odložena s malým, ale existujícím rizikem nádorové progrese (přibližně 3-5 %) [13] a může být spojena se zvýšenou operační mortalitou. Určitým argumentem proti podávání neoadjuvantní chemoterapie při lokoregionálně pokročilých nádorech může být i fakt, že cytostatická léčba je teoreticky účinnější u mikrometastáz a malých nádorů než u velkých nádorových mas. Důvodem je skutečnost, že frekvence chemorezistentních buněk vzrůstá s velikostí nádoru [14].
Před indikací neoadjuvantní chemoterapie nemocným s NSCLC by proto měly být splněny 2 hlavní podmínky. První je resekabilní nebo potenciálně resekabilní stadium onemocnění. I když se hranice operability neustále posunují a dle některých autorů je možno kompletně resekovat i vybrané nádory původně ve stadiu IIIB [15], novější studie ukazují, že vliv na délku přežití má neoadjuvantní chemoterapie především u časnějších stadií NSCLC [16]. Druhou podmínkou je použití cytostatického režimu s prokázanou aktivitou u NSCLC a s nízkou plicní toxicitou, aby se bylo možno vyhnout nepřijatelnému zvýšení chirurgické morbidity. Na druhé straně jakkoliv těžká hematologická toxicita provázející neoadjuvantní chemoterapii obvykle nezhoršuje morbiditu následné chirurgické léčby.
Randomizované studie prokazující benefit z neoadjuvantní chemoterapie
První zkušenosti s chemoterapií aplikovanou u NSCLC před léčbou chirurgickou byly získávány koncem 80. let minulého století. Skupina Memorial Sloan-Kettering Cancer Center zjistila, že kombinace cisplatiny, vindesinu a mitomycinu vykazovala vysoké procento odpovědí u lokálně pokročilého NSCLC [17]. Stejná skupina potom testovala tuto kombinaci jako předoperační neoadjuvantní režim s cílem zmenšit masu a rozsah nádoru u nemocných s NSCLC stadia IIIA N2. U takto léčených nemocných došlo k prodloužení přežití, 5 let přežívalo 25 % nemocných [18].
Výsledky této studie fáze II a mnoha dalších, které následovaly, byly potvrzeny dvěmi studiemi fáze III, ve kterých byli nemocní randomizováni do dvou skupin. Buď byli léčeni samotnou chirurgickou léčbou, nebo chirurgické léčbě předcházela, popř. ještě i po ní následovala kombinovaná systémová chemoterapie založená na platinových derivátech. Výsledky těchto studií jsou sumarizovány v tab. 1 [19,20].
Tab. 1. Randomizované studie hodnotící účinek chirurgické léčby samotné oproti neoadjuvantní chemoterapii s následnou chirurgickou léčbou u NSCLC stadia IIIA. 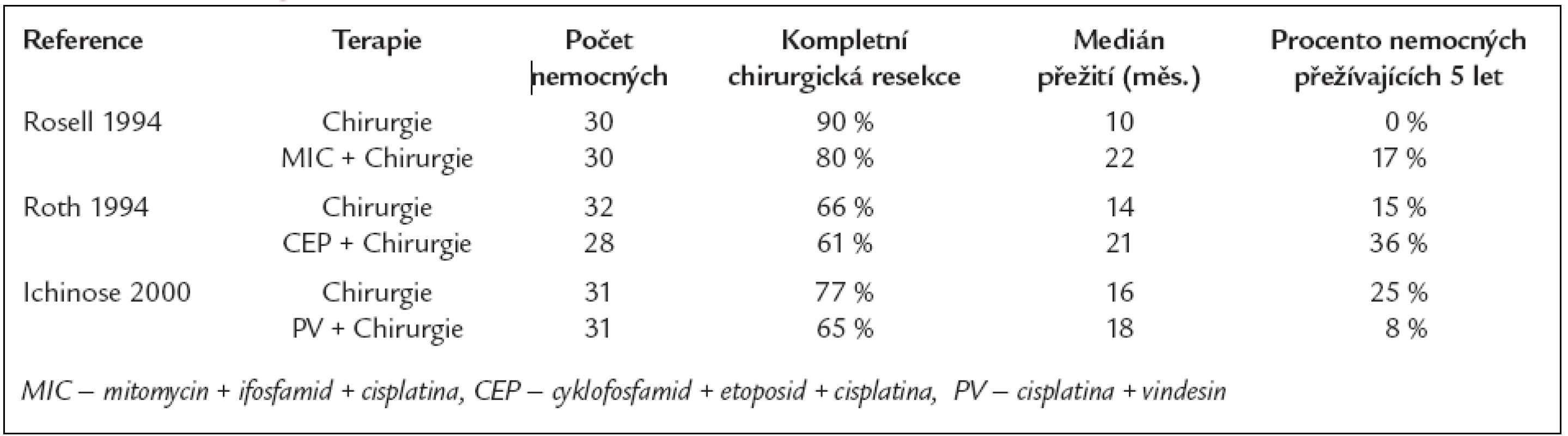
Koncem 90. let minulého století byly publikovány dlouhodobé výsledky těchto 2 autorů [21,22], které tyto výsledky potvrzovaly. Rosell et al randomizovali 60 nemocných s NSCLC ve stadiu IIIA do dvou skupin. Jedna skupina nemocných byla léčena pouze chirurgickou resekcí s následnou postoperační radioterapií, u druhé skupiny nemocných chirurgické léčbě a pooperační radioterapii předcházely 3 cykly chemoterapie. Medián přežití byl 22 měsíců ve skupině s chemoterapií a 10 měsíců ve skupině léčené pouze chirurgicky s následnou radioterapií, rozdíl v přežití byl statisticky významný; 5leté přežití činilo 17 % u skupiny léčené chemoterapií a 0 % u skupiny léčené pouze chirurgicky. Kvůli těmto výrazným rozdílům v délce přežití byla studie předčasně ukončena. Zároveň je však třeba říci, že byly zjištěny rozdíly v incidenci K-ras mutací a ploidií v obou skupinách a dále 4 nemocní ve skupině léčené předoperační chemoterapií byli zařazeni jako T3 pouze na základě satelitních nádorových uzlů, čímž byla tato skupina nepřímo zvýhodněna [21].
Ve druhé podobné studii autorů Roth et al randomizovali 60 nemocných ve stadiu IIIA NSCLC. Skupina 32 nemocných byla podrobena samotné operační léčbě, u druhé skupiny 28 nemocných resekci předcházela chemoterapie. Nemocným, kteří měli kladnou odezvu na léčbu cytostatiky, byly po operaci aplikovány další 3 cykly chemoterapie ve stejné kombinaci. Medián přežití byl 21 měsíců ve skupině nemocných léčených cytostatiky a 14 měsíců ve skupině léčených pouze chirurgicky, rozdíl byl na hranici statistické významnosti (p = 0,056). 5leté přežití činilo 15 % u nemocných po chirurgické léčbě a 36 % po léčbě kombinované. A opět tyto rozdíly v délce přežití vedly z etických důvodů k zastavení studie v okamžiku, kdy bylo randomizováno pouze 60 nemocných [22].
Přežití nemocných ze skupiny léčené kombinací chemoterapie s chirurgickou léčbou bylo v obou studiích významně delší. Tyto studie byly kritizovány pro malý počet zařazených nemocných a také pro horší prognózu nemocných ve skupině léčené samotnou chirurgickou léčbou. Nicméně na základě výsledků těchto dvou široce publikovaných studií pro většinu specialistů přestala být chirurgická léčba adekvátní terapií pro NSCLC stadia IIIA (N2).
Randomizované studie neprokazující benefit z neoadjuvantní chemoterapie
Poněkud stranou pozornosti však zůstaly 3 jiné randomizované studie uveřejněné o několik let později, jejichž výsledky neprokázaly benefit neoadjuvantní chemoterapie aplikované před chirurgickou léčbou. Jednou z nich jsou výsledky skupiny CALGB (The Cancer and Leukemia Group B), tab. 2. V této studii jedna skupina nemocných s NSCLC stadia IIIA byla léčena 2 cykly indukční chemoterapie s následnou resekcí, poté byly aplikovány další 2 cykly stejné cytostatické kombinace a následovala sekvenční radioterapie. Druhá skupina byla léčena předoperační radioterapií, chirurgickou léčbou a pooperační radioterapií do celkové dávky 54 nebo 60 Gy. Medián přežití činil 19 měsíců ve skupině léčené předoperační chemoterapií a 23 měsíců ve skupině léčené předoperační radioterapií [23]. I když výsledky kratšího přežívání ve skupině léčené indukční chemoterapií nebyly statisticky signifikantní, byly v rozporu s výsledky 3 uvedených randomizovaných studií prokazujících jednoznačný benefit neoadjuvantní chemoterapie.
Tab. 2. Randomizované studie fáze III porovnávající účinek různých kombinací léčebných modalit u nemocných s NSCLC stadia I, II a IIIA. 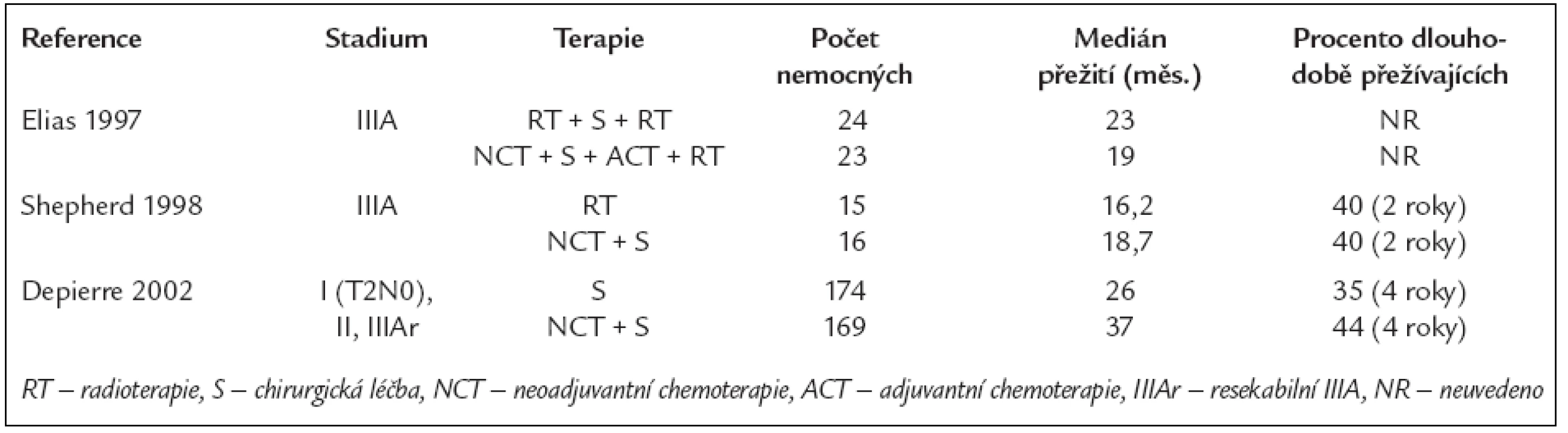
Druhá randomizovaná studie byla ukončena v roce 2000 v Japonsku [24] (tab. 1): 62 nemocných s NSCLC stadia IIIA bylo rozděleno do 2 skupin. U nemocných léčených samotnou chirurgickou léčbou se podařilo provést kompletní resekci nádoru v 77 %, medián přežití činil 16 měsíců, 3leté a 5leté přežití bylo 25 % a 25 %. U nemocných léčených 3 cykly předoperační chemoterapie se podařilo provést kompletní resekci nádoru pouze u 65 % nemocných, medián přežití činil 18 měsíců, 3leté a 5leté přežití činilo 24 % a 8 %. Rozdíly v přežití mezi oběma skupinami nebyly statisticky významné, nicméně skutečnost, že podávání neoadjuvantní chemoterapie neprokázalo benefit ve smyslu prodloužení doby přežití, vedlo k předčasnému ukončení studie. Na základě výsledků studie autoři nedoporučili neoadjuvantní chemoterapii jako standardní léčbu nemocných s NSCLC stadia IIIA N2.
Do třetí malé randomizované studie bylo zařazeno 31 nemocných s NSCLC stadia IIIA [25] (tab. 2). Jedna skupina nemocných byla léčena neoadjuvantní chemoterapií a následnou chirurgickou léčbou, druhá skupina byla léčena pouze samotnou radioterapií. Rozdíl v přežití nebyl významný: 2leté přežití činilo 40 % shodně u obou skupin nemocných. Tato kanadská studie byla předčasně ukončena kvůli připojení k jiné severoamerické studii, nicméně výsledky nastolily staronové dilema, a to je role chirurgie po neoadjuvantní chemoterapii u nemocných s NSCLC stadia IIIA a IIIB.
Deppierre et al v roce 2002 publikovali výsledky rozsáhlé randomizované studie, porovnávající samotnou chirurgickou léčbu u nemocných s NSCLC stadia IB, II a IIIA s chirurgickou léčbou kombinovanou s neoadjuvantní chemoterapií [16] (tab. 2). Předoperační chemoterapie sestávala ze 2 cyklů. Nemocným s objektivní odpovědí na indukční chemoterapii byly aplikovány další 2 cykly chemoterapie adjuvantně po resekční léčbě. Nemocným s patologickým T3 nebo N2 stadiem onemocnění byla v obou skupinách aplikována navíc též léčba ozářením. Medián přežití činil 26 měsíců u nemocných léčených samotnou resekcí a 37 měsíců u nemocných s léčbou kombinovanou. Rozdíl nebyl statisticky významný (p = 0,15). Přežití 1-, 2-, 3 - a 4leté bylo 73 %, 60 %, 41 % a 35 % v první skupině a 77 %, 59 %, 49 % a 44 % ve skupině druhé. Doba do progrese onemocnění byla významně delší ve skupině s chemoterapií (p = 0,033). Byl zjištěn nesignifikantní vzestup perioperační mortality ve skupině s neoadjuvantní chemoterapií, zejména pro tvorbu bronchopleurálních píštělí. Při hodnocení podskupin bylo zjištěno, že statisticky významný benefit z neoadjuvantní chemoterapie měli nemocní s N0-N1 uzlinovým postižením. Neoadjuvantní chemoterapie v této studii prodlužovala přežití u nemocných s resekabilním NSCLC. Tato výhoda však byla snižována poněkud vyšší perioperační mortalitou. Autoři této rozsáhlé studie došli k názoru, že neúspěch při průkazu benefitu z neoadjuvantní chemoterapie u stadia IIIA mohl být způsoben několika faktory. Za prvé, výsledky by byly pravděpodobně příznivější při zařazení většího počtu nemocných. Za druhé, účinnost chemoterapie je pravděpodobně horší u bulky disease než u časnějších stadií. Neoadjuvantní chemoterapie se zdá být účinná hlavně v případě mikrometastáz, méně již u lokoregionálního postižení lymfatických uzlin. Podobně tomu bylo např. ve studii porovnávající indukční chemoterapii s radioterapií samotnou u NSCLC stadia III, ve které chemoterapie snižovala pravděpodobnost výskytu metastáz, neměla však významný efekt na lokoregionální šíření nádoru [26]. Proto také testování nových strategií před a pooperační léčby by mělo být plánováno zvlášť pro stadia NSCLC I a II a zvlášť pro stadium III, kde je vysoké riziko lokoregionálních recidiv i vzdálených metastáz.
Nerandomizované studie neoadjuvantní chemoterapie
Koncem 90. let minulého století po publikaci výsledků dvou výše zmíněných malých randomizovaných studií [19,20], jejichž výsledky prokazovaly, že přežití nemocných s NSCLC ve stadiu IIIA N2, léčených neoadjuvantní chemoterapií s následnou resekcí, bylo signifikantně lepší ve srovnání s nemocnými léčenými samotnou chirurgickou léčbou, se změnil přístup chirurgů a onkologů k léčbě pokročilého NSCLC stadia III. Byla publikována řada studií fáze II, které testovaly výsledky neoadjuvantní chemoterapie nebo chemoradioterapie s následnou chirurgickou terapií u operabilních nemocných s NSCLC ve stadiu IIIA [23,27-38]. Samotná chirurgická léčba těchto nemocných přestala být pro většinu odborníků adekvátní terapií. Doba přežití byla v těchto studiích prodloužena ve srovnání s historickými kontrolami.
Ve studiích byly k neoadjuvantní chemoterapii většinou použity ověřené standardní režimy, jako je kombinace cisplatina - etopozid [27], cisplatina - 5fluorouracil - leukovorin v kontinuálním podání v kombinaci s radioterapií [23] nebo mitomycin - vindesin - cisplatina [29]. Ve studiích z pozdější doby byly k indukční chemoterapii využity nové účinnější cytostatické režimy, jako jsou paklitaxel - cisplatina [35], paklitaxel - karboplatina [32], docetaxel - cisplatina [39], paklitaxel - cisplatina spolu s akcelerovanou frakcionovanou radioterapií [40] nebo gemcitabin - cisplatina [41,42].
Z našich autorů informoval o použití neoadjuvantní chemoterapie Pešek et al, kteří u 29 nemocných s NSCLC aplikovali různé indukční režimy, nejčastěji to byl režim vinblastin - cisplatina u 9 nemocných a gemcitabin - cisplatina u 7 nemocných [36]. Autorka této práce s kolektivem publikovala výsledky neoadjuvantní chemoterapie u nemocných s hraničně operabilním NSCLC stadia IIIA-IIIB, léčených kombinací vinorelbin - cisplatina s následnou lokální léčbou chirurgickou nebo radiační [43,44]. Do studie bylo zařazeno 56 nemocných. Po aplikaci neoadjuvantní chemoterapie bylo dosaženo parciální regrese u 30 nemocných (54 %). U 18 nemocných (32 %) bylo dosaženo kompletní resekability (pT0-3 N0-1). Medián přežití činil 61 týdnů. Kumulativní přežití všech zařazených nemocných bylo 59 % v 1. roce a 27 % ve 2 letech po stanovení diagnózy. Z dalších českých autorů Kolek et al publikovali výsledky studie, ve které u 20 nemocných s NSCLC ve stadiu IIIA podávali vinorelbin - karboplatinu jako indukční režim, po operaci následovala léčba adjuvantní. Resekce mohla být provedena u 14 nemocných (70 %) [33]. V jiné práci autoři Kolek et al publikovali výsledky studie, ve které u 20 nemocných s hraničně operabilním NSCLC aplikovali paklitaxel a karboplatinu jako indukční režim. Pooperační adjuvantní chemoterapie byla zvolena na základě testování senzitivity in vitro. Objektivní odpověď po aplikaci neoadjuvantní chemoterapie zjistili u 11 (55 %) nemocných, operace mohla být provedena u 13 (65 %) nemocných [32].
Ačkoliv do neoadjuvantních studií fáze II byly zařazeny stovky nemocných, účinek tohoto způsobu léčby doposud není možno objektivně zhodnotit z následujících důvodů. Použité chemoterapeutické a radioterapeutické protokoly nejsou standardizovány a navzájem se významně liší. Odlišný je i rozsah předoperačního stagingu a stadium onemocnění u zařazovaných nemocných. Proto jsou výsledky obtížně interpretovatelné. Dalším důvodem je, že nemocní v těchto studiích nejsou randomizováni, a proto neexistují jiné kontrolní skupiny než historická data. Na druhé straně to byly etické důvody, které přinutily již zahájené randomizované studie předčasně ukončit.
Publikované práce hodnotící účinek nových cytostatických preparátů v neoadjuvantním podání jsou vesměs studiemi fáze II. Některé z nich jsou uvedeny v tab. 3. Autoři Pisters et al publikovali velkou prospektivní studii fáze II. Objektivní odpověď po indukční chemoterapii byla zjištěna u 56 % nemocných, kompletní chirurgická resekce se zdařila u 86 % nemocných a 1 rok přežívalo 85 % nemocných [12]. Na základě těchto velmi dobrých výsledků byla zahájena v USA již výše zmíněná randomizovaná studie porovnávající tuto indukční chemoterapii se samotnou chirurgickou léčbou u časných stadii NSCLC (SWOG 9900), tab. 4.
Tab. 3. Nerandomizované studie hodnotící účinek nových cytostatik v neoadjuvantním podání u NSCLC ve stadiu I, II a III. 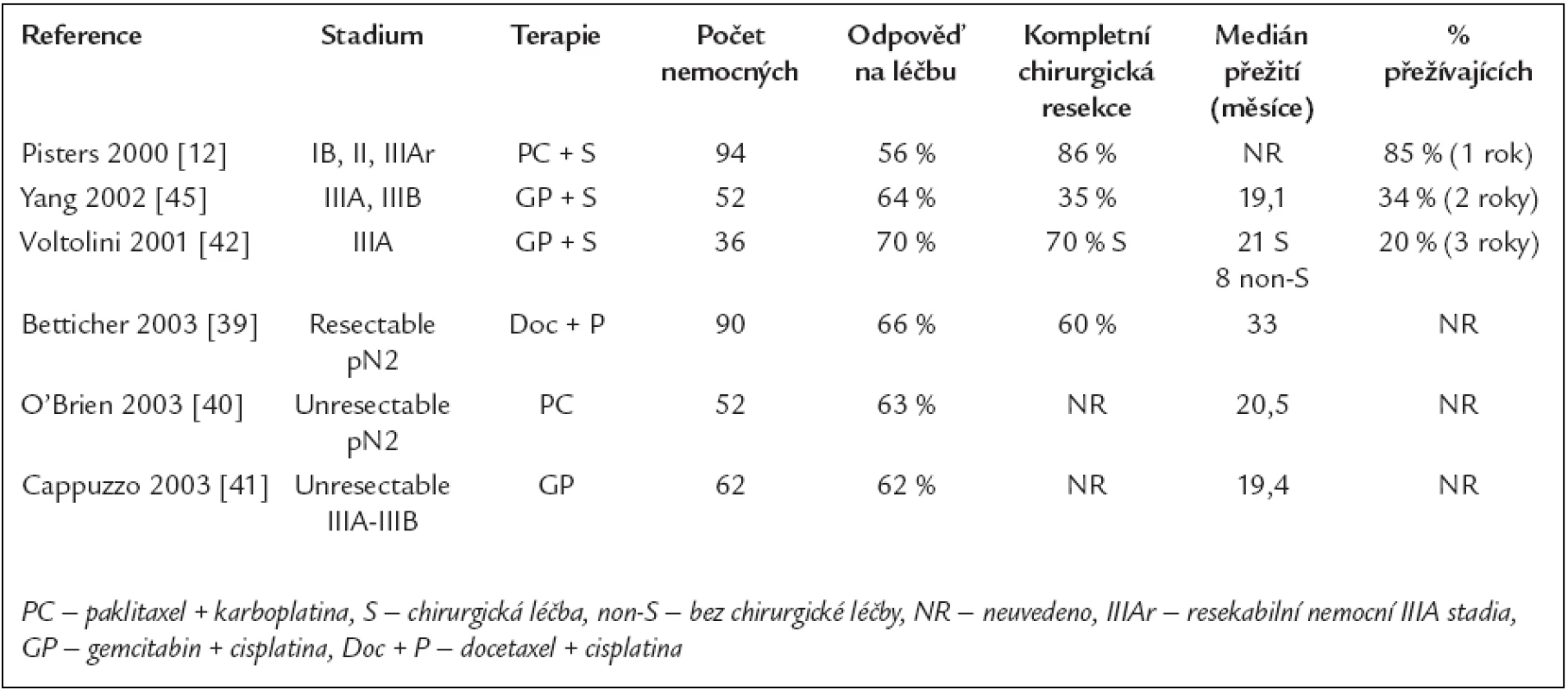
Tab. 4. Probíhající nebo nedávno uzavřené studie neoadjuvantní chemoterapie (upraveno dle Solomona [46]). ![Probíhající nebo nedávno uzavřené studie neoadjuvantní chemoterapie (upraveno dle Solomona [46]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1e882383ed53a0f8c342ad95caf2dfdc.png)
Adjuvantní či neoadjuvantní chemoterapie u NSCLC - nerozřešené dilema
Na základě doposud publikovaných randomizovaných studií není možno rozhodnout, co je pro nemocné s resekabilním NSCLC prospěšnější, zda aplikace adjuvantní či neoadjuvantní chemoterapie. Je možno podat jen omezené důkazy o porovnání účinku obou těchto léčebných postupů. Do doposud publikovaných randomizovaných studií hodnotících efekt neoadjuvantní chemoterapie u NSCLC bylo zařazeno přibližně pouze 600 nemocných, zatímco do randomizovaných studií hodnotící adjuvantní chemoterapii bylo zařazeno více než 6 000 nemocných. V randomizovaných neoadjuvantních studiích nebyly použity režimy obsahující moderní preparáty III. generace. Navíc v části studií hodnotících účinek neoadjuvantní chemoterapie byla u respondentů aplikována též léčba adjuvantní.
Výsledky všech těchto studií naznačují, že samotná chirurgická léčba nemusí být optimální terapií pro NSCLC stadia I a II, ani pro hraničně operabilní NSCLC stadia IIIA. Neodpovídají však ani na otázku, zda je neoadjuvantní chemoterapie s následnou resekcí nádoru nejlepší léčbou pro tyto nemocné, zda je účinnější adjuvantní či neoadjuvantní chemoterapie, nebo zda je nutno podat chemoterapii před i po operaci, dále zda je vůbec chirurgická léčba potřebná a zda radioterapie, ať už samotná nebo v kombinaci s chemoterapií, se ve svých účincích nevyrovná indukční chemoterapii s následnou chirurgií. Na tyto otázky se snaží nalézt odpovědi velké randomizované studie, které v současnosti probíhají nebo byly v nedávné době ukončeny v Evropě (ChEST, MRC study LU22, ICFT-0002, NATCH) a v USA (SWOG 9900), tab. 4 [46].
Jednou z nich je studie SWOG 9900, která byla předčasně ukončena v červenci roku 2004 z etických důvodů, neboť výsledky randomizovaných studií CALGB 9633 a JBR10, prezentovaných na konferenci ASCO (American Society of Clinical Oncology) v roce 2004, jednoznačně prokázaly prospěch pooperační adjuvantní chemoterapie oproti samotné chirurgické léčbě [47,48]. V době uzavření studie bylo zařazeno 356 z původně plánovaných 600 pacientů. Do této studie byli zařazováni nemocní s NSCLC ve stadiu IB, II a vybraní nemocní ve stadiu IIIA (T3N1). Nemocní byli randomizováni do 2 skupin. Jedna skupina byla léčena samotnou chirurgickou léčbou, druhá skupina dostávala navíc před operací 3 cykly chemoterapie (tab. 4). O výsledcích této předčasně uzavřené studie referovala Pisters et al na konferenci ASCO 2005 [49]. Kompletní nebo parciální odpověď byla zjištěna u 51 % nemocných, kterým byla aplikována chemoterapie. Medián přežití činil 47 měsíců u nemocných léčených předoperační chemoterapií a resekcí a 40 měsíců u nemocných léčených samotnou chirurgickou léčbou, rozdíl v přežití nebyl statisticky významný (p = 0,32).
Italská skupina ChEST (Italian Chemotherapy in Early Stages Trial), která hodnotila podání tří cyklů chemoterapie podané před operací obdobné cílové skupině nemocných (NSCLC stadium IB, II a vybraní nemocní ve stadiu IIIA - T3N1). Také tato studie byla předčasně ukončena při zařazení 256 z plánovaných 700 nemocných. Na konferenci ASCO 2005 referovali Scagliotti et al [50] o předběžných výsledcích: 6 měsíců bez progrese onemocnění bylo 89,1 % nemocných ze skupiny léčené chemoterapií a chirurgickou léčbou a 79,6 % nemocných léčených samotnou chirurgickou léčbou při mediánu sledování 10 měsíců. Autoři uzavírají, že tyto časné výsledky naznačují určitou výhodu u nemocných léčených chemoterapií před chirurgickou léčbou.
Nábor nemocných do britské studie MRC-LU22, prováděné ve spolupráci s Dutch Chest Physician Association a European Organisation for Research and Treatment of Cancer, hodnotící předoperační chemoterapii u nemocných s operabilním NSCLC jakéhokoliv stadia, se v současnosti blíží požadovanému počtu 600 nemocných.
Cílem dalších 2 uvedených studií je porovnání výsledků neoadjuvantní a adjuvantní chemoterapie. První z nich je španělská studie NATCH (Neoadjuvant Taxol Carboplatin Hope), která přímo porovnává výsledky předoperační a pooperační chemoterapie. Je plánováno zařadit 600 nemocných s NSCLC ve stadiu IA (> 2,5 cm), IB, II a IIIA (T3N1), kteří jsou randomizováni do 3 skupin: 3 cykly chemoterapie aplikované před nebo po chirurgické léčbě, 3. skupina je léčena samotnou léčbou chirurgickou. Předběžné zprávy o prvních výsledcích této studie hovoří o významném zmenšení velikosti nádoru po aplikaci chemoterapie před operací. Není vyloučeno, že dojde k uzavření skupiny léčené samotnou chirurgickou léčbou [51]. Druhá francouzská studie French IFCT-0002 (Intergroupe Francophone de Cancérologie Thoracique) je 4ramenná studie porovnávající účinnost 2 různých kombinací cytostatik a 2 různých režimů chemoterapie s 2 cykly předoperační a 2 cykly pooperační chemoterapie. Do každého ramene je plánováno zařadit 130 nemocných, celkem 520 pacientů [46].
Závěr
Ačkoliv se neoadjuvantní chemoterapie u operabilních stadií NSCLC ještě před několika málo lety zdála být velmi slibnou metodou léčby, z výsledků prací publikovaných v poslední době je zřejmé, že její role není doposud zcela jasná a nadále zůstává oblastí výzkumu. Použití nových a potenciálně účinnějších cytostatických preparátů s nižší toxicitou a dobrou tolerancí znamená lepší perspektivu pro využití této léčebné strategie. Nicméně je potřeba dalších výsledků z randomizovaných studií, než by se neoadjuvantní léčba stala léčbou standardní. Dilema, zda aplikovat adjuvantní, neoadjuvantní nebo oba typy chemoterapie nemocným operovaným pro NSCLC, tedy zůstává nerozřešené. Souhrnně se nezdá být prokázána pozitivní role chemoterapie v léčbě operabilních stadií NSCLC stadia I a II. Naopak výsledky randomizovaných studií prezentovaných poprvé v roce 2004 prokázaly prospěch pooperační adjuvantní chemoterapie oproti samotné chirurgické léčbě. Na otázku, zda je chemoterapii lépe aplikovat před, nebo po chirurgické léčbě, mohou odpovědět pouze rozsáhlé randomizované studie, jejichž výsledky jsou očekávány. Role neoadjuvantní chemoterapie u nemocných s NSCLC ve stadiu IIIA zůstává nejistá. Nejracionálnějším přístupem k těmto nemocným se jeví neoadjuvantní chemoterapie nebo chemoradioterapie s následnou chirurgickou léčbou.
MUDr. Irena Špásová, CSc.
www.fnmotol.cz
e-mail: spasovairena@seznam.cz
Doručeno do redakce: 27. 11. 2006
Přijato po recenzi: 4. 2. 2007
Zdroje
1. Mountain CF. A new international staging system for lung cancer. Chest 1986; 89(Suppl 4): 225-233.
2. Bunn PA jr. Future directions in clinical research for lung cancer. Chest 1994; 106 : 399S-407S.
3. Pantel K, Izbicki J, Passlick B et al. Frequency and prognostic significance of isolated tumour cells in bone marrow of patients with non-small-cell lung cancer without over metastases. Lancet 1996; 347 : 649-653.
4. Bulzebruck H, Bopp R, Drings P et al. New aspects in the staging of lung cancer. Prospective validation of the International Union Against Cancer TNM classification. Cancer 1992; 70 : 1102-1110.
5. Non-Smal Cell Lung Cancer Collaborative Group. Chemotherapy in non-small cell lung cancer: Meta-analysis using updated data on individual patients from 52 randomised clinical trials. Br Med J 1995; 311 : 899-909.
6. Splinter TA. Chemotherapy in advanced non-small cell lung cancer. Eur J Cancer 1990; 26 : 1093-1099.
7. Souquet PJ, Chauvin F, Boissel JP et al. Polychemotherapy in advanced non small cell lung cancer. Lancet 1993; 342 : 19-21.
8. Bunn PA jr, Kelly K. New chemoterapeutic agents prolong survival and improve quality of life in non-small cell lung cancer: A review of the literature and future directions. Clin Cancer Res 1998; 4 : 1097-1100.
9. Ohgami A, Mitsudomi T, Sugio K et al. Micrometastatic tumor cells in the bone marrow of patients with completely resected non-small-cell lung cancer. Ann Thorac Surg 1997; 64 : 363-367.
10. D’Cunha J, Corfits AL, Herndon JE 2nd et al. Molecular staging of lung cancer: realtime polymerase chain reaction estimation of lymph node micrometastatic tumor cell burden in stage I non-small cell lung cancer – preliminary results of Cancer and Leukemia Group B trial 9761. J Thorac Cardiovasc Surg 2002; 123 : 484-491.
11. Kurusu Z, Yamashita J, Ogawa M et al. Detection of circulating tumor cells by reverse transcriptase-polymerase chain reaction in patients with resectable non-small cell lung cancer. Surgery 1999; 126 : 820-826.
12. Pisters KMW, Ginsberg RJ, Giroux DJ et al. Induction chemotherapy before surgery for early-stage lung cancer: A novel aproach. Bimodality Lung Oncology Team. J Thorac Cardiovasc Surg 2000; 119 : 429-439.
13. Eberhardt WE, Albain KS, Pass H et al. Induction treatment before surgery for non-small cell lung cancer. Lung Cancer 2003; 42(Suppl 1): S9-S14.
14. Ginsberg RJ. Neoadjuvant (induction) treatment for non-small cell lung cancer. Lung Cancer 1995; 12(Suppl 1): S33-S40.
15. Rusch VW, Albain KS, Crowley JJ et al. Neoadjuvant therapy: a novel and effective treatment for stage IIIb non-small cell lung cancer. Ann Thorac Surg 1994; 58 : 290-295.
16. Depierre A, Milleron B, Moro-Sibilot D et al. Preoperative chemotherapy followed by surgery compared with primary surgery in resectable stage I (except T1N0), II, and IIIa non-small-cell lung cancer. J Clin Oncol 2002; 20 : 247-253.
17. Gralla RJ, Kris MG, Burke MT et al. The influence of the addition of mitomycin to vindesine plus cisplatin in a random-assignment trial in 120 patients with non-small cell lung cancer. Proc Am Soc Clin Oncol 1986; 5: A182.
18. Martini N, Kris MG, Gralla RJ et al. The effects of preoperative chemotherapy on the resectability of non-small cell lung carcinoma with mediastinal lymph node metastases (N2 M0). Ann Thorac Surg 1988; 45 : 370-379.
19. Rosell R, Maestre A, Font A et al. A randomized trial of Mitomycin/Ifosfamide/Cisplatin chemotherapy plus surgery versus surgery alone in stage IIIA non-small cell lung. Semin Oncol 1994; 21 : 28-33.
20. Roth JA, Fossella F, Komaki R et al. A randomized trial comparing perioperative chemotherapy and surgery with surgery alone in resectable stage IIIA non-small-cell lung cancer. J Natl Cancer Inst 1994; 86 : 673-680.
21. Rosell R, Gómez-Codina J, Camps C et al. Preresectional chemotherapy in stage IIIA non-small cell lung cancer: a 7-year assessment of a randomized controlled trial. Lung Cancer 1999; 26 : 7-14.
22. Roth JA, Atkinson EN, Fossella F et al. Long-term follow-up of patients enrolled in a randomized trial comparing perioperative chemotherapy and surgery with surgery alone in resectable stage IIIA non-small cell lung cancer. Lung Cancer 1998; 21 : 1-6.
23. Elias AD, Skarin AT, Leong T et al. Neoadjuvant therapy for surgically staged IIIA N2 non-small cell lung cancer (NSCLC). Lung Cancer 1997; 17 : 147-161.
24. Ichinose Y, Tsuchia R, Kato H Randomized trial of chemotherapy followed by surgery versus surgery for stage IIIA N2 non-small cell lung cancer: The Japan clinical oncology group (lung cancer surgical study group) 9209. Lung Cancer 2000; 29: Suppl 2 : 173.
25. Shepherd FA, Johnston MR, Payne D et al. Randomized study of chemotherapy and surgery versus radiotherapy for stage IIIA non-small cell lung cancer: a National Cancer Institute of Canada Clinical Trials Group study. Br J Cancer 1998; 78 : 683-685.
26. Le Chevalier T, Arriagada R, Tarayre M et al. Significant effect of adjuvant chemotherapy on survival in locally advanced non-small-cell lung carcinoma. Letter. J Natl Cancer Inst 1992; 84 : 58.
27. Albain KS, Rusch VW, Crowley JJ et al. Concurrent cisplatin/etoposide plus chest radiotherapy followed by surgery for stages IIIA (N2) and IIIB non-small-cell lung cancer: Mature results of Southwest Oncology Group phase II study 8805. J Clin Oncol 1995; 13 : 1880-1892.
28. Burkes RL, Ginsberg RJ, Shepherd FA et al. Induction chemotherapy with mitomycin, vindesine and cisplatin for stage III unresectable non-small cell lung cancer: results of the Toronto phase II trial. J Clin Oncol 1992; 10 : 580-586.
29. Chella A, Lucchi M, Ribechini A et al. Pre-operative chemotherapy for stage IIIa non-small cell lung cancer. Eur J Surg Oncol 1995; 21 : 393-397.
30. Eberhardt W, Wilke H, Stamatis G et al. Preoperative chemotherapy followed by concurrent chemoradiation therapy based on hyperfractionated accelerated radiotherapy and definitive surgery in locally advanced non-small-cell lung cancer: Mature results of a phase II trial. J Clin Oncol 1998; 16 : 622-634.
31. Finkelstein EI, Urschel JD, Takita H Neoadjuvant chemotherapy for resectable non-small cell lung cancer. J Exp Clin Cancer Res 1997; 16 : 437-439.
32. Kolek V, Grygárková I, Hajdúch M et al. Kombinace paklitaxel a karboplatina v neoadjuvantní chemoterapii u hraničně operabilních stádií IIIA nemalobuněčného karcinomu plic. Následná cílená pooperační adjuvantní chemoterapie. Stud Pneumol Phtiseol 2002; 62 : 19-23.
33. Kolek V, Grygárková I, Hajdúch M et al. Neoadjuvantní chemoterapie u hraničně operabilních stádií IIIA nemalobuněčného karcinomu plic kombinací vinorelbin a karboplatina. Klinická Onkologie 2001; 14 : 55-58.
34. Martini N, Kris MG, Flehinger BJ et al. Preoperative chemotherapy for stage IIIa (N2) lung cancer: the Sloan-Kettering experience with 136 patients. Ann Thorac Surg 1993; 55 : 1365-1374.
35. Palackdharry CS, Durham SJ, Durzinskyd S et al. Premilinary results of neoadjuvant Paclitaxel and Carboplatin in the treatment of early stage non-small-cell lung cancer. Sem Oncol 1997; 24: S12-34-S12-36.
36. Pešek M, Brůha F, Mukenšnábl P Indukční předoperační chemoterapie plicní rakoviny. Prakt Lék 1998; 78 : 253-255.
37. Rice TW, Adelstein DJ, Ciezki JP et al. Short-Course induction chemoradiotherapy with paclitaxel for stage III non-small cell lung cancer. Ann Thorac Surg 1998; 66 : 1909-1914.
38. Van Zandwijk N, Smith EF, Kramer GW et al. Gemcitabine and cisplatin as induction regimen for patients with biopsy-proven stage IIIA N2 non-small-cell lung cancer: a phase II study of the European Organization for Research and Treatment of Cancer Lung Cancer Cooperative Group (EORTC 08955). J Clin Oncol 2000; 18 : 2658-2664.
39. Betticher DC, Hsu Schmitz SF, Totsch M et al. Mediastinal lymph node clearance after docetaxel-cisplatin neoadjuvant chemotherapy is prognostic of survival in patients with stage IIIA pN2 non-small-cell lung cancer: a multicenter phase II trial. J Clin Oncol 2003; 21 : 1752-1759.
40. O´Brien ME, Splinter T, Smit EF et al. Carboplatin and paclitaxel (Taxol) as an induction regimen for patients with biopsy-proven stage IIIA N2 non-small cell lung cancer. An EORTC phase II study. Eur J Cancer 2003; 39 : 1416-1422.
41. Cappuzzo F, Selvaggi G, Gregorc V et al. Gemcitabine and cisplatin as induction chemotherapy for patients with unresectable Stage IIIA-bulky N2 and Stage IIIB non-small cell lung carcinoma: an Italian Lung Cancer Project Observational Study. Cancer 2003; 98 : 128-134.
42. Voltolini L, Luzzi L, Ghiribelli C et al. Results of induction chemotherapy followed by surgical resection in patients with stage IIIA (N2) non-small cell lung cancer: the importance of the nodal down-staging after chemotherapy. Eur J Cardiothorac Surg 2001; 20 : 1106-1112.
43. Špásová I, Hytych V, Petera J Účinnost a toxicita cisplatiny a vinorelbinu v léčbě III. stádia nemalobuněčné plicní rakoviny. Lék Zpr LF UK Hradec Králové 2000; 45 : 103-111.
44. Špásová I, Petera J, Hytych V The Role of Neoadjuvant Chemotherapy in Marginally Resectable or Unresectable Stage III Non-Small Cell Lung Cancer. Neoplasma 2002; 49 : 188-195.
45. Yang Ch, Tsai CM, Wang LS et al. Gemcitabine and cisplatin in a multimodality treatment for locally advanced non-small cell lung cancer. Br J Cancer 2002; 86 : 190-195.
46. Solomon B, Mitchell JD, Bunn PA Jr Adjuvant chemotherapy for resected non-small-cell lung cancer. Oncology (Williston Park) 2005; 19 : 1685-1697, discussion 1698-1700, 1705.
47. Strauss GM, Herndon J, Maddaus MA et al. Randomized clinical trial of adjuvant chemotherapy with paclitaxel and carboplatin following resection in stage IB non-small cell lung cancer (NSCLC): Report of Cancer and Leukemia Group B (CALGB) Protocol 9633 (Abstract 7019). J Clin Oncol 2004; 22: Suppl 14S: 621.
48. Winton T, Livingston R, Johnson D et al. Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. Report of National Cancer Institute of Canada Clinical Trials Group and National Cancer Institute of the United States Intergroup JBR.10. N. Engl J Med 2005; 352 : 2589-2597.
49. Pisters K, Vallierres E, Bunn P et al. S9900: a phase III trial of surgery alone or surgery plus preoperative (preop) paclitaxel/carboplatin (P/C) chemotherapy in early stage non-small cell lung cancer (NSCLC: preliminary results. Proc Am Soc Clin Oncol 2005; 24: A1095.
50. Scagliotti GV, Ch.E.S.T. Investigators. Preliminary results of Ch.E.S.T.: a phase III study of surgery alone or surgery plus preoperative gemcitabine-cisplatin in clinical early stages non-small cell lung cancer (NSCLC). J Clin Oncol 2005; 23: Suppl 16S: A7023.
51. Belani CP Adjuvant and neoadjuvant therapy in non-small cell lung cancer. Semin Oncol 2005; 32: Suppl 2: S9-S15.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2007 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Délka antikoagulační léčby a riziko recidiv u TEN - editorial
- Klinické zkušenosti s léčbou dlouhodobým inzulinovým analogem glargin v diabetologickém centru
- Vliv dlouhodobé terapie inzulinovou pumpou (CSII) u pacientů s diabetes mellitus 1. typu na metabolickou kompenzaci a výskyt hypoglykemií. Porovnání s intenzifikovanou konvenční inzulinovou terapií (MDI)
- Subpopulace CD34+buněk a jejich význam pro přihojení štěpu u příbuzenských alogenních transplantací periferních kmenových buněk
- Esenciální trombocytemie a další myeloproliferace s trombocytemií v údajích registru pacientů léčených Thromboreductinem® do konce roku 2006
- Optimální délka antikoagulační léčby po žilní tromboembolické příhodě: obecný či individualizovaný přístup?
- Kardiotoxicita antracyklínovej liečby vo svetle nových biochemických diagnostických možností
- Genetické faktory a riziko kardiovaskulárnych ochorení
-
Nové poznatky v genetice autoimunitního diabetu
(1): Monogenně podmíněné typy autoimunitního diabetu - Je familiární hypercholesterolemie v České republice pod kontrolou?
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Postavení neoadjuvantní chemoterapie v léčbě nemalobuněčného plicního karcinomu
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Ojedinělá komplikace při pokusu o zavedení dočasné kardiostimulace
- Zlepšování výsledků léčby vybraných krevních chorob a změny nákladů na tuto léčbu. Otázky pro ekonomy a další odborníky
- Jsou nezbytná kvalifikovaná rozhodnutí vycházející z věrohodných dat
- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Príspevok nefrológie vo Fakultnej nemocnici L. Pasteura a Lekárskej fakulty Univerzity P. J. Šafárika v Košiciach ku histórii českej nefrológie
- Zamrazil V. Hypotyreóza. Průvodce ošetřujícího lékaře.
- Vondráček L, Dvořáková V. Pochybení a sankce při poskytování lékařské péče.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Náklady na léky v České republice - příčiny růstu a návrhy řešení
- Hypogonadizmus - závažná komplikace chronické nedostatečnosti ledvin
- Maligní arytmie u pacienta s variantní (Prinzmetalovou) anginou pectoris
- Genetické faktory a riziko kardiovaskulárnych ochorení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



