Nové poznatky v oblasti urolitiázy – zajímavosti z 30. výročního kongresu Evropské urologické asociace 2015
Autoři:
B. Adedokun
Působiště autorů:
Urologická klinika LF MU a FN Brno
Vyšlo v časopise:
Urol List 2015; 13(2): 22-30
Úvod
30. výročí kongresu Evropské urologické asociace (European association of urology – EAU), který se konal v Madridu v období 20.–24. března 2015, byl opravdu rekordní událostí s více než 12 000 účastníky ze 117 zemí. Během kongresu proběhlo více než 4 000 vědeckých témat a téměř 7,5 milionů reakcí na sociální síti Twitter. Vědecký program EAU nabízel komplexní témata v urologii a přidružených oborech. Dále nabízel nekonečnou příležitost pro osobní profesní rozvoj. Přední světoví odborníci prezentovali své poznatky a postřehy během přednášek, diskuzí, prezentací a kurzů. Každý den ráno byla „plenary session“, kde bylo možno vyslechnout přednášky předních světových specialistů, a během zasedání byly panelové diskuze na probíraná témata. Během kongresu probíhaly vzdělávací kurzy v ranních a večerních hodinách. Tedy není možné popsat v tomto článku všechna vědecká témata, která byla projednávána. Nejvíce mě zaujaly nové pokroky v endourologii a v řešení urolitiázy a chtěl bych široce mluvit o tématech, která byla popsána a prezentována v oblasti urolitiázy.
Prevence urolitiázy
Hans-Göran Tiselius (emeritní profesor urologie, zástupce vedoucího Oddělení klinické vědy, intervence a technologie, Institut Karolinska, Švédsko), světoznámý vědec v oboru metabolického vyšetření a terapie urolitiázy, nám dal tipy v rámci léčení a prevence urolitiázy. Jak víme, jsou k dispozici pokyny EAU (Guidelines EAU) na téma urolitiázy, ale H. G. Tiselius měl několik doporučení navíc. Budu se snažit popsat pár důležitých informací z kongresu v této sekci. Mimotělní drcení litiázy (shockwave lithotripsy – SWL) je jednou z nejpopulárnějších metod minimálního invazivního řešení kamínků. Nicméně, nevýhody jsou: nutnost opakovaných výkonů pro reziduální litiázy, perzistující písek v ledvině a nedostatek jasných pokynů (v EAU Guidelines) o výběru energie rázových vln, velikosti ohniska a o počtu sérií SWL – proto je potřeba komplexní hodnocení. Pacienti s recidivující urolitiázou potřebují speciální zásah ve formě poradenství s ohledem na dietu, příjem tekutin a medikamentózní léčbu. Podle H. G. Tiseliuse dokáže prevence urolitiázy snížit recidivy urolitiáz u všech typů litiázy (tab. 1).

V rámci prevence a dispenzarizace pacientů s recidivující urolitiázou je naprosto nutné poslat vyoperovanou litiázu k mineralogickému vyšetření. Dále je nutno provést metabolické vyšetření s analýzou moči na 24 hod, abychom mohli posoudit výdej některých látek močí v celodenním období. Tímto procesem lze vyloučit základní patologie, které vedou k tvorbě močových kamenů. Analýza moči a krve (vyšetření séra) pomáhá identifikovat rizikové faktory podílející se na tvorbě močových kamenů (tab. 2, 3).



Obecné dietní metafylaxe: H. G. Tiselius kladl důraz na některá obecná doporučení tykající se diety a pitného režimu v rámci prevence urolitiázy. Doporučoval větší příjem tekutin, snížený příjem oxalátů, vyvarovat se doplňků vitaminu C, snížený příjem živočišných proteinů, větší příjem vlákniny a denní příjem kalcia mezi 20 a 25 mmol/den (tab. 4a).


Obecné farmakologické metafylaxe: podle zjištěných odchylek při metabolickém vyšetření a dále podle mineralogické analýzy močového konkrementu lze u litiatických pacientů nastavit specifické a účinné farmakologické metafylaxe. Pro litiázy, které neobsahují kalcium, doporučuje podávat bikarbonát, kalium citrát, thiopronin a léky acidifikační. Pro litiázy obsahující kalcium doporučuje podávat thiazide/indapamid, alkalické citráty, allopurinol, probiotikum a doplňky kalcia. Klade důraz na to, že medikamentózní léčba se podává selektivně s ohledem na složení konkrementů a metabolické vyšetření a až po zjištění etiopatogeneze urolitiázy. Thiazidy v kombinaci s indapamidem se doporučují pro hyperkalciurii (Yendt, 1976), je také prokázána klinická účinnost thiazidů při normokalciurii (Yendt, 1986), ke kombinaci také doporučuje kalium a magnezium citrát (tab. 4a, b). Při hypocitraturii doporučuje podávat citrát draselný. Při hyperurikosurii doporučuje podávat allopurinol. Při enterické hyperoxalurii doporučuje doplněk kalcia a magnezia. Při hypomegnezurii doporučuje magnezium citricium, eventuelně s thiazidem. Při nízkém pH moči doporučuje podávání citrátu draselného a u litických pacientů bez abnormalit při vyšetření moči konstatuje, že lze podávat citrát draselný (tab. 4b).
Nekalciové litiázy
V této sekci se H. G. Tiselius zaměřoval na infekční litiázy, litiázy z kyseliny močové a cystinové litiázy. V rámci prevence doporučuje zvýšit příjem tekutin, profylaktickou antibiotickou terapii k zastavení produkce ureázy a acidifikace moči NH4CL nebo Acimethin®/L-metionin®. Při prevenci urátové litiázy doporučuje zvýšit příjem tekutin, bikarbonát nebo citrát draselný ke zvýšení pH moči a allopurinol při hyperurikozurii. Při prevenci cystinové litiázy doporučuje zvýšit příjem tekutin, podání citrátu draselného ke zvýšení pH moči a thiopronin pro cystinurii.
Terapeutické metody pro objemné nefro- a pyelolitiázy
Laso-García et al z Urologické kliniky v nemocnici Ramón Y Cajal v Madridu prezentovali tři klinické případy pacientů s pyelolitiázou větší než 2 cm. Jejich cílem bylo popsat několik terapeutických modalit k léčbě pyelolitiázy. Diskutovali o retroperitoneoskopickém přístupu, retrográdním intrarenálním přístupu a perkutánní nefrolitotromii (PNL). U čtyřicetileté pacientky bez anamnézy s 2,5cm pyelolitiázou provedli laparoskopickou extrakci celé litiázy s retroperitoneálním přístupem. U pětačtyřicetiletého pacienta s levostrannou pyelolitiázou o velikosti 2,7 cm, po pravostranné nefrektomii v dětství pro afunkci, dále s hypertenzí a cystinurií, po dvou invazivních operacích solitární levé ledviny pro litiázu provedli retrográdní flexibilní ureteroskopii a fragmentaci litiázy holmium laserem. Extrakce fragmentů byla provedena s Dormia košíkem. U jednatřicetileté pacientky s levostrannou pyelolitiázou, v anamnéze po apendektomii, resekci ilea a omentektomii pro Crohnovou chorobu provedli PNL s kompletní extrakcí litiázy [1].
PNL – perkutánní nefrolitotromie pronační nebo supinační poloha?
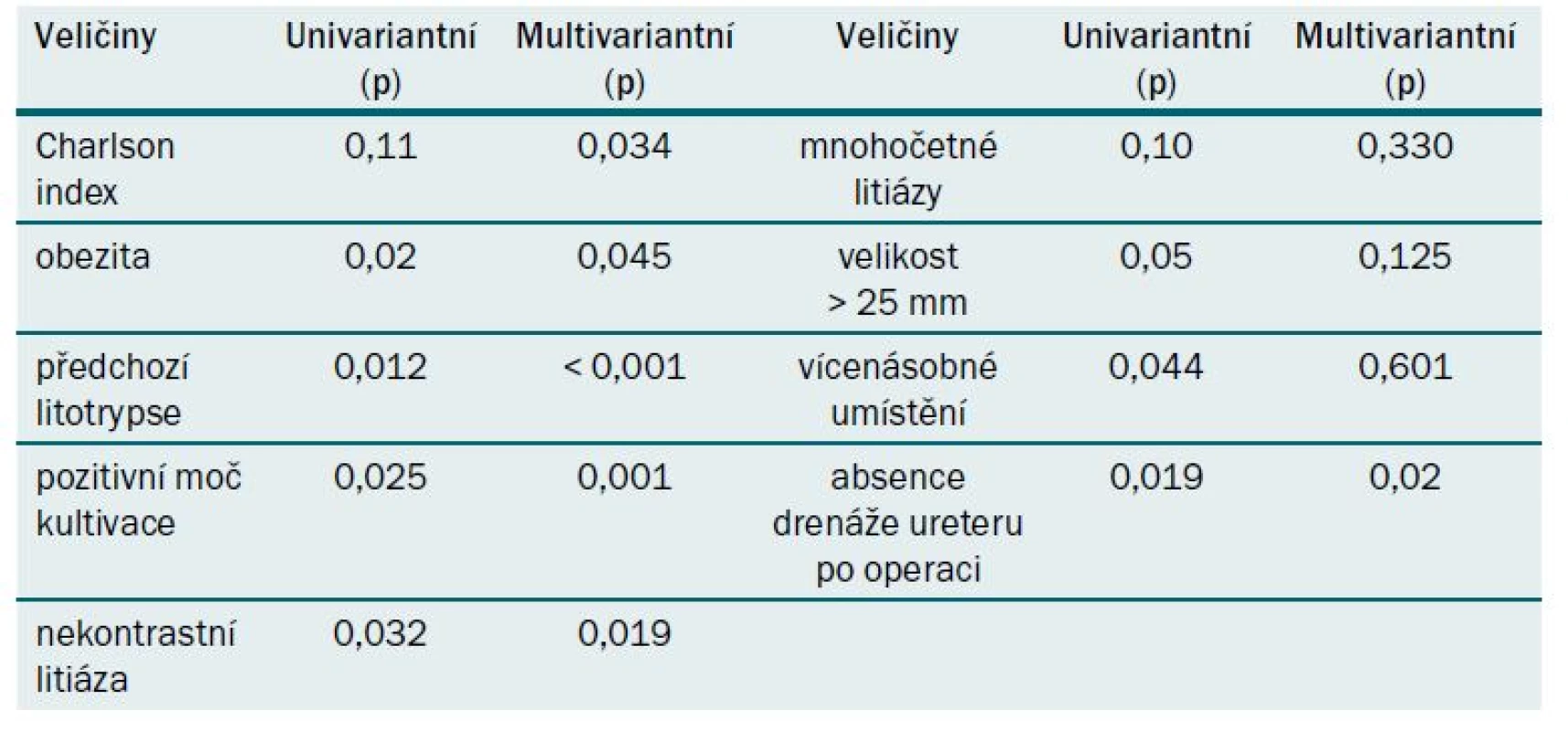
Dalším žhavým tématem debaty bylo, zda provést PNL v poloze pronační nebo supinační. Del Pozo Jiménez G. z Madridu argumentoval pro nevýhody provedení PNL v supinační poloze. Nejprve citoval absolutní indikace k PNL, což je pro nefrolitiázu větší než 2 cm, a následně popsal cíl své práce a prezentace a vytvořit prediktivní model pro rozvoj pooperačních komplikací po provedení PNL v supinační poloze. Del Pozo Jiménez et al z Madridu analyzovali 132 PNL v supinační poloze. Ženy s průměrným věkem 51,3 let a obezitou v 27,3 % tvořily 54,5 %. Ipsilaterální (homolaterální) strana – stejnostranný; znamená na stejnou stranou po předchozí litotripsi byla provedena PNL. Předchozí litotripsi mělo 30,3 % pacientů na ipsilaterální straně a 16,7 % pacientů měli přidruženou malformaci na ipsilaterální straně. PNL vlevo s kombinovaným přístupem v 15,9 % mělo 63,6 %. Většina z nich měla mnohočetné litiázy s průměrnou velikostí 25 mm a vícenásobné umístnění (41 %). Intraoperační komplikace popsali až v 13,6 % a pooperační komplikace až v 44,7 %. Komplikace klasifikovali podle Clavien-Dindo. Průměrná ztráta krve byla 2,13 g hemoglobinu, s průměrnou dobou hospitalizace po dobu pěti dnů. Většina komplikací byla klasifikována jako Clavien-Dindo gradus II. Používali univariantní a multivariantní analýzy k vytvoření tabulky k predikci komplikací po PNL v supinační poloze.
Prediktivní model umožňuje odhadnout s prediktivní kapacitou 81,1 % pravděpodobnost vzniku pooperačních komplikací po PNL v supinační poloze (obr. 1, tab. 5) [2].
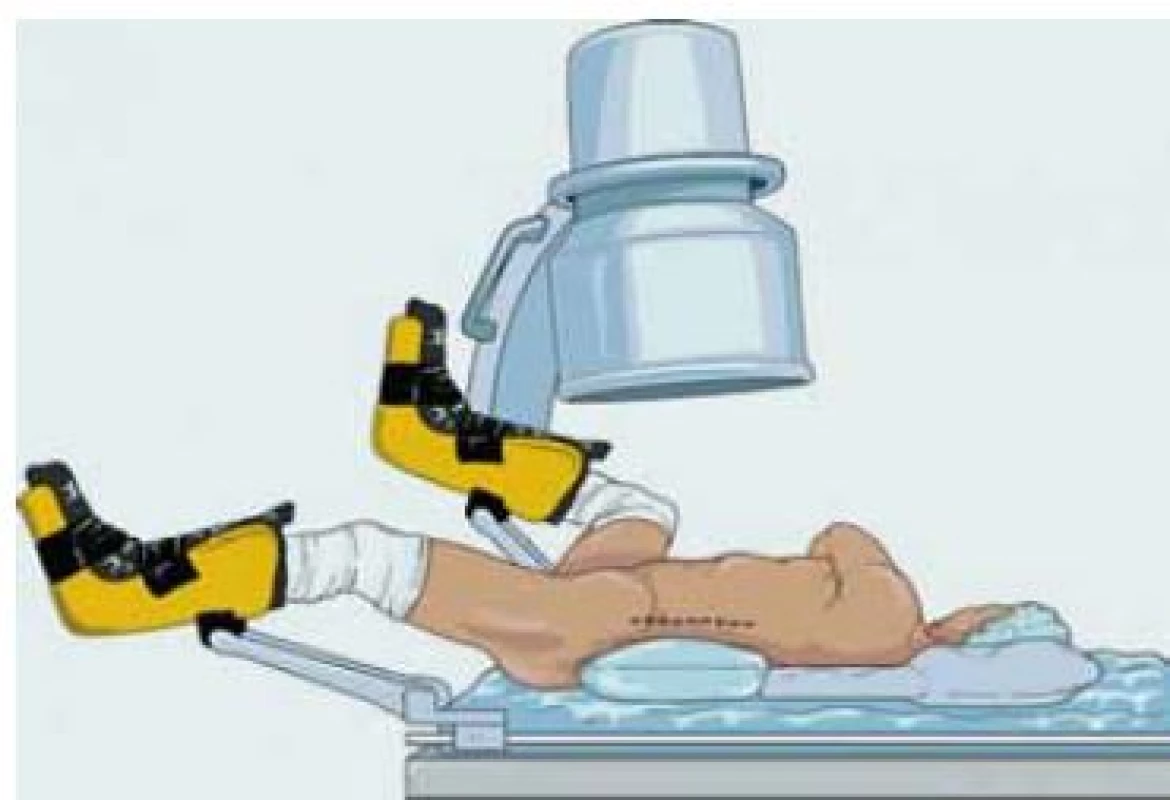
J. G. Pereira Arias (Urologická klinika, Galdakao-Usansolo, Bilkaia, Španělsko) obhajoval výhody provedení PNL v supinační poloze. Citoval některé studie porovnávající výhody PNL v supinační poloze. Mezi jeho citacemi byla práce Wu et al, kteří provedli metaanalýzu PNL v supinačních a pronačních polohách a zjistili, že čas celkového výkonu PNL v supinační poloze je kratší o 30 min a má srovnatelné výsledky kompletně odstraněné litiázy (takzvaná „stone-free rate“ (kompletní odstranění litiázy) nebo SFR 82,4 vs. 82,1 %) [3]. Další citace byla práce Karamiho et al, kteří provedli studie o srovnávání výsledků PNL v pronačních, supinačních a bočních pozicích a zjistili, že čas celkového výkonu pro PNL v supinační poloze je kratší o 14 min, ale SFR je nižší (86 vs. 92 %) [4]. Dále citoval zajímavou práci Sanguedolce et al, kteří hodnotili efektivitu a bezpečnost provedení PNL v pronační a supinační poloze pro litiázy v dolním kalichu ledviny a zjistili, že PNL v supinační poloze je lepší pro pacienty s vyšším skóre ASA (American Society of Anaesthesiologists) a pacienty s mnohočetnými litiázami v dolním kalichu [5]. Z hlediska nákladové efektivity citoval práce Justina et al, kteří konstatovali, že Galdakao-Valdivia modifikovaná supinační poloha (GVMSP) pro PNL je spojena s vyššími náklady (odhad 1 300 USD), protože vyžaduje účast dvou chirurgů (včetně poplatků za chirurga) a vedla k většímu používání zařízení s většími náklady na opravy nástrojů [6]. Výhodami GVMSP PNL jsou optimální kontrola kardiovaskulárního systému a dýchacích cest, jednorázové a definitivní polohování pacienta, lepší způsob vypláchnutí a extrakce fragmentů vzhledem k horizontálnímu úhlu nefroskopu, menší riziko poranění střeva, možnost provedení současné retrográdní intervence, nižší expozice ionizujícímu zářením, srovnatelné až trochu lepší „stone-free rate“ (ve srovnání s PNL v pronační poloze) a lepší varianta pro polymorbidní pacienty z anesteziologického hlediska. Nevýhodami jsou omezený prostor pro punkci ledvin, litiázy v horním kalichu (technický obtížný), složitá dilatace punkčního kanálu vzhledem k mobilitě ledviny (řeší se retrográdním zavedením vodiče), vyšší riziko poranění sleziny a jater a spinální interpozice (lze vyřešit otáčením C-ramene do 15–20°).
Na závěr zdůrazňovali, že míra komplikací při provedení PNL v supinační či pronační poloze je podobná.
Proietti et al prezentovali studie o přístupu do horního kalichu cestou dolního kalichu rigidním nefroskopem, srovnávali výsledky v pronačních a supinačních polohách a posuzovali anatomické faktory, které mohou ovlivnit jednotlivé přístupy, měřeno multidetektorového CT s 3D rekonstrukcí [7]. Zjistili, že přístupnost do horního kalichu cestou dolního kalichu v pronační poloze je 20 % (4/20 výkonů) a v supinační poloze 80 % (20/25). Analýza anatomických parametrů je uvedena v tab. 6.
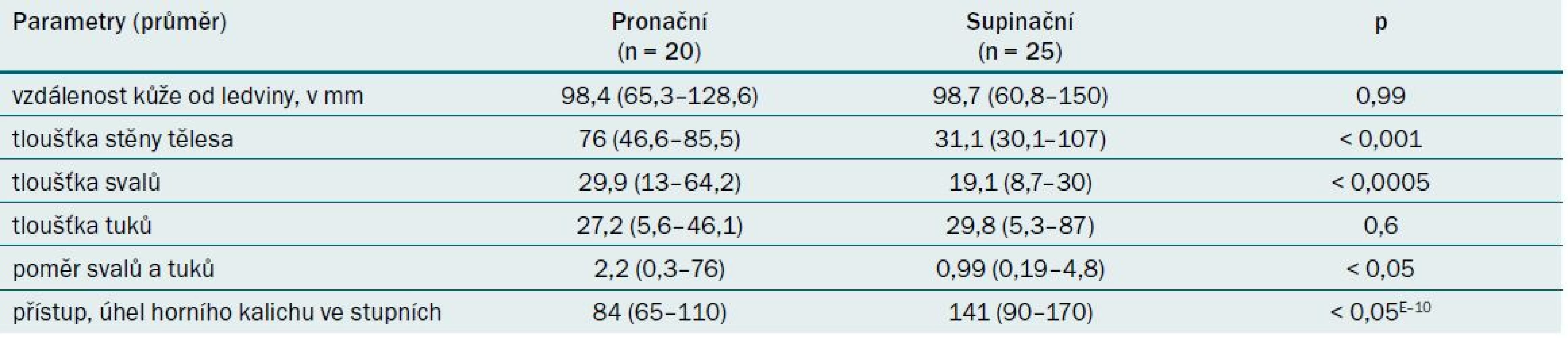
Závěr studie byl, že přístup do horního kalichu cestou dolního kalichu rigidním nefroskopem je významně lepší při PNL v supinační poloze oproti PNL v pronační poloze. Možné anatomické vysvětlení výsledků je ztenčení stěny těla a svalových vrstev, menší poměr svalstva a tělesného tuku v supinační poloze. Dále je úhel mezi osou horního kalichu a spodním kališním traktem signifikantně širší v supinační poloze oproti pronační poloze.
Perkutánní mikro/mini nefrolitotomie (mikro/mini PNL)
Ramón et al prezentovali relativně nový postup PNL, spíše se jedná o modifikovanou verzi standardní perkutánní nefrolitotomie na základě přímého přístupu do kalichu s minimálním průměrem propíchnutí (diametr) a použití mikroskopického optického materiálu, čímž lze dosáhnout nižší morbidity v důsledku menšího rizika krvácení a minimálního traumatu ledviny. Při prezentaci byla videoukázka této metody krok za krokem v supinační poloze. V celkové anestezii prováděli punkci kalichu s 16G (4,85Fr) jehlou pod fluoroskopickou a ultrazvukovou (UZ) kontrolou. Trojcestný konektor byl připojen na proximální konec pláště, což umožňuje zavedení flexibilní 0,9mm mikrooptiky do centrálního kanálu, připojení irigačního systému a 200 mikronů laserového vlákna (každý na jedné straně portu). Optika má 120° úhel pohledu a rozlišení 10 000 pixelů. Je-li litiáza větší než 1,5–2 cm, doporučuje se použití jehly 8 Fr. To umožňuje lepší vizualizaci, použití větších laserových vláken (550 µ), rychlejší fragmentace a možnost extrakce fragmentů pomocí nitinolového košíku. Mezi výhody tohoto minimálně invazivního přístupu patří možnost ukončení výkonu bez zavedení nefrostomického drénu, není nutná dilatace punkčního kanálu a minimální trauma ledvin. Na závěr výkonu je zaveden „double J stent“, který je pak extrahován ambulantně sedmý den po operaci. Závěrem této sekce bylo, že mikroPNL je minimálně invazivní metoda, která se stále vyvíjí, aby se stala účinnou a bezpečnou léčbou pro nefrolitiázy střední velikosti. Další klinické studie, včetně analýzy nákladů a přímého srovnání s jinými dostupnými metodami, jsou potřeba k zavedení mikroPNL do běžné terapie nefrolitiázy (obr. 2) [8].

Ultra mini PNL
Ultra mini PNL (UMP) byla popsána jako méně invazivní technika PNL pro terapii malých až středně velkých kamenů. UMP snižuje peri- a postoperační morbiditu. Datta et al prezentovali poster o prospektivních výsledcích UMP v rámci kohortové studie. Používali nefroskop 6 Fr s kovovým pláštěm o velikosti 13 Fr a 365 mikronů laserového vlákna pro fragmentaci litiázy. V plášti je inovativní vodní kanál, který evakuuje drobné fragmenty tím, že využívá Venturiho efekt. Autoři prezentovali výsledky UMP u 98 pacientů. Jedenáct UMP (10 %) pro litiázy o velikosti 5–10 mm, 43 UMP (41 %) pro litiázy o velikosti 10–15 mm, 38 UMP (36 %) pro litiázy o velikosti 15–20 mm a 14 UMP (13 %) pro litiázy > 20 mm. Přístup do ledviny z horního pólu (8), středního (36) a dolního (55). Průměrný čas operace byl 54 min (rozmezí od 28 do 120 min). Průměrná změna hemoglobinu byla –0,81 g/dl. Žádný pacient nedostal krevní transfuzi. Komplikací Clavien-Dindo bylo pět (I × 4, IIIb × 1), nejzávažnější byla perirenální urinózní kolekce. Orální analgezie byla dostačující u 89 pacientů (91 %). Průměrná doba hospitalizace byla 30 hod. Intraoperativní hodnocení kompletní evakuace litiázy byla u 98 %, ale CT vyšetření po měsíci prokázalo kompletní evakuaci litiázy (takzvaný „stone-free“) v 83 %. UMP pro litiázy 10–20 mm se zdá být účinná a bezpečná s menším rizikem komplikací a krátkodobou hospitalizací. Nutné jsou další multicentrické studie k validaci UMP v běžné praxi (obr. 3) [9].
Endoskopická kombinovaná intrarenální operace
PNL je standardní léčba pro objemné anebo komplexní ledvinové kameny a endoskopická kombinovaná intrarenální chirurgie v supinační poloze je vhodnou alternativou ke standardní PNL. Porpiglia et al prezentovali výsledky 10leté zkušenosti s endoskopickou kombinovanou intrarenální operací (ECIRS). Výkon se provádí ve Valdivia modifikované Galdakao pozici (GVMP). Když byla možná punkce ledviny, prováděli ji pod optickou kontrolou (technika endovision), dilatace punkčního kanálu byla provedena pomocí balonku nebo Alken dilatátorů a litotrypse pomocí balistického či UZ přístroje. Na konci výkonu se provádí retrográdní uretroskopie (URS) nebo antegrádní flexibilní nefroskopie ke kontrole urotraktu a extrakci reziduálních fragmentů. SFR definovali jako absenci významných reziduálních fragmentů (> 3 mm) na UZ nebo radiologickém vyšetření tři měsíce po léčbě. Pooperační komplikace byly klasifikovány podle systému Clavien-Dindo. Autoři prezentovali výsledky ECIRS u 282 pacientů. Průměrný věk byl 53,8 let, BMI a skóre ASA byly v tomto pořadí 26,9 a 2 (rozsah 1–4), sedm pacientů mělo solitární ledviny. Průměrná velikost litiázy byla 24,1 mm. Vícečetné litiázy mělo 150 (53,2 %) pacientů. Umístění litiázy bylo tříděno takto: 178 (63,1 %) v dolním kalichu, 87 (30,9 %) ve středním kalichu, 79 (28 %) v horním kalichu, 177 (62,8 %) v pánvičce. Odlitkové litiázy mělo 113 (40,1 %) pacientů, 23 (8,2 %) pacientů mělo simultánní ureterolitiázy. Průměrný operační čas byl 84,9 min a nebyly zjištěny žádné významné peroperační komplikace. Průměrná délka hospitalizace byla 5,4 (+ 2,8) dnů. SFR (kompletní odstranění litiázy) po první proceduře bylo 84 %. Opakována terapie byla v 8 % (ve 4 % případů byla reoperace ECIRS, zatímco SWL byla provedena pro další 4 % případů). Komplikace byly u pěti pacientů (1,8 %) podle Clavien-Dindo klasifikace (tři IIIa, jeden IIIb a jeden IV). Závěr a výsledky studie naznačují, že ECIRS je bezpečná a účinná metoda. Zdá se být užitečná v terapii pro vícečetné litiázy, objemné litiázy a při komplikovaných renálních či ureterálních konkrementech (obr. 4) [10].
Ureteroskopie pro litiázu
Ureteroskopie (URS) je indikována jako operační léčba první metody pro distální ureterolitiázu a pro proximální ureterolitiázu větší než 10 mm. Dále může URS sloužit jako metoda druhé volby pro terapii nefrolitiázy a proximální ureterolitiázy menší než 10 mm, 10–20 mm a zejména pro litiázu s velikostí do 20 mm v dolním kalichu ledviny (tzv. retrográdní intrarenální operace – RIRS). Budía et al z Valencie analyzovali nákladovou efektivitu SWL a intrarenální litotrypse Holium-YAG (yttrium-aluminium-granát) laserem při URS. Analýza nákladů zahrnula dobu hospitalizace, náklady výkonu na operačním sále, litotriptor, zdravotnické personály, materiály, reoperace a pooperační návštěvy. U pacientů s litiázou < 1 cm, byl URS významně lepší než SWL se SFR 98,3 %, zatímco SFR byla 81,7 % u pacientů po SWL pro litiázy < 1 cm. SFR byla 97,8 % u pacientů po URS a intrarenální litotrypsi laserem pro litiázy > 1 cm, zatímco SFR byla 80 % u pacientů po SWL pro litiázy > 1 cm. Celkové procento komplikací bylo významně vyšší ve skupině pacientů po SWL (18,9 %) ve srovnání se skupinou URS (1,96 %). Nicméně všechny komplikace ve skupině SWL byly klasifikovány jako Clavien--Dindo gradus I nebo II. Průměrné náklady pro SWL byly 973,09 EUR, zatímco pro URS s laserem bylo 1 537,49 EUR. Závěr je, že SWL má lepší nákladovou efektivitu než URS v terapii ureterolitiáz [11].
Roboticky asistovaná flexibilní ureteroskopie s laserovou litotrypsí (Avincenna Roboflex)
Jak bylo nedávno uvedeno v časopise European Urology, na trhu je nový robot pro flexibilní ureteroskopii, tzv. „Avicenna Roboflex“ vyrobený Elmedem v Turecku. Přístroj je prozatím k dispozici jen ve třech urologických oddělení (Ankara, Paříž, Heilbronn). Rassweiler et al demonstrovali bezpečnost a účinnost nového robotického zařízení pro flexibilní URS. Konstatují nyní, že léčba ledvinových kamenů Avicenna Roboflexem již není experimentální. Avicenna Roboflex se skládá z konzoly a manipulátoru. K rukojeti endoskopu jsou připojeny do robotického ramene. Chirurg sedí u konzole a používá dva pákové ovladače k manipulaci nástroje a kontroluje pohyby ureteroskopu (rotace, flexe, deflexe apod.). Chirurg kontroluje a sleduje vychylování stupňů endoskopu a může otáčet robotem o 440°. Tím se minimalizuje riziko torze flexibilního endoskopu. Jakmile je hrot endoskopu na kameni, obvykle se snižuje rychlost pohybu na 2 mm/s, což umožňuje přesnější pohyb. Ovladačem může chirurg na dálku vsunout nebo vytáhnout laserové vlákno, což umožňuje dobrou kontrolu vzdálenosti mezi kamenem a špičkou laserového vlákna. Je vybudován software, který zabraňuje vystřelení laserového paprsku, když je hrot laserového vlákna velmi blízko k endoskopu, aby nedošlo k poškození nástroje. Integrovaný vodní systém (přívod a odvod) může být také ovládán na dálku robotem. Tímto způsobem je možné vyoperovat kámen minimálním průtokem a provádět nízkotlakovou litotrypsi. Autoři zjistili, že robotická flexibilní URS poskytuje lepší ergonomii, zabraňuje ozáření chirurga a zabraňuje poškození nástroje. Zatím bylo léčeno robotickou flexibilní URS více než 150 ledvinových kamenů ve všech třech střediscích, včetně série větších kamenů (n = 42) s průměrným objemem kamenů 1,63 cm3. Další výhody Roboflexu se stále hledají (obr. 5) [12].

Extrakorporální litotrypse (SWL)
V souladu s guidelines EAU lze SWL volit jako metodu první volby terapie nefrolitiázy o velikosti do 20 mm a proximální ureterolitiázy o velikosti ≤ 10–20 mm. SWL má lepší SFR než URS pro proximální ureterolitiázy < 10 mm [13]. Kontraindikace SWL jsou gravidita, aktivní infekce močových cest, porucha krevní srážlivosti, aneuryzma renálních tepen, kostní malformace a morbidní obezita [14]. Míra úspěšnosti SWL závisí na výkonnosti litotryptoru, velikosti, počtu, lokalizaci a tvrdosti konkrementu, celkovém habitu pacienta a na zkušenosti operatéra [15]. Nepříznivé faktory ovlivňující úspěšnost SWL jsou: litiázy odolné na SWL (kalcium oxalát monohydrát, brushite, cystinové litiázy), ostrý infundibulo-pelvický úhel kalichu (> 45°), dlouhý dolní kalich (> 10 mm) a úzký krček kalichu (< 5 mm) [16,17]. Expulzivní terapie (MET) pomocí alfablokátorů může být navržena jako adjuvantní terapie po SWL vzhledem k jejich vypuzovací účinnosti, snížení bolesti a bezpečnostnímu profilu [18]. Úspěšnost SWL klesá v terapii litiázy v dolním kalichu a další metody jako URS a PNL při terapii litiázy > 15 mm v dolním kalichu by mohly dosáhnout lepší SFR [19]. Ahmed et al prezentovali výsledky randomizované a prospektivní studie diurézy a inverzní terapie ke zlepšení odstranění nebo odchod litiázy po SWL. Autoři prospektivně rozdělili 157 pacientů se symptomatickou solitární litiázou v dolním kalichu (velikost litiázy 5–20 mm) do dvou (randomizovaných) skupin. První skupina podstoupila SWL s maximální diurézou a při výkonu byl pacient polohován v Trendelenburgově poloze s úhlem operačního stolu do 30°. Druhá skupina podstoupila standardní SWL bez dalších manévrů. Po ukončení terapie byli pacienti sledováni pravidelně pomocí RTG a UZ ledvin. Autoři hodnotili výsledky SFR za 12 týdnů. Celkem 141 pacientů dokončilo léčebný protokol studie a sledování, 69 pacientů v první skupině a 72 pacientů v druhé skupině. Po 12 týdnech autoři zjistili signifikantně vyšší SFR u pacientů v první skupině (SFR 78,3 %), zatímco SFR v druhé skupině pacientů byla 61,1 % (p = 0,030). SFR byla signifikantně vyšší pro litiázy s větším objemem (> 10 mm) a litiázy s vyšší HU denzitou (> 500 Hounsfieldových jednotek) v první skupině než ve druhé. Mírné nevýznamné komplikace byly hlášeny u obou skupin. Autoři konstatují, že SWL s peroperační diurézou a inverzí se zdá být účinnou metodou s minimálními náklady ke zlepšení SFR po SWL [20]. Dále pokud jde o SWL na proximální ureterolitiázy, naskýtá se několik otázek, které ještě vyžadují jasné odpovědi, například bezpečný počet rázových vln (RV), výběr energie RV, počet sérií SWL, frekvence rázových vln pro nefrolitiázy a proximální ureterolitiázy. Hnilicka et al prezentovali výsledky prospektivní, randomizované studie o optimalizaci parametrů SWL (modifikovaný Dornier HM-3 litotriptor) pro ureterolitiázy. Autoři rozdělili 240 pacientů do dvou skupin. Jedna skupina (skupina A – 127 pacientů) podstoupila SWL s frekvencí RV 60 pulzů/min a druhá skupina (skupina B – 113 pacientů) podstoupila SWL s frekvencí RV 90 pulzů/min. Každý pacient měl solitární ureterolitiázu. SFR za tři měsíce po SWL byla signifikantně vyšší u pacientů, kteří podstoupili SWL s frekvencí RV 90 pulzů/min, oproti 60 pulzům/min (103/113 = 91,2 % vs. 101/127 = 79,5 %; p = 0,012). Délka výkonu SWL (průměr 36,4 min vs. 35,3 min; p = 0,938), sekundární léčby (12,6 % vs. 6,2 %; p = 0,60) a komplikace (10 % vs. 15 %; p = 0,236) se nelišily mezi skupinami. Další nezávislé prediktory úspěchu byly proximální lokalizace litiázy, nižší denzita litiázy, menší velikost litiázy a nepřítomnost JJ stentu. Na závěr konstatují, že nejen optimalizace parametrů a frekvence RV může přinášet vynikající SFR pro proximální ureterolitiázy [21]. Pokud jde o energii RV při SWL, prezentovali Skuginna et al výsledky prospektivní randomizované studie, kde postupně zvýšili energii RV během SWL a zjistili, že pacienti měli minimální poškození parenchymu ledvin ve srovnání s pacienty léčenými s fixovanou energií RV. Postupné zvyšování energie RV má ochraňující efekt na ledviny během SWL, aniž by snížila účinnost léčby [22].
Předdefinování „stone-free rate“ – SFR (stav bez konkrementu)
Prof. Sven Lahme, vedoucí Oddělení urologie, Centrum minimální invazivní terapie, robotické asistované operace, Siloah St. Trudpert Klinikum, Pforzeheim (Německo), prezentoval, že cílem aktivní terapie litiázy je, aby byl pacient bez litiázy. V závislosti na složení litiázy a morfologii močových cest ovlivňuje kompletní odstranění litiázy dlouhodobé výsledky a rychlost recidiv. Odstranění litiázy také závisí na metodě léčby. Endoskopické postupy umožňují kompletní odstranění močových kamenů, zatímco SWL zanechává reziduální konkrementy.
Pokud jde o definici SFR, neexistuje všeobecně přijímaná definice v literatuře. Přibližně třetina publikací zabývajících se výsledky po ošetření litiázy neposkytuje žádné informace o SFR. V metaanalýze 249 publikací bylo nalezeno sedm různých definic „stone-free“ [23].
Nutnost definice stavu bez konkrementu („stone-free“)
„Stone-free“ status pacienta závisí na mnoha faktorech: složení konkrementu, typ léčby a čas mezi aktivní terapií a hodnocením stavu bez konkrementu. Obecně uznávána definice „stone-free“ je nutná, aby se dosáhlo lepší srovnatelnosti studií. V tomto případě by měla být definována nejen velikost zbytkového fragmentu, ale také metoda stanovení „stone-free“.
Definice „stone-free“ v éře SWL
Mnoho definic „stone-free“ bylo publikováno po SWL, URS a PNL. Podle dostupných studií autoři používali různé zobrazovací metody k definování SFR po léčbě. Definice „stone-free“ byla určena na základně reziduálních fragmentů. Autoři klasifikovali pacienty jako „stone-free“, pokud měli reziduální fragmenty < 1 mm, < 2 mm, < 3 mm nebo < 4 mm. Metody k hodnocení „stone-free“ byly UZ, RTG anebo nativní CT vyšetření urotraktu. V rámci SWL byly nejčastější definice „stone-free“ reziduální fragmenty < 4 mm. Akceptované metody pro evaluaci SFR byly UZ, RTG a CT vyšetření.
Definice „stone-free“ v éře endourologie
Vzhledem k další miniaturizaci endoskopických přístrojů, např. ve formě mini PNL a rozvoj malých flexibilních ureteroskopů, prošlo ošetření kamene v posledních 15 letech zásadní změnou. Téměř každá část močových cest je endoskopicky přístupná s nízkou morbiditou. V současné době probíhá aktivní léčba litiázy stále častěji především endoskopicky. Pokyny EAU prošly v tomto směru změnami, což umožňuje primární endoskopickou léčbu v závislosti na velikosti konkrementu a lokalizaci. Nové technické možnosti umožňují kompletní odstranění konkrementů tak, aby nezůstaly žádné zbytkové konkrementy. Dříve přijaté zbytkové fragmenty o průměru < 4 mm dnes mohou být endoskopicky odstraněny pod optickou kontrolou. Vyvolává to otázku: do jaké míry se má definovat SFR v éře endourologie?
Nová definice pro odstranění konkrementu
Vzhledem k možnostem metod pro odstranění močových konkrementů a metod používaných k hodnocení „stone-free“ stavu se zdá být obtížné vytvořit definici SFR, která je univerzálně použitelná. Je vhodné vytvořit systém hodnocení SFR podobně jako u známých bodových systémů operačních komplikací. Tento systém umožňuje přesné zařazení výsledků léčby. Dále tento skórovací systém umožňuje snadné přizpůsobení různým způsobům léčby. Je zřejmé, že reziduální fragment < 2 mm po SWL je přijatelný výsledek SFR, ale to nemusí být přijatelné pro pacienty léčené flexibilní URS. Somani et al nedávno navrhli vhodný bodovací systém ke klasifikaci SFR (tab. 7).
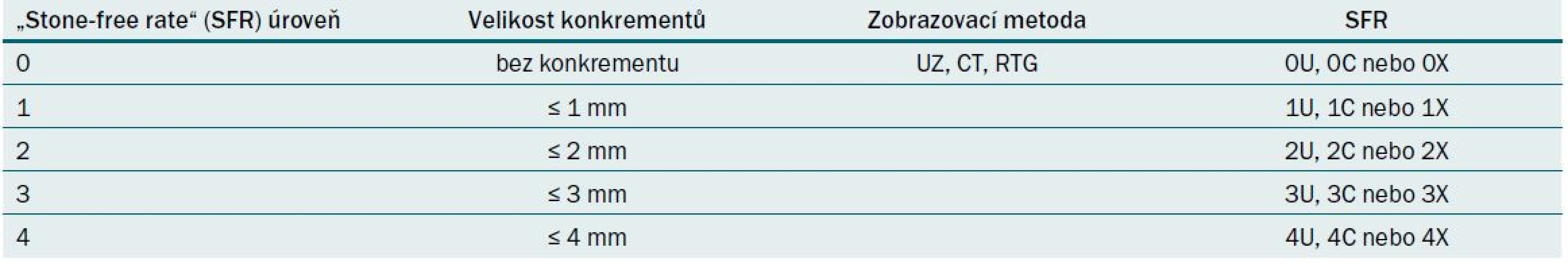
Úroveň „stone-free“ se vypočítá podle velikosti reziduálních fragmentů a další písmeno, které popisuje zobrazovací metoda pro vyhodnocení „stone-free“ statusu. Budoucnost ukáže, zda lze lepší srovnatelnosti studií dosáhnout pomocí této diferencované definice SFR [24].
Přizpůsobení k moderní definici
Moderní definice odstranění konkrementu by měla být přizpůsobena potřebám moderních endourologických metod. Ke stanovení SFR je doporučeno využít diferenciované definice „stone-free“, která je založena na velikosti reziduálních fragmentů, a zobrazovací metody. Nový skórovací systém, který popisuje „stone-free“ stav pacienta tím, že zařadí pacienty do určité úrovně, by mohl být krokem správným směrem.
Ureterální stent
Podle Guidelines EAU není doporučeno rutinní zavedení stentu před terapií SWL pro proximální ureterolitiázy a před URS [25]. Zavedení stentu před URS může usnadnit endoskopickou manipulaci s litiázou, zlepšuje SFR a snižuje riziko komplikací [26]. Zavedení stentu po URS je stále předmětem debaty, avšak podle aktualizovaných Guidelines EAU na rok 2015 není po nekomplikované URS doporučeno zavedení JJ stentu. Stent by se měl zavádět po komplikované URS nebo u pacientů, kteří mají vysoké riziko komplikací (trauma, větší reziduální fragmenty litiázy, krvácení, perforace, infekce, gravidita). Ureterální stenty mohou způsobit velké potíže pro pacienty. Alfablokátory zlepšují toleranci ureterálních stentů [27]. Na EAU kongrese prezentovali Bosio et al výsledky prospektivní studie o hodnocení tolerance stentů po URS pomocí ověřeného dotazníku (ureteral stent symptom questionnaire – USSQ). Autoři dávali pacientům po URS a zavedení stentu dotazníky. Dotazník se skládal ze šesti různých sekcí tykajících se močových symptomů, bolesti těla, celkového zdravotního stavu, pracovní výkonnosti, sexuálních záležitostí a všeobecné spokojenosti. Cílem studie bylo posoudit skutečný rozsah symptomů souvisejících se stentem v populaci a dopad symptomů na kvalitu života. Dotazník vyplnilo a vrátilo 203 pacientů. Denní frekvence močení každou hodinu nebo více byla přítomna u 56,6 % pacientů. Noční frekvence byla u 89,6 % pacientů. Urgenci mělo 87,7 % pacientů a 39,9 % mělo urgentní močovou inkontinenci. Strangurii mělo 81,2 % pacientů a 78,3 % mělo pocit neúplného vyprázdnění močového měchýře po mikci. Makroskopickou hematurii mělo 63,4 % pacientů a 24 % mělo hematurii s koaguly. Velmi nešťastně by se cítilo 79 % pacientů, kdyby měli strávit zbytek svého života se svými močovými symptomy. Stent byl příčinou bolesti a dyskomfortu u 80 % pacientů. Průměrné VAS skóre (vizuální škála bolesti) bylo 5,45 ± 2,36 (rozmezí 0–10). Bolest byla lokalizována v oblasti ledvin u 48,5 % pacientů, v oblasti močového měchýře u 33 % pacientů, v oblasti třísla u 11,9 % a ve více než jednom místě v 6,3 %. Na bolest v průběhu fyzické aktivity si stěžovalo 87,7 % pacientů a 99,4 % mělo bolesti při každodenních činnostech. Kvůli bolestem mělo 53,8 % pacientů přerušení spánku. Kvůli stentovým potížím vyžadovalo analgetika 56,6 % pacientů. Klid na lůžku na průměrnou dobu 5,7 dne potřebovalo 56,6 %, 61,1 % snižovalo každodenní aktivity po dobu 10 dnů a 45 % pacientů s aktivním sexuálním životem nemohlo mít po zavedení stentu pohlavní styk. Nešťastných by bylo 61,2 % pacientů, pokud by jim bylo navrženo zavedení stentu v budoucnu. Závěrem lze říci, že ureterální stenty ovlivňují kvalitu života pacientů a stenty by měly být zavedeny pouze v případě potřeby [28].
MUDr. Babajide Adedokun
Urologická klinika
LF MU a FN Brno
Jihlavská 20625 00 Brno
babajide.adedokun@fnbrno.cz
Zdroje
1. Laso-García IM, Duque-Ruiz G, Gómez-Del-Cañizo C et al. Therapeutic approach to moderate-sized pyelic lithiasis. Annual EAU Congres 2015, Madrid. Abstr. V65.
2. Del Pozo Jiménez G, Rodríguez Fernández E, Herranz Amo F et al. Predictive model of postoperative complications after supine percutaneous nephrolithotomy. Annual EAU Congres 2015, Madrid. Abstr. 697.
3. Wu P, Wang L, Wang K. Supine versus prone position in percutaneous nephrolithotomy for kidney calculi: a meta-analysis. Int Urol Nephrol 2011; 43: 67–77. doi: 10.1007/s11255-010-9801-0.
4. Karami H, Mohammedi R, Lotfi B. A study on comparative outcomes of percutaneous nephrolithotomy in prone, supine, and flank positions. World J Urol 2013; 31(5): 1225–1230. doi: 10.1007/s00345-012-0889-y.
5. Sanguedolce F, Breda A, Millan F et al. Lower pole stones: prone PCNL versus supine PCNL in the International Cooperation in Endourology (ICE) group experience. World J Urol 2013; 31(6): 1575–1580. doi: 10.1007/s00345-012-0941-y.
6. Friedlander JI, Duty BD, Smith AD et al. Percutaneous nephrostolithotomy: an assessment of costs for prone and Galdakao-modified supine Valdivia positioning. Urology 2012; 80(4): 771–775. doi: 10.1016/j.urology.2012.06.038.
7. Sofer M, Proietti S, Aviram G et al. Upper calyx approachability using rigid nephroscopes through a lower calyx access: comparison between prone and supine PCNL and assessment of anatomical factors that may influence this approach as measured by multidetector CT with 3D reconstructions. Annual EAU Congres 2015, Madrid. Abstr. 593.
8. Ramón De Fata F, Andrés G, Gimbernat H et al. Percutaneous micronephrolithotomy: surgical technique. Annual EAU Congres 2015, Madrid. Abstr. V69.
9. Datta S, Solanki R, Desai J. Prospective outcomes of ultra-mini percutaneous nephrolithotomy (UMP): a consecutive cohort study. Annual EAU Congres 2015, Madrid. Abstr. 582.
10. Porpiglia F, Cossu M, Poggio M et al. Endoscopic Combined Intra Renal Surgery (ECIRS): 10 years of experience. Annual EAU Congres 2015, Madrid. Abstr. 701.
11. Budía A, Caballer V, López-Acón JD et al. Comparison of extracorporeal shock wave lithotripsy versus ureteroscopy holmium laser lithotripsy in the management of ureteral stones: a cost-effectiveness analysis. Annual EAU Congres 2015, Madrid. Abstr. 91.
12. Rassweiler J, Saglam R, Traxer O et al. Robot assisted flexible ureteroscopic laser lithotripsy, with Avicenna Roboflex. Annual EAU Congres 2015, Madrid. Abstr. V67.
13. Zanetti G. Ureteral stones: SWL treatment. Arch Ital Urol Androl 2011; 83(1): 10–13.
14. Türk C, Knoll T, Petrik A et al. Guidelines on Urolithiasis. European Association of Urology 2010: 6–106.
15. Logarakis NF, Jewett MA, Luymes J et al. Variation in clinical outcome following shock wave lithotripsy. J Urol 2000; 163(3): 721–725.
16. Handa RK, Bailey MR, Paun M et al. Pretreatment with low-energy shock waves induces renal vasoconstriction during standard shock wave lithotripsy (SWL): a treatment protocol known to reduce SWL-induced renal injury. BJU Int 2009; 103(9): 1270–1274. doi: 10.1111/j.1464-410X.2008.08277.x.
17. Manikandan R, Gall Z, Gunendran T et al. Do anatomic factors pose a significant risk in the formation of lower pole stones? Urology 2007; 69(4): 620–624.
18. Grivas N, Skolarikos A, Venetis C et al. The role of blockers as medical expulsive therapy (MET) after extracorporeal shockwave lithotripsy (ESWL): a systematic review and meta-analysis. Annual EAU Congres 2015, Madrid. Abstr. 390.
19. Srisubat A, Potisat S, Lojanapiwat B et al. Extracorporeal shock wave lithotripsy (ESWL) versus percutaneous nephrolithotomy (PCNL) or retrograde intrarenal surgery (RIRS) for kidney stones. Cochrane Database Syst Rev 2014; 11: CD007044. doi: 10.1002/14651858.CD007044.pub3.
20. Abul-fotouh A, Essam S, Aref M et al. Diuresis and inversion therapy to improve clearance of lower caliceal stones after shock wave lithotripsy: a prospective, randomized, controlled, clinical study. Indian J Urol 2015; 31(2): 125–131. doi: 10.4103/0970-1591.152813.
21. Hnilicka S, Nguyen DP, Schmutz R et al. Optimising parameters of extracorporeal shock wave lithotripsy (ESWL) for ureteral stones results in excellent treatment outcomes. Results of a prospective, randomised trial. Annual EAU Congres 2015, Madrid. Abstr. 92.
22. Skuginna V, Nguyen DP, Seiler R et al. Does a step-wise voltage ramping protect the kidney from injury during extracorporeal shockwave lithotripsy (ESWL)? Results of a prospective randomized trial. Annual EAU Congres 2015, Madrid. Abstr. 90.
23. Deters LA, Jumper CM, Steinberg PL et al. Evaluating the definition of „stone-free status“ in contemporary urologic literature. Clin Nephrol 2011; 76(5): 354–357.
24. Somani BK, Desai M, Traxer O et al. Stone-free rate (SFR): a new proposal for defining levels of SFR. Urolithiasis 2014; 42(2): 95. doi: 10.1007/s00240-013-0630-3.
25. Ghoneim IA, El-Ghoneimy MN, El-Naggar AE et al. Extracorporeal shock wave lithotripsy in impacted upper ureteral stones: a prospective randomized comparison between stented and non-stented techniques. Urology 2010; 75(1): 45–50. doi: 10.1016/j.urology.2009.06.071.
26. Rubenstein RA, Zhao LC, Loeb S et al. Prestenting improves ureteroscopic stone-free rates. J Endourol 2007; 21(11): 1277–1280.
27. Lamb AD, Vowler SL, Johnston R et al. Meta-analysis showing the beneficial effect of blockers on ureteric stent discomfort. BJU Int 2011; 108(11): 1894–1902. doi: 10.1111/j.1464-410X.2011.10170.x.
28. Bosio A, Dalmasso E, Destefanis P et al. How bothersome ureteral stents are after ureteroscopy? A prospective study using a validated questionnaire (USSQ). Annual EAU Congres 2015, Madrid. Abstr. 1075.
Štítky
Dětská urologie UrologieČlánek vyšel v časopise
Urologické listy

2015 Číslo 2
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Význam monitorování hladiny anti-Xa u pacientů užívajících profylaktické dávky enoxaparinu − série kazuistik
- Doc. Jiří Kubeš: Zásadní přínos protonové terapie spočívá v ochraně zdravých tkání
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
- Referenční intervaly Indexu zdraví prostaty (PHI) u zdravých mužů
Nejčtenější v tomto čísle
- Urodynamika – průběh vyšetření a indikace
- Jak moderně přemýšlet o LUTS u mužů?
- Jak na perkutánní nefrolitotomii
- Poruchy ejakulace, sexuální apetence a orgazmu u mužů po spinálním traumatu v závislosti na rozsahu míšní léze
