-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
GUIDELINES EAU PRO DIAGNOSTIKU, KLASIFIKACI A LÉČBU TESTIKULÁRNÍHO KARCINOMU
Autoři: P. Albers; W. Albrecht; F. Algaba; C. Bokemeyer; G. Cohn-Cedermark; A. Horwich; O. Klepp; M. P. Laguna; G. Pizzocaro
Vyšlo v časopise: Urol List 2006; 4(3): 61-86
Kategorie: Guidelines
OBSAH
- ÚVOD 62
- 1.1 Metody 63
- DIAGNÓZA, PATOLOGIE A KLASIFIKACE 63
- 2.1 Ultrazvukové vyšetření skrota 63
- 2.2 Sérové tumorové markery 63
- 2.3 Ingvinální explorace a orchidektomie 63
- 2.3.1 Orgány-šetřící operace 63
- 2.4 Histopatologické vyšetření varlat 63
- 2.5 Určení stadia a klinická klasifikace 64
- DIAGNÓZA A LÉČBA TESTIKULÁRNÍ INTRAEPITELIÁLNÍ NEOPLAZIE (TIN) 65
- VLIV NA FERTILITU A INFERTILITU - SOUVISEJÍCÍ PROBLÉMY 65
- LÉČBA: TUMORY ZE ZÁRODEČNÝCH BUNĚK STADIA I 66
- 5.1 Seminom I. stadia 66
- 5.1.1 Adjuvantní radioterapie 66
- 5.1.2 Pozorování (surveillance) 66
- 5.1.3 Adjuvantní chemoterapie 66
- 5.1.4 Retroperitoneální lymfadenektomie (RPLND) 66
- 5.1.5 Léčba přizpůsobená riziku 66
- 5.1.6 Guidelines pro léčbu seminomu I. stadia 66
- 5.2 NSGCT I. stadia 66
- 5.2.1 Prognostické faktory 66
- 5.2.2 Léčba přizpůsobená riziku 67
- 5.2.2.1 Pozorování 67
- 5.2.2.2 Adjuvantní chemoterapie 67
- 5.2.3 Retroperitoneální lymfadenektomie 67
- 5.3 CS1S s (trvale) zvýšenými sérovými tumorovými markery 67
- 5.3.1 Guidelines pro léčbu neseminomatózního tumoru ze zárodečných buněk (NSGCT) I stadia 67
- LÉČBA: METASTAZUJÍCÍ TUMORY ZE ZÁRODEČNÝCH BUNĚK 67
- 6.1 Seminom II. stadia A/B 67
- 6.2 NSGCT II. stadia A/B 68
- 6.3 Pokročilé metastazující onemocnění 68
- 6.3.1 Primární chemoterapie 68
- 6.4 Opakované určení stadia a další léčba 68
- 6.4.1 Opakované určení stadia 8
- 6.4.2 Resekce reziduálního tumoru 68
- 6.4.3 Aplikace chemoterapie po sekundární operaci 69
- 6.5 Systémová záchranná léčba při recidivě nebo refrakterním onemocnění 69
- 6.5.1 Seminom 69
- 6.5.2 Neseminom 69
- 6.6 Záchranná operace 69 6.7 Léčba metastáz do mozku 69 6.8 Guidelines pro léčbu metastazujících tumorů ze zárodečných buněk 69
- SLEDOVÁNÍ PO KURATIVNÍ TERAPII 70
- 7.1 Obecná rozhodnutí 70
- 7.2 Sledování neseminomu I. stadia 70
- 7.2.1 Sledování po pozorování 70
- 7.2.2 Sledování po nervy šetřící RPLND 71
- 7.2.3 Sledování po adjuvantní chemoterapii 71
- 7.3 Sledování seminomu I. stadia 71 7.3.1 Sledování po radioterapii 71 7.3.2 Sledování po pozorování 71
- 7.3.3 Sledování po adjuvantní chemoterapii 72
- 7.4 Sledování tumoru II. stadia a pokročilého (metastazujícího) onemocnění 72
- 7.4.1 Klinické a patologické NSGCT II stadia 72
- 7.4.1.1 Recidiva po primární RPLND 72
- 7.4.1.2 Recidiva po primární chemoterapii 73
- 7.4.2 Klinické stadium II. seminomu 73
- 7.4.3 Klinické stadium IIc a III. seminomu a neseminomu 73
- 7.4.1 Klinické a patologické NSGCT II stadia 72
- TUMOR ZE STROMATU VARLETE 74
- 8.1 Úvod 74
- 8.2 Metody 74
- 8.3 Klasifikace 74
- 8.4 Tumory z Leydigových buněk 47
- 8.4.1 Epidemiologie 74
- 8.4.2 Patologie tumorů z Leydigových buněk 75
- 8.4.3 Diagnóza 75
- 8.4.4 Léčba 75
- 8.4.5 Sledování 75
- 8.5 Tumor ze Sertoliho buněk 75
- 8.5.1 Epidemiologie 75
- 8.5.2 Patologie tumorů ze Sertoliho buněk 75
- 8.5.2.1 Klasifikace 75
- 8.5.3 Diagnóza 75
- 8.5.4 Léčba 76
- 8.5.5 Sledování 76
- 8.6 Tumor z granulomatózních buněk 76
- 8.7 Skupina tumorů z thekálních buněk/fibromu 76
- 8.8 Jiné tumory ze semenného provazce/gonadálního stromatu 76
- 8.9 Tumory obsahující zárodečné buňky a tumory ze semenného provazce/gonadálního stromatu (gonadoblastom) 76
- 8.10 Různé tumory varlete 76
- 8.10.1 Tumory typu ovariálního epitelu 76
- 8.10.2 Tumory vývodných kanálků a rete testis 76
- 8.10.3 Tumory (benigní a maligní) nespecifického stromatu 77
- LITERATURA 77
- 9.1 Tumory ze zárodečných buněk 77
- 9.2 Tumory z nezárodečných buněk 84
- ZKRATKY UŽITÉ V TEXTU 86
1. ÚVOD
Testikulární karcinom představuje 1 % až 1,5 % neoplazmat u mužů a 5 % všech urologických tumorů s výskytem 3–6 nových případů na 100 000 mužů za rok v populaci zemí Západu a až 10 nových případů na 100 000 mužů za rok v Dánsku a Norsku. V průmyslově vyspělých zemích byla během posledních 30 let pozorována zvýšená incidence testikulárního karcinomu [1-3].
Až 5 % případů je bilaterálních. U 95 % pacientů odhalí histologie tumor ze zárodečných buněk, jenž je charakterizován specifickým genetickým markerem (supernumerické kopie krátkého ramena chromozomu 12, izochromozomu i (12p) [1,4]. U většiny tumorů ze zárodečných buněk byla jako prekurzor lézí prokázána intratubulární neoplazie zárodečných buněk (testikulární intraepiteliální neoplazie, TIN) [5-7].
Epidemiologickými rizikovými faktory pro vznik testikulárního tumoru jsou: anamnéza kryptorchizmu nebo nesestouplého varlete, hypotrofické (< 12 ml) nebo atrofické varle, Klinefelterův syndrom, rodinná anamnéza testikulárního tumoru u příbuzných první linie (bratři, otec), přítomnost kontralaterálního tumoru nebo TIN a infertilita [8-12].
V současné době má testikulární karcinom vynikající procento úspěšného vyléčení, 95% u karcinomů nižšího stadia a o něco méně u pokročilejších stadií onemocnění. Hlavními přispívajícími faktory jsou: pečlivé určení stadia v době diagnózy, vhodná časná léčba vycházející z mezioborového řešení zahrnujícího chemoterapii, radioterapii a operaci a velmi pečlivé sledování a záchranné terapie. Při léčbě testikulárního karcinomu má výběr léčebného centra obrovský význam. Přestože mohou být časná stadia úspěšně léčena v centrech nespecializujících se na komplikované případy odeslané z jiných pracoviš, je procento recidivy vyšší, což ukazuje, že vyšší procento přežití je způsobeno chemo - a radiosenzitivitou časnějších stadií, spíše než kompliancí dosaženou v těchto centrech [13]. Bylo prokázáno, že u neseminomatózních tumorů ze zárodečných buněk se špatnou prognózou celkové přežití v klinické studii záviselo na počtu pacientů léčených v zúčastněném centru (horší přežití: < 5 zařazených pacientů) [14].
1.1 Metody
Tyto guidelines představují implementaci dříve publikovaných textů, poslední vydání guidelines European Association of Urology (EAU) bylo formálně publikováno v roce 2001 [15] a poslední update byl rozeslán členům EAU v březnu roku 2005. Do sestavení tohoto textu, jenž vychází z nestrukturované studie literatury s pomocí databáze MEDLINE v roce 2005, byl zapojen tým lékařů různých oborů - urologů, onkologů, radioterapeutů a patologů. V největší míře sem byly zahrnuty údaje z metaanalytických studií, Cochrane evidence a doporučení European Germ Cell Cancer Collaborative Group i ostatních dostupných guidelines [16-23]. Pokud to bylo možné, byly odkazy uvedeny dle pravidel medicíny založené na důkazech (EBM). Povaha doporučení v těchto guidelines je označena dle stupně důkazu. Tento text se soustředí na změny v diagnóze a léčbě ve srovnání s dříve publikovanou verzí [15].
2. DIAGNÓZA, PATOLOGIE A KLASIFIKACE
Testikulární karcinom je obvykle diagnostikován pomocí fyzikálního vyšetření a obvykle se projevuje jako bezbolestný, unilaterální intraskrotální útvar. U všech pacientů s intraskrotální rezistencí je třeba stanovit přesnou diagnózu. Proto jsou kromě fyzikálního vyšetření nezbytná i následující vyšetření.
2.1 Ultrazvukové vyšetření skrota
Pro správné zobrazení varlete je nezbytné užití sondy 7,5 MHz. Senzitivita ultrazvukového vyšetření skrota je téměř 100% a ultrazvuk hraje významnou roli při zjištění, zda je útvar intra - nebo extratestikulární [24]. U mladých mužů s retroperitoneálním útvarem, viscerální metastázou nebo zvýšenou hodnotou lidského chorionického gonadotropinu (hCG) a/nebo alfa-fetoproteinu (AFP) je provedení ultrazvukového vyšetření varlat povinné. Zobrazovací vyšetření skrota zobrazením magnetickou rezonancí (magnetic resonance imaging - MRI) poskytuje 100% senzitivitu a 95–100 % [25] specifitu, ale její užití pro diagnostiku nelze pro vysoké náklady obhájit.
2.2 Sérové tumorové markery
Sérové tumorové markery jsou prognostickými faktory a napomáhají stanovení diagnózy a určení stadia choroby [26]. Průměrný poločas AFP v séru je 5–7 dní a u hCG přibližně 2–3 dny. Proto by měly být před orchidektomií, a poté v týdenních intervalech až do normalizace určeny následující markery:
- AFP (produkovaný buňkami žloutkového vaku)
- hCG (exprese trofoblastů)
- laktátová dehydrogenóza (LDH; marker poškození tkáně)
Celkem dochází ke zvýšení hodnot těchto markerů u 51 % případů testikulárního karcinomu [26]. Hladina AFP se zvyšuje u 50–70 % pacientů s neseminomatózním tumorem ze zárodečných buněk (NSGCT) a k zvýšení hCG dochází u 40–60 % pacientů s NSGCT. Asi u 90 % pacientů s NSGCT dochází ke zvýšení hladiny AFP a/nebo hCG-markerů. Až u 30 % seminomů může dojít ke zvýšení hladiny hCG v průběhu onemocnění [27]. Laktátová dehydrogenáza je méně specifický marker a její koncentrace je úměrná objemu tumoru. Její hladina může být zvýšena až u 80 % pacientů s pokročilým karcinomem varlete. Je třeba poznamenat, že negativní hladina markerů nevylučuje diagnózu tumoru ze zárodečných buněk. Další studované markery zahrnují neuro-specifickou enolázu (neuro-specific enolase - NSE) a placentální alkalickou fosfatázu (placental alkaline phosphatase - PLAP). NSE a/nebo PLAP mohou mít při monitorování pacientů s čistým seminomem jen omezený význam. Měření hladiny AFP, hCG a LDH v séru je povinné, zatímco měření NSE a PLAP pouze volitelné.
2.3 Ingvinální explorace a orchidektomie
Každý pacient s podezřením na přítomnost testikulární rezistence musí podstoupit ingvinální exploraci s obnažením varlete v jeho obalech. V případě zjištění tumoru je nutné okamžité provedení orchidektomie s přerušením semenného provazce v úrovni interního ingvinálního prstence. Pokud není diagnóza zcela jasná, je před orchidektomií odebrána intraoperační testikulární biopsie nebo je tumor úplně resekován pro histologické vyšetření „nazmrzlo“, abychom předešli zbytečné orchidektomii u benigních tumorů. V případě diseminovaného onemocnění nebo život ohrožujících metastáz je možné bezodkladně začít chemoterapií a orchidektomii oddálit až do stabilizace klinického stavu.
2.3.1 Orgány-šetřící operace
Přestože orgány-šetřící operace není obecně indikována, může být prováděna v následujících specifických situacích se všemi nezbytnými opatřeními [28,29]:
- při podezření na benigní lézi
- u synchronních, bilaterálních testikulárních tumorů
- u metachronních, kontralaterálních tumorů s normální předoperační hladinou testosteronu
- u tumoru solitárního varlete, s normální předoperační hladinou testosteronu.
Objem tumoru by měl být v těchto případech méně než 30 % objemu varlete. Zbývající TIN může být u všech pacientů bezpečně léčena pomocí adjuvantní radioterapie s dávkou 20 Gy [29]. Několik studií se pokusilo snížit dávku ozáření na 16 Gy. Avšak u studie prováděné v Dánsku užívající 14 Gy [30] a u německé studie užívající 16 Gy [31] došlo k recidivám. Po radioterapii dojde k infertilitě. Tuto možnost je třeba s pacientem důkladně probrat a operaci provádět v centru s dostatečnou zkušeností [29].
2.4 Histopatologické vyšetření varlete
Povinné požadavky na histopatologické vyšetření [32] zahrnují:
- makroskopické znaky: objem, velikost varlete, maximální velikost tumoru a makroskopické znaky nadvarlete, chámovodu a tunica vaginalis
- odebrání vzorků: 1 cm2 sekce na každý centimetr maximálního průměru tumoru, zahrnující makroskopicky normální parenchym (pokud je přítomen), albugineu a epididymis podezřelých oblastí. Alespoň jednu proximální a jednu distální sekci chámovodu a k tomu jakoukoliv podezřelou oblast
- mikroskopické znaky a diagnóza: histologický typ dle WHO 2004 (specifikace individuálních komponentů a odhad procentuálního množství)
- přítomnost nebo absence peritumorální venózní a/nebo lymfatické invaze
- přítomnost nebo absence invaze do tunica albuginea, tunica vaginalis, rete testis, epididymis nebo semenného provazce.
- přítomnost nebo absence TIN u parenchymu bez tumoru
- pT kategorie dle TNM 2002 (tab. 1)
- imunohistochemické vyšetření: u seminomu a smíšeného tumoru ze zárodečných buněk, APF a hCG.
Tab. 1. TNM (tumour, nodes, metastasis/tumor, uzlina, metastáza) klasifikace testikulárního karcinomu (UICC, 2002, 6th ed) [40]. ![TNM (tumour, nodes, metastasis/tumor, uzlina, metastáza) klasifikace testikulárního karcinomu (UICC, 2002, 6th ed) [40].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3507b900509f27c15f9345cf554515a9.png)
2.5 Určení stadia a klinická klasifikace
Určení stadia představuje úhelný kámen, na němž je založena léčba testikulárního karcinomu. Pro určení přítomnosti metastazujícího nebo okultního onemocnění je třeba zhodnotit poločas sérových tumorových markerů (viz sekce 2.2 a 5.3), provést screening lymfatických drah a vyloučit přítomnost viscerálních metastáz.
Posléze je navíc ke zjištění kinetiky poločasu tumorových markerů nezbytné vyšetřit:
- stav abdominálních a supraklavikulárních lymfatických uzlin a jater
- přítomnost nebo absenci postižení mediastinálních lymfatických uzlin a metastázy do plic
- stav mozku a skeletu, v případě přítomnosti podezřelých symptomů.
Abdominální, pulmonální, extrapulmonální a mediastinální lymfatické uzliny jsou nejlépe vyšetřeny pomocí počítačové tomografie (CT). Supraklavikulární lymfatické uzliny jsou nejlépe vyšetřeny pomocí fyzikálního vyšetření a v případě podezření CT-scanem. CT-vyšetření poskytuje 70–80 % senzitivitu při určování stavu retroperitoneálních lymfatických uzlin. Jeho přesnost závisí na velikosti lymfatických uzlin, senzitivita a negativní prediktivní hodnota se zvyšují při použití 3 mm prahu pro definování metastazujících lymfatických uzlin v regionální oblasti [33]. MRI má při detekci zvětšení retroperitoneálních lymfatických uzlin podobné výsledky jako CT [34]. Hlavní překážkou jeho rutinnímu užívání je vysoká cena a omezený přístup. MRI je vyšetření vhodné pro speciální indikace, v současné době nejsou indikace pro systematické užívání MRI při určování stadia testikulárního karcinomu. CT-vyšetření hrudníku je povinné u všech pacientů s NSGCT a u pacientů se seminomem, kteří mají pozitivní CT břicha [35].
Není k dispozici dostatek důkazů podporujících použití fluorodeoxyglukózové-pozitronové emisní tomografie (FDG-PET) v raném stadiu testikulárního tumoru. Lze ji však doporučit při sledování reziduální masy po chemoterapii seminomu k rozhodnutí výběru mezi pozorným vyčkáváním (WW) nebo aktivní léčbou [36-39].
Další vyšetření, jako CT mozku nebo míchy, kostní scan nebo ultrazvukové vyšetření jater by měla být prováděna v případě podezření na metastázy v těchto orgánech. CT-scan nebo MRI lebky se doporučuje u pacientů s NSGCT a rozšířenými metastázami plic.
Podle hodnoty tumorových markerů a výsledků CT-scanu by měli být pacienti klasifikováni dle 2002 TNM-klasifikace UICC (International Union Against Cancer), tab. 1 [40]. Pacienty s metastazujícím onemocněním (TNM-stadium ≥ 2) je třeba dále klasifikovat dle systému určování stadia International Germ Cell Cancer Collaborative Group (IGCCCG), jenž je definován jako klasifikační systém pro metastazující testikulární tumor založený na prognostických faktorech (tab. 2). Tento klasifikační systém byl začleněn do TNM-klasifikace a užívá histologii, lokalizaci primárního tumoru, lokalizaci metastáz a hodnoty sérových markerů jako prognostické faktory pro kategorizaci pacientů na „dobrou“, „středně dobrou“ nebo „špatnou“ prognózu [41].
Tab. 2. Systém určující stadium metastazujícího karcinomu ze zárodečných buněk (IGCCCG) založený na prognostických faktorech [41]. ![Systém určující stadium metastazujícího karcinomu ze zárodečných buněk (IGCCCG) založený na prognostických faktorech [41].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/30e9870b40685904e2cdeaed9284166b.png)
3. DIAGNÓZA A LÉČBA TIN
Pro vyloučení přítomnosti TIN se doporučuje provedení kontralaterální biopsie [42]. Přestože je to v některých zemích rutinní procedurou, zůstává ovšem z důvodu nízké incidence TIN a kontralaterálních asynchronických testikulárních tumorů (až 5 % a přibližně 2,5 %), morbiditě léčby TIN a faktu, že většina těchto asynchronických tumorů je při prezentaci v nízkém stadiu kontroverzní, doporučit provedení systémové kontralaterální biopsie [43,44]. Je obtížné dosáhnout shody ohledně toho, zda je nutné identifikovat ve všech případech existenci kontralaterální TIN. Avšak biopsie kontralaterálního varlete by měla být nabídnuta všem pacientům a doporučuje se pro vyloučení kontralaterální TIN u pacientů s vysokým rizikem s testikulárním objemem méně než 12 ml, anamnézou kryptorchizmu a ve věku pod 30 let [44].
Jakmile je TIN diagnostikováno, je lokální radioterapie (20 Gy v jednotlivých dávkách po 2 Gy) léčbou první volby. Vzhledem k tomu, že radioterapie způsobuje infertilitu, je třeba pacienta před léčbou důkladně informovat [45,46]. Kromě infertility může být dlouhou dobu po radioterapii TIN narušena funkce Leydigových buněk a tvorby testosteronu [30].
4. VLIV NA FERTILITU A INFERTILITU - SOUVISEJÍCÍ PROBLÉMY
U pacientů s testikulárními tumory se nezřídka vyskytují abnormality spermií. Navíc chemoterapie může také narušit fertilitu. Pacientům v reprodukčním věku by mělo být nabídnuto před léčbou a před orchidektomií hodnocení fertility: testosteronu, luteinizačního hormonu (LH) a folikuly stimulujícího hormonu (FSH)) a analýza spermatu spolu s kryoprezervací. Kryoprezervace by měla být provedena před nebo po orchidektomii, ale v každém případě před chemoterapií [47-51].
U případů bilaterální orchidektomie nebo nízké hladiny testosteronu se po léčbě TIN doporučuje celoživotní suplementace testosteronu [51]. Pro podrobnější informace odkazujeme čtenáře na EAU Male Infertility Guidelines.
5. LÉČBA: TUMORY ZE ZÁRODEČNÝCH BUNĚK STADIA I
5.1 Seminom I stadia
Při moderních procedurách stanovení stadia má asi 15–20 % pacientů se seminomem I stadia subklinické metastazující onemocnění, obvykle v retroperitoneu a dojde k jeho recidivě po pouhé orchidektomii [52].
5.1.1 Adjuvantní radioterapie
Buňky seminomu jsou extrémně radiosenzitivní. Adjuvantní radioterapie paraaortálního (PA) pole s celkovým cílovým objemem 20 Gy sníží procento recidivy pouze na 1–3 % [53,54].
Při moderní radioterapii dojde téměř ke všem možnostem recidivy mimo ozařované pole (v supradiafragmatických lymfatických uzlinách nebo v plicích) [55,56]. V závislosti na výsledcích velké randomizované studie Medical Research Council (MRC) Fossa et al [53] doporučil radioterapii PA-pole jako standardní léčbu pacientů s testikulárním seminomem I stadia, T1-T3 a s neporušenou lymfatickou drenáží. Míra recidivy ilických lymfatických uzlin byla 2 % při samotné iradiaci PA-pole. Po ozařování PA došlo ke snížení akutní toxicity a počet spermií byl během prvních 18 měsíců signifikantně vyšší. Paraaortická iradiace by měla být stanovena dle lokalizace primárního tumoru. Adjuvantní iradiace supradiafragmatických lymfatických uzlin se u seminomu I stadia neindikuje.
Pokud se jedná o dávky radiace, dokončil MRC v nedávné době velkou randomizovanou studii 20 Gy versus 30 Gy PA-radiace u seminomu I stadia, která prokázala, že co se týče procenta recidivy, jsou obě dávky ekvivalentní [54]. Míra závažné dlouhodobé radioaktivitou vyvolané toxicity je méně než 2%. Mírné chronické gastrointestinální (GI) vedlejší účinky byly pozorovány u přibližně 5 % pacientů a mírná akutní GI-toxicita u asi 60 %. Hlavní otázkou týkající se adjuvantní radioterapie je potencionálně zvýšené riziko radiací vyvolaných sekundárních malignit z nezárodečných buněk [57-59].V této chvíli je obtížné zhodnotit dlouhodobé riziko po adjuvantní radioterapii u seminomu I stadia, nebo dřívější poskytovatelé léčby do ní zahrnovali větší pole, vyšší dávky radioterapie a/nebo užití alkylační chemoterapie [59,60].
5.1.2 Pozorování
V posledním desetiletí bylo provedeno několik prospektivních nerandomizovaných studií pozorování, z nichž několik zahrnovalo více než 100 pacientů [61-63]. Metaanalýza 4 největších studií ukázala 82,3 % míru 5letého přežívání bez recidivy. Při multivarietní analýze byly nejdůležitějšími predikátory recidivy velikost tumoru (> 4 cm) a invaze rete testis [64].
Míra recidivy je po 5 letech 15–20 %. Nejvíce relapsů je detekováno v infradiafragmatických lymfatických uzlinách [64]. Asi u 70 % pacientů, u nichž dojde při pozorování k recidivě, je možná léčba samotnou radioterapií. Pouze u 20 % z těchto pacientů dojde po záchranné radioterapii k relapsu a vyžadují záchrannou chemoterapii. Celková míra „cancer-specific survival“ udávaná centry se zkušeností s tímto postupem je po pozorování u seminomu I stadia 97 %–100 % [61,62, 64]. Hlavní nevýhodou pozorování je potřeba intenzivnějšího sledování, zejména opakovaného provádění zobrazovacích vyšetření retroperitoneálních lymfatických uzlin minimálně 5 let po orchidektomii. K asi 70 % relapsů pozorovaných během sledování dojde do 2 let po orchidektomii, avšak k 7 % dojde více než 6 let po stanovení diagnózy [64].
5.1.3 Adjuvantní chemoterapie
V nedávné době byla dokončena studie Medical Research Council (MRC) a European Organization for Research and Treatment of Cancer (EORTC; studie MRC TE19, EORTC Trial 30942) srovnávající jeden cyklus terapie s karboplatinou (AUC 7) s adjuvantní radioterapií. Mezi terapií používající pouze karboplatinu a radioterapií nebyl z pohledu procenta recidivy, doby do vzniku recidivy a přežití po průměrném sledování po dobu 3 let prokázán žádný signifikantní rozdíl [65]. Adjuvantní terapie s karboplatinou je tedy u seminomu I stadia alternativou k radioterapii nebo pozorování. Zdá se, že dvě aplikace karboplatiny v adjuvantní terapii snižují procento relapsu dále na 1–3 %, ale jsou zapotřebí další zkušenosti a dlouhodobé pozorování [66-68].
5.1.4 Retroperitoneální lymfadenektomie (RPLND)
V prospektivní, nerandomizované studii srovnávající radioterapii a RPLND u seminomu I stadia byl trend směřující k vyšší incidenci retroperitoneálního relapsu (9,5 %) po RPLND jako primární léčbě. Tento postup by proto neměl být doporučován u seminomu I. stadia [69].
5.1.5 Léčba přizpůsobená riziku
Dle velikosti tumoru > 4 cm a invaze rete testis mohou být pacienti se seminomem I. stadia rozděleni na skupinu s nízkým rizikem a skupinu s vysokým rizikem okultního metastazující onemocnění. Tyto rizikové faktory však byly hodnoceny pouze v metaanalýze nebo retrospektivních studiích [64]. Pacienti s a bez obou rizikových faktorů mají 32 % a 12 % riziko vzniku okultního onemocnění.
5.1.6 Guidelines pro léčbu seminomu I. stadia
- Adjuvantní radioterapie paraortálního pole s maximální dávkou 20 Gy (stupeň doporučení A).
- Pozorování (v případě dostupného zařízení); stupeň doporučení B.
- Chemoterapie užívající karboplatinu (jedna aplikace AUC 7) může být doporučena jako alternativa k radioterapii a pozorování (stupeň doporučení A).
5.2 NSGCT I stadia
Pokud vyloučíme případy IS-stadia, má až 30 % NSGCT pacientů s onemocněním v klinickém stadiu I (CS1) subklinické metastázy a dojde u nich k relapsu, pokud je po orchidektomii prováděno pouze pozorování. Avšak pacienty lze rozdělit dle rizikových faktorů do různých prognostických skupin s různým procentem recidivy.
5.2.1 Prognostické faktory
Hlavním predikátorem recidivy u CS1 NSGCT řešeného pomocí pozorování a onemocnění patologického stadia II (PS2) a recidivy u patologického stadia I (PSI) po RPLNDS je histopatologický důkaz vaskulární invaze buněk tumoru v nebo blízko primárního tumoru ve varleti [70-76]. Přítomnost vaskulární invaze se zdá být významným parametrem a je klinicky použitelná, dokonce i bez centralizované studie panelu expertů.
Bylo zjištěno, že vaskulární invaze je nejlepším prediktivním faktorem stadia při multifaktoriální analýze. Absence vaskulární invaze má 77% negativní prediktivní hodnotu a umožňuje tedy provádět pozorování u pacientů s nízkým rizikem [70]. Kombinace absence vaskulární invaze spolu s nízkým skóre MIB-1 (procento proliferace < 70) zlepšuje negativní prediktivní hodnotu na 87 %. Avšak přítomnost vaskulární invaze má 53 % pozitivní prediktivní hodnotu u okultního metastazujícího onemocnění. Kombinace přítomnosti vaskulární invaze a proliferace > 70 % MIB-1 pozitivních buněk tumoru a > 50 % embryonálního karcinomu v tumoru zvyšuje riziko vzniku okultního metastazujícího onemocnění u pacienta na 64 % (vysoké riziko) [70].
5.2.2 Léčba přizpůsobená riziku
Léčba přizpůsobená riziku se u NSGCT I doporučuje jako léčba první volby. Hodnocení rizika je v současné době založeno pouze na rizikovém faktoru vaskulární invaze. Vzhledem k tomu, že některé studie zaznamenaly podobné procento přežití a procento konečného vyléčení blížící se 100 % u všech možných metod léčby je možnou volbou stratifikace pacientů s CS 1 NSGCT podle odhadovaného rizika recidivy [77-80]. Pacientům s vaskulární invazí se doporučuje podstoupit adjuvantní chemoterapii se 2 cykly užívajícími cisplatinu, etopozid a bleomycin (PEB) a pacientům bez vaskulární invaze se doporučuje podstoupit pouze pozorování. Zbývající možnosti léčby by měly být zváženy pouze v případě, že pacienti nebo lékaři nejsou ochotni akceptovat relevantní léčbu přizpůsobenou riziku, nebo pokud existují podmínky, které jsou v rozporu s léčbou přizpůsobenou riziku. Rozhodnutí o léčbě by tedy mělo být založeno na důkladném rozhovoru s pacientem, uvážením popisovaných výhod a nevýhod stejně jako individuálního stavu pacienta a/nebo léčebného centra.
5.2.2.1 Pozorování
K 80 % relapsů dojde během prvních 12 měsíců sledování, 12 % během 2. roku a 6 % během 3. roku, klesá na 1 % během 4. a 5. roku a zřídka dokonce později [76, 81-86]. Asi 35 % pacientů s recidivou má při relapsu normální hladinu sérových tumorových markerů. Asi k 60 % relapsů dochází v retroperitoneu. Navzdory velmi pečlivému sledování je u 11 % pacientů s recidivou přítomno recidivující onemocnění o velkém objemu.
5.2.2.2 Adjuvantní chemoterapie
Bylo zaznamenáno několik studií zahrnujících 2 aplikace chemoterapie s PEB jako primární léčbou u pacientů s vysokým rizikem (s 50% rizikem relapsu) [77-80, 87]. V těchto sériích, zahrnujících více než 200 pacientů, některé s průměrným sledováním téměř 8 let bylo zaznamenáno procento recidivy 2,7 %, s velmi nízkou dlouhodobou toxicitou. 2 cykly adjuvantní chemoterapie užívající cisplatinu zřejmě neovlivňují negativně fertilitu nebo sexuální aktivitu [80,88]. Je důležité uvědomit si riziko pomalu rostoucího retroperitoneálního teratomu, vznikajícího po chemoterapii a riziko chemorezistentního relapsu karcinomu.
5.2.3 Retroperitoneální lymfadenektomie
Pokud byla RPLND provedena bez hodnocení rizika, asi u 30 % pacientů se vyskytly metastázy retroperitoneálních lymfatických uzlin (PS2 onemocnění) [89-91]. Pokud při RPLND nejsou zjištěny žádné retroperitoneální metastázy (PS1), přibližně u 10 % pacientů s PS1 dojde k relapsu na vzdáleném místě.
Pokud jsou CS1-pacienti s PS2 sledováni pouze po RPLND, asi u 30 % dojde k recidivě, zejména na místech mimo břišní dutinu a pánev. Riziko recidivy závisí na objemu resekovaného retroperitoneálního onemocnění [92-95]. Pokud jsou u PS2 případů po RPLND aplikovány 2 (nebo více) cykly adjuvantní chemoterapie užívající cisplatinu, sníží se procento recidivy na méně než 2 %, včetně recidivy teratomu [96]. Riziko vzniku retroperitoneálního onemocnění po správně provedené nervy šetřící RPLND je velmi nízké (méně než 2 %), stejně jako riziko vzniku poruchy ejakulace nebo dalších vedlejších účinků [90,97]. Sledování po RPLND je mnohem snazší a méně nákladné než sledování prováděné během pozorování po orchidektomii vzhledem k snížení potřeby provádění CT-vyšetření. Ve zkušených rukou se může stát laparoskopická RPLND alternativní procedurou určující stadium k otevřené RPLND, ale v současné době ji nelze doporučit jako standardní diagnostickou metodu [98-101].
5.3 CS1S s (trvale) zvýšenými sérovými tumorovými markery
Sérové tumorové markery by měly být pečlivě sledovány, dokud není jasné, zda hladina klesá dle očekávaných hodnot poločasu AFP a beta-hCG, nebo nikoliv. Pokud se hladina markerů po orchidektomii zvýší, má pacient reziduální onemocnění. V případě, že je provedena RPLND, má až 87 % těchto pacientů histopatologicky dokumentováno postižení lymfatické uzliny v retroperitoneu [102,103]. Je třeba provést ultrazvukové vyšetření kontralaterálního varlete, v případě že nebylo provedeno na počátku.
Otázka léčby skutečných CS1S pacientů není stále vyřešena. V současné době se zdají být vhodné 3 cykly primární PEB--chemoterapie, nebo u všech pacientů se vyvine metastazující onemocnění, pokud u nich bude prováděno pouze sledování [104].
5.3.1 Guidelines pro léčbu NSGCT I stadia
CS1A (pT1, žádná vaskulární invaze); nízké riziko
- Pokud je pacient ochoten a schopen dodržovat dlouhodobě (alespoň 5 let) program sledování, mělo by být doporučeno pečlivé sledování (stupeň doporučení B).
- Adjuvantní chemoterapie nebo nervy šetřící RPLND u rizikových pacientů zůstává možností pro ty, kteří nechtějí podstoupit pozorování. V případě, že RPLND odhalí PN+ (zasažení lymfatických uzlin) onemocnění, měla by být zvážena chemoterapie s 2 cykly PEB (stupeň doporučení A).
CS1B (pT2-pT4); vysoké riziko
- Měla by být doporučena primární chemoterapie s dvěma cykly PEB (stupeň doporučení B).
- Pozorování nebo nervy šetřící RPLDN u pacientů s vysokým rizikem zůstává pro ty, jež nejsou ochotni podstoupit adjuvantní chemoterapii. Pokud je při RPLND odhaleno patologické stadium II, mělo by být zváženo další provedení chemoterapie (stupeň doporučení A).
6. LÉČBA: METASTAZUJÍCÍ TUMORY ZE ZÁRODEČNÍCH BUNĚK
6.1. Seminom stadia II A/B
Standardní léčbou seminomu stadia II A/B je radioterapie. Dávka radiace aplikovaná u stadia IIA je 30 Gy a u stadia IIB je 36 Gy. Ve srovnání se stadiem I je standardní radiační pole rozšířeno z PA oblasti na ipsilaterální ilické pole („hokejka“). U stadia IIB by měly laterální hranice zahrnovat metastazující lymfatické uzliny s bezpečnostním okrajem 1,0 až 1,5 cm. Přežití bez recidivy je u této techniky po 6 letech 95 % u stadia IIA a 89 % u stadia IIB. Celkové přežití je téměř 100 % [105, 106]. Ve stadiu IIB chemoterapie se 3 cykly PEB nebo 4 cykly EP („dobrá prognóza“) je alternativou pro pacienty, kteří nejsou ochotni podstoupit radioterapii [107].
6.2 NSGCP stadia II A/B
Existuje obecný konsenzus, že by u všech pokročilých případů NSGCP, kromě NSGCP stadia II bez zvýšených tumorových markerů, která může být alternativě léčena pomocí primární RPLND nebo pozorováním, měla léčba začínat počáteční chemoterapií [16]. Tyto vzácné případy stadia II A/B bez zvýšení markerů mohou představovat metastazující diferencovaný teratom.
Neseminom stadia II A/B se zvýšenou hladinou markerů by měl být léčen dle IGCCCG „dobrá nebo středně dobrá prognóza“ (NSGCT dle hodnot markerů (3 nebo 4 cykly PEB u pacientů s dobrou a středně dobrou prognózou, následované reziduální resekcí tumoru). Asi u 30 % pacientů nedosáhne po chemoterapii úplné remise a vyžadují resekci reziduálního tumoru.
Pacienti, kteří si nepřejí podstoupit primární chemoterapii, mají v případě metastazujícího onemocnění (pII A/B) možnost primární nervy-šetřící RPLND s adjuvantní chemoterapií (2 cykly PEB). Primární chemoterapie a primární RPLND a primární RPLND jsou vzhledem k výslednému stavu srovnatelnými metodami, ovšem vedlejší účinky a toxicita jsou odlišné, což umožňuje pacientovi podílet se na výběru možnosti léčby.
Procento vyléčení se u obou přístupů blíží 98 % [96,108,109].
6.3 Pokročilé metastazující onemocnění
6.3.1 Primární chemoterapie
Primární léčba volby se u pokročilého onemocnění sestává z 3 nebo 4 cyklů kombinované PEB-chemoterapie (tab. 3) v závislosti na klasifikaci rizika IGCCCG (viz tab. 2). Bylo prokázáno, že tento režim je u pacientů s pokročilým onemocněním úspěšnější než aplikace cisplatiny, vinblastinu a bleomycinu (PVB) [110-112]. Údaje potvrzují, že 3denní aplikace kombinované chemoterapie je stejně účinná jako pětidenní aplikace, ale je spojený se zvýšenou toxicitou [113].
Tab. 3. Aplikace PEB (každé 3 týdny). 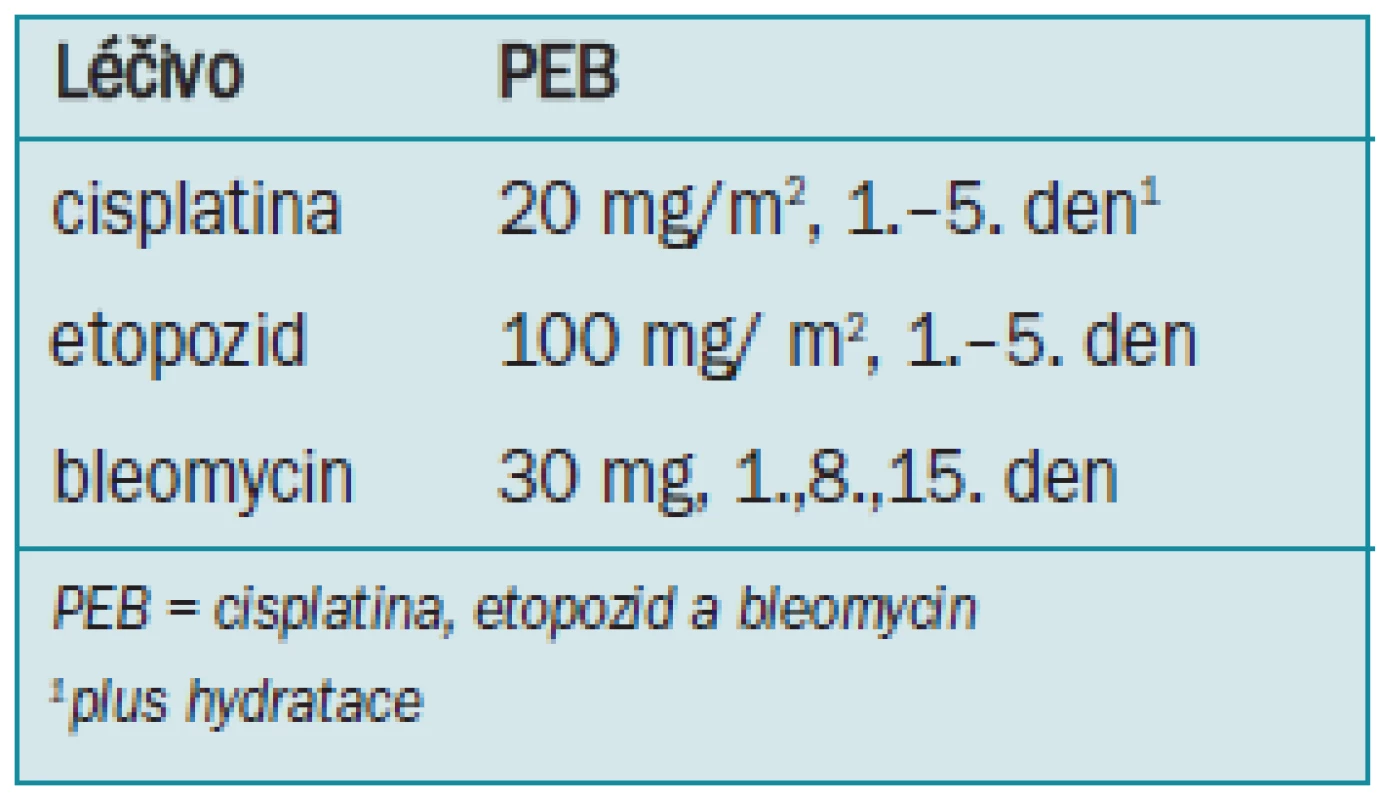
U pacientů s „dobrou prognózou“ se dle IGCCCG standardní léčba skládá z 3 cyklů PEB nebo v případě, kdy je bleomycin kontraindikován, 4 cyklů PE [112-114]. Terapie by měla být aplikována bez snížení dávkování ve 22 denních intervalech, oddálení následujícího cyklu chemoterapie je oprávněno pouze v případě horečky, hladiny neutrofilních leukocytů < 1 000/µl nebo krevních destiček < 100 000/µl první den následujícího cyklu. Profylaktická aplikace hematopoetického růstového faktoru jako například granulocytové kolonie stimulující faktor (G-CSF) není indikována. Avšak pokud během chemoterapie došlo k infekčním komplikacím, doporučuje se pro následující cykly profylaktické aplikace G-CSF [115,116].
Ve skupině se „středně dobrou prognózou“ u IGCCCG byla definována skupina pacientů, která dosahuje 80 % míry přežití po dobu 5 let. Dostupné údaje potvrzují jako standardní léčbu 4 cykly PEB [117]. Vzhledem k obecně méně příznivé prognóze u této skupiny pacientů, ve srovnání s pacienty s „dobru prognózou“, mohou být tito pacienti léčeni v prospektivních studiích, jako například EORTC GU Group studie srovnávající kombinační léčebný režim PEB s PEB plus paklitaxel [118].
U pacientů se „špatnou prognózou“ se standardní léčba skládá ze 4 cyklů PEB. Aplikace 4 cyklů PEI (cisplatina, etopozid, ifosfamid) má stejný účinek, je ovšem toxičtější [119]. Přežití po dobu 5 let bez progrese se pohybuje mezi 45 % a 50 %. Ještě nebylo prokázáno, že chemoterapie o vysokém dávkování zvyšuje procento přežití [120-122]. Vzhledem k tomu, že párová analýza ukázala vyšší procento přežití [121], měli by být tito pacienti léčeni v probíhajících prospektivních randomizovaných studiích zkoumajících hodnotu chemoterapie o vysokém dávkování, např. EORTC studie 30974. Pacienti, jejichž kritéria odpovídají „špatné prognóze“, by měli být proto přesunuti do referenčního centra pro tyto případy. Obecná doporučení pro modifikaci léčby u pacientů s celkově špatným celkovým stavem (Karnofského index < 50 %), rozsáhlou infiltrací jater (> 50 %) a rozsáhlou pulmonární infiltrací neexistují.
6.4 Opakované určení stadia a další léčba
6.4.1 Opakované určení stadia
Po ukončení 2 cyklů chemoterapie je provedeno opakované zhodnocení pomocí zobrazovacích vyšetření a určení hodnoty tumor markerů. Při poklesu hodnoty markerů a stabilní nebo regresivní manifestaci tumoru je chemoterapie dokončena (3 nebo 4 cykly v závislosti na počátečním stadiu) [123,124]. V případě poklesu hodnot markerů, ale rozšiřujících se metastáz je po ukončení indukční terapie možná resekce tumoru, pokud nedojde k akutnímu stavu růstu lokálního tumoru [125].
Časná zkřížená terapie je indikována pouze pokud je zaznamenán růst hodnot markerů po 2 cyklech chemoterapie. Tito pacienti jsou obvykle kandidáty pro studie nových medikamentů [126]. Pacienti s nízkou hodnotou markerů po léčbě jsou pozorováni, zda u nich dojde k úplné normalizaci, nebo nikoliv. Záchranná chemoterapie je indikována pouze při zvýšení hodnoty markerů [127,128].
6.4.2 Resekce reziduálního tumoru
Reziduální masa seminomu není resekována bez ohledu na velikost, ale je kontrolována pomocí zobrazovacích vyšetření a hodnot tumorových markerů [16,129-134]. Pozitronová emisní tomografie (PET) u metastazujícího seminomu je po chemoterapii validní pomůckou pro detekci reziduálního tumoru [135,136]. V případě, že po aplikaci chemoterapie jako léčby první volby, tumor přetrvává, je aplikována záchranná chemoterapie, zahrnující v případě nutnosti operaci a radioterapii.
V případě neseminomu a úplné remise po chemoterapii není resekce reziduálního tumoru indikována [16]. U případů, u nichž je přítomna reziduální masa (větší než 1 cm v průměru na příčném řezu CT) a normalizaci markerů je indikována chirurgické resekce. Celkově obsahuje po indukční PEB-chemoterapii pouze 10 % reziduální masy tkáně buňky živého karcinomu, 50 % obsahuje zralý teratom a 40 % nekrotickou fibrotickou tkáň. V současné době není žádné zobrazovací vyšetření, zahrnující PET nebo prognostické modely, schopno předpovědět histologickou diferenciaci neseminomatózního reziduálního tumoru. Proto je resekce reziduálního tumoru nezbytná [150-158].
Rozsah operace by měl vycházet z rizika vzniku recidivy každého pacienta a kvality jeho života. Pokud je to možné, je třeba resekovat celou masu, vzhledem k tomu, že kompletní resekce je v případě maligních buněk důležitější, než aplikace pooperační chemoterapie [159]. Histologie se může na různých místech orgánů lišit.
6.4.3 Aplikace chemoterapie po sekundární operaci
Po resekci nekrotického nebo zralého teratomu není nutná žádná další léčba. V případě kompletní resekce karcinomu nebo nezralého teratomu je možné u některých podskupin aplikovat 2 adjuvantní cykly chemoterapie užívající cisplatinu s běžným dávkováním (např. pacienti se „špatnou prognózou“ [160]; CAVE: kumulativní dávkování bleomycinu). Pokud je v preparovaných vzorcích přítomen po chemoterapii 2. a 3. volby karcinom, prognóza se zhorší. V tomto případě není pooperační chemoterapie indikována a není možné zlepšit díky ní prognózu [159]. V retrospektivní studii [159] bylo prokázáno, že u pacientů s vitálním karcinomem v reziduálních vzorcích je hlavním faktorem pro úspěch úplná operační resekce a procento karcinomu v reziduálním mase s pouze hraničním efektem adjuvantní chemoterapie.
6.5 Systémová záchranná léčba při recidivě nebo refrakterním onemocnění
6.5.1 Seminom
Kombinovaná záchranná chemoterapie užívající cisplatinu vede k dlouhodobé remisi asi u 50 % pacientů, u nichž dojde k recidivě po chemoterapii jako terapii první volby [161]. K dispozici jsou 2 možnosti: 4 cykly PEI/VIP (cisplatina, etopozid, ifosfamid) nebo 4 cykly VIP (vinblastin, ifosamid, cisplatina). V současné době není možné určit, zda je kombinovaná chemoterapie užívající cisplatinu s obvyklým dávkováním jako záchranná léčba dostatečná, nebo zda by se měla provést časná intenzifikace první záchranné léčby s chemoterapií o vysokém dávkování. Léčba takovýchto pacientů nepočetně zastoupených jak v klinických studiích, tak v centrech s bohatými zkušenostmi má proto obrovský význam.
6.5.2 Neseminom
Standardní záchranná léčba po chemoterapii první volby (tab. 4) se sestává ze 4 cyklů PEI/VIP. Záchrannou chemoterapií s obvyklým dávkováním lze dosáhnout dlouhodobé remise u 15–40 % pacientů, v závislosti na individuálních rizikových faktorech.
Tab. 4. Standardní PEI/VIP- a VeIP-chemoterapie. 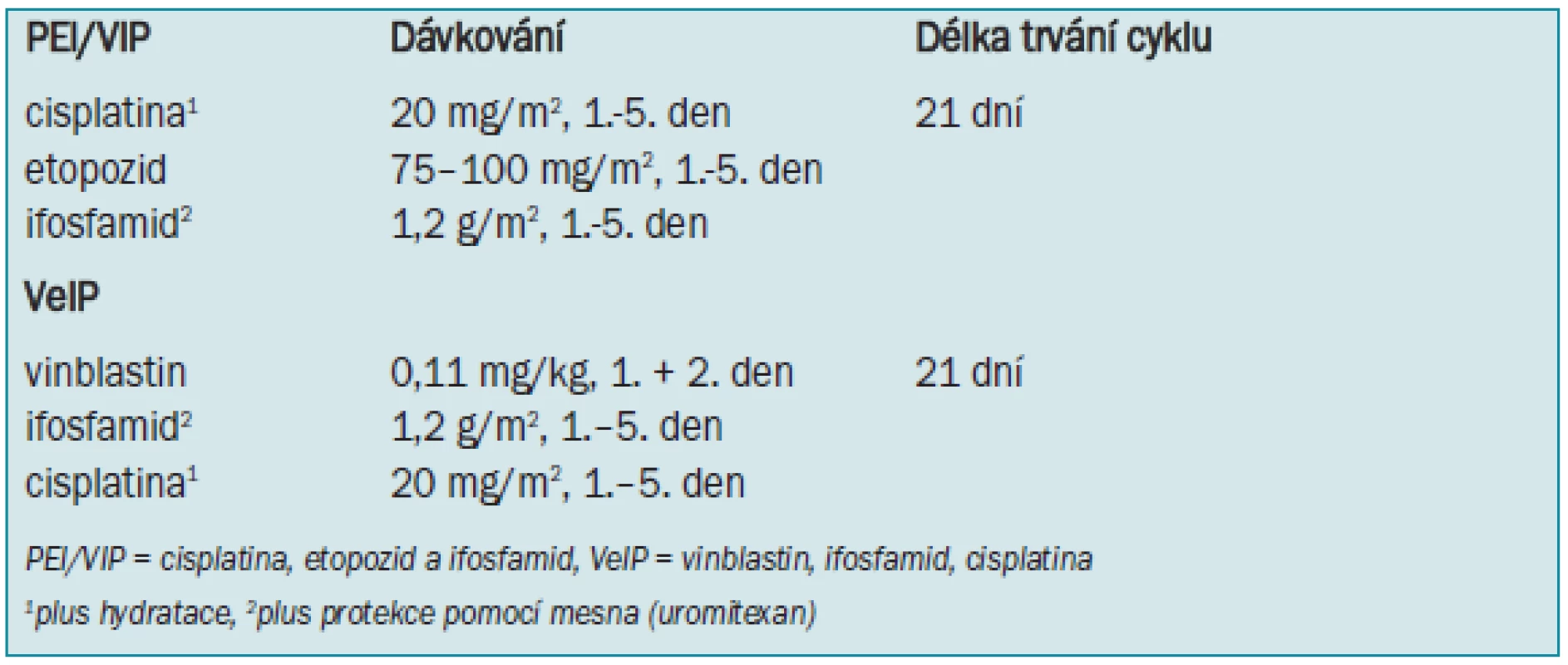
Indikátory prognózy odpovědi u záchranné terapie jsou:
- lokalizace a histologie primárního tumoru
- reakce na léčbu první volby
- trvání remise
- hodnota AFP a beta-hCG při recidivě
Záchranná terapie s aplikací VeIP není zřejmě účinnější než ostatní kombinace založené na aplikaci cisplatiny s běžným dávkováním. Použití režimu kombinace s konvenčním dávkováním, ale s použitím více nežli 3 agens zvyšuje toxicitu bez zlepšení výsledku léčby.
V závislosti na výskytu nepříznivých prognostických faktorů jsou výsledky záchranné terapie po léčbě první volby s aplikací cisplatiny neuspokojivé [162, 163]. Přestože některé studie II fáze vykazovaly 10 % zlepšení přežití s časnou intenzifikací první záchranné léčby užívající chemoterapii o vysoké dávce, jiné studie takové zlepšení neprokázaly [164-166]. V rámci záchranné terapie byly testovány nové látky, jako paklitaxel, docetaxel, gemcitabin, irinocetan a oxaliplatina. V současné době vykazují paklitaxel a gemcitabin účinek při léčbě refrakterních tumorů ze zárodečných buněk, oba léky jsou synergické s cisplatinou [167, 168]. Oxaliplatina je účinná dokonce u pacientů nereagujících na cisplatinu. V současné době se u pacientů v dobrém stavu a adekvátní funkcí kostní dřeně doporučuje kombinovaná aplikace těchto látek (např. gemcitabin v kombinaci s oxaliplatinou [169]), vzhledem k tomu, že u alespoň malého procenta pacientů může dojít znovu k dlouhodobé remisi. Všichni tito pacienti by však měli být zahrnuti do multicentrické studie, aby mohl být definován optimálního přístup k záchranné terapii, a měli by být odkázáni do center se zkušeností v péči o pacienty s recidivujícím onemocněním a/nebo refrakterní pacienty.
6.6 Záchranná operace
Reziduální tumory by měly být po záchranné chemoterapii resekovány během 4–6 týdnů po normalizaci markerů nebo pokud je dosaženo markerového plateau. V případě progrese markerů po záchranné terapii a nedostatku jiných chemoterapeutických možností, by měla být zvážena resekce reziduálních tumorů („zoufalá“ operace), pokud se zdá úplná resekce všech tumorů proveditelná (lze dosáhnout asi 25% dlouhodobého přežití) [170-179].
6.7 Léčba metastáz do mozku
Metastázy do mozku se vyskytují jako součást systémové recidivy a jen vzácně jako izolovaný relaps. Dlouhodobé přežití pacientů s metastázami do mozku při počáteční diagnóze je špatné (30–40 %), ale ještě se zhoršuje při vzniku metastáz do mozku při recidivě (přežití po dobu 5 let 2–5 %) [180-182]. V tomto případě je chemoterapie počáteční léčbou a některé údaje potvrzují aplikaci konsolidační radioterapie, dokonce v případě úplné odezvy na chemoterapii. Operaci lze zvážit v případě perzistentní solitární metastázy, v závislosti na systémovém stavu, histologii primárního tumoru a lokalizaci metastázy.
6.8 Guidelines pro léčbu metastazujících tumorů ze zárodečných buněk
- NSGCT stadia IIA/B o nízkém objemu se zvýšenými hodnotami markerů by měl být léčen jako pokročilý NSGCT s „dobrou“ nebo „středně dobrou“ prognózou pomocí 3 a 4 cyklů PEB. II stadium bez zvýšených hodnot markerů (při podezření na diferenciovaný teratom) lze léčit pomocí RPLND nebo pečlivým pozorováním a odloženou operací.
- U metastazujícího NSGCT (≥ stadium II C) s dobrou prognózou jsou primární léčbou 3 cykly PEB (stupeň doporučení A).
- U metastazujícího NSGCT se středně dobrou a špatnou prognózou jsou primární léčbou 4 cykly standardní PEB (stupeň doporučení A).
- Operační resekce reziduální masy po chemoterapii je u NSGCT indikována v případě, že je reziduální masa > 1 cm a pokud jsou hodnoty sérových tumor markerů normální nebo normalizující se (stupeň doporučení B).
- Metastazující seminom s onemocněním nižším než N3M1 lze zpočátku léčit radioterapií. V případě nutnosti lze jako záchrannou léčbu aplikovat chemoterapii se stejným programem jako u skupiny s NSGCT s korespondující prognózou (stupeň doporučení A).
- Pokročilý seminom (N3 nebo M1) by měl být léčen pomocí primární chemoterapie dle stejných pravidel jako u NSGCT (stupeň doporučení A).
7. SLEDOVÁNÍ PO KURATIVNÍ TERAPII
7.1 Obecná rozhodnutí
Navzdory tomu, že o významu sledování u asymptotických pacientů po potenciálně kurativní léčbě existuje jen omezené množství informací, je karcinom varlete, nejlépe léčitelný lidský tumor, vynikajícím modelem pro postkurativní pozorování. Selekce testů prováděných při sledování by měla odpovídat následujícím pravidlům [183]:
A ‑Interval mezi vyšetřením a doba trvání testování by měly být konzistentní s dobou maximálního rizika vzniku recidivy a přirozené povahy tumoru.
B ‑Testy by měly být zacíleny na nejpravděpodobnější místa vzniku recidivy a měly by mít velkou prediktivní hodnotu, pozitivní i negativní.
C ‑Měla by být k dispozici terapie, jež povede k vyléčení recidivy, signifikantnímu prodloužení života nebo paliaci symptomů. Započetí časnější terapie by mělo ve srovnání s terapií aplikovanou v době, kdy je pacient symptomatický z důvodu recidivy tumoru, zlepšit výsledek.
D ‑Zvýšené riziko vzniku sekundárního maligního onemocnění, na primárním místě i v jiných tkáních, jež mohly být vystaveny stejných karcinogenům nebo u nichž je epidemiologický důkaz zvýšeného rizika, by mělo také vést k provádění řady testů. Je také třeba zvážit „maligní“ a „nemaligní“ komplikace terapie. Toto testování by mělo být prováděno s frekvencí a délkou odpovídající povaze rizika a zahrnovat pouze testy s vysokou pozitivní a negativní prediktivní hodnotou.
Následující informace platí obecně pro výběr vhodného programu a vyšetřování při sledování testikulárního tumoru ve všech stadiích:
- K většině recidiv po kurativní terapii dojde během prvních 2 let, následné pozorování by se mělo provádět nejčastěji a nejintenzivněji právě v tomto období.
- K pozdějšímu relapsu může dojít i po 5 letech, doporučuje se proto každoroční sledování po zbytek života [184-187].
- Po RPLND dochází k relapsu v retroperitoneu vzácně, nejpravděpodobnější místo recidivy je hrudník.
- V současné době byl diskutován význam RTG-vyšetření hrudníku při sledování pacientů s diseminovaným onemocněním po úplné remisi [188].
- CT-vyšetření hrudníku má vyšší prediktivní hodnotu než RTG hrudníku [188].
- Výsledky terapie závisí na objemu onemocnění, proto je oprávněná intenzivní strategie detekující presymptomatické onemocnění [189,190].
- Po chemoterapii nebo radioterapii existuje malé dlouhodobé riziko sekundárních malignit [59,191].
Cílem sledování je u testikulárního tumoru:
- co nejčasnější detekce relapsu ve všech stadiích tumoru
- detekce asynchronního kontralaterálního karcinomu varlete v časném stadiu
- prevence zbytečné léčby ve stadiu I.
Vzhledem k tomu, že pro tumory I. stadia a metastazující onemocnění o nízkém objemu (mající stejné procento přežití ovšem odlišné procento recidivy) jsou k dispozici různé možnosti léčby, měla by být v těchto stadiích intenzita sledování stanovena dle procenta výskytu a doby vzniku recidivy. Lokalizace recidivy by měla u každého druhu strategie sledování určovat testy prováděné během sledování.
Testy prováděné při sledování, a již u časného nebo pokročilého stadia:
- fyzikální vyšetření (zjištění přítomnosti rezistence na krku nebo v břišní dutině, gynekomastie, vyšetření třísel, superficiálních lymfatických uzlin a zbývajícího varlete)
- stanovení hodnoty sérových tumor markerů (AFP, hCG a LDH)
- RTG a/nebo CT hrudníku, abdominální a pánevní CT nebo abdominální ultrazvukové vyšetření
- CT mozku v případě neurologických symptomů, a kostní scan v případě bolesti skeletu
V současné době jsou v literatuře k dispozici pouze nedostatečné důkazy poskytující přesná doporučení týkající se načasování a výběru testů během sledování. Stupeň doporučení průběhu sledování je stupně B nebo C, s konzistentním nedostatkem randomizovaných studií. Proto by autoři rádi zdůraznili, že následující doporučení představují minimální standardizaci sledování. V závislosti na klinickém protokolu nebo pro výzkumné účely mohou být prováděny jakékoliv další testy (stanovení hladiny hormonů, spermiogram, neurologické vyšetření) nebo vyšetření mohou být prováděna častěji.
7.2 Sledování neseminomu I. stadia
U přibližně 5 % pacientů s klinickým NSGCT stadia I se po orchidektomii vyskytují zvýšené hodnoty tumorových markerů a až u 25–30 % dojde během prvních 2 let k relapsu [4,77,80,84,85,87,192-194]. Program sledování se liší dle toho, která ze 3 možných léčebných strategií byla zvolena: pozorování, nervy-šetřící RPLND nebo primární chemoterapie.
7.2.1 Sledování po pozorování
Výsledky programu pozorování závisí na pečlivém předoperačním stanovení stadia tumoru a sledování. K polovině relapsů dojde během prvních 6 měsíců, avšak recidivující onemocnění bylo detekováno i 6 let po orchidektomii. Při programu „wait and see“ se relaps objeví u 30 % případů. 80 % těchto relapsů se vyskytne během prvních 12 měsíců po orchidektomii a přibližně 12 % během 2. roku. Medián doby do vzniku recidivy je 6 měsíců (v rozmezí 1-62 měsíců), ovšem může dojít k relapsu po 3–5 letech, a dokonce i později, s 4 % roční mírou výskytu [76,81]. K relapsu dochází zejména v retroperitoneu; asi 20 % pacientů má zřejmé metastázy v retroperitoneu a 10 % v mediastinu a plicích [86]. Někdy je jedinou indikací zvýšená hodnota tumorových markerů.
Pečlivé pozorování během prvních 6–12 měsíců po orchidektomii je povinné, poté může být interval i delší. Pozorování by mělo pokračovat po dobu minimálně 6 let a někteří doporučují trvalé roční sledování. Pro pozorování neexistuje žádný obecně platný protokol. V tab. 5 je zobrazeno doporučení pro program sledování. Zvláště obtížné je vytvořit doporučení u pacientů s negativními předoperačními hodnotami tumor markerů.
Tab. 5. Doporučený program sledování při pozorovací strategii - neseminom stadia I. 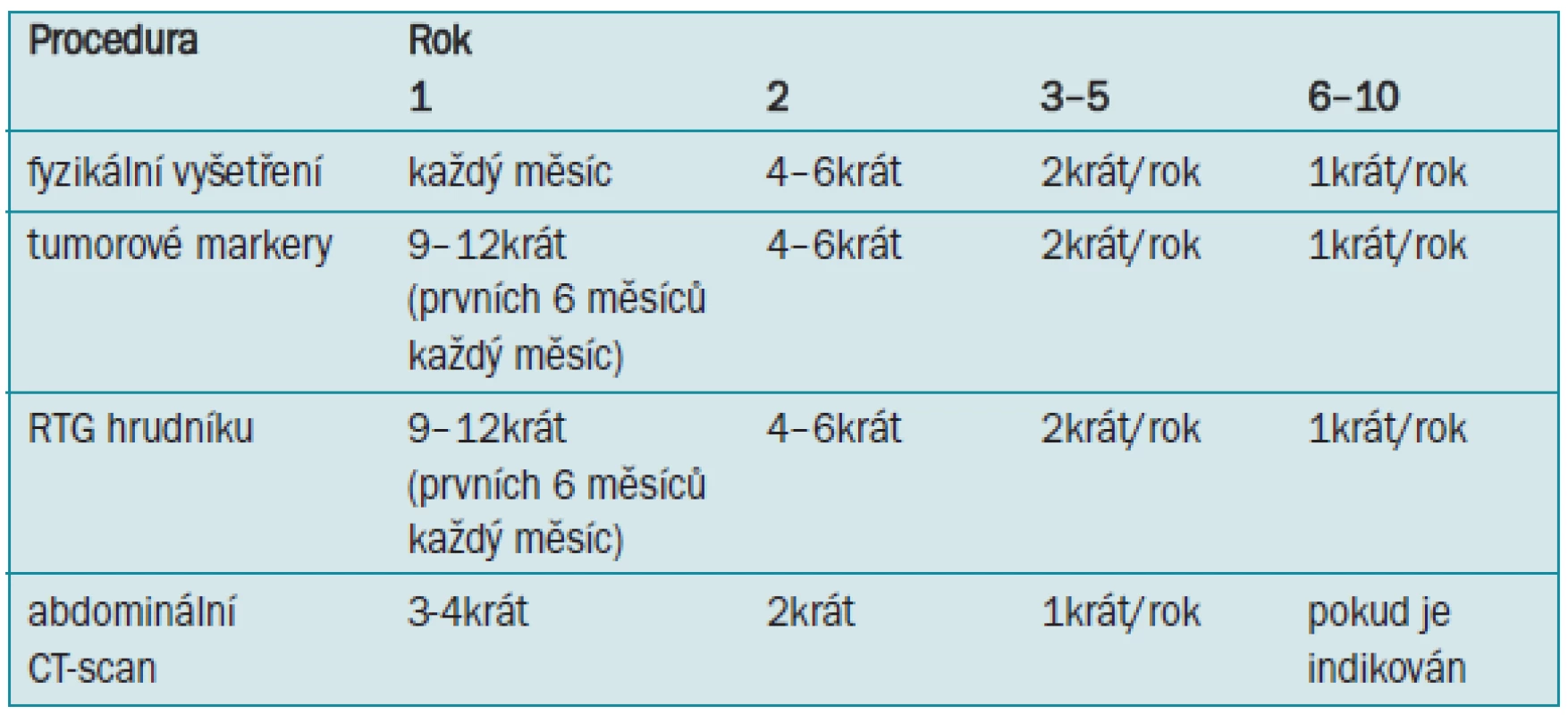
7.2.2 Sledování po nervy-šetřící RPLND
Recidiva v oblasti retroperitonea se po řádně provedené, nervy-šetřící RPLND vyskytuje velmi vzácně. RPLND by měla eliminovat retroperitoneální lymfatické uzliny jako místo relapsu, a tedy potřebu opakovaného provádění abdominálního CT. Údaje USA Intergroup zaznamenaly recidivu v retroperitoneu u 7 ze 264 pacientů s onemocněním patologického stadia I (a 20 pulmonálních relapsů); 4 z těchto 7 pacientů neměli zvýšené hodnoty markerů [95]. Ve studii prováděné ve státě Indiana byl zaznamenán z 559 případů pouze jediný relaps [159]. K recidivě dochází obvykle v oblasti hrudníku, krku a na okrajích operačního pole. Pulmonární recidiva se objevuje u 10–12 % pacientů a k více než 90 % dochází během 2 let po RPLND [196,197]. Doporučený program sledování je znázorněn v tab. 6.
Tab. 6. Doporučený program sledování po retroperitoneální lymfadenektomii nebo adjuvantní chemoterapii - neseminom stadia I. 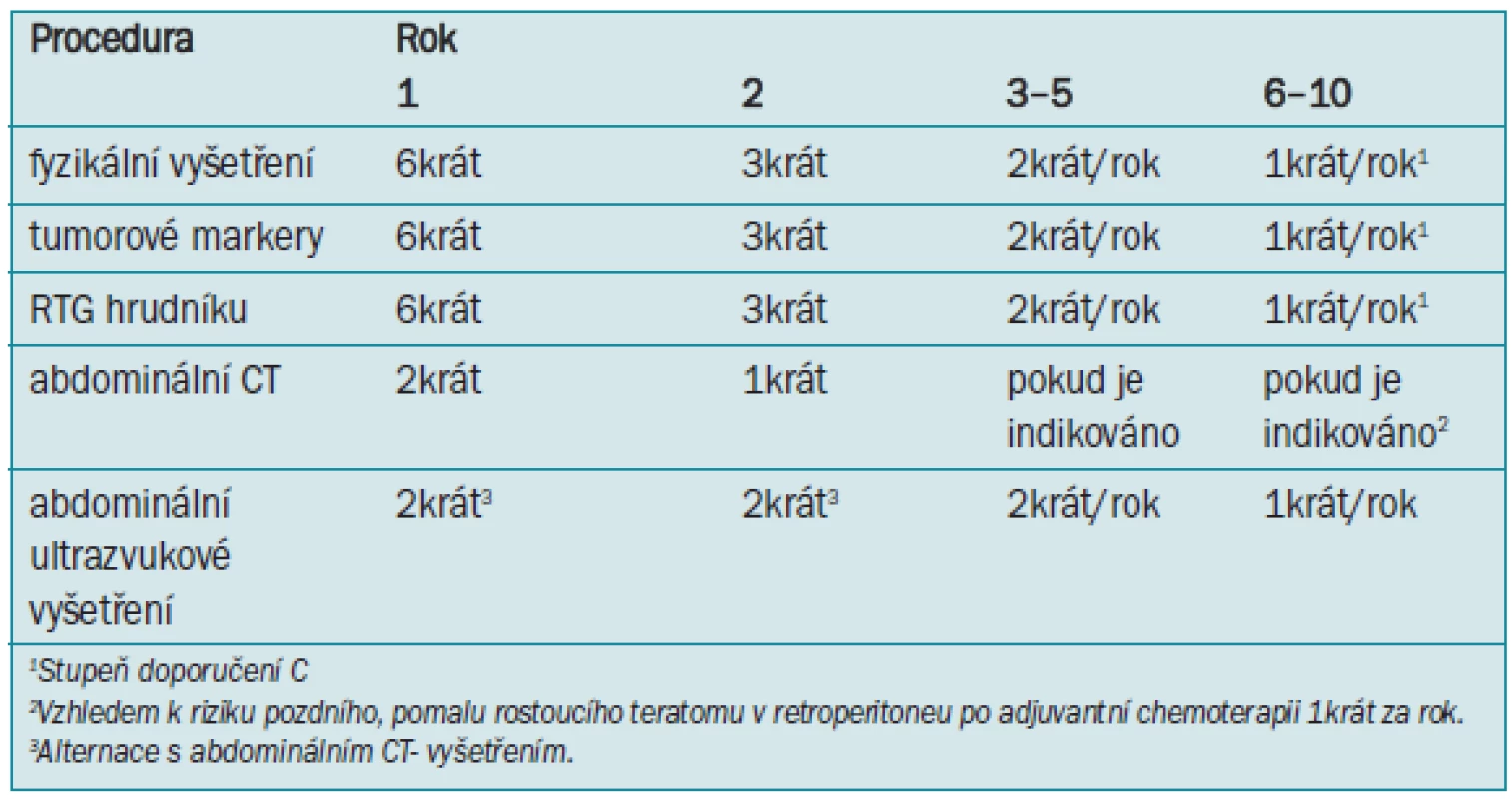
7.2.3 Sledování po adjuvantní chemoterapii
Přestože je počet pacientů léčených pomocí adjuvantní chemoterapie stále malý, některé prospektivní studie s dlouhodobým sledováním vykazují velmi nízké procento recidivy - okolo 3 % [77,78, 80,87]. Potřeba opakovaného a dlouhodobého vyšetření retroperitonea není stále jasná. Při léčbě NSGCT nelze považovat primární chemoterapii za výzkumnou, ale je třeba ji stále nabízet v klinických studiích. Program sledování závisí na výsledcích těchto studií, ale zřejmě bude podobný programu doporučovanému po RPLND (tab. 6). Vzhledem k riziku vzniku pozdního, pomalu rostoucího teratomu v retroperitoneu po adjuvantní chemoterapii by měla být (alespoň) 1krát ročně prováděno abdominální CT nebo ultrazvukové vyšetření, během 2. až 5. roku.
7.3 Sledování seminomu stadia I
Většina pacientů se seminomem (70–80 %) má při stanovení diagnózy onemocnění I. stadium [198]. U 15–20 % případů jsou v retroperitoneu postiženy lymfatické uzliny a pouze u 5 % pacientů se vyskytují vzdálené metastázy [198]. Procento recidivy se pohybuje mezi 1 % a 20 %, v závislosti na výběru terapie po orchidektomii. Pouze u 30 % seminomů je při diagnóze nebo v průběhu onemocnění zvýšená hladina beta-hCG. Následně není měření hladiny markerů v krvi u většiny případů spolehlivým testem pro sledování [189]. Možnostmi léčby u seminomu I. stadia po orchidektomii jsou retroperitoneální radioterapie, pozorování a adjuvantní chemoterapie. Vzhledem k extrémní radio - a chemosenzitivitě se pomocí všech přístupů dosahuje vysokého procenta vyléčení - téměř 100%, dokonce i v případě recidivy. Cena různých terapií se může lišit, stejně jako předpokládané vedlejší účinky [61,199,200].
Je třeba stanovit optimální program sledování, jenž bude záviset na výběru léčby. Podle doby do vzniku relapsu a druhu recidivy je třeba provádět různé testy.
7.3.1. Sledování po radioterapii
Pacienti léčení radioterapií o nízkém dávkování (20–24 Gy) omezenou na retroperitoneum nebo „hokejkové“ pole dosahují po 5–10 letech přibližně 99% míry přežití [53,55,201-203]. Míra recidivy je 1–2% a nejčastější doba manifestace je během prvních 18 měsíců po léčbě [53,56,200, 204,205], přestože byla popsána i pozdní recidiva [185]. Lokalizace recidivy je zejména v supradiafragmatických lymfatických uzlinách, mediastinu, plicích nebo skeletu. U malého počtu případů dochází k relapsu tumoru v ingvinálních nebo zevních ilických lymfatických uzlinách [198].
Vedlejší účinky radioterapie zahrnují narušenou spermatogenezi, gastrointestinální symptomy (peptické vředy) a indukci sekundárních maligních onemocnění [200,206,207]. Až u 50 % pacientů může dojít k toxicitě I–II stupně [202]. Program sledování je popsán v tab. 7.
Tab. 7. Sledování při radioterapii nebo chemoterapii prováděné po orchidektomii - seminom stadia I. 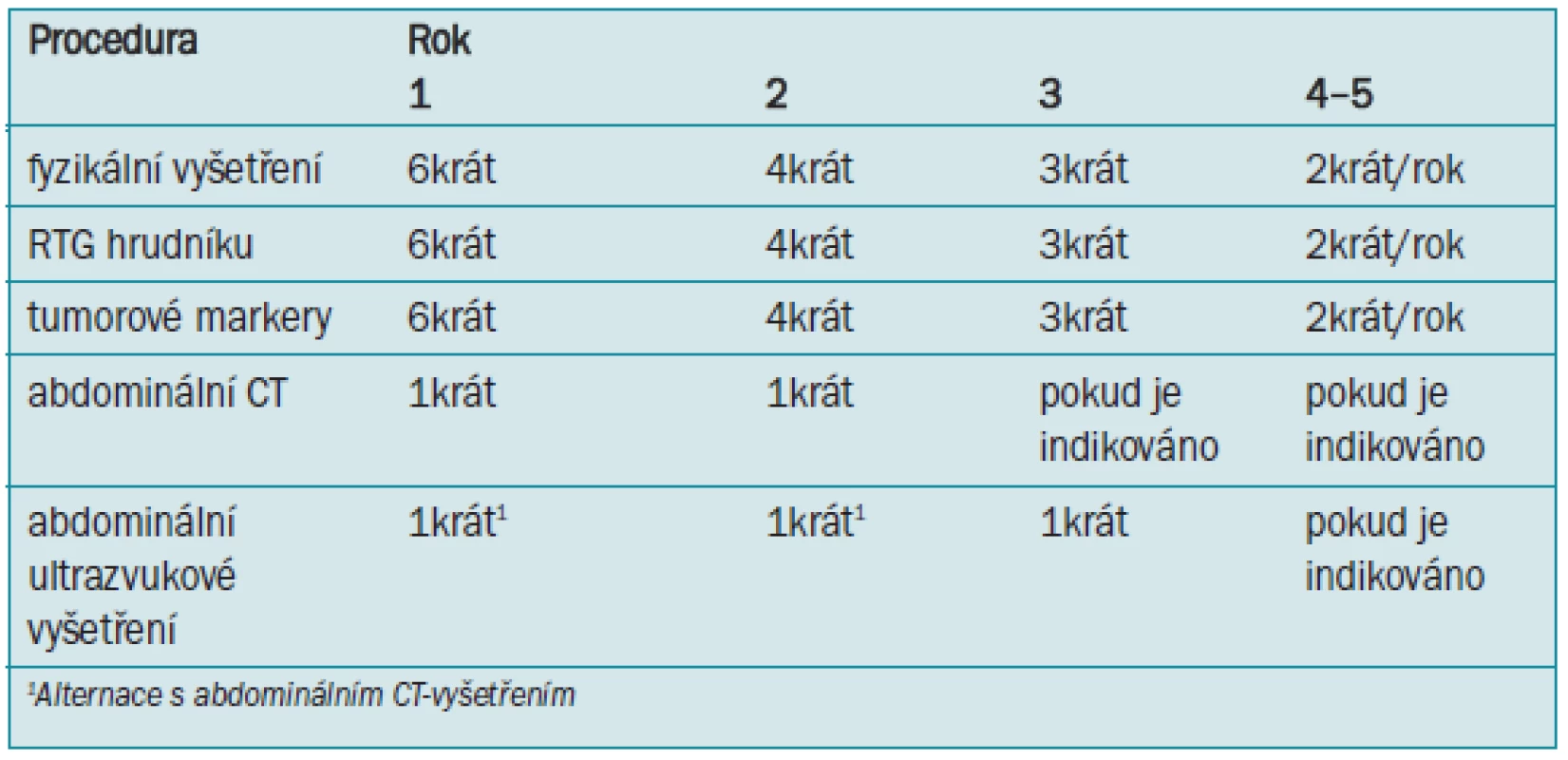
7.3.2. Sledování po pozorování
Je třeba si uvědomit, že v případě vynechání profylaktické radioterapie je větší potřeba provádět záchrannou chemoterapii. V opačném případě je alespoň 80 % pacientů aplikována zbytečná radioterapie, v případě že je podávána profylakticky všem pacientům se seminomem stadia I. Existují prospektivní, ovšem nerandomizované studie zabývající se pozorováním, které ukazují, že se riziko vzniku recidivy po 5 letech pohybuje mezi 15–20 % [208-212]. Přesto v tomto případě není riziko úmrtí zvýšené. Průměrná doba do vzniku relapsu se pohybuje mezi 12–18 měsíci, ovšem až 29 % relapsů se může vyvinout později [198]. V až 82 % případů jsou místem recidivy PA lymfatické uzliny, pánevní lymfatické uzliny, ingvinální lymfatické uzliny, a dokonce mohou být postiženy i plíce [198]. Vzhledem k vysokému procentu většinou pozdní recidivy je po dalších alespoň 5 let nutné provádět pečlivé a aktivní sledování. Hlavními nevýhodami tohoto řešení je nedostatek údajů o dlouhodobém sledování, vysoká cena a problematická kompliance pacienta. Program sledování je popsán v tab. 8.
Tab. 8. Sledování při režimu pozorování. 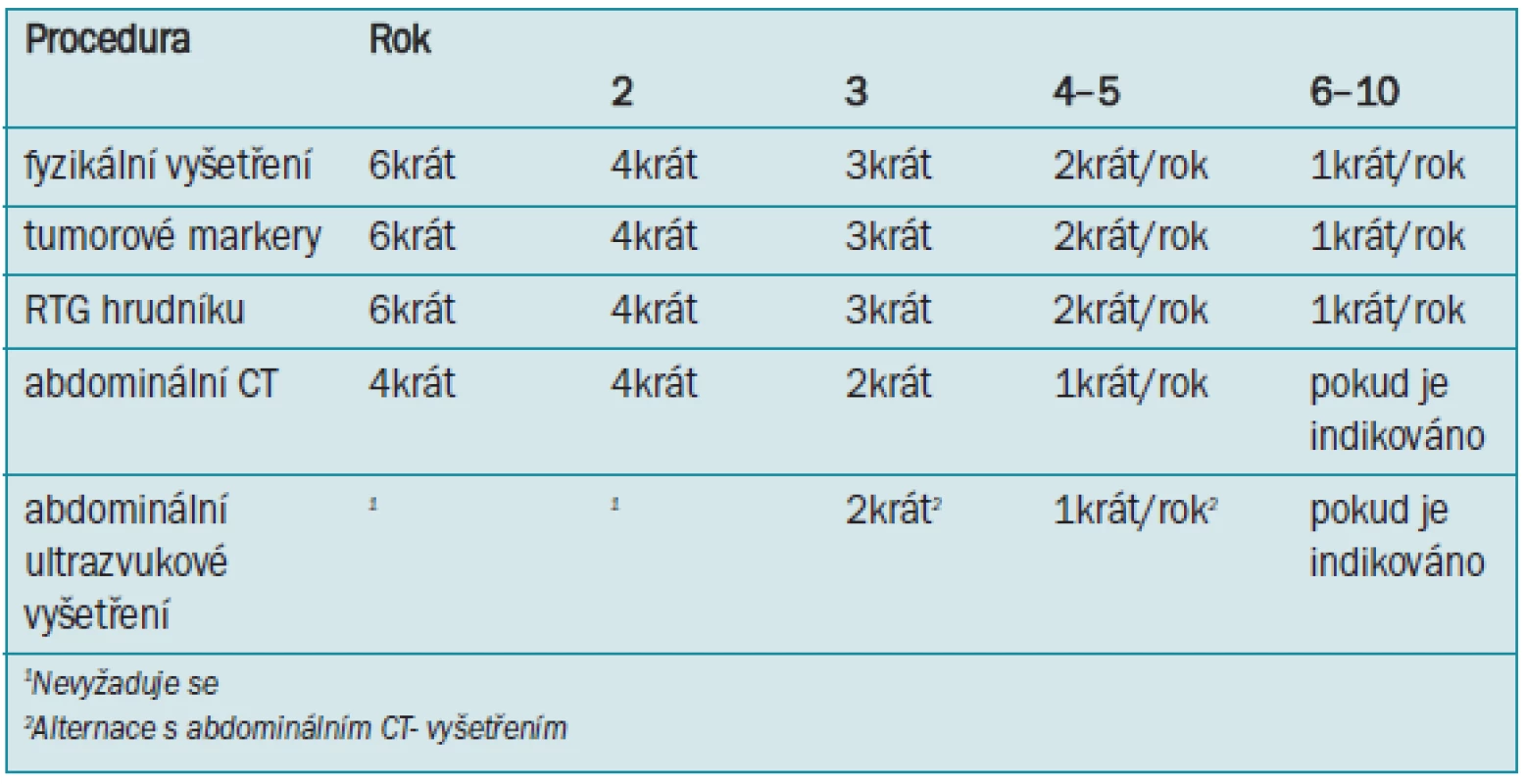
7.3.3. Sledování po adjuvantní chemoterapii
U seminomu stadia I jsou efektivní alternativní léčbou 1 nebo 2 cykly chemoterapie užívající karboplatinu. Procento recidivy činí méně než 2 %, ovšem počet pacientů zapojených do prospektivní studie je stále malý a délka sledování je ve většině studií omezena. Obecně je tato léčba dobře snášena, pouze s mírnou, akutní a střednědobou toxicitou [67,68]. Vzhledem k tomu, že procento recidivy je nízké, může být program sledování stejný, jako u radioterapie prováděné po orchidektomii (tab. 7).
7.4 Sledování tumoru stadia II a pokročilého (metastazujícího) onemocnění
Čím je stadium zasažení lymfatických uzlin pokročilejší, tím vyšší je pravděpodobnost vzniku recidivy [96]. Obecně ovlivňuje útvar primárního tumoru výsledný stav u pacientů s NSGCT [213]. U NSGCT stadia II, bez ohledu na druh léčby, se dosahuje 97% míry přežití v případě, že je recidiva identifikována co nejdříve [109,193,214].
U pokročilých metastazujících tumorů ze zárodečných buněk souvisí rozsah onemocnění s odpovědí na terapii a s přežitím. Při použití kombinace chemoterapie užívající cisplatinu a operace (agresivní multimodalita) se pohybuje míra vyléčení mezi 65–80 % v závislosti na počátečním rozsahu onemocnění [213,215]. Úplná odpověï na chemoterapii se pohybuje mezi 50–60 % [213]; dalších 20–30 % pacientů lze po operaci prováděné po chemoterapii hodnotit jako bez onemocnění [216].
Hlavními důvody pro selhání terapie u pokročilého NSGTC jsou [213,217,218]:
- přítomnost rozsáhlého onemocnění nereagujícího na chemoterapii
- neresekovatelný reziduální teratom po chemoterapii
- přítomnost nebo vznik chemorezistentních prvků z nezárodečných buněk, jež tvoří asi 8,2 % případů.
Je stále nedostatek výsledků z randomizovaných studií, podle nichž vytvořené sledování závisející na důkazech a různé programy užívané různými centry mají vyšší variabilitu a jsou více individualizované než u stadia Ia.
7.4.1. Klinické a patologické stadium II NSGCT
Jak už bylo v těchto guidelines uvedeno NSGCT stadia II o nízkém objemu lze léčit pomocí primární RPLDN nebo primární chemoterapie.
7.4.1.1 Recidiva po primární RPLDN
Může dojít ke 2 různým situacím:
- Asi 23–28 % pacientů s onemocněním klinického stadia II má onemocnění patologické stadia I, a měli by být dle toho sledováni (viz sledováni NSGCT I. stadia) [219,220].
- 72–77 % pacientů s onemocněním klinického stadia II má patologické stadium II, s různým procentem recidiv závisejícím na druhu léčby. Bez ohledu na to, jaká je zvolena léčebná strategie, dojde k většině relapsů během prvních 2 let a mimo operační pole.
Recidiva po primární RPLDN následované 2 cykly chemoterapie
Míra recidivy u této skupiny je po 4 letech 6% [96,215]. V nerandomizovaných studiích s průměrnou dobou sledování pohybující se mezi 30–72 měsíci vede tato metoda léčby k vysokému celkovému přežívání bez známek onemocnění pohybující se mezi 98–100 % [214,221].
Hlavní nevýhodou adjuvantní chemoterapie je to, že představuje u přibližně 50 % pacientů s onemocněním stadia II „overtreatment“.
Recidiva po primární PRLDN sledované pozorováním
Průměrná míra vzniku recidivy je v této skupině průměrně po 4 letech 35% (v rozmezí 8–49 %) [96,190,222].
Přesto závisí procento recidivy na patologickém stadiu. Patologické stadium IIa představuje méně než 50% riziko, zatímco patologické stadium IIb představuje alespoň 50% riziko vzniku relapsu [96,214,215,223]. Retroperitonální CT-vyšetření po RPLDN lze nahradit finančně méně nákladným abdominálním ultrazvukovým vyšetřením, přestože se doporučuje provádění CT jako výchozího vyšetření po RPLDN. Pokud je primární RPLND sledována pozorováním (obvykle u případů postižení lymfatických uzlin o nízkém objemu nebo patologického stadia IIa), je nezbytný přísnější program sledování než u adjuvantní chemoterapie. Fyzikální vyšetření, stanovení hodnoty tumorových markerů a RTG hrudníku se provádí častěji než u předchozího léčebného režimu.
Lze provádět sledování znázorněné v tab. 9, ovšem testy je třeba provádět:
- 1. rok každý měsíc
- 2. rok každé 2 měsíce
- 3. rok každé 3 měsíce
- 4. rok každé 4 měsíce
- 5. rok 2krát ročně
- poté 1krát rok
Tab. 9. Sledování NSGCT stadia IIa-IIb po RPLND plus chemoterapie nebo po primární chemoterapii. 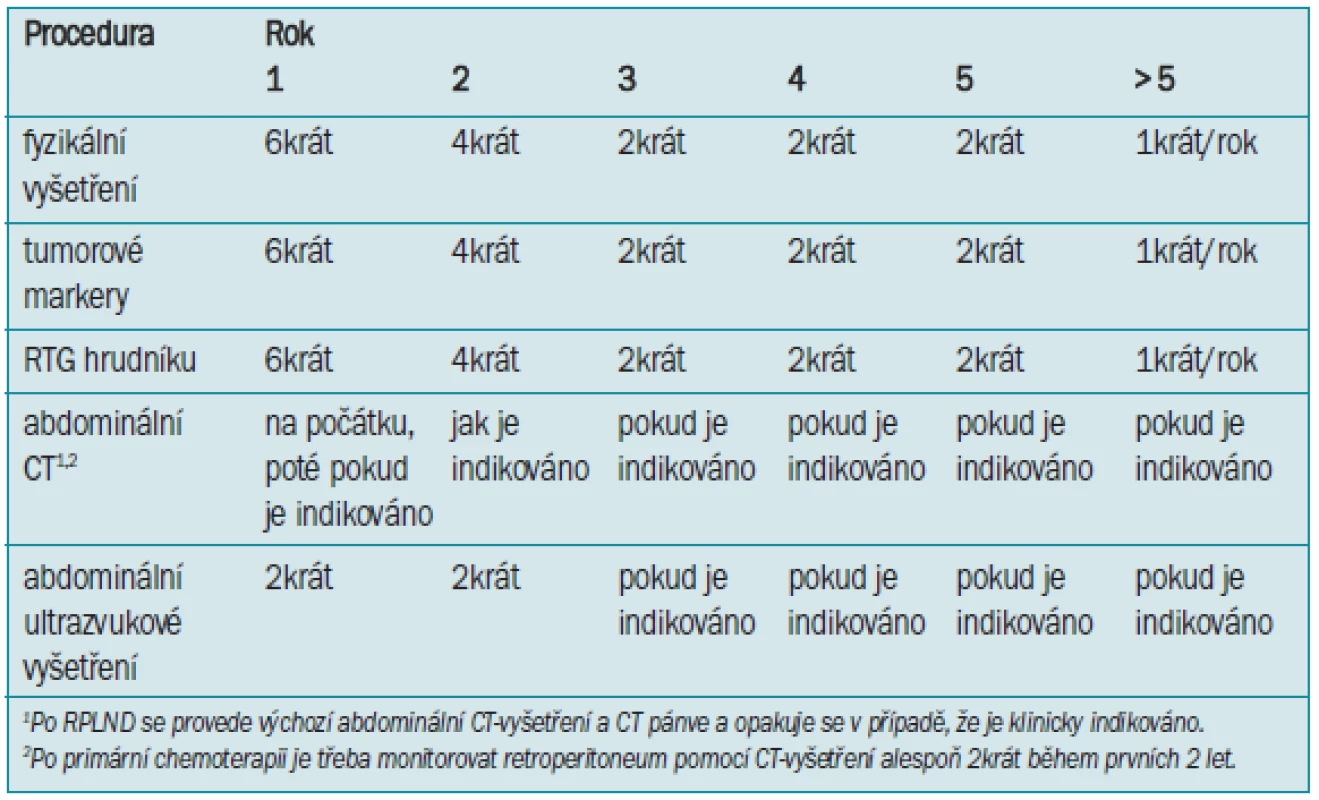
7.4.1.2 Relaps po primární chemoterapii
68–78 % pacientů (průměrně 75 %) dosáhne úplné klinické odpovědi [85,109, 224]. Procento recidivy se pohybuje kolem 5 % a k většině relapsů dojde během prvních 8 měsíců až 2 let po chemoterapii. Přesto může dojít k pozdním relapsům v rozmezí 2–5 % v závislosti na různých prognostických faktorech (např. zda je metastáza < 3 cm nebo > 3 cm a histologii primárního tumoru/teratoidních prvků). Výskyt zralých teratomů byl popsán po 5–8 letech sledování [214]. Obecně je procento recidivy při střední době sledování 5,5 roku přibližně 8 %. Míra přežití bez progrese je asi 92% a celková míra přežití je 97% [109].
Přestože se pomocí této léčebné metody u 68–78 % pacientů vyhneme RPLND, v závislosti na tom, zda je klinické stadium IIa nebo IIb [109,156,224], vyžaduje tato metoda rozsáhlé sledování. Po primární chemoterapii nelze z programu sledování vynechat retroperitoneální CT. Program sledování je prakticky stejný jako při primární RPLND plus adjuvantní chemoterapii, ačkoliv po primární chemoterapii je třeba provádět alespoň 2krát během prvních 2 let abdominální a pánevní CT-vyšetření (tab. 9).
7.4.2 Seminom stadia II
Míra recidivy po radioterapii u klinického stadia IIa a IIb se pohybuje v rozmezí 5–15 %. K většině relapsů dojde během prvních 2 let a manifestuje se supraklavikulární nebo mediastinální rezistencí, zatímco recidiva v ozařovaném poli se vyskytuje vzácně [215]. Doporučený program sledování je uveden v tab. 10.
Tab. 10. Sledování seminomu stadia IIa-IIb po radioterapii. 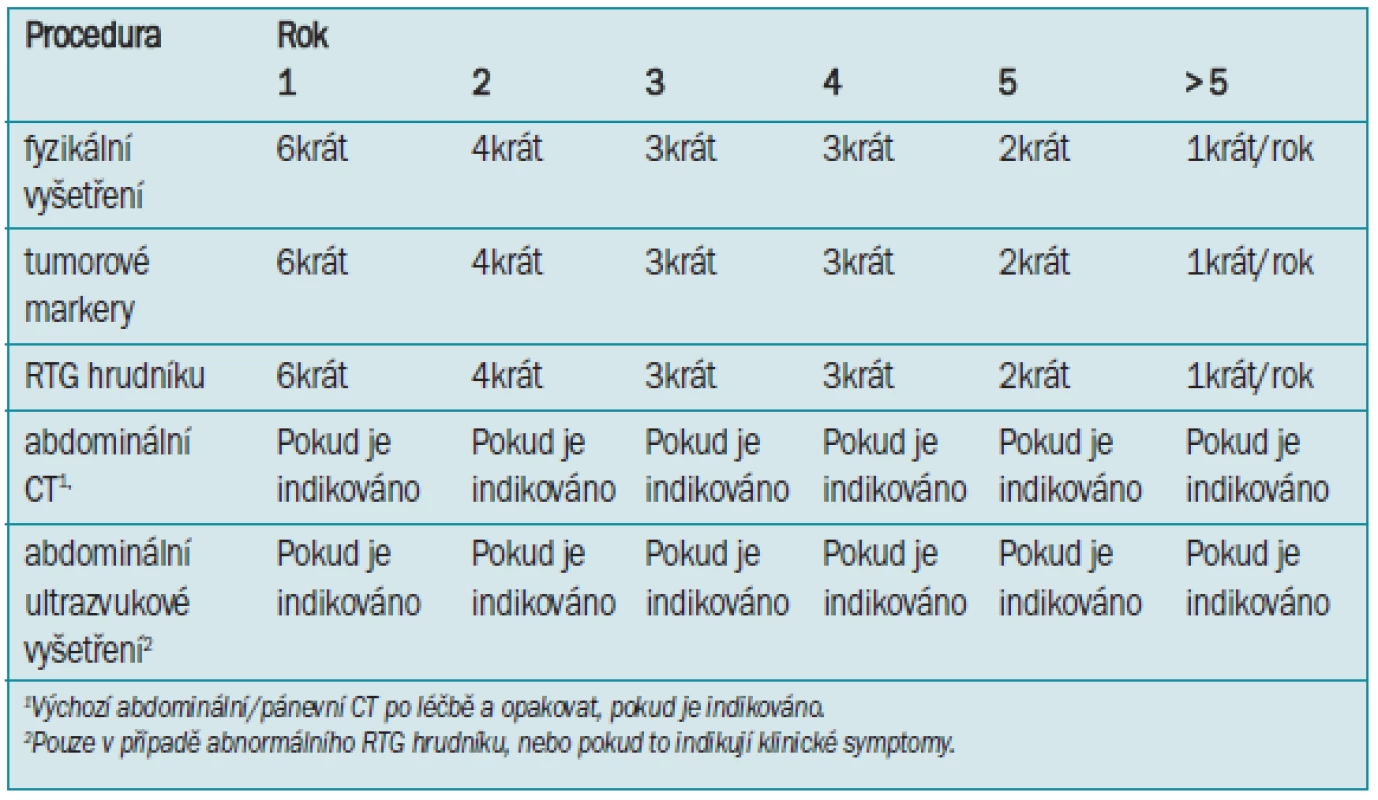
7.4.3 Seminom a neseminom klinického stadia IIc a III
U pokročilého onemocnění je po IGCCCG-klasifikaci u pacientů v dobré prognostické kategorii celková míra přežití 92 %, u pacientů v kategorii se středně dobrou prognózou 80 % a 48 % ve špatné prognostické kategorii [41]. Stadium IIc je obvykle zařazováno do skupiny pacientů s dobrou prognózou [214].
Po chemoterapii se v případě alespoň 90% poklesu objemu retroperitoneální hmoty doporučuje pečlivé sledování, v případě, že není v primárním tumoru důkaz teratomu. Avšak v současné době neexistují spolehlivá kritéria CT-vyšetření pro rozlišení tumoru od nekrotického debris po chemoterapii, míra falešně negativního CT se pohybuje od 8-37 % [217].
U pokročilého NSGCT se riziko falešně negativní predikce založené na CT-vyšetření pohybuje stále přibližně okolo 20 %, navzdory statistické korelaci s dalšími faktory (např. stupeň zmenšení, množství reziduální hmoty, hodnota tumorových markerů před chemoterapií, komponenty teratomu ve vzorku z orchidektomie) [217].
Pokud je CT-vyšetření normální nebo vykazuje reziduální abnormalitu menší než 3 cm v průměru, je u pokročilého seminomu míra „in-site“ selhání 3% [130-132,225]. Program sledování pokročilého onemocnění (seminom a neseminom) je zobrazen v tab. 11.
Tab. 11. Sledování seminomu stadia IIa-IIb po radioterapii. 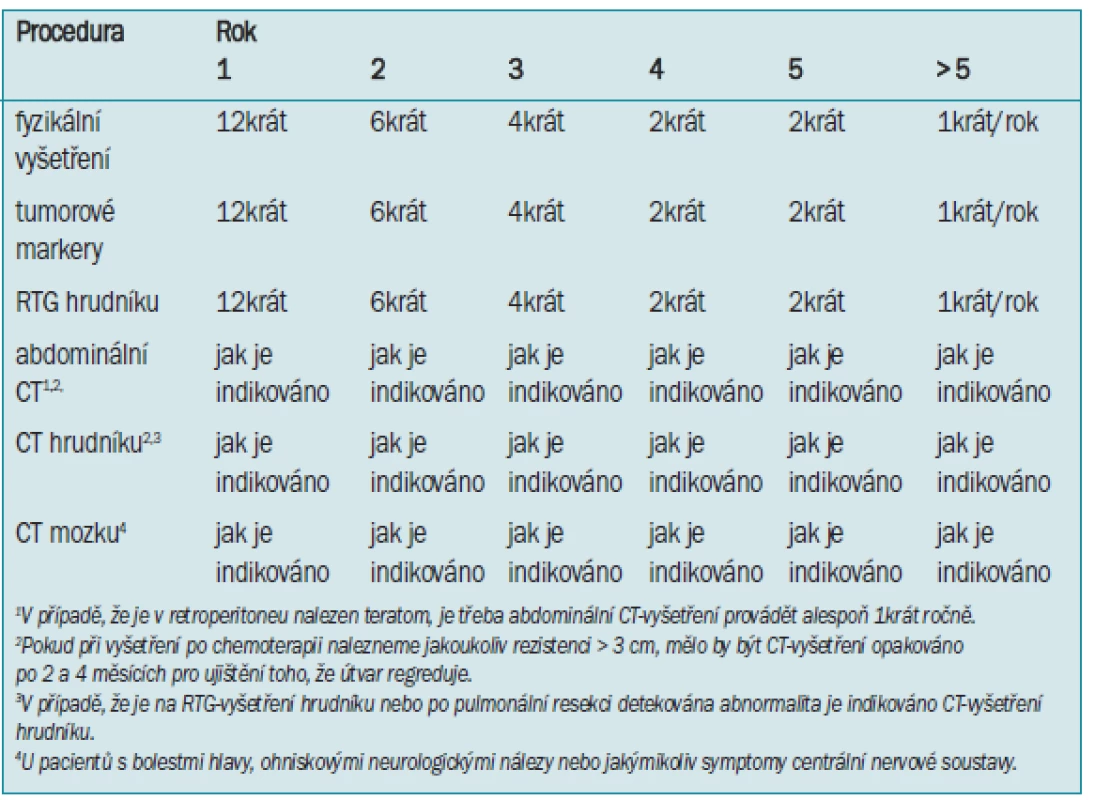
U pokročilého onemocnění je nejdůležitější procedurou při sledování rutinní stanovení sérových tumor markerů (hCG a AFP) následované fyzikálním vyšetřením a určením klinické anamnézy [188,266]. Některé součastné studie se zabývají významem rutinního RTG-vyšetření hrudníku [188].
Pokud jsou přítomny neurologické symptomy, je třeba při sledování provádět CT-vyšetření mozku, vzhledem k tomu, že až u 5 % pacientů s pokročilým onemocněním jsou přítomny, nebo dojde ke vzniku metastáz do mozku [215]. Minimálně 1krát za rok je třeba provádět abdominální CT-vyšetření, vzhledem k velkému významu teratomu, v případě že byl zjištěn v retroperitoneu.
8. TUMORY ZE STROMATU VARLETE
8.1 Úvod
Tumory ze stromatu varlete se vyskytují velmi vzácně a tvoří asi pouze 2 % až 4 % testikulárních tumorů u dospělých mužů. Avšak pouze tumory z Leydigových buněk a Sertoliho buněk mají klinický význam. Vzhledem k tomu, že doposud nebylo publikováno žádné obecné doporučení, rozhodla se Testicular Cancer Working Group EAU zahrnout tyto tumory do EAU Germ Cell Tumour Guidelines. Doporučení pro diagnózu a léčbu se týkají pouze tumorů z Leydigových buněk a Sertoliho buněk.
8.2 Metody
Na Medline byl proveden průzkum tumoru z Leydigových buněk (synonymum: tumor z intersticiálních buněk) a tumorů ze Sertoliho buněk (synonymum: androblastom). Bylo nalezeno přibližně 850 publikací. Po vyloučení čistě laboratorních prací bez klinických údajů, tumorů u žen a dětí a zvířat, bylo hodnoceno 371 studií a abstraktů. Byly vyloučeny dvojité publikace a studie s nejasným histologickým vyšetřením nebo chybějícími údaji. Většina ze zbývajících 285 publikací byly případové studie, z nichž se pouze několik studií zabývalo sérií více než 10 případů, většina z nich byla publikována v histopatologické literatuře. Skutečná incidence tumorů ze stromatu varlete není proto jasná a množství metastazujících tumorů lze uvádět jen přibližně.
Avšak symptomy předoperačního podezření na přítomnost tumoru ze stromatu varlete a charakteristika tumoru s vysokým rizikem výskytu metastáz jsou dostatečně dobře stanoveny (EBM IIA a EBM IIB) pro doporučení týkající se diagnózy a operačního přístupu. Avšak vzhledem k absenci údajů týkajících se sledování u většiny zaznamenaných případů a fatálního výsledného stavu u metastazujících tumorů, bez ohledu na zvolenou terapii není možné uvádět žádná doporučení pro vhodné sledování.
Individuální publikace byly klasifikovány dle kategorií EBM (viz výše).
Literární průzkum týkající se klinických údajů o tumorech z Leydigových buněk vedl k 193 publikacím zabývajících se více než 480 tumory u dospělých, zahrnující 3 publikace [1-3] uvádějící větší série s celkem 90 pacienty. U přibližně 80 pacientů jsou k dispozici údaje o sledování trvajícím více než 2 roky.
Literární průzkum týkající se klinických údajů o tumorech ze Sertoliho buněk vedl k 93 publikacím zabývajících se více než 260 tumory u dospělých, zahrnující 3 publikace (ze stejné skupiny) [4-6] uvádějící větší série s celkem 80 pacienty. U méně než 40 pacientů jsou k dispozici údaje o sledování trvající více než 2 roky.
8.3 Klasifikace
Tumory varlete z nezárodečných buněk zahrnují tumory semenného provazce/ tumory ze stromatu a různé další tumory ze stromatu varlete z nespecifických buněk.
Různé histologické podtypy testikulárních tumorů jsou definovány dle klasifikace WHO 2004 (upraveno) [7].
8.4 Tumory z Leydigových buněk
8.4.1 Epidemiologie
Tumory z Leydigových buněk tvoří asi 1–3 % testikulárních tumorů u dospělých [2,8] a 3 % testikulárních tumorů u dětí [8]. Tumor se u dospělých nejčastěji vyskytuje ve 3. až 6. dekádě s podobnou incidencí pozorovanou v každé dekádě. Další vrchol incidence je pozorována u dětí mezi 3 a 9 lety. 3 % tumorů z Leydigových buněk jsou bilaterální [2]. Občas se vyskytují u pacientů s Kinefelterovým syndromem [8].
8.4.2 Patologie tumorů z Leydigových buněk
Tumory z Leydigových buněk jsou nejčastějším typem tumorů semenného provazce/gonadálního stromatu. Histopatologicky jsou dobře ohraničeny a obvykle mají do 5 cm v průměru. Jsou solidní, žluté až nahnědlé barvy, s krvácením a/nebo nekrózou u 30 % případů. Mikroskopicky jsou buňky polygonní s eozinofilním cytoplazmatem s občasnými Reinkeho krystaly, pravidelným jádrem, pevným uskupením a kapilárním stromatem. Buňky vylučují vimentin, inhibin, protein S100, steroidní hormony, kalretinin a cytokeratin (fokálně) [7].
Přibližně 10 % tumorů z Leydigových buněk jsou maligní tumory, u nichž se vyskytují následující parametry:
- větší rozměr (> 5 cm)
- cytologická atypie
- zvýšená miotická aktivita (> 3 na 10 „high - power field"“ - HPF)
- zvýšená exprese MIB-1 (18,6 % vs 1,2 % u benigních)
- nekróza
- vaskulární invaze [1]
- infiltrované okraje
- rozšíření za testikulární parenchym
- DNA-aneuploidie [1,9].
8.4.3 Diagnóza
Pacienti mají nebolestivé zvětšené varle, nebo je tumor zjištěn náhodně při ultrazvukovém vyšetření. U až 80 % jsou zaznamenány hormonální poruchy s vysokými hodnotami estrogenu a estradiolu a nízkou hodnotou testosteronu, zvýšenými hodnotami lutenizačního hormonu (LH) a folikuly stimulujícího hormonu (FSH) [10,11], zatímco hodnoty testikulárních tumorových markerů ze zárodečných buněk, AFP, HCG, laktátové dehydrogenázy (LDH) a PLAP jsou vždy negativní. Přibližně 30 % pacientů má gynekomastii [12,13]; 3 % tumorů jsou bilaterální [2].
Je třeba odlišit tumory z Leydigových buněk od multinodulárních a často bilaterálních lézí androgenitálního syndromu připomínajících tumor [14]. Diagnostický postup musí zahrnovat: stanovení hodnoty markerů, hormonů (alespoň testosteronu, LH a FSH, pokud nevedou k závěru, navíc estrogenu, estradiolu, progesteronu a kortizolu), ultrazvukové vyšetření obou varlat a CT-vyšetření hrudníku a břicha.
Při ultrazvukovém vyšetření je možné pozorovat dobře definované, malé, hypoechogenní léze s hypervaskularizací, ovšem jejich vzhled může být různý a je nemožné je rozlišit od tumorů ze zárodečných buněk [15,16].
Množství metastazujících tumorů je ve všech publikovaných kazuistikách pouze 10 %. Ve 3 větších souborech s delším sledováním bylo u 83 případů zaznamenáno 18 metastazujících tumorů (21,7 %) [1-3]. Histopatologické známky malignity byly uvedeny výše (viz 8.4.2) [1,9]. Navíc mají starší pacienti vyšší riziko přítomnosti tumoru s maligním potenciálem.
8.4.4 Léčba
Asymptomatické testikulární tumory o malém objemu jsou často mylně považovány za tumory ze zárodečných buněk a je provedena ingvinální orchidektomie. Velmi se doporučuje provádět u každé menší intraparenchymatózní léze orgán-šetřící operaci, abychom získali histologickou diagnózu. Zejména u pacientů se symptomy gynekomastie nebo hormonální poruchou bychom měli počítat s tumorem z nezárodečných buněk a měli bychom předejít okamžitému provádění orchidektomie [17]. U případů, u nichž je při biopsii „nazmrzlo“ nebo parafínové histologii zjištěn tumor ze zárodečných buněk, se doporučuje provedení orchidektomie, pokud je přítomno normální kontralaterální varle.
U tumorů ze stromatu varlete s histologickými známkami malignity, zejména u starších pacientů se pro prevenci vzniku metastáz doporučuje provést orchidektomii a retroperitoneální lymfadenektomii [8].
Pokud nejsou při histologickém vyšetření přítomny známky malignity, doporučuje se po orchidektomii individuální strategie pozorování (vzhledem k tomu, že nejsou k dispozici hodnoty specifických tumor markerů, je nejvhodnějším vyšetřením CT-sledování).
Tumory, které metastazovaly do lymfatických uzlin, plic, jater nebo skeletu, odpovídají na chemoterapii nebo radiaci špatně a doba přežití je krátká [18].
8.4.5 Sledování
Vzhledem k nedostatku údajů týkajících se sledování ve většině zaznamenaných studiích a smrtícímu výsledku metastazujících tumorů, bez ohledu na zvolenou terapii, nelze doporučit vhodné sledování.
8.8 Tumory ze Sertoliho buněk
8.5.1 Epidemiologie
Tumory ze Sertoliho buněk tvoří méně než 1 % tumorů varlete, průměrný věk při stanovení diagnózy je 45 let se vzácnými případy u pacientů mladších než 20 let [4,19]. Vzácně mohou tyto tumory vzniknout u pacientů se syndromem androgenní necitlivosti a Peutzova-Jeghersova syndromu.
8.5.2 Patologie tumorů ze Sertoliho buněk
Tumor je dobře ohraničen, žluté, nahnědlé nebo bílé barvy, průměrně 3,5 cm v průměru [4]. Mikroskopicky jsou buňky eozinofilní až bledé s vakuoalizovanou cytoplazmou. Jádra jsou pravidelná s žlábky a mohou se zde vyskytovat inkluze. Uspořádání buněk je tubulární, nebo solidní, může se vyskytnout síové nebo pruhovité uskupení. Stroma je jemné a kapilární, v některých případech ovšem převládá sklerotizující aspekt. Buňky vylučují vimentin, cytokeratin, inhibin (40 %) a protein S-100 (30 %) [4].
Míra výskytu maligních tumorů se pohybuje mezi 10 % a 22 % a je zaznamenáno méně než 50 případů [20-22].
Známky maligního tumoru ze Sertoliho buněk jsou:
- větší rozměr (> 5 cm)
- pleomorfní jádra s jadérky
- zvýšená mitotická aktivita (> 5 per 10 HPF)
- nekróza
- vaskulární invaze.
8.5.2 Klasifikace
Byly popsány 3 podtypy [19]:
- klasický tumor ze Sertoliho buněk [4]
- velká kalcifikující buněčná formace s charakteristickými kalcifikacemi [5,23]
- vzácná sklerotizující forma [6,24]
8.5.3 Diagnóza
Pacienti mají buï zvětšené varle, nebo je tumor zjištěn náhodně při ultrazvukovém vyšetření [25]. Většina klasických tumorů ze Sertoliho buněk je unilaterální a unifokální. Hormonální poruchy nejsou obvyklé, přestože se někdy setkáme s gynekomastií [4]. Testikulární tumor markery AFP, HCG, LDH a PLAP jsou vždy negativní.
Diagnostický postup musí zahrnovat stanovení hodnoty tumor markerů, hormonů (alespoň testosteronu, LH a FSH, pokud nevedou k závěru, dále estrogenu, estradiolu, progesteronu a kortizolu) ultrazvukovové vyšetření obou varlat a CT-vyšetření hrudníku a břicha.
Tumory ze Sertoliho buněk jsou při ultrazvukovém vyšetření obvykle hypoechogenní, ale mohou mít různý vzhled, a proto je nelze snadno odlišit od tumorů ze zárodečných buněk [19]. Pouze velká kalcifikující buněčná formace má charakteristické zobrazení s jasnými echogenními ohnisky způsobenými kalcifikací [26,27].
Velká kalcifikující buněčná formace je diagnostikována u mladších mužů a je spojena s genetickými syndromy (Carneyho syndromem [28] a Peutzovým-Jeghersovým syndromem [29]) nebo v asi 40 % případů endokrinními poruchami. 44 % je bilaterální, synchronní nebo metachronní a 28 % vykazuje multifokalitu [21].
Charakteristika metastazujících tumorů byla uvedena v předchozím textu [21,22]. Avšak u pacientů, u nichž byly tumory histopatologicky klasifikovány pomocí této nebo podobné charakteristiky jako „maligní“ (tj. 18,8 % tumorů ve všech zaznamenaných studiích), pouze u 7 % došlo během sledování k metastazujícímu onemocnění.
V největších souborech s nejdelší dobou sledování bylo 7,5 % pacientů při primární diagnóze klasifikováno jako „maligní“ a u 11,7 % se prokázalo během dlouhodobého sledování metastazující onemocnění [4]. Obecně jsou postižení pacienti starší, tumory jsou téměř vždy hmatné a vykazují více než jeden znak malignity [4].
Až 20 % velkých sklerotizujících buněčných formací je maligních. Rozlišení mezi časnou a pozdní dobou nástupu může sloužit jako vodítko pro určení různého rizika vzniku metastáz (5,5 % ve srovnání s 23 %) [19]. Metastázy se u neběžného sklerotizujícího podtypu vyskytují vzácně.
8.5.4 Léčba
Testikulární tumory o malém objemu, jinak asymptomatické, jsou často mylně považovány za tumory ze zárodečných buněk a provádí se ingvinální orchidektomie. Dokud není k dispozici konečné histologické vyšetření, doporučuje se u malých intraparenchymatózních testikulárních lézí pokračovat v léčbě orgány-šetřícím přístupem. Zejména u pacientů se symptomy gynekomastie nebo hormonálními poruchami nebo typickým obrazem na ultrazvukovém vyšetření (kalcifikace, malé ohraničené tumory) by měla být zvážena orgán-šetřící operace. Pokud konečné patologické vyšetření odhalí tumor ne ze stromatu (např. ze zárodečných buněk), měla by být zvážena sekundární orchidektomie. Orgány-šetřící operační přístup je oprávněn, pokud je zbývající testikulární parenchym a dostačující pro endokrinní (a u některých tumorů ze stromatu taky exokrinní) funkci.
U tumorů s histologickými známkami malignity, zejména u starších pacientů se doporučuje pro prevenci vzniku metastáz provádět orchidektomii a retroperitoneální lymfadenektomii [18]. Pokud nejsou přítomny známky ukazující na malignitu, doporučuje se po orchidektomii individuální strategie pozorování (CT může být nejvhodnějším vyšetřením, vzhledem k tomu, že nejsou k dispozici specifické tumorové markery). Tumory metastazující do lymfatických uzlin, plic nebo skeletu špatně reagují na chemoterapii nebo radiaci a doba přežití je krátká.
8.5.5 Sledování
Vzhledem k nedostatku údajů týkajících se sledování ve většině zaznamenaných publikací a letalitě metastazujících tumorů, bez ohledu na zvolenou terapii, nelze doporučit jako terapeutický postup sledování.
8.6 Tumor z granulomatózních buněk
Tumor z granulomatózních buněk je velmi vzácně se vyskytující tumor, který má 2 varianty - juvenilní a u dospělých.
Juvenilní tumor z granulomatózních buněk je benigní. Je to nejčastěji se vyskytující kongenitální testikulární tumor a představuje 6,6 % všech předpubertálních testikulárních neoplazmat. Pro tento druh tumoru je charakteristický cystický vzhled [30].
U tumoru vyskytujícího se u dospělých je průměrný věk při manifestaci 44 let. Typická morfologie je homogenní, žlutošedý tumor s prodlouženými buňkami se žlábky v mikrofolikulárním uspořádání a Callovými-Exnerovými tělísky.
Maligní tumory tvoří asi 20 % všech případů. Mají obvykle více než 7 cm v průměru. Vaskulární invaze a nekróza ukazují na maligní povahu [31].
8.7 Skupina tumorů z thekálních buněk/fibromu
Tyto tumory se vyskytují velmi vzácně a jsou benigní (7).
8.8 Jiné tumory ze semenného provazce/gonadálního stromatu
Tumory ze semenného provazce/gonadálního stromatu mohou být neúplně diferencovány nebo mohou mít smíšené formy.
Máme pouze malou zkušenost s neúplně diferencovanými tumory ze semenného provazce/gonadálního stromatu a žádné případy s výskytem metastáz [7]. U smíšených tumorů by měly být zaznamenány všechny histologické komponenty. Avšak klinické chování pravděpodobně odráží převládající druh nejagresivnější komponenty tumoru [32].
8.9 Tumory obsahující zárodečné buňky a tumory ze semenného provazce/ gonadálního stromatu (gonadoblastom)
Pokud je uspořádání zárodečných buněk charakteru hnízda a zbytek tumoru je tvořen ze semenného provazce/gonadálního stromatu, užívá se termínu gonadoblastom. Je to nejčastější gonadální dysgeneze u nerozlišeného genitálu. Bilaterální tumory jsou přítomny ve 40 % případů. Prognóza souvisí s invazivním růstem germinálních komponent [33].
V případě difuzního uspořádání různých komponent jsou zde jisté pochyby o neoplastické povaze germinálních buněk a někteří autoři je považují spíše za „entrapped“ než neoplazmatické [34].
8.10 Různé tumory varlete
8.10.1 Tumory typu ovariálního epitelu
Tento tumor připomíná epiteliální tumor vaječníku. Lze pozorovat cystický vzhled s občasným mucinózním materiálem. Mikroskopicky je identický svému protějšku vznikajícímu ve vaječníku a jeho vývoj je podobný jako u různých podtypů tumoru vaječníku. Některé Brenerovy varianty mohou být maligní [7].
8.10.2 Tumory vývodných kanálků a rete testis
Tyto tumory se vyskytují velmi vzácně. Byly zaznamenány benigní (adenom) a maligní (adenokarcinom), přitom maligní tumory vykazující lokální růst s procentem mortality 56 % [17].
8.10.3 Tumory (benigní a maligní) nespecifického stromatu
Tyto tumory jsou velmi neobvyklé a mají podobná kritéria, prognózu a léčbu jako sarkomy měkké tkáně.
9. LITERATURA
9.1 Germ cell tumours
1. Richie JP. Neoplasms of the testis. In: Walsh PC et al, editors. Campbells urology. 7th ed. Philadelphia:
WB Saunders, 1997, pp 2411-2452.
2. Huyghe E, Matsuda T, Thonneau P. Increasing incidence of testicular cancer worldwide: a review. J Urol 2003;170 : 5-11. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12796635&dopt=Abstract
3. McGlynn KA, Devesa SS, Sigurdson AJ, Brown LM, Tsao L, Tarone RE. Trends in the incidence of testicular germ cell tumors in the United States. Cancer 2003;97 : 63-70. EBM III-IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12491506&dopt=Abstract
4. Bosl GJ, Motzer RJ. Testicular germ-cell cancer. N Engl J Med 1997;337 : 242-253.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9227931&dopt=Abstract
5. Von der Maase H, Rorth M, Walbom-Jorgensen S, Sorensen BL, Christophersen IS, Hald T, Jacobsen
GK, Berthelsen JG, Skakkebaek NE. Carcinoma-in-situ of contralateral testis in patients with testicular germ cell cancer: study of 27 cases in 500 patients. BMJ 1986;293 : 1398-1401. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3026550&dopt= Abstract
6. Giwercman A, Bruun E, Frimotd-Muller C, Skakkebaek NE. Prevalence of carcinoma in situ and other histopathological abnormalities in testes of men with a history of cryptorchidism. J Urol 1989;142 : 998 - 1002. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2571738&dopt=Abstract
7. Dieckmann KP, Loy V. Prevalence of contralatral testicular intraepithelial neoplasia in patients with testicular germ cell neoplasm. J Clin Oncol 1996;14 : 3126-3132. EBM IIa-IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8955658&dopt=Abstract
8. Osterlind A, Berthelsen JG, Abildgaard N, Hansen SO, Hjalgrim H, Johansen B, Munck-Hansen J, Rassmussen LH. Risk of bilateral testicular germ cell tumors in Denmark: 1960-1984. J Natl Cancer Inst 1991;83 : 1391-1395. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1656057&dopt=Abstract
9. Moller H, Prener A, Skakkebaek NE. Testicular cancer, cryptorchidism, inguinal hernia, testicular atrophy and genital malformations: case-control studies in Denmark. Cancer Causes Control 1996;7 : 264-274. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8740739&dopt=Abstract
10. Dieckmann KP, Pichlmeier U. The prevalence of familial testicular cancer. Cancer 1997;80 : 1954-1960. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9366298&dopt=Abstract
11. Forman D, Oliver RT, Brett AR, Marsh SG, Moses JH, Bodmer JG, Chilvers CE, Pike MC. Familial testicular cancer: a report of the UK family register, estimation of risk and a HLA class 1 sib-pair analysis. Br J Cancer 1992;65 : 255-262. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1739626&dopt=Abstract
12. Westergaard T, Olsen JH, Frisch M, Kroman N, Nielsen JW, Melbye M. Cancer risk in fathers and brothers of testicular cancer patients in Denmark. A population based study. Int J Cancer 1996;66 : 627-631. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8647624&dopt=Abstract
13. Jones A, Fergus JN,Chapman J, Houghton L. Is surveillance for stage I germ cell tumours of the testis appropiate outside a specialist centre? BJU Int 1999;84 : 79-84. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10444129&dopt=Abstract
14. Collette L, Sylvester RJ, Stenning SP, Fossa SD, Mead GM, de Wit R, de Mulder PH, Neymark N, Lallemand E, Kaye SB. Impact of the treating institution on survival of patients with “poor-prognosis” metastatic non-seminoma. European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Collaborative Group and the Medical Research Council Testicular Working Party. J Natl Cancer Inst 1999;91 : 839-846. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10340903&dopt=Abstract
15. Laguna MP, Pizzocaro G, Klepp O, Algaba F, Kisbenedek L, Leiva O: EAU Working Group on Oncological Urology. EAU guidelines on testicular cancer. Eur Urol 2001;40 : 102-110.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids= 11528185&query_hl=35
16. Schmoll HJ, Souchon R, Krege S, Albers P, Beyer J, Kollmannsberger C, Fossa SD, Skakkebaek NE, de Wit R, Fizazi K, Droz JP, Pizzocaro G, Daugaard G, de Mulder PH, Horwich A, Oliver T, Huddart R, Rosti G, Paz Ares L, Pont O, Hartmann JT, Aass N, Algaba F, Bamberg M, Bodrogi I, Bokemeyer C, Classen J, Clemm S, Culine S, de Wit M, Derigs HG, Dieckmann KP, Flasshove M, Garcia del Muro X, Gerl A, Germa-Lluch JR, Hartmann M, Heidenreich A, Hoeltl W, Joffe J, Jones W, Kaiser G, Klepp O, Kliesch S, Kisbenedek L, Koehrmann KU, Kuczyk M, Laguna MP, Leiva O, Loy V, Mason MD, Mead GM, Mueller RP, Nicolai N, Oosterhof GO, Pottek T, Rick O, Schmidberger H, Sedlmayer F, Siegert W, Studer U, Tjulandin S, von der Maase H, Walz P, Weinknecht S, Weissbach L, Winter E, Wittekind C; European Germ Cell Cancer Consensus Group. European consensus on diagnosis and treatment of germ cell cancer: a report of the European Germ Cell Cancer Consensus Group (EGCCCG). Ann Oncol 2004;15 : 1377-1399.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15319245&query_hl=38
17. Shelley MD, Burgon K, Mason MD. Treatment of testicular germ-cell cancer: a Cochrane evidencebased systematic review. Cancer Treat Rev 2002;28 : 237-253.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12435371&dopt=Abstract
18. Krege S, Souchon R, Schmoll HJ; German Testicular Cancer Study Group. Interdisciplinary consensusvon diagnosis and treatment of testicular germ cell tumors: result of an update conference on evidence-based medicine (EBM). Eur Urol 2001;40 : 372-391.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11713391&dopt=Abstract
19. Deutsche Krebsgesellschaft: [Evidence based guideline for the diagnosis and therapy of testicular tumours (EBM).] In: Souchon R, Schmoll HJ, Krege S, for the German Testicular Cancer Study Group editors. [Quality assurance in oncology 1st ed.] Munich, Berne, Wien, New York: Zuckschwerdt, 2002. [German]
20. The Royal College of Radiologists’ clinical oncology network in partnership with Scottish Intercollegate Network 2000: guidelines on the management of adult testicular germ cell tumours. Clin Oncol 2000;12:S173-S210.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11315727&dopt=Abstract
21. US Department of Health and Human Services. Public Health Service, Agency for Health Care Policy and Research 1992, pp 115-127. http://www.ahrq. gov/clinic/epcindex.htm#methodology
22. Comiter CU, Benson CJ, Capelouto CC, Kantoff P, Shulman L, Richie JP, Loughlin KR. Nonpalpable intratesticular masses detected sonographically. J Urol 1995;154 : 1367-1369. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids= 7658540&query_hl=10
23. Rholl KS, Lee JKT, Ling D, Heiken JP, Glazer HS. MR imaging of the scrotum with a high resolution surface coil. Radiology 1987;163 : 99-103. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3547497&dopt=Abstract
24. [Diagnostics and treatment of testicular germ cell tumours]. Guidelines of the Dutch Urological Society. No 14. [Dutch]
25. Segal R, Lukka H, Klotz LH, Eady A, Bestic N, Johnston M; Cancer Care Ontario Practice Guidelines
Initiative Genitourinary Cancer Disease Site Group. Surveillance programs for early stage nonseminomatous testicular cancer: a practice guideline. Can J Urol 2001;8 : 1184-1192.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11268306&dopt=Abstract
26. Klein EA. Tumor markers in testis cancer. Urol Clin North Am 1993;20 : 67-73.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7679533&dopt=Abstract
27. Javadpour N. The role of biologic markers in testicular cancer. Cancer 1980;45 : 1755-1761.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=6154517&dopt=Abstract
28. Weissbach L. Organ preserving surgery of malignant germ cell tumors. J Urol 1995;153 : 90-93. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7966800&dopt=Abstract
29. Heidenreich A, Weissbach L, Holtl W, Albers P, Kliesch S, Kohrmann KU, Dieckmann KP; German Testicular Cancer Study Group. Organ sparing surgery for malignant germ cell tumor of the testis. J Urol 2001;166 : 2161-2165. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11696727&dopt=Abstract
30. Petersen PM , Giwercman A, Daugaard G, Rorth M, Petersen JH, Skakkebaek NE, Hansen SW, von der Maase H. Effect of graded testicular doses of radiotherapy in patients treated for carcinoma-in-situ in the testis. J Clin Oncol 2002;20 : 1537-1543. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11896102&dopt=Abstract
31. Classen J, Dieckmann K, Bamberg M, Souchon R, Kliesch S, Kuehn M, Loy V; German Testicular Cancer Study Group. Radiotherapy with 16 Gy may fail to eradicate testicular intraepithelial neoplasia: preliminary communication of a dose-reduction trial of the German Testicular Cancer Study Group. Br J Cancer 2003;88 : 828-831. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12644817&query_hl=1
32. WHO histological classification of testis tumours. In: Eble JN, Sauter G, Epstein JI, Sesterhenn IA, editors. Pathology & genetics: tumours of the urinary system and male genital organs. Lyon: IARC Press, 2004, pp 218, 250-262.
33. Leibovitch I, Foster RS, Kopecky KK, Donohue JP. Improved accuracy of computerized tomography based clinical staging in low stage nonseminomatous germ cell cancer using size criteria of retroperitoneal lymph nodes. J Urol 1995;154 : 1759-1763. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7563341&dopt=Abstract
34. Ellis JH, Blies JR, Kopecky KK, Klatte EC, Rowland RG, Donohue JP. Comparison of NMR and CT imaging in the evaluation of metastatic retroperitoneal lymphadenopathy from testicular carcinoma. J Comput Assist Tomogr 1984;8 : 709-719.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=6539790&dopt=Abstract
35. See WA, Hoxie L. Chest staging in testis cancer patients: imaging modality selection based upon risk assessment as determined by abdominal computerized tomography scan results. J Urol 1993; 150 : 874-878. EBM III. http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8345604&dopt=Abstract
36. Cremerius U, Wildberger JE, Borchers H, Zimny M, Jakse G, Gunther RW, Buell U. Does positron emission tomography using 18-fluoro-2-deoxyglucose improve clinical staging of testicular cancer? - results of a study in 50 patients. Urology 1999;54 : 900-904. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10565755&dopt=Abstract
37. Albers P, Bender H, Yilmaz H, Schoeneich G, Biersack HJ, Mueller SC. Positron emission tomography in the clinical staging of patients with stage I and II testicular germ cell tumours. Urology 1999;53 : 808-811. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/ query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10197862&dopt=Abstract
38. De Santis M, Bokemeyer C, Becherer A, Stoiber F, Oechsle K, Kletter K, Dohmen BM, Dittrich C, Pont J. Predictive impact of 2-18fluoro-2-deoxy-D-glucose positron emission tomography for residual postchemotherapy masses in patients with bulky seminoma. J Clin Oncol 2001;19 : 3740-3744. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11533096&dopt=Abstract
39. Spermon JR, De Geus-Oei LF, Kiemeney LA, Witjes JA, Oyen WJ. The role of (18)fluoro-2 - deoxyglucose positron emission tomography in initial staging and re-staging after chemotherapy for testicular germ cell tumours. BJU Int 2002;89 : 549-556. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11942962&dopt=Abstract
40. Sobin LH, Wittekind Ch, editors. UICC: TNM classification of malignant tumours. 6th ed. Wiley-Liss, 2002. www.wiley.com/go/tnm
41. International Germ Cell Cancer Collaborative Group. International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. J Clin Oncol 1997;15 : 594-603. EBM Ia, IIa, IIb, III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9053482&dopt=Abstract
42. Skakkebaek EN. Possible carcinoma-in-situ of the testis. Lancet 1972;2 : 516-517. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=4115573&dopt=Abstract
43. Dieckmann KP, Loy V. Prevalence of contralateral testicular intraepithelial neoplasia in patients with testicular germ cell neoplasms. J Clin Oncol 1996;14 : 3126-3132. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=8955658&query_hl=3
44. Harland SJ, Cook PA, Fossa SD, Horwich A, Mead GM, Parkinson MC, Roberts JT, Stenning SP. Intratubular germ cell neoplasia of contralateral testis in testicular cancer: defining high risk group. J Urol 1998;160 : 1353-1357. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=9751353&query_hl=15.
45. De Santis M, Albrecht W, Holtl W, Pont J. Impact of cytotoxic treatment on long-term fertility in patients with germ-cell cancer. Int J Cancer 1999;83 : 864-865. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10597213&dopt=Abstract
46. Jacobsen KD, Fossa SD, Bjoro TP, Aass N, Heilo A, Stenwig AE. Gonadal function and fertility in patients with bilateral testicular germ cell malignancy. Eur Urol 2002;42 : 229-238. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12234507&dopt=Abstract
47. Kliesch S, Behre HM, Jurgens H, Nieschlag E. Cryopreservation of semen from adolescent patients with malignancies. Med Pediatr Oncol 1996;26 : 20-27. EBM IV.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7494508&dopt=Abstract
48. Giwercman A, von der Maase H, Rorth M, Skakkebaek NE. Semen quality in testicular tumour and CIS in the contralateral testis. Lancet 1993;341 : 384-385. EBM IV.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8094162&dopt=Abstract
49. Kliesch S, Bergmann M, Hertle L, Nieschlag E, Behre HM. Semen parameters and testicular pathology in men with testicular cancer and contralateral carcinoma in situ or bilateral testicular malignancies. Hum Reprod 1997;12 : 2830-2835. EBM IV.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9455863&dopt=Abstract
50. Spermon JR, Kiemeney LA, Meuleman EJ, Ramos L, Wetzels AM, Witjes JA. Fertility in men with testicular germ cell tumors. Fertil Steril 2003; 79(Suppl 3):1543-1549. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12801557&dopt=Abstract
51. Nieschlag E, Behre HM. Pharmacology and clinical use of testosterone. In: Nieschlag E, Behre HM, editors. Testosterone - action, deficiency, substitution. Berlin, Heidelberg, New York: Springer, 1999, pp 92-114. EBM Ib-IV.
52. Zagars GK. Management of stage I seminoma: radiotherapy. In: Horwich A, editor. Testicular cancer: investigation and management. London: Chapman & Hall Medical, 1999, p 99.
53. Fossa SD, Horwich A, Russell JM, Roberts JT, Cullen MH, Hodson NJ, Jones WG, Yosef H, Duchesne GM, Owen JR, Grosch EJ, Chetiyawardana AD, Reed NS, Widmer B, Stenning SP. Optimal planning target volume for stage I testicular seminoma: a Medical Research Council randomized trial. J Clin Oncol 1999;17 : 1146-1154. EBM Ib.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10561173&dopt=Abstract&itool=iconabstr
54. Jones WG, Fossa SD, Mead GM, Roberts JT, Sokal M, Horwich A, Stenning SP. Randomized trial of 30 versus 20 Gy in the adjuvant treatment of stage I testicular seminoma: a report on Medical Research Council Trial TE18, European Organisation of Research and Treatment of Cancer Trial 30942 (ISRCTN18525328). J Clin Oncol 2005;25 : 1200-1208. EBM Ib.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15718317&query_hl=6
55. Melchior D, Hammer P, Fimmers R, Schuller H, Albers P. Long term results and morbidity of paraaortic compared with paraaortic and iliac adjuvant radiation in clinical stage I seminoma. Anticancer Res 2001;21 : 2989-2993. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11712799&dopt=Abstract&itool=iconabstr
56. Livsey JE, Taylor B, Mobarek N, Cooper RA, Carrington B, Logue PJ. Patterns of relapse following radiotherapy for stage I seminoma of the testis: implications for follow-up. Clin Oncol (R Coll Radiol) 2001;13 : 296-300. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11554630&dopt=Abstract&itool=iconabstr
57. Van Leeuwen FE, Stiggelbout AM, van den Belt-Dusebout AW, Noyon R, Eliel MR, van Kerkhoff EH, Delemarre JF, Somers R. Second cancer risk following testicular cancer: a follow-up study of 1909 patients. Clin Oncol 1993;11 : 415-424.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8445415&dopt=Abstract&itool=iconabstr
58. Travis LB, Curtis RE, Storm H, Hall P, Holowaty E, Van Leeuwen FE, Kohler BA, Pukkala E, Lynch CF, Andersson M, Bergfeldt K, Clarke EA, Wiklund T, Stoter G, Gospodarowicz M, Sturgeon J, Fraumeni JF Jr, Boice JD Jr. Risk of second malignant neoplasms among long-term survivors of testicular cancer. J Natl Cancer Inst 1997;89 : 1429-1439. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9326912&dopt=Abstract&itool=iconabstr
59. Zagars GK, Ballo MT, Lee AK, Strom SS. Mortality after cure of testicular seminoma. J Clin Oncol 2004; 22 : 640-647.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=14726503&query_hl=13
60. Horwich A, Bell J. Mortality and cancer incidence following treatment for seminoma of the testis. Radiother Oncol 1994;30 : 193-198. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8209001&dopt=Abstract&itool=iconabstr
61. Sharda N, Kinsella T, Ritter M. Adjuvant radiation versus observation: a cost analysis of alternate management schemes in early stage testicular seminoma. J Clin Oncol 1996;14 : 2933-2939. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8918490&dopt=Abstract&itool=iconabstr
62. Francis R, Bower M, Brunstrom G, Holden L, Newlands ES, Rustin GJS, Seckl MJ. Surveillance for stage I testicular germ cell tumors: results and cost benefit analysis of management options. Eur J Cancer 2000;36 : 1925-1932. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11000572&dopt=Abstract&itool=iconabstr
63. Warde P, Gospodarowicz M, Panzarella T, Catton C, Sturgeon J, Moore M, Jewett M. Issues in the management of stage I testicular seminoma. Int J Radiat Oncol Biol Phys 1997;39:S156.
64. Warde P, Specht L, Horwich A, Oliver T, Panzarella T, Gospodarowicz M, von der Maase H. Prognostic factors for relapse in stage I seminoma managed by surveillance: a pooled analysis. J Clin Oncol 2002;20 : 4448-4452. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12431967&dopt=Abstract
65. Oliver RT, Mason M, von der Maase H et al., on behalf of the MRC Testis Tumor Group and the EORTC GU group. A randomised comparison of single agent carboplatin with radiotherapy in the adjuvant treatment of stage I seminoma of the testis, following orchidectomy: MRC TE19/EORTC 30982. Proc ASCO 2004;23 : 385. Abstract 4517. EBM Ib.
66. Aparicio J, Garcia del Muro X, Maroto P, Paz-Ares L, Alba E, Saenz A, Terrasa J, Barnadas A, Almenar D, Arranz JA, Sanchez M, Fernandez A, Sastre J, Carles J, Dorca J, Guma J, Yuste AL, Germa JR; Spanish Germ Cell Cancer Cooperative Group (GG). Multicenter study evaluating a dual policy of postorchiectomy surveillance and selective adjuvant single-agent carboplatin for patients with clinical stage I seminoma. Ann Oncol 2003;14 : 867-872.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12796024&dopt=Abstract&itool=iconabstr
67. Krege S, Kalund G, Otto T, Goepel M, Rubben H. Phase II study: adjuvant single-agent carboplatin therapy for clinical stage I seminoma. Eur Urol 1997;31 : 405-407. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9187898&dopt=Abstract
68. Dieckmann KP, Krain J, Kuster J, Bruggeboes B. Adjuvant carboplatin treatment for seminoma clinical stage I. J Cancer Res Clin Oncol 1996;122 : 63-66. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=8543595&dopt=Abstract
69. Warszawski N, Schmucking M. Relapses in early-stage testicular seminoma: radiation therapy versus retroperitoneal lymphadenectomy. Scan J Urol Nephrol 1997;31 : 335-339. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9290165&dopt=Abstract&itool=iconabstr
70. Albers P, Siener R, Kliesch S, Weissbach L, Krege S, Sparwasser C, Schulze H, Heidenreich A, de Riese W, Loy V, Bierhoff E, Wittekind C, Fimmers R, Hartmann M; German Testicular Cancer Study Group. Risk factors for relapse in clinical stage I nonseminomatous testicular germ cell tumors: results of the German Testicular Cancer Study Group Trial. J Clin Oncol 2003;21 : 1505-1512. EBM IIa-Ib.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12697874&dopt=Abstract
71. Klepp O, Olsson AM, Henrikson H, Aass N, Dahl O, Stenwig AE, Persson BE, Cavallin-Stahl E, Fossa SD, Wahlqvist L. Prognostic factors in clinical stage I nonseminomatous germ cell tumors of the testis: multivariate analysis of a prospective multicenter study. J Clin Oncol 1990;8 : 509-518. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1689773&dopt=Abstract&itool=iconabstr
72. Freedman LS, Parkinson MC, Jones WG, Oliver RT, Peckham MJ, Read G, Newlands ES, Williams CJ. Histopathology in the prediction of patients with stage I testicular teratoma treated by orchiectomy alone. Lancet 1987;ii:294-298.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2886764&dopt=Abstract&itool=iconabstr
73. Klepp O, Dahl O, Flodgren P, Stierner U, Olsson AM, Oldbring J,Nilsson S, Daehlin L, Tornblom M, Smaland R, Starkhammar H, Abramsson L, Wist E, Raabe N, Edekling T, Cavallin-Stahl E. Risk-adapted treatment of clinical stage 1 non-seminoma testis cancer. Eur J Cancer 1997;33 : 1038-1044. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9376184&dopt=Abstract&itool=iconabstr
74. Kratzik C, Holtl W, Albrecht W et al. Risk adapted management for NSGCT stage I: long-term results of a multicenter study. J Urol 1996;155 : 547A. Abstract.
75. Ondrus D, Matoska J, Belan V. Prognostic factors in clinical stage I nonseminomatous germ cell testicular tumors: rationale for different risk-adapted treatment. Eur Urol 1998;33 : 562-566. EBM IIa,IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9743698&dopt=Abstract&itool=iconabstr
76. Read G, Stenning SP, Cullen MH, Parkinson MC, Horwich A, Kaye SB, Cook PA. Medical Research Council prospective study of surveillance for stage I testicular teratoma. J Clin Oncol 1992;10 : 1762-1768. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1403057&dopt=Abstract&itool=iconabstr
77. Cullen MH, Stenning SP, Parkinson MC, Fossa SD, Kaye SB, Horwich AH, Harland SJ, Williams MV, Jakes R. Short-course adjuvant chemotherapy in high-risk stage I nonseminomatous germ cell tumours of the testis: a Medical Research Council report. J Clin Oncol 1996;14 : 1106-1113. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8648364&dopt=Abstract&itool=iconabstr
78. Oliver RTD, Raja MA, Ong J, Gallagher CJ. Pilot study to evaluate impact of a policy of adjuvant chemotherapy for high risk stage I malignant teratoma on overall relapse rate of stage I cancer patients. J Urol 1992;148 : 1453-1456. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1279211&dopt=Abstract&itool=iconabstr
79. Studer UE, Fey MF, Calderoni A. Adjuvant chemotherapy after orchiectomy in high risk patients with clinical stage I nonseminomatous testicular cancer. Eur Urol 1993;23 : 444-449. EBM IIb. http://www. ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7687549&dopt=Abstract&itool=iconabstr
80. Pont J, Albrecht W, Postner G, Sellner F, Angel K, Holtl W. Adjuvant chemotherapy for high risk clinical stage I nonseminomatous testicular germ cell cancer: long-term results of a prospective trial. J Clin Oncol 1996;14 : 441-448. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8636755&dopt=Abstract&itool=iconabstr
81. Colls BM, Harvey VJ, Skelton L, Frampton CM, Thompson PI, Bennett M, Perez DJ, Dady PJ, Forgeson GV, Kennedy IC. Late results of surveillance of clinical stage I nonseminoma germ cell testicular tumours: 17 years’ experience in a national study in New Zealand. B J Urol Int 1999;83 : 76-82. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10233456&dopt=Abstract&itool=iconabstr
82. Spermon JR, Roeleveld TA, van der Poel HG, Hulsbergen-van de Kaa CA, Ten Bokkel-Huinink WW, van de Vijver M, Witjes JA, Horenblas S. Comparison of surveillance and retroperitoneal lymph node dissection in stage I nonseminomatous germ cell tumors. Urology 2002;59 : 923-929. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12031382&dopt=Abstract&itool=iconabstr
83. Hendry WF, Norman A, Nicholls J, Dearnaley DP, Peckham MJ, Horwich A. Abdominal relapse in stage 1 nonseminomatous germ cell tumours of the testis managed by surveillance or with adjuvant chemotherapy. BJU Int 2000;86 : 89-93. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10886090&dopt=Abstract&itool=iconabstr
84. Lowe BA. Surveillance versus nerve-sparing retroperitoneal lymphadenectomy in stage I germ cell tumors. Urol Clin North Am 1993;20 : 75-83. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8381999&dopt=Abstract
85. Sternberg CN. Role of primary chemotherapy in stage I and low-volume stage II nonseminomatous germ-cell testis tumors. Urol Clin North Am 1993;20 : 93-109. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8382000&dopt=Abstract
86. Gels ME, Hoekstra HJ, Sleijfer DT, Marrink J, de Bruijn HW, Molenaar WM, Freling NJ, Droste JH, Schraffordt Koops H. Detection of recurrence in patients with clinical stage I nonseminomatous testicular germ cell tumors and consequences for further follow-up: a single-center 10-year experience. J Clin Oncol 1995;13 : 1188-1194. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7537802&dopt=Abstract
87. Bohlen D, Borner M, Sonntag RW, Fey MF, Studer UE. Long-term results following adjuvant chemotherapy in patients with clinical stage I testicular nonseminomatous malignant germ cell tumors with high risk factors. J Urol 1999;161 : 1148-1152. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10081858&dopt=Abstract&itool=iconabstr
88. Bohlen D, Burkhard FC, Mills R, Sonntag RW, Studer UE. Fertility and sexual function following orchiectomy and 2 cycles of chemotherapy for stage I high risk nonseminomatous germ cell cancer. J Urol 2001;165 : 441-444. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11176393&dopt=Abstract&itool=iconabstr
89. Pizzocaro G, Salvioni R, Zanoni F. Unilateral lymphadenectomy in intraoperative stage I nonseminomatous testis cancer. J Urol 1985;134 : 485-489. EBM III. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=2993672&dopt=Abstract&itool=iconabstr
90. Donohue JP, Thornhill JA, Foster RS, Rowland RG, Bihrle R. Retroperitoneal lymphadenectomy for clinical stage A testis cancer (1965-1989): modifications of technique and impact on ejaculation. J Urol 1993;149 : 237-243. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8381190&dopt=Abstract&itool=iconabstr
91. Foster RS, Roth BJ. Clinical stage I nonseminoma: surgery versus surveillance. Semin Oncol 1998; 25 : 145-153.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9562447&dopt=Abstract&itool=iconabstr
92. Donohue JP, Thornhill JA, Foster RS, Rowland RG, Bihrle R. Clinical stage B nonseminomatous germ cell testis cancer: the Indiana University experience using routine primary retroperitoneal lymph node dissection. Eur J Cancer 1995;31A:1599-1604. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7488408&dopt=Abstract&itool=iconabstr
93. Richie JP, Kantoff PW. Is adjuvant chemotherapy necessary for patients with stage 1B testicular cancer? J Clin Oncol 1991;9 : 1393-1398.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2072143&dopt=Abstract&itool=iconabstr
94. Pizzocaro G, Monfardini S. No adjuvant chemotherapy in selected patients with pathological stage II nonseminomatous germ cell tumors of the testis. J Urol 1984;131 : 677-680. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=6200611&dopt=Abstract&itool=iconabstr
95. McLeod DG, Weiss RB, Stablein DM, Muggia FM, Paulson DF, Ellis JH, Spaulding JT, Donohue JP. Staging relationships and outcome in early stage testicular cancer: a report from the Testicular Cancer Intergroup Study. J Urol 1991;145 : 1178-1183. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1851890&dopt=Abstract
96. Williams SD, Stablein DM, Einhorn LH, Muggia FM, Weiss RB, Donohue JP, Paulson DF, Brunner KW, Jacobs EM, Spaulding JT. Immediate adjuvant chemotherapy versus observation with treatment at relapse in pathological stage II testicular cancer. N Engl J Med 1987;317 : 1433-1438. EBM Ib.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2446132&dopt=Abstract&itool=iconabstr
97. Heidenreich A, Albers P, Hartmann M, Kliesch S, Kohrmann KU, Krege S, Lossin P, Weissbach L; German Testicular Cancer Study Group. Complications of primary nerve sparing retroperitoneal lymph node dissection for clinical stage I nonseminomatous germ cell tumors of the testis: experience of the German Testicular Cancer Study Group. J Urol 2003;169 : 1710-1714. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12686815&dopt=Abstract&itool=iconabstr
98. Bianci G, Beltrami P, Giusti G. Unilateral laparoscopic lymph node dissection for clinical stage I nonseminomatous germ cell testicular neoplasm. Eur Urol 1998;33 : 190-194. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9519363&dopt=Abstract&itool=iconabstr
99. Rassweiler JJ, Frede T, Lenz E, Seemann O, Alken P. Long-term experience with laparoscopic retroperitoneal lymph node dissection in the management of low-stage testis cancer. Eur Urol 2000;37 : 251-260. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10720848&dopt=Abstract&itool=iconabstr
100. Janetschek G, Hobisch A, Peschel R, Hittmair A, Bartsch G. Laparoscopic retyroperitoneal lymph node dissection for clinical stage I non-seminomatous testicular carcinoma: long-term outcome. J Urol 2000;163 : 1793-1796. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10799184&dopt=Abstract&itool=iconabstr
101. LeBlanc E, Caty A, Dargent D, Querleu D, Mazeman E. Extraperitoneal laparoscopic para-aortic lymph node dissection for early stage nonseminomatous germ cell tumors of the testis with introduction of a nerve sparing technique: description and results. J Urol 2001;165 : 89-92. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11125371&dopt=Abstract&itool=iconabstr
102. Pizzocaro G, Nicolai N, Salvioni R. Marker positive clinical stage I non seminomatous germ cell tumors (NSGCT) of the testis: which primary therapy? J Urol 1996;155(Suppl):328A.
103. Davis BE, Herr HW, Fair WR, Bosl GJ. The management of patients with nonseminomatous germ cell tumors of the testis with serologic disease only after orchiectomy. J Urol 1994;152 : 111-113. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7515445&dopt=Abstract&itool=iconabstr
104. Saxman SB, Nichols CR, Foster RS, Messemer JE, Donohue JP, Einhorn LH. The management of patients with clinical stage I nonseminomatous testicular tumors and persistently elevated serologic markers. J Urol 1996;155 : 587-589. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=8558665&query_hl=13
105. Classen J, Schmidberger H, Meisner C, Souchon R, Sautter-Bihl ML, Sauer R, Weinknecht S. Radiotherapy for stages IIA/B testicular seminoma: final report of a prospective multicenter clinical trial. J Clin Oncol 2003;21 : 1101-1106. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12637477&query_hl=30
106. Warde P, Gospodarowicz M, Panzarella T, Catton C, Sturgeon J, Moore M, Jewett M. Management of stage II seminoma. J Clin Oncol 1998;16 : 290-294.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&d
107. O’Sullivan JM, Huddart RA, Norman AR, Nicholls J, Dearnaley DP, Horwich A. Predicting the risk of bleomycin lung toxicity in patients with germ-cell tumours. Ann Oncol 2003;14 : 91-96.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?CMD=search&DB=pubmed
108. Weissbach L, Bussar-Maatz R, Fletchner H, Pichlmeier U, Hartmann M, Keller L. RPLND or primary chemotherapy in clinical stage IIA/B nonseminomatous germ cell tumors. Results of a prospective multicenter trial including quality of life assessment. Eur Urol 2000;37 : 582-594.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10765098&dopt=Abstract
109. Horwich A, Norman A, Fisher C, Hendry WF, Nicholls J, Dearnaley DP. Primary chemotherapy for stage II nonseminomatous germ cell tumors of the testis. J Urol 1994;151 : 72-77; discussion 77-78.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids= 8254836&query_hl=18
110. Saxman S, Finch D, Gonin R, Einhorn LH. Long-term follow-up of a phase III study of three versus four cycles of bleomycin, etoposide and cisplatin in favorable-prognosis germ-cell tumors: the Indiana University Experience. J Clin Oncol 1998;16 : 702-706. EBM Ib.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9469360&dopt=Abstract
111. De Wit R, Stoter G, Kaye SB, Sleijfer DT, Jones WG, ten Bokkel Huinink WW, Rea LA, Collette L, Sylvester R. Importance of bleomycin in combination chemotherapy for good-prognosis testicular nonseminoma: a randomized study of the European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Cooperative Group. J Clin Oncol 1997;15 : 1837-1843. EBM Ib.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9164193&dopt=Abstract
112. Horwich A, Sleijfer DT, Fossa SD, Kaye SB, Oliver RT, Cullen MH, Mead GM, de Wit R, de Mulder PH, Dearnaley DP, Cook PA, Sylvester RJ, Stenning SP. Randomized trial of bleomycin, etoposide and cisplatin compared with bleomycin, etoposide and carboplatin in good-prognosis metastatic nonseminomatous germ cell cancer: a multi-institutional Medical Research Council/European Organization for Research and Treatment of Cancer trial. J Clin Oncol 1997;15 : 1844-1852. EBM Ib.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9164194&dopt=Abstract
113. De Wit R, Roberts JT, Wilkinson PM, de Mulder PH, Mead GM, Fossa SD, Cook P, de Pryck L, Stenning S, Collette L. Equivalence of three or four cycles of bleomycin, etoposide, and cisplatin chemotherapy and of a 3 - or 5-day schedule in good-prognosis germ cell cancer: a randomized study of the European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Cooperative Group and the Medical Research Council. J Clin Oncol 2001;19 : 1629-1640. EBM Ib. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11250991&dopt =Abstract
114. Xiao H, Mazumdar M, Bajorin DF, Sarosdy M, Vlamis V, Spicer J, Ferrara J, Bosl GJ, Motzer RJ. Longterm follow-up of patients with good-risk germ cell tumors treated with etoposide and cisplatin. J Clin Oncol 1997;15 : 2553-2558. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9215824&dopt=Abstract
115. Fossa SD, Kaye SB, Mead GM, Cullen M, de Wit R, Bodrogi I, van Groeningen CJ, de Mulder PH, Stenning S, Lallemand E, de Pryck L, Collette L. Filgastrim during combination chemotherapy of patients with poor prognosis metastatic germ cell malignancy. European Organization for Research and Treatment of Cancer, Genito-Urinary Group, and the Medical Research Council Testicular Cancer Working Party. J Clin Oncol 1998;16 : 716-724. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9469362&dopt=Abstract
116. Bokemeyer C, Kuczyk MA, Köhne H, Einsele H, Kynast B, Schmoll HJ. Hematopoetic growth factors and treatment of testicular cancer: biological interactions, routine use and dose intensive chemotherapy. Ann Hematol 1996;72 : 1-9. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8605273&dopt=Abstract
117. De Wit R, Stoter G, Sleijfer DT, Neijt JP, ten Bokkel Huinink WW, de Pryck L, Collette L, Sylvester R. Four cycles of BEP vs four cycles of VIP in patients with intermediate-prognosis metastatic testicular non-seminoma: a randomized study of the EORTC Genitourinary Tract Cancer Cooperative Group. European Organization for Research and Treatment of Cancer. Br J Cancer 1998;78 : 828-832. EBM Ib.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9743309&dopt=Abstract
118. De Wit R, Louwerens M, de Mulder PH, Verweij J, Rodenhuis S, Schornagel J. Management of intermediate-prognosis germ-cell cancer: results of a phase I/II study of Taxol-BEP. Int J Cancer 1999;83 : 831-833. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10597204&dopt=Abstract
119. Nichols CR, Catalano PJ, Crawford ED, Vogelzang NJ, Einhorn LH, Loehrer PJ. Randomized comparison of cisplatin and etoposide and either bleomycin or ifosfamide in treatment of advanced disseminated germ cell tumors: an Eastern Cooperative Oncology Group, Southwest Oncology Group, and Cancer and Leukaemia Group B Study. J Clin Oncol 1998;16 : 1287-1293. EBM Ib.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9552027&dopt=Abstract
120. Motzer RJ, Mazumdar M, Bajorin DF, Bosl GJ, Lyn P, Vlamis V. High-dose carboplatin, etoposide, and cyclophosphamide with autologous bone marrow transplantation in first-line therapy for patients with poor-risk germ cell tumors. J Clin Oncol 1997;15 : 2546-2552. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9215823&dopt=Abstract
121. Bokemeyer C, Kollmannsberger C, Meisner C, Harstrick A, Beyer J, Metzner B, Hartmann JT, Schmoll HJ, Einhorn L, Kanz L, Nichols C. First-line high-dose chemotherapy compared with standard-dose PEB/VIP chemotherapy in patients with advanced germ cell tumors: a multivariate and matched-pair analysis. J Clin Oncol 1999;17 : 3450-3456. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10550141&dopt=Abstract
122. Kaye SB, Mead GM, Fossa SD, Cullen M, de Wit R, Bodrogi I, van Groeningen C, Sylvester R, Collette L, Stenning S, de Pryck L, Lallemand E, de Mulder P. Intensive induction-sequential chemotherapy with BOP/VIP-B compared with treatment with BEP/EP for poor prognosis metastatic germ cell tumor: a randomized Medical Research Council/European Organization for Research and Treatment of Cancer study. J Clin Oncol 1998;16 : 692-701. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9469359&dopt=Abstract
123. Gerl A, Clemm C, Lamerz R, Mann K, Wilmanns W. Prognostic implications of tumor marker analysis in non-seminomatous germ cell tumours with poor prognosis metastatic disease. Eur J Cancer 1993; 29A:961-965. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7684597&dopt=Abstract
124. Murphy BA, Motzer RJ, Mazumdar M, Vlamis V, Nisselbaum J, Bajorin D, Bosl GJ. Serum tumor markers decline is an early predictor of treatment outcome in germ cell tumor patients treated with cisplatin and ifosfamide salvage chemotherapy. Cancer 1994;73 : 2520-2526. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7513603&dopt=Abstract
125. Andre F, Fizazi K, Culine S, Droz J, Taupin P, Lhomme C, Terrier-Lacombe M, Theodore C. The growing teratoma syndrome: results of therapy and long-term follow-up of 33 patients. Eur J Cancer 2000; 36 : 1389-1394. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10899652&dopt=Abstract
126. De Wit R, Collette L, Sylvester R, de Mulder PH, Sleyfer DT, ten Bokkel Huinink WW, Kaye SB, van Oosterom AT, Boven E, Stoter G. Serum alpha-fetoprotein surge after the initiation of chemotherapy for non-seminomatous testicular cancer has an adverse prognostic significance. Br J Cancer 1998;78 : 1350-1355. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9823978&dopt=Abstract
127. Zon RT, Nichols C, Einhorn LH. Management strategies and outcomes of germ cell tumor patients with very high human chorionic gonadotropin levels. J Clin Oncol 1998;16 : 1294-1297. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9552028&dopt=Abstract
128. Fossa AD, Stenning SP, Gerl A, Horwich A, Clark PI, Wilkinson PM, Jones WG, Williams MV, Oliver RT, Newlands ES, Mead GM, Cullen MH, Kaye SB, Rustin GJ, Cook PA. Prognostic factors in patients progressing after cisplatin-based chemotherapy for malignant non-seminomatous germ cell tumours. Br J Cancer 1999;80 : 1392-1399. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10424741&dopt=Abstract
129. Herr HW, Bosl G. Residual mass after chemotherapy for seminoma: changing concepts of management. J Urol 1987;137 : 1234-1235. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2438431&dopt=Abstract
130. Loehrer PJ Sr, Birch R, Williams SD, Greco FA, Einhorn LH. Chemotherapy of metastatic seminoma: the SouthEastern Cancer Study Group Experience. J Clin Oncol 1997;15 : 1212-1220. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2442317&dopt=Abstract
131. Motzer R, Bosl G, Heelan R, Fair W, Whitmore W, Sogani P, Herr H, Morse M. Residual mass: an indication for further therapy in patients with advanced seminoma following systemic chemotherapy. J Clin Oncol 1987;5 : 1064-1070. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3598610&dopt=Abstract
132. Peckham MJ, Horwich A, Hendry WF. Advanced seminoma treatment with cisplatinum based combination chemotherapy or carboplatin (JM8). Br J Cancer 1985;52 : 7-13. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3893507&dopt=Abstract
133. Duchesne GM,Stenning SP, Aass N, Mead GM, Fossa SD, Oliver RT, Horwich A, Read G, Roberts IT, Rustin G, Cullen MH, Kaye SB, Harland SJ, Cook PA. Radiotherapy after chemotherapy for metastatic seminoma - a diminishing role. Eur J Cancer 1997;33 : 829-835. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9291801&dopt=Abstract
134. Mosharafa AA. Foster RS, Leibovich BC, Bihrle R, Donahue JP. Is the post-chemotherapy resection of seminomatous elements associated with higher acute morbidity? J Urol 2002;167 : 172. Abstract 692. EBM III.
135. De Santis M, Becherer A, Bokemeyer C, Stoiber F, Oechsle K, Sellner F, Lang A, Kletter K, Dohmen BM, Dittrich C, Pont J. 2-18fluoro-deoxy-D-glucose positron emission tomography is a reliable predictor for viable tumor in postchemotherapy seminoma: an update of the prospective multicentric SEMPET trial. J Clin Oncol 2004; 22 : 1034-1039. EBM IIb.
136. Becherer A, Santis MD, Karanikas G, Szabo M, Bokemeyer C, Dohmen BM, Pont J, Dudczak R, Dittrich C, Kletter K. FDG PET is superior to CT in the prediction of viable tumour in postchemotherapy seminoma residuals. Eur J Radiol 2005;54 : 284-288. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids= 15837411&query_hl=8
137. Fossa SD, Ous S, Lien HH, Stenwig AE. Post-chemotherapy lymph node histology in radiologically normal patients with metastatic nonseminomatous testicular cancer. J Urol 1989;141 : 557-559. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2918591&dopt=Abstract
138. Toner GC, Panicek DM, Heelan RT, Geller NL, Lin SY, Bajorin D, Motzer RJ, Scher HI, Herr HW, Morse MJ et al. Adjunctive surgery after chemotherapy for nonseminomatous germ cell tumors: recommendations for patient selection. J Clin Oncol 1990;8 : 1683-1694. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2170590&dopt=Abstract
139. Donohue JP, Rowland RG, Kopecky K, Steidle CP, Geier G, Ney KG, Einhorn L, Williams S, Loehrer P. Correlation of computerized tomographic changes and histological findings in 80 patients having radical retroperitoneal lymph node dissection after chemotherapy for testis cancer. J Urol 1987;137 : 1176-1179. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3035236&dopt=Abstract
140. Richie JP. The surgical management of advanced abdominal disease. Semin Urol 1984;2 : 238-243.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=6505446&dopt=Abstract
141. Stomper PC, Fung CY, Socinski MA, Jochelson MS, Garnick MB, Richie JP. Detection of retroperitoneal metastases in early-stage nonseminomatous testicular cancer: analysis of different CT criteria. Am J Roentgenol 1987;149 : 1187-1190. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2825494&dopt=Abstract
142. Aprikian AG, Herr HW, Bajorin DF, Bosl GJ. Resection of post-chemotherapy residual masses and limited retroperitoneal lymphadenectomy in patients with metastatic testicular nonseminomatous germ cell tumors. Cancer 1994;74 : 1329-1334. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8055456&dopt=Abstract
143. Herr HW. Does necrosis on frozen-section analysis of a mass after chemotherapy justify a limited retroperitoneal resection in patients with advanced testis cancer? Br J Urol 1997;80 : 653-657. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9352708&dopt=Abstract
144. Hendry WF, A’Hern RP, Hetherington JW, Peckham MJ, Dearnaley DP, Horwich A. Para-aortic lymphadenectomy after chemotherapy for metastatic non-seminomatous germ cell tumors: prognostic value and therapeutic benefit. Br J Urol 1993;71 : 208-213.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8384914&dopt=Abstract
145. Wood DP, Herr HW, Heller G, Vlamis V, Sogani PC, Motzer RJ, Fair WR, Bosl GJ. Distribution of retroperitoneal metastases after chemotherapy in patients with nonseminomatous germ cell tumors. J Urol 1992;148 : 1812-1815. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1331547&dopt=Abstract
146. Baniel J, Foster RS, Rowland RG, Bihrle R, Donohue JP. Complications of post-chemotherapy retroperitoneal lymph node dissection. J Urol 1995;153 : 976-980. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7853586&dopt=Abstract
147. Hartmann JT, Schmoll HJ, Kuczyk MA, Candelaria M, Bokemeyer C. Post-chemotherapy resection of residual masses from metastatic non-seminomatous germ cell tumors. Ann Oncol 1997;8 : 531-538.
EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9261521&dopt=Abstract
148. Rabbani F, Goldenberg SL, Gleave ME, Paterson RF, Murray N, Sullivan LD. Retroperitoneal lymphadenectomy for post-chemotherapy residual masses: is a modified dissection and resection of the residual mass sufficient? Br J Urol 1998;81 : 295-300. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9488075&dopt=Abstract
149. Tekgul S, Özen HA, Celebi I, Ozgu I, Ergen A, Demircin M, Remzi D. Postchemotherapeutic surgery for metastatic testicular germ cell tumors: results of extended primary chemotherapy and limited surgery. Urology 1994;43 : 349-354. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8134989&dopt=Abstract
150. Steyerberg EW, Keizer HJ, Fossa SD, Sleijfer DT, Toner GC, Schraffordt Koops H, Mulders PF, Messemer JE, Ney K, Donohue JP et al. Prediction of residual retroperitoneal mass histology after chemotherapy for metastatic nonseminomatous germ cell tumor: multivariate analysis of individual patient data from six study groups. J Clin Oncol 1995;13 : 1177-1187. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7537801&dopt=Abstract
151. Hartmann JT, Candelaria M, Kuczyk MA, Schmoll HJ, Bokemeyer C. Comparison of histological results from the resection of residual masses at different sites after chemotherapy for metastatic nonseminomatous germ cell tumours. Eur J Cancer 1997;33 : 843-847. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9291803&dopt=Abstract
152. Stenning SP, Parkinson MC, Fisher C, Mead GN, Cook PA, Fossa SD, Horwich A, Jones WG, Newlands ES, Oliver RT, Stenwig AE, Wilkinson PM. Post-chemotherapy residual masses in germ cell tumor patients: content, clinical features and prognosis. Medical Research Council Testicular Tumour Working Party. Cancer 1998;83 : 1409-1419. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9762943&dopt=Abstract
153. Albers P, Weissbach L, Krege S, Kliesch S, Hartmann M, Heidenreich A, Walz P, Kuczyk M, Fimmers R. Prediction of necrosis after chemotherapy of advanced germ cell tumors: results of a prospective multicenter trial of the German Testicular Germ Cell Group. J Urol 2004;171 : 1835-1838. EBM IIb.
154. Hendry WF, Norman AR, Dearnaley DP, Fisher C, Nicholls J, Huddart RA, Horwich A. Metastatic nonseminomatous germ cell tumors of the testis: results of elective and salvage surgery for patients with residual retroperitoneal masses. Cancer 2002;94 : 1668-1676. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11920527&dopt=Abstract
155. Sheinfeld J. The role of adjunctive post-chemotherapy surgery for nonseminomatous germ-cell tumors: current concepts and controversies. Sem Urol Oncol 2002;20 : 262-271. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12489059&dopt=Abstract
156. Foster RS, Donohue JP. Can retroperitoneal lymphadenectomy be omitted in some patients after chemotherapy? Urol Clin North Am 1998;25 : 479-484. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9728217&dopt=Abstract
157. Steyerberg EW, Kaiser HJ, Habbema JD. Prediction models of the histology of residual masses after chemotherapy for metastatic testicular cancer. ReHiT Study Group. Int J Cancer 1999;83 : 856-859. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10597211&dopt=Abstract
158. Vergouwe Y, Steyerbeg EW, De Wit R, Roberts JT, Keizer HJ, Collette L, Stenning SP, Habbema JD. External validity of a prediction rule for residual mass histology in testicular cancer: an evaluation for good prognosis patients. Br J Cancer 2003;88 : 843-847. EBM III. http://www.ncbi.nlm.nih.gov/entrez/query. fcgi?cmd=Retrieve&db=PubMed&list_uids=12644820&dopt=Abstract
159. Fizazi K, Tjulandin S, Salvioni R, Germa-Lluch JR, Bouzy J, Ragan D, Bokemeyer C, Gerl A, Flechon A, de Bono JS, Stenning S, Horwich A, Pont J, Albers P, De Giorgi U, Bower M, Bulanov A, Pizzocaro G, Aparicio J, Nichols CR, Theodore C, Hartmann JT, Schmoll HJ, Kaye SB, Culine S, Droz JP, Mahe C. Viable malignant cells after primary chemotherapy for disseminated nonseminomatous germ cell tumors: prognostic factors and role of postsurgery chemotherapy - results from an international study group. J Clin Oncol 2001;19 : 2647-2657. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11352956&dopt=Abstract
160. Miller KD, Loehrer PJ, Gonin R, Einhorn LH. Salvage chemotherapy with vinblastine, ifosfamide and cisplatin in recurrent seminoma. J Clin Oncol 1997;15 : 1427-1431. EBM IIb. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9193335&dopt=Abstract
161. Loehrer PJ, Gonin R, Nichols CR, Weathers T, Einhorn LH. Vinblastine plus ifosfamide plus cisplatin as initial salvage therapy in recurrent germ cell tumor. J Clin Oncol 1998;16 : 2500-2504. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9667270&dopt=Abstract
162. Beyer J, Rick O, Siegert W, Bokemeyer C. Salvage chemotherapy in relapsed germ cell tumors. World J Urol 2001;19 : 90-93. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11374323&dopt=Abstract
163. Schmoll HJ, Beyer J. Prognostic factors in metastatic germ cell tumors. Semin Oncol 1998;25 : 174 - 185. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9562450&dopt=Abstract
164. Beyer J, Stenning S, Gerl A, Fossa S, Siegert W. High-dose versus conventional-dose chemotherapy as a first-salvage treatment in patients with non-seminomatous germ-cell tumors: a matched pair analysis. Ann Oncol 2002;13 : 599-605. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12056711&dopt=Abstract
165. Bhatia S, Abonour R, Porcu P, Seshadri R, Nichols CR, Cornetta K, Einhorn LH. High-dose chemotherapy as inital salvage chemotherapy in patients with relapsed testicular cancer. J Clin Oncol 2000;18 : 3346-3351. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11013274&dopt=Abstract
166. Rosti G, Pico JL, Wandt H et al. High-dose chemotherapy (HDC) in the salvage treatment of patients failing first-line platinum chemotherapy for advanced germ cell tumors (GCT): first results of a prospective randomised trial of the European Group for Blood and Marrow Transplantation (EBMT): IT-94 study. Proc ASCO 2002;21 : 180a. Abstract 716. EBM Ib.
167. Motzer JR, Sheinfeld J, Mazumdar M, Bains M, Mariani T, Bacik J, Bajorin D, Bosl GJ. Paclitaxel, ifosfamide, and cisplatin second-line therapy for patients with relapsed testicular germ cell cancer. J Clin Oncol 2000;18 : 2413-2418. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10856101&dopt=Abstract
168. Bokemeyer C, Gerl A, Schoffski P, Harstrick A, Niederle N, Beyer J, Casper J, Schmoll HJ, Kanz L. Gemcitabine in patients with relapse or cisplatin refractory testicular cancer. J Clin Oncol 1999;17 : 512-516. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10080593&dopt=Abstract
169. Kollmannsberger C, Beyer J, Liersch R, Schoeffski P, Metzner B, Hartmann JT, Rick O, Stengele K, Hohloch K, Spott C, Kanz L, Bokemeyer C. Combination chemotherapy with gemcitabine plus oxaliplatin in patients with intensively pretreated or refractory germ cell cancer: a study of the German Testicular Cancer Study Group. J Clin Oncol 2004;22 : 108-114. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=14701772&query_hl=47
170. Fox EP, Weathers TS, Williams SD, Loehrer PJ, Ulbright TM, Donohue JP, Einhorn LH. Outcome analysis for patients with persistent nonteratomatous germ cell tumor in postchemotherapy retroperitoneal lymph node dissections. J Clin Oncol 1993;11 : 1294-1299. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8391067&dopt=Abstract
171. Gerl A, Clemm C, Schmeller N, Dienemann H, Lamerz R, Kriegmair M, Wilmanns W. Outcome analysis after post-chemotherapy surgery in patients with non-seminomatous germ cell tumors. Ann Oncol 1995;6 : 483-488. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7545430&dopt=Abstract
172. Hollender A, Stenwig EA, Ous S, Fossa SD. Survival of patients with viable malignant nonseminomatous germ cell tumor persistent after cisplatin-based induction chemotherapy. Eur Urol 1997;31 : 1 41-147. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9076455&dopt=Abstract
173. Pizzocaro G, Nicolai N, Milani A. Is further chemotherapy necessary in radically resected residual cancer in non-seminomatous germ cell tumors (NSGCT) of the testis following induction chemotherapy? Proc ASCO 1998;17 : 309a. Abstract 1191.
174. Coogan CL, Foster RS, Rowland RG, Bihrle R, Smith ER Jr, Einhorn LH, Roth BJ, Donohue JP. Postchemotherapy retroperitoneal lymph node dissection is effective therapy in selected patients with elevated tumor markers after primary chemotherapy alone. Urology 1997;50 : 957-962. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9426730&dopt=Abstract
175. Eastham JA, Wilson TG, Russell C, Ahlering TE, Skinner DG. Surgical resection in patients with nonseminomatous germ cell tumor who fail to normalize serum tumor markers after chemotherapy. Urology 1994;43 : 74-80. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7506856&dopt=Abstract
176. Kisbenedek L, Bodrogi I, Szeldeli P, Baki M, Tenke P, Horti J. Results of salvage retroperitoneal lymphadenectomy (RLA) in the treatment of patients with nonseminomatous germ cell tumors remaining marker positive after inductive chemotherapy. Int Urol Nephrol 1995;27 : 325-329. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7591598&dopt=Abstract
177. Murphy BR, Breeden ES, Donohue JP, Messemer J, Walsh W, Roth BJ, Einhorn LH. Surgical salvage of chemorefractory germ cell tumors. J Clin Oncol 1993;11 : 324-329. EBM III. http://www.ncbi.nlm. nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8381163&dopt=Abstract
178. Ravi R, Ong J, Oliver RT, Badenoch DF, Fowler CG, Hendry WF. Surgery as salvage therapy in chemotherapy-resistant nonseminomatous germ cell tumors. Br J Urol 1998;81 : 884-888. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9666776&dopt=Abstract
179. Albers P. Ganz A, Hanning E, Miersch WD, Muller SC. Salvage surgery of chemorefractory germ cell tumors with elevated tumor markers. J Urol 2000; 164 : 381-384. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10893590&dopt=Abstract
180. Fossa SD, Bokemeyer C, Gerl A, Culine S, Jones WG, Mead GM, Germa-Luch JR, Pont J, Schmoll HJ, Tjulandin S. Treatment outcome of patients with brain metastases from malignant germ cell tumors. Cancer 1999;85 : 988-997. EBM IIa.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10091779&dopt=Abstract
181. Bokemeyer C, Nowak P, Haupt A, Metzner B, Kohne H, Hartmann JT, Kanz L, Schmoll HJ. Treatment of brain metastases in patients with testicular cancer. J Clin Oncol 1997;15 : 1449-1454. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9193339&dopt=Abstract
182. Hartmann JT, Bamberg M, Albers P et al. Multidiciplinary treatment and prognosis of patients with central nervous metastases (CNS) from testicular germ cell tumor (GCT) origin. Proc ASCO 2003;22 : 400. Abstract 1607. EBM III.
183. Edelman MJ, Meyers FJ, Siegel D. The utility of follow-up testing after curative cancer therapy. JGIM 1997;12 : 318-331.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9159703&dopt=Abstract
184. Gerl A, Clemm C, Schmeller N, Hentrich M, Lamerz R, Wilmanns W. Late relapse of germ cell tumors after cisplatin-based chemotherapy. Ann Oncol 1997;8 : 41-47. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9093706&dopt=Abstract
185. Baniel J, Foster RS, Einhorn LH, Donohue JP. Late relapse of clinical stage I testicular cancer. J Urol 1995;154 : 1370-1372. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7658541&dopt=Abstract
186. George DW, Foster RS, Hromas RA, Robertson KA, Vance GH, Ulbright TM, Gobbett TA, Heiber DJ, Heerema NA, Ramsey HC, Thurston VC, Jung SH, Shen J, Finch DE, Kelley MR, Einhorn LH. Update on late relapse of germ cell tumor: a clinical and molecular analysis. J Clin Oncol 2003;21 : 113-122. EBM III.
187. Dieckmann KP, Albers P, Classen J, De Wit M, Pichlmeier U, Rick O, Müllerleile U, Kuczyk M. Late relapse of testicular germ cell neoplasms: a descriptive analysis of 122 cases. J Urol 2005;173 : 824-829.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids= 15711278&query_hl=52
188. Gietema JA, Meinardi MT, Sleifer DT, Hoekstra HJ, van der Graaf WT. Routine chest X-rays have no additional value in the detection of relapse during routine follow-up of patients treated with chemotherapy for disseminated non-seminomatous testicular cancer. Ann Oncol 2002;13 : 1616-1620. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12377651&dopt=Abstract
189. McCaffrey JA, Bajorin DF, Motzer RJ. Risk assessment for metastatic testis cancer. Urol Clin North Am 1998;25 : 389-395.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9728209&dopt=Abstract
190. Rabbani F, Sheinfeld J, Farivar-Mohseni H, Leon A, Rentzepis MJ, Reuter VE, Herr HW, McCaffrey JA, Motzer RJ, Bajorin DF, Bosl GJ. Low-volume nodal metastases detected at retroperitoneal lymphadenectomy for testicular cancer: pattern and prognostic factors for relapse. J Clin Oncol 2001;19 : 2020-2025. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids= 11283135&query_hl=12
191. Travis LB, Fossa SD, Schonfeld SJ, McMaster ML, Lynch CF, Storm H, Hall P, Holowaty E, Andersen A, Pukkala E, Andersson M, Kaijser M, Gospodarowicz M, Joensuu T, Cohen RJ, Boice JD Jr, Dores GM, Gilbert ES. Second cancers among 40,576 testicular cancer patients: focus on long-term survivors. J Natl Cancer Inst. 2005 21;97 : 1354-65.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=16174857&query_hl=4&itool=pubmed_docsum
192. Lashley DB, Lowe BA. A rational approach to managing stage I nonseminomatous germ cell cancer. Urol Clin North Am 1998;25 : 405-423.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9728211&dopt=Abstract&itool=iconabstr
193. Baniel J, Donohue JP. Cost and risk benefit considerations in low stage (I and II) nonseminomatous testicular tumors. AUA Update Series 1997;26 : 50-55.
194. Tjan-Heijnen VCG, Oosterhof GON, de Wit R, de Mulder PHM. Treatment of germ cell tumours: state of the art. Eur J Surg Oncol 1997;23 : 110-117.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9158183&dopt=Abstract
195. Donohue JP, Thornhill JA, Foster RS, Rowland RG, Bihrle R. Primary retroperitoneal lymph node dissection in clinical stage A non-seminomatous germ cell testis cancer: review of the Indiana University Experience 1965-1989. Br J Urol 1993;71 : 326-335. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8386580&dopt=Abstract
196. Klepp O, Flodgren P, Maartman-Moe H, Lindholm CE, Unsgaard B, Teigum H, Fossa SD, Paus E. Early clinical stages (CS1, CS1Mk+ and CS2A) of non-seminomatous testis cancer. Value of pre - and postorchiectomy serum tumor marker information in prediction of retroperitoneal lymph node metastases. Swedish-Norwegian Testicular Cancer Project (SWENOTECA). Ann Oncol 1990; 1 : 281 - 288. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1702312&dopt=Abstract
197. Schmoll HJ, Weissbach L. [Diagnostics and therapy of testicular tumours], Interdisziplinäre Konsensus-Konferenz, Halle (Saale), 1996. [German] EBM IIa-IIb-III.
198. Warde P, Jewett MAS. Surveillance for stage I testicular seminoma. Is it a good option? Urol Clin North Am 1998;25 : 425-433.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9728212&dopt=Abstract&itool=iconabstr
199. Buchholz TA, Walden TL, Prestidge BR. Cost-effectiveness of post-treatment surveillance after radiation therapy for early stage seminoma. Cancer 1998;82 : 1126-1133. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9506359& dopt=Abstract
200. Tana S, Cerrotta A, Gardani G, Palazzi M, Pizzocaro G. Post surgical policy in stage I testicular seminoma: cost and benefit of prophylactic irradiation in a long-term experience. Tumori 1997; 83 : 918-921. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9526584& dopt=Abstract
201. Jones WG, Fossa SD, Mead GM, Roberts JT, Sokal M, Naylor S, Tenning SP. A randomised trial of two radiotherapy schedules in the adjuvant treatment of stage I seminoma (MRC TE 18). Eur J Cancer 2001;37(Suppl 6):S157. Abstract 572. EBM Ib.
202. Sultanem K, Souhami L, Benk V, Bahary JP, Roman T, Shenouda G, Freeman C. Para-aortic irradiation only appears to be adequate treatment for patients with stage I seminoma of the testis. Int J Radiat Oncol Biol Phys 1998;40 : 455-459. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9457835& dopt=Abstract
203. Kiricuta IC, Sauer J, Bohndorf W. Omission of the pelvic irradiation in stage I testicular seminoma: a study of postorchiectomy paraaortic radiotherapy. Int J Radiat Oncol Biol Phys 1996;35 : 293-298. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8635936& dopt=Abstract
204. Warde P, Gospodarowicz MK, Panzarella T, Catton CN, Sturgeon JF, Moore M, Goodman P, Jewett MA. Stage I testicular seminoma: results of adjuvant irradiation and surveillance. J Clin Oncol 1995;13 : 2255-2262. EBM III. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7666083& dopt=Abstract
205. Fossa SD, Aass N, Kaalhus O. Radiotherapy for testicular seminoma stage I: treatment results and long-term post-irradiation morbidity in 365 patients. Int J Radiat Oncol Biol Phys 1989;16 : 383-388. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2921142& dopt=Abstract
206. Stein ME, Leviov M, Drumea K, Moshkovitz B, Nativ O, Milstein D, Sabo E, Kuten A. Radiationinduced tumors in irradiated stage I testicular seminoma: results of a 25-year follow-up (1968-1993). J Surg Oncol 1998;67 : 38-40. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9457255& dopt=Abstract
207. Akimoto T, Takahashi I, Takahashi M, Yamakawa M, Hayakawa K, Mitsuhashi N, Niibe H. Long-term outcome of postorchiectomy radiation therapy for stage I and II testicular seminoma. Anticancer Res 1997;17 : 3781-3785. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9427780& dopt=Abstract
208. Von der Maase H, Specht L, Jacobsen GK, Jakobsen A, Madsen EL, Pedersen M, Rorth M, Schultz H. Surveillance following orchidectomy for stage I seminoma of the testis. Eur J Cancer 1993;14 : 1931-1934. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8280484& dopt=Abstract
209. Horwich A, Alsanjari N, A’Hern, Nicholls J, Dearnaley DP, Fisher C. Surveillance following orchidectomy for stage I testicular seminoma. Br J Cancer 1992;65 : 775-778. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1586607& dopt=Abstract
210. Germá Lluch JR, Climent MA, Villavicencio H, Gomez de Segura G, Blanco R, Mer edes A, de Andres L, Sole Balcells FJ. Treatment of stage I testicular tumors. Br J Urol 1993;71 : 473-477. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8499994& dopt=Abstract
211. Warde P, Gospodarowicz MK, Goodman PJ, Sturgeon JF, Jewett MA, Catton CN, Richmond H, Thomas GM, Duncan W, Munro AJ. Results of a policy of surveillance in stage I testicular seminoma. Int J Radiat Oncol Biol Phys 1993;27 : 11-15. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8365931& dopt=Abstract
212. Allhoff EP, Liedke S, de Riese W, Stief C, Schneider B. Stage I seminoma of the testis: adjuvant radiotherapy or surveillance? Br J Urol 1991;68 : 190-194. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1715798& dopt=Abstract
213. Bukowski RM. Management of advanced and extragonadal germ-cell tumors. Urol Clin North Am 1993;20 : 153-160.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8381995& dopt=Abstract
214. Frohlich MW, Small EJ. Stage II nonseminomatous testis cancer: the roles of primary and adjuvant chemotherapy. Urol Clin North Am 1998;25 : 451-459.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9728214& dopt=Abstract
215. Fair W, Dalbagni G, Machele Donat S, Theodorescu D. Evaluation and follow-up of patients with urologic cancer. AUA Office of Education Publications 9958 PG, 1999.
216. Pizzocaro G. Non-seminomatous germ-cell tumors (NSGCT) of the testis: diagnosis and management, stage by stage. Eur Urol Update Series 1997;6 : 139-145.
217. Sheinfeld J, Bajorin DF, Solomon M. Management of postchemotherapy residual masses in advanced germ cell tumors. Urol Clin North Am 1997;3 : 18-23.
218. Little JS, Foster RS, Ulbright TM, Donohue JP. Unusual neoplasms detected in testis cancer patients undergoing postchemotherapy retroperitoneal lymphadenectomy. J Urol 1994;152 : 1144-1149. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8072083& dopt=Abstract
219. Aas N, Kaasa S, Lund E, Kaalhus O, Heier MS, Fossa SD. Long-term somatic side-effects and morbidity in testicular cancer patients. Br J Cancer 1990;61 : 151-155. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2297486& dopt=Abstract
220. Donohue JP, Thornhill JA, Foster RS, Bihrle R, Rowland RG, Einhorn LH. The role of retroperitoneal lymphadenectomy in clinical stage B testis cancer: the Indiana University Experience (1965 to 1989). J Urol 1995;153 : 85-89. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7966799& dopt=Abstract
221. Motzer RJ, Sheinfeld J, Mazumdar M, Bajorin DF, Bosl GJ, Herr H, Lyn P, Vlamis V. Etoposide and cisplatin adjuvant therapy for patients with pathological stage II germ cell tumors. J Clin Oncol 1995; 13 : 2700-2704. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7595727& dopt=Abstract
222. Hermans BP, Sweeney CJ, Foster RS, Einhorn LE, Donohue JP. Risk of systemic metastases in clinical stage nonseminoma germ cell testis tumor managed by retroperitoneal lymph node dissection. J Urol 2000;163 : 1721-1724. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10799168& dopt=Abstract
223. Hartlapp JH, Weissbach L, Bussar-Maatz R. Adjuvant chemotherapy in nonseminomatous testicular tumor stage II. Int J Androl 1987;10 : 277-284.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2438221& dopt=Abstract
224. Logothetis CJ, Swanson DA, Dexeus F, Chong C, Ogden S, Ayala AG, von Eschenbach AC, Johnson DE, Samuels ML. Primary chemotherapy for clinical stage II nonseminomatous germ cell tumors of the testis: a follow-up of 50 patients. J Clin Oncol 1987;5 : 906-911. EBM IIb.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2438389& dopt=Abstract
225. Fossa SD, Borge L, Aass N, Johannessen NB, Stenwig AE, Kaalhus O. The treatment of advanced metastatic seminoma: experience in 55 cases. J Clin Oncol 1987;5 : 1071-1077. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2439660& dopt=Abstract
226. Rathmell AJ, Brand IR, Carey BM, Jones WG. Early detection of relapse after treatment for metastatic germ cell tumour of the testis: an exercise in medical audit. Clin Oncol (R Coll Radiol) 1993;5 : 34-38. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7678749& dopt=Abstract
9.2 Non-germ cell tumours
1. Cheville JC, Sebo TJ, Lager DJ, Bostwick DG, Farrow GM. Leydig cell tumour of the testis: a clinicopathologic, DNA content, and MIB-1 comparison of nonmetastasizing and metastasizing tumours. Am J Surg Pathol 1998;22 : 1361-1367. EBM IIA.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids=9808128
2. Kim I, Young RH, Scully RE. Leydig cell tumours of the testis. A clinicopathological analysis of 40 cases and review of the literature. Am J Surg Pathol 1985;9 : 177-192. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?CMD=search&DB=pubmed
3. Matveev BP, Gurarii LL. [Leydig-cell tumours of the testis.] Urol Nefrol (Mosk) 1997 : 34-36. [Russian] EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids =9381620
4. Young RH, Koelliker DD, Scully RE. Sertoli cell tumours of the testis, not otherwise specified: a clinicopathologic analysis of 60 cases. Am J Surg Pathol 1998;22 : 709-721. EMB III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids=9630178
5. Proppe KH, Scully RE. Large-cell calcifying Sertoli cell tumour of the testis. Am J Clin Pathol 1980;74 : 607-619. EMB III. http://www.ncbi.nlm.nih.gov/ entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 7446466
6. Zukerberg LR, Young RH, Scully RE. Sclerosing Sertoli cell tumour of the testis. A report of 10 cases. Am J Surg Pathol 1991;15 : 829-834. EMB III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 1719830
7. WHO histological classification of testis tumours. In: JN Eble, G Sauter, JI Epstein, IA Sesterhenn, editors. Pathology & genetics. Tumours of the urinary system and male genital organs. IARC Press: Lyon, 2004, p 218, 250-262. EBM III.
8. Ulbright TM, Amin MB, Young RH. Tumours of the testis, adnexia, spermatic cord and scrotum. AFIP 1999. EBM III.
9. McCluggage WG, Shanks JH, Arthur K, Banerjee SS. Cellular proliferation and nuclear ploidy assessments augment established prognostic factors in predicting malignancy in testicular Leydig cell tumours. Histopathology 1998;33 : 361-368. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 9822927
10. Mineur P, de Cooman S, Hustin J, Verhoeven G, de Hertogh E. Feminizing testicular Leydig cell tumour: hormonal profile before and after unilateral orchidectomy. J Clin Endocrinol Metab 1987;64 : 686-691. EBM IIB,
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 3818898
11. Reznik Y, Rieu M, Kuhn JM, Mandard JC, Bottet P, Lemonnier D, Bekka S, Mahoudeau J. Luteinizing hormone regulation by sex steroids in men with germinal and Leydig cell tumours. Clin Endocrinol (Oxf) 1993;38 : 487-493. EBM IIB.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 8392454
12. Bercovici JP, Nahoul K, Tater D, Charles JF, Scholler R. Hormonal profile of Leydig cell tumours with gynecomastia. J Clin Endocrinol Metab 1984;59 : 625-630. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 6434575
13. Haas GP, Pittaluga S, Gomella L, Travis WD, Sherins RJ, Doppman JL, Linehan WL, Robertson C.
Clinical occult Leydig cell tumour presenting with gynecomastia. J Urol 1989;142 : 1325-1327. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 2810523
14. Ruthgers JL, Young RH, Scully RE. The testicular "tumour" of the adrenogenital syndrome. A report of six cases and review of the literature on testicular masses in patients with adrenocortical disorders. Am J Surg Pathol 1988;12 : 503-513. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 3291624
15. Maizlin ZV, Belenky A, Kunichezky M, Sandbank J, Strauss S. Leydig cell tumours of the testis: gray scale and color Doppler sonographic appearance. J Ultrasound Med 2004;23 : 959-964. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 15292565
16. Ponce de Leon Roca J, Algaba Arrea F, Bassas Arnau L, Villavicencio Mavrich H. [Leydig-cell tumours of the testis.] Arch Esp Urol 2000; 53 : 453-458. [Spanish] EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 11002512
17. Wegner HE, Dieckmann KP, Herbst H, Andresen R, Miller K. Leydig cell tumour - comparison of results of radical and testis sparing surgery in a single center. Urol Int 1997;59 : 170-173. EBM IIB.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 9428434
18. Mosharafa AA, Foster RS, Bihrle R, Koch MO, Ulbright TM, Einhorn LH, Donohue JP. Does retroperitoneal lymph node dissection have a curative role for patients with sex cord-stromal testicular tumours? Cancer 2003;98 : 753-757. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 12910519
19. Giglio M, Medica M, De Rose AF, Germinale F, Ravetti JL, Carmignani G. Testicular Sertoli cell tumours and relative sub-types. Analysis of clinical and prognostic features. Urol Int 2003;70 : 205-210. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 12660458
20. Jacobsen GK. Malignant Sertoli cell tumours of the testis. J Urol Pathol 1993;1 : 233-255. EBM III.
21. Kratzer SS, Ulbright TM, Talerman A, Srigley JR, Roth LM, Wahle GR, Moussa M, Stephens JK, Millos A, Young RH. Large cell calcifying Sertoli cell tumour of the testis: contrasting features of six malignant and six benign tumours and a review of the literature. Am J Surg Pathol 1997;21 : 1271-1280. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 9351565
22. Henley JD, Young RH, Ulbright TM. Malignant Sertoli cell tumours of the testis: a study of 13 examples of a neoplasm frequently misinterpreted as seminoma. Am J Surg Pathol 2002;26 : 541-550. EBM III.
23. Plata C, Algaba F, Andujar M, Nistal M, Stocks P, Martinez JL, Nogales FF. Large cell calcifying Sertoli cell tumour of the testis. Histopathology 1995;26 : 255-259. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 7541015
24. Anderson GA. Sclerosing Sertoli cell tumour of the testis: a distinct histological subtype. J Urol 1995;154 : 1756-1758. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 7563340
25. Grabrilove JL, Freiberg EK, Leiter E, Nicolis GL. Feminizing and non-feminizing Sertoli cell tumour. J Urol 1980;124 : 757-767.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 7003168
26. Gierke CL, King BF, Bostwick DG, Choyke PL, Hattery RR. Large-cell calcifying Sertoli cell tumour of the testis: appearance at sonography. AJR Am J Roentgenol 1994;163 : 373-375. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 8037034
27. Chang B, Borer JG, Tan PE, Diamond DA. Large-cell calcifying Sertoli cell tumour of the testis: case report and review of the literature. Urology 1998;52 : 520-522. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 9730477
28. Washecka R, Dresner MI, Honda SA. Testicular tumours in Carney’s complex. J Urol 2002;167 : 1299-1302. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 11832717
29. Young S, Gooneratne S, Straus FH, Zeller WP, Bulun SE, Rosenthal IM. Feminizing Sertoli cell tumours in boys with Peutz-Jeghers syndrome. Am J Surg Pathol 1995;19 : 50-58. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 7802138
30. Kaplan GW, Cromie WJ, Kelalis PP, Silber I, Tank ES Jr. Gonadal stromal tumours: a report of the prepuberal testicular tumours registry. J Urol 1986;136 : 300-302. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 3723681
31. Al-Bozom IA, El-Faqih SR, Hassan SH, El-Tiraifi AE, Talic RF. Granulosa cell tumour of the adult type. A case report and review of the literature of a very rare testicular tumour. Arch Pathol Lab Med2000;124 : 1525-1528. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 11035589
32. Perito PE, Ciancio G, Civantos F, Politano VA. Sertoli-Leydig cell testicular tumour. Case report and review of sex cord/gonadal stromal tumour histogenesis. J Urol 1992;148 : 883-885. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 1512847
33. Scully RE. Gonadoblastoma. A review of 74 cases. Cancer 1970;25 : 1340-1356. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 4193741
34. Ulbright TM, Srigley JR, Reuter VE, Wojno K, Roth LM, Young RH. Sex-cord-stromal tumours of the testis with entrapped germ cells: a lesion mimicking unclassified mixed germ cell sex cord-stromal tumours. Am J Surg Pathol 2000;24 : 535-542. EBM III.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract& list_uids= 10757400
10. ZKRATKY UŽÍVANÉ V TEXTU
Tento seznam nezahrnuje nejčastější zkratky.
AFP alfa-fetoprotein
beta hCG ‑beta lidský chorionický gonadotropin/beta-human chorionic gonadotrophin
CNS centrální nervový systém
CT počítačová tomografie
EBM ‑medicína založená na důkazech/evidence-based medicine
EGCCCG ‑European Germ Cell Cancer Collaborative Group
EORTC ‑European Organization for Research and Treatment of Cancer
FDG-PET ‑fluorodeoxyglukózo-pozitro-nová emisní tomografie
FSH ‑folikuly-stimulující hormon/ evidence-based medicine
G-CSF ‑granulocytové kolonie stimulující faktor/granulocyte - colony stimulating factor
GI gastrointestinální
HPF high-power field
IGCCCG ‑International Germ Cell Cancer Collaborative Group
LDH laktátová dehydrogenáza
LH lutenizační hormon
MRC Medical Research Council
MRI ‑zobrazovací vyšetření magnetickou rezonancí/magnetic resonance imaging
NSE neurospecifická enoláza
NSGCT ‑neseminomatózní tumor ze zárodečných buněk
PA paraaortální
PEB ‑cisplatina, etopozid, bleomycin
PEI/VIP ‑cisplatina, etopozid, ifosfamid
PET ‑pozitronová emisní tomografie
PFS ‑přežití bez progrese/progression-free survival
PLAP ‑placentální alkalická fosfatáza/progression-free survival
PVB ‑cisplatina, vinblastin, bleomycin
RPLND ‑retroperitoneální lymfadenektomie
TIN ‑intratubulární neoplazie ze zárodečných buněk
TNM ‑Tumour Node Metastasis (klasifikace tumor, lymfatické uzliny, metastázy)
UICC ‑International Union Against Cancer
ULN ‑horní hranice normálního rozmezí
VeIP ‑vinblastin, ifosfamid a cisplatina
VIP/PEI ‑cisplatina, etopozid, ifosfamid
WW ‑pozorné sledování/watchful waiting
Štítky
Dětská urologie Urologie
Článek LIEČBA NÁDOROV TESTISČlánek ZE ZAHRANIČNÍCH PERIODIKČlánek LYMFATICKÁ DRENÁŽ VARLETEČlánek KVÍZČlánek Editorial
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2006 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- TERATOM VARLETE: SOUČASNÁ KLASIFIKACE Z POHLEDU WHO Z ROKU 2004
- VELKOBUNĚČNÝ NÁDOR ZE SERTOLIHO BUNĚK S KALCIFIKACEMI: PŘEHLED PROBLEMATIKY
- NÁDORY TESTIS: EPIDEMIOLÓGIA, ETIOLÓGIA, PATOLÓGIA A DIAGNOSTIKA
- LIEČBA NÁDOROV TESTIS
- NÁDORY VARLAT - CHIRURGICKÉ ŘEŠENÍ
- ROLE RADIOTERAPIE V LÉČEBNÉ STRATEGII NÁDORŮ VARLAT
- ZE ZAHRANIČNÍCH PERIODIK
- Editorial
- PENILNÍ PROTÉZA VE TŘETÍM TISÍCILETÍ
- RADIKÁLNÍ PROSTATEKTOMIE: OTEVŘENÁ, LAPAROSKOPICKÁ NEBO ROBOTICKY ASISTOVANÁ - JE MOŽNO NĚKTEROU OBJEKTIVNĚ PREFEROVAT?
- LYMFATICKÁ DRENÁŽ VARLETE
- ZPRÁVA Z KONFERENCE AUA ANNUAL MEETING 2006, ATLANTA, USA
- KVÍZ
- GUIDELINES EAU PRO DIAGNOSTIKU, KLASIFIKACI A LÉČBU TESTIKULÁRNÍHO KARCINOMU
- BIOLOGICKÉ CHOVÁNÍ GERMINÁLNÍCH NÁDORŮ VARLETE
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- LYMFATICKÁ DRENÁŽ VARLETE
- TERATOM VARLETE: SOUČASNÁ KLASIFIKACE Z POHLEDU WHO Z ROKU 2004
- PENILNÍ PROTÉZA VE TŘETÍM TISÍCILETÍ
- VELKOBUNĚČNÝ NÁDOR ZE SERTOLIHO BUNĚK S KALCIFIKACEMI: PŘEHLED PROBLEMATIKY
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



