-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ROLE RADIOTERAPIE V LÉČEBNÉ STRATEGII NÁDORŮ VARLAT
THE ROLE OF RADIOTHERAPY IN THE TREATMENT STRATEGY OF TESTICLE TUMOURS
Radiotherapy is indispensable in the treatment of seminomas. It has produced excellent results in the treatment of this disease, especially in its use, thus far, as a standard adjuvant treatment of stage I and curative treatment of stages IIA and IIB. The role of radiation of residual mass after chemotherapy in advanced or metastatic cases is debatable. In cases following surgery (orchiopexis, groin hernia surgery), apart from same-side radiation of the ilical area, double-sided inguinopelvic area radiation is done using the technique of two oppositely laid poles in the shape of an inverted ”Y“. Radiation of the hemiscrotum is not necessary if it was not preceded by adequate steps like orchiectomy or diagnostic abjection through puncture or excision, all of which could result in the contamination of the scrotum and a real danger of local deterioration. Radiotherapy in non-seminomas is generally indicated as a palliative treatment, or in individual cases as adjuvant - radiation of residual infiltrates after chemotherapy (when they are inoperable)
KEY WORDS:
radiotherapy, seminoma, non-seminoma
Autoři: doc. MUDr. Pavel Šlampa, CSc.; MUDr. Blažena Syptáková
Působiště autorů: oddělení radiační onkologieMasarykův onkologický ústav, Brno
Vyšlo v časopise: Urol List 2006; 4(3): 33-38
Souhrn
Radioterapie má své nezastupitelné místo v léčbě seminomů. Podílí se na výborných výsledcích léčby tohoto onemocnění, zejména jako dosud standardní adjuvantní léčba stadia I a kurativní léčba stadia IIA a IIB. Role ozáření reziduálních mas po chemoterapii u pokročilého nebo metastatického onemocnění je zpochybňována. V případě předchozího chirurgického výkonu (orchiopexe, operace tříselné kýly) se provádí kromě stejnostranné ilické oblasti ozáření oboustranné ingvinopelvické oblasti technikou dvou protilehlých polí typu obráceného „Y“. Ozáření hemiskrota není potřebné, nepředcházel-li neadekvátní výkon na šourku, jako orchidektomie skrotální cestou nebo zavrženíhodná diagnostická punkce či excize, při nichž je možná nádorová kontaminace skrota a reálné nebezpečí lokální recidivy. Radioterapie u neseminomů je indikována obyčejně jako léčba paliativní, nebo v individuálních případech jako adjuvantní - ozáření reziduálních infiltrátů po chemoterapii (a při jejich inoperabilitě).
KLÍČOVÁ SLOVA:
radioterapie, seminom, neseminomLÉČEBNÁ STRATEGIE
V léčbě nádorů varlat je uplatňován multidisciplinární přístup.
CHIRURGICKÁ LÉČBA
Chirurgickou léčbou je vysoká ingvinální orchidektomie, je u všech stadií primárním léčebným výkonem odstraňujícím primární tumor. Tento výkon může mít u seminomu stadia I kurativní efekt a kromě toho vždy umožňuje přesnou patologickou diagnózu a určení pT. I když je seminom nádor vysoce radiosenzitivní, existovali ještě v 70. a 80. letech autoři, kteří doporučovali ihned po orchidektomii provedení radikální retroperitoneální lymfadenektomie. Šlo nepochybně o přenesení zkušeností z profylaktických lymfadenektomií prováděných s úspěchem u neseminomů do oblasti seminomu bez jasné úvahy o rozdílnosti biologického chování těchto dvou skupin germinálních nádorů. Radioterapie a lymfadenektomie má u seminomů klinického stadia I zcela shodné léčebné výsledky. Lymfadenektomie je poměrně rozsáhlý operační výkon, při němž je pacient vystaven zbytečnému operačnímu riziku, nebo téhož výsledku lze dosáhnout radiací, která má rizika minimální. Profylaktická lymfadenektomie jako léčebná metoda klinického stadia I seminomů nemá dnes žádné opodstatnění a je nutno ji v této indikaci považovat za škodlivou. Operačního řešení se používá k resekci zbytkového nádoru po předchozí chemoterapii (eventuálně radioterapii). U pacientů s neseminomy stadia I-IIB lze ve vybraných případech provést radikální kurativní zákrok - nervy šetřící retroperitoneální lymfadenektomii.
Čistý seminom je vysoce radiosenzitivní a chemosenzitivní. U stadia I se neurčují prognostické faktory predikující přežití. Nemocní s nepokročilým seminomem přežívali i v dávné minulosti, i když se podrobovali léčbě, kterou bychom v dnešní době označili za zcela neadekvátní. Nicméně prognostické faktory se používají k identifikaci rizika relapsu [1,2].
RADIOTERAPIE
Adjuvantně je indikována u seminomů klinického stadia I, jako kurativní metoda pak u klinického stadia IIA,B. Možnou indikací radioterapie je reziduum nádoru po předchozí chemoterapii pokročilého stadia seminomu. Dále je indikována jako kurativní metoda po orchidektomii pro seminom a zároveň s nálezem karcinoma in situ (punkcí) u druhostranného varlete; v tomto případě se zbylé varle ozařuje dávkou 20 Gy.
CHEMOTERAPIE
Chemoterapie je nejužívanější léčebnou metodou u neseminomů - adjuvantně u stadia I, nebo kurativně v případech lokálně pokročilých stadií onemocnění nebo při postižení regionálních uzlin či vzdálené diseminaci. Používá se několik chemoterapeutických režimů, všechny na bázi cisplatiny (C), která je nejefektivnějším cytostatikem u těchto nádorů. Z dalších cytostatik používaných v kombinacích jsou etopozid (E), bleomycin (B), ifosfamid (I), vinblastin (V), paklitaxel (P) a gemcitabin (kombinace BEP, PVB, PIB, PEI, EC). V léčbě seminomů je chemoterapie alternativní metodou k radioterapii u stadia IIA,B.
Indikací k ozáření ingvin a skrota u seminomů je operace skrotální cestou (např. u velmi pokročilých tumorů, jinak je tento postup non lege artis), punkce skrota nebo prorůstání tumoru do skrota.
Před zahájením radioterapie a před chemoterapií a retroperitoneální lymfadenektomií je vhodné po domluvě s pacientem provést kryoprezervaci spermatu [3,4,5].
RADIOTERAPIE
Radioterapie byla jedinou léčebnou metodou používanou u seminomů přibližně až do roku 1976. Zavedení kurativní kombinované chemoterapie použitelné u diseminovaných seminomů, rozvoj diagnostických radiologických metod umožňujících relativně přesné vyšetření retroperitonea, porozumění faktorům majícím vliv na další prognózu po samotné radiaci a možnost sledování biochemických markerů však pohled na radioterapii seminomů pozměnily.
Ještě v dobách, kdy neexistovaly dnešní diagnosticko-léčebné prostředky, se již dosahovalo na většině pracoviš u stadia I kurativních výsledků ve více než 95 % případů. Tento fakt svědčí o značné efektivitě radioterapie. Vzhledem k tomu, že v té době chyběly informace získávané dnes zobrazovacími vyšetřovacími metodami, zahrnovala tehdy populace nemocných, jejichž onemocnění bylo klasifikováno jako stadium I, 10–15 % případů s nerozpoznaným retroperitoneálním onemocněním. Z toho vyplývaly i zprávy o relapsech v retroperitoneu, a konečně je to i důvod, proč se původně na některých pracovištích aplikovala relativně vysoká dávka (až 35–40 Gy ve 4 týdnech). V současné době je adjuvantní pooperační radioterapie uznávanou a běžně prováděnou léčebnou metodou na většině pracoviš. Použití megavoltáže je samozřejmostí.
Ponechané varle není a nesmí být nikdy v přímém svazku záření. Přesto se může vyvinout oligospermie či azoospermie, a to až u 50 % takto léčených nemocných. Zachování fertility není u valné části nemocných ve středním věku příliš důležité, protože většina z nich již vlastní potomstvo má. Pro některé, zvláště mladší pacienty, může však jít o aspekt významný, proto je třeba tomuto problému věnovat zvláštní pozornost a navrhnout eventuálně před léčbou kryoprezervaci spermatu. V případě předchozího chirurgického výkonu (orchiopexe, operace tříselné kýly) se ozáření provádí kromě stejnostranné ilické oblasti i oboustranně oblasti ingvinopelvické technikou dvou protilehlých polí typu obráceného „Y“. Ozáření hemiskrota není potřebné, nepředcházel-li neadekvátní výkon na šourku jako orchidektomie skrotální cestou nebo zavrženíhodná diagnostická punkce či excize, při nichž je možná nádorová kontaminace skrota a reálné nebezpečí lokální recidivy. Ozáření celého šourku včetně ponechaného testis s cílem zabránit vývoji možného druhostranného nádoru je neoprávněné pro nízkou frekvenci bilaterálních tumorů (1–2 %). Všeobecně se přijímá názor, že se tyto druhostranné tumory mají léčit, až když skutečně vzniknou.
Popsanou léčbu většina pacientů velice dobře snáší a absolvuje ji ambulantně. Nízký počet nemocných, pokud to dovoluje charakter jejich povolání (lehká, fyzicky nenáročná práce), dokonce na vlastní přání nepřerušuje zaměstnání. Asi pětina nemocných si během záření stěžuje na vedlejší příznaky jako je nauzea, zvracení, průjem, kolikovité bolesti v břiše. Tyto obtíže se lehko zvládají symptomatickou léčbou a zřídka jsou příčinou dočasného přerušení léčby [5,6].
Radioterapie má své místo v adjuvantní léčbě u stadia I a jako aktivní léčba stadia IIA a B.
Kontraindikace radioterapie
Přesto mohou nastat situace, při kterých je radioterapie kontraindikována.
Jsou to:
- atypická nebo rotovaná pozice levé ledviny, která může alterovat lymfatickou drenáž
- zánětlivé procesy v dutině břišní (regionální ileitis, pancreatitis, vředová choroba gastroduodenální, divertiaulitis, hepatitis)
- značná obezita
- abdominopelvické adheze
- AIDS s nízkým počtem CD 4
- extragonadální seminom (rozsáhlý)
- podkovovitá ledvina nebo pánevní dystopie ledviny (byla by v radiačním objemu)
- odmítnutí radiace pacientem [7]
Ozařovací objem
Vynikající léčebné výsledky u prvního klinického stadia seminomů a riziko chronických pozdních poradiačních změn včetně radiačně indukovaných nádorů vedlo ke snahám o zmenšení ozařovacího objemu a snížení aplikované dávky při předpokládaném zachování léčebného efektu. Nízká incidence postižení iliakálních a pánevních uzlin vedla řadu autorů k myšlence vypustit právě tuto oblast z ozařovacího objemu a ozařovat jen uzliny paraaortální. Klíčovou studii provedli skandinávští autoři, kteří porovnali četnost relapsů a toxické účinky u skupiny nemocných léčených tradiční technikou oproti skupině pacientů s ozářením pouze paraaortálních lymfatických uzlin. Nebylo signifikantních rozdílů v 3letém přežití a akutní toxické účinky (nauzea, zvracení, leukopenie) byly méně časté a méně výrazné u nemocných s pouhou paraaortální léčbou. V této skupině byly počty spermií významně vyšší než u mužů ozařovaných tradičním polem. Po uskutečnění této studie se dosáhlo všeobecné shody v tom, že by se paraaortální ozáření u seminomů stadia I mělo stát terapeutickým standardem [5,7].
Nedávno zveřejněné výsledky studie T18 ukázaly, že lze snížit i celkovou dávku. V uvedené studii se porovnávala dávka 20 Gy v 10 frakcích oproti dávce 30 Gy v 15 frakcích u 625 nemocných. Nebyl významný rozdíl mezi oběma skupinami co do 3letého bezpříznakového přežití, ale kvalita života byla vyšší ve skupině s nižší celkovou dávkou. V případě relapsu je možné léčit nemocné cytostatiky [8,9].
SEMINOMY
Plánovací cílový objem (PTV) - adjuvantní radioterapie
Stadium I (mimo pT3 a pT4; dávka: 20–25 Gy, 5 × 1,8 Gy/týden)
Plánovací cílový objem tvoří paraaortální břišní lymfatické uzliny, ipsilaterální renální hilové uzliny s bezpečnostním lemem 2 cm (obr. 1).
Obr. 1. Simulační snímky adjuvantní radioterapie oblasti paraaortálních břišních uzlin u pacienta se seminomem klinického stadia I (kraniální a kaudální hranice protilehlých polí). 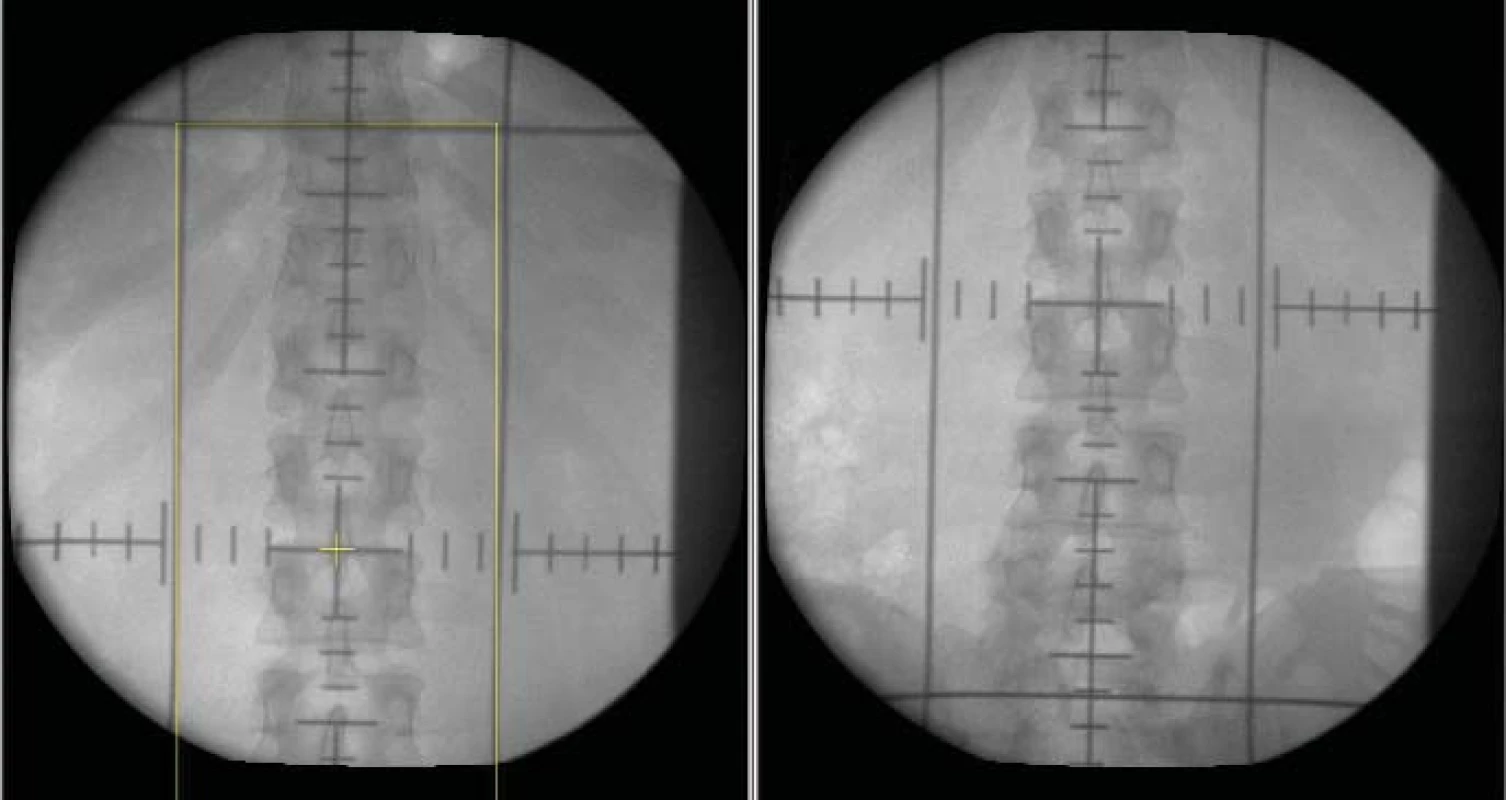
Anatomicky je obvykle cílový objem vymezen:
Hranice: kraniální mezi obratli Th10/11 (po úpon bránice), kaudální mezi obratli L5-S1, laterální laterální okraje processus laterales vertebrae.
Stadium IIA (včetně pT3 a pT4 klinického stadia I; dávka: 30 Gy, 5 × 1,8 Gy/týden)
Plánovací cílový objem zahrnuje paraaortální břišní uzliny, ipsilaterální renální hilové uzliny a ipsilaterální pánevní uzliny s bezpečnostním lemem 2 cm - technika „hokejka“ („dog leg“), obr. 2 a-c.
Obr. 2. Adjuvantní radioterapie u pacientů se seminomem technikou „hokejka“, brzdný svazek lineárního urychlovače. a) 3rozměrná rekonstrukce individuálně vymezeného cílového objemu vícelamelovým kolimátorem a kritických orgánů b) vymezení plánovacího cílového objemu v 2D-obraze c) dávkově-objemový histogram (křivka: červená - PTV, tyrkysová - mícha, hnědá - rektum, fialová - pravá ledvina, žlutá - levá ledvina). 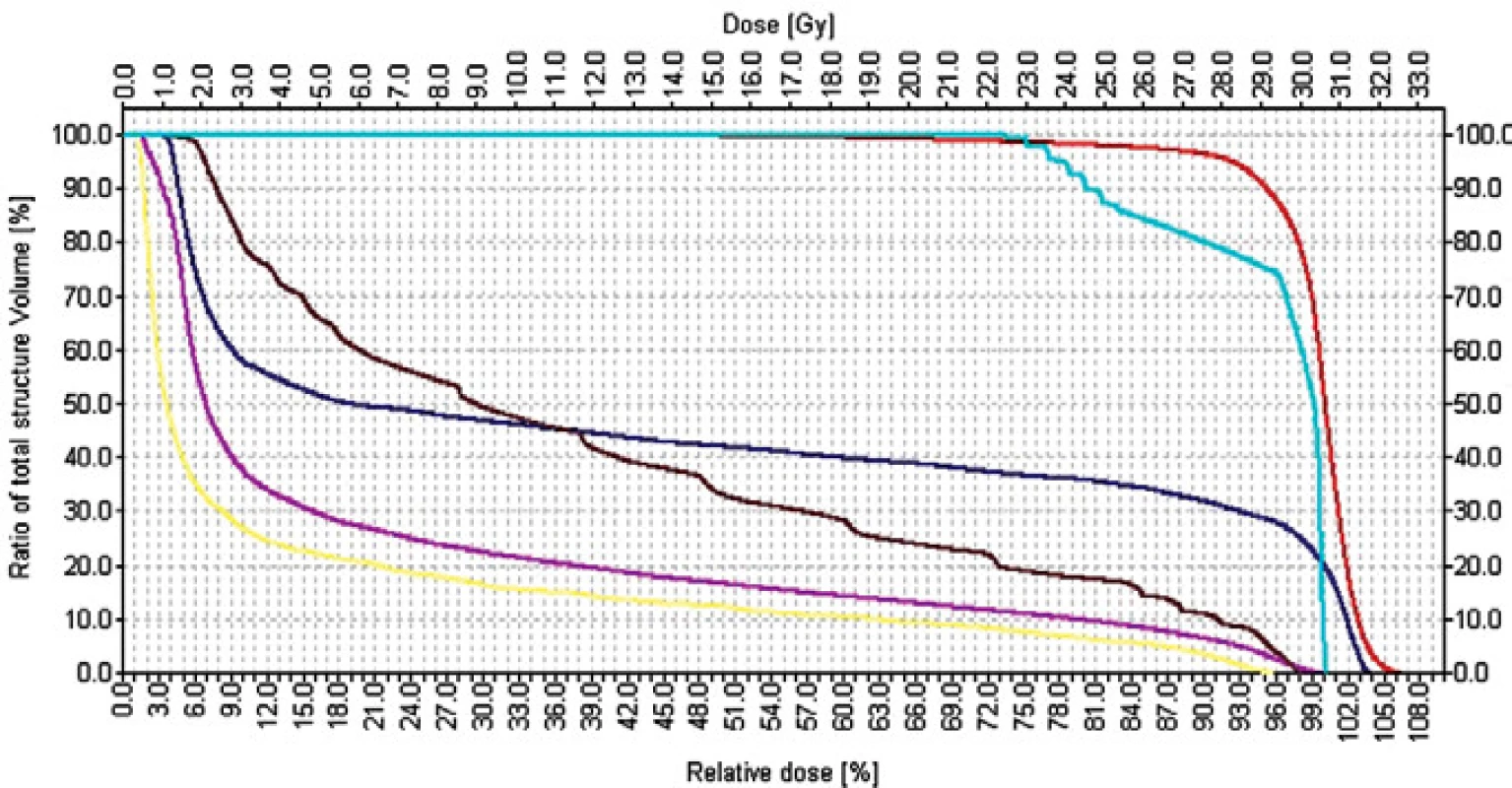
Obvyklé anatomické hranice: kraniální mezi obratli Th10-11 kaudální dolní okraj foramen obturatum laterální laterální okraj acetabula
mediální mediální okraj foramen obtu - ratorium, při L5-S1 zalomení hranice pole,
laterální paraaortální části pole: late - rální okraje procesus late - rales vertebrae a ipsilaterál - ní renální hilus (zvláště při levostranném postižení), lem 2 cm od uzlin zobrazených při CT-vyšetření, ingvinální jizva v poli
U rozsahu nádoru pT4 je v cílovém objemu scrotum.
Stadium IIB (po orchidektomii, bez chemoterapie)
PTV 1 (dávka: 30 Gy, 5 × 1,8 Gy/týden)
Plánovací cílový objem je stejný jako u stadia IIA - technika „hokejka“ (v anglické literatuře nazývaná „dog leg“).
PTV 2 (dávka 6,0 Gy, 3 × 2,0 Gy)
Zmenšený cílový objem tvoří reziduální lymfatické uzliny ≥ 4 cm s bezpečnostním lemem 2 cm.
Stadium IIB (po orchidektomii a chemoterapii)
Plánovací cílový objem (PTV), technika a dávka (36 Gy) jsou stejné jako u stadia IIC. (Pokud předpokládáme zvýšené riziko vzniku retrográdních lymfogenních metastáz z oblasti retroperitonea do pánevních uzlin, například pokud je přítomen masivní uzlinový paket v blízkosti bifurkace aorty, pak je indikována technika „obráceného Y“.)
Technika „obráceného Y“
PTV 1
Plánovací cílový objem zahrnuje uzliny retroperitonea ve výši obratlů Th11 až L5 včetně, oboustranné pánevní uzliny (společné ilické, zevní i vnitřní ilické). V případě masivního infiltrátu překrývajícího obě ledviny je nutno během radioterapie zopakovat CT-vyšetření a při zmenšení uzlinového infiltrátu redukovat i velikost PTV, aby byly alespoň 2/3 parenchymu ledvin zatíženy dávkou menší než 18 Gy.
Techniku „obráceného Y“ tvoří 2 protilehlá izocentrická předozadní AP/PA-pole. Individuálními bloky jsou kryty ledviny, střevo a kaudální střední část pánve močovým měchýřem. Tím dostane pole tvar obráceného Y. Vhodné je krytí skrota.
Obvyklé anatomické hranice:
kraniální meziobratlová ploténka Th10 - -11 (úpon bránice)
kaudální dolní okraje foramen obtura - torium
laterální v oblasti pánve laterální okraj acetabula, v oblasti retrope - ritonea příčné výběžky obrat - lů, resp. ipsilaterální renální hilus a uzlinový paket s le - mem 2 cm. Přechodem je šikmá spojnice mezi okra - jem pole ve výši mezi obratli L5-S1 a stříškou acetabula
centrální v dolní části pánve mezi vykrytí mediálními okraji foramen obturatorium
PTV 2
Zmenšený cílový objem je tvořen uzlinovým infiltrátem ≥ 4 cm s lemem 2 cm.
Stadium IIC (po orchidektomii a chemoterapii)
V tomto stadiu je indikováno ozáření rezidua při nemožnosti provedení chirurgického zákroku (radikální odstranění rezidua) a u recidivujících nádorů. Plánovací cílový objem je tvořen reziduální nádorovou infiltrací po předchozí chemoterapii (lem 2–3 cm) a je ozářen dávkou 36 Gy. Je však možný individuální přístup podle původního rozsahu, provedené léčbě a velikosti rezidua; reziduum větší než 3 cm je vhodné odstranit chirurgickou cestou, do velikosti 3 cm možno sledovat - v tomto případě je vhodné provedení PET-vyšetření; cílový objem může být volen jako IF-radioterapie místa původního postižení či EF-radioterapie - ozáření celé lymfatické oblasti.
Není-li možno u stadia IIC podat chemoterapii, použijeme ozařovací techniku obráceného Y.
Technika a plánování radioterapie
Pacient je ozařován v poloze na zádech, supinační, ruce nad hlavou, s mírně podloženými koleny. Zbylé varle je kryto speciálním krytem (zvl. při ozařování technikou „hokejka“). Nejčastější technikou je kombinace dvou protilehlých izocentrických předozadních AP/PA-polí, eventuálně při kraniokaudálním velkém rozměru pole se plánuje ozařování ze vzdálenosti ohnisko-kůže (OK, SSD) 110–120 cm. Cílový objem se plánuje na RTG-simulátoru, nicméně preciznějším postupem je využití CT plánování a trojrozměrného plánovacího systému. Zdrojem záření je obvykle brzdné záření (15–18 MV) lineárního urychlovače. Kritickými orgány jsou střeva, rektum, kostní dřeň, ledviny, močový měchýř [5,7,8,10,11].
NESEMINOMY
Radioterapie je indikována obyčejně jako léčba paliativní, nebo v individuálních případech jako adjuvantní - ozáření reziduálních infiltrátů po chemoterapii (a při jejich inoperabilitě); obyčejně je aplikována dávka 36–46 Gy (podle velikosti cílového objemu a hodnot tolerančních dávek kritických orgánů).
Technika a plánování radioterapie jsou stejné jako při ozařování seminomů; určení plánovacího cílového objemu (PTV) je stejné jako při radioterapii seminomů klinického stadia IIC [2,4,5,7,10].
DISKUSE
Klinické stadium I (bez postižení paraaortálních uzlin)
V minulosti bylo metodou volby u seminomů I. klinického stadia adjuvantní ozáření uzlin retroperitonea a stejnostranných pánevních uzlin dávkou 30 Gy technikou „hokejka“. Vzhledem k vysoké kurabilitě případných relapsů došlo počátkem 90. let ke snaze přehodnotit léčebnou strategii s cílem minimalizovat riziko případných nežádoucích účinků záření. Podstatným faktem je, že bez další adjuvantní léčby dojde k relapsu onemocnění pouze u 15–20 % nemocných. Jen v 0,5–2 % případů je relaps lokalizován v pánvi, v 90 % pak v uzlinách retroperitonea. Z toho vyplývá, že u 80–85 % pacientů dochází vlastně k nadbytečné léčbě (tzv. overtreatmentu). Nemocní jsou pak zbytečně zatěžováni akutními i pozdními nežádoucími účinky terapie. Tento problém je významný, protože jde velmi často o muže mladé, kteří po léčbě dlouhodobě přežívají.
Tuto otázku se v posledních letech snažila řešit řada klinických studií s cílem omezit rizika léčby při zachování jejích výborných výsledků. Prvním přístupem je vynechání ozáření pánevních uzlin, kde je riziko relapsu velmi malé, a ozáření pouze uzlin v oblasti retroperitonea (s výjimkou porušené lymfatické drenáže po předchozí operací v třísle nebo na skrotu). Také dochází ke snižování aplikované dávky pod 30 Gy, jelikož seminom je onemocnění vysoce radiosenzitivní. Za dostatečnou je považována dávka 25 Gy, podle některých prací dokonce 20 Gy [2,4,5,7,8].
Nahradit adjuvantní radioterapii u nepokročilého seminomu adjuvantní chemoterapií se během posledních 10–15 let snažila řada autorů. Tyto snahy zintenzivněly zejména poté, co byla odhalena účinnost karboplatiny v monoterapii. Tento preparát, který je velmi účinný u metastatického seminomu, je při podání nízkých dávek spojen s nízkou a dobře zvladatelnou toxicitou. Øada studií se zabývala a zabývá adjuvantním podání jednoho nebo dvou cyklů karboplatiny u seminomu stadia I jako alternativy adjuvantní radioterapie. Autoři uvádějí, že kvalita života je v rameni s chemoterapií neskonale vyšší než v rameni s radiací, gonadální toxicita v rameni s karboplatinou je minimální. Výsledky svědčí pro aplikování 2 sérií karboplatiny v adjuvanci ve všech případech, v nichž existují kontraindikace radioterapie. Je pravděpodobné, že tato strategie má svou velkou budoucnost [12].
Některá pracoviště volí taktiku sledování (k relapsům dochází v 15–20 % případů). Taktika zvýšeného dohledu (taktika „wait and watch“) znamená, že nemocní po orchidektomii zařazení do klinického stadia I nedostávají žádnou léčbu, ale podrobují se pečlivému sledování pomocí RTG plic, CT retroperitonea a pánve, biochemických markerů s cílem odhalit včas eventuální relapsy, aby mohli být pacienti ihned léčeni. Tato taktika sleduje eliminaci časných i pozdních postradiačních změn. Dlouho zde vyvstávala znepokojivá otázka, zda je u nádorové skupiny s tak vysokým léčebným úspěchem oprávněná radikální změna v léčebném přístupu, když více než 95 % nemocných při léčbě adjuvantní radiací trvale přežívá.
Analogie mezi seminomy a germinálními nádory neseminomového typu (GNNST) však z hlediska biologických rozdílností není oprávněná. Argumentem zastánců taktiky zvýšeného dohledu je, že pro seminomy s lokalizovaným objemným metastatickým postižením existuje účinná léčba ve formě radioterapie a pro diseminované onemocnění účinná chemoterapie. Kombinací obou metod je možné případný relaps úspěšně zvládnout. Uplatněním taktiky zvýšeného dohledu by se 60–80 % nemocných se seminomy uchránilo před pooperační radioterapií včetně nepříznivého účinku na fertilitu.
Byla provedena řada randomizovaných studií k odhalení role surveillance. Z nich vyplynulo, že riziko relapsu v prvním roce sledování je 5–10% a zvyšuje se až na 15–20% po 3 letech. Nejčastějším místem relapsů jsou paraaortální mízní uzliny, extrémně vzácně uzliny nad bránicí. Nehledě na tuto situaci je zřejmé, že je k dispozici účinná „salvage“ terapie (záchranná léčba) v podobě radioterapie nebo systémové chemické léčby. Øada studií zabývajících se taktikou zvýšeného dohledu se věnovala studiu prognostických a prediktivních faktorů relapsu. Multivariační analýzou 4 velkých studií se 638 zařazenými nemocnými se ukázalo, že nejzávažnějšími prediktivními faktory pro relaps jsou velikost tumoru a invaze do rete testis. Nemocní s přítomností nepříznivých prediktivních faktorů se k surveillance rozhodně nehodí. Nutno podotknout, že zvýšený dohled znamená relativně časté návštěvy nemocného v onkologickém zařízení, časté provádění zobrazovacích rentgenologických metod a nemocní jsou vystaveni prolongovaně psychickému stresu. Dohled je náročný na čas i finance, a navíc monitorování seminomů je obtížnější než sledování neseminomů. Tato taktika vyžaduje naprosto ukázněného pacienta a velmi zkušeného klinika. Surveillance umožňuje 85 % nemocným se seminomem prvního klinického stadia se vyhnout ozáření. V každodenní praxi je však vhodná jen pro úzkou skupinu nemocných.
Alternativní postupy (sledování nebo adjuvantní chemoterapie) jsou vhodné u nemocných s kontraindikací radioterapie (podkovovitá ledvina, zánětlivé onemocnění střeva, předchozí radioterapie v oblasti břicha). K definitivnímu vyřešení této otázky bude třeba srovnání zejména studií fáze III hodnotících dlouhodobé výsledky léčby, kvalitu života nemocných a ekonomickou náročnost jednotlivých přístupů. Významnou roli zde hraje i fakt, že v případě relapsu choroby má kombinovaná chemoterapie na bázi platiny kurabilní potenciál.
Lymfadenektomie prováděné před více než 30 lety, tedy před érou CT, u seminomů klinického stadia I prokázaly 10 % okultních retroperitoneálních metastáz. U seminomů téhož stadia diagnostikovaného moderními prostředky však neexistují srovnatelná data ze současnosti, nebo lymfadenektomie se již neprovádějí. Někteří autoři v této souvislosti nacházejí argumenty porovnáváním vývoje seminomů s germinálními nádory neseminomového typu (GNNST). Je známo, že nemocní s germinálními nádory neseminomového typu klinického stadia I mají v 10–19 % mikroskopické nádorové postižení retroperitoneálních uzlin. Lze říci, že 80 % nemocných je tedy vyléčeno samotnou orchidektomií a 20 % relabuje. Zastánci taktiky zvýšeného dohledu u seminomů tak vycházejí z analogie s GNNST na základě historických výsledků u pacientů s lymfadenektomií. Usuzují, že relapsů u seminomů by mělo být při uplatnění konzervativního přístupu méně než 10 % [1,4,5,13,14].
Klinické stadium IIA a IIB (paraaortální uzliny do 5 cm)
Je mnohem méně časté než stadium I. Standardní léčbou je zde kurativní radioterapie retroperitoneálních a stejnostranných pánevních uzlin technikou „hokejka“ („dog leg“). Dávka bývá aplikována v rozmezí 35–36 Gy. V poslední době se u stadia IIA doporučená dávka snížila na 30 Gy. V případě přítomnosti masivního uzlinového paketu v oblasti bifurkace aorty se zvyšuje pravděpodobnost vzniku retrográdních metastáz v pánvi a je doporučováno ozářit bilaterální pánevní uzliny a uzliny retroperitonea technikou „obrácené Y“.
Samostatnou radioterapií je vyléčeno 90–95 % nemocných, u relabujících je salvage chemoterapie účinná téměř ve 100 %. Od profylaktického ozáření mediastina u stadia II, které se používalo v minulosti, již bylo upuštěno, nebo nezlepšilo přežití, zhoršovalo toleranci léčby a často vedlo k pozdním komplikacím [2,5,7,15,16].
Klinické stadium IIC (paket větší než 5 cm) a III (diseminované onemocnění)
Radioterapie u stadia IIC dosáhne poměrně dobré lokální kontroly, avšak riziko relapsu mimo ozářený objem je až 50 %, což není akceptovatelné. Proto je u bulky onemocnění stadia II a u stadia III metodou volby kombinovaná chemoterapie s cisplatinou. Nejužívanějšími režimy jsou pro nízce riziková onemocnění 3 série režimem BEP - bleomycin, etopozid, cisplatina, eventuálně 4 cykly EP. Pro skupinu se středním rizikem se doporučují 4 série BEP. Role radioterapie následující po chemoterapii je kontroverzní. K relapsům u pacientů léčených samostatnou chemoterapií dochází nejčastěji v místě původního masivního postižení. Incidence těchto recidiv je však poměrně nízká (asi 12 %). Obsah vitálního tumoru v reziduích menších než 3 cm lze očekávat v 3 % případů, u nálezů větších než 3 cm asi v 10 % (vhodné je PET-vyšetření). Až u poloviny nemocných může dojít k samovolnému vymizení infiltrátu. Na základě těchto zkušeností je význam ozáření zpochybňován. Podle retrospektivní studie publikované na ASCO 1997, která zhodnotila výsledky léčby 302 pacientů z 10 evropských center, neovlivní ozáření reziduálních mas po chemoterapii dobu do progrese, a efekt radioterapie je minimální. Z toho důvodu je v současnosti u reziduí po chemoterapii do 3 cm doporučeno pouze sledování, u větších je metodou volby chirurgické odstranění.
Při léčbě onemocnění primárně diseminovaného do mozku je přínosná aplikace chemoterapie spolu s ozářením mozku dávkou 30–40 Gy, popřípadě s cíleným doozářením 10 Gy. Pokud není možno aplikovat chemoterapii, může být výjimečně použito u stadia IIC ozáření uzlin retroperitonea a oboustranných pánevních uzlin technikou „obrácené Y“ (25–30 Gy) s doozářením metastatického paketu v retroperitoneu (10 Gy).
V 60. letech se na mnoha pracovištích provádělo profylaktické ozáření mediastina a ozáření levého nebo obou nadklíčků s cílem zničit potenciální okultní metastázy v těchto oblastech. Od tohoto způsobu se všeobecně upustilo a autoři v současné době nevidí důvod k zatěžování pacienta další radiací, nebo relapsy ve jmenovaných oblastech jsou extrémně vzácné a lze je úspěšně léčit, až když vzniknou [2,4,5,7].
INTRATUBULÁRNÍ NEOPLAZIE
Při nálezu karcinomu in situ (tzv. intratubulární neoplazie) je indikováno ozáření varlete dávkou 18–20 Gy. V probíhajících studiích je však patrná tendence k redukci dávky až na 10 Gy [2,4,5,6].
ZÁVĚR
I přes stále rostoucí užití chemoterapie má radioterapie v léčbě seminomů své nezastupitelné místo. Podílí se na výborných výsledcích léčby tohoto onemocnění, zejména jako dosud standardní adjuvantní léčba stadia I a kurativní léčba stadia IIA a IIB. Ozáření je indikováno také jako prevence vzniku invazivního germinálního tumoru při průkazu intratububulární neoplazie v biopsii, dále po konzervativním chirurgickém výkonu a po operaci skrotálním přístupem. Role ozáření reziduálních mas po chemoterapii u pokročilého nebo metastatického onemocnění se zpochybňuje.
doc. MUDr. Pavel Šlampa, CSc.
MUDr. Blažena Syptáková
oddělení radiační onkologieMasarykův onkologický ústav, Brno
Zdroje
1. Abrahámová J. Nádory varla. Praha: Triton 2001 : 100.
2. Abrahámová J, Povýšil C, Novák J et al. Nádory varlat a penisu. Praha: Triton 2005 : 30
3. Adam Z, Vorlíček J et al. Speciální onkologie. Brno: MÚ 2002 : 166-176.
4. Adam Z, Vorlíček J, Vaníček J et al. Diagnostické a léčebné postupy u maligních chorob. 1. vyd. Praha: Grada 2002 : 185-196.
5. Šlampa P, Petera J et al. Radiační onkologie. 1. vyd. Praha: Galén 2006, v tisku.
6. Dieckmann KP, Besserer A, Loy V. Low-dose radiation therapy for testicular intraepithelial neoplasia. J Cancer Res Clin Oncol 1993; 119(6): 355-359.
7. Šlampa P et al. Radiační onkologie v praxi. Brno: MOÚ 2004 : 128-134.
8. Fossa SD, Horwich A, Russell JM et al. Optimal planning target volume for stage I testicular seminoma: a Medical Research Council randomized trial. J Clin Oncol 1999; 17 : 1146-1153.
9. Fossa SD, Horwich A, Russell JM et al. Optimal planning target volume for stage I testicular seminoma. J Clin Oncol 1999; 17(4): 1146.
10. Perez CA, Brady LW (ed.). Principles & Practice of Radiation Oncology. 4rd ed. Philadelphia: Lippincott& Wilkins 2004 : 1763-1799.
11. ICRU Report 50. Prescribing, recording and reporting photon beam therapy. International Commission for Radiation Units and Measurements, Bethesda, MD 1993 : 71.
12. Heindereich A. Therapeutical option for seminomas at clinical stage I-II A. Urologe 2005; 43(8): 1435-1444.
13. UICC. TNM klasifikace zhoubných novotvarů. 6. vyd. Praha: ÚZIS 2004 : 156-160.
14. Warde P, Specht L, Horwich A et al. Prognostic factors for relapse in stage I seminoma managed by surveillance: a pooled analysis. J Clin Oncol 2002; 21 : 4448-4452.
15. Classen J, Schmidberger H, Meisner C et al. Radiotherapy for stages IIA/B testicular seminoma. J Clin Oncol 2003; 21(6): 1101-1106.
16. Milosevic MF, Gospodarowicz M, Warde P. Management of testicular seminoma. Semin Surg Oncol 1999; 17 : 240-249.
Štítky
Dětská urologie Urologie
Článek LIEČBA NÁDOROV TESTISČlánek LYMFATICKÁ DRENÁŽ VARLETEČlánek ZE ZAHRANIČNÍCH PERIODIKČlánek EditorialČlánek KVÍZ
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2006 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- TERATOM VARLETE: SOUČASNÁ KLASIFIKACE Z POHLEDU WHO Z ROKU 2004
- VELKOBUNĚČNÝ NÁDOR ZE SERTOLIHO BUNĚK S KALCIFIKACEMI: PŘEHLED PROBLEMATIKY
- NÁDORY TESTIS: EPIDEMIOLÓGIA, ETIOLÓGIA, PATOLÓGIA A DIAGNOSTIKA
- LIEČBA NÁDOROV TESTIS
- NÁDORY VARLAT - CHIRURGICKÉ ŘEŠENÍ
- ROLE RADIOTERAPIE V LÉČEBNÉ STRATEGII NÁDORŮ VARLAT
- ZE ZAHRANIČNÍCH PERIODIK
- Editorial
- PENILNÍ PROTÉZA VE TŘETÍM TISÍCILETÍ
- RADIKÁLNÍ PROSTATEKTOMIE: OTEVŘENÁ, LAPAROSKOPICKÁ NEBO ROBOTICKY ASISTOVANÁ - JE MOŽNO NĚKTEROU OBJEKTIVNĚ PREFEROVAT?
- LYMFATICKÁ DRENÁŽ VARLETE
- ZPRÁVA Z KONFERENCE AUA ANNUAL MEETING 2006, ATLANTA, USA
- KVÍZ
- GUIDELINES EAU PRO DIAGNOSTIKU, KLASIFIKACI A LÉČBU TESTIKULÁRNÍHO KARCINOMU
- BIOLOGICKÉ CHOVÁNÍ GERMINÁLNÍCH NÁDORŮ VARLETE
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- LYMFATICKÁ DRENÁŽ VARLETE
- TERATOM VARLETE: SOUČASNÁ KLASIFIKACE Z POHLEDU WHO Z ROKU 2004
- PENILNÍ PROTÉZA VE TŘETÍM TISÍCILETÍ
- VELKOBUNĚČNÝ NÁDOR ZE SERTOLIHO BUNĚK S KALCIFIKACEMI: PŘEHLED PROBLEMATIKY
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





