-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
NÁDORY VARLAT - CHIRURGICKÉ ŘEŠENÍ
TESTICULAR TUMOURS - SURGICAL MANAGEMENT
The objective of surgical treatment of testicular cancer is to examine or remove the tumorous mass suspicious for testicular cancer and to intervene in the retroperitoneum. It is applicable for stage 3 seminomas and stage 1 and 3 non-seminoma tumours in the diagnostic and therapeutic process.
Stage 3 seminomas are typical for the presence of lymphogenic metastases above the diaphragma or other distant metastases. Radiotherapy is used as complementary therapy only.
Three methods with the same final effect are currently used for the treatment of stage 1 non-seminoma tumours: watchful waiting, or surveillance, Retroperitoneal Lymph Node Dissection (RPLND) and adjuvant chemotherapy. Relapsing patients are treated with chemotherapy. Therapy of stage 2 non-seminoma patients involves RPLND, chemotherapy or the combination of the above two therapies. Therapeutic approaches vary: the preferred first-line treatment is either RPLND (e.g. USA), or chemotherapy (Europe), capable of inducing complete remission. The article further deals with different surgery techniques. The author concludes that laparoscopic RPLND is the appropriate surgery in the case of non-seminomatous germ cell tumours (NSGT) for its staging (stage 1) and should be preferred to open surgery for its low morbidity. The benefit of the surgery, especially in terms of its curative effect, has not yet been clearly determined for stage 2. Surgery for residual tumour after chemotherapy should be considered a risky but beneficial strategy to precise the staging; curative effect is possible in the case of vital tumour, yet another 2 to 4 cycles of adjuvant chemotherapy are recommended.
KEY WORDS:
testicular tumours, inguinal exploration, orchiectomy, preserving intervention, tumour resection, retroperitoneal lymphadenectomy, RPLND, surgery technique in RPLND, laparoscopic RPLND, NSGT
Autoři: prim. MUDr. Ivan Pavlík; MUDr. Libor Šafařík, CSc.
Působiště autorů: Urologická klinika 1. LF UK a VFN, Praha
Vyšlo v časopise: Urol List 2006; 4(3): 27-32
Souhrn
Cílem chirurgické léčby nádorů varlat je revize nebo odstranění onkologicky suspektní testikulární nádorové masy a intervenci v retroperitoneu. V diagnosticko-léčebném procesu má své místo u seminomů III. stadia a nádorů neseminomového typu I. a II. stadia.
Stadium III. seminomů se vyznačuje přítomností lymfogenních metastáz nad bránicí nebo jinými vzdálenými metastázami. Radioterapie se indikuje jen jako terapie doplňková.
V terapii I. stadia nádorů neseminomového typu se v současné době používají 3 léčebné metody, které mají zcela stejné konečné výsledky: pečlivé sledování („wait and watch“, resp. surveillance), retroperitoneální lymfadenektomie (RPLND) a adjuvantní chemoterapie. V případě relapsu jsou nemocní léčeni chemoterapeutiky. Terapie stadia II nádorů neseminomového typu zahrnuje RPLND, chemoterapii a kombinaci obou uvedených způsobů. Terapeutické přístupy se liší: preferovanou léčbou 1. volby je buď RPLND (např. USA), nebo chemoterapie (Evropa), která je schopna navodit kompletní remisi. Dále jsou probrány jednotlivé operační techniky. Konstatuje se, že laparoskopická RPLND je v případě GNNST vhodnou operací pro staging (stadium I) a pro nízkou morbiditu by měla být preferována před otevřenou operací. Ve stadiu II je její přínos, zvláště kurativní, zatím nejasný. Operaci pro reziduální nádor po chemoterapii je nutno považovat za riskantní, avšak přínosnou k upřesnění stagingu. Kurativní efekt je v případě vitálního nádoru možný, doporučují se však další 2–4 cykly adjuvantní chemoterapie.
KLÍČOVÁ SLOVA:
nádory varlat, ingvinální explorace, orchidektomie, záchovný zákrok, resekce nádorur, etroperitoneální lymfadenektomie, RPLND, operační technika u RPLND, laparoskopická RPLND, GNNSTÚVOD
Hovoříme-li o chirurgické léčbě nádorů varlat, máme na mysli především revizi nebo odstranění onkologicky suspektní testikulární nádorové masy a intervenci v retroperitoneu. V diagnosticko-léčebném procesu má své místo u seminomů III. stadia a nádorů neseminomového typu I. a II. stadia.
III. stadium seminomů se vyznačuje přítomností lymfogenních metastáz nad bránicí nebo jinými vzdálenými metastázami. Radioterapie má v tomto stadiu i přes vysokou radiosenzitivitu seminomu omezený význam a používá se jen jako doplňková. Léčebně je toto stadium doménou kombinované chemoterapie, diskutován je význam cytoredukčních chirurgických výkonů. Ty se považují za léčebnou metodu volby, i když nejsou léčbou rutinní. Nemocní postižení relapsem seminomu v retroperitoneu po definitivní radiační léčbě a nemocní se zbytkovým retroperitoneálním nádorem po chemické a radiační léčbě jsou kandidáty k chirurgickému výkonu v retroperitoneu. Stejně tak nemocní s izolovanou plicní metastázou by měli být indikováni k jejímu chirurgickému odstranění, pokud metastáza perzistuje po ukončené chemoterapii [1].
V terapii I. stadia nádorů neseminomového typu se v současné době používají 3 léčebné metody, které mají zcela stejné konečné výsledky. Je to taktika pečlivého sledování („wait and watch“, resp. surveillance), retroperitoneální lymfadenektomie (RPLND) a adjuvantní chemoterapie. Retroperitoneální lymfadenektomie se považuje za alternativní metodu léčby u tohoto stadia. Provádí se modifikovaná unilaterální, infrahilární RPLND technikou šetřící nervové pleteně (nerve-sparing) tak, aby byla zachována ejakulace. Relapsy po RPLND činí kolem 10 %. V případě relapsu jsou nemocní stejně jako u relapsů skupiny surveillance léčeni chemoterapeutiky. Jde tedy vlastně o stagingovou RPLND.
Léčebné způsoby II. stadia nádorů neseminomového typu zahrnují RPLND, chemoterapii a kombinaci obou uvedených způsobů. Na rozdíl od stadia I, je zde objektivně prokazatelný nález v retroperitoneu. Existují pracoviště (zejména v USA), která preferují RPLND jako léčbu 1. volby, a to hlavně v případech, v nichž byl nález menší než 3 cm v průměru. Většina evropských pracoviš se přiklání k primární chemoterapii tím spíše, že se chemoterapie indikuje po RPLND ve většině případů, zejména pokud byla v odebraném materiálu nalezena některá z postižených uzlin alespoň velikosti 2 cm. Pro primární chemoterapii svědčí fakt, že může navodit kompletní remisi. Tím se stává RPLND zbytečnou, má však nesporný význam v případech, v nichž po předchozí chemoterapii nedošlo ke kompletní remisi [1].
INGVINÁLNÍ EXPLORACE A ORCHIDEKTOMIE
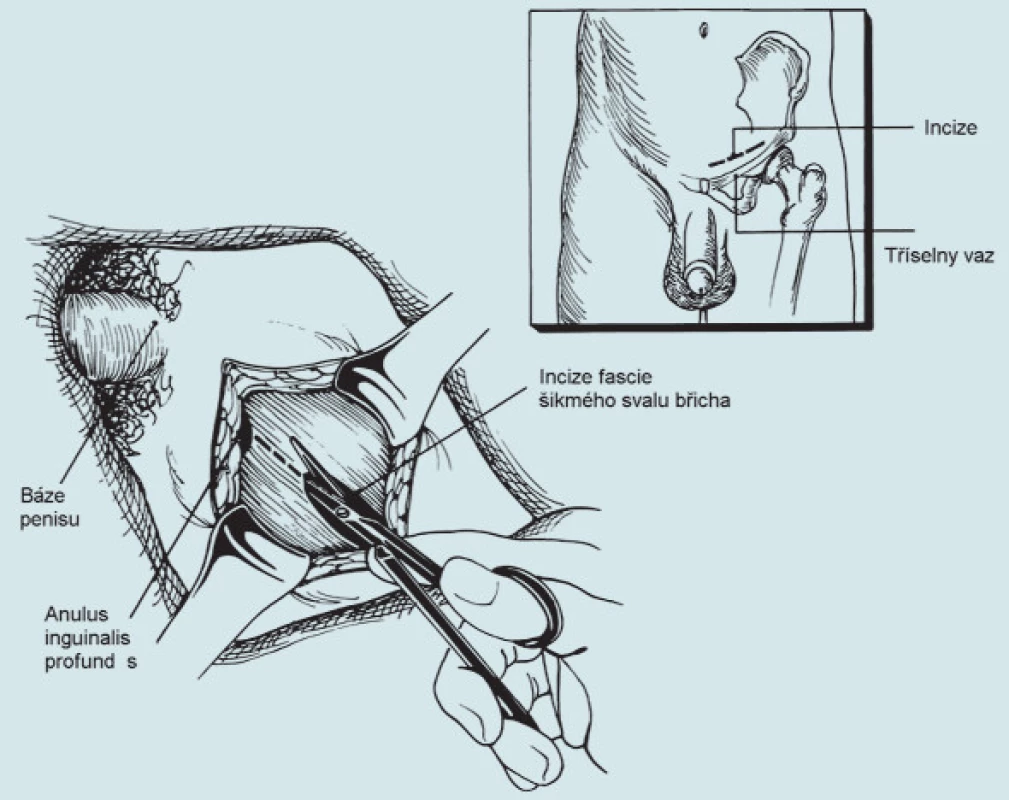
Každá onkologicky suspektní testikulární masa musí být potvrzena ingvinální explorací, a je-li odhalen tumor, okamžitou orchidektomií. Tu je třeba provést co nejdříve po klinickém vyšetření. Růst některých nádorů bývá velmi rychlý a zdvojnásobení objemu během 5 dnů nebývá výjimečné. Operaci provádíme z tříselného řezu (obr. 1). Izolovaný spermatický provazec „zaklemujeme“, otevřeme vaginální tuniku a varle zrevidujeme. V případě nejasnosti můžeme odeslat k rychlému zpracování bioptický vzorek. Jeho interpretace je však obtížná a výtěžnost často malá. Je-li diagnóza jasná, provádíme vysokou orchiektomii a varle odstraňujeme s co možná nejdelším kusem provazce. V řadě zemí bývá v této fázi rutinním postupem i biopsie druhostranného varlete, a to vzhledem k 5% výskytu testikulární intratubulární neoplazie (TIN). Pokud je však toto varle atrofické, je nutné biopsii udělat v každém případě. Vzhledem k riziku lokálního rozsevu a změny lymfatické drenáže do tříselných uzlin, neprovádíme biopsii varlete skrze kožní kryt. U nemocných s extenzivním metastatickým postižením uzlin můžeme k diagnóze využít tumorových markerů nebo jehlové biopsie z metastáz. V tomto případě nemusí být orchiektomie nutně iniciálním zákrokem.
ZÁCHOVNÝ ZÁKROK - RESEKCE NÁDORU
Obecně není záchovný výkon při podezření na nádor indikován. V případě oboustranného výskytu nebo postižení solitárního varlete lze u nádorů menších než 2 cm provést jeho resekci [2]. Okolní tkáň, postižená až v 82 % případů CIS, může být pak doléčena radioterapií.
RETROPERITONEÁLNÍ LYMFADENEKTOMIE
Všechny testikulární germinální nádory (TGN) se šíří lymfatickými uzlinami, ačkoliv v případě choriokarcinomu je vaskulární diseminace mnohem častější a obvyklejší. Primární lymfatickou drenážní oblastí varlete je oblast jeho embryonálního původu, to znamená retroperitoneální lymfatické uzliny v okolí velkých cév [3]. Lymfatické cévy z pravého varlete ústí do interaortokaválních, prekaválních a parakaválních lymfatických uzlin, zatímco lymfatické cévy z levého varlete zásobují levostranné paraaortální a preaortální uzliny [4]. Odstranění spádových uzlin retroperitonea u germinálních nádorů neseminomového typu (GNNST) nízkého stadia má několik potenciálních výhod. Za prvé dobře provedená operace je nejefektivnějším doplněním stagingu. Až 30 % pacientů klinicky zařazených do stadia I má nález postižených uzlin a spadá ve skutečnosti do stadia II. Dalších 23 % pacientů zařazených klinicky do stadia II patří na základě negativního histologického nálezu ve skutečnosti do stadia I. Za druhé odstranění postižených uzlin má kurabilní efekt a za třetí RPLND do budoucna eliminuje retroperitoneum jako místo recidivy. Proto pacienti po RPLND v nízkém stadiu nemusí být sledováni CT břicha. To zlepší kvalitu života a sníží cenu sledování. Dalším pozitivním aspektem je snížení intenzity sledování. Pacient je kontrolován v delších časových intervalech, podstoupí méně RTG plic, krevních odběrů a návštěv u lékaře, což přispívá pozitivně ke snížení stresu a zlepšení psychického stavu. Nervy šetřící RPLND je vedena tak, aby byla u nemocných zachována emise a ejakulace a pacient zůstal fertilní. Konečně RPLND snižuje i pravděpodobnost pozdní recidivy a má tak kladný vliv na celkové přežití (bylo prokázáno, že vyléčení u pozdní recidivy je pouze 40 %). U nemocných po chemoterapii s přetrvávajícím uzlinovým nálezem v retroperitoneu, normalizací HCG a AFP (parciální remise) indikujeme RPLND rovněž. Ve 45 % případů nalézáme histologicky struktury zralého teratomu, stejným dílem je zastoupena fibrózní nebo nekrotická tkáň a asi v 10 % je přítomen GNNST. Tyto nálezy mají jak prognostický, tak - v případě odstranění vitálního nádoru - terapeutický efekt, který, je-li přítomen karcinom, zajišujeme dalšími 2 kúrami chemoterapie na bázi platiny [5].
OPERAČNÍ TECHNIKA
Oboustranná retroperitoneální lymfadenektomie
Základním principem RPLND je myšlenka, že velké cévy jsou mobilizovány kompletně a odděleny od nádoru. Poté je nádor a ostatní lymfatická tkáň uvolněna od retroperitonea. Koncepce je známá pod názvem „rozděl a stáhni“ (split and roll) a jejím autorem je Donohue [6,7]. Výkon se skládá z 3 kroků:
- orientace v retroperitoneu a výběr tkání, které budou odstraněny
- mobilizace velkých cév, renálních arterií, vén a nervových struktur
- odstranění lymfatických struktur za kontroly lumbálních arterií a vén
Laparotomický řez vedeme ve střední čáře od symfýzy až asi 5 cm pod mečík hrudní kosti. Palpačně ohledáme retroperitoneum a podle objemu a lokalizace nádorové masy zvolíme další postup. Je-li nutná oboustranná RPLND, otevíráme zadní peritoneum od foramen epiploicum (Winslow) distálně podél céka a zpět proximálně k ligamentum Treitzi (obr. 2).
Obr. 2. Přístup k uzlinám v retroperitoneu. 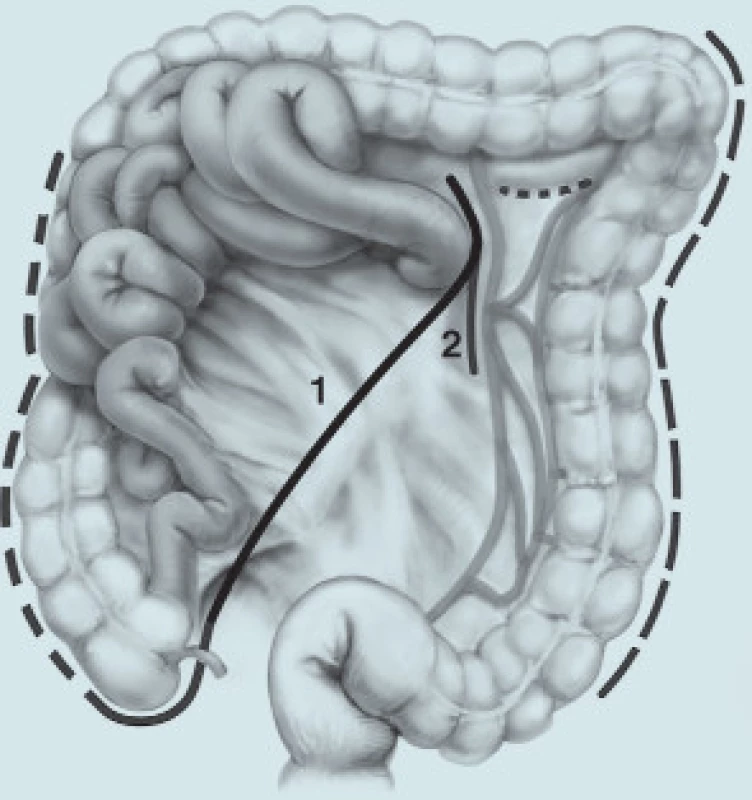
Dolní mezenterickou vénu podvážeme a přerušíme. Cékum a radix mezenteria spolu se vzestupným tračníkem vyklopíme z dutiny břišní a umístíme na hrudník do střevního vaku. Hranice resekce nyní určují proximálně crura bránice, bifur-kace společných iliakálních arterií a laterálně oba močovody. „Split“ manévr začínáme před aortou na č. 12. K rozdělení tkáně používáme obvykle pravoúhlý disektor s kauterizací nebo nůžky „Metzenbaum“. Tkáň zvolna stahujeme („roll“ manévr) mediálně a laterálně. Obnažené lumbální arterie mobilizujeme, podvazujeme a přerušujeme. Stejný manévr provádíme také nad levou renální vénou a poté, co je tkáň stažena distálně, přerušujeme zpravidla levou testikulární vénu. Lumbální vénu, která se v této lokalizaci vyskytuje ve 40 % případů, přerušujeme a pečlivě podvazujeme. Podobně uvolňujeme z lymfatické a nádorové tkáně i levou renální arterii.
V další fázi obracíme pozornost na oblast dolní duté žíly. Provádíme podobný manévr jako nad aortou a stahujeme uvolněnou tkáň mediálně a laterálně. Tím opět zpřístupňujeme lumbální vény, podvazujeme je a přerušujeme. Postupně uvolňujeme levou renální vénu a pod ní se nacházející renální arterii. Po úplné disekci lymfatické tkáně v této oblasti bývají zřetelná crura bránice. Po stažení tkáně distálně přerušujeme pravou testikulární vénu. Na závěr ještě uvolníme oba iliakální cévní svazky a případně ligujeme a přerušíme nabízející se lumbální cévní větve. Zkontrolujeme intaktnost obou močovodů tvořících nyní laterální okraj operačního pole. Uvolněnou a vypreparovanou lymfatickou a nádorovou tkáň oddělíme za pomocí kauteru, eventuálně s využitím liga-klipů. Tím jsme odstranili lymfatickou tkáň ze 4 důležitých oblasti: levé periaortální, interaortokavální, pravé parakavální a interiliakální (obr. 3).
Obr. 3. Retroperitoneální uzliny. 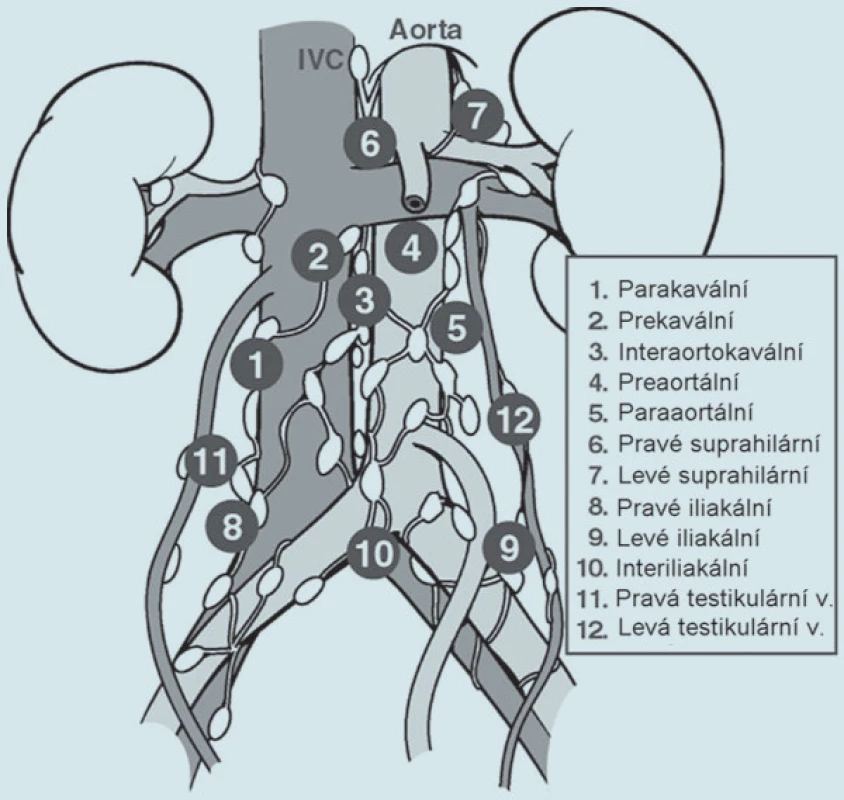
Nejčastějším vedlejším účinkem bilaterální RPLND je ztráta antegrádní ejakulace a infertilita díky postižení sympatických nervových vláken. Hlubší poznání neuroanatomie emise a ejakulace, anatomické studie distribuce retroperitoneálních metastáz pravostranných a levostranných TGN vedly k modifikacím výše popsaného chirurgického postupu a ke snížení nežádoucích účinků.
Modifikovaná a nervy šetřící retroperitoneální lymfadenektomie
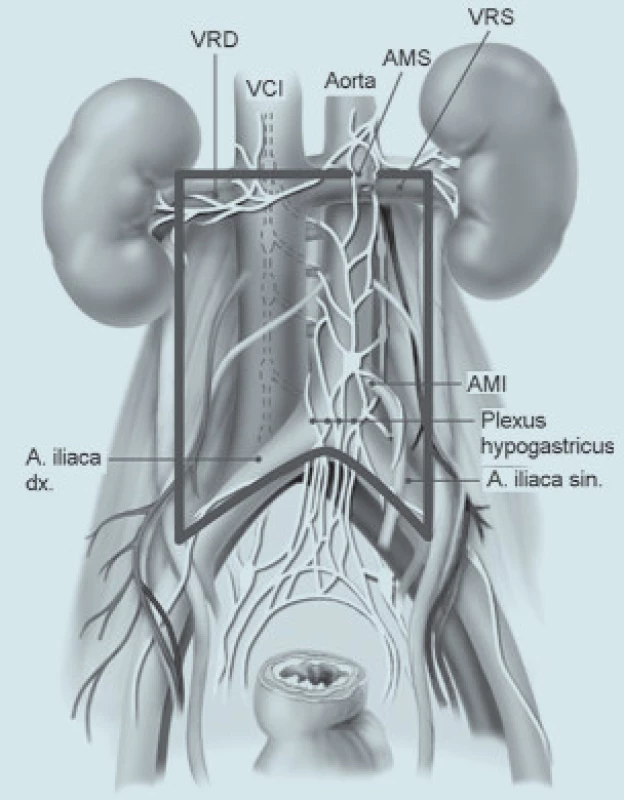
Na rozsah a místo postižení v retroperitoneu mají vliv 2 faktory. Jsou to objem nádorové masy a lateralita postiženého varlete. U pacientů s onemocněním nízkého stadia se vzhledem k minimálnímu postižení retroperitonea provádí jen tzv. modifikovaná nervy-šetřící RPLND [8]. Její výhodou je kratší operační čas, menší počet pooperačních ileózních stavů a ochrana emise a ejakulace (až v 99 % případů). Antegrádní ejakulace vyžaduje koordinaci 3 oddělených činností: 1. uzávěr hrdla močového měchýře, 2. emise semenných váčků a 3. ejakulace. Sympatická vlákna odpovědná za emisi ze semenných váčků vycházejí primárně z Th12 až L3. Asi uprostřed retroperitonea, poté, co opustí truncus sympaticus, se vlákna spojují a blízko odstupu dolní mezenterické arterie nad aortální bifurkací vytvářejí hypogastrický plexus (obr. 4). Z něho vycházející sympatická vlákna distálně formují pánevní plexus a inervují semenné váčky, vas deferens, prostatu a hrdlo močového měchýře. Ejakulace je zprostředkována nervy vycházejícími ze sakrálních a lumbálních míšních kořenů. Sympatická vlákna uzavírají hrdlo měchýře, zatímco pudendální somatická inervace S2-S4 způsobuje relaxaci zevního svěrače a je odpovědná za rytmické kontrakce bulbouretrální a perineální svaloviny. Peroperační šetření paravertebrálních sympatických ganglií T2-L4 a vláken konvergujících v hypogastrický plexus má klíčový vliv na zachování antegrádní ejakulace. Z tohoto důvodu provádíme v indikovaných případech modifikovanou a nervy šetřící disekci. Kandidáty na nervy šetřící RPLND jsou pacienti s klinickým stadiem I. Před vlastním zahájením disekce identifikujeme sympatické nervy a to zejména 1. bilaterální sympatické svazky, z nich vycházející 2. postganglionární sympatická nervová vlákna a 3. hypogastrický plexus před dolní částí aorty. Existuje určitá variabilita průběhu sympatických nervových pletení, ale obecně lze říci, že při pravostranné RPLND identifikujeme eferentní pleteně jdoucí z prostoru za vena cava do interaortokaválního prostoru, z něhož překračují aortální bifurkaci do pánve. Sympatická vlákna na levé straně kříží levou společnou iliakální arterii. Směrem proximálním procházejí levou periaortální lymfatickou tkání a vstupují do sympatického kmene. Je proto bezpečné provádět „split“ manévr na přední straně v. cava, který nervy nepoškodí. Naproti tomu před podobným manévrem nad aortou je nutné tyto nervy identifikovat a izolovat tak, aby nedošlo k jejich přerušení [9,10]. Zvláště je nutný opatrný postup při přerušování a prepa-raci lumbální cév, které jsou často doprovázeny nervovými vlákny, z nichž ty, jdoucí z ganglií L3-L4 mají asi největší podíl na ejakulaci. Správná operační technika uchová tuto funkci až u 95 % nemocných (obr. 5 a 6)
Obr. 5. RPLND pravostranná, modifikovaný přístup. 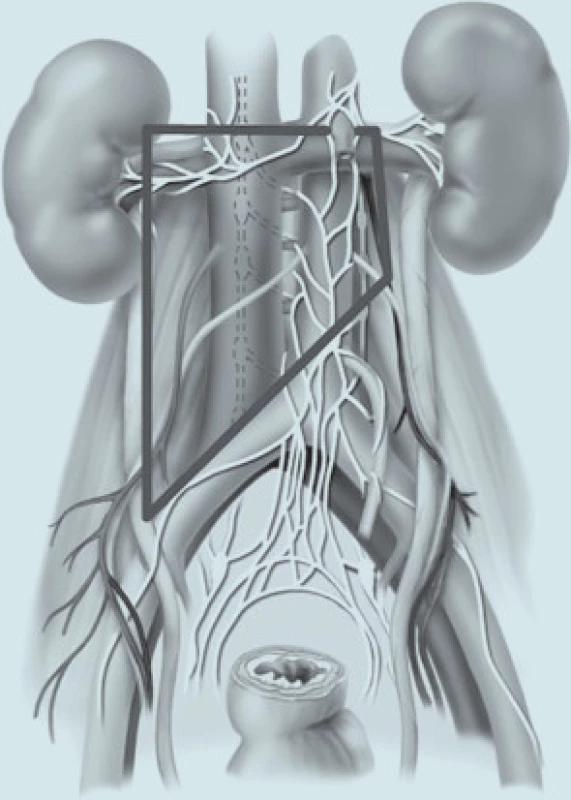
Obr. 6. RPLND levostranná, modifikovaný přístup. 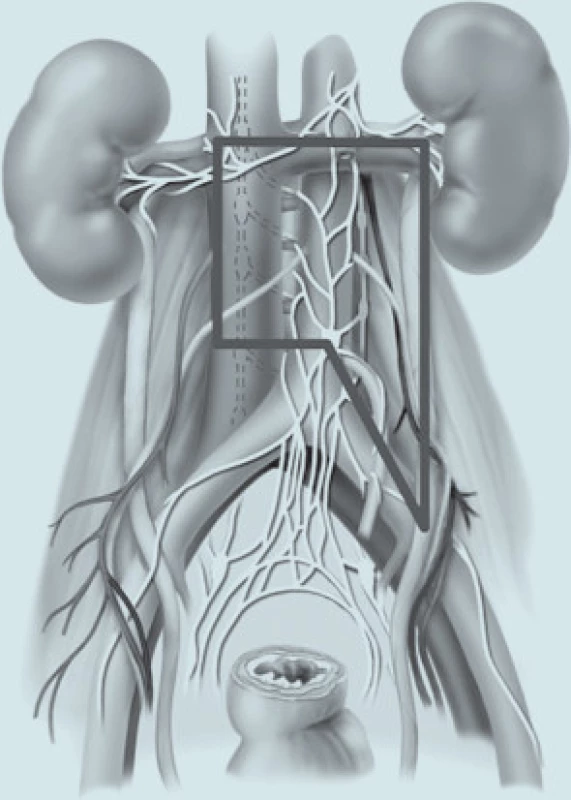
Retroperitoneální lymfadenektomie pro přetrvávající uzlinový nález
Po chemoterapii, a někdy i po kombinaci chemoterapie s aktinoterapií přetrvává u nemocných pozitivní uzlinový nález a chirurgické odstranění nádorové masy je to jediné, co můžeme ještě pro nemocného udělat. Nezřídka mají tito nemocní postižené i suprahilární, retrokrurální, pánevní nebo mediastinální prostory. Standardní bilaterální RPLND tak musí být modifikována. Retrokrurální a mediastinální nádory vyžadují incizi torakoabdominální nebo typu „chevron“ a následně i mobilizaci jater, sleziny, žaludku a hlavy pankreatu. Operační přístup a technika jsou vždy individuální a závisejí na rozsahu postižení, lokalizaci a velikosti nádorové masy. Základní technika „rozděl a stáhni“ však zůstává stejná.
U těchto nemocných se setkáváme v perioperačním období s vyšší četností komplikací. Ty se vyskytují až u 20,7 % pacientů [11]. Jde zejména o lymfokélu, plicní komplikace (atelektáza, pneumonie, ARDS), infekce, krvácení, poranění nervů, gastrointestinální (paralytický ileus, stresový vřed, pankreatitis). Dříve rutinně prováděná apendektomie se pro vyšší četnost infekčních komplikací již nedoporučuje [12].
Retroperitoneální lymfadenektomie je většinou dobře tolerována. Mortalita nedosahuje obvykle 1 % a morbidita se pohybuje mezi 5–25 %. Nejčastějšími komplikacemi bývají atelektáza, pneumonie, ileus, lymfokéla a pankreatitis [5,10].
Laparoskopická retroperitoneální lymfadenektomie
Laparoskopická retroperitoneální lymfadenektomie (LRPLND) je v dnešní době indikována na pracovištích, která mají již větší zkušenosti s laparoskopiemi v urologii, nebo nároky na orientaci a přesnou preparační techniku jsou v případě postchemoterapeutických reziduálních mas v blízkosti aorty a dolní duté žíly extrémní.
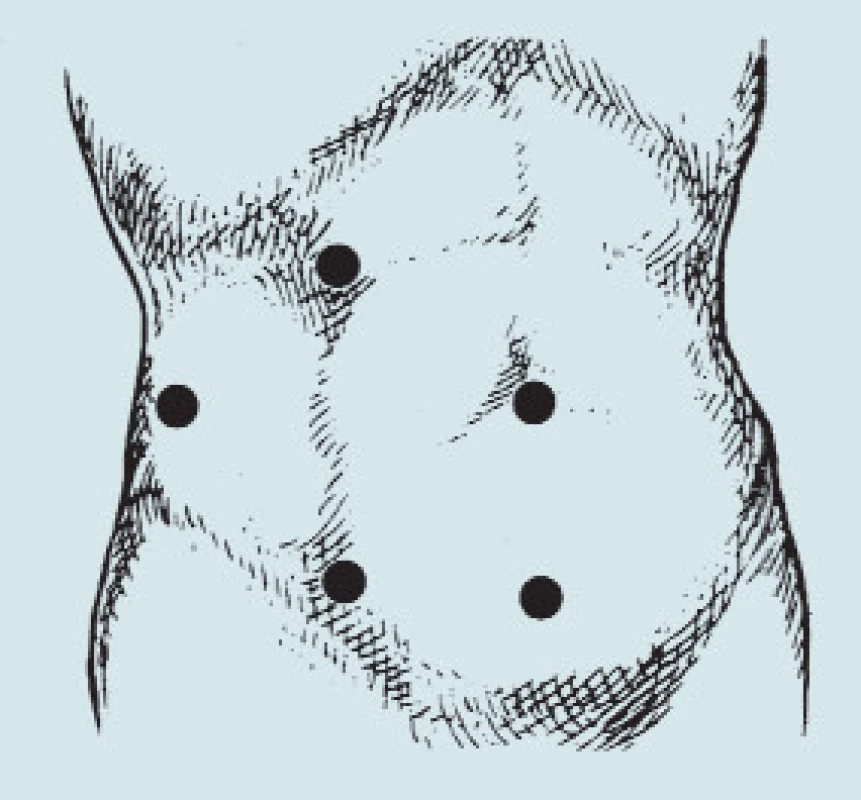
Indikace k LRPLND je v podstatě stejná jako při indikaci otevřené retroperitoneální lymfadenektomie. Pro laparoskopickou lymfadenektomii se rozhodneme především v těch případech, v nichž nejsou předpoklady rozsáhlých intraabdominálních srůstů po předchozích operacích a dále v těch případech, v nichž jsou jak technické, tak personální podmínky pro to, aby bylo možno tuto náročnou operaci provést [13,14,15]. Z hlediska čistě praktického se předoperační příprava před touto operací neliší od otevřené operace. Vhodné je, když má pacient vyprázdněn gastrointestinální systém, předoperačně je zavedena nazogastrická sonda a měchýřová cévka. S úvodem do anestézie je podáno širokospektrální antibiotikum, které do 48 hodin vysazujeme, nedojde-li během operace ke komplikacím. Pokud může anesteziolog vynechat oxid dusný, pak je to rovněž považováno za výhodu, nebo N2O má výrazný podíl na paralýze a distenzi střevních kliček během operace a při delším průběhu kličky mechanicky brání operujícímu v přehledu v operačním poli. Na rozdíl od otevřené operace, při níž je nemocný v poloze na zádech a řez se vede ve střední čáře na břiše, při LRPLND pacient leží v poloze na boku, a to stranou, která má být operována, nahoru. Operační stůl je flektován s bodem zlomu v přibližné výši renálního hilu a dolní část trupu je skloněna k zemi tak, aby střevní kličky gravitací směřovaly do kontralaterální jámy kyčelní proti operované straně v retroperitoneu. Zakládáme celkem 4–5 portů (obr. 7). Za použití 30° optiky (ta však může být zaměněna za 0° dle zvyklostí operujícího) incidujeme mesocolon ascendens, resp. descendens a část mesocolon transversum v rozsahu, který nám umožní dosáhnout retroperitonea. Na pravé straně Kocherovým manévrem uvolníme duodenum a necháme klesnout mediálně, na levé straně dáme pozor na kaudu pankreatu po odklopení sleziny. Na obou stranách musíme dosáhnout renálního hilu jakožto kraniální hranice disekce. Laterálně nám ohraničuje operační pole močovod. V dnešní době jej zpravidla preoperačne nestentujeme, jen tam, kde předpokládáme velké srůsty, nám může ureterální cévka v močovodu pomoci s jeho identifikací. Mediální a distální hranice je určena klasicky podle Donohuea tak, aby nedocházelo k „suché ejakulaci“ v pooperačním období - modifikovaná RPLND [8]. Stagingové operace pro GNNST zpravidla nejsou tak obtížné, jako disekce reziduálních uzlin po chemoterapii, eventuálně radioterapii. Zvláště na pravé straně nad dolní dutou žílou (vena cava inferior - VCI) je velké riziko, že buď exstirpace nebude dokonalá, nebo tenká stěna VCI povolí a dojde k masivnímu krvácení. To je také nejčastější příčinou konverze laparoskopických RPLND na otevřený výkon. Kumulativní procento komplikací se uvádí mezi 25–29 % [16,17]. Pokud se operaci podaří dokončit laparoskopicky, pak se pohybuje pooperační doba hospitalizace mezi 2–4 dny [18]. Peroperačně ani v pooperačním období není zpravidla nutné podávat transfuzi a sací drén je možno odstranit 2.–3. den s plnou mobilizací pacienta již od 1. pooperačního dne. Proti otevřené retroperitoneální lymfadenektomii prakticky nepozorujeme pooperační paralytický ileus, takže nemocný může již od 1. dne přijímat perorálně potravu (nejprve tekutou, od 2. dne kaši). Z hlediska onkologické „čistoty“ operačního pole je LRPLND ve zkušených rukách stejně bezpečná jako otevřená retroperitoneální lymfadenektomie. Rassweiler uvádí pouze 2 recidivy teratomu z 80 provedených LRPLND (2,5 %), Janetschek nalezl jen 1 recidivu po 64 provedených operacích (1,6 %) [19,20]. V literatuře jsou jen ojedinělé zprávy o metastáze v portu po LRPLND [19].
Závěrem je možné shrnout, že laparoskopická retroperitoneální lymfadenektomie u GNNST je vhodnou operací pro staging (stadium I) a pro nízkou morbiditu by měla být preferována před otevřenou operací. Ve stadiu II je její úloha zatím nejasná především z hlediska kurativního. Operaci pro reziduální nádor po předchozí chemoterapii je nutno považovat za riskantní, ale vhodnou k upřesnění stagingu. Její kurativní efekt je možný v případě vitálního nádoru, ale další 2–4 cykly adjuvantní chemoterapie jsou na místě [21].
prim. MUDr. Ivan Pavlík
MUDr. Libor Šafařík, CSc.
Urologická klinika 1. LF UK a VFN, Praha
Zdroje
1. Abrahámová J. Nádory varlat. Postgraduální medicína 2003; 5(6): 599-615.
2. Heidenreich A, Weissbach L, Holth W et al. Organ sparing surgery for malignant germ cell tumor of the testis. J Urol 2001; 166 : 2161-2165.
3. Skinner DG, Leadbetter WF. The surgical management of the testis tumors. J Urol 1971; 106 : 84-93.
4. Weinstein M. Lymphatic drainage of the testes. Atlas Urol Clin North Am 1999; 7 : 1-7.
5. Walsh P, Retik AB, Vaughan ED (eds). Campbell´s Urology. 8th ed. Philadelphia: WB Saunders 2002.
6. Donohue JP. Retroperitoneal lymphadenectomy: the anterior approach including bilateral suprarenal hilar disection. Urol Clin N Am 1977; 4 : 509-521.
7. Donohue JP, Thornhill JA, Foster RS et al. Retroperitoneal lymphadenectomy for clinical stage A testis cancer (1965-1989): Modifications of technique and impact on ejaculation. J Urol 1993; 149 : 237-243.
8. Donohue JP, Foster RS, Rowland RG et al. Nerve sparing retroperitoneal lymhadenectomy with preservation for ejaculation. J Urol 1990; 144 : 287-292.
9. Klein EA. Nerve-sparing retroperitoneal lymphadenectomy. Atlas Urol Clin 1995; 3 : 63-79.
10. Hamdy FC, Basler JW, Neal DE et al. Management of Urological Malignancies. London: Churchill Livingstone 2002.
11. Baniel J, Foster RS, Rowland RG et al. Complications of primary retroperitoneal lymph node dissection. J Urol 1994; 152 : 424-427.
12. Lebovitch I, Rowland RG, Goldwasser B et al. Incidental appendectomy during urological surgery. J Urol 1995 : 154 : 1110-1112.
13. Rassweiler JJ, Seemann O, Henkel TO et al. Laparoscopic retroperitoneal lymph node disection for nonseminomatous germ cell tumors: indications and limitations. J Urol 1996; 156 : 1108-1113.
14. Nelson JB, Chen RN et al. Laparoscopic retroperitoneal lymph node disection for clinical stage I nonseminomatous germ cell testicular tumors. Urology 1999; 54 : 1064-1067.
15. Rassweiler JJ, Frede T, Lenz E et al. Long-term experience with laparoscopic retroperitoneal lymph node dissection in the management of low-stage testis cancer. Eur Urol 2000; 37 : 251-260.
16. Wonfield HN. Laparoscopic retroperitoneal lymphadenectomy for cancer of the testis. Urol Clin N Am 1998; 25(3): 469-478.
17. Palese MA, Su LM, Kavoussi LR. Laparoscopic retroperitoneal lymph node dissection after chemotherapy. Urology 2002; 60(1): 130-134.
18. Janetschek G, Peschel R, Hobisch A. Laparoscopic retroperitoneal lymph node dissection. J Endourol 2001; 15(4): 449-453.
19. Rassweiler J, Tsivian A, Kumar AV. Oncological safety of laparoscopic surgery for urological malignancy: experience with more than 1,000 operations. J Urol 2003; 169(6): 2072-2075.
20. Janetschek G, Hobisch A, Peschel R. Laparoscopic retroperitoneal lymph node dissection. Urology 2000; 55(1): 136-140.
21. EAU Guidelines - update. Guidelines on laparoscopy 2003 : 23. http://www.uroweb.nl/files/uploaded_ files/2002_Testicular_secure.pdf
Štítky
Dětská urologie Urologie
Článek LIEČBA NÁDOROV TESTISČlánek LYMFATICKÁ DRENÁŽ VARLETEČlánek ZE ZAHRANIČNÍCH PERIODIKČlánek EditorialČlánek KVÍZ
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2006 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- TERATOM VARLETE: SOUČASNÁ KLASIFIKACE Z POHLEDU WHO Z ROKU 2004
- VELKOBUNĚČNÝ NÁDOR ZE SERTOLIHO BUNĚK S KALCIFIKACEMI: PŘEHLED PROBLEMATIKY
- NÁDORY TESTIS: EPIDEMIOLÓGIA, ETIOLÓGIA, PATOLÓGIA A DIAGNOSTIKA
- LIEČBA NÁDOROV TESTIS
- NÁDORY VARLAT - CHIRURGICKÉ ŘEŠENÍ
- ROLE RADIOTERAPIE V LÉČEBNÉ STRATEGII NÁDORŮ VARLAT
- ZE ZAHRANIČNÍCH PERIODIK
- Editorial
- PENILNÍ PROTÉZA VE TŘETÍM TISÍCILETÍ
- RADIKÁLNÍ PROSTATEKTOMIE: OTEVŘENÁ, LAPAROSKOPICKÁ NEBO ROBOTICKY ASISTOVANÁ - JE MOŽNO NĚKTEROU OBJEKTIVNĚ PREFEROVAT?
- LYMFATICKÁ DRENÁŽ VARLETE
- ZPRÁVA Z KONFERENCE AUA ANNUAL MEETING 2006, ATLANTA, USA
- KVÍZ
- GUIDELINES EAU PRO DIAGNOSTIKU, KLASIFIKACI A LÉČBU TESTIKULÁRNÍHO KARCINOMU
- BIOLOGICKÉ CHOVÁNÍ GERMINÁLNÍCH NÁDORŮ VARLETE
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- LYMFATICKÁ DRENÁŽ VARLETE
- TERATOM VARLETE: SOUČASNÁ KLASIFIKACE Z POHLEDU WHO Z ROKU 2004
- PENILNÍ PROTÉZA VE TŘETÍM TISÍCILETÍ
- VELKOBUNĚČNÝ NÁDOR ZE SERTOLIHO BUNĚK S KALCIFIKACEMI: PŘEHLED PROBLEMATIKY
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání