-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infekčné komplikácie behom indukčnej liečby akútnej myeloidnej leukémie bez použitia antibiotickej profylaxie
Infectious complications of induction therapy in acute myeloid leukaemia patients without the use of antibiotic prophylaxis
The induction chemotherapy represents one of the riskiest phases of therapy of acute myeloid leukaemia (AML) due to reduced haematopoiesis and a big tumour mass. Therefore, the infectious complications are very frequent in patients undergoing induction chemotherapy. They represent an important risk factor of the mortality of primary diagnosis. This research aims at describing the infectious complications and their therapy carried out during the first cycle of induction chemotherapy on the group of 100 AML patients, who were treated without antibiotic prophylaxis, in the Department of Haemato-Oncology, Faculty of Medicine and Dentistry, Palacký University and University Hospital Olomouc during the years 2007–2011. This research also compares the result of the above patient group with the groups of AML patients published in literature who had been given an antibiotic prophylaxis during induction. Our results showed that 93% of patients had infectious complications during induction chemotherapy. Clinically and/or microbiologically documented infections were described in 48 patients and febrile neutropenia was described in 45 patients. Sepsis was documented in 32 patients, inflammatory infiltrate of lungs and extrapulmonary infectious focuses were observed in 24 patients each. Proven invasive fungal infections were noticed in 2, probable in 4 and possible in 29 patients. The achieving of complete remission (67%) after induction therapy had a significant influence on lower occurrence of sepsis (22.4% vs. 51.5%, p = 0.0037), shorter hospitalization (35.1 vs. 39.4 days, p = 0.028), shorter antibiotic (27.8 vs. 35.0 days, p = 0.011) and antifungal (27.9 vs. 33.2 days, p = 0.031) therapy in comparison with non-remission patients. Seven patients undergoing induction chemotherapy had no signs of infection. Infectious complications were the cause of death in 3 patients. The results showed that, occurrence of infectious complications during induction was not significantly higher in patients without the use of antibiotic prophylaxis in comparison with published data of patients receiving antibiotic prophylaxis (93.0% vs. 85.2% (p = 0.088), respectively 91.3% (p = 0.58). The monitoring of bacterial resistance, adverse effects and clinical efficiency should be the conditions for using antibiotic prophylaxis in patients undergoing induction chemotherapy for AML.
Key words:
acute myeloid leukaemia, induction chemotherapy, infectious complications, complete remission
Autoři: M. Čerňan 1; T. Szotkowski 1; M. Kolář 2
; J. Hubáček 1; E. Faber 1
Působiště autorů: Hemato-onkologická klinika LF UP a FN Olomouc 1; Ústav mikrobiologie LF UP a FN Olomouc 2
Vyšlo v časopise: Transfuze Hematol. dnes,21, 2015, No. 1, p. 14-23.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Indukčná liečba predstavuje v dôsledku ťažko redukovanej normálnej krvotvorby a veľkej nádorovej masy jednu z najrizikovejších fáz terapie akútnej myeloidnej leukémie (AML). Infekčné komplikácie sú preto u pacientov podstupujúcich indukciu veľmi časté. Predstavujú významný rizikový faktor mortality primárneho ochorenia. Cieľom práce bolo komplexne zmapovať infekčné komplikácie v priebehu prvého cyklu indukčnej chemoterapie a ich terapiu na súbore 100 pacientov s AML liečených na Hemato-onkologickej klinike LF UP a FN v Olomouci v rokoch 2007–2011 bez antibiotickej profylaxie a porovnať ich s literárnymi údajmi o pacientoch s AML v indukcii, ktorí dostávali antibiotickú profylaxiu. Výsledky ukázali, že 93 % pacientov malo behom indukčnej chemoterapie infekciu. Klinicky a/alebo mikrobiologicky dokumentované infekčné komplikácie sa vyskytli u 48 a febrilná neutropénia u 45 pa-cientov. Sepsa bola dokumentovaná u 32 pacientov, zápalový pľúcny infiltrát a extrapulmonálne ložiskové infekcie zhodne u 24 pacientov. Dokázané invazívne mykotické infekcie boli popísané u 2, pravdepodobné u 4 a možné u 29 pacientov. Dosiahnutie kompletnej remisie (67 %) po indukčnej terapii malo významný vplyv na nižší výskyt sepsy (22,4 % vs. 51,5 %, p = 0,0037), kratšiu dobu hospitalizácie (35,1 vs. 39,4 dní, p = 0,028), antibiotickej (27,8 vs. 35,0 dní, p = 0,011) a antimykotickej (27,9 vs. 33,2 dní, p = 0,031) terapie v porovnaní so skupinou pacientov, ktorí remisiu nedosiahli. Bez známok infekcie prebehla indukčná chemoterapia u 7 pacientov. U troch pacientov boli infekčné komplikácie príčinou úmrtia. Výsledky ďalej ukázali, že výskyt infekčných komplikácií u pacientov bez antibiotickej profylaxie nebol významne vyšší, v porovnaní so skupinami pacientov udávanými v literatúre, ktorí dostávali antibiotickú profylaxiu (93,0% vs. 85,2% (p = 0,088), resp. 91,3% (p = 0,58). Kontrola vývoja rezistencie, monitorovanie nežiaducich účinkov a sledovanie klinickej účinnosti by malo byť podmienkou používania antibiotickej profylaxie behom indukčnej chemoterapie AML.
Klúčové slová:
akútna myeloidná leukémia, indukčná liečba, infekčné komplikácie, kompletná remisiaÚVOD
Akútne myeloidné leukémie (AML) sú heterogénnou skupinou malígnych ochorení krvotvorby. Tvoria 80 % všetkých akútnych leukémií dospelých [1] s inciden-ciou 3/100.000 obyvateľov za rok. Základom kuratívnej liečby AML je indukčná chemoterapia, ktorej cieľom je navodiť hematologickú remisiu ochorenia [2]. Infekcie a febrilné neutropénie patria k jej najzávažnejším komplikáciám, a popri nezvládnuteľnej nádorovej chorobe predstavujú súčasne jednu z najčastejších príčin úmrtia pacientov s AML. Na vysokú náchylnosť k infekciám má vplyv nielen samotné ochorenie, ale aj liečba (intenzívna chemoterapia), ktorá je jedinou cestou k dlhodobému prežívaniu pacientov. Nedostatok zrelých granulocytov v obehu je príčinou zvýšeného počtu infekcií, často s agresívnym priebehom, a len nedostatočne reagujúcich na liečbu [3]. Riziko infekcie výrazne stúpa s hĺbkou poklesu neutrofilov, dĺžkou trvania neutropénie, prítomnosťou komorbidít a kolonizáciou virulentnými patogénmi [3, 4]. Cieľom práce bolo komplexné zmapovanie infekčných komplikácií, antimikrobiálnej terapie a profylaxie u pacientov s AML podstupujúcich indukciu bez antibiotickej profylaxie na Hemato-onkologickej klinike LF UP a FN Olomouc (HOK), a porovnanie výsledkov s publikovanými súbormi pacientov, ktorí počas indukcie dostávali antibiotickú profylaxiu.
SÚBOR PACIENTOV A METODIKA
Práca je retrospektívnou analýzou záznamov súboru, do ktorého bolo zaradených 100 po sebe nasledujúcich, zo všetkých 117 pacientov s diagnózou AML liečených indukčnou terapiou na našom pracovisku v období rokov 2007–2011. Pacienti neboli selektovaní – po dosiahnutí požadovaného počtu spracovaním po sebe idúcich prípadov bol súbor k analýze uzavretý.
Súbor tvorilo 50 mužov a 50 žien vo veku 21 až 73 rokov (medián veku 54 rokov), z toho 29 (resp. 9) pacientov vo veku ≥ 60 (resp. ≥ 65) rokov. Pacientov s promyelocytárnou leukémiou bolo v sledovanom súbore 14. Títo pacienti boli liečení indukčnou liečbou pozostávajúcou z kombinácie all-trans retinovej kyseliny (ATRA) a idarubicínu (protokol AIDA = ATRA + IDArubicín): ATRA 45 mg/m2 denne, rozdelená do 2 dávok, do dosiahnutia hematologickej remisie + idarubicín 12 mg/m2 2., 4., 6., 8. deň [5]. Pacienti s ostatnými formami AML boli liečení indukciou podľa protokolu ‘7+3‘ – cytosin arabinosid (ara-C) 100–200 mg/m2/deň v kontinuálnej 24-hodinovej infúzii 7 dní a daunorubicín 45-60 mg/m2/deň (príp. idarubicín alebo mitoxantron v dávke 10–12 mg/m2/deň) v hodinovej infúzii 3 dni [6, 7]. Pri zahájení hospitalizácie bol u pacientov vykonaný kompletný kultivačný (výter z krku, moč, stolica, eventuálne perianálny ster, príp. výter z infekčného ložiska) a sérologický (chlamýdie, chlamydophily, mykoplazmy, CMV, Toxoplasma gondii, hepatitídy, lues, HIV) skríning. Ďalšie kultivačné vyšetrenia boli opakované pri známkach infekcie, inak minimálne 1x týždenne (vrátane vyšetrenia galaktomananu v sére). V súbore pacientov liečených na HOK nebola použitá žiadna antibiotická profylaxia. Pri nástupe febrílií alebo klinických známok infekcie boli pacientom odobrané vzorky krvi a stery na kultivačné vyšetrenie. Následne boli empiricky podané antibiotiká prvej línie, iniciálne obvykle v zložení amoxicilín/kyselina klavulanová a gentamicín, príp. piperacilín/tazobaktám, s následnou úpravou terapie podľa výsledkov mikrobiologického vyšetrenia. Kombinácia amoxicilín/kyselina klavulanová + gentamicín bola preferovaná u pacientov bez predchádzajúceho záchytu kolonizácie rezistentnými kmeňmi baktérií, pri súčasne neprítomnej kontraindikácii použitia týchto antibiotík (týka sa hlavne gentamicínu) a neprítomnosti známok rozvoja septického šoku. U ostatných pacientov bol v prvej línii liečby nasadzovaný piperacilín/tazobaktám.
V prípade, že infekčné agens nebolo možné na základe opakovaných vyšetrení identifikovať – pri perzistujúcej febrilnej neutropénii (FN, súčasne prítomná horúčka a neutropénia) či klinických známkach progredujúcej infekcie, bola iniciálna terapia zamenená za účinnejšiu kombináciu – ceftazidím, resp. meropenem, vankomycín a eventuálne gentamicín/amikacín (druhá línia empirickej liečby FN), následne cefepím, teikoplanín a eventuálne gentamicín/amikacín (tretia línia). Empirickú antibiotickú terapiu FN zobrazuje tabuľka 1. Protokol empirickej antibiotickej liečby feb-rilnej neutropénie na našom pracovisku vychádzal z dlhoročných skúseností, monitorovania kolonizácie pacientov bakteriálnymi kmeňmi a citlivosti, resp. rezistencie týchto kmeňov k antibiotikám. Jeho zloženie bolo pravidelne podľa týchto výsledkov revidované.
Tab. 1. Prehľad empirickej antibiotickej terapie febrilnej neutropénie (FN) 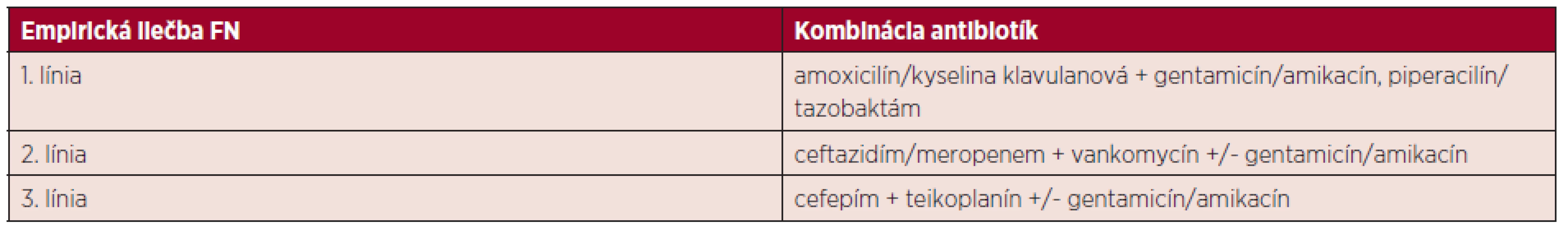
Indikácie k ukončeniu podávania antibiotík po terapii infekcie neboli striktne stanovené. Vždy bol hodnotený klinický stav pacienta, laboratórne nálezy, ich vývoj a zohľadnená bola tiež predpokladaná doba trvania neutropénie.
Antimykotická profylaxia bola pri zahájení indukčnej terapie podávaná (s výnimkou jedného pa-cienta) celému sledovanému súboru. Iniciálne podávaný flukonazol v dávke 200 mg/deň bol pri febrilnej atake zamenený za itrakonazol. U 17 pacientov bol itrakonazol podávaný už iniciálne v dávke 200 mg/deň. Ďalšia terapia antimykotikami bola indikovaná podľa zmeny klinických a laboratórnych parametrov. Invazívne mykotické infekcie boli klasifikované podľa kritérií European Organisation for Research and Treatment of Cancer a Mycosis Study Group (EORTC/MSG) [8]. Profylaxia aciclovirom nebola v súbore pacientov rutinne použitá. Sepsa bola v tejto práci definovaná ako febrilná neutropénia s pozitívnym kultivačným záchytom v hemokúlturach. Pri hodnotení spektra zachytených patogénov v hemokultúrach a ich etiologického podielu na infekčnej epizóde bolo prihliadnuté k prítomnosti potenciálneho infekčného ložiska, opakovaného záchytu rovnakých agens v krvi a možnosti kontaminácie vzoriek, ktorá komplikuje interpretáciu hlavne v prípade záchytu koaguláza-negatívnych zástupcov rodu Staphylococcus. Štatistické spracovanie bolo vykonané pomocou programu Microsoft Office Excel 2010 a RStudio verzia 0.98.501. Mann-Whitney U test bol použitý pre porovnanie parametrov s nenormálnou distribúciou, normálna distribúcia bola verifikovaná Shapiro-Wilk testom. Štatistická významnosť rozdielu bola vypočítaná chi kvadrát testom. Vo všetkých testoch bola použitá hladina štatistickej významnosti p = 0,05. Cena antiinfekčnej terapie v jednotlivých kategóriách – antibiotiká, antimykotiká a antivirotiká, bola stanovená ako súčet nákladov za jednotlivé prípravky vo vymenovaných kategóriách. Hodnota terapie konkrétnym prípravkom bola vypočítaná ako súčin počtu dní, kedy bolo liečivo v skupine pacientov podávané, a ceny za 1 deň terapie. Cena terapie za jeden deň bola určená ako cena pre najčastejšie, príp. výhradne, používanú liekovú formu a dávkovanie u najčastejšie, príp. výhradne, používaného konkrétneho HVLP (hromadne vyrábaný liečivý prípravok) s požadovanou účinnou látkou. Cena jednotlivých HVLP prípravkov bola stanovená k 4/2013 podľa www.sukl.cz pri nákupe za “Orientačnú nákupnú cenu“ u ekonomicky najvýhodnejšieho balenia. Počet pacientov liečených určitým terapeutikom, znamená počet tých, ktorí dostali minimálne jednu dávku daného liečiva počas hospitalizácie.
VÝSLEDKY
Prehľad infekčných komplikácií v sledovanom súbore pacientov
Infekčné komplikácie sprevádzajúce indukčnú terapiu postihli 93 pacientov zo sledovaného súboru. Z toho u 48 pacientov bola infekcia klinicky a/alebo mikrobiologicky dokumentovaná. Febrilná neutropénia (FN) vznikla u 45 pacientov. Indukčná terapia bez známok infekčných komplikácií prebehla u 7 pacientov. U týchto pacientov nebola zistená klinicky/mikrobiologicky dokumentovaná infekcia, a nespĺňali ani podmienky pre diagnózu FN. Infekčným komplikáciám podľahli 3 pacienti.
Klinicky a/alebo mikrobiologicky dokumentované infekcie
Klinicky a/alebo mikrobiologicky dokumentované infekcie predstavovali najčastejšie spektrum komplikácií. Boli zaznamenané u 48 pacientov – budú prebrané podľa vyvolávajúceho infekčného agens.
Bakteriálne infekčné komplikácie
Najpočetnejšou bakteriálnou infekciou boli sepsy, postihujúce 32 pacientov. Grampozitívne (G+) agens bolo zachytené v krvi u 21 (65,6 %), gramnegatívne (G-) agens u 17 (53,1 %) pacientov. Súčasný záchyt G+/G - etiológie bol zistený u 6 (18,8 %) pacientov so sepsou. U jedného pacienta sa vyskytla kandidémia (Candida krusei) so súčasným záchytom G - agens (Pseudomonas aeruginosa). Etiologické spektrum u sepsy prehľadne ukazuje graf 1.
Graf 1. Prehľad etiologického spektra u sepsy 
Najčastejšie sa vyskytujúce G+ patogény boli zástupcovia rodu Staphylococcus: Staphylococcus epidermidis 7/17 (41,2 %), Staphylococcus haemolyticus 4/17 (23,5 %), iné 6/17 (35,3 %), zachytené v hemokultúrach u 17 (53,1 %) pacientov. Ďalší G+ pôvodcovia sepsy boli zástupcovia rodov Streptococcus a Enterococcus zachytení zhodne u 2 (6,3 %) pacientov. V prípade G - bola najčastejšie zaznamenaná Klebsiella pneumoniae produkujúca širokospektré beta-laktamázy (ESBL+; extended-spectrum beta-lactamases) u 7 (21,9 %), nasledovaná Escherichia coli u 4 (12,5 %) pacientov. Pseudomonas aeruginosa a Enterobacter sp. boli zhodne zachytené v krvi u 3 (9,4 %) pacientov so sepsou. Záchyt patogénov v hemokultúrach u pacientov so sepsou prehľadne zobrazuje tabuľka 2. Zápalový pľúcny infiltrát bol zistený u 24 pacientov. Odlíšenie bakteriálnej a mykotickej pľúcnej infekcie na základe rádiologického vyšetrenia nie je jednoznačne možné [9]. Preto je u vysoko rizikových neutropenických pa-cientov nutné nasadiť popri antibiotickej aj preemptívnu antimykotickú terapiu [4]. Extrapulmonálne infekcie sa vyskytli spolu u 24 pacientov, pričom dvaja pacienti mali súčasne 2 infekčné ložiská. Infekcie mäkkých tkanív sa vyskytovali najčastejšie v orofaryngeálnej a anogenitálnej krajine, zhodne u 7 (29,2 %) pacientov. V oblasti horných a dolných končatín bola infekcia popísaná u 6 (25 %) a v inej lokalizácii (hrudník, brucho, genitálie) u 4 (16,7 %) pacientov s extrapulmonálnou infekciou. U 2 (8,3 %) pacientov bola zaznamenaná enterokolitída s pozitívnym výsledkom vyšetrení na prítom-nosť klostrídiového enterotoxínu v stolici. Ložiská výskytu extrapulmonálnych infekcií zobrazuje tabuľka 3.
Tab. 2. Záchyt patogénov v krvi u pacientov so sepsou 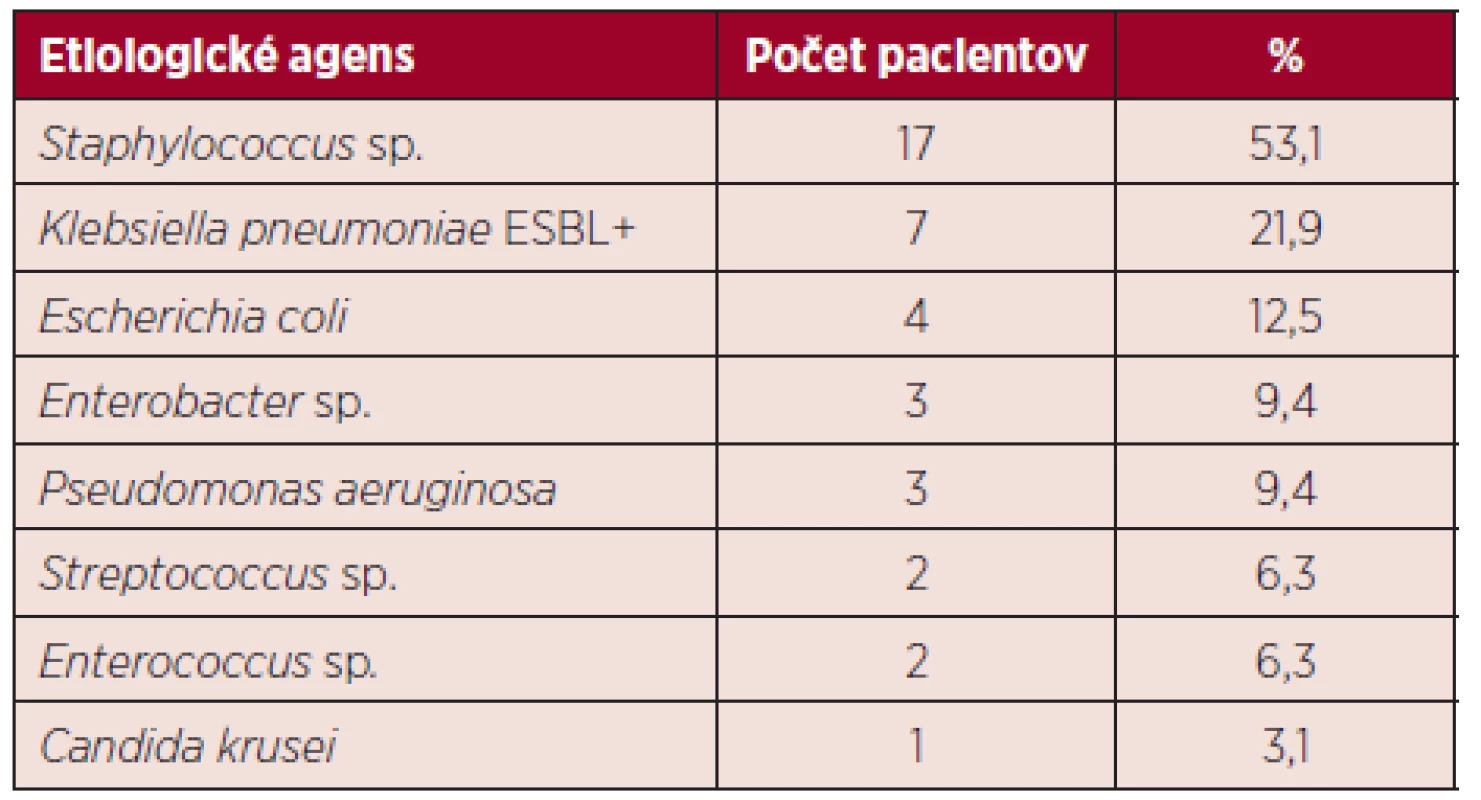
Tab. 3. Prehľad extrapulmonálnych infekcií 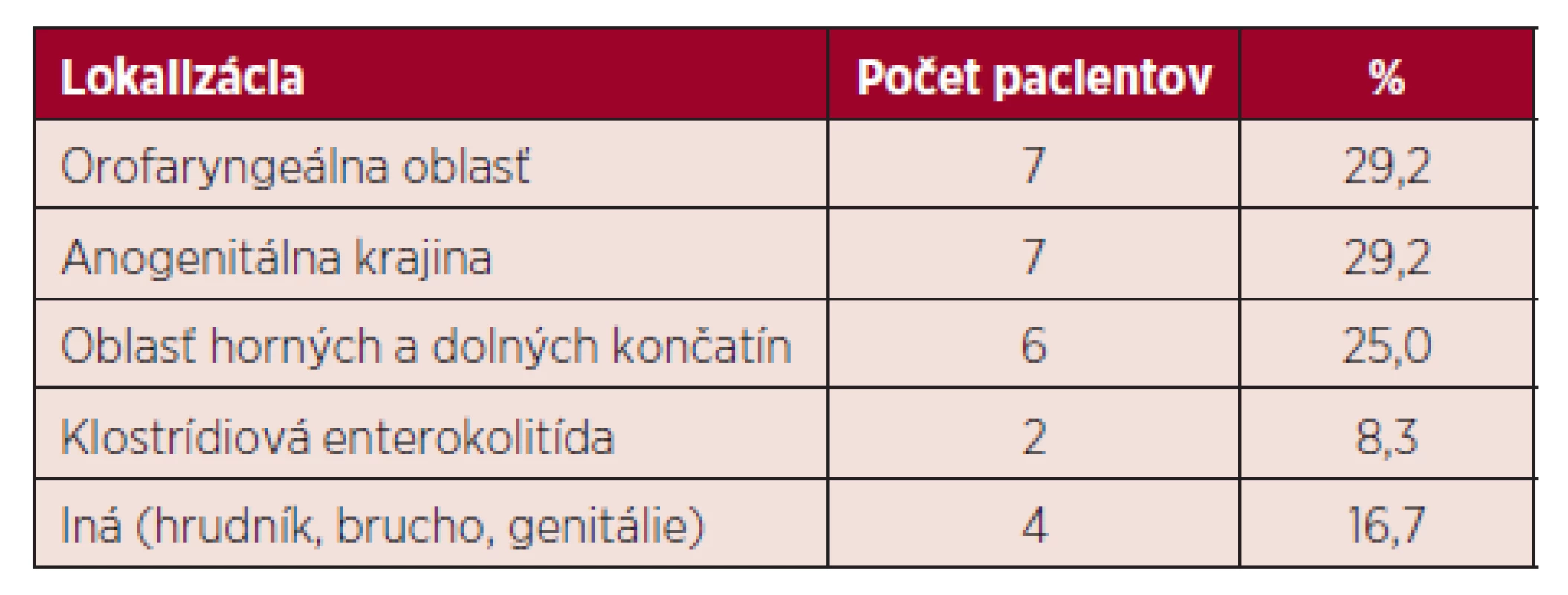
Mykotické infekčné komplikácie
Systémová forma mykózy (IFI; invasive fungal infections) sa vyskytla u 35 pacientov. Ako dokázané boli vyhodnotené systémové mykózy u 2 (6 %) pacientov. U prvého pacienta boli pri sekcii nájdené infekčné ložiská v pľúcach a slezine (Aspergillus sp.), druhý mal opakovane zistenú kandidémiu (C. krusei). Pravdepodobné mykózy boli zistené u 4 (11 %) pacientov s IFI – u všetkých pacientov bol rádiologicky preukázaný suspektný zápalový pľúcny infiltrát v kombinácii s febríliami nereagujúcimi na podávanú ATB terapiu. V 2 prípadoch bolo pozitívne vyšetrenie na galaktomanan v sére, ktorý vykazuje špecificitu pre aspergilózu 89 % [9]. Jeden pacient mal súčasne rádiologicky preukázané suspektné ložisko v slezine. Možné IFI boli popísané u 29 (83 %) pacientov.
Vírusové a parazitárne infekcie
Vírusové a parazitárne ochorenia ako infekčné komplikácie pacientov pri indukčnej terapii boli najmenej časté. Osem pacientov malo herpes simplex labialis. Reaktivácia CMV, klinicky manifestná infekcia CMV ani iná systémová vírusová infekcia zaznamenaná nebola. Parazitárne ochorenie taktiež nebolo v sledovanej skupine zistené.
Febrilná neutropénia (FN)
U časti pacientov nebolo zistené etiologické agens febrílií, stav bol preto hodnotený ako FN. Tá bola zaznamenaná u 45 pacientov, u ktorých bolo spolu dokumentovaných 66 epizód FN. Klinická odpoveď na1. líniu antibiotík – v zložení amoxicilín/kyselina klavulanová a gentamicín – bola zaznamenaná u 12 (18,2 %) epizód FN. U 34 (51,5 %) epizód bol pozorovaný ústup febrílií až po nasadení 2. línie. Do roku 2008 bola 2. línia antibiotickej terapie tvorená kombináciou ceftazidím, gentamicín/amikacín a vankomycín. V tomto období sa však začal zvyšovať u pacientov na našej klinike záchyt Pseudomonas aeruginosa rezistentných na ceftazidím [10]. To spolu s nárastom výskytu kmeňov Klebsiella pneumoniae (ESBL+) viedlo k výmene ceftazidímu za meropenem. Dvadsať (30,3 %) epizód FN reagovalo až na nasadenie 3. línie, v zložení cefepím, gentamicín/amikacín a teikoplanín.
Infekčné komplikácie a dosiahnutie kompletnej remisie
V súbore 100 pacientov dosiahlo kompletnú remisiu (KR) po prvom cykle indukcie 67 z nich. Výskyt sepsy v skupine pacientov dosahujúcich KR bol signifikantne nižší v porovnaní so skupinou bez dosiahnutia KR (22,4 % vs. 51,5 %, p = 0,0037). Zápalový pľúcny infiltrát a mykotické infekcie boli štatisticky nevýznamne častejšie zaznamenané u skupiny nedosahujúcej KR (19,4 % vs. 33,3 %, p = 0,1 resp. 31,3 % vs. 42,4 %, p = 0,192). Výskyt FN a extrapulmonálnych infekcií bol nevýznamne vyšší v skupine pacientov, ktorí po indukčnej liečbe KR dosiahli (49,3 % vs. 36,4 %, p = 0,158 resp. 25,4 % vs. 21,2 %, p = 0,423). Pomer vybraných infekčných komplikácií v skupine pacientov dosahu-júcich/nedosahujúcich KR prehľadne zachytáva graf 2. V celom súbore pacientov bola priemerná dĺžka trvania hospitalizácie 36,5 dní (medián 34 dní). Priemerná doba hospitalizácie v skupine pacientov dosahujúcich KR bola významne kratšia v porovnaní so skupinou pacientov, ktorí KR nedosiahli (35,1 vs. 39,4 dní, p = 0,0281). Trvanie hospitalizácie a antimikrobiálnej terapie v skupine pacientov dosahujúcich/nedosahujúcich KR zobrazuje graf 3. V skupine pacientov rezistentných na indukčnú chemoterapiu, traja zomreli na infekciu. U prvého pacienta bola indukčná terapia komplikovaná klinicky závažnou pneumóniou (možná IFI) s progredujúcou kardiálnou dekompenzáciou. V druhom prípade bol zápalový pľúcny infiltrát klasifikovaný ako pravdepodobná IFI (etiologicky suspektne Aspergillus sp.) so súčasným výskytom ložiska infekcie v perianálnej oblasti (kultivačne zachytený Staphylococcus sp.). Dokázaná invazívna systémová mykóza s ložiskami v pľúcach a slezine (pri sekcii potvrdený Aspergillus sp.) bola fatálnou infekčnou komplikáciou u posledného pacienta.
Graf 2. Výskyt infekčných komplikácií u pacientov dosahujúcich/nedosahujúcich KR 
Graf 3. Trvanie hospitalizácie a antimikrobiálnej terapie v skupine pacientov dosahujúcich/nedosahujúcich KR 
Antimikrobiálna terapia
V súbore pacientov sme sa zamerali na analýzu spotreby jednotlivých antiinfekčných terapeutík, dĺžku trvania terapie a jej cenu.
Antibiotiká. V súbore 100 pacientov bola antibiotická terapia nasadená u 99 % z nich. Len u jedného pacienta prebiehala indukcia bez nutnosti použitia antibiotík a antimykotík. U ďalších šiestich pacientov bez infekčných komplikácií počas indukcie, bola antibiotická terapia nasadená pri náleze zvýšenej hladiny CRP bez iných klinických, resp. mikrobiologických známok infekcie. Doba užívania antibiotík bola v celom súbore priemerne 30,2 dní (medián 29 dní). Dĺžka trvania antibiotickej terapie bola významne kratšia v skupine pacientov, ktorí dosiahli KR, v porovnaní so skupinou, v ktorej pacienti remisiu nedosiahli (27,8 vs. 35,0 dní, p = 0,011). Dĺžka trvania a počet línií antibiotickej terapie nevykazovali štatisticky významné rozdiely v skupine s FN, v porovnaní so skupinou pacientov s klinicky a/alebo mikrobiologicky dokumentovanou infekciou (29,6 vs. 32,8 dní, p = 0,91, resp. 2,49 vs. 2,40; p = 0,166). Spotrebu vybraných antibiotík ukazuje prehľadne graf 4. Cena terapie antibiotikami počas hospitalizácie prepočítaná na 1 pacienta, stanovená ku 4/2013 podľa cenníku dostupného na stránkach SÚKL, predstavovala 56 712 CZK.
Graf 4. Použitie vybraných antibiotík v terapii/profylaxii infekčných komplikácií 
Antimykotiká. Častý výskyt mykotických infekcií u hemato-onkologických pacientov si vyžiadal nasadenie antimykotík u 99 % pacientov súboru. Priemerná doba užívania bola 29,7 dní (medián 28,5 dní). Dĺžka trvania antimykotickej terapie bola významne kratšia v skupine pacientov, ktorí dosiahli KR, v porovnaní so skupinou pacientov bez dosiahnutia remisie (27,9 vs. 33,2 dní, p = 0,031). Terapia bola obvykle zahájená podaním azolového antimykotika – flukonazol/itrakonazol, s prípadnou následnou zámenou podľa klinickej odpovede alebo výsledkov vyšetrovacích metód. U jednej tretiny súboru nebola indikovaná zmena iniciálnej antimykotickej profylaxie/liečby. Spotrebu vybraných antimykotík zobrazuje graf 5. Cena takejto terapie, v prepočte na 1 pacienta, činila 88 521 CZK.
Graf 5. Použitie vybraných antimykotík v terapii/profylaxii infekčných komplikácií 
Antivirotiká. Táto skupina patrila k menej často používaným preparátom. Aciclovir bol systémovo nasadený u 27 pacientov, priemerne po dobu 17,2 dní (medián 18 dní). Cena tejto terapie predstavovala 244 CZK v prepočte na pacienta.
DISKUSIA
Výskyt a zastúpenie pôvodcov infekcií sa môže líšiť medzi hemato-onkologickými pracoviskami. V literatúre bolo publikovaných niekoľko prác mapujúcich infekčné komplikácie u pacientov podstupujúcich indukciu pre AML.
De Rosa et al. v súbore 81 pacientov, ktorí počas indukcie dostávali profylakticky levofloxacín v dávke 500 mg/deň a itrakonazol 2 x 200 mg/deň, zaznamenal výskyt infekčných komplikácií počas indukčnej chemoterapie u 69 (85,2 %) pacientov [11]. Zápalový pľúcny infiltrát bol popísaný u 19 (23,4 %) a sepsa u 20 (24,7 %) pacientov. Najčastejší pôvodca identifikovaný u sepsy bol Staphylococcus epidermidis, 11/20 (55%) prípadov (všetky izoláty boli rezistentné na fluorochinolóny). Dokázané alebo pravdepodobné IFI boli prítomné u 8 (9,9 %) pacientov. Infekčné komplikácie boli príčinou úmrtia u 5 (6,2 %) pacientov – počas indukčnej aj konsolidačnej terapie.
Malagola et al. popísal výskyt infekčných komplikácií v súbore 224 pacientov [12]. Ako profylaxia počas indukcie bol použitý levofloxacín (500 mg/deň) a itrakonazol (2 x 200 mg/deň). Sepsa bola zistená u 77 (34,4 %) pacientov, G+ pôvodcovia predstavovali 47/77 (61,0 %) etiológie. Dokázané a pravdepodobné invazívne systémové mykózy boli zachytené u 10 (4,5%) a epizóda febrilnej neutropénie u 146 (65,2 %) pacientov. V súbore pacientov nebola zaznamenaná žiadna vírusová či parazitárna infekcia. Infekčné komplikácie počas indukcie boli príčinou úmrtia u 8 (3,6 %) pacientov. Autori tiež poukazujú na vyšší výskyt dokázaných/pravdepodobných IFI v skupine pacientov, ktorí nedosiahli CR v porovnaní so skupinou dosahujúcou CR, 9 %, resp. 3 %.
V súbore 309 pacientov s AML liečených v 11 poľských centrách (Polish Adult Leukemia Group) popísali výskyt infekčných komplikácií Lech-Maranda et al. [13]. Profylaxiu antibiotikami počas indukcie dostávalo 224 (72,5 %) a antimykotikami 283 (91,5 %) pacientov. V profylaxii bol použitý kotrimoxazol, penicilíny a fluorochinolóny u 49 %, 26 %, resp. 20 % pacientov s antibiotickou a flukonazol u 92 % pacientov s antimykotickou profylaxiou. Infekčné komplikácie sa vyskytli u 282 (91,3 %) pacientov. Sepsa bola popísaná u 74 (24,0 %) pacientov (G+ agens 47 %, G - agens 23 %, polymikrobiálna etiológia 23 % a kandidémia – Candida sp. 7 %). FN bola zaznamenaná u 97 (31,4 %) pacientov. Počas indukcie 31 (10,0 %) pacientov infekciám podľahlo.
Kinnunen et al. dokumentovali infekčné komplikácie počas indukčnej terapie AML v súbore 76 pacientov [14]. V sledovanej skupine nebola použitá profylaxia antibiotikami. Infekčné komplikácie boli zaznamenané u všetkých pacientov súboru. Zápalový pľúcny infiltrát (počas indukcie aj konsolidácie) bol popísaný u 32 (42,1 %) pacientov.
Prehľad vybraných infekčných komplikácií v uvedených súboroch pacientov zobrazuje tabuľka 4.
Tab. 4. Prehľad infekčných komplikácií v publikovaných súboroch pacientov 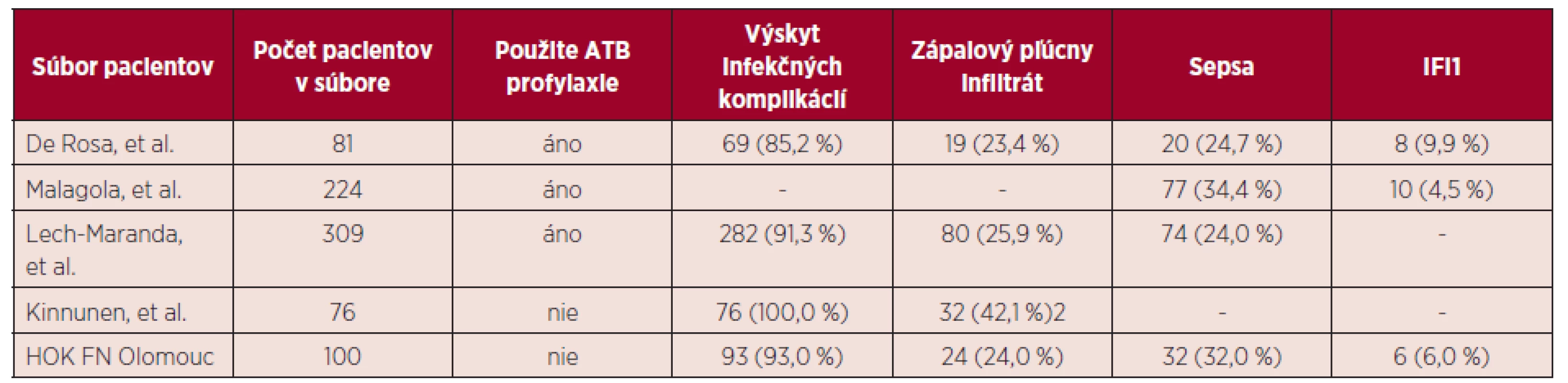
1Pravdepodobné a dokázané invazívne mykotické infekcie (IFI). 2Počet pacientov počas indukcie aj konsolidácie. -Údaj nebol autormi publikovaný Naše výsledky ukázali, že výskyt infekčných komplikácií u pacientov bez antibiotickej profylaxie nebol významne vyšší, v porovnaní so skupinami pacientov udávanými v literatúre, ktorí dostávali antibiotickú profylaxiu (93,0 % vs. 85,2 % (p = 0,088), resp. 91,3% (p = 0,58).V sledovaných súboroch pacientov sa významne nelíšil ani výskyt sepsy (32,0 % vs. 24,7 % (p = 0,28), resp. 34,4 % (p = 0,67), resp. 24,0 % (p = 0,11) a zápalového pľúcneho infiltrátu (24,0% vs. 23,4% (p = 0,93), resp. 25,9% (p = 0,71). Sepsa bola vo všetkých súboroch najčastejšie G+ etiológie. Rozdiel vo výskyte pravdepodobných a dokázaných IFI nebol v súboroch pacientov, ktorí dostávali antimykotickú profylaxiu (flukonazol, príp. itrakonazol) štatisticky významný (6,0 % vs. 9,9 % (p = 0,33), resp. 4,5 % (p = 0,56). Porovnanie výsledkov HOK so súbormi pacientov udávanými v literatúre, ktorí dostávali antibiotickú profylaxiu počas indukcie, zobrazuje tabuľka 5.
Tab. 5. Porovnanie výsledkov HOK FN Olomouc so súbormi pacientov s antibiotickou profylaxiou 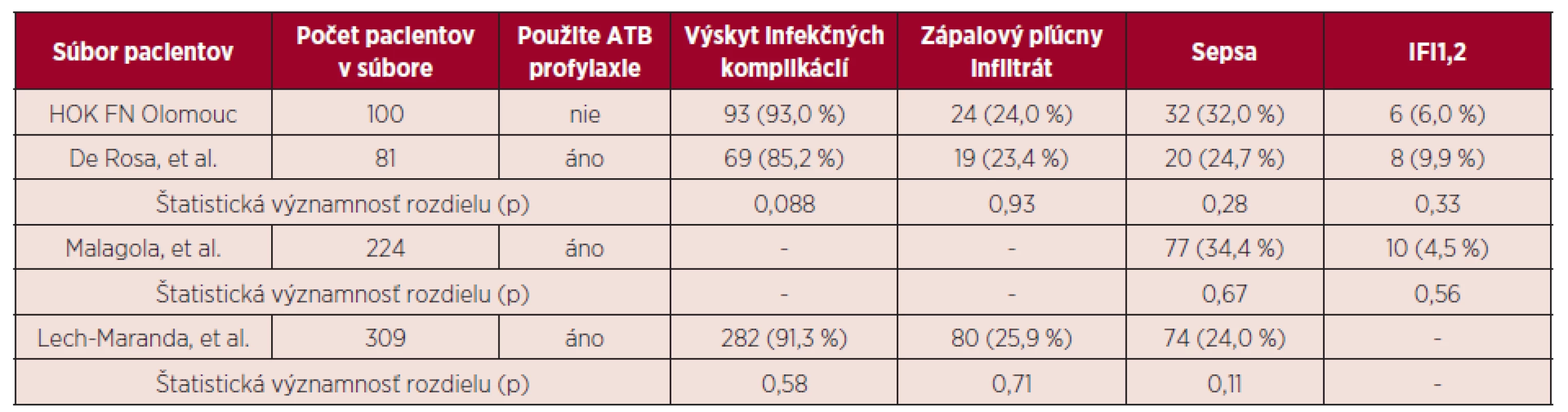
1Pravdepodobné a dokázané invazívne mykotické infekcie (IFI). 2Vo všetkých uvedených súboroch pacientov bola použitá profylaxia antimykotikami. - Údaj nebol autormi publikovaný. Je pravdepodobné, že časť záchytov G+ agens v hemokultúrach boli kontaminácie, a nie etiologické agens infekčných epizód, hlavne v prípadoch nálezov koaguláza-negatívnych zástupcov rodu Staphylococcus. Podobným skreslením sú však vzhľadom k publikovaným výsledkom zrejme zaťažené aj ostatné zmieňované práce hodnotiace infekčné komplikácie indukčnej liečby AML.
Infekčné komplikácie predstavujú významný faktor morbidity a mortality u pacientov s AML podstupu-júcich indukčnú chemoterapiu [11–13]. Gupta et al. v súbore 95 pacientov, ktorí nedostávali antibiotickú profylaxiu, zaznamenal 17 (17,9 %) úmrtí počas indukcie aj konsolidácie v dôsledku infekčných komplikácií [15]. Všetci pacienti v uvedenom súbore dostávali antimykotickú profylaxiu (flukonazol/itrakonazol). V súbore 327 pacientov, ktorí nedostávali počas indukčnej chemoterapie profylaxiu antibiotikami, zaznamenal Syrjälä et al. 35 (10,7 %) úmrtí na infekčné komplikácie [16]. Výskyt fatálnych infekčných komplikácií vo vybraných súboroch pacientov zobrazuje tabuľka 6. Rozdiel v mortalite na infekčné komplikácie bol v porovnaní so súbormi pacientov, ktorí dostávali antibiotickú profylaxiu, v jednom prípade významný (3,0 % vs. 10,0 % (p = 0,027), a v druhom prípade nevýznamný (3,0 % vs. 3,6 % (p = 0,79). V našom súbore bol výskyt úmrtí na infekčné komplikácie pomerne nízky. Pri hodnotení výsledkov je však potrebné zvážiť aj ďalšie dôležité faktory – zloženie súboru pacientov, použitie antimykotickej profylaxie, aktuálnu epidemiologickú situáciu a miestnu politiku v používaní antiinfektív. Systematický prehľad autorov Gafter-Gvili et al. z roku 2012 potvrdzuje signifikantné zníženie výskytu febrilných epizód (relatívne riziko; RR = 0,80), klinicky (RR = 0,65) a mikrobiologicky (RR = 0,51) dokumentovaných infekcií a úmrtí na infekčné komplikácie (RR = 0,51) pri používaní antibiotickej profylaxie u neutropenických pacientov. Profylaktické použitie antibiotík, predovšetkým fluorochinolónov, by malo byť zvážené hlavne v skupine neutropenických pacientov s hematologickými malignitami [17, 18]. Na základe súčasných údajov a skúseností je optimálnou chinolónovou profylaxiou febrilnej neutropénie podávanie ciprofloxacínu (2 x 500 mg) alebo levofloxacínu (1 x 500 mg), je však potrebné starostlivé zváženie postavenia profylaxie v celej antiinfekčnej stratégii [18]. Vzhľadom k významným rozdielom v epidemiologickej situácii v jednotlivých centrách, nemôžu obecne doporučené postupy plnohodnotne nahradiť lokálne protokoly antibiotickej terapie. Kontrola vývoja rezistencie, monitorovanie nežiaducich účinkov a sledovanie klinickej účinnosti by malo byť podmienkou zavedenia rutinnej profylaxie u neutropenických pacientov do klinickej praxe [19]. Výsledky ďalej ukázali, že dosiahnutie KR po indukcii nemá štatisticky významný vplyv na výskyt infekčných komplikácií (zápalový pľúcny infiltrát, mykotické infekcie, FN a extrapulmonálne ložiskové infekcie), signifikantne vyšší bol iba výskyt sepsy v non-remisnej skupine pacientov. Dĺžka trvania hospitalizácie a antiinfekčnej terapie bola významne kratšia v skupine pacientov, ktorí dosiahli po indukčnej liečbe remisiu. Pacienti dosahujúci KR majú všeobecne lepšiu prognózu v porovnaní s tými, ktorí remisiu nedosiahli [20], čo by mohlo mať vplyv aj na komplikácie už počas indukčnej terapie. Je však potrebné zvážiť ovplyvnenie výsledkov zložením súboru pacientov, lokálnou epidemiologickou situáciou a politikou v používaní antimikrobiálnej terapie.
Tab. 6. Výskyt fatálnych infekčných komplikácií vo vybraných súboroch pacientov 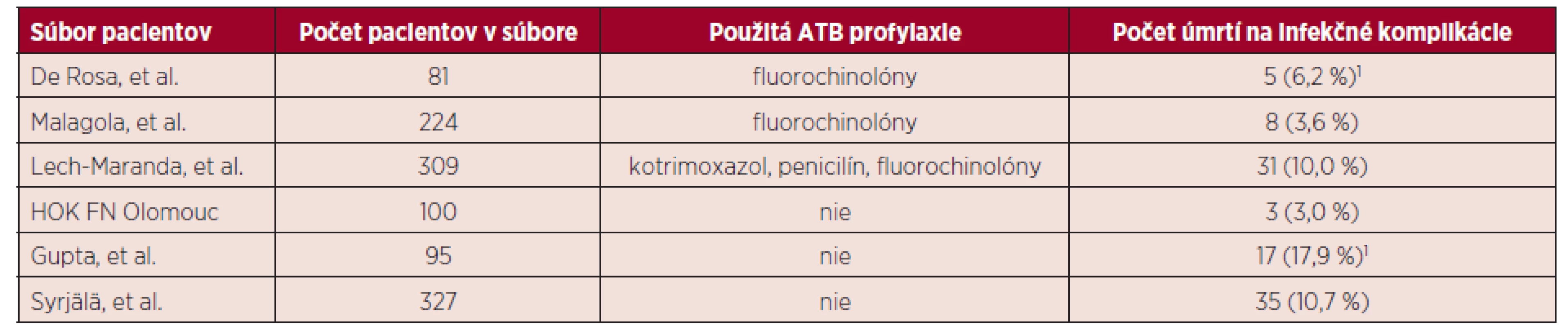
1Počet pacientov počas indukcie aj konsolidácie. (Údaj nie je vyhodnocovaný pre štatistickú významnosť rozdielu v danej kategórii.) ZÁVER
Infekcie patria k najčastejším komplikáciám liečby v hemato-onkológii. Výsledky ukázali, že 93 % pacientov malo behom indukčnej chemoterapie AML infekciu. Terapeutické/profylaktické nasadenie antiinfektív bolo potrebné u 99 % súboru. Cena tejto terapie činila v prepočte na 1 pacienta priemerne 145 477 CZK. Traja pacienti na následky infekcie zomreli. Výskyt infekčných komplikácií u pacientov bez antibiotickej profylaxie nebol významne vyšší, v porovnaní so skupinami pacientov udávanými v literatúre, ktorí dostávali antibiotickú profylaxiu. Vhodné používanie dostupných a vývoj nových antimikrobiálnych terapeutík a postupov je dôležitým krokom k zvýšeniu úspešnosti supportívnej terapie pri indukčnej liečbe AML.
Autori ďakujú doc. Mgr. Jiřímu Slavíkovi, CSc. a Bc. Martinovi Slavíkovi za cenné pripomienky pri štatistickom spracovaní údajov.
Podiel autorov na rukopise
Martin Čerňan – zber a analýza dát, hlavný autor práce
Dr. Tomáš Szotkowski – liečba pacientov, korešpondujúci autor, spoluautor práce
Prof. Milan Kolář – autor protokolu pre liečbu febrilnej neutropénie na HOK FNOL, kritická revízia rukopisu
Dr. Jaromír Hubáček – liečba pacientov, kritická revízia rukopisu
Prof. Edgar Faber – spoluautor práce, kritická revízia rukopisu
Transparentná spolupráca
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohto článku nie je v strete záujmov, a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlásenie sa týka aj všetkých spoluautorov.
Dedikácia
Táto práca bola podporená grantom IGA-LF-2014-001.
Doručeno do redakce: 9. 11. 2014
Přijato po recenzi: 14. 1. 2015
MUDr. Tomáš Szotkowski, Ph.D.
Horní lán 1257/51
779 00 Olomouc
e-mail: tomas.szotkowski@fnol.cz
Zdroje
1. Szotkowski T, Faber E. Akutní leukemie. In: Faber E, et al. Základy hematologické diagnostiky. Univerzita Palackého v Olomouci, 2012, ISBN 978-80-244-2935-9, s. 153–159.
2. Trněný M, Čermák J, Klamová H, et al. Akutní myeloidní leukemie. In Češka R, et al. Interna. Triton, 2010, ISBN 978-80-7387-423-0, s. 684–686.
3. Bodey GP, Buckley M, Sathe YS, Freireich EJ. Quantitative relationships between circulating leukocytes and infection in patients with acute leukemia. Ann Intern Med 1966; 64(2): 328–340.
4. Drgoňa Ľ. Febrilná neutropénia. In Drgoňa Ľ. Infekčné komplikácie onkologických pacientov - vybrané kapitoly. Univerzita Komenského v Bratislave, 2013, ISBN 978-80-223-3468-6, s. 10–22.
5. Sanz AM, Montesinos P, Vellanga E, et al. Risk-adapted treatment of acute promyelocytic leukemia with all-trans retinoic acid and anthracycline monochemotherapy: long-term outcome of the LPA 99 multicenter study by the PETHEMA Group. Blood 2008; 112(8): 3130–3134.
6. Tallman MS, Gilliland DG, Rowe JM. Drug therapy for acute myeloid leukemia. Blood 2005; 106 : 1154–1163.
7. Dillman RO, Davis RB, Green MR, et al. A comparative study of two different doses of cytarabine for acute myeloid leukemia: a phase III trial of Cancer and Leukemia Group B. Blood 1991; 78 : 2520–2526.
8. Ascioglu S, Rex JH, Pauwde B, et al. Defining Opportunistic Invasive Fungal Infections in Immunocompromised Patients with Cancer and Hematopoietic Stem Cell Transplants: An International Consensus. Clin Infect Dis 2002; 34(1): 7–14.
9. Sherif F, Brahm H. Pľúcna aspergilóza – klinické prejavy, diagnostika, liečba a komplikácie. Curr Opin Pulm Med/CS 2010; 7 : 31–38.
10. Drgoňa Ľ. Febrilná neutropénia. Onkológia (Bratisl.) 2012; 7(1): 20–23.
11. De Rosa FG, Motta I, Audisio E, et al. Epidemiology of bloodstream infections in patients with acute myeloid leukemia undergoing levofloxacin prophylaxis. BMC Infectious Diseases 2013; 13 : 563.
12. Malagola M, Peli A, Damiani D, et al. Incidence of bacterial and fungal infections in newly diagnosed acute myeloid leukaemia patients younger than 65 yr treated with induction regimens including fludarabine: retrospective analysis of 224 cases. Eur J Haematol 2008; 81(5): 354–363.
13. Lech-Maranda E, Seweryn M, Giebel S, et al. Infectious complications in patients with acute myeloid leukemia treated according to the protocol with daunorubicin and cytarabine with or withoutaddition of cladribine. A multicenter study by the Polish Adult Leukemia Group (PALG). International Journal of Infectious Diseases 2010; 14 : 132–140.
14. Kinnunen U, Koistinen P, Ohtonen P, Koskela M, Syrjälä H. Influence of chemotherapy courses on the rate of bloodstream infections during neutropenia in adult acute myeloid leukaemia. Scandinavian Journal of Infectious Diseases 2008; 40 : 642–647.
15. Gupta A, Singh M, Singh H, et al. Infections in acute myeloid leukemia: an analysis of 382 febrile episodes. Med Oncol 2010; 27 : 1037–1045.
16. Syrjälä H, Ohtonen P, Kinnunen U, et al. Blood stream infections during chemotherapy-induced neutropenia in adult patients with acute myeloid leukemia: treatment cycle matters. Eur J Clin Microbiol Infect Dis 2010; 29 : 1211–1218.
17. Gafter-Gvili A, Fraser A, Paul M, et al. Antibiotic prophylaxis for bacterial infections in afebrile neutropenic patients following chemotherapy. Cochrane Database Syst Rev 2012; 1: CD004386.
18. Bucaneve G, Castagnola E, Viscoli C, Leibovici L, Menichetti F. Quinolone prophylaxis for bacterial infections in afebrile high risk neutropenic patients. EJC supplements 2007; 5 : 5–12.
19. Haber J, Cetkovský P, Ráčil Z, et al. Antibiotická profylaxe u hematologických nemocných – doporučení odborníků s podporou CELL, ČHS a ČOS ČLS JEP, S.CH.S. SLS. Postgraduální medicína 2011; 13(5): 43–46.
20. Shilpan SS, Kantarjian H, Farhad R, O’Brien S, Garcia-Menero G, Andreeff M. Survival Outcomes In Relapsed/Refractory Acute Myeloid Leukemia Patients Who Achieve Less-Than-Complete Response After Salvage Therapy. Blood 2013; 122(21): 2654.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2015 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Infekčné komplikácie behom indukčnej liečby akútnej myeloidnej leukémie bez použitia antibiotickej profylaxie
- Mykotické komplikácie po autológnej transplantácii krvotvorných buniek u pacientov s mnohopočetným myelómom
- Interference složek krevní plazmy při turbidimetrickém stanovení D-dimeru
- Inkorporace humanizované tkáně jako strategie pro zlepšení uchycení leukemie v imunodeficientní myši
- Excellent prognosis of late relapses of ETV6/RUNX1-positive childhood acute lymphoblastic leukemia: lessons from the FRALLE 93 protocol
- Clinical heterogeneity and predictors of outcome in primary autoimmune hemolytic anemia: a GIMEMA study of 308 patients
- The toxicity of very prolonged courses of PEGasparaginase or Erwinia asparaginase in relation to asparaginase activity, with a special focus on dyslipidemia
- Safety and efficacy of rituximab in adult immune thrombocytopenia: results from a prospective registry including 248 patients
- First-line treatment for severe aplastic anemia in children: bone marrow transplantation from a matched family donor versus immunosuppressive therapy
- Management and clinical outcomes in patients treated with apixaban vs warfarin undergoing procedures
- Recombinant long-acting glycoPEGylated factor IX in hemophilia B: a multinational randomized phase 3 trial
- XXII. česko-slovenská konference o trombóze a hemostáze s mezinárodní účastí
- Soutež o Cenu firmy Janssen
- Úvodník
- Uchycení akutní a chronické myeloidní leukemie v NOD scid gamma myši
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Infekčné komplikácie behom indukčnej liečby akútnej myeloidnej leukémie bez použitia antibiotickej profylaxie
- Interference složek krevní plazmy při turbidimetrickém stanovení D-dimeru
- Mykotické komplikácie po autológnej transplantácii krvotvorných buniek u pacientov s mnohopočetným myelómom
- Uchycení akutní a chronické myeloidní leukemie v NOD scid gamma myši
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



