-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mykotické komplikácie po autológnej transplantácii krvotvorných buniek u pacientov s mnohopočetným myelómom
Invasive fungal infections following autologous hematopoietic stem cell transplantation in patients with multiple myeloma
The article gives a history of the occurrence of invasive fungal infections in patients with multiple myeloma following autologous stem cell transplantation. These patients are at low risk (LR) for developing invasive fungal infection (IFI). It assesses the impact of previous treatment of the underlying disease; comorbidities and risk factors for the incidence and aetiology of invasive fungal infections; their clinical manifestation and treatment. In the analysed group of 39 patients, invasive fungal infection developed in 4 patients. In 2 cases, possible invasive fungal infection of the lungs was diagnosed One patient was diagnosed with probable invasive aspergillosis of the lungs and the other case suggested the possibility of lung infection caused by Trichosporon species. Risks associated with the development of these infectious complications included the administration of corticosteroids, neutropenia, mucositis and renal insufficiency.
Key words:
multiple myeloma, invasive fungal infections, risk factors, autologous hematopoietic stem cell transplantation
Autoři: J. Gabzdilová; E. Tóthová 1; T. Guman 2; Š. Raffač 1; P. Jarčuška 3 4
Působiště autorů: Klinika hematológie a onkohematológie UNLP a LF UPJŠ, Košice 1; Ústav lekárskej a klinickej biofyziky LF UPJŠ, Košice 2; Oddelenie laboratórnej medicíny UNLP, Košice 3; Klinika infektológie a cestovnej medicíny UNLP a LF UPJŠ, Košice 4
Vyšlo v časopise: Transfuze Hematol. dnes,21, 2015, No. 1, p. 24-29.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Článok prináša skúsenosti s výskytom invazívnych mykotických infekcií u pacientov s mnohopočetným myelómom po autológnej transplantácii krvotvorných buniek, ktorí z hľadiska rozvoja tejto infekčnej komplikácie patria k nízkorizikovej skupine (LR). Hodnotí vplyv predchádzajúcej liečby základného ochorenia, komorbidity a rizikových faktorov na výskyt a etiológiu invazívnych fungálnych infekcií (IFI), ich klinickú manifestáciu a liečbu. V analyzovanom súbore 39 pacientov došlo k rozvoju invazívnej mykotickej infekcie u 4 pacientov. V dvoch prípadoch išlo o možnú invazívnu mykotickú infekciu pľúc, u ďalšieho pacienta bola diagnostikovaná pravdepodobná invazívna aspergilóza pľúc a ďalší prípad nasvedčoval pre pravdepodobnú pľúcnu trichosporonovú infekciu. Z rizík spojených s rozvojom týchto infekčných komplikácií sú významné predovšetkým podávanie kortikoterapie, rozvoj neutropénie, mukozitídy a renálna insuficiencia.
Kľúčové slová:
mnohopočetný myelóm, invazívne mykotické infekcie, rizikové faktory, autológna transplantácia krvotvorných buniekÚVOD
Mikroskopické huby spolu s ostatnými mikroorganizmami sú súčasťou nášho životného prostredia a boli dlhú dobu považované za patogény, ktoré u človeka nespôsobujú závažné ochorenia. V súčasnosti predstavujú vážny medicínsky problém predovšetkým u imunokompromitovaných pacientov [1]. V skupine onkohematologických chorých je viac ako polovica invazívnych fungálnych infekcií (IFI) vyvolaná vláknitými hubami, s dominantným postavením Aspergillus species. Invazívne kandidové infekcie sa vyskytujú menej často, približne v 35 %. Taktiež stúpa výskyt infekcií vyvolaných tzv. vzácnymi plesňami, a to hlavne zygomycétami (do tejto skupiny sú zaradené rody Absidia, Rhizopus, Mucor) a fusáriami. Mortalita spojená s invazívnou aspergilovou infekciou dosahuje približne 40 % a pri invazívnych kandidových infekciách 30 % [2, 3]. V skupine pa-cientov podstupujúcich alogénnu transplantáciu krvotvorných buniek je výskyt invazívnych mykotických ochorení približne 20 %, zatiaľ čo v období po autológnej transplantácii je približne 2 až 6 %. Invazívne fungálne infekcie sa u pacientov s mnohopočetným myelómom (MM) vyskytujú v 0,5–3 % [2, 3, 16]. Aj keď sa tieto infekčné komplikácie vyskytujú v populácii chorých s MM v menšej miere, vzhľadom na zmeny v liečebnej stratégii a predĺžené prežívanie týchto pacientov je potrebné prehodnotiť riziká aj v tejto skupine chorých.
V našej práci prezentujeme skúsenosti s výskytom invazívnych mykotických infekcií u pacientov s mnohopočetným myelómom, ktorí podstúpili autológnu transplantáciu krvotvorných buniek, a to s prihliad-nutím na predchádzajúcu liečbu základného ochorenia a riziká, ktoré potencujú rozvoj tejto závažnej komplikácie.
MATERIÁL A METÓDY
Retrospektívne sme analyzovali údaje od pacientov s mnohopočetným myelómom, podstupujúcich autológnu transplantáciu krvotvorných buniek v období od januára 2011 do decembra 2013, ktorí boli hospitalizovaní na Klinike hematológie a onkohematológie UNLP a LF UPJŠ v Košiciach.
Informácie sme získali z dokumentácie pacientov, kde boli podrobne uvedené denné záznamy o klinickom stave a liečbe pacientov ako aj výsledky hematologických, biochemických, mikrobiologických a zobrazovacích vyšetrení. Pacienti boli hospitalizovaní na onkohematologickej jednotke intenzívnej starostlivosti v jednolôžkových izbách s využitím HEPA filtrácie vzduchu a zvýšeným hygienickým režimom. Antiinfekčná profylaxia bola pacientom aplikovaná vo fáze útlmu krvotvorby v kombinácii ciprofloxacín a flukonazol. K primárnej antimykotickej profylaxii flukonazolom sme sa priklonili na základe prítomnosti rizikových faktorov IFI, predovšetkým neutropénie, rozvíjajúceho sa ťažkého slizničného poškodenia a prítomnosti centrálneho venózneho katétra. Nakoľko ide o retrospektívnu analýzu, tento postup reflektuje dlhodobé skúsenosti pracoviska s prihliadnutím k ekonomickým možnostiam. Antiinfekčná profylaxia bola podávaná do regenerácie krvotvorby s úpravou hladiny neutrofilov.
Závažná neutropénia bola vymedzená poklesom počtu neutrofilov < 0,5 x 109/l. Regenerácia počtu neutrofilov bola stanovená ako zvýšenie ich hladiny nad 0,5 x 109/l počas dvoch dní po sebe. Febrilná epizóda bola definovaná ako orálna teplota viac ako 38,5 ˚C nameraná jednorázovo alebo dve za sebou nasledujúce merania viac ako 38,0 ˚C počas dvoch hodín [4]. Mukozitída dutiny ústnej bola klasifikovaná podľa WHO od najmenej závažnej – I. stupeň, po IV. stupeň s nutnosťou zavedenia parenterálnej výživy [5]. U všetkých pacientov boli v pravidelných intervaloch realizované odbery biologického materiálu, ktorý bol odosielaný do mikrobiologického laboratória. Išlo o tampóny z nosa, tonzíl, stery z jazyka, tampón z rekta a moč. Sérologické vyšetrenie mykotických antigénov bolo realizované u pacientov s febrilitami a mukozitídou, u ktorých bolo zahájené pátranie po rozvíjajúcej sa invazívnej mykotickej infekcii. Vyšetrenia boli realizované každé 2–3 dni počas tohto obdobia. Galaktomanan (GM) bol vyšetrený metódou ELISA, s využitím komerčnej sady Platelia Aspergillus EIA. Za pozitívnu bola považovaná hodnota v sére s IP > 0,5 a ako pozitívny pacient bol označený chorý s 2 po sebe nasledujúcimi pozitívnymi odbermi. Výsledky testu sme hodnotili so zreteľom na riziko falošnej pozitivity a negativity. Sérologické vyšetrenie kandidového antigénu bolo takisto vyšetrené metódou ELISA – komerčná súprava Platelia Candida Ag – pozitívna bola vzorka s hodnotou nad 125 pg/ml.
Pri objavení sa febrility boli pacientom odoberané hemokultúry z centrálního venózneho katétra (CVK) a z periférnej krvi. Hemokultúry boli vyšetrené na prítomnosť baktérií a mykotických agens. Boli vyšetrené aj vzorky z miest, ktorých kolonizácia mohla viesť k vzniku infekčnej komplikácie. Tieto procedúry boli realizované opakovane denne počas obdobia subfebrilií, febrilít a rozvoja infekcií. Denne boli hodnotené parametre krvného obrazu a monitorované laboratórne parametre, predovšetkým zápalové markery – C-reaktívny proteín (CRP) a prokalcitonín (PCT), renálne, hepatálne parametre a mineralogram.
U pacientov s febrilnou neutropéniou (FN) bola zahájená empirická antibiotická liečba v súlade s odporúčaním medzinárodných odborných spoločností [6, 7]. Po obdržaní mikrobiologických výsledkov bola liečba upravená cielene podľa citlivosti zachytených patogénov.
Pri podozrení na rozvoj invazívnej fungálnej infekcie boli s prihliadnutím na ďalšie klinické známky infekcie realizované zobrazovacie vyšetrenia. Išlo predovšetkým o RTG hrudníka a HRCT pľúc (high-resolution computed tomography). V prípade pozitívneho nálezu bola plánovaná realizácia bronchoalveolárnej laváže, avšak vzhľadom na ťažkú trombocytopéniu spojenú s rizikom krvácania nebola prevedená u žiad-neho chorého.
Jednotlivé epizódy IFI sme klasifikovali podľa odporú-čaní EORTC/MSG z roku 2008 [8]. V skupine našich pa-cientov sme hodnotili predchádzajúcu liečbu základného ochorenia ako aj dlhodobé užívanie kortikosteroidov. Sledovaná bola aj prítomnosť komorbidít, ktoré predisponujú k rozvoju IFI: renálne zlyhanie, potreba hemodialýzy, diabetes mellitus, chronická obštrukčná choroba pľúc a ďalšie faktory asociované s rozvojom IFI.
SÚBOR PACIENTOV
Hodnotili sme údaje od 39 pacientov, ich charakteristika je uvedená v tabuľke 1.
Tab. 1. Charakteristika pacientov v sledovanom súbore 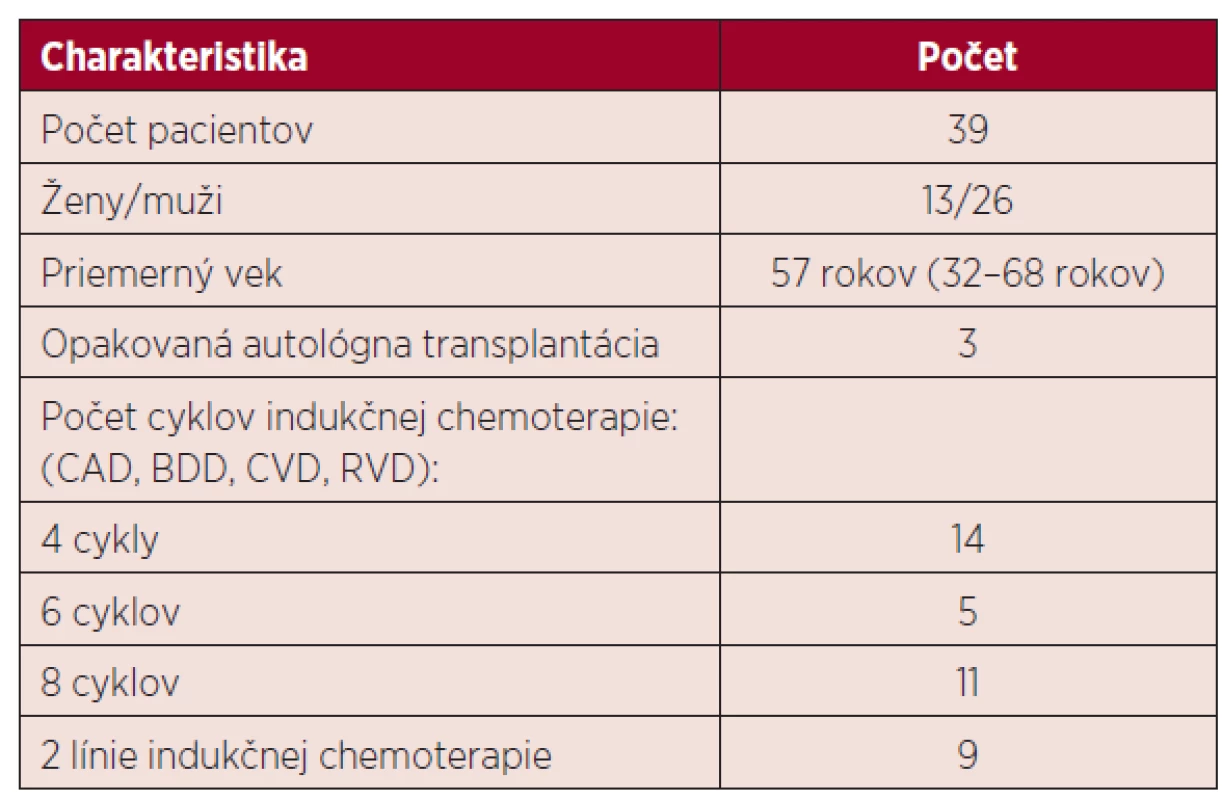
CAD – cyklofosfamid-doxorubicín-dexametazón, BDD – bortezomib-doxorubicín-dexametazón, CVD – cyklofosfamid-vinkristin-dexametazón, RVD – lenalidomid-bortezomib-dexametazón Všetci pacienti podstúpili vysokodávkovanú chemoterapiu nasledovanú podaním krvotvorných buniek z periférnej krvi. Pacienti sa líšili klinickým štádiom ochorenia, typom a počtom cyklov predchádzajúcej chemoterapie, liečebnou odpoveďou a pridruženými komorbiditami.
U všetkých pacientov v našom súbore bol podaný prípravný myeloablatívny režim (melphalan 200 mg/m2), po ktorom došlo k útlmu kostnej drene s ťažkou neutropéniou. V skupine chorých bez IFI trvalo obdobie do regenerácie počtu neutrofilov približne 6 dní, v skupine s IFI 8 dní. Vzhľadom na rozvoj bakteriálnej infekcie bolo u 32 pacientov potrebné aplikovať empirickú antibiotickú liečbu a po obdržaní výsledkov upraviť terapiu podľa citlivosti. Charakteristika rizikových faktorov u pacientov je uvedená v tabuľke 2.
Tab. 2. Charakteristika rizikových faktorov 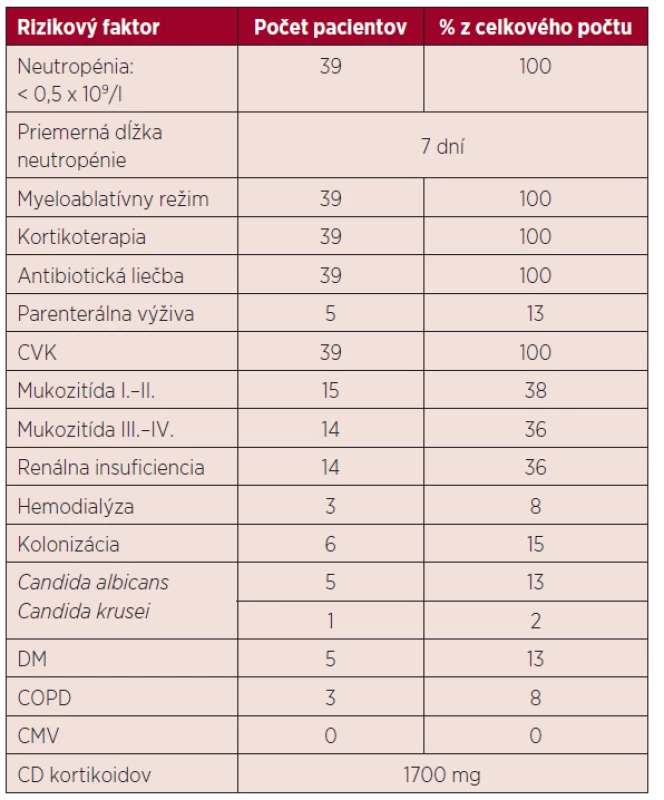
ATB – antibiotická liečba, CVK – centrálny venózny katéter, DM – diabetes mellitus, COPD – chronická obštrukčná pľúcna choroba, CMV – infekcia cytomegalovírusom, CD – celková dávka VÝSLEDKY
Možná alebo pravdepodobná invazívna fungálna infekcia sa vyskytla u 4/39 pacientov (10 % analyzovaného súboru).
U všetkých pacientov liečených pre IFI boli prítomné febrility nereagujúce na širokospektrálnu antibiotickú liečbu a klinické príznaky postihnutia respiračného systému (suchý kašeľ a sťažené dýchanie.) Z uvedených dôvodov bolo indikované HRCT vyšetrenie pľúc a doplnené vyšetrenie mykotických antigénov.
Podľa výsledkov vyšetrení, klinického stavu a klasifikácie EORTC/MSG (8) sme sa v 2 prípadoch na základe pretrvávajúcich febrilít, klinického stavu, HRCT nálezu na pľúcach, ale bez pozitivity GM priklonili k diagnóze možnej invazívnej mykotickej infekcie. V ďalšom prípade išlo o pravdepodobnú invazívnu pľúcnu infekciu Trichosporon spp. a 1 pacientka bola diagnostikovaná ako pravdepodobná invazívna aspergilóza pľúc. Charakteristika pacientov s IFI je uvedená v tabuľke 3. Vzhľadom k nízkemu počtu pacientov s IFI sme nemohli stanoviť štatistický korelát.
Tab. 3. Invazívne mykotické infekcie u pacientov s mnohopočetným myelómom 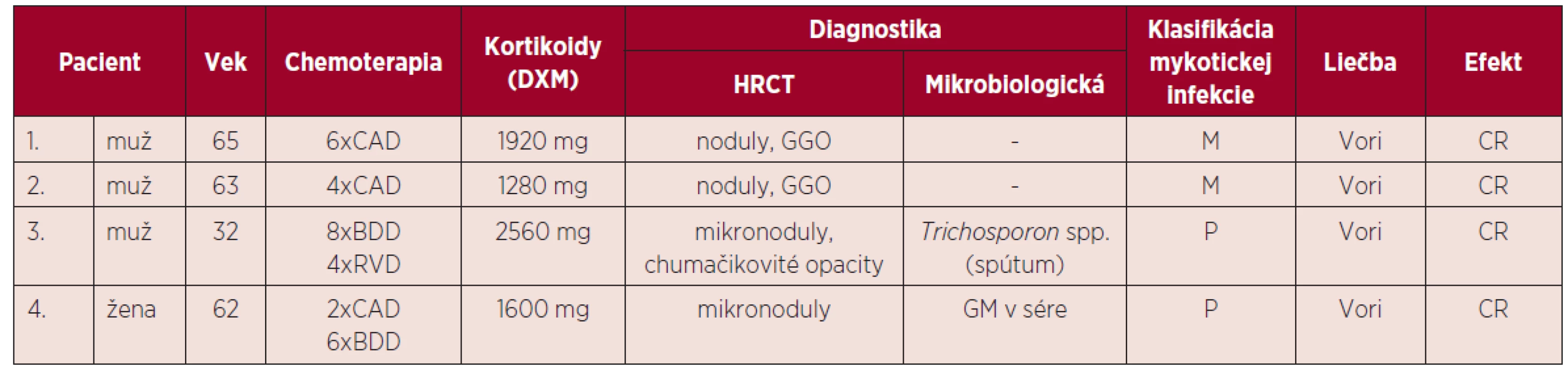
DXM – dexametazón, CAD – cyklofosfamid, doxorubicín, dexametazón, BDD – bortezomib, doxorubicín, dexametazón, RVD – lenalidomid, bortezomib, dexametazón, HRCT – počítačová tomografia s vysokým rozlíšením (high resolution computed tomography), GGO – opacity mliečneho skla (ground glass opacity), GM – galaktomanan, CR – kompletná remisia, P – pravdepodobná IFI, M – možná IFI, Vori – vorikonazol. Všetci pacienti boli liečení vorikonazolom v dávke 6 mg/kg/12 hodín v prvý deň, pokračujúc dávkou 4 mg/kg/12 hodín. V jednom prípade u pacienta s renálnou insuficienciou v chronickom dialyzačnom programe bola pre známu nefrotoxicitu vehikula v intravenóznej forme aplikovaná perorálna forma v dávke 200 mg/12 hod. Dĺžka liečby bola minimálne 3 týždne a všetci pacienti po zhodnotení kontrolného HRCT nálezu dosiahli kompletnú remisiu ochorenia, ktorá bola stanovená podľa Segalových kritérií odpovede na liečbu [9].
Výskyt invazívnej kandidovej infekcie sme nezaznamenali. Kandidami boli kolonizovaní 6 pacienti. U 5 pacientov bola kolonizovaná dutina ústna Candida albicans, citlivá na flukonazol a jeden pacient bol kolonizovaný C. krusei, ktorá bola flukonazol rezistentná, ale citlivá na echinokandíny. Vzhľadom na priebeh ochorenia a klinický stav pacienta echinokandíny nebolo potrebné podávať.
V skupine pacientov, u ktorých sa rozvinula ťažká mukozitída dutiny ústnej, sme zvýšili dávku flukonazolu na 800 mg/deň a aplikovaná bola formou perorálnej suspenzie a intravenózne.
Celková transplantačná mortalita v deň +100 po transplantácii bola nulová v skupine bez IFI ako aj u pacientov s IFI.
DISKUSIA
V posledných rokoch znamenalo zavedenie vysokodávkovanej chemoterapie nasledovanej autológnou transplantáciou krvotvorných buniek a zavedenie nových liečebných postupov (thalidomid, lenalidomid a bortezomib) predĺžené prežívanie u pacientov s mnohopočetným myelómom, čo posúva toto ochorenie do skupiny chronických ochorení. Všetky tieto okolnosti vedú k prehĺbeniu imunosupresie, a tak k zvýšenému riziku rozvoja infekčných komplikácií [10, 11, 15]. Imunodeficiencia pri MM je spojená s postihnutím viacerých úrovní imunitného systému. Vyplýva jednak z funkčného deficitu B-lymfocytov a s tým spojenej hypogamaglobulinémie, ale aj kvantitatívnych a funkčných zmien dendritických buniek, NK buniek a CD4+ T-lymfocytov. Ďalšími faktormi asociovanými s rozvojom infekcií je liečba základného ochorenia, orgánová dysfunkcia ako aj pridružené komorbidity pacienta, keďže MM postihuje prevažne starších pacien-tov [10, 12]. Riziko rozvoja infekčných komplikácií u pacientov podstupujúcich autológnu transplantáciu je najvyššie v období pred prihojením štepu, kde najvýznamnejším faktorom je pretrvávanie neutropénie a mukozitída. Obdobie po transplantácii je rizikové z hľadiska neskoršej obnovy bunkami sprostredkovanej imunity. Ďalšími faktormi, ktoré je potrebné u týchto pacientov zohľadniť sú: poškodenie obličiek, preťaženie organizmu železom, liečba základného ochorenia a ostatné známe rizikové faktory pre invazívnu aspergilózu a invazívnu kandidózu [10].
V našej skupine sa IFI vyskytla u 4 pacientov (10 %). Z tohto počtu išlo u 2 pacientov o diagnózu možnej IFI a v ďalších 2 prípadoch o diagnózu pravdepodobnej IFI (tab. 3). Tento výsledok je porovnateľný s výsledkami iných publikácií s touto problematikou [10, 11, 13].
Rozvoj IFI je spojený s dlhodobou neutropéniou. V našom súbore pacientov trvala fáza ťažkej neutropénie priemerne 8 dní v skupine s IFI a 6 dní u pacientov, kde sa IFI nevyskytla. Z ďalších faktorov je potrebné brať do úvahy vek, stav a predchádzajúcu liečbu základného ochorenia, komorbity pacienta a použitie kortikoidov v liečbe. V sledovanom súbore mali pacienti s IFI častejšie výskyt mukozitídy III. a IV. stupňa (75 % vs. 31 %), renálnej insufiencie (75 % vs. 31 %). Všetci pacienti boli liečení chemoterapeutickými schémami s obsahom kortikosteroidov (dexametazónu) v období od stanovenia diagnózy až do realizácie autológnej transplantácie. Priemerná celková dávka kortikoidov v sledovanej skupine bola 1 640 mg v skupine bez IFI vs. 2 150 mg u pacientov s IFI. Tento faktor sa zdá byť významný v sledovanej skupine, podobne ako v iných prácach, ktoré dokumentujú, že kortikosteroidy a ich dlhodobé užívanie je spojené so zvýšenou náchylnosťou na vznik invazívnych mykotických infekcií (tab. 4) [14]. Z ďalších predisponujúcich faktorov boli prítomné zavedenie CVK a liečba širokospektrálnymi antibiotikami. Invazívna fungálna infekcia sa rozvinula u pacientov s mukozitídou v dutine ústnej a možným rizikovým faktorom sú aj stavebné a rekonštrukčné práce, ktoré v sledovanom období prebiehali v nemocnici a jej okolí. Sú spojené s uvoľňovaním mykotických spór do okolia a kontamináciou dýchacích ciest. Hoci boli pacienti počas transplantácie hospitalizovaní na jednotke intenzívnej starostlivosti s filtráciou ovzdušia, počas podávania chemoterapeutickej liečby boli umiestnení na štandardnom lôžkovom oddelení a ku kolonizácii mohlo dôjsť aj počas pobytu v domácej starostlivosti.
Tab. 4. Rizikové faktory v skupine pacientov s IFI a bez IFI 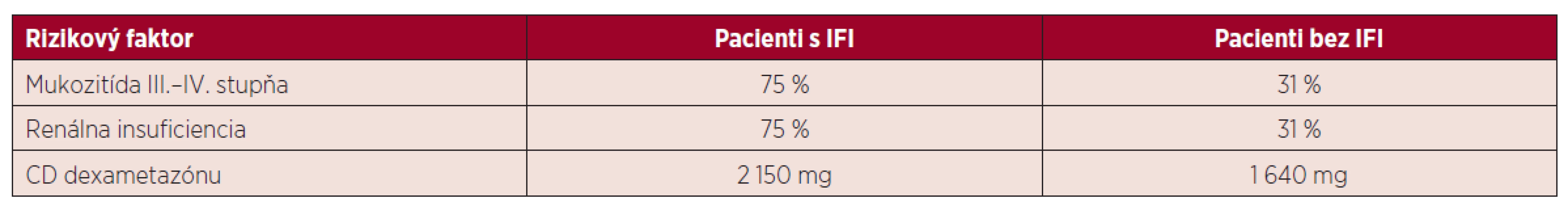
CD – celková dávka ZÁVER
Chorí s mnohopočetným myelómom nepatria z hľadiska rozvoja IFI do vysokorizikovej skupiny, ale počet týchto invazívnych infekcií aj v tejto populácii pribúda. Je to spojené so zavedením nových liečebných stratégií a transplantačných režimov, ktoré sú dnes štandardom v liečbe mnohopočetného myelómu. Preto je potrebné myslieť aj na takúto komplikáciu predovšetkým ak nie je prítomná jednoznačná odpoveď na antibiotickú liečbu u pacientov so známkami infekcie. Z rizík spojených s invazívnou mykotickou infekciou sú významné predovšetkým podávanie kortikoterapie, rozvoj neutropénie, mukozitídy a renálna insuficiencia. Sú potrebné nové epidemiologické a klinické poznatky a skúsenosti na zlepšenie kategorizácie predisponujúcich rizík a z toho vyplývajúcej antimykotickej stratégie začínajúcej od efektívnej profylaxie, diagnostiky až po cielenú antifungálnu liečbu.
Podiel autorov na príprave rukopisu
J.G. – príprava rukopisu, liečba pacientov, zber dát
E.T. – liečba pacientov, revízia rukopisu
T.G. – liečba pacientov, revízia rukopisu
Š.R. – laboratórne vyšetrenia pacientov, imunologický konzultant, revízia rukopisu
P. J. – príprava rukopisu, antibiotický konzultant, podiel na antiinfekčnej liečbe pacientov, revízia rukopisu.
Transparentná spolupráca
Autorka práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohto článku nie je v strete záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlásenie sa týka aj všetkých spoluautorov.
Doručeno do redakce: 14 . 12. 2014
Přijato po recenzi: 27. 1. 2015
MUDr. Juliana Gabzdilová
Klinika hematológie a onkohematológie UNLP a LF UPJŠ
Trieda SNP 1
040 01 Košice
Slovenská republika
e-mail: julianagabzdilova@centrum.sk
Zdroje
1. Upton A, Kirby KA, Carpenter P, et al. Invasive aspergillosis following hematopoietic cell transplantion: Outcomes and prognostic factors associated with mortality. Clin Infect Dis 2007; 44 : 531–540.
2. Pagano L, Morena C, Candoni A, et al. The epidemiology of fungal infections in patients with hematologic malignancies: the SEIFEM-2004 study. Haematologica 2006; 91 : 1068–1075.
3. Marr K A, Carter RA, Crippa F, et al. Epidemiology and outcome of mould infections in hematopoetic stem cell transplant recipients. Clin Infect Dis 2002; 34 : 909–917.
4. De Naurois I, Basso MJ, Marti F, et al. Management of febrile neutropenia: ESMO Clinical Practice Guidelines. Ann Oncol 2010; 21(suppl 5): v252–v256.
5. Lalla RV, Sonis ST, Peterson DE. Management of oral mucositis in patients with cancer. Dent Clin N Am 2008; 5 : 61–77.
6. Ráčil Z, Haber J, Drgoňa Ľ, et al. Empirická antimykotická léčba febrilní neutropenie u nemocných s hematologickou malignitou – doporučení odborníků – s podporou CELL, ČHS ČLS JEP, ČOS ČLS JEP, SCHS SLS. Postgrad Med 2010; 12 : 23–25.
7. Freifeld AG, Bow EJ, Sepkowitz KA, et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 update by the Infectious Diseases Society of America. Clin Infect Dis 2011; 52 : 56–90.
8. De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal diseases from the European Organization for Reasearch and Treatment of Cancer / Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus. Clin Infect Dis 2008; 46(12): 1813–1821.
9. Segal BH, Herbrecht R, Stevenns DA, et al. Defining response to therapy and study outcomes in clinical trials of invasive fungal diseases: Mycoses Study Group and European Organization for Research and Treatment of Cancer consensus criteria. Clin Infect Dis 2008; 47(5): 674–683.
10. Nucci M, Anaissie E. Infections in patients with multiple myeloma in the era of high-dose therapy and novel agents. Clin Infect Dis 2009; 49 : 1211–1225.
11. Post MJ, Lass-Floerl C, Gastl G, Nachbaur D. Invasive fungal infections in allogeneic and autologous stem cell transplant recipients: a single-center study of 166 transplanted patients. Transpl Infect Dis 2007; 9 : 189–195.
12. Schütt P, Brandhorst D, Stellberg W, et al. Immune parameters in multiple myeloma patients: influence of treatment and correlation with opportunistic infections. Leuk Lymphoma 2006; 47(8): 1570–1582.
13. Gill L, Kozlowska-Skrzypczak M, Mol A, et al. Increased risk for invasive aspergillosis in patients with lymphoproliferative diseases after autologous hematopoietic SCT. Bone Marrow Transplant 2009; 43 : 121–126.
14. Cornillet A, Camus A, Nimubona S, et al. Comparison of epidemiological, clinical and biological features of invasive aspergillosis in neutropenic and nonneutropenic patients: a 6-year survey. Clin Infect Dis 2006; 43(5): 577–584.
15. Nucci M, Nouér SA, Anaissia E. Early diagnosis of invasive pulmonary aspergillosis in hematologic patients: an opportunity to improve the outcome. Haematologica 2013; 98(11): 1657–1660.
16. Nosari AM, Pioltelli ML, Riva M, et al. Invasive fungal infections in lymphoproliferative disorders: a monocentric retrospective experience. Leuk Lymphoma 2014; 55 : 1844–1848.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2015 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Infekčné komplikácie behom indukčnej liečby akútnej myeloidnej leukémie bez použitia antibiotickej profylaxie
- Mykotické komplikácie po autológnej transplantácii krvotvorných buniek u pacientov s mnohopočetným myelómom
- Interference složek krevní plazmy při turbidimetrickém stanovení D-dimeru
- Inkorporace humanizované tkáně jako strategie pro zlepšení uchycení leukemie v imunodeficientní myši
- Excellent prognosis of late relapses of ETV6/RUNX1-positive childhood acute lymphoblastic leukemia: lessons from the FRALLE 93 protocol
- Clinical heterogeneity and predictors of outcome in primary autoimmune hemolytic anemia: a GIMEMA study of 308 patients
- The toxicity of very prolonged courses of PEGasparaginase or Erwinia asparaginase in relation to asparaginase activity, with a special focus on dyslipidemia
- Safety and efficacy of rituximab in adult immune thrombocytopenia: results from a prospective registry including 248 patients
- First-line treatment for severe aplastic anemia in children: bone marrow transplantation from a matched family donor versus immunosuppressive therapy
- Management and clinical outcomes in patients treated with apixaban vs warfarin undergoing procedures
- Recombinant long-acting glycoPEGylated factor IX in hemophilia B: a multinational randomized phase 3 trial
- XXII. česko-slovenská konference o trombóze a hemostáze s mezinárodní účastí
- Soutež o Cenu firmy Janssen
- Úvodník
- Uchycení akutní a chronické myeloidní leukemie v NOD scid gamma myši
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Infekčné komplikácie behom indukčnej liečby akútnej myeloidnej leukémie bez použitia antibiotickej profylaxie
- Interference složek krevní plazmy při turbidimetrickém stanovení D-dimeru
- Mykotické komplikácie po autológnej transplantácii krvotvorných buniek u pacientov s mnohopočetným myelómom
- Uchycení akutní a chronické myeloidní leukemie v NOD scid gamma myši
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



