-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRegenerační schopnosti nanovláknového obvazu na bázi polylaktidu
Regenerative abilities of a nanofiber wound dressing based on polylactide
Introduction: The development of an ideal dressing for wound healing remains an unresolved issue. Thanks to the development of electrospinning technology, polymers in the form of nanofibers have come to the forefront of research interest. A modern and very promising dressing material is a “nonwoven” based on nanofibers of the synthetic polymer polylactide (PLA). The aim of this work was to assess the regenerative abilities of PLA in a standardized wound in a porcine model and compare our results to the literature data.
Methods: We applied PLA-based nanofiber dressings to the standardized wounds created in the porcine model. On the third, tenth, seventeenth and twenty-fourth days after the formation of the defect, we changed the wound dressing while taking a tissue sample for histopathological examination. We continuously monitored serum levels of acute phase proteins.
Results: PLA stimulated an inflammatory response. From the third day, the thickness of the fibrin layer with granulocytes increased. It reached its maximum values on the tenth day (mean 340 μm); at the same time the level of serum amyloid A, as a marker of inflammation, culminated. The individual phases of healing intertwined. The highest thickness values of the granulation tissue with cellular connective tissue (diameter 8463 μm) were reached on the seventeenth day. On the twenty-fourth day, the defects were healed macroscopically with a mean reepithelialization layer of 9913 μm.
Conclusion: PLA-based nanofiber dressing potentiates the inflammatory, proliferative and reepithelialization phases of healing. Its structure perfectly mimics the extracellular matrix and serves as a 3D network for the growth and interaction of cellular elements. In addition to biocompatibility, PLA has a unique ability of two-phase biodegradation. It is a promising material for industrial production of dressing materials. Most of the available studies were performed in vitro. In vivo comparative studies approximating the use of PLA to daily practice are still missing.
Keywords:
nanofibres – polylactide – Wound healing
Autoři: K. Menclová 1; P. Svoboda 1; J. Hadač 1; R. Doležel 1; M. Ryska 1; V. Mandys 2; Radek Pohnán 1
Působiště autorů: Chirurgická klinika 2. lékařské fakulty Univerzity Karlovy a Ústřední vojenská nemocnice – Vojenská fakultní, nemocnice Praha 1; Ústav patologie 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha 2
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 9, s. 435-439.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2021.100.9.435–439Souhrn
Úvod: Vývoj ideálního krytí pro oblast hojení ran je stále nevyřešeným problémem. Díky rozvoji techniky elektrostatického zvlákňování se do popředí výzkumného zájmu dostaly polymery ve formě nanovláken. Moderním a velice slibným obvazovým materiálem je netkaný textil na bázi nanovláken syntetického polymeru polylaktidu (PLA). Cílem práce bylo posouzení regeneračních schopností PLA na standardizované ráně prasečího modelu a naše výsledky porovnat s literárními údaji.
Metody: Na vytvořené standardizované rány na prasečím modelu jsme aplikovali nanovláknové obvazy na bázi PLA. Třetí, desátý, sedmnáctý a dvacátý čtvrtý den od tvorby defektu jsme ránu převázali za současného odběru tkáně k histopatologickému vyšetření. Průběžně jsme monitorovali hladiny sérových proteinů akutní fáze zánětu.
Výsledky: PLA stimuloval zánětlivou reakci. Od třetího dne narůstala tloušťka fibrinové vrstvy s granulocyty. Maximálních hodnot dosáhla desátý převazový den (průměr 340 μm), zároveň kulminovala hladina sérového amyloidu A jakožto markeru zánětu. Jednotlivé fáze hojení se vzájemně prolínaly. Největších hodnot tloušťky granulační tkáně s buněčným vazivem (průměr 8463 μm) bylo docíleno sedmnáctý den. Dvacátý čtvrtý den byly defekty makroskopicky zhojeny s průměrnou vrstvou reepitelizace 9913 μm.
Závěr: Nanovláknový obvaz na bázi PLA potencuje zánětlivou, proliferační i reepitelizační fázi hojení. Jeho struktura dokonale napodobuje stavbu a funkci extracelulární matrix a slouží jako 3D síť pro růst a interakci buněčných elementů. Mimo biokompatibilitu disponuje PLA unikátní schopností dvoufázové biodegradace. Je slibným materiálem pro výrobu převazových materiálů. Většina dostupných studií byla provedena in vitro. Dosud chybí in vivo srovnávací studie, přibližující použití PLA k denní praxi.
Klíčová slova:
nanovlákna – polylaktid – hojení ran
ÚVOD
Technika elektrostatického zvlákňování polymerů, jehož produktem jsou nanočástice a nanovlákna, do sáhla v posledních desetiletích významného rozvoje. Zjednodušeně jde o metodu, kdy k tvorbě vláken dochází mezi dvěma opačně nabitými vysokonapěťovými elektrodami v roztoku polymeru. Využití nanočástic je všestranné. Uplatňují se v čištění odpadních vod, k absorpci tuků z vody nebo k výrobě protektivních oděvů [1]. Opravdový boom zažívají v biomedicíně a tkáňovém inženýrství. Jejich dominantní přínos se projevil zejména v oblasti hojení ran.
Zachování kožní integrity je jednou ze zásadních podmínek udržení homeostázy organismu. Porušení kožního krytu vede nezbytně k nárůstu morbidity a mortality [2]. Absence časné adekvátní léčby má negativní socioekonomické důsledky. To vše je důvodem k vynalézání stále nových obvazových materiálů s cílem urychlit hojení ran. Ideální krytí musí splňovat hned několik podmínek, jakými jsou biokompatibilita, zabránění vniku exogenních mikroorganismů do rány a flexibilita. Krytí by mělo být biodegradabilní a mít hemostatický účinek [3]. Nezanedbatelné jsou praktické požadavky na cenovou a materiální dostupnost a snadnou a bezbolestnou aplikaci.
Nanovláknové obvazy z elektrostaticky zvlákněných přírodních (např. chitosan) [1] i syntetických (polyglykolát, polylaktid) polymerů se právě pro svoji všestrannost jeví v řešení problematiky hojení ran slibně. Syntetický polylaktid (PLA) je moderní lehce hydrofobní materiál vynikající svými mechanickými vlastnostmi, biodegradabilitou i biokompatibilitou a snadnou obnovitelností. Neopomenutelná je jeho šetrnost k přírodě [4]. V naší práci jsme se zaměřili na zhodnocení regeneračních schopností právě syntetického krytí ve formě netkané textilie na bázi PLA. Zkoumali jsme vliv jeho aplikace na vytvořenou standardizovanou ránu na prasečím modelu v průběhu všech fází hojení rány.
METODY
Pokus byl schválen etickou komisí Ústavu živočišné fyziologie a genetiky Akademie věd ČR (ÚŽFG AV ČR). Členové výzkumného týmu měli oprávnění k vedení experimentální studie na zvířatech v souladu se zákonem č. 246/1992 Sb. upraveným vyhl. č. 207/2004 s následným výkladem k vyhlášce č. 39/2009.
Výroba nanovláknového obvazu se uskutečnila ve spolupráci s firmou Nanotex s.r.o. PLA (IngeoTM, Biopolymer 4032D, NatureWorks, Minnesota, USA) byl připraven ze 7% roztoku chloroformu, dichlorethanu a ethylacetátu. Jeho hmotnost na jednotku plochy činila 10 g/m2. Elektrostatické zvláknění proběhlo na přístroji NanospiderTM unit (NS Lab 500, ELmarco, Liberec).
Pokus byl proveden na půdě ÚŽFG AV. K pokusu bylo využito 8 samčích kastrátů prasat z chovu „Minipig Liběchov“ o průměrné hmotnosti 31 kg. V celkové inhalační anestezii (vzduch + 02 + Isofluran) s intratracheální intubací po předchozí premedikaci (Tiletamine 2 mg/ kg + Zolazepam 2 mg/kg + Ketamine 2 mg/kg + Xylazine 0,4 mg/kg) jsme každému praseti po dezinfekci kožního krytu roztokem Betadine vytnuli skalpelem podél hřbetu 4 identické defekty v celé tloušťce kůže o rozměrech 40×40 mm. Na defekty jsme aplikovali netkaný obvaz ze zvlákněného PLA. Defekty jsme převazovali každý třetí, desátý, sedmnáctý, resp. dvacátý čtvrtý den. V průběhu jednotlivých převazů jsme postupně odebírali tkáňové vzorky a odesílali je k histopatologickému vyšetření. Po odběru byly fixovány v roztoku 10% formalinu, dehydratovány a zality v parafinu. Před mikroskopickým odečtem, prováděným zkušeným patologem, byly obarveny hematoxylin-eosinem. Z každé ze čtyř ran podél hřbetu prasete jsme vzorek odebrali postupně a jen jednou tak, aby nedošlo k další traumatizaci a tím zkreslení výsledku v procesu hojení. Paralelně s převazy jsme prováděli odběry žilní krve ke stanovení hladiny sérových proteinů akutní fáze zánětu – C-reaktivní protein (CRP), sérový amyloid A (SAA), haptoglobin (HPT). Své poznatky jsme porovnali s dostupnou literaturou.
VÝSLEDKY
Mikroskopické hodnocení bylo zaměřeno na zhodnocení hloubky defektu v průběhu hojení. Dále jsme hodnotili tloušťku fibrinové vrstvy s granulocyty typické pro iniciální fázi zánětu, tloušťku vrstvy granulační tkáně a buněčného vaziva charakterizující fázi proliferační a konečně sílu reepitelizace ve finální fázi hojení rány. Deskriptivní data s hodnotami tlouštěk jednotlivých vrstev shrnuje tabulka (Tab. 1).
Tab. 1. Absolutní hodnoty tlouštěk jednotlivých vrstev a jejich průměry v průběhu hojení
Tab. 1: Absolute values of layer thicknesses and their means during the healing process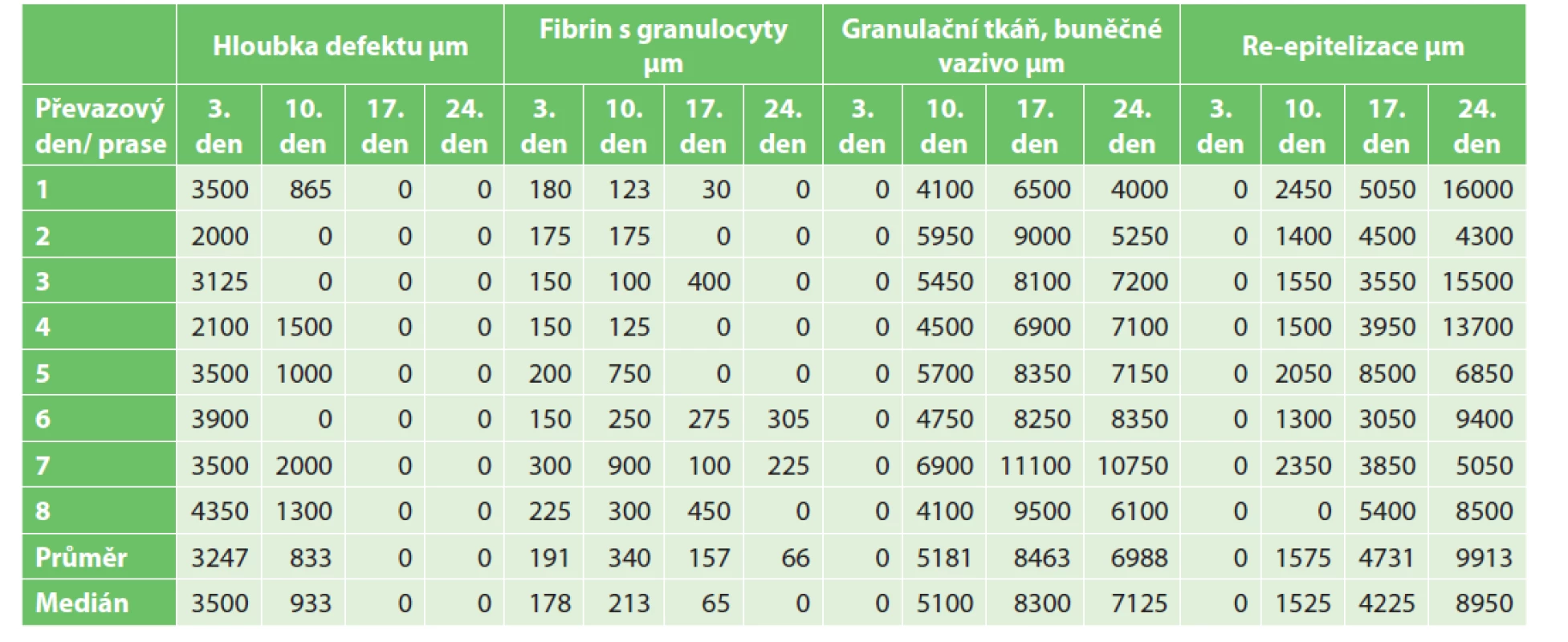
Jednotlivé fáze hojení se kontinuálně prolínaly. Z dat uvedených v tabulce vyplývá, že významnou zánětlivou reakci jsme pozorovali již během prvního převazu rány a že svého maxima dosahovala kolem desátého dne po tvorbě defektu, kdy již postupně přecházela ve fázi proliferační. Tloušťka granulační tkáně s buněčným vazivem kulminovala sedmnáctý převazový den. Reepitelizace s keratinocyty se objevila již během druhého převazu se svým maximem během posledního převazu, kdy již byly všechny rány makroskopicky zhojeny zepitelizovanou jizvou.
U měřených sérových hladin proteinů akutní fáze zánětu nedošlo s výjimkou SAA k výchylce v průběhu všech fází hojení. Výkyv hladiny SAA dokumentující probíhající zánětlivou reakci během desátého převazového dne znázorňuje Graf 1.
Graf 1. Hladiny SAA v průběhu hojení rány
Graph 1: Levels of SAA during the healing process
DISKUZE
Elektrostaticky zvlákněné polymery v podobě nanovláken se v posledních desetiletích těší stále větší oblibě a stojí v popředí výzkumných zájmů biomedicíny a tkáňového inženýrství. Využití nacházejí v podobě nosičů léčivých přípravků, slouží jako 3D podpora růstu buněčných elementů při regeneraci chrupavky, kostí, srdečních chlopní, svalů, nervové tkáně a kůže [5]. Vyskytují se ve formě gelů, filmů, částic nebo vláken různých velikostí [6]. Jsou součástí moderních obvazových materiálů.
Předmětem tkáňového inženýrství je najít „scaffold (lešení)“ pro proliferaci a diferenciaci buněk napodobující funkci a strukturu extracelulární matrix v živém systému [4,7], která je za normálních okolností tvořená fibrózní sítí s kolagenem. Taková síť poskytuje nejen mechanickou oporu buňkám, ale umožňuje i jejich vzájemné působení a ovlivňuje jejich funkci. Růst, organizace, diferenciace i smrt buněk je regulována interakcí s matrix [4]. Dříve používané extrahované zvířecí kolagenové preparáty obsahovaly četné endotoxiny a jiné peptidy spouštějící v lidském těle kaskádu patologických procesů [1]. Naproti tomu nanovlákenné polymery, zejména PLA, vykazují vysokou biokompatibilitu. PLA je moderní syntetický polymer. První nanovlákna na bázi PLA byla vyrobena v roce 2005 [8]. Chemický vzorec PLA ukazuje Obr. 1.
Obr. 1. Chemická struktura PLA
Fig. 1: Chemical structure of PLA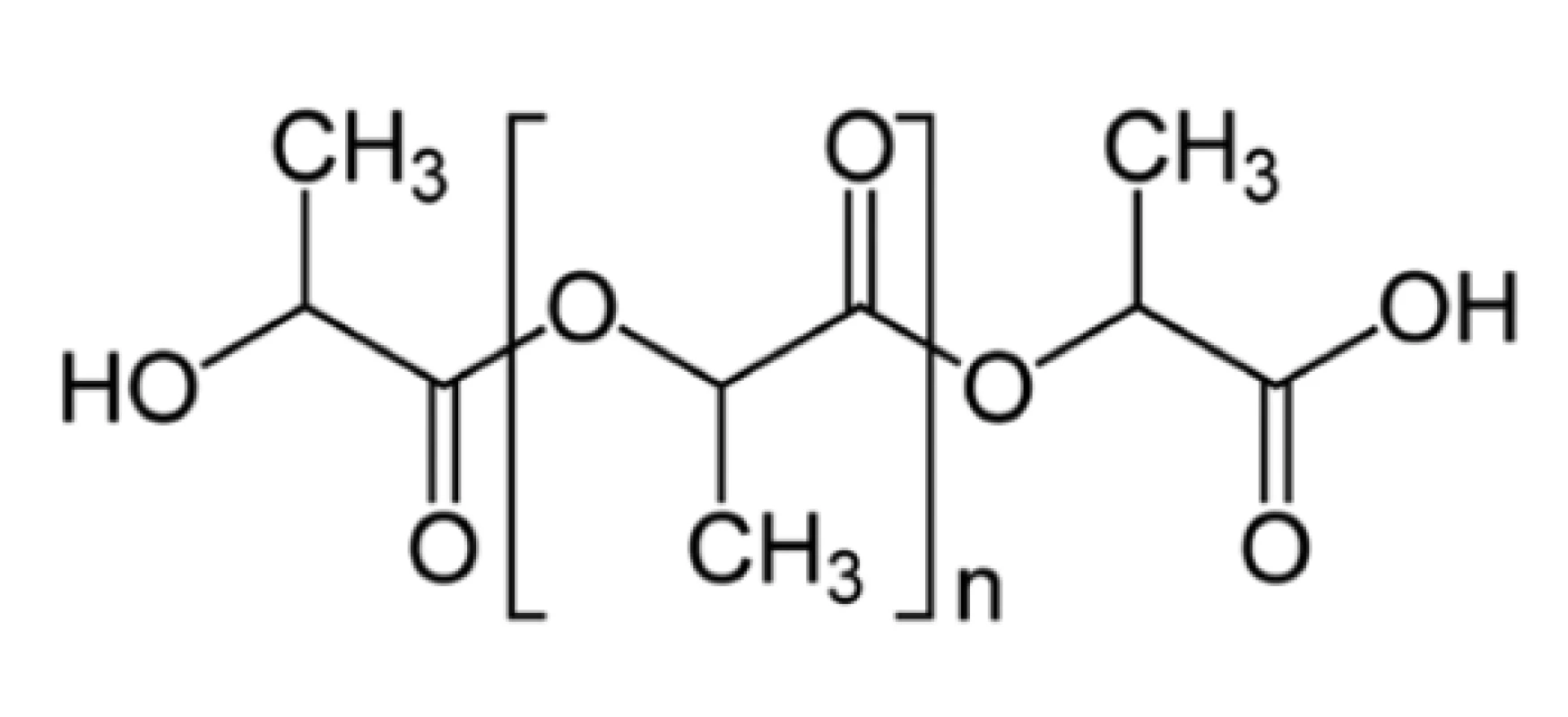
Nanovláknová struktura PLA vzniklá zvlákněním roztoku polymeru je výhodná. Materiál obsahuje četné póry a drážky napodobující síť extracelulární matrix (Obr. 2).
Obr. 2. A) Nanovlákna PLA v rastrovacím elektronovém mikroskopu; B) extracelulární dermální matrix v rastrovacím elektronovém mikroskopu
Fig. 2: A) PLA nanofibres in the scanning electron microscope; B) extracellular dermal matrix in the scanning electron microscope
Zdroj: Miletić A, Pavlić B, Ristić I et al. Encapsulation of Fatty Oils into Electrospun Nanofibres for Cosmetic Products with Antioxidant Activity. Appl. Sci. 2019, 9, 2955; doi:10.3390/app9152955. Dává tak mechanickou oporu pro růst buněk. Přínosná je forma „plátků“ netkané textilie mající díky porozitě velký povrch vzhledem k objemu obvazu [4]. Formu netkané textilie jsme používali i my v našem in vivo pokusu. Vysoká porozita a flexibilita umožňuje volnou výměnu plynů s okolím [9], přitom „3D mřížka“ usnadňuje buněčnou adhezi, proliferaci i diferenciaci buněk. Bohužel většina dosud publikovaných prací zabývajících se studiem nanovláknových krytí byla prováděna in vitro [10,11]. Dominantní změny typické pro zánětlivou fázi jsme v našem projektu zaznamenali v období kolem desátého dne po vytvoření rány, tedy v průběhu druhého převazu. Kulminovala tloušťka fibrinové vrstvy s granulocyty, svého maxima dosáhla hladina SAA. Z literatury víme, že PLA potencuje vznik silné vrstvy zánětlivých buněk mezi ním a tkání [4]. Méně zánětlivou reakci vyvolává stereokomplexní forma PLA [4]. Hodí se pro případy předpokládaného protrahovaného hojení, např. regenerace nervových vláken, kde je nižší zánětlivá reakce žádoucí. Obecně platí, že stupeň zánětlivé odpovědi polymerních biomateriálů závisí na jejich chemické struktuře, zejména na hydrofilitě polymeru. Tato vlastnost potažmo souvisí, dokonce se prolíná s další vlastností PLA, a tou je biodegradabilita. In vivo je proces degradace zajištěn hydrolýzou materiálu tělesnými tekutinami, následovanou bakteriální degradací nízkomolekulárních fragmentů [12]. Zásadní roli na rychlost procesu mají okolní teplota a pH [13]. Zatímco degradace probíhá rychleji v zásaditém a vodném prostředí, acidita rozpadový proces zbržďuje. Na rozdíl od hydrofilních polymerů je degradace PLA v in vivo podmínkách pomalá a nastupuje zpravidla po 4 týdnech po aplikaci [4], resp. k ní dochází mezi 6–12 měsíci po aplikaci u studií in vivo. To jsme pozorovali i v průběhu našich převazů. PLA se postupně zakomponoval do rány. Jeho hydrofobní „nepřichycené“ zbytky jsme mohli během převazů, bylo-li třeba, nekomplikovaně z rány odstranit, případně jsme materiál navrstvili a postupně se stal součástí rány. Tato vlastnost je unikátní a je možné, že do budoucna bude vytvořeno krytí s minimální potřebou jeho výměny, které se plně degraduje v ráně. PLA také významně akcentuje růst granulační tkáně a fázi reepitelizace. Důvodem je již zmíněná poskytnutá mechanická podpora napodobující extracelulární matrix [5].
Design práce byl zaměřen na zhodnocení vlastností polylaktidového krytí jako takového. Autoři jsou si vědomi, že limitací této práce je bezpochyby absence kontrolní skupiny.
ZÁVĚR
Závažnost problematiky hojení ran vytváří neustálý tlak na výzkum v biomedicíně a tkáňovém inženýrství. Je obtížné naplnit všechny požadavky ideálního obvazového materiálu. Slibným moderním materiálem je krytí na bázi nanovláknového PLA. Tento polymer vyniká svou biokompatibilitou, flexibilitou a zejména unikátní dvoufázovou biodegradabilitou. Dokonale napodobuje strukturu a funkci extracelulární matrix. Jak jsme prokázali, mimo proliferační a reepitelizační fázi má i stimulační vliv na iniciální zánětlivou fázi hojení rány. Slabinou zůstává fakt, že většina prací zabývajících se aplikací nanovláknového PLA je prováděna v in vitro podmínkách. Zcela pak chybí srovnávací in vivo studie mezi různými typy obvazů jako zásadní mezikrok k výrobě a praktické aplikaci těchto obvazů v humánní medicíně.
Projekt byl podpořen grantem MO 3270 a MO 1012.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Kateřina Menclová
Chirurgická klinika 2. LF UK a ÚVN
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: katerina.menclova@uvn.cz
ORCID: 0000-0002-9930-8915
Zdroje
1. Eang C, Opaprakasit P. Electrospun nanofibres with superhydrophobicity derived from degradable polylactide for oil/water separation applications. Journal of Polymers and the Environment 2020;28 : 1484–1491. doi: 10.1007/ s10924-020-01704-z.
2. No HK, Park NY, Lee SH, et al. Antibacterial activity of chitosans and chitosan 4 oligomers with different molecular weights. Int J Food Microbiol. 2002;74 : 65–72. doi:10.1016/S0168-1605(01)007171-6.
3. Brans TA, Dutrieux RP, Hoekstra MJ, et al. Histopathological evaluation of scalds and 8 contact burns in the pig model. Burns 1994;20(1):48–51. doi:10.1016/0305-4179(94)900906,
4. Ishii D, Ying TH, Yamaoka T, et al. Characterization and biocompatibility of biopolyester nanofibres. Materials 2009;2 : 1520−1546. doi: 10.3390/ ma2041520,
5. Miguel SP, Figueira DR, Simões D, et al. Electrospun polymeric nanofibres as wound dressings: A review. Colloids and Surfaces B: Biointerfaces 2018;169 : 60–71. doi: 10.1016/j.colsurfb.2018.05.011.
6. Tharanathan RN, Kittur FS. Chitin – the undisputed biomolecule of great potential. Crit Rev 16 Food Sci Nutr. 2003;43 : 61–87. doi: 10.1080/1040869039082645.
7. Bacakova L, Filova E, Parizek M, et al. Modulation of cell adhesion, proliferation and differentiation on materials designed for body implants. Biotechnol 3 Adv. 2011;29(6):739–767. doi: 10.1016/j. biotechadv.2011.06.004.
8. Dersch R, Greiner A, Steinhart M, et al. Nanofasern und Nanoröhrchen: Bausteine aus Polymeren. Chemie in Unserer Zeit. 2005;39 : 26–35. doi:10.1002/ ciuz.200400321.
9. Park JU, Jeong SH, Song EH, et al. Acceleration of the healing process of full-thickness wounds using hydrophilic chitosan-silica hybrid sponge in a porcine model. Journal of Biomaterials Applications 2018;32(8):1–13. doi: 10.1177/0885328217751246.
10. Braekt de MM, Alphen FA, Kuijpers-Jagtman AM, et al. Wound healing and wound contraction after palatal surgery and implantation of poly-(L-lactic) acid membranes in beagle dogs. J. Oral Maxillofac Surg. 1992;50 : 359–364. doi: 10.1016/0278-2391(92)90398-J.
11. Sullivan TP, Eaglstein WH, Davis SC, et al. The pig as a model for human wound healing. Wound Repair Regen. 2001;9 : 66–73. doi: 10.1046/j.1524 - 475x.2001.00066.x.
12. Henton D, Gruber P, Lunt J, et al. Polylactic acid technology. In: Natural fibers, biopolymers, and biocomposites. Boca Raton, Tylor & Francis 2005;04–08. doi: 10.1201/9780203508206.ch16.
13. Magiera A, Markowski J, Pilch J, et al. Degradation behavior of electrospun PLA and PLA/CNT nanofibres in aqueous environment. Journal of Nanomaterials 2018;15 pages. doi: 10.1155/2018/8796583.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2021 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Atestace
- Komentář k editorialu pana profesora Pavla Pafka
- Prehabilitace, cesta ke zlepšení pooperačních výsledků
- Akutní apendicitida v době jarní pandemie covid-19 v roce 2020 − srovnávací retrospektivní studie
- Regenerační schopnosti nanovláknového obvazu na bázi polylaktidu
- Laparoskopická versus otevřená hernioplastika uskřinuté tříselné kýly
- Trombolýza jako léčba transplantační trombózy renálních tepen – tři neúpěšné kazuistiky a přehled literatury
- Synchrónna nádorová duplicita neuroendokrinného tumoru Meckelovho divertikla s metastázami do pečene a kolorektálneho karcinómu
- Torze omenta jako možná příčina náhlé příhody břišní
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prehabilitace, cesta ke zlepšení pooperačních výsledků
- Laparoskopická versus otevřená hernioplastika uskřinuté tříselné kýly
- Torze omenta jako možná příčina náhlé příhody břišní
- Atestace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



