-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaFluorescenčná angiografia v kolorektálnej chirurgii, vplyv rozšírenej reality na operačnom sále na anastomotický leak po nízkej resekcii rekta
Fluorescent angiography in colorectal surgery, the influence of augmented reality in the operating room on the anastomotic leakage after low rectal resection
Introduction: Near-infrared (NIR) fluorescence angiography (FA) is an augmented reality (AR) technique. When used in the operating room, it allows colorectal surgeons to visualize and evaluate intestinal blood flow in real time, identify lymph nodes, ureters, or peritoneal metastases. Evaluation of perfusion with FA in augmented reality mode has an impact on reducing the ALR (anastomotic leakage rate) in rectal resections.
Methods: Data analysis of patients after minimally invasive surgery (MIS) for middle and lower rectal adenocarcinoma with total mesorectal excision (TME) using fluorescent angiography (FA) with indocyanine green (ICG) (100 patients, 2015−2019) were subsequently compared with a historical control group (100 patients) operated on for the same diagnosis before the introduction of the FA-ICG method (2012−2015) using minimally invasive approach (MIS). The patients were operated on consequently at one workplace.
Results: In fifteen patients (15%), the resection line was shifted due to insufficient perfusion detected by FA-ICG. The incidence of AL was lower in the group with FA compared to the group without FA (9% vs. 19%, p=0.042, χ test). A retrospective analysis of the group revealed a significant risk factor (RF) for the anastomotic leak, namely diabetes (p=0.036) and, among others, a protective factor, application of the transanal drain (NoCoil) (p=0.032).
Conclusion: The introduction of new procedures and the use of new technologies, such as the use of the FA method in the AR mode in resections of the rectum with TME for cancer can lead to a reduction in the incidence of anastomotic leakage.
Keywords:
anastomotic leakage − rectal resections − fluorescence angiography − augmented reality
Autoři: V. Benčurik 1,5; M. Skrovina 1,2,5; L. Martínek 1,3
; J. Bartoš 1; M. Macháčková 1; M. Dosoudil 1; E. Štěpánová 1; L. Přibylová 4; R. Briš 4; P. Anděl 1; H. Hlavíková 1
Působiště autorů: Chirurgické odděleni, Nemocnice Nový Jičín 1; Chirurgická klinika, Lékařská a zubná fakulta, Univerzita Palackého Olomouc 2; Chirurgická klinika, Lékařská fakulta, Ostravská univerzita 3; Katedra aplikované matematiky, Fakulta elektrotechniky a informatiky, VŠB – Technická Univerzita Ostrava 4; Výzkumný a vzdělávací institut AGEL, Prostějov 5
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 11, s. 543-551.
Kategorie: pôvodná práca
doi: https://doi.org/10.33699/PIS.2021.100.11.543–551Souhrn
Úvod: Fluorescenčná angiografia (FA) v spektre blízkom infračervenému svetlu (NIR) je technikou rozšírenej reality AR (augmented reality) a pri jej využití na operačnom sále umožňuje mimo iné i kolorektálnym chirurgom v reálnom čase vizualizovať a hodnotiť vaskularizáciu čriev, identifikovať lymfatické uzliny, močovody, či metastázy. Hodnotenie prekrvenia pomocou FA v režime rozšírenej reality má určitý dopad na zníženie ALR (anastomotic leakage rate) pri resekciách rekta.
Metódy: Analýza dát pacientov s miniinvazívnou resekciou rekta (MIS – minimally invasive surgery) pre adenokarcinom stredného a dolného rekta s totálnou excíziou mesorekta (TME) s využitím fluorescenčnej angiografie (FA) s indocyanínovou zeleňou (ICG) (100 pacientov r. 2015−2019) bola následne porovnaná s historickou kontrolnou skupinou pacientov (100 pacientov) operovaných pre rovnakú diagnózu, a to miniinvazívne (MIS) pred zavedením metódy FA-ICG (2012−2015). Pacienti boli operovaný postupne na jednom pracovisku.
Výsledky: U pätnástich pacientov (15%) bola resekčná línia posunutá z dôvodu nedostatočnej perfúzie zistenej pomocou FA-ICG. Výskyt AL bol nižší v skupine s FA oproti skupine bez FA (9 % oproti 19 %, p = 0,042, χ test). Retrospektívnou analýzou súboru bola zístěná ako významný rizikový faktor (RF) pre anastomotický leak cukrovka (p=0,036) a protektívny faktor, aplikácia transanálneho drénu (NoCoil) (p=0,032).
Záver: Zavádzanie nových postupov a využívanie nových technológií, ako je využitie metódy FA v režime AR pri resekciách rekta s TME pre karcinóm môže viesť k zníženiu výskytu anastomotického leaku.
Klíčová slova:
anastomotický leak − rektálne resekcie − fluorescenčná angiografia − rozšírená realita
ÚVOD
Rozšírená realita (AR) je na operačných sálach čoraz viac využívaná ako vizuálna pomoc chirurgom pri operáciách. Je vytvorená prekrytím digitálnych informácií v jednom obraze v reálnom čase. Fluorescencia je vlastnosť absorbovať svetlo krátkej vlnovej dĺžky a emitovať svetlo dlhšej vlnovej dĺžky. Pri zobrazovaní pomocou fluorescenčnej angiografie (FA) sa intravenózne alebo priamo do tkaniva injektuje fluorescenčné farbivo, fluorochróm, emitujúci v spektre blízkom infračervenej oblasti (NIR). Systém akvizície AR používa súčasne dve kamery: kameru na biele svetlo získavajúcu obrázky z reálneho sveta a druhú infračervenú kameru na snímanie fluorescenčných obrazov emitovaných farbivom. Obrázok AR sa potom skonštruuje superpozíciou obrazu z reálneho sveta a obraz NIR prefarbí.
Indocyanínová zeleň (ICG) je najbežnejšie používaným fluoroforom v zobrazovaní NIR-FA schváleným pre klinické a výskumné použitie u ľudí od roku 1956. Jeho fluorescenčné schopnosti sa od roku 2000 čoraz viac využívajú v rôznych špecializáciách, ako je neurochirurgia, plastická chirurgia, gynekológia alebo všeobecná chirurgia. ICG je jódové farbivo [1], ktoré sa môže injektovať intravenózne. Táto zlúčenina sa z 98 % viaže na plazmatické bielkoviny a jej hepatálny klírens je 18 %−24 %/min. do žlče. To vedie k polčasu zobrazenia prekrvenia trvajúcom zvyčajne 3 až 4 minúty v závislosti od vaskularizácie sledovaného orgánu. Jeho rýchla miera klírensu umožňuje použitie farbiva opakovane počas jedného výkonu. ICG sa excituje medzi 750 a 800 nm vlnovej dĺžky svetla a fluorescencia sa pozoruje okolo 830 nm [2]. Tento fluorochróm je u pacientov dobre tolerovaný. Ojedinele sú však opísané prípady hypotenzie, tachykardie, dyspnoe, urtiky či anafylaktického šoku [3]. Pri onkochirurgických operáciách hrubého čreva a konečníka sa FA s ICG využíva na zobrazenie prekrvenia čreva, na identifikovanie lymfatickej drenáže tumorov kolorektra [4] a na zisťovanie prítomnosti peritoneálnych metastáz [5]. Dá sa však tiež využiť na zobrazenie anatomických štruktúr, ako sú močovody alebo ich lézie [6].
Dobre zhojená anastomóza je v kolorektálnej chirurgii zásadná. Zlyhanie zvyšuje chorobnosť a úmrtnosť, negatívne ovplyvňuje kvalitu života a zhoršuje prognózu pacientov [7]. Implementácia moderných chirurgických techník, úsilie o identifikáciu rizikových faktorov a zlepšenie perioperačnej starostlivosti pomáhajú znižovať výskyt tejto závažnej komplikácie. Výskyt anastomotického leaku (AL) sa uvádza v širokom rozmedzí od 0,5 do 30 % [7]. Frekvencia AL sa zvyšuje v aborálnom smere a najvyššie hodnoty sú pre anastomózy v distálnom rekte [4].
Dostatočné prekrvenie anastomozovaných črevných segmentov je predpokladom správneho zhojenia anastomózy. Subjektívne hodnotenie perfúzie nie je presné a môže viesť k určitej miere chybovosti [8]. Naopak, peroperačná vizualizácia prekrvenia sa zdá byť kľúčová. Na hodnotenie perfúzie sa používa niekoľko techník. Niektoré sú experimentálne a ich použitie v rutinnej chirurgickej praxi je náročné; môžu však predstavovať objektívnejší výsledok perfúzie, napríklad laserová dopplerovská prietokometria alebo spektrofotometrické techniky [9,10].
V súčasnej kolorektálnej chirurgii sa fluorescenčná angiografia v blízkom infračervenom spektre s indocyanínovou zeleňou javí ako veľmi sľubná, pretože umožňuje ľahko posúdiť vitalitu tkaniva v reálnom čase [11,12]. Štúdie na túto tému prezentované v literatúre sú väčšinou heterogénnym súborom otvorených, robotických a laparoskopických operácií s odlišnými metodikami. Porovnávacie prípadové kontrolné štúdie sú zastúpené zriedka a väčšina štúdií je prospektívna. Väčšie randomizované štúdie chýbajú. Naša unicentrická štúdia predstavuje výsledky analýzy pomerne homogénneho súboru pacientov (s karcinómom stredného a dolného rekta) a operácií (elektívne nízke resekcie rekta pre karcinóm s TME vykonané roboticky alebo laparoskopicky bez konverzie).
Cieľom našej štúdie bolo posúdiť účinnosť intraoperačnej fluorescenčnej angiografie ako novej techniky zavedenej do našej praxe v auguste 2015 vo vzťahu k anastomotickému leaku po miniinvazívnej nízkej prednej resekcii rekta s totálnou mezorektálnou excíziou (TME) a dvojstaplerovou anastomózou. Sekundárnym cieľom bolo identifikovať ďalšie potenciálne RF, ktoré ovplyvnili AL v našej skupine.
METÓDY
U pacientov zaradených do štúdie, ktorí boli operovaní medzi augustom 2015 a januárom 2019 pre adenokarcinom rekta, s neoadjuvantnou liečbou alebo bez nej, a ktorí boli indikovaní k nízkej prednej resekcii rekta s TME a primárnou dvojstaplerovou anastomózou pomocou miniinvazívnych techník (laparoskopicky, roboticky) sme využili FA s ICG na objektívne hodnotenie perfúzie oblasti proximálnej resekčnej línie. Tieto výsledky boli porovnané s historickou kontrolnou skupinou pacientov, ktorí boli operovaní pred zavedením techniky FA od novembra 2012 do augusta 2015 (rovnako 100 pacientov). Pacienti v oboch skupinách boli operovaní postupne, bez náhodného výberu, v jednom onkochirurgickom centre, rovnakým tímom kolorektálnych chirurgov s dlhoročnými skúsenosťami v laparoskopickej a robotickej kolorektálnej chirurgii. U všetkých pacientov v obidvoch skupinác bol použitý rovnaký operačný postup. Otvorené alebo konvertované výkony, pacienti so synchrónnym a recidivujúcim karcinómom hrubého čreva a pacienti s alergiou na jódové kontrastné látky boli zo štúdie vylúčení. Štúdiu schválila inštitucionálna komisia schvaľujúca interné granty. Všetky klinické a demografické údaje boli zhromaždené prospektívne a následne analyzované a to vek, ASA skóre (Americká spoločnosť anestéziológov) index telesnej hmotnosti (BMI), pohlavie, komorbidity, chronická medikácia, nutričný stav, fajčenie, charakteristiky nádoru vrátane vzdialenosti tumoru od análneho okraja (AV), neoadjuvantná rádioterapia/chemoterapia, charakteristiky chirurgického výkonu (technika, doba operácie, intraoperačné komplikácie, strata krvi, vzdialenosť kolorektálnej anastomózy od AV), parametre intraoperačnej fluorescenčnej angiografie (čas potrebný na vizualizáciu od podania ICG, posunutie resekčnej čiary, celkový čas postupu FA), pooperačné údaje (90dňová úmrtnosť, dĺžka pobytu v nemocnici, pooperačné komplikácie podľa Clavien-Dindo klasifikácie, miera resekcie ileostómií). Primárnym cieľom bolo zhodnotenie metódy FA–ICG na operačnom sále v režime AR pri nízkych resekciách rekta pre adenokarcinóm s TME, sekundárnym cieľom bolo zhodnotenie ďalších rizikových faktorov pre anastomotický leak po LAR s TME.
Všetci pacienti v štúdii mali mobilizovanú slezinnú flexúru, a to čiastočne alebo kompletne, tak, aby sa dosiahla dostatočná dĺžka kolon k beznapäťovej anastomóze a mali perušenú dolnú mesenterickú artériu pri odstupe od aorty, alebo za odstupom ľavej kolickej artérie. Po dokončení TME bolo rektum resekované nad panvovým dnom; hrubé črevo bolo vytiahnuté cez mini-laparotómiu; mezokolon bol disekovaný k stene kolon k miestu, kde sme chceli resekovať (proximálny koniec); potom bola podaná intravenózna dávka ICG 0,2 mg/kg (ICG-Pulsion® 5 mg/ml Pulsion Medical Systems, Münich, Nemecko). Na vizualizáciu boli použité systémy SPIES (KARL STORZ GmbH & Co. KG, Tuttlingen, Nemecko) alebo robotický chirurgický systém FireflyTM da Vinci Xi® (Intuitive Surgical, Sunnyvale, CA, USA).
Perfúziu na predpokladanej proximálnej resekčnej línii s využitím AR na operačnom sále hodnotil operujúci chirurg. Vyhodnotenie bolo uskutočnené 60 sekúnd po podaní ICG, aby sa eliminovali rozdiely v rýchlosti absorpcie na základe použitého typu intravenózneho vstupu (periférny vs. centrálny katéter). Systolický krvný tlak bol u všetkých pacientov počas zákroku nad 100 mm Hg s cieľom štandardizovať priebeh zákroku. Ak bola perfúzia považovaná chirurgickým tímom za nedostatočnú, resekčná línia bola posunutá proximálne a opäť sa hodnotilo jej prekrvenie. Údaje týkajúce sa FA boli zaznamenané do dokumentácie. Všetci pacienti mali primárne založenú dvojstaplerovú end-to-end anastomózu a všetci pacienti z oboch skupín mali na záver založenú ileostómiu. Nevykonávali sme intraoperačný air leak test u žiadneho z pacientov. U niektorých pacientov bol na konci operácie transanálne zavedený ochranný silikónový drén (NoCoil), ktorý bol ponechaný po dobu 3–4 dní.
Pred resekciou ileostomie bola kolorektálna anastomóza vyšetrená okolo 28. dňa od operácie pomocou nízkej irigografie, a to u všetkých pacientov v oboch skupinách. Toto vyšetrenie odhalilo prípadne klinicky nemanifestné anastomotické leaky. CT brucha a malej panvy sa vykonalo iba v prípadoch, keď sa anastomotický leak prejavil klinicky. Následne bola v takom prípade vykonaná revízia s transanálnym endoskopickým vyšetrením. Anastomotický leak bol klasifikovaný podľa klasifikácie Medzinárodnej študijnej skupiny pre rektálne karcinómy. Leak klasifikovaný ako stupeň A bol anastomotický leak, ktorý nemal za následok žiadnu zmenu v liečbe pacientov, zatiaľ čo leak stupňa B vyžadoval aktívny terapeutický zásah, však bez bez opätovnej laparoskopie či laparotómie. Leak stupňa C vyžadoval relaparoskopiu či laparotómiu.
Štatistická analýza
Mann-Whitneyov test sa použil na porovnanie mediánu populácie kontinuálnych premenných s ohľadom na ich vplyv na anastomotický leak. Na vyhodnotenie účinku kategorických premenných na výskyt anastomotických leakov sa použil Pearsonov χ2test, v niektorých prípadoch s použitím Yatesovej korekcie. V prípade dichotomickej premennej boli tieto výsledky doplnené bodovými a intervalovými odhadmi koeficientu šancí (OR), relatívneho rizika (RR) a Cramerovho V. bodový odhad koeficientu šancí vyjadril pomer šancí na výskyt anastomotického leaku exponovanej skupiny pacientov a kontrolnej skupiny. Bodový odhad relatívneho rizika vyjadril pomer pravdepodobností výskytu anastomotického leaku exponovanej skupiny pacientov a kontrolnej skupiny. Analýza viacerých premenných bola uskutočnená s použitím testu pravdepodobnostného pomeru pri logistickej regresii. Chýbajúce údaje neboli nahradené. Hodnota p menšia ako 0,05, bola pri odmietnutí nulovej hypotézy interpretovaná ako štatisticky významný výsledok. Štatistická analýza sa uskutočňovala pomocou softvéru R [13].
VÝSLEDKY
Základné demografické a klinické údaje, vrátane charakteristík nádorov v porovnávaných súboroch, sú uvedené v Tab. 1.
Tab. 1. Demografické a klinické data
Tab. 1: Demographic and clinical patient data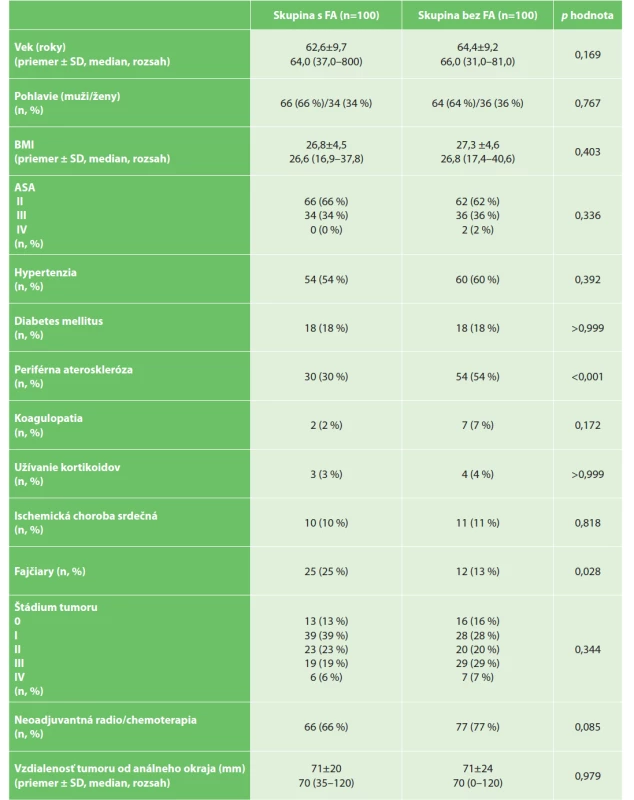
Vysvětlivky: p – hodnota porovnania pre kvalitatívne premenné vypočítaná Personovým chí-kvadrát testom, pre kvantitatívne premenné Mann-Whitneyovým testom; SD – štandardná odchýlka; BMI – body mass index; ASA – American Society of Anesthesiologists (ASA systém klasifikácie fyzického stavu)
Legend: p–value of comparison for qualitative variables is calculated by Person’s chi-squared test, for quantitative variables by Mann-Whitney test; SD – standard deviation; BMI – body mass index; ASA – American Society of Anesthesiologists (ASA physical status classification system)Kontrolná skupina bola porovnateľná vo väčšine parametrov (vek, ASA, BMI, pohlavie, výskyt koagulopatií, užívanie kortikoidov, prítomnosti diabetu u pacientov). Porovnávané skupiny sa tiež nelíšili v lokalizácii alebo štádiu karcinómu rekta a bol porovnateľný aj podiel pacientov, ktorí podstúpili neoadjuvantnú liečbu. Významné rozdiely boli vo výskyte periférnej aterosklerózy (častejšie prítomnej v skupine bez FA) a v počte fajčiarov (častejšie v skupine s FA). Podrobnosti chirurgického zákroku sú uvedené v Tab. 2.
Tab. 2. Operačné data
Tab. 2: Operation data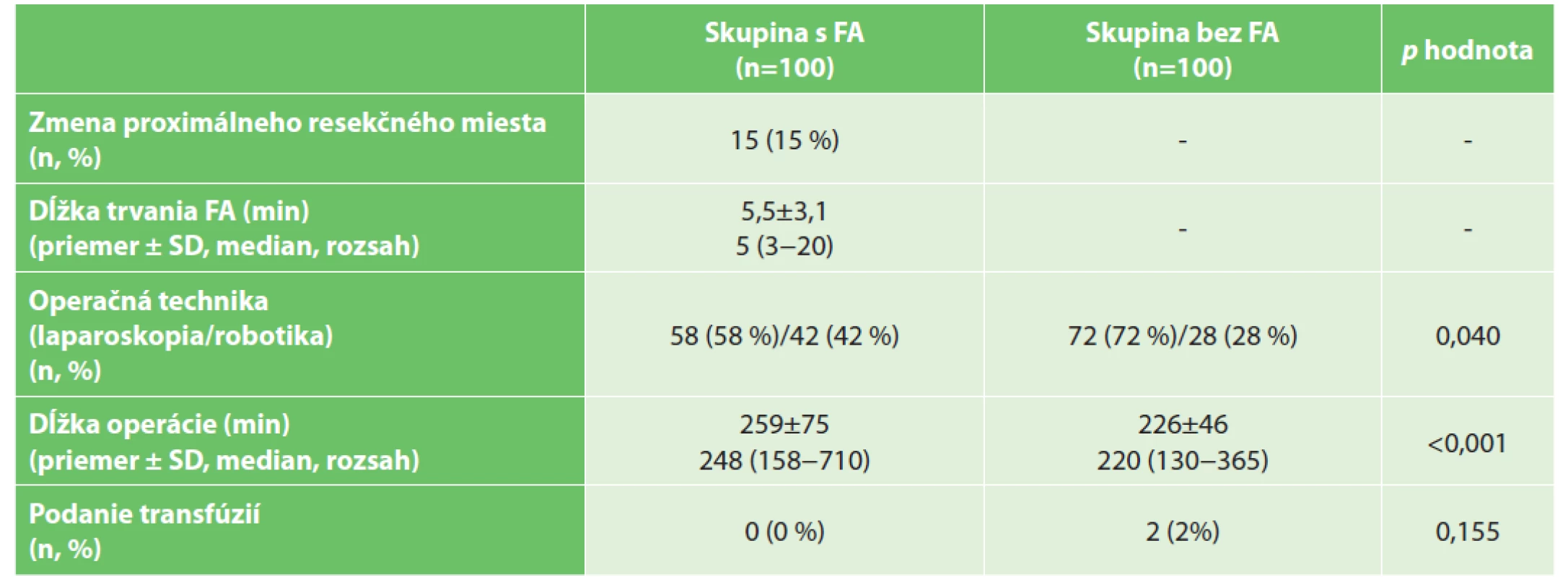
Vysvětlivky: p hodnota porovnania pre kvalitatívne premenné vypočítaná Personovým chí-kvadrát testom pre kvantitatívne premenné Mann-Whitneyovým testom; FA – fluorescenčná angiografia; SD – štandardná odchýlka
Legend: p value of comparison for qualitative variables is calculated by Person’s chi-squared test, for quantitative variables by Mann-Whitney test; FA – fluorescent angiography; SD – standard deviationSúbory sa líšili podielom zastúpených laparoskopických a robotických operácií v prospech robotických operácií v skupine s FA. Fluorescenčná angiografia predĺžila chirurgický zákrok o menej ako 6 minút. Metóda fluorescenčnej angiografie bola úspešne prevedená u všetkých pacientov v skupine s FA, a s intraoperačným podaním fluorescenčného farbiva neboli spojené žiadne negatívne vedľajšie účinky. U pätnástich pacientov (15 %) v skupine s využitím FA sme boli nútení posunúť resekčný okraj o 5–60 mm proximálne, kvôli neprítomnej perfúzii v predpokladanom mieste resekcie. Pooperačné údaje s komplikáciami sú uvedené v Tab. 3.
Tab. 3. Pooperačné data
Tab. 3: Postoperative data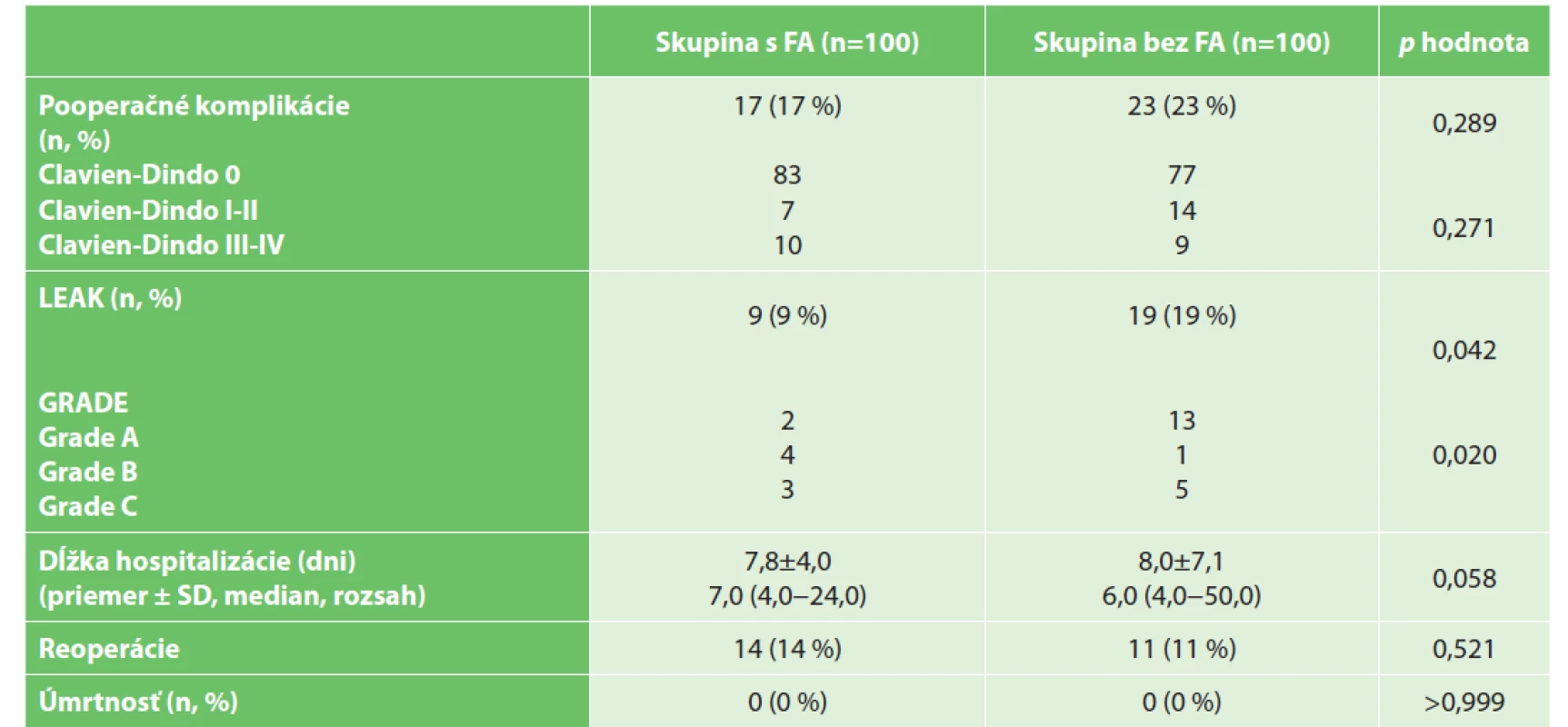
Vysvětlivky: p hodnota porovnania, pre kvalitatívne premenné vypočítaná Personovým chí-kvadrát testom, pre kvantitatívne premenné Mann-Whitneyovým testom; SD – štandardná odchýlka
Legend: p value of comparison for qualitative variables is calculated by Person’s chi-squared test, for quantitative variables by Mann-Whitney test; SD – standard deviationRozdiel v celkových pooperačných komplikáciách nebol medzi skupinami štatisticky významný, rozdiel bol štatisticky významný iba v skupine s menej závažnými komplikáciami (Clavien-Dindo I, II). Frekvencia anastomotických leakov sa v skupine s FA štatisticky významne znížila, a to na polovicu (19 % oproti 9 %). V skupine s FA sa znížil počet leakov typu A, zatiaľ, čo celkový počet klinicky manifestných leakov B a C sa medzi skupinami nelíšil. Protektívna ileostómia bola resekovaná následne u všetkých pacientov v oboch skupinách. Ani v jednej skupine nedošlo k úmrtiu. Porovnanie vplyvu kvalitatívnych premenných na výskyt leaku anastomózy je uvedené v Tab. 4.
Tab. 4. Výskyt anastomotického leaku v závislosti na kategoriálnych premenných Tab. 4: Occurrence of anastomotic leakage depending on categorical variables 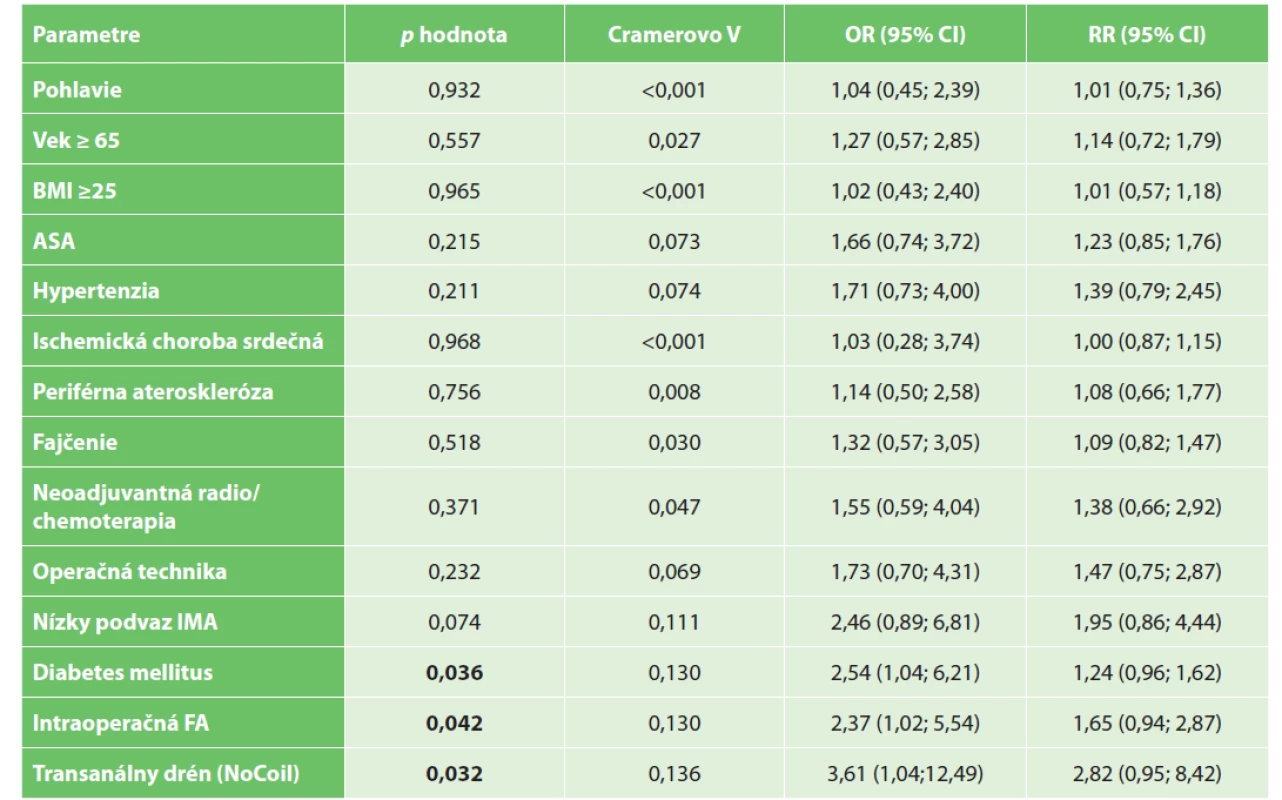
Vysvětlivky: p hodnota vypočítaná Personovým chí-kvadrát testom; BMI – body mass index; ASA – American Society of Anesthesiologists (ASA systém klasifikácie fyzického stavu); IMA – arteria mesenterica inferior (dolná mesenterická artéria); FA – fluorescenčná angiografia.
Legend: p value is calculated by Person’s chi-squared test; BMI – body mass index; ASA – American Society of Anesthesiologists (ASA physical status classification system); IMA – inferior mesenteric artery; FA – fluorescent angiography.Na základe výsledkov Pearsonovho χ2 testu možno vyvodiť záver, že incidencia leaku bola štatisticky významne závislá od FA s ICG (hodnota p=0,042, test χ2), rovnako bola závislá od využitia NoCoil (hodnota p=0,032, test χ2) a od výskytu diabetes mellitus (hodnota p=0,036, χ2 test). U pacientov s FA bola pravdepodobnosť leaku (riziko leaku) asi dvakrát nižšia (OR=2,37). Cramerovo V=0,130 vykazovalo miernu závislosť. U pacientov bez využitia transanálnej drenáže pomocou NoCoil bola pravdepodobnosť leaku (OR=3,61) asi tri a pol až štyrikrát vyššia. Cramerovo V=0,136 vykazovalo miernu závislosť. Pravdepodobnosť leaku bola u pacientov s diabetom asi dva a polkrát vyššia (OR=2,54). Cramerovo V=0,130 vykazovalo miernu závislosť. Nezistila sa štatisticky významná závislosť medzi výskytom leaku a premennými ako vek, BMI, pohlavie, ateroskleróza, hypertenzia, ischemická choroba srdca, ASA, neoadjuvantná liečba, štádium ochorenia, lokalizácia nádoru, fajčenie a chirurgická technika (pozri Tab. 4). Tab. 5 ukazuje porovnanie jednorozmernej a viacrozmernej analýzy vplyvu premenných na výskyt anastomotického leaku.
Tab. 5. Porovnanie výsledkov jednorozmernej a viacrozmernej analýzy vplyvu premenných na výskyt anastomotického leaku
Tab, 5: Comparison of one variable and multivariable analysis of the occurrence of anastomotic leakage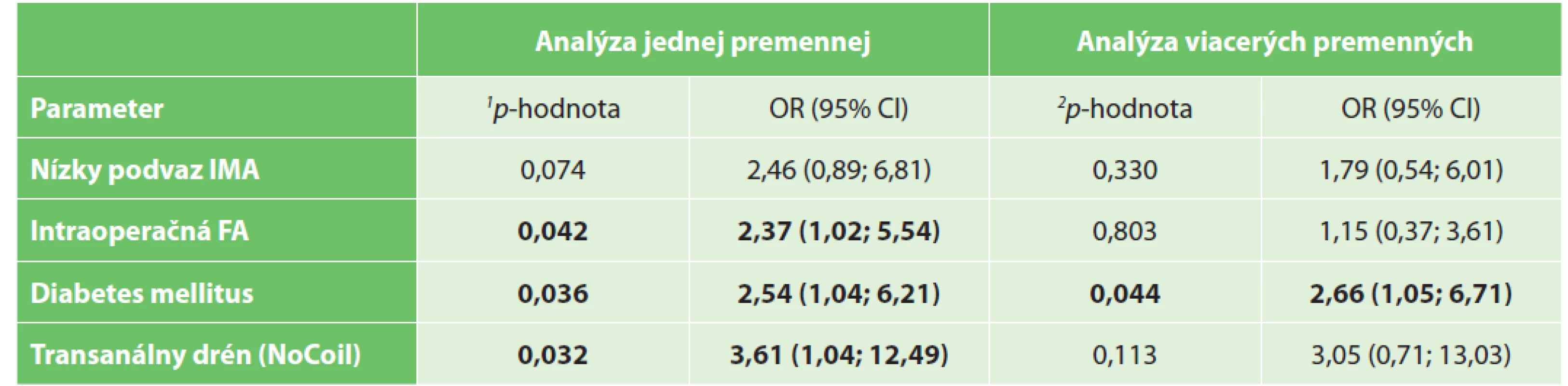
Vysvětlivky: Faktory boli vybrané na základe výsledkov jednorozmernej analýzy (pozri Tab. 4) pre p-hodnotu χ2 testu menej ako 0,1. 1p-hodnota vypočítaná Pearsonovým chí-kvadrát testom; 2p-hodnota vyjadrená výsledkom testu pomeru pravdepodobnosti s využitím logistickej regresie; IMA – dolná mesenterická artéria (inferior mesenteric artery); FA – fluorescenčná angiografia.
Legend: Factors were selected based on one-dimensional analysis results (see Tab. 4) for p-value of χ2 test less than 0,1. 1p-value of one variable analysis is calculated by Pearson’s chi-squared test; 2p-value of multivariable analysis expressed result of likelihood ratio test at logistic regression; IMA – inferior mesenteric artery; FA – fluorescent angiography.V našom súbore pacientov sa viacrozmernou analýzou zistilo, že rizikovým faktorom pre AL je prítomnosť ochorenia cukrovkou (hodnota p=0,044).
DISKUSIA
Prvú klinickú štúdiu uvádzajúcu túto metódu v kolorektálnej chirurgii uskutočnili Kudszuz et al. [14] v roku 2010. ICG podaná intravenózne zvýraznila mikrovaskulatúru a umožnila chirurgom presnejšie detegovať oblasti so slabým prekrvením. V skutočnosti je ischemická hranica čreva viditeľná pri normálnom svetle viac ako 10 minút po disekcii mesokola k stene črevnej, zatiaľ čo NIR-FA takmer okamžite odlišuje vaskularizované oblasti od oblastí neprekrvených tkanív. Fluorescencia býva viditeľná do 30 až 60 sekúnd po injekcii fluorochrómu [11]. Na základe zobrazeného prekrvenia sa operatér rozhodne pre potvrdenie či zmenu miesta resekcie kolon.
V meta-analýze 10 štúdií od roku 2010 do roku 2017 (894 pacientov) Van Den Bos et al. [15] uviedli zmenu v pôvodnom chirurgickom pláne u 10,8 % pacientov. Pri neuspokojivej perfúzii sa vo väčšine prípadov posunulo resekčné miesto do lepšie prekrvenej oblasti, alebo sa musela už urobená anastomóza resekovať a urobiť de novo [11]. Použitie ICG tiež pomohlo upresniť klinický dojem slabej perfúzie, a to tak, že nebolo potrebné miesto resekcie ďalej rozširovať. Napríklad Kudszus a kol. [14] opísali nerozširovanie resekcie u 2,5 % pacientov (5/201) napriek klinickému dojmu slabej perfúzie.
V súčasnej kolorektálnej chirurgii sa fluorescenčná angiografia v spektre blízkom infračervenému žiareniu s indocyanínovou zeleňou javí ako veľmi sľubná, pretože umožňuje ľahké hodnotenie vitality tkanív v reálnom čase [12]. Štúdie na túto tému prezentované v literatúre sú dodnes väčšinou heterogénnym súborom otvorených, robotických a laparoskopických postupov s odlišnými metodikami. Porovnávacie prípadové kontrolné štúdie sú zastúpené zriedka a väčšina štúdií predstavuje prospektívne štúdie. Prospektívne randomizované štúdie chýbajú. Štúdia porovnávajúca dve skupiny pacientov, využívajúcich presnejšie porovnanie skupín pacientov súčasne vo viacerých prametroch tzv. propensity score matching zahrňovala 211 pacientov, bola publikovaná v roku 2019 autormi Watanabe et al. [16] so štatisticky významným poklesom AL v skupine s FA. Naopak, randomizovaná kontrolná štúdia De Nardiho a kol. z roku 2020 skončila negatívnym výsledkom (bez štatisticky významného zníženia miery anastomotického leaku v ramene s využitím ICG-FA) [17].
Naša unicentrická štúdia predstavuje výsledky analýzy pomerne homogénneho súboru pacientov (s karcinómom stredného a dolného rekta) a operácií (elektívna nízka predná resekcia s TME vykonávaná roboticky alebo laparoskopicky bez konverzie). Doteraz boli podobné štúdie s porovnateľným počtom pacientov publikované iba v obmedzenom počte [12,14,15,16]. Vizualizácia tkanivovej perfúzie pomocou ICG bola vo všetkých prípadoch úspešná v súlade so skúsenosťami publikovanými v literatúre [12,14,15,16]. Vykonanie FA predĺžilo operačný čas len mierne a štatisticky nevýznamne. Použitie ICG bolo absolútne bezpečné, vrátane opakovania dávok, v súlade s inými štúdiami [12,14,15,16]. Dlhšie operačné časy v skupine s FA v našej štúdii súviseli s vyšším podielom robotických výkonov, ktoré sú spojené s dlhšími operačnými časmi. Preferencia robotických výkonov je daná smerovaním pracoviska autorov.
U 15 pacientov (15 %) bolo nutné upraviť resekčnú líniu na podklade FA. V dostupnej literatúre sa uvádza, že korekcia resekčnej línie sa pohybuje v rozmedzí od 3,7 do 40 % prípadov [12,14,15,16,18]. Boni a kol. uvádza zmenu resekčnej línie v 4,7 % prípadov [11]. V už skôr spomenutej štúdii autorov Watanabe et al. uvádzajú autori zmenu v resekčnej línii u 5,7 % prípadov [16]. V systematickom prehľade na súbore 555 pacientov, ktorí podstúpili kolorektálny chirurgický zákrok s použitím FA s ICG, autori Blanco-Colino a kol. uviedli zmenu v resekčnej línii u 7,4 % prípadov [18].
V našom súbore pacientov, u ktorých bola resekčná línia posunutá kvôli zlému prekrveniu na základe FA v 15 % (15 pacientov), sa AL následne vyskytol u 2 z nich. V práci Boni a kol. nie je zmienka o AL u pacientov, u ktorých bola vykonaná podobná korekcia [11]. Hlavným cieľom našej štúdie bolo posúdiť účinnosť metódy FA na zníženie výskytu AL po mini-invazívnej resekcii rekta s TME pre adenokarcinóm. Dosiahli sme štatisticky významné zníženie výskytu AL (19 % oproti 9 %, p=0,042). Watanabe a kol. zistil pokles incidencie z 10,4 % na 4,7 % pri použití FA [16]. V niektorých podobných štúdiách nedošlo k žiadnemu anastomotickému leaku v ramene fluorescenčnej angiografie [11]. Rovnaký výsledok, tj. bez prítomnosti leaku, sa dosiahol u menších a heterogénnejších skupín pacientov, ktoré publikovali Ris a kol. [19] alebo Martinek a kol. [20]. Systematická meta-analýza Blanco-Colino et al. potvrdzuje pozitívny potenciál FA pri znižovaní ALR pri resekciách pre kolorektálny karcinóm [18].
V súčasnosti nie je k dispozícii podrobná fyzikálno - matematická analýza obrazu v rozšírenej realite ICG - FA v reálnom čase na operačnom sále. Boli publikované niektoré štúdie so softvérovou analýzou obrazu na hodnotenie intenzity fluorescencie [21] alebo rýchlosti jej nástupu [22], ktoré však vyžadujú štandardizované podmienky, ktoré je ťažké dosiahnuť za normálnych podmienok na operačnom sále. Snahy o kvantifikáciu meraní vychádzajú aj zo štúdií in vitro [23].
Sekundárnym cieľom našej štúdie bolo zhodnotiť ďalšie rizikové faktory anastomotického leaku. Štatistická analýza nepreukázala zvýšené riziko vzniku leaku spojené s pohlavím, vekom, BMI, fajčením, aterosklerózou, hypertenziou, ischemickou chorobou srdca a klasifikáciou ASA. Rovnako nebola rizikom pre vznik leaku lokalizácia nádoru, štádium ochorenia, neoadjuvantná terapia, použitá chirurgická technika (laparoskopická alebo robotická), vysoký alebo nízky podväz IMA. Diabetes mellitus býva uvedený ako možný rizikový faktor AL vo viacerých štúdiách [7]. Závery našej analýzy ukázali v jednorozmernej analýze dva a pol krát vyššie riziko AL u pacientov s cukrovkou. Vo viacrozmernej analýze bola cukrovka naším jediným rizikovým faktorom pre AL. Transanálna drenáž s využitím NoCoil sa úspešne používa pomerne často, čo je zrejmé z meta-analýzy publikovanej Wangom a kol. Na súbore 909 pacientov predstavovalo využitie NoCoil zníženie AL o 8,5 % [24]. V našej štúdii sme potvrdili pozitívny vplyv využitia transanálnej drenáže na zníženie anastomotického leaku. Bol to však nový prvok postupne zavádzaný do našej praxe, ktorý nebol využitý u všetkých pacientov.
Po zavedení nových technických prvkov do praxe, sme nútení tieto prvky hodnotiť, ako potenciálne RF a rešpektovať ich v rámci vyhodnocovania výsledkov. Cieľom identifikácie potenciálnych RF, ktoré ovplyvňujú frekvenciu AL, je úsilie o zníženie rizika skreslenia z hľadiska vyhodnotenia iba jednej premennej. Takto sme v našej populácii pacientov zistili štatisticky významný vplyv FA s ICG, použitie NoCoil a prítomnosť DM na anastomotický leak. Predpokladáme, že tieto výsledky nám následne umožnia upraviť stratégiu u operácií stredného a dolného rekta pre karcinóm, napríklad zavádzať štandardne na konci operácie transanálny NoCoil drén, alebo naopak nezakladať protektívnu ileostómiu u všetkých pacientov. Mohli by sme sa tak vyhnúť potencionálnym často diskutovaným komplikáciám, ktoré založenie protektívnej ileostómie prináša [25]. Ďalšími RF vplývajúcimi na anastomotický leak pri nízkych resekciách rekta v literatúre sú pohlavie, štádium a lokalizácia nádoru, neoadjuvantná terapia atď., ktoré sme, prekvapivo pre nás, v našej zostave nepotvrdili. Najpravdepodobnejšou príčinou je nedostatočná veľkosť súboru (chyba typu 2) na preukázanie štatistickej významnosti.
Vyhodnocovanie vplyvu najme de novo zavádzaných prvkov do praxe, môže prispieť k znižovaniu rizika komplikácií a zlepšovaniu kvality života po operáciách upravením stratégie operačných postupov. Malo by dopad na ALR využitie metódy FA s ICG na hodnotenie prekrvenia už zkonštruovanej kolorektálnej resp. koloanálnej anastomózy, a to extraluminálne a endoskopicky? Aký má vplyv na ALR zavedenie nových 3-staple cirkulárnych staplerov? Riešenie týchto problémov by malo zahŕňať štúdie s vysokokvalitnou metodikou (nie nevyhnutne randomizované štúdie) s dostatočným počtom pacientov.
ZÁVER
Rozšírená realita stále častejšie pomáha chirurgom pri riešení problémov na operačnom sále čím zvyšuje kvalitu ich práce. Fluorescenčná angiografia v NIR spektre s indocyanínovou zeleňou je ľahko vykonateľné a bezpečné vyšetrenie, ktoré umožňuje mimo iné i v kolorektálnej chirurgii bezpečné intraoperačné zobrazenie prekrvenia či zobrazenie anatomických štruktúr. Zobrazenie prekrvenia v resekčnej línii pri nízkej resekcii rekta, môže prispieť k zníženiu pooperačných komplikácií v zmysle zníženia ALR.
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov, a že tento článok nebol publikovaný v žiadnom inom časopise, s výnimkou kongresových abstrakt a klinických odporúčaných postupov.
MUDr. Vladimír Benčurik
Chirurgické oddělení,
Nemocnice Nový Jičín, a.s., člen skupiny Agel
Purkyňova 2138/16
741 01 Nový Jičín,
e-mail: bencurik.vladimir@gmail.com
ORCID: 0000-0003-1492-9032
Zdroje
1. Reinhart MB, Huntington CR, Blair LJ, et al. Indocyanine green: Historical context, current applications, and future considerations. Surg Innov. 2016 Apr;23(2):166−175. doi: 10.1177/1553350615604053. Epub 2015 Sep 10. PMID: 26359355.
2. Benson RC, Kues HA. Fluorescence properties of indocyanine green as related to angiography. Phys Med Biol. 1978 Jan;23(1):159−163. doi: 10.1088/0031 - 9155/23/1/017. PMID: 635011.
3. Jafari MD, Lee KH, Halabi WJ, et al. The use of indocyanine green fluorescence to assess anastomotic perfusion during robotic assisted laparoscopic rectal surgery. Surg Endosc. 2013 Aug;27(8):3003−3008. doi: 10.1007/s00464-013-2832-8. Epub 2013 Feb 13. PMID: 23404152.
4. Emile SH, Elfeki H, Shalaby M, et al. Sensitivity and specificity of indocyanine green near-infrared fluorescence imaging in detection of metastatic lymph nodes in colorectal cancer: Systematic review and meta-analysis. J Surg Oncol. 2017 Nov;116(6):730−740. doi: 10.1002/ jso.24701. Epub 2017 Jun 1. PMID: 28570748.
5. Liberale G, Bourgeois P, Larsimont D, et al. Indocyanine green fluorescence-guided surgery after IV injection in metastatic colorectal cancer: A systematic review. Eur J Surg Oncol. 2017 Sep;43(9):1656−1667. doi: 10.1016/j.ejso.2017.04.015. Epub 2017 May 8. PMID: 28579357.
6. Foppa C, Spinelli A. Ureteric identification with indocyanine green fluorescence in laparoscopic redo pouch surgery. Tech Coloproctol. 2018 Aug;22(8):627−628. doi: 10.1007/s10151-018-1838-6. Epub 2018 Aug 28. PMID: 30167911.
7. McDermott FD, Heeney A, Kelly ME, et al. Systematic review of preoperative, intraoperative and postoperative risk factors for colorectal anastomotic leaks. Br J Surg. 2015 Apr;102(5):462−479. doi: 10.1002/bjs.9697. Epub 2015 Feb 19. PMID: 25703524.
8. Kudszus S, Roesel C, Schachtrupp A, et al. Intraoperative laser fluorescence angiography in colorectal surgery: a noninvasive analysis to reduce the rate of anastomotic leakage. Langenbecks Arch Surg. 2010 Nov;395(8):1025−1030. doi: 10.1007/s00423-010-0699-x. Epub 2010 Aug 12. PMID: 20700603.
9. Vignali A, Gianotti L, Braga M, et al. Altered microperfusion at the rectal stump is predictive for rectal anastomotic leak. Dis Colon Rectum 2000 Jan;43(1):76−82. doi: 10.1007/BF02237248. PMID: 10813128.
10. Darwich I, Rustanto D, Friedberg R, er al. Spectrophotometric assessment of bowel perfusion during low anterior resection: a prospective study. Updates Surg. 2019 Dec;71(4):677−686. doi: 10.1007/ s13304-019-00682-9. Epub 2019 Oct 12. PMID: 31606856; PMCID: PMC6892764.
11. Boni L, Fingerhut A, Marzorati A, e al. Indocyanine green fluorescence angiography during laparoscopic low anterior resection: results of a case-matched study. Surg Endosc. 2017 Apr;31(4):1836−1840. doi: 10.1007/s00464-016-5181-6. Epub 2016 Aug 23. PMID: 27553790.
12. Skrovina M, Bencurik V, Martinek L, et al. The significance of intraoperative fluorescence angiography in miniinvasive low rectal resections. Wideochir Inne Tech Maloinwazyjne 2020 Mar;15(1):43−48. doi: 10.5114/wiitm.2019.84851. Epub 2019 May 8. PMID: 32117485; PMCID: PMC7020717.
13. R Core Team: A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria 2019. URL https://www.R-project. org/
14. Kudszus S, Roesel C, Schachtrupp A, et al. Intraoperative laser fluorescence angiography in colorectal surgery: a noninvasive analysis to reduce the rate of anastomotic leakage. Langenbecks Arch Surg. 2010 Nov;395(8):1025−1030. doi: 10.1007/s00423-010-0699-x. Epub 2010 Aug 12. PMID: 20700603.
15. van den Bos J, Al-Taher M, Schols RM, et al. Near-infrared fluorescence imaging for real-time intraoperative guidance in anastomotic colorectal surgery: A systematic review of literature. J Laparoendosc Adv Surg Tech A. 2018 Feb;28(2):157−167. doi: 10.1089/ lap.2017.0231. Epub 2017 Nov 6. PMID: 29106320.
16. Watanabe J, Ishibe A, Suwa Y, et al. Indocyanine green fluorescence imaging to reduce the risk of anastomotic leakage in laparoscopic low anterior resection for rectal cancer: a propensity scorematched cohort study. Surg Endosc. 2020 Jan;34(1):202−208. doi: 10.1007/s00464 - 019-06751-9. Epub 2019 Mar 14. PMID: 30877565.
17. De Nardi P, Elmore U, Maggi G, et al. Intraoperative angiography with indocyanine green to assess anastomosis perfusion in patients undergoing laparoscopic colorectal resection: results of a multicenter randomized controlled trial. Surg Endosc. 2020 Jan;34(1):53−60. doi: 10.1007/ s00464-019-06730-0. Epub 2019 Mar 21. PMID: 30903276.
18. Blanco-Colino R, Espin-Basany E. Intraoperative use of ICG fluorescence imaging to reduce the risk of anastomotic leakage in colorectal surgery: a systematic review and meta-analysis. Tech Coloproctol. 2018 Jan;22(1):15−23. doi: 10.1007/s10151-017-1731-8. Epub 2017 Dec 11. PMID: 29230591.
19. Ris F, Liot E, Buchs NC, et al. Near-infrared anastomotic perfusion assessment network VOIR. Multicentre phase II trial of near-infrared imaging in elective colorectal surgery. Br J Surg. 2018 Sep;105(10):1359−1367. doi: 10.1002/ bjs.10844. Epub 2018 Apr 16. PMID: 29663330; PMCID: PMC6099466.
20. Martínek L, Pazdírek F, Hoch J, et l. Technické aspekty fluorescenční angiografie pro peroperační hodnocení perfuze anastomózy v kolorektální chirurgii. Rozhl Chir. 2018;97(4):167−171. PMID: 29726262.
21. Chang YK, Foo CC, Yip J, et al. The impact of indocyanine-green fluorescence angiogram on colorectal resection. Surgeon 2019 Oct;17(5):270−276. doi: 10.1016/j. surge.2018.08.006. Epub 2018 Sep 5. PMID: 30195865.
22. Son GM, Kwon MS, Kim Y, et al. Quantitative analysis of colon perfusion pattern using indocyanine green (ICG) angiography in laparoscopic colorectal surgery. Surg Endosc. 2019 May;33(5):1640−1649. doi: 10.1007/s00464-018-6439-y. Epub 2018 Sep 10. PMID: 30203201; PMCID: PMC6484815.
23. Diana M, Halvax P, Dallemagne B, et al. Real-time navigation by fluorescence - based enhanced reality for precise estimation of future anastomotic site in digestive surgery. Surg Endosc. 2014 Nov;28(11):3108−3118. doi: 10.1007/ s00464-014-3592-9. Epub 2014 Jun 10. PMID: 24912446.
24. Wang S, Zhang Z, Liu M, et al. Efficacy of transanal tube placement after anterior resection for rectal cancer: a systematic review and meta-analysis. World J Surg Oncol. 2016 Mar 31;14 : 92. doi: 10.1186/ s12957-016-0854-0. PMID: 27030245; PMCID: PMC4815125.
25. Hanna MH, Vinci A, Pigazzi A. Diverting ileostomy in colorectal surgery: when is it necessary? Langenbecks Arch Surg. 2015 Feb;400(2):145−152. doi: 10.1007/ s00423-015-1275-1. Epub 2015 Jan 30. PMID: 25633276.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2021 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Současné trendy v chirurgické léčbě karcinomu rekta
- „Watch and wait“ strategie v léčbě pacientů s karcinomem rekta
- TaTME (transanal total mesorectal excision) – state of the art
- Resekce rekta s totální excizí mezorekta – laparoskopický versus robotický přístup
- K článku Resekce rekta s totální excisí mezorekta – laparoskopický versus robotický přístup autorů Škrovina M se spoluautory.
- Kvalita života pacientů po transanální totální mezorektální excizi – naše zkušenosti
- Fluorescenčná angiografia v kolorektálnej chirurgii, vplyv rozšírenej reality na operačnom sále na anastomotický leak po nízkej resekcii rekta
- Rizikové faktory syndrómu prednej nízkej resekcie po restoratívnej miniinvazívnej resekcii rekta
- Volvulus středního střeva u kongenitální poruchy rotace v dospělém věku – kazuistika
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Resekce rekta s totální excizí mezorekta – laparoskopický versus robotický přístup
- Volvulus středního střeva u kongenitální poruchy rotace v dospělém věku – kazuistika
- TaTME (transanal total mesorectal excision) – state of the art
- Kvalita života pacientů po transanální totální mezorektální excizi – naše zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



