-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Problematika nozokomiálních pneumonií
Nosocomial pneumonias
The paper provides clear definitions of the basic concepts of nosocomial pneumonias. Specifically, definitions and classifications of HAP and VAP, general treatment principles and specific recommended procedures for antibiotic therapy are given as applicable in the Czech Republic.
Keywords:
antibiotics – therapy – HAP – VAP
Autoři: M. Kolář 1
; L. Doubravská 2
Působiště autorů: Ústav mikrobiologie Lékařské fakulty Univerzity Palackého v Olomouci 1; Klinika anesteziologie, resuscitace a intenzivní medicíny Fakultní nemocnice Olomouc 2
Vyšlo v časopise: Rozhl. Chir., 2020, roč. 99, č. 7, s. 293-298.
Kategorie: Souhrnné sdělení
doi: https://doi.org/10.33699/PIS.2020.99.7.293–298Souhrn
V předloženém sdělení jsou přehledně definovány základní pojmy týkající se nozokomiálních pneumonií. Konkrétně jsou uvedeny definice i klasifikace HAP a VAP, obecné zásady jejich léčby a konkrétní doporučené postupy pro antibioterapii v podmínkách České republiky.
Klíčová slova:
HAP – VAP – antibiotiká – léčba
Úvod
Nozokomiální pneumonie (HAP – Hospital Acquired Pneumonia) je druhou nejčastější nozokomiální infekcí a u pacientů na jednotkách intenzivní péče dokonce nejčastější. Z hlediska morbidity, mortality a ekonomických nákladů představují HAP nejdůležitější skupinu nozokomiálních infekcí [1−4]. Schulgen uvádí, že téměř polovina úmrtí spojených s nozokomiálními infekcemi souvisí právě s HAP [5].
HAP je v současné době jednou z nejvýznamnějších komplikací zdravotního stavu hospitalizovaných pacientů, především na jednotkách intenzivní péče, a při její léčbě se často potýkáme s problematikou bakteriální rezistence. Zastoupení jednotlivých bakteriálních patogenů a jejich odolnost k antibakteriálním přípravkům má významný dopad na možnosti antibiotické terapie a její úspěch [6−11]. Bylo vyčísleno, že tento typ infekce prodlouží hospitalizaci v průměru o 7 dní a zvýší finanční náklady o více než 40 tisíc USD na pacienta [12,13]. Opožděné zahájení správné antibiotické léčby, včetně adekvátního dávkování, riziko mortality zvyšuje [14].
Pokud jsou dýchací cesty pacienta zajištěny invazivně (orotracheální intubací nebo tracheostomií), patří tato pneumonie do skupiny ventilátorových pneumonií (VAP – Ventilator Associated Pneumonia) [14]. Je vhodné zdůraznit, že invazivní zajištění dýchacích cest s mechanickou ventilací zvyšují riziko vzniku nozokomiální pneumonie [15,16]. Chastre et al. ve své studii uvádějí, že intubace a mechanická ventilace zvyšují riziko HAP 3−21× [16]. Jednou z příčin vzniku HAP/VAP je translokace bakteriálních patogenů z horních cest dýchacích či gastrointestinálního traktu do plic [17].
HAP/VAP jsou závažným zdravotnickým problémem, především v intenzivní péči, s mortalitou 20–60 %, obzvláště pokud dojde k progresi a rozvoji sepse a septického šoku [6,14,18]. Důslednou prevencí a správnou antibioterapií lze snížit jejich incidenci, zvýšit úspěšnost léčby a omezit nárůst bakteriální rezistence, nelze však nozokomiální pneumonie zcela vymýtit [14]. Je vhodné zdůraznit význam adekvátní antibiotické léčby, nepodcenění stavu pacienta a zároveň nepoužívání širokospektrých antibiotik tam, kde jejich použití není nutné. Dále je důležitá snaha o časnou deeskalaci léčby a zkrácení doby podávání antibiotik [14,19].
Definice HAP/VAP
Pneumonie je definována přítomností nově vzniklého nebo progredujícího plicního infiltrátu a klinických i laboratorních známek plicní infekce, kterými jsou febrilie, purulentní sputum, leukocytóza a pokles v oxygenaci [14,19]. VAP je pneumonie postihující pacienty na umělé plicní ventilaci. Vzniká za déle než 48 hodin po endotracheální intubaci [14,19]. VAP je dle aktuálních amerických doporučení samostatnou kategorií, a tedy typem nozokomiální pneumonie postihující pacienty na umělé plicní ventilaci [19]. Evropská doporučení výše uvedené rozdělení plicních afekcí na HAP a VAP neakceptovala a nadále chápou VAP jako podtyp HAP [20]. Pacienti trpící těžkou nozokomiální pneumonií, kteří v průběhu její léčby dospějí do stadia respirační insuficience vyžadující napojení na umělou plicní ventilaci, nenaplňují kritéria pro VAP [20].
Doporučené postupy pro HAP/VAP
V roce 2016 byla publikována aktualizace přístupu k nemocničním a ventilátorovým pneumoniím u dospělých „Management of adult with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society“ [19]. V roce 2017 byl zveřejněn nový doporučený postup evropských odborných společností za spolupráce Latinskoamerické hrudní společnosti „International ERS/ESICM/ESCMID/ALAT guidelines for management of hospital-acquired pneumonia and ventilator-associated pneumonia“ [20]. Obě tato doporučení, americká z roku 2016 i evropská z roku 2017, jsou zpracována do podobného formátu s využitím metodologie „Grading of Recommendation, Assessment, Development and Evaluation (GRADE)“ a formulací klinických otázek ve formátu PICO (Population-Intervention-Comparison-Outcome).
Významnou změnou v uvedených postupech je vyřazení pneumonie spojené se zdravotní péčí (HealthCare-Associated Pneumonia, HCAP) jako samostatné podjednotky HAP. V tomto se evropský a americký pohled přiblížily, neboť tato podkategorie pneumonií nebyla v Evropě nikdy přijata. Evropští experti považovali důkazy podporující vyčlenění HCAP za protichůdné, respektive nesprávně interpretované, a v dalších studiích se HCAP z hlediska etiologie spíše podobaly komunitním pneumoniím [21,22]. Evropští experti poukazují i na další změny, především využití antibiogramu (výčtu antibiotik s uvedením citlivosti či rezistence bakteriálního původce k antibakteriálním přípravkům) k vedení antibiotické léčby, zavedení krátkodobé léčby u většiny pacientů s HAP i VAP bez ohledu na jejich mikrobiologickou etiologii a deeskalaci antibiotické léčby [20].
Klasifikace HAP/VAP
Důležitou otázkou je dělení HAP/VAP na typ časný a pozdní (Tab. 1). Předpokládá se, že doba nástupu nozokomiální pneumonie umožňuje odhadnout pravděpodobnou etiologii a lépe zacílit iniciální antibiotickou léčbu [20,23]. I když tento předpoklad nadále platí, je zřejmý nárůst výskytu multirezistentních (MDR) bakterií u časných HAP i VAP [19,24]. MDR bakterii lze chápat jako bakterii se získanou rezistencí (nelze zahrnovat přirozenou rezistenci) k minimálně jednomu antibiotiku ze tří a více antibiotických skupin [25]. Studie Trouilleta et al. definuje specifické rizikové faktory silně spojené s HAP vyvolanou MDR patogeny, a to trvání mechanické ventilace ≥ 7 dní a předchozí užívání antibiotik [26]. Některé novější práce však výše uvedenou klasifikaci zpochybňují, neboť byla identifikována srovnatelná etiologická agens, ať už se jednalo o typ s časným nebo pozdním nástupem [27,28]. Tato skutečnost může souviset s celosvětovým růstem bakteriální rezistence k antibakteriálním přípravkům a zdůrazňuje možnost, že místní „mikrobiální ekosystém“ je nejdůležitějším rizikovým faktorem pro získání MDR bakterií bez ohledu na délku intubace [29,30]. Recentní práce Papajka et al. však nadále potvrzuje význam klasifikace HAP na pozdní a časné a současně dokladuje negativní vliv předchozí antibiotické léčby na výskyt MDR bakterií [31].
Tab. 1. Základní pojmy související s HAP/VAP
Tab. 1: Basic terms related to HAP/VAP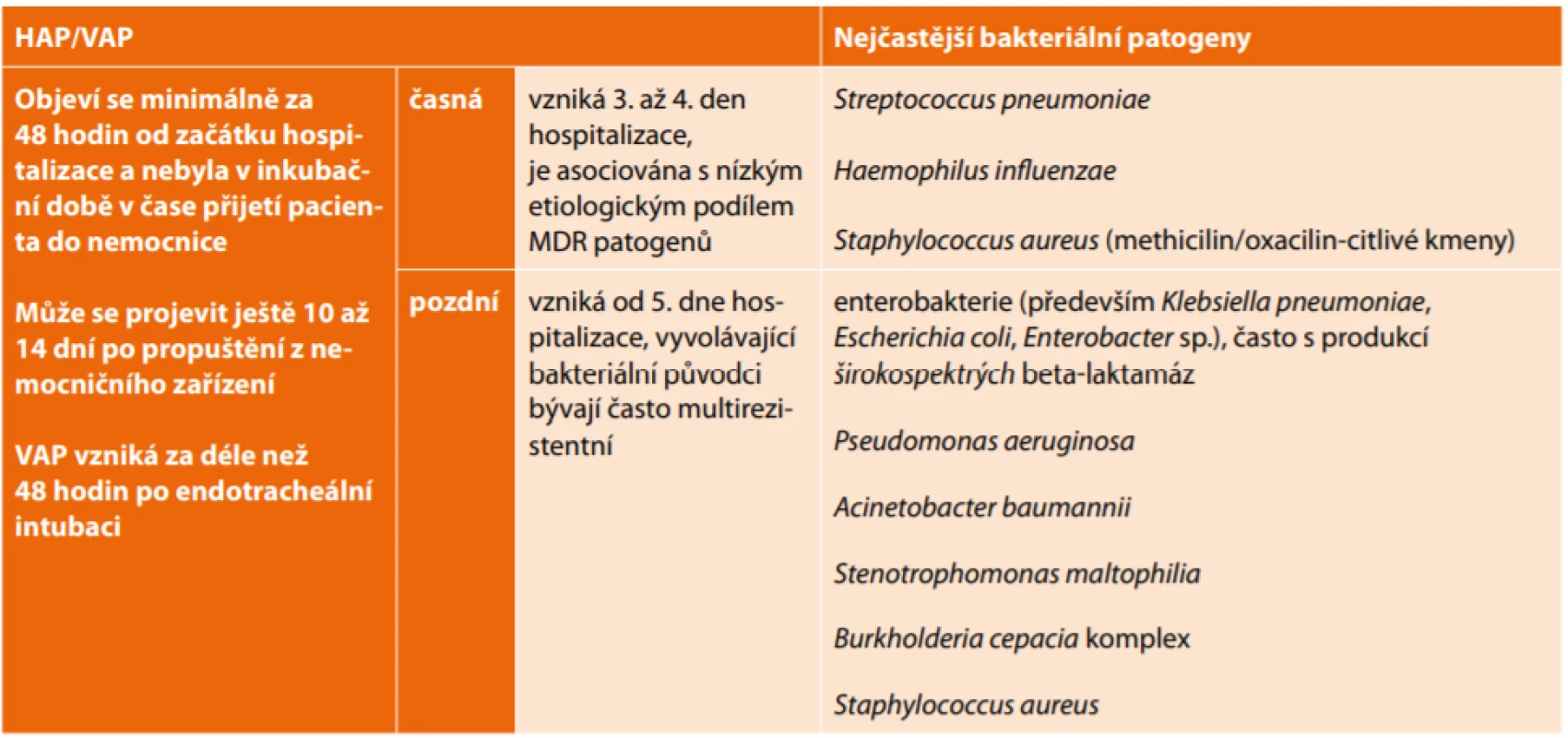
Legend/Vysvětlivky: HAP – Hospital Acquired Pneumonia (nozokomiální pneumonie), VAP – Ventilator Associated Pneumonia (ventilátorová pneumonie), MDR – Multidrug-resistant (multirezistentní) Obecné zásady léčby HAP/VAP vycházející z aktuálních evropských doporučení [20]
- U intubovaných pacientů s podezřením na VAP je doporučeno odebrat vzorky z dolních dýchacích cest před zahájením antibioterapie a tyto zpracovat kvantitativně. Výsledky použít k cílené antibiotické léčbě vycházející z určení etiologického bakteriálního agens a jeho antibiogramu. Cílem je deeskalace, resp. zacílení a zúžení iniciální antibiotické léčby, pokud byla použita kombinace antibiotik.
- Je doporučeno užití antibiotik s užším spektrem účinku u pacientů s časnou nozokomiální pneumonií a nízkým rizikem MDR patogenů. Podle tohoto doporučení však nelze postupovat, pokud je stav pacienta komplikován, resp. u pacientů s podezřením na časnou HAP se sepsí či možným rozvojem sepse nebo při hospitalizaci na nemocničním oddělení s vysokým výskytem MDR bakterií. V těchto případech je nutné nasadit antibiotika s účinkem na Pseudomonas aeruginosa a enterobakterie s produkcí širokospektrých beta-laktamáz (v souladu s lokální epidemiologickou situací).
- U vysoce rizikových pacientů s HAP/VAP je v iniciální antibioterapii doporučeno pokrytí především MDR gramnegativních bakterií. Za vysoce rizikové jsou považováni pacienti s HAP/VAP a sepsí nebo septickým šokem a/nebo s následujícími rizikovými faktory:
- pobyt na oddělení s vysokou frekvencí MDR patogenů,
- předchozí antibiotická léčba,
- pobyt v nemocnici delší než 4 dny,
- prokázaná kolonizace MDR bakteriemi.
Rozšíření účinku na methicilin/oxacilin-rezistentní kmeny Staphylococcus aureus (MRSA) je doporučováno u pacientů s pozitivním průkazem nebo rizikem jejich přítomnosti (např. pozitivní kultivační průkaz v anamnéze).- Je doporučeno, aby u pacientů s HAP/VAP bez imunodeficitu, cystické fibrózy, empyému, plicního abscesu, kavitace či nekrotizující pneumonie a s dobrou klinickou odpovědí na léčbu trvala antibioterapie 7–8 dní. A to včetně pacientů s prokázanými MDR bakteriálními patogeny. Pacienti, kteří neměli iniciální léčbu adekvátně nastavenou, mohou vyžadovat delší dobu aplikace antibiotik, resp. uvedená doba 7–8 dní se týká adekvátní antibioterapie.
- Není doporučeno rutinní stanovování biochemických markerů zánětu (C-reaktivní protein, prokalcitonin) za účelem odhadu progrese onemocnění či špatné klinické odpovědi v časovém intervalu prvních 3–4 dnů léčby. Je však doporučeno provádění denního rutinního klinického zhodnocení pacienta u lůžka a toto je označeno za správnou klinickou praxi. Vyšetření obvykle zahrnuje měření teploty, posouzení množství a charakteru produkovaného tracheobronchiálního sekretu, zhodnocení skiagramu hrudníku, hodnocení krevního obrazu (počtu leukocytů), výpočet hypoxemického indexu a vypočet jednoho či více skórovacích systémů jako Clinical Pulmonary Infection Score (CPIS), Organ Dysfunction and Infection System (ODIN), Sequential Organ Failure Assessment (SOFA), Simplified Acute Physiological Score II (SAPS II) nebo Acute Physiology and Chronic Health Evaluation II (APACHE II).
- Není doporučeno rutinní měření hodnot prokalcitoninu (PCT) a C-reaktivního proteinu (CRP) za účelem zkrácení délky antibioterapie, pokud je předpokládána délka léčby 7–8 dní. Monitorace dynamiky hodnot PCT a CRP je však doporučena v klinických situacích, kdy je cílem deeskalace antibioterapie nebo když pacient vyžaduje prodlouženou aplikaci antibiotik.
- Nelze doporučit selektivní dekontaminaci dutiny ústní chlorhexidinem u pacientů na umělé plicní ventilaci. Kvůli nedostatku dat není zřejmé, zda převažují výhody, resp. snížení výskytu VAP, či nežádoucí účinky související s poškozením plic při mikroaspiraci. Selektivní dekontaminace střeva antibiotiky není doporučena.
Obecné zásady terapeutického přístupu k pacientům s HAP/VAP jsou shrnuty ve Schématu 1.
Schéma 1: Obecný terapeutický přístup k HAP/VAP z pohledu bakteriální etiologie
Schema 1: General therapeutic approach to HAP/VAP in terms of bacterial etiology
Bakteriální původci HAP/VAP
V etiopatogenezi nozokomiálních pneumonií se uplatňuje široké spektrum potenciálních bakteriálních patogenů, především enterobakterie (nejčastěji Klebsiella pneumoniae a Escherichia coli), Pseudomonas aeruginosa a Staphylococcus aureus. V případě aspirační pneumonie je nutné vzít v úvahu anaerobní bakterie. Frekvence výskytu bakteriálních původců je podmíněna i délkou hospitalizace pacienta. U časných forem se uplatňují jako původci spíše bakterie z primární bakteriální mikroflóry, a tedy citlivější k antibiotikům, u pozdních forem převažují spíše bakterie sekundárně kolonizující pacienta a s vyšší mírou rezistence [32−35]. K nepravděpodobným původcům patří koaguláza-negativní stafylokoky a viridující streptokoky [33−36]. Enterokoky jsou možnými původci v případě pozdních HAP a dle Herkela et al. tvoří 5 % všech bakteriálních etiologických agens [6]. Jejich zdrojem je v tomto případě horní část gastrointestinálního traktu a pneumonie vzniká následkem regurgitace žaludečního obsahu a následné mikroaspirace, jak prokázala studie Pudové et al. [17].
Studie zaměřené na situaci v České republice uvádějí vysoké procento pozdních nozokomiálních pneumonií způsobených gramnegativními bakteriemi. Naopak výskyt Staphylococcus aureus je v porovnání se zahraničními údaji nízký [6,31–36]. Uvízl et al. označují druhy Klebsiella pneumoniae, Pseudomonas aeruginosa, Burkholderia cepacia komplex a Escherichia coli za nejčastěji asociované s úmrtím pacientů na JIP z důvodu HAP, přičemž zastoupení MDR kmenů u těchto species bylo více než 50 % [33]. V multicentrické prospektivní observační studii realizované v letech 2013−2015 ve čtyřech centrech v České republice (ve Fakultní nemocnici Olomouc, Fakultní nemocnici Brno, Fakultní nemocnici Hradec Králové a Thomayerově nemocnici Praha) se zaměřením na epidemiologii HAP bylo zjištěno celkem 22 bakteriálních species – původců HAP. Pouze u 6 z nich byla frekvence výskytu vyšší než 5 %, a to Klebsiella pneumoniae 20 %, Pseudomonas aeruginosa 20 %, Escherichia coli 11 %, Enterobacter sp. 8 %, Staphylococcus aureus 6 % a Burkholderia cepacia komplex 6 % [6]. Uvedená studie Herkela et al. rovněž prokázala, že 87 % HAP bylo pozdního typu, přičemž zhruba u třetiny pacientů byla potvrzena polymikrobiální etiologie [6].
Rezistence bakteriálních původců HAP/VAP a dopad na mortalitu
Bakteriální odolnost k účinku antibiotik představuje velmi závažný problém pro iniciální antibiotickou léčbu. Neadekvátní antibioterapie s následným vzestupem mortality je reálným nebezpečím a je zřejmé, že nelze pokrýt všechny možné kombinace bakteriálních patogenů a jejich fenotypů rezistence. Na druhé straně je však nutné poskytnout pacientům s HAP/VAP co největší pravděpodobnost, že toto závažné onemocnění bude úspěšně zvládnuto. Nezbytným předpokladem je podrobná znalost bakteriálních původců a jejich rezistence k antibakteriálním přípravkům v konkrétní epidemiologické jednotce.
Rezistence bakteriálních původců HAP/VAP vůči antibiotikům se liší mezi jednotlivými zeměmi a regiony. Proto je kladen důraz na vytvoření doporučených postupů antibiotické léčby a tato doporučení musejí být pravidelně revidována podle aktuální epidemiologické situace na daném pracovišti [14,19−21,34,37]. Prospektivní studie Verhammeho et al. analyzující HAP u pacientů v intenzivní péči uvádí, že k nejvýznamnějším rizikovým faktorům etiologické role MDR bakteriálních patogenů patří předcházející antibiotická léčba a vyšší věk pacienta [38]. Papajk et al. rovněž dokumentují vztah mezi předchozím podání antibiotik a vyšším výskytem MDR bakterií [31].
Nedílnou součástí hodnocení nejčastějších bakteriálních původců nozokomiálních pneumonií je rezistence k antibakteriálním přípravkům, včetně jejího vývoje v čase. Tyto údaje jsou základním výchozím zdrojem iniciální antibiotické léčby, která musí být zvolena tak, aby pravděpodobnost úspěšné léčby byla co nejvyšší. Je nutné zdůraznit, že 100% jistotu účinné antibioterapie nelze zaručit. Na základě podrobné znalosti nejčastějších bakteriálních původců a jejich citlivosti k antibiotikům lze však zvolit optimální antibiotický režim [14,19,20,35]. Současně lze doporučit stanovení kumulativního antibiogramu, který lze definovat jako společný účinek (v procentech) konkrétního antibiotika na nejčastější původce HAP/VAP, a tento aplikovat při výběru iniciální antibioterapie (viz Schéma 1). Konkrétní dopad rezistence bakteriálního původce HAP/VAP na aplikovanou antibiotickou léčbu uvádějí ve své práci Luna et al. [10]. Z výsledků této studie vyplývá 38% mortalita v případě pacientů adekvátně léčených (tedy s účinnou antibioterapií), zatímco v případě neadekvátní (bakteriální původce byl rezistentní) dosáhla mortalita hodnoty 91 %. Herkel et al. rovněž uvádějí statisticky významný rozdíl mezi adekvátní a neadekvátní antibiotickou léčbou VAP ve vztahu k mortalitě. U pacientů s adekvátní léčbou byla mortalita 27 %, zatímco v případě neadekvátní, bakteriální původci byli rezistentní k iniciální antibiotické léčbě, dosáhla hodnoty 45 % [6].
Antibiotická léčba HAP/VAP
Antibiotická léčba nozokomiálních pneumonií je podmíněna typem onemocnění, celkovým stavem pacienta a musí být zahájena ihned po stanovení diagnózy, především u pacientů v intenzivní péči. To však v žádném případě neznamená, že volba antibiotik může být náhodná, ale naopak musí vycházet z kvalifikovaného předpokladu dostatečné aktivity na nejčastější bakteriální původce, v podmínkách České republiky především na enterobakterie a kmeny Pseudomonas aeruginosa [6,31−36]. Aplikace antibiotik je podmíněna lokálními zdroji informací, konkrétně frekvencí bakteriálních patogenů a úrovní jejich rezistence k antibiotikům, včetně jejího trendu [14,19,20,32–36]. Důsledná rozvaha a racionální výběr antibioterapie jsou zásadní pro úspěšnou léčbu a mohou mít pozitivní vliv na přežití pacienta s těžce probíhající a život ohrožující nozokomiální pneumonií [6,14,18,19,33,35]. Současně je nutné zdůraznit, že je velmi důležité odebrat co nejdříve (optimálně před zahájením antibioterapie) adekvátní klinický materiál k mikrobiologickému vyšetření, a to včetně opakovaných hemokultur [14,18−20].
V případě klinického efektu nasazené antibiotické léčby a v souladu s mikrobiologickým vyšetřením je vhodné realizovat deeskalační postup, tedy cílenou léčbu na základě stanovení etiologického agens a jeho citlivosti k antibakteriálním přípravkům. Tento postup snižuje riziko vývoje bakteriální rezistence a současně snižuje ekonomické náklady. Tab. 2 shrnuje popsaný postup.
Tab. 2. Postup léčby u nozokomiálních pneumonií
Tab. 2: Therapeutic approach to nosocomial pneumonias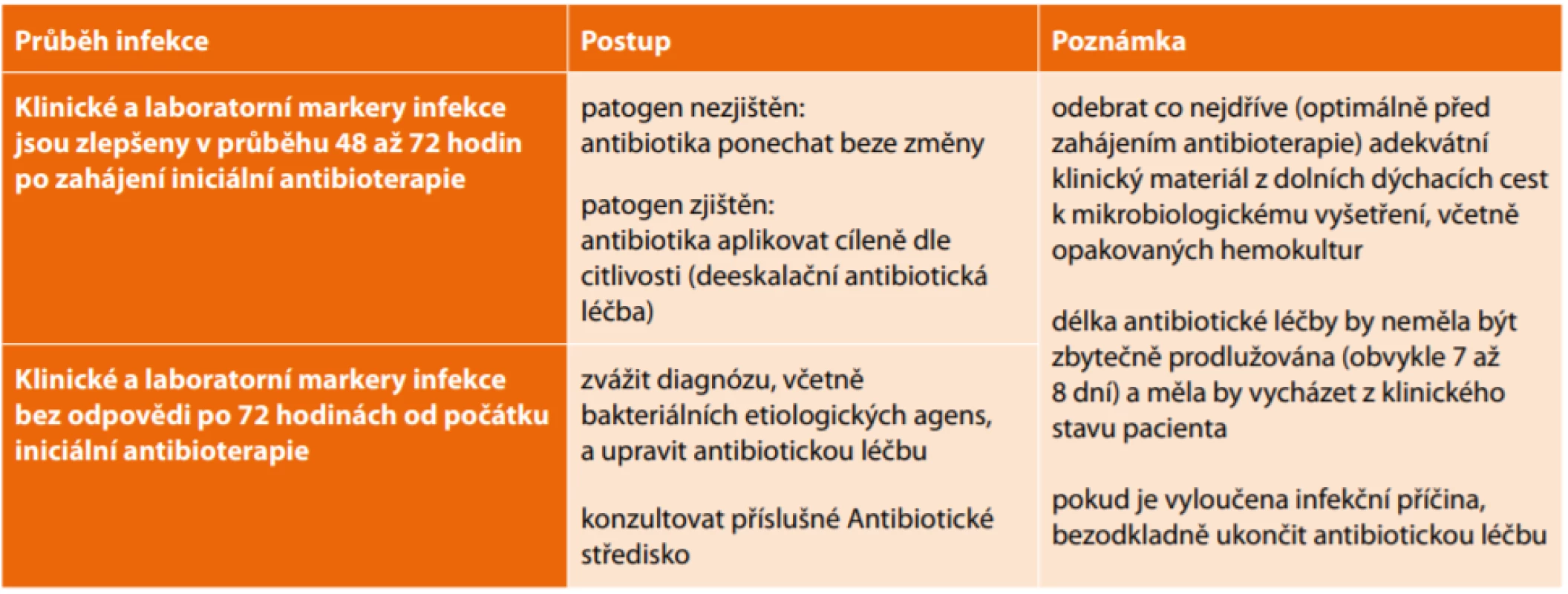
Tab. 3 uvádí možné režimy iniciální antibiotické léčby HAP/VAP v podmínkách České republiky. Tyto vycházejí z frekvence bakteriálních původců včetně jejich citlivosti/rezistence k antibiotikům, přičemž východiskem je rovněž klasifikace z pohledu časného nebo pozdního typu infekce. Jsou uvedeny některé možné přístupy k antibiotické léčbě, které však nelze považovat za jediné možné.
Tab. 3. Iniciální antibiotická léčba HAP/VAP
Tab. 3: Initial antibiotic treatment of HAP/VAP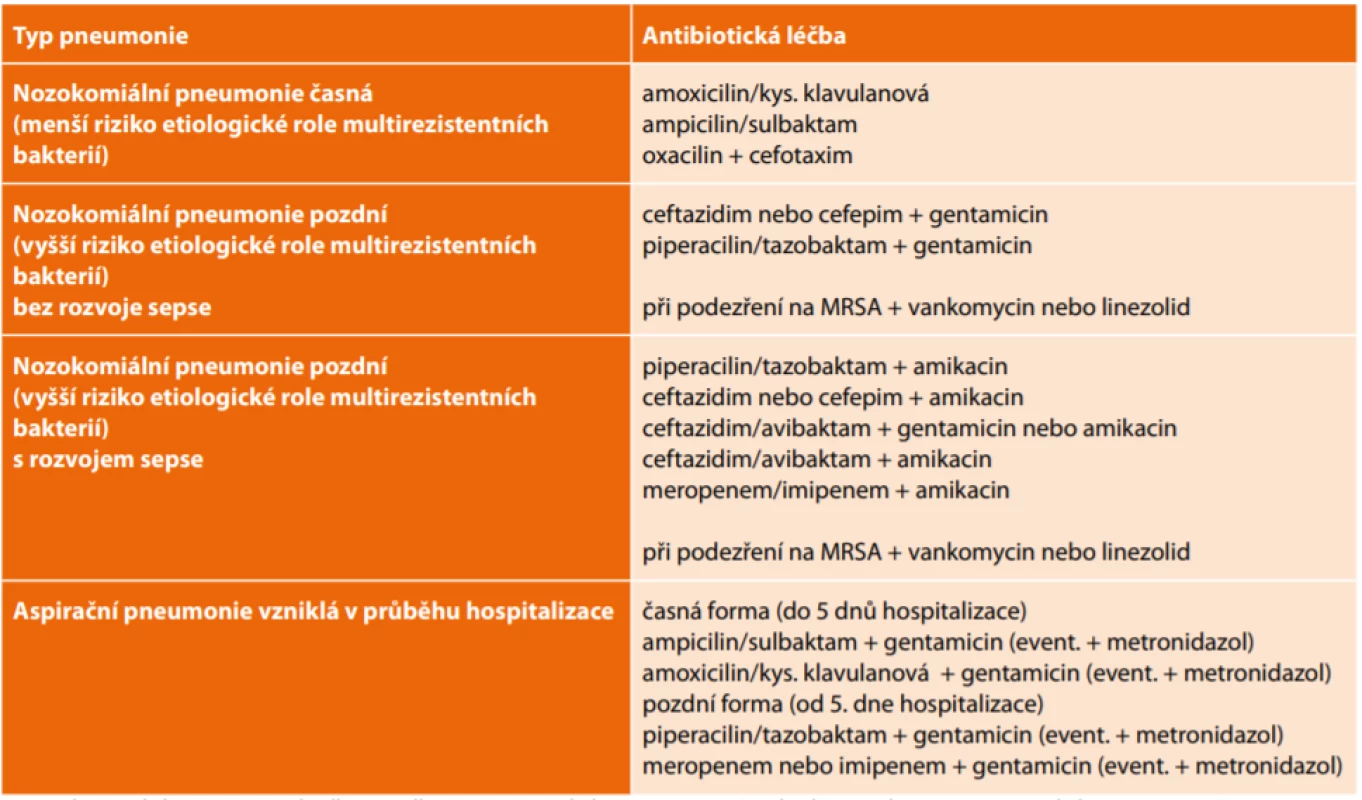
Legend/Vysvětlivky: MRSA – Methicillin/oxacillin-resistant Staphylococcus aureus (methicilin/oxacilin-rezistentní Staphylococcus aureus) Podpořeno grantem IGA_LF_2020_021.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
prof. MUDr. Milan Kolář, Ph.D.
Ústav mikrobiologie LF UP a FNOL
Hněvotínská 3
775 15 Olomouc
e-mail: milan.kolar@fnol.cz
Zdroje
- Douglas IS. Pulmonary infections in critical/intensive care – rapid diagnosis and optimizing antimicrobial usage. Curr Opin Pulmon Med. 2017;23(3):198−203. doi:10.1097/MCP.0000000000000366.
- Torres A, Ewig S, Lode H, et al. Defining, treating and preventing hospital acquired pneumonia: European perspective. Intensiv Care Med. 2009;35(1):9−29. doi:10.1007/s00134-008-1336-9.
- Vincent JL, Bihari DJ, Suter PM, et al. The prevalence of nosocomial infection in intensive care units in Europe. Results of the European Prevalence of Infection in Intensive Care (EPIC) Study. EPIC International Advisory Committee. JAMA 1995;274(8):639−44. doi:10.1001/jama.1995.03530080055041.
- Vincent JL, Rello J, Marshall J, et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA 2009;302(21):2323−2329. doi:10.1001/jama.2009.1754.
- Schulgen G, Kropec A, Kappstein I, et al. Estimation of extra hospital stay attributable to nosocomial infections. J Clin Epidemiol. 2000;53(4):409−417. doi:10.1016/S0895-4356(99)00182-1.
- Herkel T, Uvizl R, Doubravska L, et al. Epidemiology of hospital-acquired pneumonia: Results of a Central European multicenter, prospective, observational study compared with data from the European region. Biomed Papers 2016;160(3):448−455. doi:10.5507/bp.2016.014.
- Werarak P, Kiratisin P, Thamlikitkul V. Hospital-acquired pneumonia and ventilator-associated pneumonia in adults at Siriraj Hospital: etiology, clinical outcomes, and impact of antimicrobial resistance. J Med Assoc Thai 2010;93(Suppl.1):126−138.
- Tejada Artigas A, Bello Dronda S, Chacón Vallés E, et al. Risk factors for nosocomial pneumonia in critically ill trauma patients. Crit Care Med. 2001;29(2):304–309. doi:10.1097/00003246-200102000-00015.
- Piskin N, Aydemir H, Oztoprak N, et al. Inadequate treatment of ventilator-associated and hospital-acquired pneumonia: Risk factors and impact on outcomes. BMC Infect Dis. 2012;12 : 268. doi:10.1186/1471-2334-12-268.
- Luna CM, Vujacich P, Niederman MS, et al. Impact of BAL data on the therapy and outcome of ventilator-associated pneumonia. Chest 1997;111(3):676-85. doi:10.1378/chest.111.3.676.
- Kollef MH, Sherman G, Ward S, et al. Inadequate antimicrobial treatment of infections. A risk factor for hospital mortality among critically ill patients. Chest 1999;115(2):462−474. doi:10.1378/chest.115.2.462.
- Warren DK, Shukla SJ, Olsen MA, et al. Outcome and attributable cost of ventilator-associated pneumonia among intensive care unit patients in a suburban medical center. Crit Care Med. 2003;31(5):1312−1317. doi:10.1097/01.CCM.0000063087.93157.06.
- Wyncoll D, Camporota L. Number needed to treat and cost-effectiveness in the prevention of ventilator-associated pneumonia. Crit Care 2012;16(3):430. doi:10.1186/cc11346.
- American Thoracic Society and the Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med. 2005;171(4):388−416. doi:10.1164/rccm.200405-644ST.
- Doubravská L, Uvízl R, Gabrhelík T, et al. Nozokomiální pneumonie ve světle aktuálních doporučení – je prostor pro zlepšení péče o pacienta? Klin Mikrobiol Inf Lék. 2018;24(1):4−9.
- Chastre J, Fagon JY. Ventilator-associated Pneumonia. Am J Respir Crit Care Med. 2002;165(7):867−903. doi:10.1164/ajrccm.165.7.2105078.
- Pudová V, Htoutou Sedláková M, Kolář M. and working group. Clonality of bacterial pathogens causing hospital-acquired pneumonia. Curr Microbiol. 2016;73(3):312−316. doi:10.1007/s00284-016-1058-0.
- Uvizl R, Adamus M, Cerny V, et al. Patient survival, predictive factors and disease course of severe sepsis in Czech intensive care units: a multicentre, retrospective, observational study. Biomed Papers 2016;160(2):287−297. doi:10.5507/bp.2015.052.
- Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Inf Dis. 2016;63(5):61−111. doi:10.1093/cid/ciw353.
- Torres A, Niederman MS, Chastre J, et al. International ERS/ESICM/ESCMID/ALAT guidelines for the management of hospital-acquired pneumonia and ventilator-associated pneumonia. Eur Respir J. 2017;50(3):1−26. doi:10.1183/13993003.00582-2017.
- Ewig S, Welte T, Chastre J, et al. Rethinking the concepts of community-acquired and health-care-associated pneumonia. Lancet Inf Dis. 2010;10(4):279−287. doi:10.1016/S1473-3099(10)70032-3.
- Yap V, Datta D, Metersky ML. Is the present definition of health care–associated pneumonia the best way to define risk of infection with antibiotic-resistant pathogens? Inf Dis Clin North America 2013;27(1):1−18. doi: 10.1016/j.idc.2012.11.002.
- Safdar N, Dezfulian C, Collard HR, et al. Clinical and economic consequences of ventilator-associated pneumonia: A systematic review. Crit Care Med. 2005;33(10):2184−2193. doi:10.1097/01.ccm.0000181731.53912.d9.
- Timsit JF, Esaied W, Neuville M, et al. Update on ventilator-associated pneumonia. F1000Research 2017;6 : 2061. doi:10.12688/f1000research.12222.1.
- Magiorakos AP, Srinivasan A, Carey RB, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Inf. 2012;18(3):268−281. doi:10.1111/j.1469-0691.2011.03570.x.
- Trouillet JL, Chastre J, Vuagnat A, et al. Ventilator-associated pneumonia caused by potentially drug-resistant bacteria. Am J Resp Crit Care Med. 1998;157(2):531−539. doi:10.1164/ajrccm.157.2.9705064.
- Martin-Loeches I, Torres A, Rinaudo M, et al. Resistance patterns and outcomes in intensive care unit (ICU)-acquired pneumonia. Validation of European Centre for Disease Prevention and Control (ECDC) and the Centers for Disease Control and Prevention (CDC) classification of multidrug resistant organisms. J Inf. 2015;70(3):213−222. doi:10.1016/j.jinf.2014.10.004.
- Martin-Loeches I, Deja M, Koulenti D, et al. Potentially resistant microorganisms in intubated patients with hospital-acquired pneumonia: the interaction of ecology, shock and risk factors. Intensive Care Med. 2013;39(4):672−681. doi:10.1007/s00134-012-2808-5.
- Neu HC. The crisis in antibiotic resistance. Science 1992;257(5073):1064−1073. doi:10.1126/science.257.5073.1064.
- Kolář M, Urbánek K, Látal T. Antibiotic selection pressure and development of bacterial resistance. Intern J Antimicrob Agents 2001;17(5):357−363. doi:10.1016/S0924-8579(01)00317-X.
- Papajk J, Uvízl R, Kolář M. Vliv předchozí antibiotické terapie na epidemiologii ventilátorových pneumonií. Klin Mikrobiol Inf Lék. 2019;25 : 7−11.
- Uvízl R, Herkel T, Kolář M, et al. Nozokomiální pneumonie – optimální nastavení iniciální empirické antimikrobiální terapie. Int Med Prax. 2017;19(4):225−229.
- Uvizl R, Hanulik V, Husickova V, et al. Hospital-acquired pneumonia in ICU patients. Biomed Papers 2011;155(4):373−378. doi:10.5507/bp.2011.067.
- Kolář M. Respirační infekce a jejich léčba. Maxdorf Jessenius, Praha, 2016.
- Htoutou Sedláková M, Pudová V, Kolář M, et al. Bakteriální původci nozokomiálních pneumonií – multicentrická studie v České republice. Klin Mikrobiol Inf Lék. 2015;21(1):10−14.
- Gabrhelík T, Hanulík V, Jakubec P, et al. Porovnání validity různých vzorků biologického materiálu z dýchacích cest a jejich přínosu v detekci původců nozokomiální pneumonie. Klin Mikrobiol Inf Lék. 2015;21(1):4−9.
- Dalhoff K, Ewig S. Adult patients with nosocomial pneumonia: epidemiology, diagnosis, and treatment. Deuts Arzteblatt Intern. 2013;110(38):634−640. doi:10.3238/arztebl.2013.0634.
- Verhamme KM, de Coster W, de Roo L, et al. Pathogens in early-onset and late-onset intensive care unit-acquired pneumonia. Inf Control Hosp Epidemiol. 2007;28(4):389−397. doi:10.1086/511702.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Morgagniho kýla – kazuistiky
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2020 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Technický vývoj robotické chirurgie
- Problematika nozokomiálních pneumonií
- Endovenózní laserová ablace vena saphena − střednědobé výsledky potvrzují trvalý uzávěr a možnost ošetřit více lézí během jednoho zákroku
- Implantace stimulátoru vagového nervu při léčbě epilepsie u 126 pacientů – chirurgická technika, komplikace
- Metastázy světlobuněčného karcinomu ledviny do pankreatu
- Komplikace dekompresivní kraniektomie u nemocných s kraniocerebrálním poraněním
- Morgagniho kýla – kazuistiky
- Primární perineální kýla: kazuistika
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Morgagniho kýla – kazuistiky
- Metastázy světlobuněčného karcinomu ledviny do pankreatu
- Implantace stimulátoru vagového nervu při léčbě epilepsie u 126 pacientů – chirurgická technika, komplikace
- Primární perineální kýla: kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



