-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Implantace stimulátoru vagového nervu při léčbě epilepsie u 126 pacientů – chirurgická technika, komplikace
Implanted vagus nerve stimulation in 126 patients: surgical technique and complications
Introduction: Vagus nerve stimulation is a palliative treatment for patients with refractory epilepsy to reduce the frequency and intensity of seizures. A bipolar helical electrode is placed around the left vagus nerve at the cervical level and is connected to the pulse generator placed in a subcutaneous pocket, most commonly in the subclavian region.
Methods: Between March 1998 and October 2019, we performed 196 procedures related to the vagal nerve stimulation at the Neurosurgery Department in Motol University Hospital. Of these, 126 patients were vagal nerve stimulator implantation surgeries for intractable epilepsy. The cases included 69 female and 57 male patients with mean age at the time of the implantation surgery 22±12.4 years (range 2.1−58.4 years).
Results: Nine patients (7.1%) were afflicted by complications related to implantation. Surgical complications included postoperative infection in 1.6%, VNS-associated arrhythmias in 1.6%, jugular vein bleeding in 0.8% and vocal cord paresis in 2.4%. One patient with vocal cord palsy also suffered from severe dysphagia. One patient (0.8%) did not tolerate extra stimulation with magnet due to a prolonged spasm in his throat. The extra added benefit of vagus stimulation in one patient was a significant reduction of previously regular severe headaches.
Conclusion: Vagus nerve stimulation is an appropriate treatment for patients with drug-resistant epilepsy who are not candidates for focal resective surgery. Implantation of the vagus nerve stimulator is a relatively safe operative procedure.
Keywords:
epilepsy − epilepsy surgery − vagus nerve stimulation – VNS − complications
Autoři: M. Bláha; M. Tichý
Působiště autorů: Neurochirurgická klinika dětí a dospělých 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol
Vyšlo v časopise: Rozhl. Chir., 2020, roč. 99, č. 7, s. 304-310.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2020.99.7.304–310Souhrn
Úvod: Stimulace vagového nervu je paliativní výkon u farmakorezistentní epilepsie ke snížení frekvence a intenzity záchvatů. Při implantaci vagového stimulátoru se umístí elektroda na krční úsek levého vagového nervu a generátor stimulátoru do podkožní kapsy, nejčastěji v podklíčkové oblasti.
Metody: Od března 1998 do listopadu 2019 jsme na Neurochirurgické klinice dětí a dospělých 2. LF UK a FN Motol provedli 196 operací spojených s vagovou stimulací. Z toho 126 operací byla levostranná primoimplantace vagového stimulátoru pro farmakorezistentní epilepsii. V našem souboru bylo 69 žen a 57 mužů s průměrným věkem 22±12,4 roku. Nejmladšímu pacientovi bylo 2,1 roku a nejstaršímu bylo 58,4 roku.
Výsledky: V našem souboru jsme zaznamenali komplikace u 9 pacientů (7,1 %). Pooperační infekce se vyskytla u dvou pacientů (1,6 %), poruchy srdečního rytmu se objevily ve dvou případech (1,6 %), u jednoho pacienta došlo peroperačně k významnému krvácení (0,8 %). U tří pacientů se objevila paréza zvratného nervu (2,4 %) a u jednoho z těchto pacientů se souběžně projevila pooperačně těžká dysfagie (0,8 %). U jednoho pacienta (0,8 %) při extrastimulaci magnetem docházelo k výrazné déletrvající křeči v hrdle. Extra přidaným benefitem vagové stimulace u jedné pacientky bylo výrazné snížení pravidelných krutých bolestí hlavy.
Závěr: Stimulace vagového nervu je možnou alternativou pro pacienty s farmakorezistentní epilepsií, u kterých není vhodná resekční operace. Implantace vagového stimulátoru je poměrně bezpečná operační technika.
Klíčová slova:
epilepsie − epileptochirurgie − stimulace vagového nervu – VNS − komplikace
Úvod
Epilepsie je nejčastější chronické onemocnění centrálního nervového systému (CNS) projevující se opakovanými nevyprovokovanými epileptickými záchvaty s neurobiologickými, kognitivními, psychologickými a sociálními následky [1]. Prevalence epilepsie v České republice je 0,5−1 % (50–100 tisíc epileptiků). Incidence je 50 nově diagnostikovaných epilepsií na 100 tisíc obyvatel za rok [2]. Základem terapie je medikamentózní léčba antiepileptiky a režimová opatření [3]. Přesto u některých pacientů není dosaženo kompenzace epilepsie ani při podávání adekvátně zvolených a dostatečně dávkovaných antiepileptikách v různých kombinacích [4]. Tito farmakorezistentní pacienti jsou dále vyšetřováni na specializovaných epileptologických pracovištích a je zvažována neurochirurgická resekční operace. U pacientů, u nichž ani komplexní vyšetření neumožní naplánování resekční operace – riziko operační resekce je příliš vysoké nebo pacient resekci odmítá – můžeme zvážit stimulaci vagového nervu jako paliativní proceduru.
První implantace vagového stimulátoru (VNS) byla provedena v USA v roce 1988 [5] a metoda byla schválena ke klinickému použití v roce 1997 po klinických studiích bezpečnosti a účinnosti [6,7]. První implantace VNS v České republice proběhla již v roce 1997.
Mechanismem účinku VNS je aktivace nemyelinizovaných C vláken vagového nervu během elektrické stimulace, čímž dochází k desynchronizaci elektroencefalografické aktivity neuronů prostřednictvím tractus solitarius a retikulární formace [8]. K desynchronizaci také přispívá snížení excitačních a zvýšení inhibičních neurotransmiterů [9]. Současnými indikacemi k vagové stimulaci jsou multifokální epilepsie, idiopatická generalizovaná epilepsie, symptomatická generalizovaná epilepsie, tonicko-atonické záchvaty, Lennox-Gastautův syndrom a neúspěšná resekční operace [7,10–18].
Snížení frekvence nebo intenzity záchvatů vede ke zlepšení kvality života asi u dvou třetin pacientů s implantovaným vagovým stimulátorem a s prodlužující se dobou od implantace je snížení počtu záchvatů výraznější [6,7,19–24]. U těchto pacientů nejde pouze o snížení počtu záchvatů, ale zlepšují se konkomitantně i kognitivní funkce, paměť, nálada, kvalita života a u dětí školní docházka [25–30].
Operační výkony u stimulace vagového nervu rozdělujeme do tří skupin. Zaprvé jde o primoimplantace vagového stimulátoru – tedy operační umístění elektrody na krční úsek vagového nervu a umístění generátoru do podklíčkové oblasti (Obr. 1). Druhým typem operace je výměna generátoru při vybití baterie nebo vzácněji při výměně za novější typ umožňující jiné stimulační parametry. Do třetí skupiny je možné zařadit ostatní výkony – například výměnu elektrod při malfunkci, explantaci generátoru a elektrod při neúčinnosti nebo nutnosti vyšetření magnetickou rezonancí nebo revize pro infekci. Tato práce bude dále popisovat chirurgickou techniku primoimplantací. Výměny generátoru jsou poměrně jednoduché zákroky a výkony ze třetí skupiny jsou méně časté s často individuálním přístupem a operační technikou. Stimulace vagového nervu jako paliativní léčba refrakterní epilepsie je využívána na našem pracovišti od března 1998. Obsahem této publikace je popis operačního postupu při primoimplantacích a výsledky souboru 126 dětských i dospělých pacientů s posouzením a rozborem chirurgických komplikací. Indikační kritéria k zavedení VNS, stimulační protokoly a výsledky VNS při redukci epileptických záchvatů nejsou obsahem této publikace, jsou sledována a publikována odděleně spolupracujícími neurology pro neurologicko-epileptologickou komunitu. Indikace k vagové stimulaci v našem souboru vychází ze současných doporučení a průběžné výsledky léčby jsou ve shodě s publikovaným snížením frekvence a intenzity záchvatů asi u dvou třetin pacientů.
Obr. 1. Vagový stimulátor
Fig. 1: Vagus nerve stimulator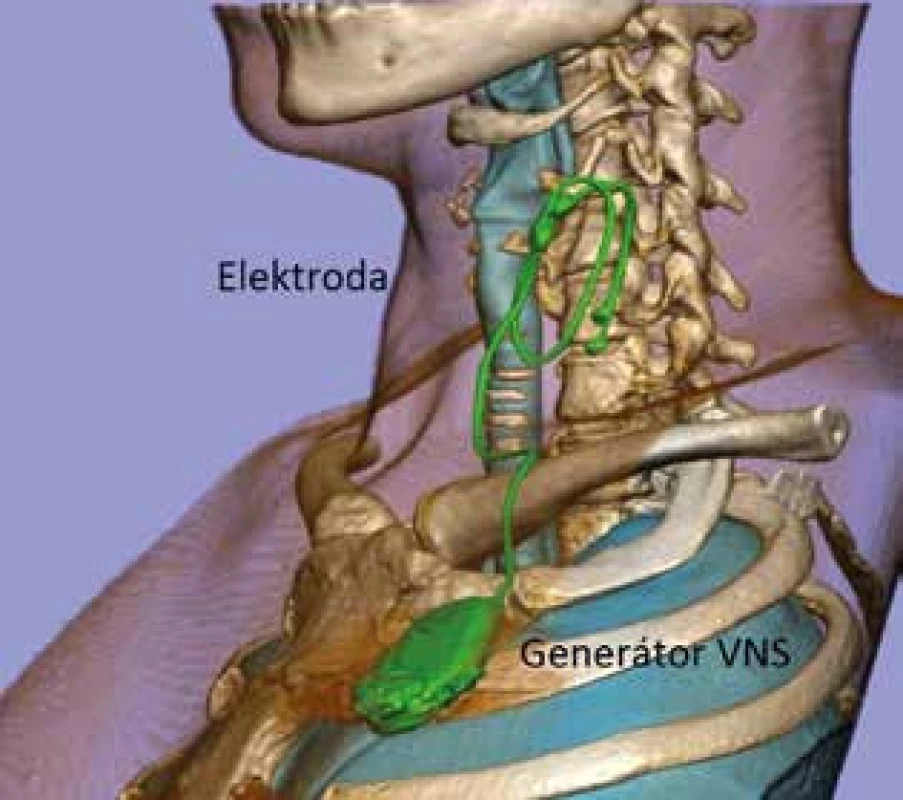
Metody
Set vagového stimulátoru pro primoimplantace obsahuje titanový generátor s lithium-karbonovou monofluoridovou baterií, elektrodu o délce 43 cm s dvěma kontaktními platino-iridiovými spirálovitými kotvičkami a s jednou fixační plastovou kotvičkou. Starší elektrody měly dvoukolíkové napojení na generátor, novější již mají jednokolíkový kontakt. Dále je obsahem setu podkožní tunelizátor, tři plastová fixační křidélka a šroubovák k fixaci elektrody ke generátoru.
Primoimplantace vagového stimulátoru
Pacienty přijímáme den před operačním výkonem. Často se jedná o pacienty se zvýšenou potřebou ošetřovatelské péče, a jako doprovod tedy přijímáme i jejich rodiče nebo opatrovníky. Ráno před operačním zákrokem pacient ještě dostane svoji pravidelnou dávku antiepileptik. Použijeme běžnou antibiotickou profylaxi a pacient je uveden do celkové anestezie s orotracheální intubací. Pacient leží na zádech, podložíme mu mírně ramena a hlavu natočíme asi o 30 stupňů doprava, operační stůl vykloníme částečně do antiTrendellenburgovy polohy k usnadnění venózního odtoku. Obě horní končetiny jsou podél těla na operačním stole, anesteziolog je u nohou pacienta, operatér na levé straně operačního stolu a asistent naproti. Provedeme dezinfekci a zarouškování levé strany krku a infraklavikulární krajiny. Několik centimetrů pod klíčkem vedeme kožní horizontální řez, dlouhý asi 4−6 cm a vytvoříme podkožní kapsu k budoucímu umístění generátoru stimulátoru. Podkožní kapsu vypláchneme fyziologickým roztokem. Dále v polovině vzdálenosti mezi mastoidálním výběžkem a klíčkem vedeme druhý transverzální kožní řez okolo 4 cm, jehož dorzální část přesahuje mediální okraj sternocleidomastoideálního svalu (SCM). Provedeme podkožní disekci a umístíme Gelpi rozvěrač. Platysma protneme kolmo ke kožnímu řezu vertikálně a disekcí pod svalem po povrchové krční fascii připravíme prostor pro umístění kličky elektrody. Pod mediální hranu SCM usadíme Weitlanerův tupý rozvěrač a ostře preparujeme skrze intermuskulární fascii podél musculus omohyoideus a thyreohyoideus ke karotické arterii. Při preparaci se můžeme řídit hmatným pulzem. Karotická arterie je zde v rámci nervově-cévní krčního svazku zavzata do vazivového obalu vagina carotica společně s vnitřní jugulární žílou, horní větví ansa cervicalis a vagovým nervem. Dále již pokračujeme pod operačním mikroskopem. Protneme vaginu caroticu a směřujeme do prostoru mezi karotidu ležící mediálně a vnitřní jugulární žílu, která je laterálně. Povrchově mezi jugulární žílou a karotidou leží horní větev ansa cervicalis. Většinou je rozlišení od vagového nervu jednoznačné – nerv leží povrchově, je slabší a často hlavní kmen nebo jeho větve zatáčejí do podkoží. Nerv se snažíme mobilizovat na stranu a nepřerušit. Zcela výjimečně musíme větev ansy nebo i hlavní kmen protnout při obtížném anatomickém přístupu. Toto v sérii našich pacientů nevedlo k žádné prokazatelné morbiditě. Pokračujeme preparací do hloubky mezi karotidu a jugulární žílu a zde se nalézá vagový nerv. Je silnější než ansa, a pokud má v této výšce větev, je velice slabá, směřuje paralelně s hlavním kmenem a zůstává v hluboké vrstvě. Nerv uvolníme v délce asi 3–4 cm se zachováním perineuria a vasa vasorum. Můžeme si pomoci také podvlekem nervu, který použijeme k malému oddálení nervu od přilehlých struktur. Vagový nerv lze také po jeho mobilizaci podložit plastovou nebo papírovou podložkou k usnadnění další manipulace. Pomocí tunelizátoru protáhneme distální část elektrody s napojovacím kolíkem podkožně z krční rány do infraklavikulární, předem připravené podkožní kapsy (Obr. 2). V krční ráně vytvoříme dvě smyčky elektrody v podkoží a distální konec přiložíme k vagovému nervu tak, aby konec elektrody byl co nejvíce kraniálně. Začneme fixovat elektrodu na vagový nerv pomocí spirálovitých kotviček. Nejprve umístíme plastovou fixační kotvičku na kaudální část nervu, poté prostřední – pozitivní – kontaktní spirálovitou kotvičku na prostředek nervu a nakonec negativní kontaktní kotvičku (nejvíce distálně na elektrodě) zajistíme na kraniální část mobilizovaného vagového nervu (Obr. 3). Po připnutí elektrody k nervu napojíme elektrodu v infraklavikulární části do generátoru a zajistíme šroubem – utahujeme do dvou kliknutí. Provedeme prvý test zařízení pomocí sterilně zabaleného programovacího zařízení. Testovací sekvence trvá asi 1 minutu s parametry 1 mA, 550 µs, 20 Hz a změříme impedanci elektrody. Vysoká impedance nad 2000 Ω znamená buď špatný kontakt elektrody, nebo její malfunkci. Při testovací sekvenci musí být anesteziologický tým ve střehu, může dojít k závažné bradykardii nebo asystolii. U některých typů stimulátoru se dále otestuje schopnost adekvátně zaznamenávat hodnoty srdeční frekvence porovnáním s daty na anesteziologickém monitoru. Pokud první test proběhl úspěšně, vložíme generátor do podkožní kapsy na hrudníku. Z krční rány vyjmeme Weitlanerův rozvěrač, provedeme kontrolu hemostázy a pomocí dvou až tří plastových křidélek fixujeme elektrodu proti dislokaci k hluboké i povrchové krční fascii. Z kosmetických důvodů je důležité, aby fixační křidélka i smyčky elektrody byly pod platysmou. Provedeme suturu obou ran po jednotlivých vrstvách. Na konci výkonu zkontrolujeme programátorem opět impedanci elektrody. Pacient je vyveden z celkové anestezie, a pokud výkon proběhl bez komplikací, nepotřebuje intenzivní péči a je přeložen zpět na standardní oddělení. Pooperační rentgenové vyšetření implantovaného systému není nutné. Vlastní nastavení iniciální stimulační sekvence obvykle provádíme první pooperační den, před propuštěním do domácího ošetřování. Nastavení stimulátoru, různé typy sekvencí a magnetem spouštěná extrastimulace již nejsou předmětem tohoto sdělení.
Obr. 2. Tunelizace elektrody
Fig. 2: Tunneling of the electrode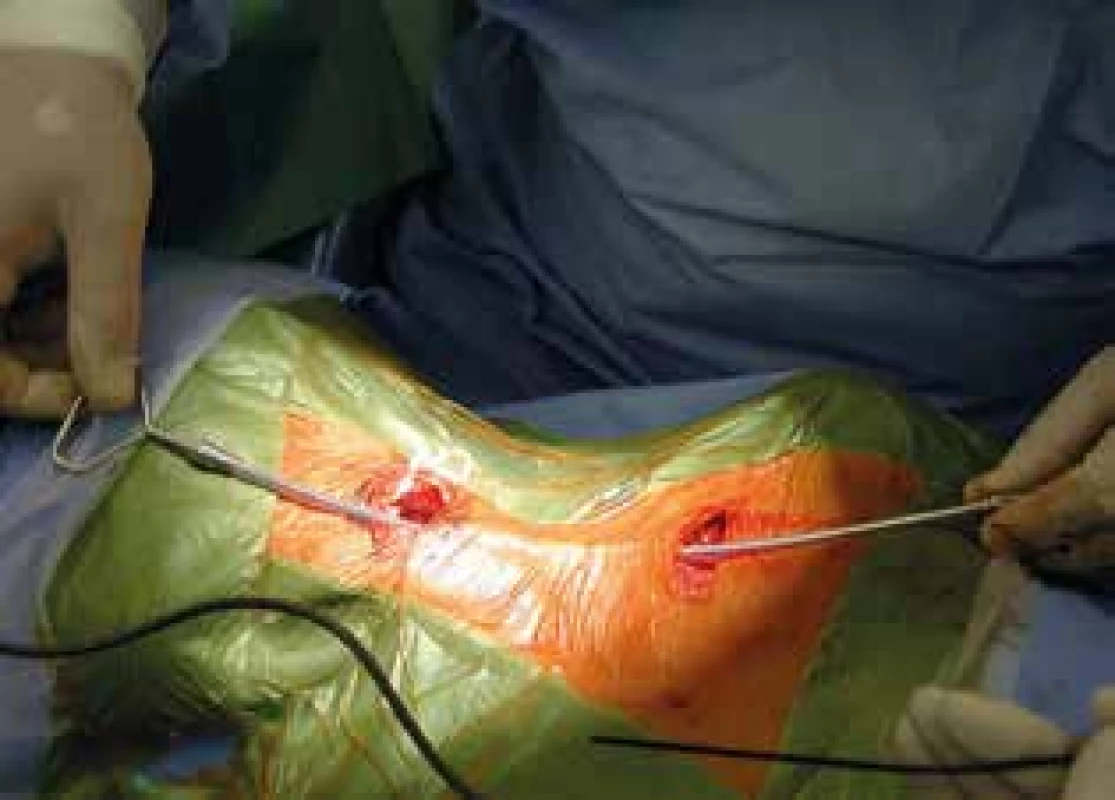
Obr. 3. Elektroda na vagovém nervu
Fig. 3: Electrode around the vagus nerve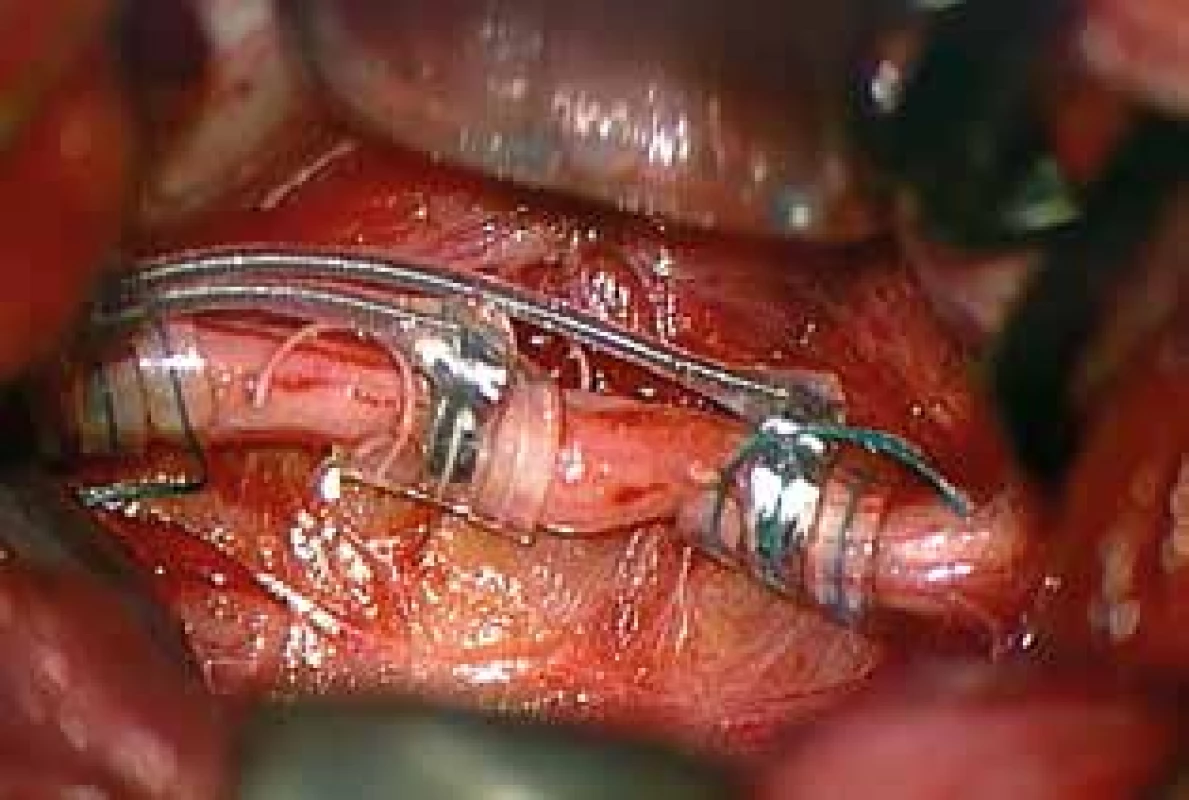
Výsledky
Od března 1998 do listopadu 2019 jsme na Neurochirurgické klinice dětí a dospělých 2. LF UK a FN Motol provedli 196 operací spojených s vagovou stimulací. Z toho 126 operací byla výše popsaná levostranná primoimplantace vagového stimulátoru pro farmakorezistentní epilepsii. V našem souboru 126 pacientů bylo 69 žen a 57 mužů s průměrným věkem 22±12,4 roku. Nejmladšímu pacientovi bylo 2,1 roku a nejstaršímu bylo 58,4 roku. Dvacet dva pacientů bylo mladších deseti let a pouze tři pacienti byli starší než 50 let. VNS stimulátor Model 100 jsme implantovali 2×, Model 101 22×, Model 102 28×, Model 103 56× a Model 106 18×.
V našem souboru operací jsme zaznamenali komplikace u 9 pacientů (7,1 %) − viz Tab. 1. Pooperační infekce se vyskytla u dvou pacientů (1,6 %), poruchy srdeční rytmu se objevily ve dvou případech (1,6 %), u jednoho pacienta jsme museli ošetřit peroperačně významné krvácení (0,8 %). U tří pacientů došlo k přechodné paréze zvratného nervu (2,4 %). U jednoho z těchto pacientů se souběžně objevila pooperačně těžká dysfagie (0,8 %). U velké části pacientů s VNS je běžná změna hlasu či dráždění na kašel v průběhu probíhající stimulace, to však neevidujeme jako komplikaci, ale jako nepříjemný důsledek léčby. U jednoho pacienta (0,8 %) však při extrastimulaci magnetem docházelo k výrazné déletrvající křeči v hrdle, která ho limitovala ve využití této extrastimulace. Extra přidaný benefit vagové stimulace jsme zaznamenali u třicetileté pacientky, kdy po zavedení VNS došlo k výraznému snížení jinak pravidelných krutých bolestí hlavy.
Tab. 1. Komplikace
Tab.1: Complications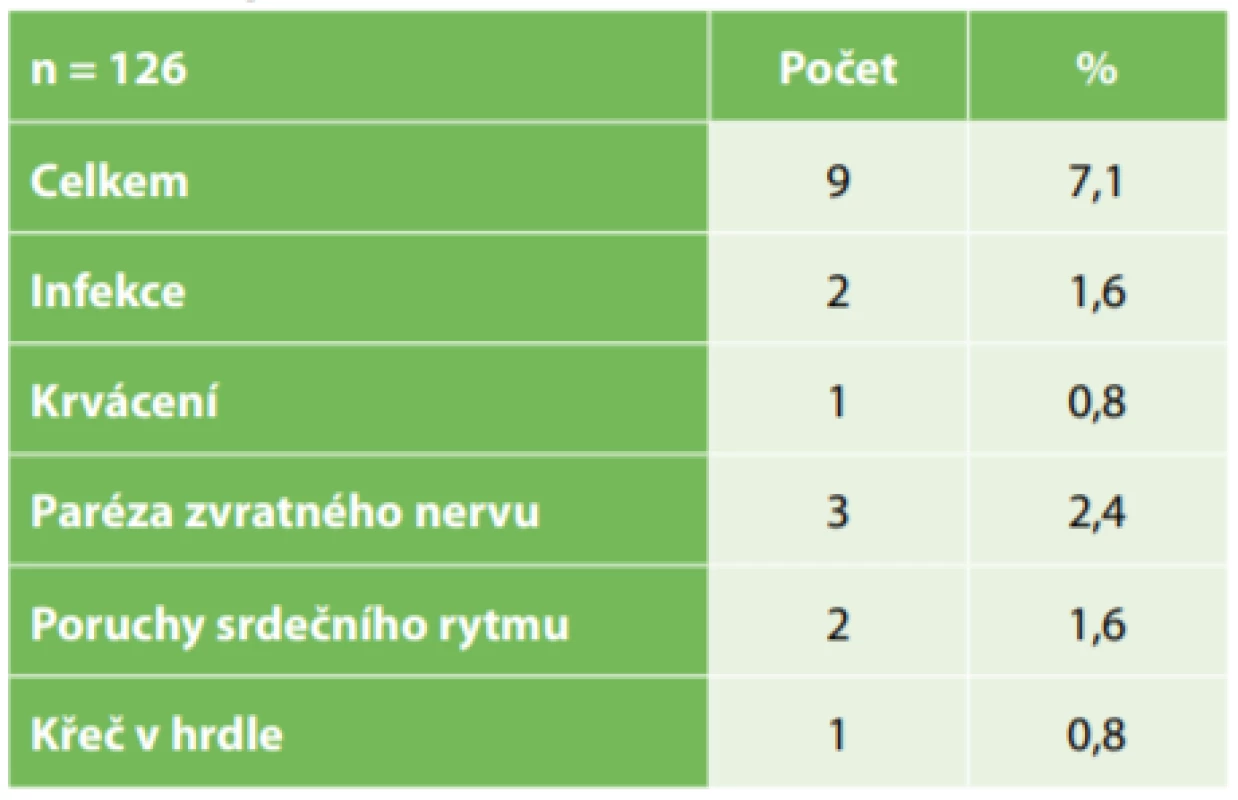
Infekční komplikaci jsme měli ve dvou případech – u jednoho pacienta jsme byli nuceni extrahovat celý systém, u druhého pacienta s typickým obrazem infekce kapsy generátoru a kultivačně prokázaným Staphylococcus aureus jsme byli schopni infekci kompletně vyléčit při ponechání celého funkčního systému in situ. Pacient dostával kombinaci antibiotik 6 týdnů – Rifampicin (Eremfat, StadaArzneimittel®) 300 mg po 8 hod. a ofloxacin (Ofloxin, Zentiva®) 400 mg po 12 hod. Jako základní antibiotikum byl použit Rifampicin pro svůj účinek na stafylokokový biofilm. Pacient podstoupil pouze jeden kratší následný operační zákrok v lokální anestezii – vyčištění a výplach rány s mechanickým očištěním hardwaru k odstranění vznikajícího biofilmu a opětovnou resuturu rány pouze monofilamentním stehem.
Peroperační komplikací bylo v jednom případě poranění jugulární žíly s významným krvácením, které vyžadovalo chirurgickou suturu žíly. Další peroperační komplikací byla přechodná asystolie při spuštění testovací sekvence. Po ukončení testování se spontánně obnovil pravidelný srdeční rytmus. Pacient pak měl v pooperačním období nastavovány stimulační parametry velice opatrně, ale bez jakýchkoliv obtíží a arytmií. Druhou komplikací z oblasti poruch srdečního rytmu byly těžké bradykardie v souvislosti se zapnutou stimulací s následnou nutností definitivního vypnutí VNS po dvou letech od implantace. Tři pooperační parézy zvratného nervu se velice lišily jak závažností, tak i průběhem. U prvního pacienta došlo okamžitě po operačním výkonu k rozvoji chrapotu bez dušnosti a vyšetření hlasivek ukázalo inkompletní parézu levé hlasivky. Pacient se spontánně zotavil během následujících několika měsíců. Druhý pacient byl v pooperačním období zcela bez obtíží. Dva týdny po operaci mu byly navýšeny stimulační parametry a došlo k rozvoji kompletní parézy levé hlasivky. Po vypnutí VNS pacient absolvoval foniatrickou léčbu a ke kompletnímu zotavení došlo během půl roku. Poté jsme opět zahájili léčbu VNS s navyšováním stimulačních parametrů po velice malých krocích a již bez dalších komplikací. Nejzávažnějšími komplikacemi byly paréza zvratného nervu a dysfagie u třetího pacienta – třináctileté dívky –, která vedla i k opakovaným aspiracím vyžadujícím antibiotickou terapii. Naštěstí i zde došlo ke spontánnímu zotavení všech funkcí, ale až v období jednoho roku od implantační operace.
Poruchy elektrody, dané většinou mechanickým prasknutím v krční oblasti, se nezařazují mezi chirurgické komplikace. U starších elektrod se spíše jedná o přirozenou únavu materiálu. Vzhledem k důležitosti sběru dat při sledování životnosti elektrod údaje přesto publikujeme. Prasklou nefunkční elektrodu jsme zaznamenali u pěti pacientů, tří mužů a dvou žen s průměrným věkem 20±16 let. Porucha funkce elektrody nastala 10,4±5,5 roku od implantace, respektive přesně – 15,4, 7,3, 12, 2,4 a 15 let od zavedení.
Diskuze
Varianty a modifikace operační techniky
Standardní technika implantace vagového stimulátoru byla popsána v mnoha studiích a v různých variantách je používána dodnes [6–8,10,23,31]. Stimulační elektroda se většinou umisťuje na levém vagovém nervu, protože pravý nerv inervuje sinoatriální uzel a jeho stimulace by mohla vést k bradykardii nebo asystolii [32]. Pacientům, u nichž levostranná implantace není možná (infekce, riziko poranění cév), je však za pečlivého monitorování srdečního rytmu možno provést i pravostrannou implantaci. To bylo nejdříve prokázáno studií na zvířecím modelu [33] a poté referováno v několika studiích na malých souborech pacientů či kazuistik [34–36]. Další technickou variantou je implantace metodou jedné incize [37,38]. Z transverzální incize v dolní části krku je umístěna jak elektroda na vagový nerv, tak provedena podkožní disekce pod klíčkem a umístěn generátor. Hlavní nevýhodou tohoto postupu je hlavně riziko poškození elektrody při výměně generátoru a dále jistě i kosmeticky větší jizva na krku. Z technického hlediska jsou možné různé varianty umístění generátoru. Kožní incize může být umístěna v přední axilární čáře vertikálně nebo horizontálně infraklavikulárně a generátor se může implantovat do podkožní nebo subpektorálně připravené kapsy [39]. Pro nespolupracující kognitivně postižené děti byla popsána i technika umístění generátoru VNS na záda interskapulárně k zabránění opakovanému škrábání a manipulacím s ránou, které vedly v předchozím pooperačním průběhu k rozpadu rány a sekundární infekci [40].
Komplikace – porovnání
Celková incidence komplikací v předchozích publikovaných souborech se pohybuje od 2,5 % do 16,8 % [17,24,41–43]. V našem souboru operací jsme zaznamenali komplikace u 9 pacientů (7,1 %).
Infekce patří mezi vážné komplikace spojené s operacemi VNS. Incidence pooperačních infekcí je podle publikovaných dat mezi 2–6 % [43–46]. Většina infekcí se klinicky projeví do čtyř týdnů od implantace jako zarudnutí a otok rány, často bývá i depo tekutiny nebo hnisu v podkoží. Celkové příznaky, jako horečka a schvácenost, velice často nemusejí být přítomny. Stejně tak může být i normální vyšetření hladiny C-reaktivního proteinu (CRP) a množství bílých krvinek (WBC). Zánět může postihnout ránu v krční oblasti nebo častěji na hrudníku v oblasti implantace generátoru. Infekce rány v oblasti generátoru se také nazývají „pocket infections“ [47]. Nejčastějším vykultivovaným patogenem je Staphylococcus aureus. Jako rizikový faktor VNS infekcí byl prokázán nízký body mass index (BMI) a nižší inteligenční kvocient (IQ) [48]. Jednoznačný postup léčby pooperačních VNS infekcí není zcela jasný. Standardním a nejagresivnějším postupem je chirurgické vyjmutí celého systému jako cizího tělesa, vyčištění ran a podání systémových antibiotik podle výsledků kultivací a citlivosti [16,45,46]. Po zhojení infekce je pak možné uvažovat o reimplantaci systému. Tento postup zatíží pacienta rozsáhlejším výkonem s nutností opětovné disekce vagového nervu z jizvy v oblasti krčního cévního svazku a v případě reimplantace by se jednalo o další preparaci nervu a další eventuální riziko poškození [45,49,50]. Samotná antibiotická léčba infekce většinou krátkodobě potlačí klinické projevy, ale v dlouhodobém horizontu dochází velice často k recidivě (73–100 %) [47,51]. Jedním z důvodů může být vytvoření biofilmu na povrchu implantovaného hardwaru s omezeným průnikem antibiotik [52]. Protože nejčastějším patogenem je při těchto infekcích Staphylococcus aureus, nejvhodnější volbou do antibiotické kombinace je Rifampicin jako nejúčinnější lék proti stafylokokovému biofilmu [52–54]. Vzhledem k omezené účinnosti samotných antibiotik byly navrženy a publikovány některé postupy léčby s částečným nebo kompletním zachováním hardwaru (salvage procedures) [55,56].
Poruchy srdečního rytmu po operacích VNS jsou spíše vzácné a ve shodě s našimi zkušenostmi se dělí na peroperační a s opožděným nástupem účinku [57,58]. Peroperační bradykardie nebo asystolie jsou spouštěny zahájením testovací sekvence. Dle publikovaných dat i naší zkušenosti se však již v dalším pooperačním období nijak neprojevují a nebrání ve využití VNS. Druhá skupina poruch srdečního rytmu vzniká při navyšování stimulačních parametrů a svým negativním účinkem na pacienta může vést až k nutnosti vypnutí či odstranění vagového stimulátoru.
Poškození či zlomenina elektrod se v publikovaných souborech udává mezi 6,5 až 8 % [41−43,59]. Ojediněle je poškození elektrody v souvislosti s proběhlým úrazem v oblasti krku [60], ve většině případů ale dochází k malfunkci elektrody bez jasného vyvolávajícího momentu.
Publikovaná data ukazují pooperační incidenci poranění zvratného nervu u 1–5,6 % pacientů [6,24,41–43,50]. U většiny z nich však naštěstí dojde ke spontánnímu zotavení. V námi prezentovaném souboru došlo u tří pacientů k přechodné paréze zvratného nervu (2,4 %).
Vývoj vagové stimulace
Budoucnost vagové stimulace se jistě bude dále rozvíjet v technické rovině – vývoj longitudinálních elektrod či metod neinvazivní vagové stimulace [61,62]. Další možností je rozšíření spektra indikací pro VNS i mimo epilepsii. Dalšími možnými indikačními směry jsou deprese, chronické srdeční selhání, chronické bolesti hlavy a revmatoidní artritida [46].
Závěr
Péče o pacienty s farmakorezistentní epilepsií probíhá v multidisciplinárním týmu v epileptochirurgických centrech. Stimulace vagového nervu je možnou alternativou pro pacienty s farmakorezistentní epilepsií, u kterých není vhodná resekční operace. Implantace vagového stimulátoru je poměrně bezpečná operační technika.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Martin Bláha, Ph.D.
Neurochirurgická klinika dětí a dospělých
2. LF UK Praha a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: martin.blaha@fnmotol.cz
Zdroje
- Fisher RS, Acevedo C, Arzimanoglou A, et al. ILAE Official report: A practical clinical definition of epilepsy. Epilepsia 2014;55(4):475−482. doi:10.1111/epi.12550.
- Marusič P, Krijtová H. Kompenzovaný pacient s epilepsií − cesta a cíl. Neurol pro praxi 2011;12(6):407−410.
- Hovorka J. Farmakologická léčba epilepsie podle „guidelines“? Neurol pro praxi 2009;10(4):228−236.
- Brázdil M, Hadač J. Definice farmakorezistentní epilepsie, příčiny intraktability. In: Brázdil M, Hadač J, Marusič P, eds. Farmakorezistentní epilepsie. Triton, Praha 2011 : 11−22.
- Penry JK, Dean JC. Prevention of intractable partial seizures by intermittent vagal stimulation in humans: Preliminary results. Epilepsia 1990;31:S40-S43. doi:10.1111/j.1528-1157.1990.tb05848.x.
- Ben‐Menachem E, Mañon‐Espaillat R, Ristanovic R, et al. Vagus nerve stimulation for treatment of partial seizures: 1. A controlled study of effect on seizures. Epilepsia 1994;35(3):616−626. doi:10.1111/j.1528-1157.1994.tb02482.x.
- Ramsay RE, Uthman BM, Augustinsson LE, et al. Vagus nerve stimulation for treatment of partial seizures: 2. safety, side effects, and tolerability. Epilepsia 1994;35(3):627−636. doi:10.1111/j.1528-1157.1994.tb02483.
- Samadani U, Baltuch G. Vagus nerve stimulation. In: Baltuch G, Villemure J, eds. Operative techniques in epilepsy surgery. Thieme, New York 2009 : 149−157.
- Ben-Menachem E, Hamberger A, Hedner T, et al. Effects of vagus nerve stimulation on amino acids and other metabolites in the CSF of patients with partial seizures. Epilepsy Res 1995;20(3):221−227. doi:10.1016/0920-1211(94)00083-9.
- Landy HJ, Ramsay RE, Slater J, et al. Vagus nerve stimulation for complex partial seizures: Surgical technique, safety, and efficacy. J Neurosurg 1993;78(1):26−31. doi:10.3171/jns.1993.78.1.0026.
- Ng M, Devinsky O. Vagus nerve stimulation for refraktory idiopathic generalised epilepsy. Seizure 2004;13(3):176−178. doi:10.1016/S1059-1311(03)00147-X.
- Nei M, O’Connor M, Liporace J, et al. Refractory generalized seizures: Response to corpus callosotomy and vagal nerve stimulation. Epilepsia 2006;47(1):115−122. doi:10.1111/j.1528-1167.2006.00377.x.
- Rosenfeld WE, Roberts DW. Tonic andatonic seizures: What’s next – VNS or callosotomy? Epilepsia 2009;50(SUPPL. 8):25−30. doi:10.1111/j.1528-1167.2009.02232.x.
- Benbadis SR, Tatum WO, Vale FL. When drugs don’t work: An algorithmic approach to medically intractable epilepsy. Neurology 2000;55(12):1780−1784. doi:10.1212/WNL.55.12.1780.
- Yamamoto T. Vagus nerve stimulation therapy: Indications, programing, and outcomes. Neurol Med Chir (Tokyo) 2015;55(5):407−415. doi:10.2176/nmc.ra.2014-0405.
- Elliott RE, Morsi A, Kalhorn SP, et al. Vagus nerve stimulation in 436 consecutive patients with treatment-resistant epilepsy: long-term outcomes and predictors of response. Epilepsy Behav 2011;20(1):57−63. doi:10.1016/j.yebeh.2010.10.017.
- Elliott RE, Rodgers SD, Bassani L, et al. Vagus nerve stimulation for children with treatment-resistant epilepsy: a consecutive series of 141 cases. J Neurosurg Pediatr 2011;7(5):491−500. doi:10.3171/2011.2.PEDS10505.
- Lancman G, Virk M, Shao H, et al. Vagus nerve stimulation vs. corpus callosotomy in thetreatment of Lennox-Gastaut syndrome: a meta-analysis. Seizure 2013;22(1):3−8. doi:10.1016/j.seizure.2012.09.014.
- Spanaki MV, Allen LS, Mueller WM, et al. Vagus nerve stimulation therapy: 5-year or greater outcome at a university-based epilepsy center. Seizure 2004;13(8):587−590. doi:10.1016/j.seizure.2004.01.009.
- DeGiorgio CM, Schachter SC, Handforth A, et al. Prospective long-term study of vagus nerve stimulation for the treatment of refractory seizures. Epilepsia 2000;41(9):1195−1200. doi:10.1111/j.1528-1157.2000.tb00325.x.
- Chrastina J, Novak Z, Zeman T, et al. Single-center long-term results of vagus nerve stimulation for epilepsy: A 10-17 year follow-up study. Seizure 2018;59 : 41−47. doi:10.1016/j.seizure.2018.04.022.
- Englot DJ, Rolston JD, Wright CW, et al. Rates and predictors of seizure freedom with vagus nerve stimulation for intractable epilepsy. Neurosurgery. 2016;79(3):345−353.. Neurosurgery. 2016;79(3):345−353. doi:10.1227/NEU.0000000000001165.
- Reid SA. Surgical technique for implantation of the neurocybernetic prosthesis. Epilepsia 1990;31:S38−S39. doi:10.1111/j.1528-1157.1990.tb05847.x.
- Kuba R, Brázdil M, Kalina M, et al. Vagus nerve stimulation: Longitudinal follow-up of patients treated for 5 years. Seizure 2009;18(4):269−274. doi:10.1016/j.seizure.2008.10.012.
- Hallböök T, Lundgren J, Stjernqvist K, et al. Vagus nerve stimulation in 15 children with therapy resistant epilepsy; its impact on cognition, quality of life, behaviour and mood. Seizure 2005;14(7):504−513. doi:10.1016/j.seizure.2005.08.007.
- Malow BA, Edwards J, Marzec M, et al. Vagus nerve stimulation reduces daytime sleepiness in epilepsy patients. Neurology 2001;57(5):879−884. doi:10.1212/wnl.57.5.879.
- Dodrill CB, Morris GL. Effects of vagal nerve stimulation on cognition and quality of life in epilepsy. Epilepsy Behav. 2001;2(1):46-53. doi:10.1006/ebeh.2000.0148.
- Ghacibeh GA, Shenker JI, Shenal B, et al. The influence of vagus nerve stimulation on memory. Cogn Behav Neurol. 2006;19(3):119−122. doi:10.1097/01.wnn.0000213908.34278.7d.
- Sirven JI, Sperling M, Naritoku D, et al. Vagus nerve stimulation therapy for epilepsy in older adults. Neurology 2000;54(5):1179-1182. doi:10.1212/WNL.54.5.1179.
- Helmers SL, Wheless JW, Frost M, et al. Vagus nerve stimulation therapy in pediatric patients with refraktory epilepsy: Retrospective study. J Child Neurol 2001;16(11):843−848. doi:10.1177/08830738010160111101.
- Uthman BM, Wilder BJ, Penry JK, et al. Treatment of epilepsy by stimulation of the vagus nerve. Neurology 1993;43(7):1338−1345. doi:10.1212/wnl.43.7.1338.
- Randall WC, Ardell JL, Becker DM. Differential responses accompanying sequential stimulation and ablativ of vagal branches to dog heart. Am J Physiol – Hear Circ Physiol 1985;18(1). doi:10.1152/ajpheart.1985.249.1.h133.
- Krahl SE, Senanayake SS, Handforth A. Right-sided vagus nerve stimulation reduces generalized seizure severity in rats as effectively as left-sided. Epilepsy Res 2003;56(1):1−4. doi:10.1016/S0920-1211(03)00122-0.
- Navas M, Navarrete EG, Pascual JM, et al. Treatment of refractory epilepsy in adult patients with right-sided vagus nerve stimulation. Epilepsy Res 2010;90(1-2):1-7. doi:10.1016/j.eplepsyres.2010.04.007.
- McGregor A, Wheless J, Baumgartner J, et al. Right-sided vagus nerve stimulation as a treatment for refractory epilepsy in humans. Epilepsia 2005;46(1):91−96. doi:10.1111/j.0013-9580.2005.16404.x.
- Spuck S, Nowak G, Renneberg A, et al. Right-sided vagus nerve stimulation in humans: An effective therapy? Epilepsy Res 2008;82(2-3):232−234. doi:10.1016/j.eplepsyres.2008.08.003.
- Kumar R, Winston KR, Folzenlogen Z. Experience with a low single cervical incision for implantation of a vagus nerve stimulator: Technique and advantages. World Neurosurg 2015;84(6):1785−1789. doi:10.1016/j.wneu.2015.07.058.
- Patil AA, Chand A, Andrews R. Single incision for implanting a vagal nerve stimulator system (vnss): Technical note. Surg Neurol 2001;55(2):103−105. doi:10.1016/S0090-3019(01)00350-0.
- Bauman JA, Ridgway EB, Devinsky O, et al. Subpectoral implantation of the vagus nerve stimulator. Neurosurgery 2006;58(4 Suppl 2):ONS-322-5; discussion ONS-325-6. doi:10.1227/01.NEU.0000208975.19581.8A.
- Le H, Chico M, Hecox K, Frim D. Interscapular placement of a vagal nerve stimulator pulse generator for prevention of wound tampering. Pediatr Neurosurg. 2002;36(3):164−166. doi:10.1159/000048375.
- Révész D, Rydenhag B, Ben-Menachem E. Complications and safety of vagus nerve stimulation: 25 years of experience at a single center. J Neurosurg Pediatr. 2016;18(1):97−104. doi:10.3171/2016.1.PEDS15534.
- Spuck S, Tronnier V, Orosz I, et al. Operative and technical complications of vagus nerve stimulator implantation. Neurosurgery 2010;67(SUPPL. 2):489−494. doi:10.1227/NEU.0b013e3181f88867.
- Kahlow H, Olivecrona M. Complications of vagal nerve stimulation for drug-resistant epilepsy: a single center longitudinal study of 143 patients. Seizure 2013;22(10):827−833. doi:10.1016/j.seizure.2013.06.011.
- Ben-Menachem E. Vagus-nerve stimulation for the treatment of epilepsy. Lancet Neurol 2002;1(8):477−482. doi:10.1016/S1474-4422(02)00220-X.
- Couch JD, Gilman AM, Doyle WK. Long-term expectationsof vagus nerve stimulation: A look at battery replacement and revision surgery. Neurosurgery 2016;78(1):42−46. doi:10.1227/NEU.0000000000000985.
- Yang J, Phi JH. The present and future of vagus nerve stimulation. J Korean Neurosurg Soc 2019;62(3):344−352. doi:10.3340/jkns.2019.0037.
- Patel NC, Edwards MS. Vagal nerve stimulator pocket infections. Pediatr Infect Dis J 2004;23(7):681−683. doi:10.1097/01.inf.0000131632.25375.c7.
- Kuroda N, Fujimoto A, Okanishi T, et al. Low body mass index and low intelligence quotient are infection risk factors in vagus nerve stimulation. World Neurosurg 2019;130:e839−e845. doi:10.1016/j.wneu.2019.06.235.
- Aalbers MW, Rijkers K, Klinkenberg S, et al. Vagus nerve stimulation lead removal or replacement: surgical technique, institutional experience, and literature overview. Acta Neurochir (Wien) 2015;157(11):1917−1924. doi:10.1007/s00701-015-2547-9.
- Giordano F, Zicca A, Barba C, et al. Vagus nerve stimulation: Surgical technique of implantation and revision and related morbidity. Epilepsia 2017;58 : 85−90. doi:10.1111/epi.13678.
- Air EL, Ghomri YM, Tyagi R, et al. Management of vagal nerve stimulator infections: do they need to be removed? J Neurosurg Pediatr 2009;3(1):73−78. doi:10.3171/2008.10.PEDS08294.
- Jacqueline C, Caillon J. Impact of bacterial biofilm on the treatment of prosthetic joint infections. J Antimicrob Chemother 2014;69 Suppl 1:i37−40. doi:10.1093/jac/dku254.
- Jørgensen NP, Skovdal SM, Meyer RL, et al. Rifampicin-containing combinations are superior to combinations of vancomycin, linezolid and daptomycin against Staphylococcus aureus biofilm infection in vivo and in vitro. Pathog Dis 2016;74(4):ftw019. doi:10.1093/femspd/ftw019.
- Zimmerli W, Sendi P. Role of rifampin against Staphylococcal biofilm infections in vitro, in animal models, and in orthopedic-device-related infections. Antimicrob Agents Chemother 2019;63(2). doi:10.1128/AAC.01746-18.
- Wozniak SE, Thompson EM, Selden NR. Vagal nerve stimulator infection: a lead-salvage protocol. J Neurosurg Pediatr 2011;7(6):671−675. doi:10.3171/2011.4.PEDS10556.
- Ortler M, Luef G, Kofler A, et al. Deep wound infection after vagus nerve stimulator implantation: treatment without removal of the device. Epilepsia 2001;42(1):133−135. doi:10.1046/j.1528-1157.2001.23800.x.
- Ardesch JJ, Buschman HPJ, van der Burgh PH, et al. Cardiac responses of vagus nerve stimulation: Intraoperative bradycardia and subsequent chronic stimulation. Clin Neurol Neurosurg 2007;109(10):849−852. doi:10.1016/j.clineuro.2007.07.024.
- Schevchuck A, West MB. Late-onset advanced heart block due to vagal nerve stimulation. Am J Ther 2014;21(6):545−547. doi:10.1097/MJT.0b013e31828df0c7.
- Seçen AE. Lead fractures after vagal nerve stimulat or implantation. J Turkish Epilepsi Soc. 2018;25(3):136−140. doi:10.14744/epilepsi.2018.97659.
- Tran Y, Shah AK, Mittal S. Lead breakage and vocal cord paralysis following blunt neck trauma in a patient with vagal nerve stimulator. J Neurol Sci. 2011;304(1−2):132−135. doi:10.1016/j.jns.2011.02.022.
- Rong P, Liu A, Zhang J, et al. Transcutaneous vagus nerve stimulation for refractory epilepsy: a randomized controlled trial. Clin Sci (Lond) April 2014. doi:10.1042/CS20130518.
- Bucksot JE, Wells AJ, Rahebi KC, et al. Flat electrode contacts for vagus nerve stimulation. PLoSOne 2019;14(11):e0215191. doi:10.1371/journal.pone.0215191.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Morgagniho kýla – kazuistiky
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2020 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Technický vývoj robotické chirurgie
- Problematika nozokomiálních pneumonií
- Endovenózní laserová ablace vena saphena − střednědobé výsledky potvrzují trvalý uzávěr a možnost ošetřit více lézí během jednoho zákroku
- Implantace stimulátoru vagového nervu při léčbě epilepsie u 126 pacientů – chirurgická technika, komplikace
- Metastázy světlobuněčného karcinomu ledviny do pankreatu
- Komplikace dekompresivní kraniektomie u nemocných s kraniocerebrálním poraněním
- Morgagniho kýla – kazuistiky
- Primární perineální kýla: kazuistika
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Morgagniho kýla – kazuistiky
- Metastázy světlobuněčného karcinomu ledviny do pankreatu
- Implantace stimulátoru vagového nervu při léčbě epilepsie u 126 pacientů – chirurgická technika, komplikace
- Primární perineální kýla: kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



