-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chirurgická léčba nádorů gastroezofageální junkce
Autoři: P. Šmejkal; J. Šimša
Působiště autorů: Chirurgická klinika 1. LF UK a TN, přednosta: Doc. MUDr. Jaromír Šimša, Ph. D.
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 8, s. 449-453.
Kategorie: Postgraduální vzdělávání
Nádory gastroezofageální junkce neboli kardie tvoří po stránce etiologie, diagnostiky, klasifikace i léčby značně specifickou skupinu, která se v řadě aspektů odlišuje od nádorů žaludku. Do skupiny těchto nádorů řadíme subkardiální karcinom žaludku, vlastní nádory kardie a karcinomy distálního jícnu, jejichž střed leží do vzdálenosti 5 cm od gastroezofageální junkce. Pro stanovení diagnózy a předoperačního stagingu je klíčová horní endoskopie s odběrem vícečetných biopsií, CT vyšetření břicha a hrudníku a endoskopická ultrasonografie. Ta je dnes považována za nejpřesnější metodu pro T-a N-staging. Řada autorů dnes u nádorů kardie a distálního jícnu doporučuje i provedení PET-CT. Kombinace uvedených vyšetření většinou umožní poměrně přesně stanovit staging i klasifikaci nádoru. Z pohledu strategie léčby jsou nádory kardie specifickou skupinou, pro kterou se dosud užívané klasifikace ukázaly jako málo vyhovující. Pro tyto nádory proto Siewert se spolupracovníky z mnichovské chirurgické kliniky navrhli klasifikaci novou. Autoři definují nádory kardie jako expanze, jejichž střed se nachází do vzdálenosti 5 cm orálně nebo aborálně od anatomického přechodu jícnu a žaludku. Nádory kardie dělí do tří skupin, které se liší jak po stránce etiologie, tak i možnými směry šíření nádoru do odlišných spádových lymfatických uzlin. Pokud nádor postihuje více oblastí, zařazuje se do jedné ze skupin podle místa výskytu největší nádorové masy. Z klasifikace nádorů kardie následně vyplývá potřebný rozsah chirurgické léčby – Tab. 1. Jako typ I označuje Siewert adenokarcinom distálního jícnu, který vzniká v terénu intestinální metaplazie v Barrettově jícnu. Nádor může infiltrovat ezofagogastrickou junkci shora. Typ II – vlastní adenokarcinom kardie – vychází z epitelu kardie nebo z malých přechodových segmentů intestinální metaplazie v ezofagogastrické junkci. Poslední skupinu tvoří subkardiální adenokarcinom žaludku – typ III, který vychází z oblasti žaludku a orálním směrem může ezofagogastrickou junkci infiltrovat odspodu [1–7, 8, 9, 10, 11].
Tab. 1. Klasifikace nádorů gastroezofageálního přechodu podle Siewerta [8] ![Klasifikace nádorů gastroezofageálního přechodu podle Siewerta [8]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/420e8b8a49a7c29db51e2170ae330d6f.png)
Pro obecné hodnocení rozsahu nádoru a zařazení do klinického stadia je stále nejpoužívanější TNM systém. Poslední, 7. vydání TNM klasifikace vyšlo v roce 2009, v České republice ji publikoval ÚZIS v roce 2011. V případě nádorů jícnu a kardie přineslo 7. vydání poměrně zásadní změny v rozšíření pohledu na spádové lymfatické uzliny u nádorů jícnu a gastroezofageální junkce. Podle této klasifikace jsou za spádové lymfatické uzliny považovány všechny uzliny podél krčního, hrudního i břišního jícnu kromě uzlin supraklavikulárních, a to nyní již bez ohledu na lokalizaci primárního nádoru [23]. Pro možnost srovnání výsledků lymfadenektomie různého rozsahu byly spádové lymfatické uzliny rozděleny do jednotlivých oblastí. Jejich přehled a pravděpodobnost metastatického postižení v závislosti na typu nádoru v oblasti gastroezofageální junkce uvádí Tab. 2.
Tab. 2. Spádové lymfatické uzliny a pravděpodobnost jejich postižení (%) u jednotlivých podtypů nádorů kardie podle Siewerta [8, 9] ![Spádové lymfatické uzliny a pravděpodobnost jejich postižení (%) u jednotlivých podtypů nádorů kardie podle Siewerta [8, 9]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/80700008ec14d8582626af8554560d22.png)
Symptomatologie nádorů gastroezofageální junkce je poměrně heterogenní a mění se v závislosti na pokročilosti onemocnění. Délka trvání příznaků nemusí nutně korelovat se stadiem onemocnění ani jeho resekabilitou. Většina pacientů s časným karcinomem je asymptomatická. V těchto případech bývá nádor spíše náhodným nálezem při rutinním vyšetření nebo při vyšetření pro jiné nesouvisející onemocnění. Nejčastěji si nemocní stěžují na mírnou bolest v epigastriu a za dolní částí hrudní kosti nebo na problémy s polykáním. U pokročilých nádorů je nejčastějším příznakem dysfagie, která se vyskytuje v 80–95 %. Problém s polykáním se zpravidla nejdříve objevuje u tuhé stravy. Nemožnost příjmu tekutin je většinou již známkou kompletního uzávěru jícnu. Při jídle si nemocní zprvu často pomáhají zapíjením jídla vodou, která jim polykání zúženým jícnem usnadňuje. Velká část nemocných však i dnes přichází s úplnou afagií a velkou ztrátou váhy. U pokročilých stenóz je častým příznakem také regurgitace, která se zhoršuje zejména v noci v horizontální poloze. U těchto osob je vysoké riziko aspirace a dalších plicních komplikací [12–15].
Léčba nádorů kardie je komplexní a závisí na stadiu onemocnění, lokalizaci nádoru a celkovém stavu pacienta. Zahrnuje endoskopickou léčbu u vybraných časných nádorů (Tis a T1), radikální výkony chirurgické, terapii onkologickou a jejich kombinace. Řada nemocných přichází bohužel ve IV. stadiu onemocnění, kde je možná jen péče paliativní. Primární chirurgická léčba je indikovaná u pacientů s časnými nádory (Tis a T1), které nelze ošetřit endoskopicky a kteří jsou schopni radikální výkon podstoupit. Od stadia T2N1 výše je indikována neoadjuvantní chemo - nebo chemoradioterapie, po které následuje léčba chirurgická. U místně pokročilých T4 nádorů je cílem neoadjuvantní chemoradioterapie downstaging a dosažení operability. Nemocní, u kterých špatný celkový stav nebo generalizace onemocnění nedovolují radikální léčbu, je indikovaná péče paliativní (stent, paliativní léčba onkologická).
Endoskopická resekce mukózy nebo endoskopická submukózní disekce jsou dnes uznávanou variantou kurativní léčby u přesně definované skupiny časných intramukózních karcinomů. Někteří autoři uvádějí možnost endoskopické resekce i u nádorů postihujících vrchní část submukózy. Indikační kritéria jsou poměrně přísná a zahrnují nádory menší než 20 mm, dobře nebo středně diferencované (G1-2), bez lymfatické a cévní invaze a příznivého makroskopického typu (I, IIa-b). Podmínkou kurativního endoskopického výkonu jako definitivní varianty léčby jsou volné laterální i hluboké okraje resekovaného vzorku, ke kterým nádor nedosahuje [16, 17, 18, 19]. Technika, zpracování vzorku i následné sledování nemocných jsou obdobné jako u karcinomu žaludku a jsou podrobně popsány v předchozí části této postgraduální kapitoly.
Chirurgická léčba nádorů kardie spočívá buď v totální gastrektomii s resekcí abdominálního jícnu (Siewertův typ II a III), nebo v subtotální ezofagektomii s resekcí proximální části žaludku (Siewertův typ I). O tom, který z obou uvedených výkonů bude nutný, však často není možné před operací rozhodnout. Z těchto důvodů by měl být každý nemocný s nádorem v oblasti kardie chystán k dvoudutinovému výkonu. Totální gastrektomie pro typ II a III podle Siewerta byla podrobně popsána v předchozí části. V této práci se proto budeme zabývat výhradně dvoudutinovými výkony pro nádory postihující distální jícen a kardii shora (typ I podle Siewerta), které nelze ošetřit z laparotomického přístupu s rozšířením bráničního hiátu. Při zvažování operace je klíčový nejen rozsah primárního nádoru, ale i celkový stav nemocného a jeho únosnost k thorakotomii. U osob s interními komorbiditami má být proto v rámci předoperačního vyšetření vždy zváženo provedení spirometrie a funkčních zátěžových testů – echokardiografie a spiroergometrie. Váhový úbytek provází většinu nemocných s nádorem v oblasti kardie nebo distálního jícnu a je způsoben jak vlastním nádorovým onemocněním, tak i poruchou příjmu stravy. Velká ztráta váhy sama o sobě není kontraindikací operace, přestože váhový pokles o 20 % a více je považován za významný negativní prognostický faktor stran operability. Tito nemocní mohou profitovat z neoadjuvantní léčby, po které většinou přibývají na váze. V rámci zajištění operace zavádíme před výkonem nebo po úvodu do anestezie centrální žilní katetr, epidurální katetr a žaludeční sondu. Vhodná je invazivní monitorace arteriálního tlaku, většinou cestou arteria radialis. Intubace se provádí biluminální kanylou pro možnost kolapsu jedné plíce. Zda se operace začne transthorakálně nebo z přístupu laparotomického, se rozhoduje individuálně. Oba postupy mají své výhody i rizika. I karcinom hrudního jícnu může být inoperabilní z důvodu nálezu v břiše (neodstranitelné pakety uzlin při truncus coeliacus a v retroperitoneu, jaterní metastázy, peritoneální rozsev). U jasně operabilních nádorů se začíná laparotomií a po přípravě interponátu se pokračuje transthorakálně resekcí jícnu a provedením spojky. U sporně operabilních nálezů je lepší začít revizí vlastního nádoru v dutině hrudní a po jeho resekci a fázi abdominální se opět do hrudníku vrátit. Transthorakální resekce jícnu s radikální lymfadenektomií je metodou volby pro nádory postihující distální jícen a kardii shora (typ I podle Siewerta). Pro přístup do hrudníku se užívá pravostranná thorakotomie, která umožňuje nejen dostatečný přístup k jícnu, ale i k mediastinálním uzlinám, jejichž odstranění je nutné v rámci radikální lymfadenektomie. K náhradě resekovaného jícnu se ve většině případů používá tubulizovaný žaludek. Pouze v případě, že žaludek použít nelze, provádí se náhrada jícnu tenkým nebo tlustým střevem. Operace se provádí v celkové anestezii při selektivní ventilaci plic. Výkon začínáme abdominální fází ze střední nebo příčné laparotomie. Příčné řezy v poslední době preferujeme pro lepší přehled v oblasti hiátu, dobrou subjektivní toleranci i nižší frekvenci pooperačních kýl. Po laparotomii je vždy nutná revize celé peritoneální dutiny. Pozornost věnujeme zejména oblasti truncus coeliacus, kde se nejčastěji vyskytuje metastatické postižení regionálních lymfatických uzlin. Přístup k hiátu usnadňuje uvolnění levého laloku jaterního protětím ligamentum triangulare hepatis sinistrum. Po protětí peritonea, frenoezofageální membrány a malého omenta uvolníme abdominální jícen a kardii s nádorem. Prorůstání nádoru do bráničních crus není kontraindikací k výkonu, v případě invaze nádoru má být vždy učiněn pokus o jejich radikální resekci. Následuje uvolnění celého žaludku a resekce omenta. Při protínání gastrokolického vazu je klíčové šetření arteria gastroepiploica dextra, která je jedinou nutriční tepnou tubulizovaného žaludku. Uvolnění sleziny vyžaduje podvaz a protětí arteriae et venae gastricae breves. Splenektomii provádíme pouze při blízkosti nebo přímém prorůstání nádoru nebo rozsáhlém postižení hilových uzlin. Velmi opatrně se musí postupovat v místě často se vyskytující komunikující žíly mezi vena colica media a vena gastroepiploica dextra. Distálně je mobilizace ukončena uvolněním duodena a hlavy slinivky pomocí Kocherova manévru. Pokračujeme při malém zakřivení uvolněním arteria gastrica sinistra a jejím podvazem těsně při odstupu z truncus coeliacus. V rámci lymfadenektomie má být odstraněna veškerá tuková tkáň s uzlinami nad horní hranou pankreatu od sleziny přes oblast truncus coeliacus podél hepatické arterie k ligamentum hepatoduodenale. Po protětí abdominálního jícnu se provádí resekce kardie s nádorem a s přilehlou částí malé kurvatury. Tubulizací žaludku s pomocí lineárního stapleru je připravena náhrada jícnu – Obr. 1.
Obr. 1. Operační nález: tubulizovaný žaludek s výživou cestou arteria gastroepiploica dextra připravený pro rekonstrukci na konci abdominální fáze výkonu 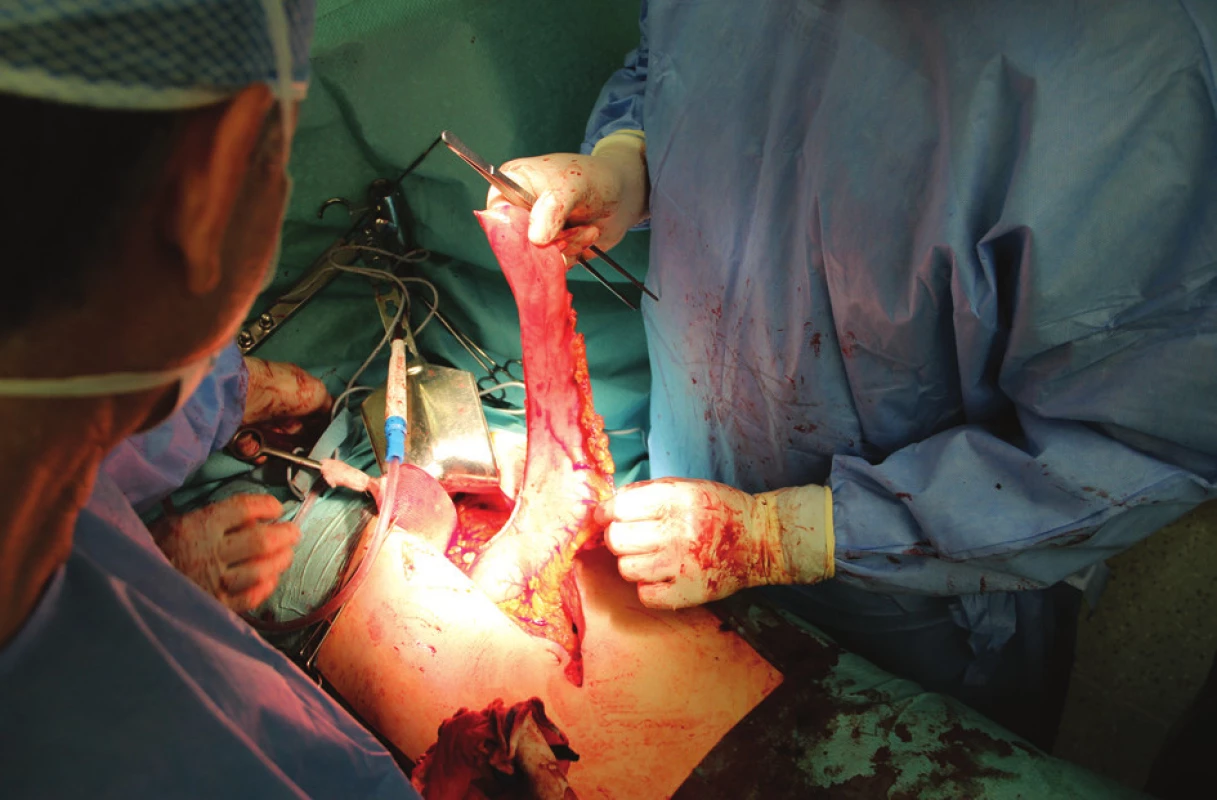
Staplerovou suturu většinou ještě přešíváme pokračujícím PDS stehem. Pyloroplastika se již většinou neprovádí, za dostatečnou dnes většina chirurgů považuje divulzi pyloru. Brániční hiatus rozšiřujeme protětím části bráničních crus, aby nehrozilo uskřinování cévního zásobení tubulizovaného žaludku s následnou ischemií a dehiscencí nitrohrudní anastomózy. Oblast levého subfrenia standardně drénujeme. Není-li možné pro rekonstrukci použít žaludek, např. z důvodu nutnosti provedení totální gastrektomie, používá se pro náhradu jícnu tenké nebo tlusté střevo. Tenké střevo je vhodné jen pro spojky na distální jícen, dosažení vyšší etáže většinou neumožňuje délka závěsu střeva. Standardní technikou je anastomóza jícnu na exkludovanou kličku podle Rouxe. Při použití tračníku se nejčastěji využívá jeho pravá část. Při mobilizaci střeva je většinou nutné podvázat ileokolickou i pravou kolickou tepnu. Výživu jícnové náhrady zajišťuje arteria colica media. Vzestupný tračník s distálním ileem se interponuje do hrudníku, následuje anastomóza ilea s jícnem intrathorakálně nebo na krku a anastomóza „dolů otočeného“ vzestupného tračníku s jejunem.
Po dokončení abdominální fáze a uzavření laparotomie následuje hrudní část výkonu. Prvním krokem je změna polohy nemocného do pozice na levém boku. Hrudník otevíráme pravostrannou posterolaterální thorakotomií v 6. nebo 7. mezižebří, která umožňuje dobrý přístup k jícnu i infrakarinálním mediastinálním uzlinám. Po revizi pleurální dutiny se otevírá mediastinální pleura nad jícnem, zjišťuje se rozsah nádoru a jeho event. prorůstání do okolních struktur. Jícen nad tumorem obcházíme a zavěšujeme na gumový drén. Tah za jícen usnadňuje mobilizaci nádoru s okolním tukem a uzlinami, preferována je resekce en block. Resekční linie na jícnu má být vedena minimálně 2 cm nad tumorem a vždy má být ověřena peroperačním histologickým vyšetřením. Při hrudní en block disekci se odstraňuje jícen, vena azygos, ductus thoracicus a okolní tuk s mediastinálními uzlinami. Hranicemi disekce jsou kraniálně oblouk vena azygos, laterálně levá a pravá mediastinální pleura a vpředu pars membranacea trachey, perikard a bránice. Vzadu ohraničují oblast disekce páteř a aorta, kaudálně pak brániční hiatus. Stav po dokončení resekce s radikální lymfadenektomií ukazuje Obr. 2.
Obr. 2. Operační nález při pravostranné thorakotomii: jícen přerušený nad nádorem s enterální sondou (velká bílá šipka), aorta po odstranění tukové tkáně s uzlinami po radikální lymfadenektomii (malá bílá šipka), pravá plíce (velká černá šipka) a bránice (malá černá šipka) 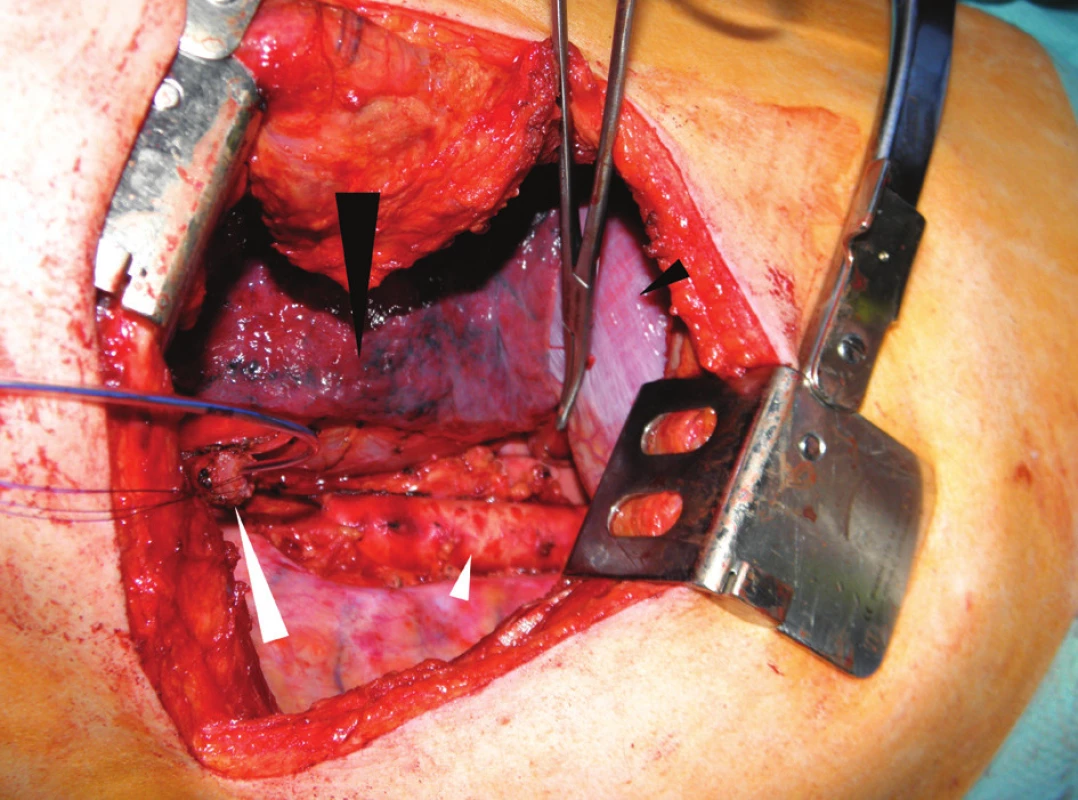
Disekce nad obloukem aorty musí být velmi opatrná, z důvodu nebezpečí poranění nervus laryngeus recurrens je nutné postupovat těsně u jícnu. Radikální lymfadenektomie pro karcinom distálního jícnu a kardie (Siewert typ I) by měla zahrnout odstranění uzlin ze všech následných oblastí: dolní paratracheální, subkarinální, perihilární, paraezofageální, uzliny z oblasti bráničního hiátu, kostovertebrální, uzliny kolem porta hepatis, horní retropankreatické a uzliny podél arteria hepatica, truncus coeliacus a arteria lienalis. Paratracheální disekce se u adenokarcinomu kardie rutinně neprovádí [20–22].
Po dokončení resekce a radikální lymfadenektomie následuje rekonstrukční fáze operace. Do hrudníku se bráničním hiátem vtahuje připravený interponát a provádí se anastomóza, buď end to end, nebo end to side – Obr. 3.
Obr. 3. Operační nález při pravostranné thorakotomii: tubulizovaný žaludek (bílá šipka) jako náhrada jícnu po dokončení anastomózy 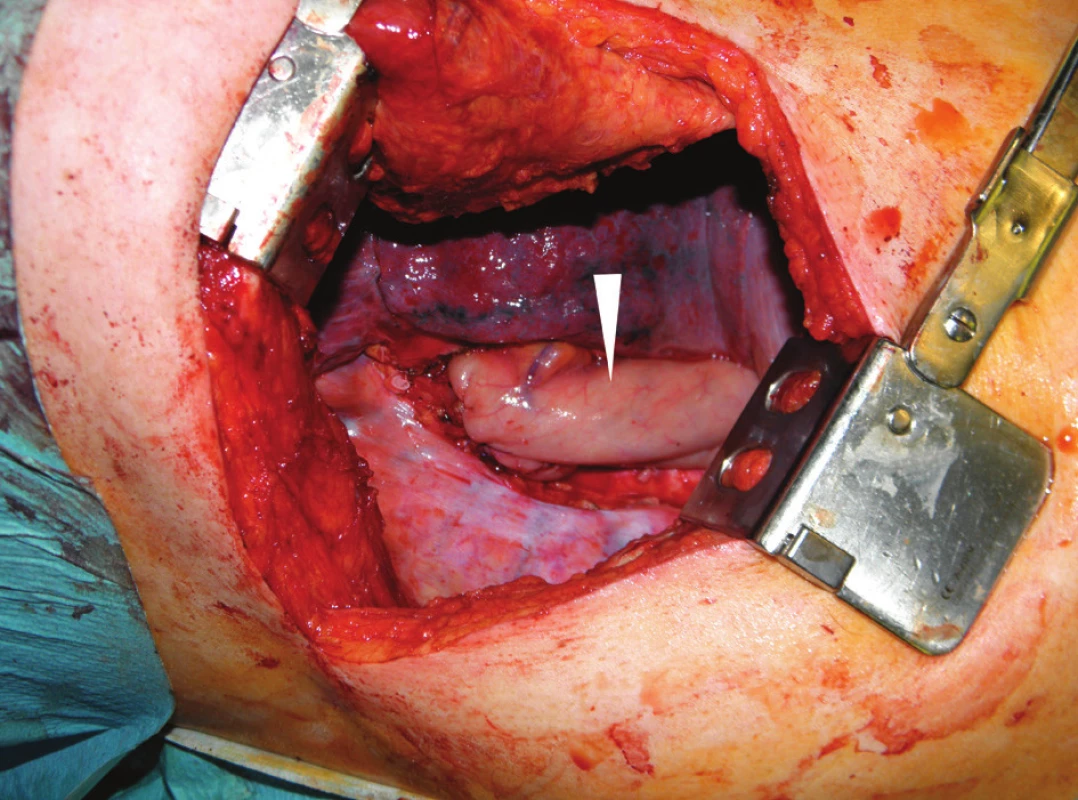
Technik provedení nitrohrudní anastomózy byla popsána celá řada: od jednotlivých stehů v jedné nebo ve dvou vrstvách přes steh pokračující až po anastomózy s využitím staplerů. Ty mohou být buď polomechanické (zadní stěna staplerem, přední pokračujícím stehem), nebo plně mechanické s využitím cirkulárního stapleru. Podle řady autorů však způsob rekonstrukce nerozhoduje o frekvenci anastomotických komplikací [21]. Někteří ještě doporučují překrýt anastomózu pleurou. Hrudní fázi výkonu ukončujeme zavedením hrudní drenáže do pravé pleurální dutiny. U pokročilých nádorů a u osob po neoadjuvantní léčbě bývá na jícen těsně nalepena i levá mediastinální pleura, a snadno tak může během výkonu dojít k otevření levé pleurální dutiny. V tomto případě je nutné drénovat obě pleurální dutiny. Po kontrole rozvinutí plíce ukončujeme výkon uzávěrem thorakotomie po vrstvách.
Technicky dokonalé provedení operace na pracovišti s dostatečným počtem každoročně odoperovaných osob, a tedy i zkušenostmi s řešením možných komplikací, je pro nemocné podstupující rozsáhlý dvoudutinový resekční výkon zásadní. Všem pacientům mají být před operací podána profylakticky antibiotika. Při operaci trvající déle než tři hodiny nebo při krevní ztrátě vyšší než 1500 ml podáváme druhou dávku antibiotik. Rutinně podáváme i inhibitory protonové pumpy ke snížení sekrece žaludeční sliznice. Většina pacientů je po výkonu extubována přímo na sále a převezena na JIP chirurgie. Kontinuální analgezie je zajištěna předoperačně zavedeným epidurálním katetrem, který ponecháváme přibližně 5–7 dní. Po stránce výživy preferujeme podávání nutrice peroperačně zavedenou tenkou enterální sondou. Pro pokrytí energetických a nutričních potřeb nemocného je první dny po operaci nutná plná parenterální výživa, většinou formou vaku all-in-one. Při nekomplikovaném průběhu a nízkých odvodech odstraňujeme 3.–4. pooperační den hrudní i břišní drény. Nasogastrickou sondu odstraňujeme většinou ještě dříve, a to v závislosti na velikosti odpadů a rychlosti obnovy pasáže. Od 4.–5. dne po operaci dovolujeme nemocným pít menší množství tekutin. U všech nemocných kontrolujeme 5.–7. pooperační den hojení anastomózy provedením kontrolní RTG pasáže jícnem vodnou kontrastní látkou. Při normálním RTG nálezu je možno přejít na tekutou dietu a následně kašovitou stravu. Při nekomplikovaném průběhu jsou pacienti propouštěni okolo 10. pooperačního dne.
MUDr. Přemysl Šmejkal
Chirurgická klinika 1. LF UK a Thomayerovy nemocnice
Vídeňská 800,
140 59 Praha 4 - Krč
e-mail: premysl.smejkal@ftn.cz
Zdroje
1. Lynch HT, Smyrk T, Lynch J. Genetics and cancer of the gastrointestinal tract. In Surgery for gastrointestinal cancer: A multidisciplinary approach. Edited by Harold J.Wanebo. Lippincott-Raven Publishers, Philadelphia 1997 : 59–86.
2. Schuchert MJ, Luketich JD, Landreneau RJ. Management of Esophageal Cancer. Curr Probl Surg, November 2010;47[11]: 845–946.
3. Wetscher GJ, Hinder RA, Smyrk T et al. Gastric acid blockade with omeprazole promotes gastric carcinogenesis induced by duodenogastric reflux. Dig Dis Sci 1999;44[6]:1132–5.
4. Haigh CR, Attwood SE, Thompson DG et al. Gastrin induces proliferation in Barrett’s metaplasia through activation of the CCK2 receptor. Gastroenterology 2003;124[3]:615–25.
5. Bateman DN, Colin-Jones D, Hartz S et al. Mortality study of 18 000 patients treated with omeprazole. Gut Jul 2003;52[7]:942–6.
6. Chow WH, Finkle WD, McLaughlin JK et al. The relation of gastroesophageal reflux disease and its treatment to adenocarcinomas of the esophagus and gastrin cardia. JAMA 1995; 274[6]:474–7.
7. Siewert RJ, Feith M, Werner M, Stein HJ. Adenocarcinoma of the esophagogastric junction: results of surgical therapy based on anatomical/topographic classification in 1002 consecutive patients. Ann Surg 2000;232 : 353–61.
8. Siewert JR, Stein HJ, Sendler A et al. Surgical resection for cancer of the cardia. Semin Surg Oncol 1999;17[2]:125–131.
9. Siewert JR, Bottcher K, Stein HJ et al. Problem of proximal third gastric carcinoma. World J Surg 1995;19[4]:523–531.
10. Hardwick RH, Wiliams GT. Staging of oesophageal adenocarcinoma. Br J Surg 2002;89 : 1076–7.
11. Esophagus and esophagogastric junction. In: Edge SB, American Joint Committee on Cancer, editors. AJCC Cancer Staging Manual, 7th edition. New York: Springer 2010 : 103–15.
12. Law SYK, Wong J. Managment of squamous cell carcinoma of the esophagus. In Esophageal surgery. 2nd ed. Edited by F.Griffith Pearson et al. Churchill Livingstone 2002;705–723.
13. Jaffer NM, Chia Sing Ho. Radiology, computed tomography and magnetic resonance imaging. In Esophageal surgery. 2nd ed. Edited by F.Griffith Pearson et al. Churchill Livingstone 2002 : 77–112.
14. Catalano MF, Sivak MV, Rice TW. Endosonographic features predictive of lymph node metastases. Gastrointest Endosc 1994;40 : 442.
15. Chung M, Chang HR. Clinical use of tumor markers in gastrointestinal malignancies. In Surgery for gastrointestinal cancer: A multidisciplinary approach. Edited by Harold J.Wanebo. Lippincott-Raven Publishers, Philadelphia 1997 : 97–104.
16. Ono H, Kondo H, Gotoda T et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut 2001;48 : 225–9.
17. Ell C, May A, Pech O et al. Curative endoscopic resection of early esophageal adenocarcinomas [Barrett’s cancer]. Gastrointest Endosc 2007;65 : 3–10.
18. Zehetner J, DeMeester SR, Jeffrey A. Hagen JA, Shahin Ayazi, Augustin F, Lipham JC, DeMeester TR. Endoscopic resection and ablation versus esophagectomy for high-grade dysplasia and intramucosal adenocarcinoma. J Thorac Cardiovasc Surg 2011;141 : 39–47.
19. Schuchert MJ, Luketich JD, Barrett’s Esophagus. In: Shields TW, ed. General Thoracic Surgery. Philadelphia: Wolters Kluwer/Lippincott Williams and Wilkins 2009 : 1925–36.
20. Rizzetto C, DeMeester SR, MD, Hagen JA, Peyre CG, Lipham JC, DeMeester TR. En block esophagectomy reduces local recurrence and improves survival compared with transhiatal resection after neoadjuvant therapy for esophageal adenocarcinoma. J Thorac Cardiovasc Surg 2008;135 : 1228–36.
21. Stephanie Worrell MS, Seemal Mumtaz MD, Kazuto Tsuboi MD, Tommy H, Lee MD, Sumeet K. Mittal. Anastomotic Complications Associated with Stapled Versus Hand-Sewn Anastomosis. Journal of Surgical Research 2010;161 : 9–12.
22. Wemys-Holden SA, Launois B, Maddern GJ. Managment of thoracic duct injuries after oesophagectomy. Br J Surg 2001;88 : 1442–8.
23. TNM klasifikace zhoubných nádorů – 7. vydání 2009, České vydání, UZIS 2011.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Karcinom žaludku
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 8- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Proběhly první elektronické volby do orgánů České chirurgické společnosti ČLS JEP
- 110 let od narození prof. MUDr. Vladislava Rapanta, DrSc.
- Chirurgická léčba jaterních metastáz karcinomu žaludku
- Porucha evakuace žaludku po parciální duodenopankreatektomii
- K-ras mutace a nádory infiltrující lymfocyty u karcinomu kolon, současnost a výhledy
- Poranenie brušnej steny cudzím telesom s neskorou perforáciou GITu
- Komplikace augmentace – kazuistika
- K životnímu jubileu prof. MUDr. Jiřího Hocha, CSc.
- 44. setkání Evropského pankreatického klubu
- Karcinom žaludku
- Endoskopická léčba časného karcinomu žaludku
- Chirurgická léčba karcinomu žaludku
- Chirurgická léčba nádorů gastroezofageální junkce
- Laparoskopické operace pro karcinom žaludku
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Komplikace augmentace – kazuistika
- Chirurgická léčba karcinomu žaludku
- Chirurgická léčba nádorů gastroezofageální junkce
- Chirurgická léčba jaterních metastáz karcinomu žaludku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



