-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
K-ras mutace a nádory infiltrující lymfocyty u karcinomu kolon, současnost a výhledy
K-ras mutational status and tumour-infiltrating lymphocytes in human colon cancer: state of the art and future perspectives
Introduction:
Nowadays, the prognosis of newly diagnosed colorectal cancer patients relies mostly on the tumour-node-metastasis (TNM) classification which is also a determining criterion for the indication of adjuvant oncological treatment. Currently, new prognostic and predictive biomarkers are sought after in order to more precisely define prognosis and better predict the benefits of adjuvant treatment in colorectal cancer. Besides several molecular biomarkers, such as mutations in the proto-oncogene K-ras, analyses of tumour-infiltrating lymphocytes have shown promising prognostic value. The aim of the study is to examine the correlations between K-ras mutational status and tumour-infiltrating immune cells in colon cancer patients with respect to colon cancer recurrence.Material and methods:
Formalin-fixed paraffin-embedded specimens were obtained from 44 patients with surgically resected colon cancer (R0 resection) treated between 2004 and 2009. K-ras mutational status was detected using PCR amplification of exon 1 followed by direct sequencing and K-ras StripAssay. Tumour-infiltrating immune cells were detected by immunofluorescence staining using monoclonal antibodies against CD3, CD8, FoxP3, CD1a and DC-LAMP.Results:
All 44 patients in our cohort underwent radical resection of colon cancer. In 16 patients the tumour relapsed (36.4%). K-ras mutations were found in 45.5% (n=20) of the primary carcinomas: 65% in codon 12 and 35% in codon 13. Although codon 13 K-ras mutations were associated with disease relapse, they were present in both disease-free and relapsed patients. However, disease-free and relapsed patients differed markedly in their patterns of tumour-infiltrating immune cells. There was a trend towards decreased density of tumour-infiltrating lymphocytes within the group of relapsed patients. In addition, relapsed patients with codon 13 mutations had markedly lower levels of tumour-infiltrating mature DC-LAMP+ dendritic cells and higher frequency of CD1a+ cells compared to disease-free patients.Conclusion:
Colon cancer patients with low levels of tumour-infiltrating lymphocytes, a high CD1a+/DC-LAMP+ tumour-infiltrating DC ratio and a K-ras mutation in codon 13 are at a high risk of disease recurrence.Keywords:
colorectal cancer – K-ras – tumour-infiltrating lymphocytes
Autoři: P. Kocian 1; M. Šedivcová 3; J. Drgáč 4; Karin Černá 3
; J. Hoch 1; R. Kodet 4; J. Bartůňková 2; R. Špíšek 2; A. Fialová 2
Působiště autorů: Chirurgická klinika 2. LF UK a FN v Motole 1; Ústav imunologie 2. LF UK a FN v Motole 2; Ústav patologie LF Plzeň 3; Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole 4
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 8, s. 427-432.
Kategorie: Původní práce
Práce byla věnována prof. MUDr. Jiřímu Hochovi, CSc. při příležitosti jeho významného životního jubilea.
Souhrn
Úvod:
Prognóza kolorektálního karcinomu v současné době vychází z TNM klasifikace, která je zároveň určujícím kritériem pro indikaci adjuvantní onkologické léčby. Aktuálním tématem je hledání nových prognostických a prediktivních biomarkerů, které povedou k selekci rizikových pacientů a racionalizaci adjuvantní onkologické léčby. Vedle řady molekulárních biomarkerů je jednou z možností analýza lymfocytů infiltrujících nádory. Cílem studie je stanovení mutace K-ras a analýza imunitních buněk infiltrujících nádorovou tkáň u pacientů s karcinomem kolon ve vztahu k recidivě onemocnění.Materiál e metodika:
Do retrospektivní studie bylo zařazeno 44 pacientů s karcinomem kolon, kteří podstoupili radikální chirurgický výkon (R0 resekce) v období 2004–2009. V parafinových řezech karcinomu kolon byly stanoveny mutace K-ras a provedena imunofluorescenční analýza imunitních buněk infiltrujících nádorovou tkáň (CD3, CD8, FoxP3, CD1a, DC-LAMP).Výsledky:
Všichni pacienti s karcinomem kolon (n=44) podstoupili radikální chirurgický výkon (R0 resekce). U 16 pacientů došlo k recidivě onemocnění (36,4 %). Mutace K-ras byla prokázána u 45,5 % (n=20) karcinomů: 65 % v kodonu 12 a 35 % v kodonu 13. Přestože mutace K-ras v kodonu 13 byla frekventní zejména mezi pacienty s recidivou onemocnění, vyskytovala se i ve skupině pacientů v remisi. Při podrobnější analýze pacientů s mutantní formou kodonu 13 byly nicméně mezi pacienty s recidivou onemocnění a pacienty v remisi zjištěny zásadní rozdíly v zastoupení imunitních buněk infiltrujících nádorovou tkáň. Byl prokázán trend ke klesajícímu množství lymfocytů infiltrujících nádory ve skupině pacientů s recidivou onemocnění. Navíc u pacientů s recidivou onemocnění bylo v nádorové tkáni detekováno pouze malé množství zralých dendritických buněk (DC-LAMP+) a naopak velké množství nezralých dendritických buněk (CD1a+) v porovnání se skupinou pacientů v remisi.Závěr:
Pacienti s mutantní formou kodonu 13, nízkou denzitou lymfocytů infiltrujících nádory a vysokým poměrem CD1a+/DC-LAMP+ buněk v nádorové tkáni mají vysoké riziko rekurence onemocnění.Klíčová slova:
kolorektální karcinom – K-ras – lymfocyty infiltrující nádoryÚVOD
Kolorektální karcinom je civilizačním onemocněním s významným socioekonomickým dopadem. Prognóza kolorektálního karcinomu v současné době vychází z TNM klasifikace, která je zároveň určujícím kritériem pro indikaci adjuvantní onkologické léčby. Zatímco pacienti v klinickém stadiu III (přítomnost uzlinového postižení) po radikálním chirurgickém výkonu z adjuvantní chemoterapie jednoznačně profitují, role adjuvantní léčby v klinickém stadiu II zůstává stále diskutabilní [1–3]. Při rozhodování o indikaci adjuvantní léčby zůstává v dnešní době jedinou možností posouzení klinických a histopatologických rizikových faktorů (nádor velikosti T4, angioinvaze, lymfatická invaze, perineurální šíření, stanovení N0 na základě vyšetření menšího počtu lymfatických uzlin než 12, nízká diferenciace nádoru G3-4, pozitivní resekční okraje, obstrukce či perforace střeva jako první projev nádoru, zvýšená hladina onkomarkeru CEA). Aktuálním tématem je hledání nových prognostických a prediktivních biomarkerů, které povedou k selekci rizikových pacientů napříč oběma klinickými stadii a racionalizaci adjuvantní onkologické léčby. Jinými slovy na základě laboratorního vyšetření těchto biomarkerů předurčit, zda bude další onkologická léčba pro pacienta přínosná ve srovnání s pouhým sledováním po radikální chirurgické resekci. V současné době jediným, rutinně používaným molekulárním biomarkerem je stav mutace K-ras. Tato mutace se vyskytuje přibližně u 30–50 % kolorektálních karcinomů [4–6] a ve více než 90 % případů je lokalizována v kodonu 12 a 13 [7]. Stanovení mutace K-ras je jednoznačným markerem absence léčebné odpovědi (non response) na léčbu inhibitory EGFR, tj. cetuximabem či panitumumabem (prediktivní biomarker)[8–10]. Naopak prognostický význam mutace K-ras zůstává stále kontroverzní. [11–13] Vedle řady molekulárních biomarkerů je jednou z možností analýza lymfocytů infiltrujících nádory (TILs). Existují důkazy pro to, že imunitní systém je schopen kontrolovat růst nádorových buněk, a to zejména v raných stadiích karcinogeneze. V boji proti nádorovým buňkám používá imunitní systém obě hlavní složky – systém přirozené imunity i systém imunity adaptivní (specifické T a B lymfocyty). Spojkou mezi oběma systémy jsou buňky dendritické, které hrají klíčovou roli v procesu zahájení plnohodnotné imunitní reakce. Nedávno publikovaná data získaná od pacientů s kolorektálním karcinomem prokazují, že přítomnost TILs je asociována s příznivou prognózou onemocnění [14–18]. Cílem této práce je stanovení mutace K-ras a analýza imunitních buněk infiltrujících nádorovou tkáň (včetně dendritických buněk) u pacientů s karcinomem kolon (zejména klinické stadium II a III) ve vztahu k relapsu onemocnění.
MATERIÁL A METODIKA
Do retrospektivní studie bylo zařazeno 44 pacientů s karcinomem kolon, kteří podstoupili radikální chirurgický výkon (R0 resekce) na Chirurgické klinice 2. LF UK a FN v Motole v období 2004–2009 (Tab. 1). Primárně byli vybráni pacienti s recidivou onemocnění a soubor byl doplněn o pacienty ze stejného období bez recidivy. Žádný pacient neabsolvoval neoadjuvantní onkologickou léčbu. Medián doby sledování byl 55 měsíců pro pacienty v remisi a 20 měsíců pro pacienty s recidivou onemocnění. V parafinových řezech karcinomu kolon byly vyšetřeny mutace K-ras pomocí PCR amplifikace exonu 1 následované přímým sekvenováním a K-ras StripAssay. Zastoupení jednotlivých subpopulací T lymfocytů a dendritických buněk, infiltrujících nádorovou tkáň, bylo identifikováno imunofluorescenčním značením parafinových řezů pomocí monoklonálních protilátek proti povrchovým a intracelulárním znakům (CD3, CD8, FoxP3, CD1a, DC-LAMP). Nádorové buňky byly charakterizovány pomocí protilátek proti cytokeratinu a proti proliferačnímu markeru Ki-67. Kvantitativní analýza imunitních buněk infiltrujících nádorovou tkáň (intraepiteliální a stromální lokalizace) byla provedena pomocí fluorescenčního mikroskopu Olympus FV300 (Obr. 1).
Tab. 1. Klinicko-patologická charakteristika pacientů Tab. 1: Clinicopathological features of patients 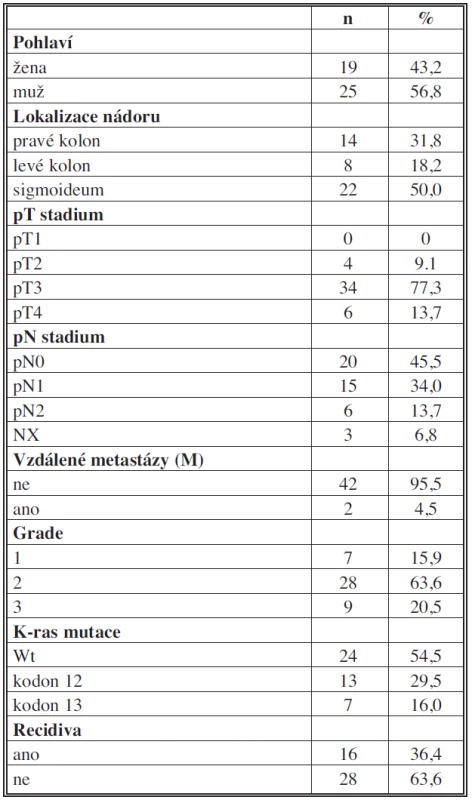
Obr. 1. Imunofluorescenční značení parafinových řezů Fig. 1: Immunofluorescent staining of paraffin sections 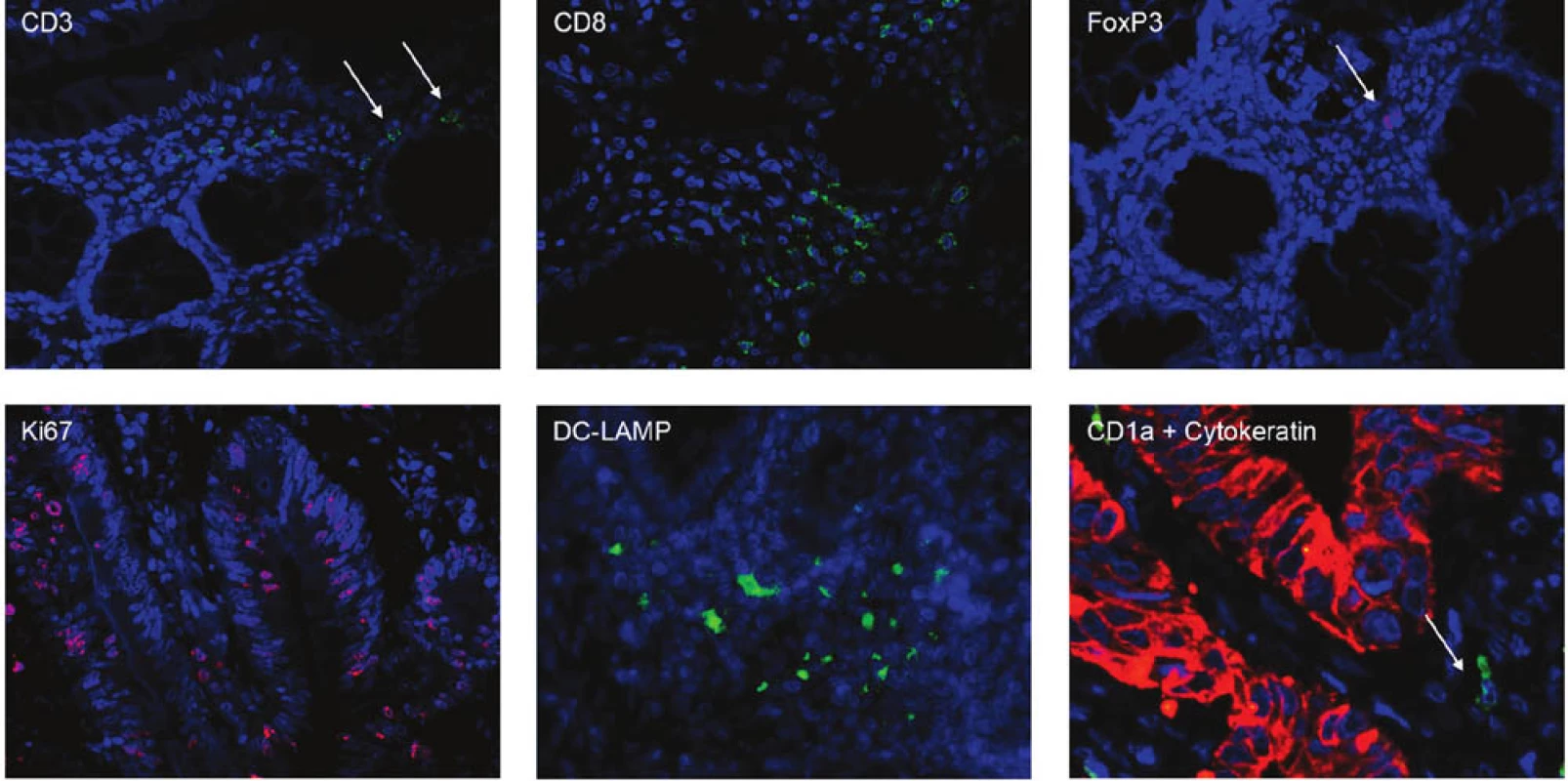
VÝSLEDKY
Všichni pacienti s karcinomem kolon (n=44) podstoupili radikální chirurgický výkon (R0 resekce). U dvou pacientů byla přítomna v době diagnózy solitární synchronní metastáza v játrech. V obou případech byla jaterní metastáza zresekována v jedné době s primárním karcinomem a bylo dosaženo R0 výkonu. U 16 pacientů došlo k recidivě onemocnění (36,4 %). Mutace K-ras byla prokázána u 45,5 % (n=20) karcinomů: 65 % v kodonu 12 a 35 % v kodonu 13. Karcinomy s mutantní formou kodonu 13 vykazovaly signifikantně vyšší proliferční aktivitu (vyšší poměr Ki67+ nádorových buněk) ve srovnání s karcinomy s mutantní formou kodonu 12 a wild-type karcinomy (bez mutace)(Graf 1). 57 % pacientů s mutantní formou kodonu 13 bylo asociováno s recidivou onemocnění ve srovnání pouze s 30,1 % a 33,3 % pacientů s mutantní formou kodonu 12 a wild type mutací (Graf 2). Přestože mutace K-ras v kodonu 13 byla frekventní zejména mezi pacienty s recidivou onemocnění, vyskytovala se i ve skupině pacientů v remisi. Při podrobnější analýze pacientů s mutantní formou kodonu 13 byly nicméně mezi pacienty s recidivou onemocnění a pacienty v remisi zjištěny zásadní rozdíly v zastoupení imunitních buněk infiltrujících nádorovou tkáň. Byl prokázán trend ke klesajícímu množství TILs ve skupině pacientů s recidivou onemocnění (Graf 3). Navíc u pacientů s recidivou onemocnění bylo v nádorové tkáni detekováno pouze malé množství zralých dendritických buněk (DC-LAMP+) a naopak velké množství nezralých dendritických buněk (CD1a+) v porovnání se skupinou pacientů v remisi. Pacienti s recidivou onemocnění měli signifikantně vyšší poměr nezralých/zralých dendritických buněk (CD1a+/DC-LAMP+ ratio) v nádorovém stromatu v porovnání s pacienty v remisi (Graf 4).
Graf 1. Zastoupení Ki67+ nádorových buněk ve vztahu k mutaci K-ras Wt (wild-type), pacienti bez přítomnosti mutace n=24; G12, pacienti s mutací v kodonu 12 n=13; G13, pacienti s mutací v kodonu 13 n=7. Graph 1: Proportions of Ki67+ tumour cells according to K-ras mutational status Wild-type (Wt) patients, n=24; patients with a mutation in codon 12 (G12), n=13; patients with a mutation in codon 13 (G13), n=7. 
Graf 2. Poměr pacientů v remisi/s recidivou ve vztahu k mutaci K-ras Wt (wild-type), pacienti bez přítomnosti mutace n=24; G12, pacienti s mutací v kodonu 12 n=13; G13, pacienti s mutací v kodonu 13 n=7 (bílé sloupce – pacienti v remisi, černé sloupce – pacienti s recidivou). Graph 2: Proportions of disease-free versus relapsed patients according to K-ras mutational status Wild-type (Wt) patients, n=24; patients with mutation in codon 12 (G12), n=13; patients with a mutation in codon 13 (G13), n=7. Columns represent the proportion of disease-free (white columns) or relapsed (black columns) patients classified according to K-ras mutational status. 
Graf 3. Rozdíly v zastoupení imunitních buněk infiltrujících nádorovou tkáň mezi pacienty s recidivou a pacienty v remisi s mutací v kodonu 13 (černé sloupce – nádorový epitel, bílé sloupce – nádorové stroma) Graph 3: Differences between patients with a codon 13 mutation of the K-ras gene with (relapse) and without (relapse) recurrence (black columns – immune cells inltrating the tumour epithelium; white columns – immune cells inltrating the tumour stroma) 
Graf 4. Poměr nezralých/zralých dendritických buněk (CD1a+/DC-LAMP+) v nádorové tkáni u pacientů s recidivou a u pacientů v remisi s mutací v kodonu 13 (černé sloupce – nádorový epitel, bílé sloupce – nádorové stroma) Graph 4: Ratio of CD1a+/DC-LAMP+ dendritic cells in patients with a codon 13 mutation of the K-ras gene with (relapse) and without (relapse) recurrence (black columns – immune cells inltrating the tumour epithelium; white columns – immune cells inltrating the tumour stroma) 
DISKUZE
V době biologické terapie již nelze spoléhat na klinické stadium podle TNM systému jako na jediný prostředek pro stratifikaci nemocných s kolorektálním karcinomem. Je to právě biologická léčba, která vyvolává naléhavou potřebu nových prediktivních a prognostických biomarkerů, které povedou k dalšímu zdokonalování v oblasti optimalizace a individuální specifikace adjuvantní chemoterapie. U pacientů s kolorektálním karcinomem je za tímto účelem velmi intenzivně studována mutace K-ras. Panuje široká shoda, že právě aktivační mutace K-ras na krátkém rameni chromozomu 12 v kodonu 12 a 13 patří mezi nejběžnější mutace u lidských maligních onemocnění. V případě kolorektálního karcinomu se mutace K-ras vyvíjí v časné fázi tumorigeneze, během progrese z adenomu na karcinom [19–21]. Výskyt K-ras mutace u kolorektálního karcinomu se pohybuje mezi 30–50 %. V naší kohortě pacientů s karcinomem kolon byla prokázána mutace K-ras v 45,5 % případů: 65 % v kodonu 12 a 35 % v kodonu 13, tedy v souladu s literárně udávanými daty [4–7]. Vzhledem k významu K-ras v rámci signální kaskády receptoru pro epidermální růstový faktor (EGFR) je stanovení mutace K-ras jednoznačným prediktivním markerem absence léčebné odpovědi (no response) na léčbu inhibitory EGFR, tj. cetuximabem či panitumumabem [8–10]. Přítomnost mutace K-ras vede k rezistenci nádoru vůči působení monoklonálních protilátek namířených proti EGFR, a tedy pouze pacienti s nemutovaným K-ras (wild-type K-ras) jsou vhodní pro tento druh terapie a lze u nich očekávat pozitivní terapeutickou odpověď (prediktivní marker). Naopak prognostický význam mutace K-ras zůstává stále kontroverzní [11–13]. Bazan et al. v prospektivní studii publikovali horší parametry přežití u pacientů s kolorektálním karcinomem s mutantní formou kodonu 13, zatímco pacienti s mutantní formou kodonu 12 byli asociováni s mucinózním typem karcinomu [4]. Obdobně v naší studii pacienti s karcinomem kolon s mutantní formou kodonu 13 byli asociováni s recidivou onemocnění a jejich karcinomy vykazovaly signifikantně vyšší proliferační aktivitu (vyšší poměr Ki67+ nádorových buněk) ve srovnání s karcinomy s mutantní formou kodonu 12 a wild type karcinomy. Mezi pacienty s mutantní formou kodonu 13 byly dále prokázány zásadní rozdíly v zastoupení imunitních buněk infiltrujících nádorovou tkáň. U pacientů s recidivou onemocnění bylo v nádorové tkáni (epitel, stroma) zastiženo pouze malé množství lymfocytů (TILs) a signifikantně vyšší poměr CD1a+/DC-LAMP+ buněk (nezralé/zralé dendritické buňky) ve srovnání s pacienty v remisi. Tyto výsledky podporují teorii protinádorového imunitního dohledu – podle něhož imunitní systém kontinuálně rozpoznává a odstraňuje maligní buňky v době jejich vzniku [22]. Nedávno publikovaná data získaná od pacientů s kolorektálním karcinomem prokazují, že právě přítomnost efektorových T lymfocytů v nádorové tkáni je asociována s příznivou prognózou onemocnění [14–18]. Naopak prognostický význam dendritických buněk infiltrujících nádorovou tkáň není stále objasněn [23]. Dendritické buňky patří mezi nejúčinnější antigen prezentující buňky, které hrají klíčovou roli v procesu zahájení plnohodnotné imunitní reakce. V organismu se vyskytují ve dvou vývojových stadiích – jako zralé a nezralé dendritické buňky. Zralé dendritické buňky jsou jediné, které dokážou aktivovat naivní T lymfocyty a tím zahájit primární specifickou imunitní odpověď, naopak v nezralém stavu se podílejí na indukci regulačních T lymfocytů, které specificky potlačují imunitní odpověď proti vlastním tkáním [24]. V souladu s výše uvedeným korelují výsledky i naší studie, u pacientů s recidivou onemocnění bylo v nádorové tkáni prokázáno malé množství zralých dendritických buněk (DC-LAMP+) a velké množství nezralých dendritických buněk (CD1a+) ve srovnání s pacienty v remisi. Pacienti s mutantní formou kodonu 13, nízkou denzitou lymfocytů (TILs) a vysokým poměrem CD1a+/DC-LAMP+ buněk v nádorové tkáni mají vysoké riziko rekurence onemocnění. Tito pacienti jsou vzhledem k přítomnosti K-ras mutace navíc rezistentní na léčbu inhibitory EGFR, a tudíž vystaveni vyššímu riziku úmrtí na nádorové onemocnění. Kombinací molekulárních biomarkerů s analýzou imunitních buněk infiltrujících nádorovou tkáň lze získat slibný prognostický faktor, pomocí kterého bude možné identifikovat rizikové pacienty s karcinomem kolon a racionalizovat adjuvantní onkologickou léčbu. S cílem porovnat infiltráty imunitních buněk u pacientů v remisi a s recidivou onemocnění, byli do souboru primárně vybráni pacienti s recidivou onemocnění (36,4 %) a soubor byl doplněn o pacienty ze stejného období bez recidivy. Pro statistiku bylo potřebné získání podobného počtu pacientů s recidivou a bez recidivy onemocnění.
ZÁVĚR
Pacienti s mutantní formou kodonu 13, nízkou denzitou lymfocytů (TILs) a vysokým poměrem CD1a+/DC-LAMP+ buněk v nádorové tkáni mají vysoké riziko rekurence onemocnění. Vzhledem ke skutečnosti, že tito pacienti jsou rezistentní na léčbu inhibitory EGFR, a tudíž vystaveni vyššímu riziku úmrtí na nádorové onemocnění, měli by být po radikálním chirurgickém výkonu indikováni k adjuvantní onkologické léčbě a pečlivému follow-up.
Seznam zkratek:
CEA – carcinoembryonic antigen
EGFR – epidermal growth factor receptor
K-ras – kirsten rat sarcoma viral oncogene homolog
PCR – polymerase chain reaction
TILs – tumor infiltrating lymphocytes
TNM – tumor node metastasis
MUDr. Petr Kocián
U Dívčích hradů 3289/22
150 00 Praha 5, Smíchov
e–mail: kocian.cz@gmail.com
Zdroje
1. Chau I, Cunningham D. Adjuvant therapy in colon cancer – what, when and how? Ann Oncol 2006;17(9):1347–59.
2. Chung KY, Saltz LB. Adjuvant therapy of colon cancer: current status and future directions. Cancer J 2007;13(3):192–7.
3. Van Cutsem E, Oliveira J. Primary colon cancer: ESMO clinical recommendations for diagnosis, adjuvant treatment and follow-up. Ann Oncol 2009;20 Suppl4 : 49–50.
4. Bazan V et al. Specific codon 13 K-ras mutations are predictive of clinical outcome in colorectal cancer patients, whereas codon 12 K-ras mutations are associated with mucinous histotype. Ann Oncol 2002;13(9):1438–46.
5. Bos JL et al. Prevalence of ras gene mutations in human colorectal cancers. Nature 1987;327(6120):293–7.
6. Boughdady IS et al. K-ras gene mutations in adenomas and carcinomas of the colon. Surg Oncol 1992;1(4):275–82.
7. Benvenuti S et al. Oncogenic activation of the RAS/RAF signaling pathway impairs the response of metastatic colorectal cancers to anti-epidermal growth factor receptor antibody therapies. Cancer Res 2007;67(6):2643–8.
8. De Roock W et al. KRAS wild-type state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cetuximab. Ann Oncol 2008;19(3):508–15.
9. Di Fiore F et al. Clinical relevance of KRAS mutation detection in metastatic colorectal cancer treated by Cetuximab plus chemotherapy. Br J Cancer 2007;96(8):1166–9.
10. Lievre A et al. KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cetuximab. J Clin Oncol 2008;26(3):374–9.
11. Andersen SN et al. K-ras mutations and prognosis in large-bowel carcinomas. Scand J Gastroenterol 1997;32(1):62–9.
12. Ince WL et al. Association of k-ras, b-raf, and p53 status with the treatment effect of bevacizumab. J Natl Cancer Inst 2005;97(13): 981–9.
13. Tortola S et al. p53 and K-ras gene mutations correlate with tumor aggressiveness but are not of routine prognostic value in colorectal cancer. J Clin Oncol 1999;17(5):1375–81.
14. Galon J et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science 2006;313(5795):1960–4.
15. Chiba T et al. Intraepithelial CD8+ T-cell-count becomes a prognostic factor after a longer follow-up period in human colorectal carcinoma: possible association with suppression of micrometastasis. Br J Cancer 2004;91(9):1711–7.
16. Naito Y et al. CD8+ T cells infiltrated within cancer cell nests as a prognostic factor in human colorectal cancer. Cancer Res 1998;58(16):3491–4.
17. Ohtani H. Focus on TILs: prognostic significance of tumor infiltrating lymphocytes in human colorectal cancer. Cancer Immun 2007;7 : 4.
18. Ropponen KM et al. Prognostic value of tumour-infiltrating lymphocytes (TILs) in colorectal cancer. J Pathol 1997;182(3): 318–24.
19. Forrester K et al. Detection of high incidence of K-ras oncogenes during human colon tumorigenesis. Nature 1987;327(6120): 298–303.
20. Pretlow TP et al. K-ras mutations in putative preneoplastic lesions in human colon. J Natl Cancer Inst 1993;85(24):2004–7.
21. Vogelstein B et al. Genetic alterations during colorectal-tumor development. N Engl J Med 1988;319(9):525–32.
22. Dunn GP et al. Cancer immunoediting: from immunosurveillance to tumor escape. Nat Immunol 2002;3(11):991–8.
23. Dadabayev AR et al. Dendritic cells in colorectal cancer correlate with other tumor-infiltrating immune cells. Cancer Immunol Immunother 2004;53(11):978–86.
24. Dhodapkar MV et al. Antigen-specific inhibition of effector T cell function in humans after injection of immature dendritic cells. J Exp Med 2001;193(2):233–8.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Karcinom žaludku
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 8- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Proběhly první elektronické volby do orgánů České chirurgické společnosti ČLS JEP
- 110 let od narození prof. MUDr. Vladislava Rapanta, DrSc.
- Chirurgická léčba jaterních metastáz karcinomu žaludku
- Porucha evakuace žaludku po parciální duodenopankreatektomii
- K-ras mutace a nádory infiltrující lymfocyty u karcinomu kolon, současnost a výhledy
- Poranenie brušnej steny cudzím telesom s neskorou perforáciou GITu
- Komplikace augmentace – kazuistika
- K životnímu jubileu prof. MUDr. Jiřího Hocha, CSc.
- 44. setkání Evropského pankreatického klubu
- Karcinom žaludku
- Endoskopická léčba časného karcinomu žaludku
- Chirurgická léčba karcinomu žaludku
- Chirurgická léčba nádorů gastroezofageální junkce
- Laparoskopické operace pro karcinom žaludku
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Komplikace augmentace – kazuistika
- Chirurgická léčba karcinomu žaludku
- Chirurgická léčba nádorů gastroezofageální junkce
- Chirurgická léčba jaterních metastáz karcinomu žaludku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



