-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Případ kombinace endoleaku Ib a IIIa typu po zavedení stentgraftu pro subrenální výduť aorty
A Case Report of Endoleak type Ib and IIIa Combination after Endovascular Subrenal Aneurysm Repair
Authors describe a case report of complications and theirs solutions after endovascular abdominal aneurysm repair. There was symptomatic progression of aneurysmal sac due to endoleak type Ib in this patient 4 years after successful stentgraft treatment. Endovascular treatment was done with optimal effect, but aneurysm sac rupture had early become. The patient was urgently operated. The cause of the rupture was endoleak type IIIa, that was diagnosed perioperatively. This complication was solved with direct suture of disconnected parts of stentgraft. Despite of postoperative complications the patient vas released home in a good condition after 23 days of hospital staying. Endoleaks and their management are discussed in the article.
Key words:
aneurysm of subrenal aorta – stentgraft – endoleak – aneurysm rupture
Autoři: S. Jiška; T. Daněk; Z. Bělobrádek; D. Dobeš 1; J. Raupach 2
Působiště autorů: Chirurgická klinika Lékařské fakulty UK v Hradci Králové a Fakultní nemocnice Hradec Králové, přednosta: doc. MUDr. A. Ferko, CSc. ; Fakulta vojenského zdravotnictví Univerzity obrany v Hradci Králové, děkan: plk. prof. MUDr. R. Prymula, Ph. D. 1; Radiologická klinika Lékařské fakulty UK v Hradci Králové a Fakultní nemocnice Hradec Králové, přednosta: prof. MUDr. P. Eliáš, Ph. D. 2
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 1, s. 24-27.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Autoři článku popisují případ komplikace léčby subrenální výdutě aorty zavedením stentgraftu a její řešení. V popisované kazuistice došlo u nemocného po čtyřech letech k progresi výdutě v důsledku endoleaku Ib typu. Bylo provedeno úspěšné endovaskulární ošetření, ale časně po tomto výkonu došlo k ruptuře výdutě. Pacient byl urgentně operován. Příčinou ruptury byl endoleak IIIa typu, který byl diagnostikován až peroperačně. Tato komplikace byla řešena přímou suturou rozpojených komponent stentgraftu. I přes pooperační komplikace byl nemocný propuštěný v celkově dobrém stavu do domácí péče po 23 dnech hospitalizace. V článku je zmíněna problematika endoleaků a jejich možné řešení.
Klíčová slova:
výduť subrenální aorty – stentgraft – endoleak – ruptura výdutěÚVOD
Aneuryzma subrenální aorty (AAA) je nejčastější výdutí vůbec. Incidence v populaci vyspělých zemí činí 3–6,6 % [1, 3, 4]. Výskyt v posledních desetiletích trvale stoupá jak absolutně (se stárnutím populace), tak i relativně (s rozvojem a dostupností diagnostických metod). K významnému nárůstu výskytu dochází u mužů po 55 roce a u žen po 70 roce života. Muži jsou postiženi 5–9x častěji [1, 2, 4]. Kouření je spojeno až s osminásobně častějším výskytem této choroby [1]. U starších hypertoniků se vyskytuje AAA v 10–12 % [1]. Většinou se jedná o polymorbidní pacienty (ischemická choroba srdeční 60–75 %, hypertenze 50 %, chronická obstrukční choroba plicní 25 %) [1, 4]. Pacienti s AAA mají rovněž častější výskyt výdutí v dalších lokalizacích (pánevní tepny, femoropopliteální segment, hrudní aorta) [1].
Nejzávažnějším klinickým projevem AAA je ruptura. Až ve 25 % jde o první projev výdutě vůbec. Celková letalita této komplikace dosahuje 90 %. U nemocných, kterým se dostane invazivní léčby, je letalita v 30–70 % [1, 2, 4]. Riziko ruptury stoupá s průměrem výdutě a s rychlostí jejího zvětšování [1, 4].
Léčebné možnosti AAA zahrnují postupy konzervativní, endovaskulární a chirurgické. Konzervativní léčba je určená pro nemocné s asymptomatickou výdutí do maximálního příčného průměru 55 mm, nedochází-li k jejímu zvětšování o více než 5 mm/6 měsíců [1]. V opačném případě jsou pacienti indikováni k elektivnímu řešení. U pacientů nad 80 let věku je možno postupovat konzervativně a intervenovat až při rozvoji komplikací. Konzervativní léčba zahrnuje především eliminaci ovlivnitelných rizikových faktorů (korekce hypertenze, nekouření…). Samozřejmostí jsou pravidelné kontroly zahrnující zobrazovací metodu (nejčastěji UZ vyšetření) k objektivnímu posouzení progrese výdutě [1, 4].
Symptomatické výdutě jsou, pro svou vysokou náchylnost k přechodu do ruptury, určeny k časné invazivní léčbě zavedením stentgraftu či operačně) [1].
Ruptura výdutě se z vitální indikace řeší urgentně chirurgicky. Jen u pacientů hemodynamicky stabilních je možné uvažovat (při dobré dostupnosti) o léčbě endovaskulární [1, 4].
Možnosti invazivní léčby jsou jak endovaskulární, tak chirurgické. Endovaslulární léčba zavedením stentgraftu je limitována jak morfologií výdutě (především vztahem k renálním tepnám, délkou a angulací proximálního krčku s přítomností trombu, či kalcifikací, distálním šířením aneuryzmatických změn…), tak i stavem přístupového řečiště (většinou cestou společných femorálních tepen) – angulací a stenozujícími procesy ilických tepen. Pracoviště s širokou nabídkou užívaných typů stentgraftů udávají technickou možnost zavedení stentgraftu okolo 40–80 % [1, 3]. Tato metoda nabízí hemodynamicky podstatně méně zatěžující řešení ve srovnání s operací (odpadá klamp aorty) a je tedy výhodnou alternativou léčby pro jinak vysoce rizikové pacienty [1, 2, 3].
Jako každá metoda, tak i zavedení stengraftu je spojeno s možnými komplikacemi. Z nespecifických komplikací se nejčastěji setkáváme s problémy kardiopulmonálními v 6,9 % (oproti 19,6 % při léčbě chirurgické), embolizací do periferie ve 3 % a renálním selháním ve 3 % (vlivem kontrastní látky, či embolizace). Při uzávěru obou vnitřních ilických tepen může vzniknout porucha erekce, pánevní dyskomfort, či hýžďové klaudikace (12–40 %) a stoupá i riziko ischemie tračníku. V místě zavádění může vzniknout hematom, pseudoaneuryzma, lymfatická píštěl, či rozvoj infektu [2, 3, 4]. Specifické komplikace vznikají v souvislosti se zaváděním stentgraftu. Mohou být ve spojitosti se zaváděcím systémem – disekce aorty, ilických tepen, či jejich perforace, zalomení či uvíznutí zavaděče, devastace až přetržení femorální tepny, nebo přímo souvisí se stentgraftem. Může dojít k jeho nesprávnému umístění, či migraci, trombóze až okluzi, zalomení, perforaci, infekci, či k přetrvávající perfuzi vaku výdutě (endoleaku) s možnou následnou rupturou [2, 3]. Primární endoleak (do 30 dnů od zavedení) by neměl být častější než v 10 % (většinou I a III typu) [3]. Sekundární endoleak se vyskytuje ve 20–40 % (většinou II typu) [2, 4]. Endoleak je nejčastější komplikací zavedení stentgraftu. Rozlišujeme 4 typy. Typ I – netěsnost v místě kotvení stentgraftu (Ia – proximální konec, Ib – distální konec, Ic kolem okludoru u uniiliakálního stentgraftu). Typ II – plnění z volných větví ústících do vaku. Typ III – netěsnost vlastního stentgraftu (IIIa – rozpojení jednotlivých komponent stentgraftu, IIIb porušením vlastní stěny stentgraftu). Typ IV je spojen se zvýšenou propustností neporušeného materiálu endoprotézy do 30 dnů od zavedení. Zvláštní komplikací je endotension, kdy dochází ke zvětšování vaku bez signifikantního endoleaku (cca v 1,5 %) [2, 3].
KAZUISTIKA
V únoru 2009 jsme na naší klinice urgentně operovali nemocného s rupturou AAA po zavedení stentgraftu. Jednalo se o 58letého muže, kterému byl zaveden bifurkační stentgraft před 4 roky na cizím pracovišti pro subrenální výduť aorty. Ze závažných přidružených chorob byla přítomna ischemická choroba srdeční (ICHS), stav po infarktu myokardu a aortokoronárním bypassu v roce 1996 s ejekční frakcí levé komory 20–25 %. Pro arytmickou formu ICHS byl chronicky léčen Warfarinem a Cordaronem. Dále pacient trpěl chronickou obstrukční chorobou bronchopulmonální. Nemocný byl pět dnů hospitalizován ve spádové okresní nemocnici pro bolesti břicha. Na UZ vyšetření zde diagnostikovali AAA průměru 11 cm bez známek prosakování (stacionární nález při opakovaných vyšetřeních). Během vyšetřování nebyl nalezen jiný zdroj obtíží nemocného, a tak bylo provedeno CT vyšetření s bolusem kontrastní látky, kde byl prokázán endoleak Ib typu v oblasti kotvení levého raménka stentgraftu a vysloveno i podezření na endoleak III typu (Obr. 1). Pracoviště zavádějící stentgraft nebylo v danou dobu schopno tuto komplikaci řešit, a proto byl pacient po domluvě přeložen do Fakultní nemocnice v Hradci Králové k endovaskulární léčbě. Zde byla provedena angiografie potvrzující endoleak v oblasti distálního konce levého raménka a výduť vnitřní ilické tepny vlevo (AII sin.). Endoleak III typu nebyl patrný (Obr. 2). Vazointervenční radiolog provedl nejprve embolizaci výdutě levé vnitřní iliky a následně vyřešil netěsnost levého raménka jeho extenzí do zevní ilické tepny zavedením dalšího stentgraftu. Na kontrolní angiografii po výkonu byl výsledek optimální, bez známek další netěsnosti (Obr. 3). Po endovaskulárním výkonu byl nemocný hospitalizován na JIP chirurgické kliniky. Za šest hodin této intervenci došlo k progredující hypotenzi s poklesem v krevním obraze. Bylo urgentně provedeno CT, kde byla zjištěna další progrese velikosti vaku na 12 cm a rozsáhlý retroperitoneální hematom (Obr. 4). Pacient byl z vitální indikace operován. Byl evakuován retroperitoneální hematom a po otevření vaku výdutě přítomno masivní tepenné krvácení v důsledku rozpojení těla stentgraftu a pravé ilické komponenty (až nyní bylo zjištěno, že jde o trojdílný stentgratf) (Obr. 5). Po naložení klampu subrenálně byla tato situace řešena přímou suturou dehiscentních komponent end to end (bez známek dalšího krvácení) s následnou resekcí a přešitím vaku výdutě (Obr. 6). Klamp aorty trval 15 min.
Obr. 1. CTA rekonstrukce ze spádové nemocnice. Šipky označují endoleaky Ib a suspektní III Fig. 1. A CTA reconstruction done in district hospitál. Arrows show endoleaks type I band suspicious III 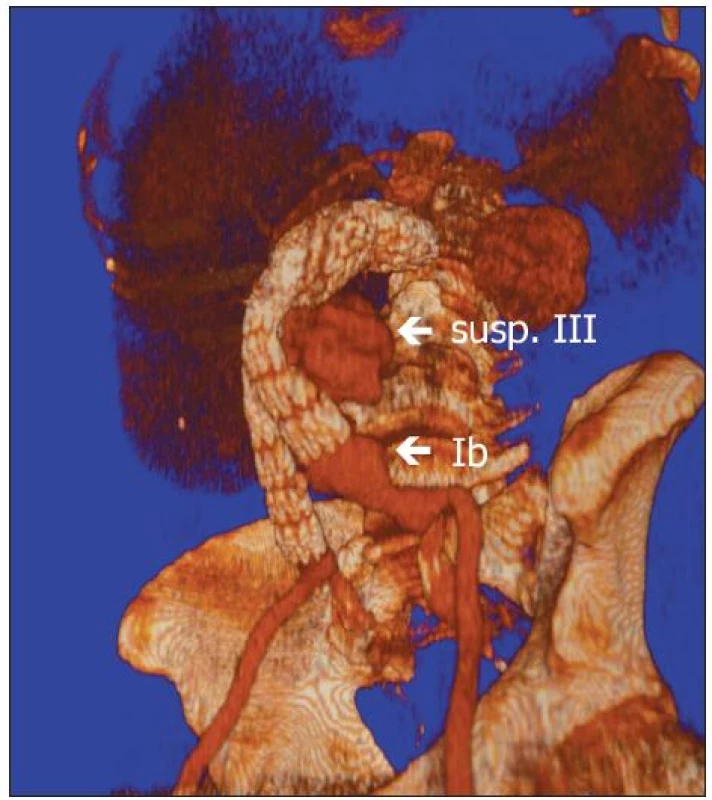
Obr. 2. Angiografie před ošetřením Ib endoleaku (zobrazena i embolizovaná výduť levé vnitřní ilické tepny) Fig. 2. An angiography before management of type Ib endoleak (with embolised aneurysm of left internal iliac artery) 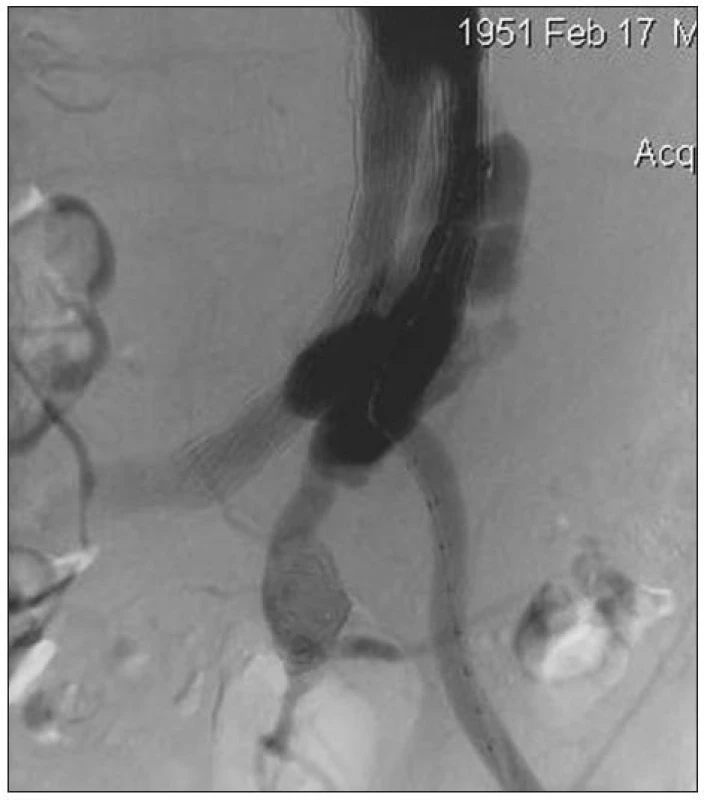
Obr. 3. Dobrý efekt extenze levého raménka stentgraftu (bez endoleaku) Fig. 3. Agood effect of left branch extension of stentgraft (no endoleak) 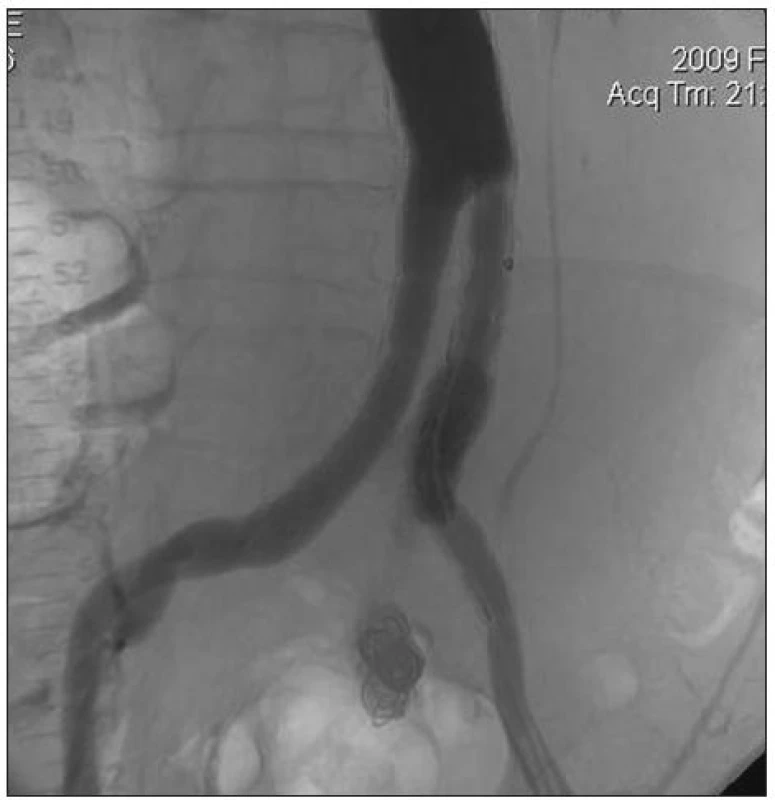
Obr. 4. Urgentní CT 6 hodin po endovaskulárním ošetření (zvětšení vaku, retroperitoneální hematom) Fig. 4. An urgent CT 6 hours after endovascular treatement (enlargement of sac, retroperitoneal hematoma) 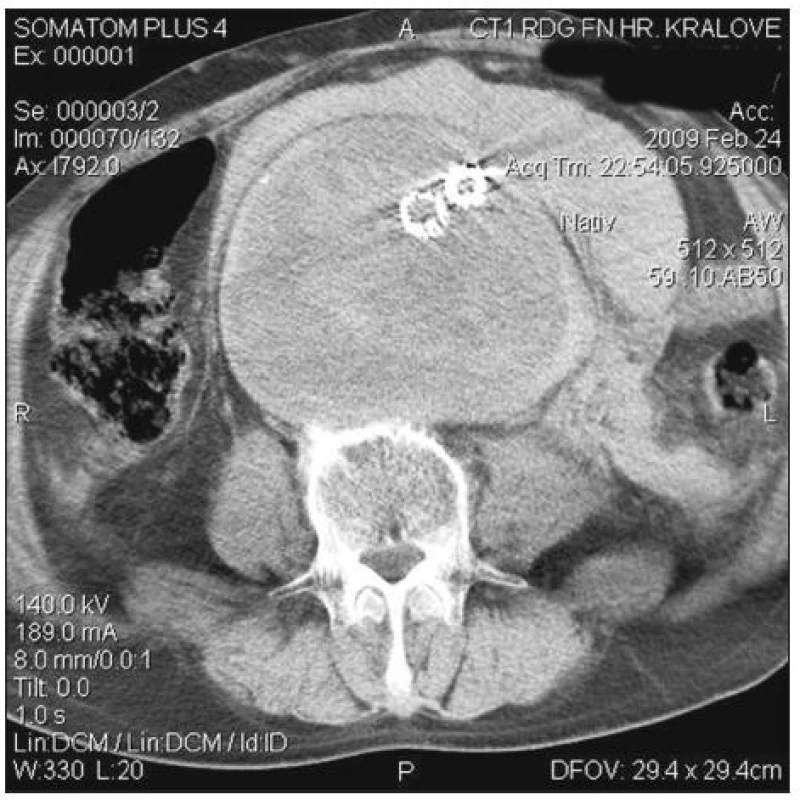
Obr. 5. Peroperační nález rozpojeného těla stentgraftu a pravého ilického raménka Fig. 5. Aperoperative finding of discontinued body and right iliac branch of stentgraft 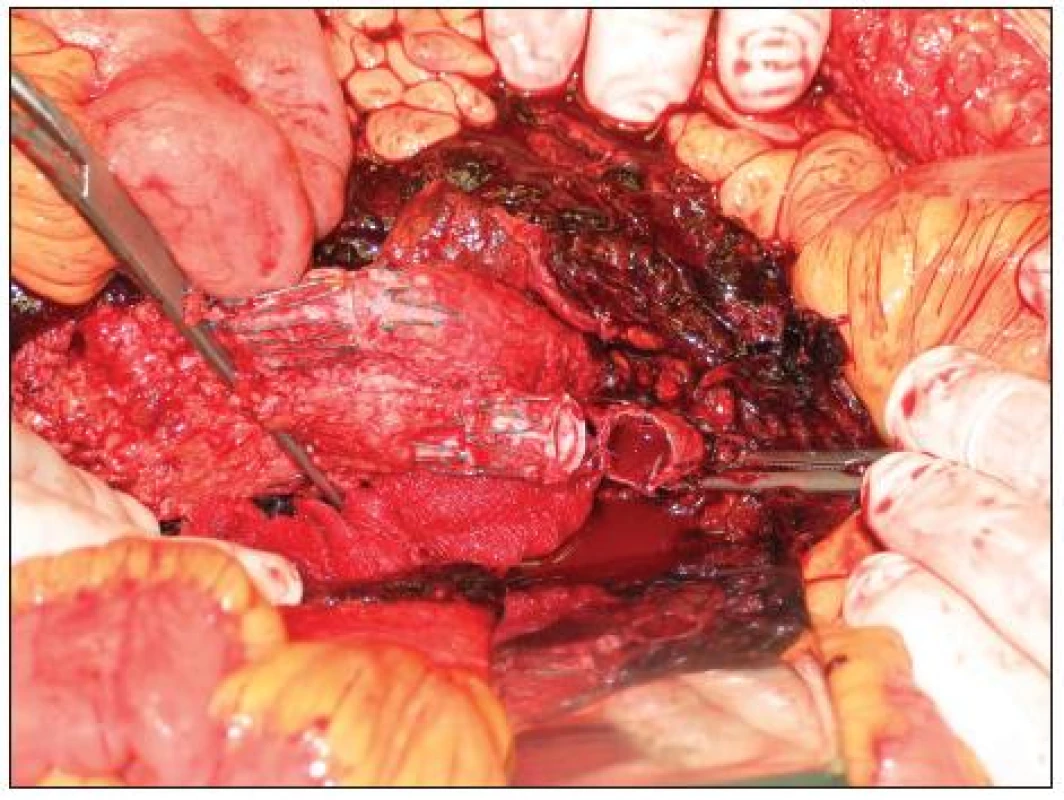
Obr. 6. Stav po sutuře rozpojených částí Fig. 6. A status after suture of discontinued parts 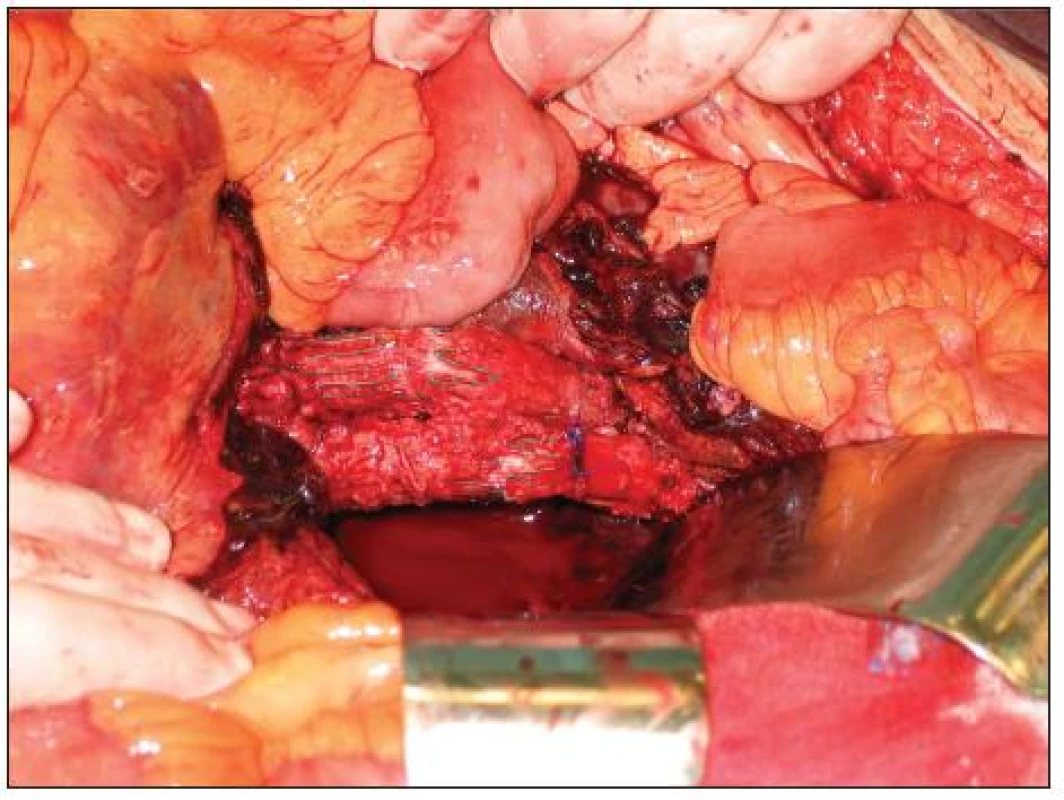
Pooperačně byl pacient krátkodobě resuscitován pro komorovou fibrilaci. Z dalších komplikací se vyskytl pooperační ikterus (hepatopatie, masivní krevní převody), subileozní stav, serom a částečná kožní dehiscence distálního pólu rány po laparotomii. Ikterus regredoval a pasáž se obnovila k normě na konzervativní terapii. Pulzace dolních končetin byla hmatná do periferie. Před propuštěním bylo provedeno kontrolní CT břišní aorty, kde nebyly známky prosakování do vaku, ani retroperitoneální hematom. Pacient byl po 23 dnech hospitalizace (z toho 8 dnů na JIP) propuštěn v dobrém stavu do domácí péče.
DISKUSE
Vzhledem k relativně častému výskytu endoleaku při léčbě AAA zavedením stentgraftu je nezbytné na tuto možnou komplikaci nejen myslet, ale aktivně ji vyhledávat a v indikovaných případech léčit. Endoleak způsobující selhávání metody jako takové může vést k progresi velikosti vaku a vyústit až v rupturu AAA, která je často pro pacienta fatální. K rychlému zvětšování výdutě vedou především endoleaky I a III typu. Z toho vyplývá i nutnosti jejich časného řešení ať již endovaskulárně (překrytí dalším stentgraftem jako v našem případě), nebo chirurgicky (bandáž v oblasti konce stentgraftu, či konverze ke klasické chirurgické resekci výdutě s nebo bez odstranění stentgraftu) [2–7]. U našeho nemocného jsme zvolili přímou chirurgickou rekonstrukci rozpojených komponent stentgraftu, což se nám vzhledem k jeho minimální kardiální rezervě jevilo jako nejméně zatěžující výkon řešící danou akutní situaci. Tento názor nám potvrdil i pooperační průběh, při němž došlo k nestabilitě myokardu, jež vedla k atace fibrilace komor.
Nejčastějším je endoleak II typu (většinou z lumbálních tepen, či z dolní mezenterické tepny). Tendence k progresi výdutě u tohoto typu je jen mírná, často dochází k jeho spontánní regresi. Pacienta je nutné pravidelně sledovat a intervence je indikována až při zvětšování vaku. Léčba může být endovaskulární (selektivní embolizace průchodné větvě), či pokus o trombotizaci perkutánní aplikací trombinu do vaku výdutě, nebo chirurgická (zaklipování průchodné větve) [2, 3, 5–7].
Podle doporučení EUROSTAR jsou pacienti po zavedení stentgragtu sledování v pravidelných intervalech včetně zobrazovacích metod (CTA, MRA) po zavedení stentgraftu, za 3, 6 a 12 měsíců a dále 1x ročně, nejsou-li známky komplikací [2, 5]. V rukách zkušeného ultrasonografisty je možné tato vyšetření suplovat UZ vyšetřením a CTA, či MRA doplnit až při UZ suspekci na komplikaci [2, 3, 8, 9]. Náš pacient se dostavil k lékaři až s klinickými obtížemi. Dobu od zavedení stentgraftu po rozvoj endoleaku nelze stanovit, neboť poslední kontrolu absolvoval v květnu 2007, tedy 21 měsíců před dianózou endoleaku, což je jistě důvod k opakovanému zamyšlení nad indikací této léčby nejen z hlediska medicínského, ale i z pohledu nutnosti a ochoty pacienta k další spolupráci. Řešení endoleaku bylo v našem případě raritní (ve světové literatuře jsme jej nezaznamenli), ale za daných podmínek rychlé, vhodné a účinné.
MUDr. Stanislav Jiška
K Lesu 273
500 09 Hradec Králové
e-mail: jiskas@seznam.cz
Zdroje
1. Moore, W. S. Vascular and Endovascular Surgery: A Comprohensive Review. 7th edition. Saunders, 2005, p. 488–507.
2. Ferko, A., Krajina, A. Arteriální aneuryzmata. ATD nakladatelství, Hradec Králové, 1999, s. 74–105.
3. Krajina, A., Peregrin, J. H. Intervenční radiologie. Miniinvazivní terapie. Olga Čermáková, Hradec Králové, 2005, s. 281–292.
4. Krajíček, M., Peregrin, J. H., Roček, M., Šebesta, P. Chirurgická a intervenční léčba cévních onemocnění. Grada Publishihg, Praha, 2007, s. 185–214.
5. Szmidt, J., Galazka, Z., Rowinski, O., et al. Late aneurysma rupture after endovascular abdominal aneurysm repair. Interact. Cardiovasc. Thorac. Surg., 2007 Aug, 6(4): p. 490–494.
6. Buth, J., Harris, P. L., van Marrewijk, C., Fransen, G. The significance and management of different types of endoleaks. Semin. Vasc. Surg., 2003, Vol. 16(2), p. 95–102.
7. Nes, J. G. H., Hendriks, J. M., Tseng, L. N. L., et al. Endoscopic Aneurysm Sac Fenestration as a Treatment Option for Growing Aneurysms Due to Type II Endoleak or Endotension. Journal of Endovascular Therapy: Vol. 12, No. 4, p. 430–434.
8. Raman, K. G., Missig-Carroll, N., Richardson, T., Muluk, S. C., Makaroun, M. S. Color-flow duplex ultrasound scan versus computed tomographic scans in the surveillance of endovascular aneurysm repair. J. Vasc. Surg., 2003 Oct, 38(4), p. 645–651.
9. Lawrence-Brown, M. M., Sun, Z., Semmens, J. B., et al. Type II endoleaks: when is intervention indicated and what is the index of suspicion for types I or III? J. Endovasc. Ther., 2009 Feb., 16 Suppl 1, p. 106–118.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2010 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Prevence endoleaku II. typu pomocí peroperačního coilingu vaku aneuryzmatu abdominální aorty během implantace stentgraftu
- Případ kombinace endoleaku Ib a IIIa typu po zavedení stentgraftu pro subrenální výduť aorty
- Současné možnosti roboticky asistované cévní chirurgie
- Příspěvek k diagnostice infekce cévní protézy
- Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy
- Operace na vnitřních karotidách v lokoregionální anestezii na chirurgické klinice v Plzni za uplynulých 7 let. Diskuse nad AHA a ESVS guidelines
- Klinické zkušenosti s použitím chladem konzervovaných žilních a tepenných alloštěpů: dlouhodobé výsledky
- Pedální bypass – desetileté zkušenosti
- Vícenásobná sekvenční revaskularizace infrapopliteálních tepen při záchraně kriticky ischemické končetiny
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Výsledky kombinované chirurgické a endovaskulární léčby žilního thoracic outlet syndromu v letech 2000 – 2007 na II. chirurgické klinice VFN a 1. LF UK v Praze
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Infekce av spojky k hemodialýze založené ePTFE interponátem. Léčba na základě zkušeností nebo podle nálezů moderních vyšetřovacích metod?
- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Hybridní výkony v léčbě torakoabdominálních výdutí typu IV, V
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Pedální bypass – desetileté zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



