-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prevence endoleaku II. typu pomocí peroperačního coilingu vaku aneuryzmatu abdominální aorty během implantace stentgraftu
Prevention of Type II Endoleak Using Postoperative Coiling of the Abdominal Aortic Aneurysm Sac during Stent Graft Implantation
Aim:
A prospective randomized study assessing the success rates of type II endoleak (EL) prevention, using postoperative coiling of the abdominal aortic aneurysm (AAA) sac during stent graft (SG) implantation.Material and Methods:
From January 2008 to July 2009, 86 patients were operated for AAA using endovascular methods with bifurcation SG. The subjects were prospectively randomized into two subgroups. Group A subjects (42 subjects; 48.8%) had various numbers of coils introduced into the sac, close to the SG body. Group B (44 subjects; 51.2%) included patients without coils. Preoperative CT angiograhy (CT AG) was used to assess patency and the number of lumbal arteries (AL), a.mesenterica inferior (AMI), a. sacralis mediana (ASM) and aa. renales accessoriae (ARA), the AAA sac and the lumen size. At the end of the studied period, existence of type II EL and the AAA sac size was assessed using sonography and /or CT AG.Results:
Prior to the procedure, there were only minor differencies in the number of source type II EL arteries (AL 3.8 vs. 3.5; AMI 0.78 vs. 0.55; ASM 0.26 vs. 0.3; ARA 0.095 vs. 0.05), preoperative AAA sac size (68.6 vs. 67.0 mm) and the lumen size (47.6 vs. 40.0 mm), the AAA sac size at the end of the studied period (63.9 vs. 62.1 mm) and its mean size change (-4.7 vs. -4.9 mm), between the Group A and B, respectively . Postoperatively, the type II EL was detected in 6 subjects in Group A (14.3%), and in 9 subjects in Group B (20.5%). At the study endpoint, the type II EL was identified in 4 subjects in Group A (9.5%), in 8 subjects in Group B (18.2%).Conclusion:
Peroperative introduction of coils into the AAA sac is one of the options for type II EL prevention. It facilitates successful regression and disappearance of type II EL.Key words:
endoleak – abdominal aortic aneurysm – coil – stent graft
Autoři: P. Šedivý; K. El Samman; K. Bartík; T. Mach *; M. Šlais; P. Štádler; H. Přindišová
Působiště autorů: Oddělení cévní chirurgie, NsP Na Homolce, Praha 5, primář: doc. MUDr. Petr Štádler, Ph. D. ; Oddělení radiodiagnostiky, NsP Na Homolce, Praha 5, primář: prof. MUDr. Josef Vymazal, DrSc. *
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 1, s. 18-23.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Cíl:
prospektivní randomizovaná studie sledující úspěšnost prevence endoleaku (EL) II. typu pomocí peroperačního coilingu vaku aneuryzmatu abdominální aorty (AAA) při endovaskulární operaci pomocí stentgraftu (SG).Materiál a metodika:
Od ledna 2008 do července 2009 byla u 86 pacientů řešena AAA endovaskulárně pomocí bifurkačního SG. Osoby byly prospektivně randomizovány do dvou skupin. Pacientům ve skupině A (42 osob; 48,8 %) jsme peroperačně aplikovali různý počet coilů do volného prostoru vaku v okolí těla SG, skupina B (44 osob; 51,2 %) zahrnuje pacienty bez coilů. Byly vyhodnoceny předoperační CT angiografie (CT AG) s ohledem na průchodnost a počet aa. lumbales (AL), a. mesenterica inferior (AMI), a. sacralis mediana (ASM), aa. renales accessoriae (ARA), změřena velikost vaku AAA a průtočného lumen. Na konci sledovaného období byla sonograficky a/nebo CT AG vyhodnocena přítomnost EL II. typu a velikost vaku AAA.Výsledky:
Před operací se skupiny A a B velmi málo lišily v počtu přítomných zdrojových tepen EL II. typu (AL 3,8 vs. 3,5; AMI 0,78 vs. 0,55; ASM 0,26 vs. 0,3; ARA 0,095 vs. 0,05), předoperační velikostí vaku výdutě (68,6 vs. 67,0 mm) a průměrem průtočného lumen (47,6 vs. 40,0 mm), průměrem vaku na konci sledovaného období (63,9 vs. 62,1 mm) a průměrnou změnou jeho velikosti (-4,7 vs. -4,9 mm). Bezprostředně po operaci byl EL II. typu zjištěn ve skupině A u 6(14,3%), ve skupině B u 9 (20,5 %) osob. Na konci sledování byl EL II. typu ve skupině A nalezen u 4 (9,5 %), ve skupině B u 8 (18,2 %) osob.Závěr:
Peroperační zavedení coilů do volného prostoru vaku AAA je jedním ze způsobů možné prevence vzniku EL II. typu, zvýší se tím úspěšnost regrese a vymizení EL II. typu.Klíčová slova:
endoleak – aneuryzma aorty abdominální – coil – stentgraftÚVOD
Endovaskulární řešení AAA pomocí implantace SG je alternativou otevřeného operačního přístupu u pacientů s vyšším operačním rizikem. Předpokladem úspěšnosti je vhodná anatomická morfologie vaku výdutě, subrenálního krčku a distálních kotvících úseků výtokového řečiště. Achillovou patou endovaskulárního postupu je vznik různých typů endoleaků s rozdílnou klinickou významností. Zatímco EL I. a III. typu je vhodné ihned agresivně řešit, EL II. typu nemusí pro nemocného představovat nebezpečí, a pokud nedochází k expanzi vaku výdutě, stačí jej pouze v běžných intervalech sledovat [1–3]. EL II. typu se může spontánně zmenšovat a i vymizet [4, 5]. Na druhou stranu byly opakovaně popsány pozdní ruptury vaku AAA díky přítomnému EL II. typu [1–3].
Incidence EL II. typu se na renomovaných světových pracovištích pohybuje mezi 3 % a 42 % [6–9]. Některá pracoviště ve snaze omezit frekvenci výskytu EL II. typu zavádějí předoperačně nebo peroperačně různé embolizační materiály a snaží se ústí potenciálních zdrojových tepen okludovat. Mezi materiály k tomuto účelu používané patří trombin [10], coily [8, 11], tkáňová lepidla, etylen-vinyl alkohol [12] a absorbovatelná želatinová houba [13]. Zatímco embolizace a. mesenterica inferior (AMI) a a. renalis accessoria (ARA) dosahuje téměř 100% úspěšnosti, embolizace aa. lumbales (AL) je úspěšná zhruba v 65 % [11]. Zatím není prokázáno, že by cílená předoperační embolizace lumbálních tepen snižovala výskyt EL II. typu z tohoto zdroje [14, 15].
MATERIÁL A METODA
Během osmnáctiměsíčního období od ledna 2008 do července 2009 podstoupilo na Oddělení cévní chirurgie Nemocnice Na Homolce 86 pacientů endovaskulární léčbu AAA pomocí bifurkačního SG. Sestava zahrnuje 78 mužů a 8 žen ve věku 49–90 let (průměr 74,8 let; medián 77). Tito pacienti byli před operací vyšetřeni pomocí CT angiografie (CT AG). Na CT řezech byly identifikovány a zaznamenány patentní AL, AMI, a. sacralis mediana (ASM) a ARA. Dále byl změřen maximální průměr vaku AAA, maximální průměr průtočného lumen ve vaku výdutě a zaznamenáno případné šíření dilatace na aa. iliacae. Pacienti byli randomizováni do dvou skupin, skupiny A (42 osob; 40 mužů a 2 ženy; věk 49-86 let, průměr 73,2 let; medián 76) a skupiny B (44 osob; 38 mužů a 6 žen; věk 60-90 let, průměr 76,3 let; medián 77). Počty pacientů ve skupinách podává tabulka 1. U obou skupin byl pro diagnózu AAA plánovaně zaveden aortoilický bifurkační SG. Pacientům ve skupině A jsme v jedné době po dokončení implantace SG zavedli do volného a původně průtočného lumen mezi stěnu SG a aorty různý počet coilů s povrchem krytým polyesterovými vlákny typu Gianturco (Cook, Bloomington, USA). Do studie byli zařazeni pouze pacienti, kterým byl implantován modulární bifurkační SG kotvený proximálně transrenálně (ELLA : ELLA-CS, Hradec Králové, Česká republika) nebo subrenálně (Gore Excluder: W. L. Gore & Associates, Inc., Flagstaff, Arizona, USA; Anaconda: Vascutek Ltd., Renfrew, Skotsko, Velká Británie) a distálně ukončený v aa. iliacae communes.
Tab. 1. Demografie souboru Tab. 1. The study group‘s demography 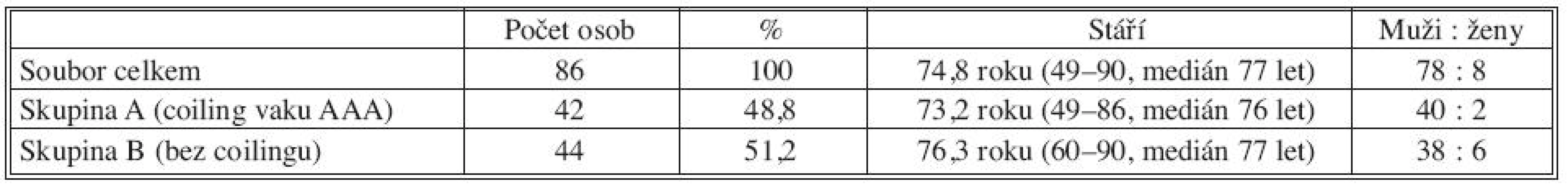
Do studie nebyli zařazeni pacienti s krvácejícím aneuryzmatem, pacienti po předchozích otevřených operacích na aortoilickém řečišti a po předchozích implantacích SG v tomto úseku. Do studie také nebyli zařazeni pacienti, kterým byl implantován aortouniiliacký či jiný tubulární SG a případné okludory do pánevních tepen. Vyřadili jsme také pacienty, u kterých bylo alespoň jedno raménko distálně kotveno v a. iliaca externa a tím překryta průchodná a. iliaca interna. Ze studie byli později také vyloučeni pacienti, u kterých byl pooperačně zjištěn endoleak I. typu s nutností endovaskulární nebo otevřené chirurgické reintervence.
Operační postup
Endovaskulární výkony jsme prováděli na operačním sále vybaveném fluoroskopickým stolem Maquet s plovoucí deskou a pojízdným rentgenovým přístrojem OEC 9800. Postup implantace SG u skupiny B bez coilingu byl zcela standardní. U pacientů randomizovaných ke coilingu (skupina A) jsme paralelně se zavaděčem SG zavedli jednou nebo oběma pánevními tepnami embolizační katetry. Po dokončení implantace SG jsme jejich pomocí provedli angiografii vaku se zobrazením dosud patentních a z něj odstupujících tepenných větví. Poté jsme do úrovně jejich ústí neselektivně zavedli různý počet coilů a operaci běžným způsobem dokončili.
Pacienti byli před propuštěním z nemocnice kontrolováni CT AG a hledán případný EL II. typu a jeho zdroj. V ambulantní péči byli nemocní kontrolováni sonograficky po 1, 3, 6, 12 a 18 měsících. Sledovali a měřili jsme změny maximálního průměru vaku výdutě a přítomnost EL II. typu. Pacienti s identifikovaným EL byli opět vyšetřeni CT AG a provedena identifikace jeho typu a zdroje. Po 18 měsících trvání studie byly obě skupiny vyhodnoceny a porovnány. Výsledky byly po této době vyhodnotitelné u všech zařazených pacientů. Žádný ze sledovaných pacientů v bezprostředním perioperačním období nezemřel. Deset pacientů zemřelo v průběhu sledovaného období (3x AIM, 2x CPM, 2x pneumonie, 1x plicní tumor, 1x akutní pankreatitida, 1x tumor prostaty) a tři pacienti přestali docházet na ambulantní kontroly, ale vždy nejméně po jednom měsíci sledování. Jen jeden z těchto pacientů měl detekovaný EL II. typu, který přetrvával 3 měsíce po operaci, další kontrolu jsme již neuskutečnili. Všechny tyto pacienty jsme ve studijních skupinách ponechali zařazené.
Za hospitalizace a v průběhu pooperačního sledování jsme zaznamenávali tyto parametry: Průměr vaku AAA před operací, průměr průtočného lumen v AAA před operací, průměr vaku AAA a průměrnou změnu velikosti vaku na konci sledovaného období, přítomnost a počty AL, AMI, ASM a ARA, počet coilů zavedených do vaku AAA ve skupině A, přítomnost EL II. typu po operaci a jeho zdroj.
Vstupní hodnoty pro jednotlivé skupiny jsou zobrazeny v tabulce 2. Průměrné počty potenciálních zdrojových tepen EL II. typu, průměrné velikosti vaku AAA a průtočného lumen se v obou skupinách jen nepatrně liší.
Tab. 2. Podrobná charakteristika skupin Tab. 2. Detailed characteristics of the groups 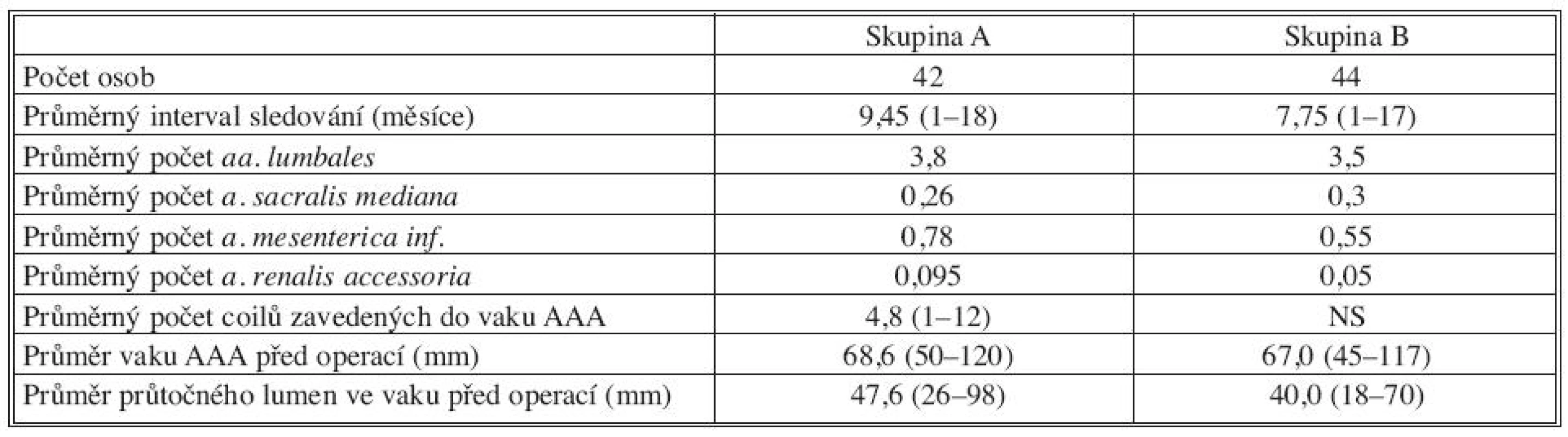
VÝSLEDKY
Průměrná velikost vaku AAA na konci sledovaného období ve skupině A byla 63,9 mm a ve skupině B 62,1 mm. Průměrná změna velikosti vaku byla ve skupině A -4,7 mm a ve skupině B -4,9 mm. Můžeme tedy konstatovat, že se vak v obou skupinách průměrně zmenšoval stejnou rychlostí a přítomnost coilů tuto rychlost neovlivnila (Tab. 3).
Tab. 3. Změny velikosti vaku AAA Tab. 3. Changes of the AAA sac size 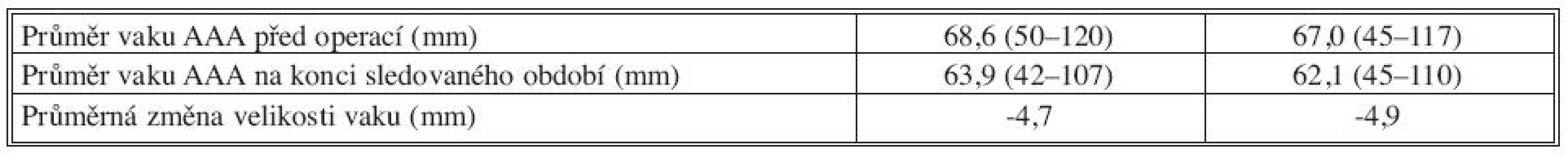
Bezprostředně po operaci na první kontrolní CT AG jsme zaznamenali výskyt EL ve skupině A u 6 (14,3 %) pacientů a ve skupině B u 9 (20,5 %) pacientů. Některé endoleaky spontánně regredovaly a postupně zanikly, takže na konci sledovaného období byl ve skupině A detekován EL u 4 (9,5 %) nemocných a ve skupině B u 8 (18,2 %) pacientů. AMI byla zdrojem EL v obou skupinách jen u jedné osoby, a to na začátku i na konci sledovaného období, v ostatních případech šlo vždy o zdroj v komunikujících AL, případně kombinaci AL a ASM. Porovnání výskytu EL mezi skupinami přehledně ukazuje tabulka 4. Ve skupině A s coilingem vaku AAA byl patrný trend k nižšímu výskytu EL II. typu, a to nejen bezprostředně po operaci (20,5 vs. 14,3 %), ale ještě výrazněji na konci studie (18,2 vs. 9,5 %). Hodnoty jsme podrobili testu o rovnosti parametrů dvou alternativních rozdělení. Počet pacientů s EL byl ve skupině A bezprostředně po operaci signifikantně nižší než ve skupině B (hodnota p = 0,02), statisticky ještě významnější rozdíl byl na konci sledovaného období (p = 0,0004).
Tab. 4. Porovnání výskytu EL II. typu mezi skupinami Tab. 4. Comparison of the type II EL rates between the groups 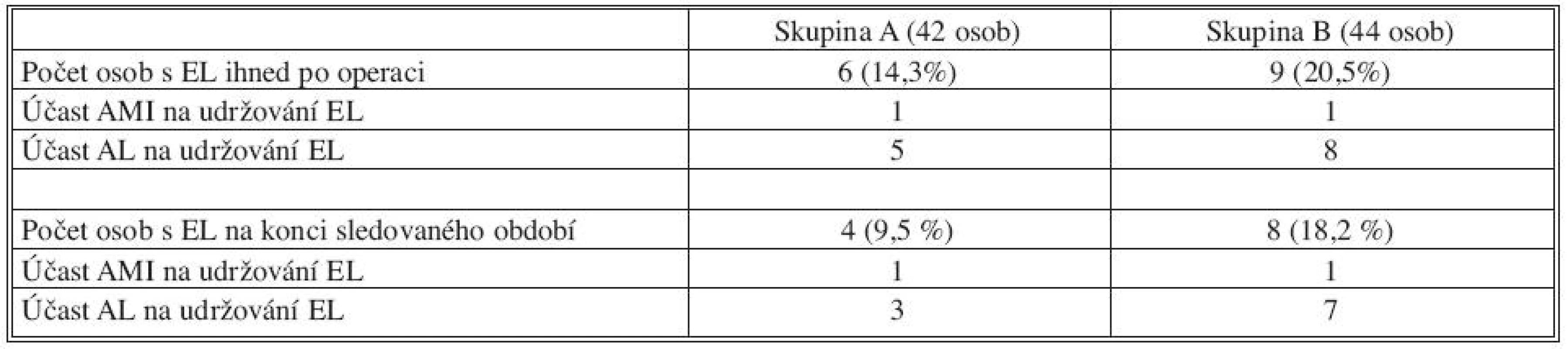
Vztah změn velikosti vaku AAA a přítomnosti EL II. typu ukazuje tabulka 5. U obou skupin se vak zmenšoval u více než 50 % osob, a to bez ohledu na přítomnost EL. U více než 40 % sledovaných pacientů se velikost vaku neměnila, opět bez ohledu na přítomnost EL. Ke zvětšování vaku došlo ve skupině A jen u jednoho (2,4 %) pacienta, měl současně EL II. typu. Ve skupině B došlo ke zvětšení vaku u dvou (4,6 %) pacientů, jeden z nich měl EL II. typu. Přítomnost EL se tedy mohla spoluúčastnit na narůstání velikosti vaku jen u 2 pacientů z 12 (16,7 %), jednoho (2,4 %) ze skupiny A a jednoho (2,3 %) ze skupiny B. V celém souboru 86 osob jsme takto dokumentovali souvislost EL II typu a narůstání vaku AAA pouze u dvou (2,3 %) pacientů.
Tab. 5. Vztah změn velikosti vaku a přítomnosti EL na konci sledovaného období Tab. 5. Relationship between the sac size and the existence of EL at the end of the studied period 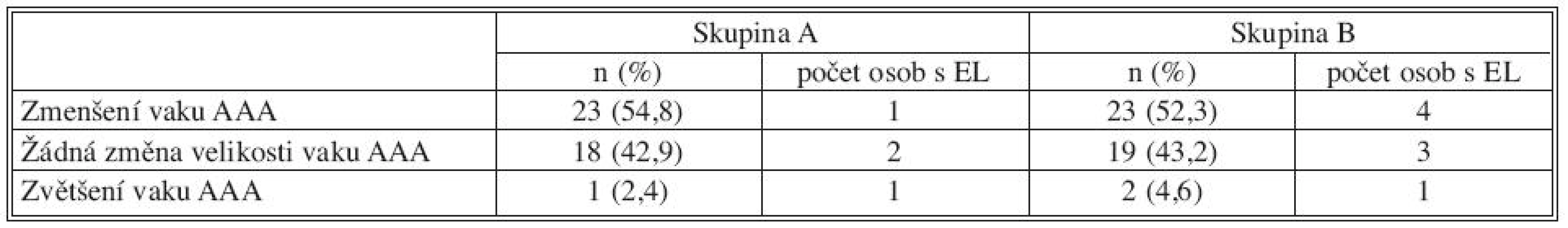
Obr. 1. Verifikace průchodných větví na předoperační CT AG: na zadním obvodu a. sacralis mediana Fig. 1. Verification of patent branches on preoperative CT AG: posterior circumference of a. sacralis mediana 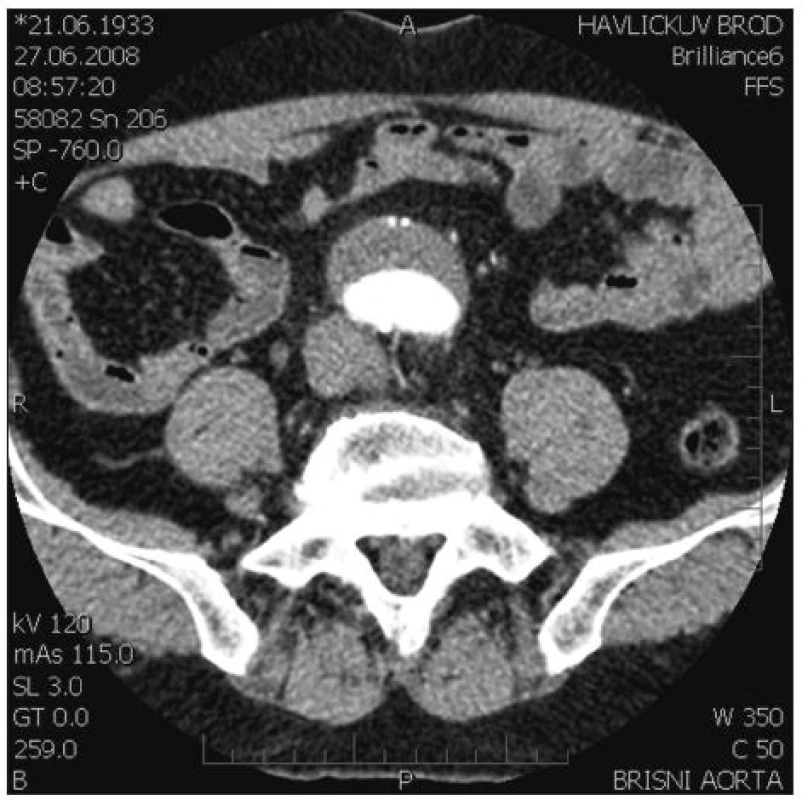
Obr. 2. Verifikace průchodných větví na předoperační CT AG: na zadním obvodu aa. lumbales, na předním obvodu a. renalis accessoria Fig. 2. Verification of patent branches on preoperative CT AG: posterior circumference of aa. lumbales, anterior circumference of a. renalis accessoria 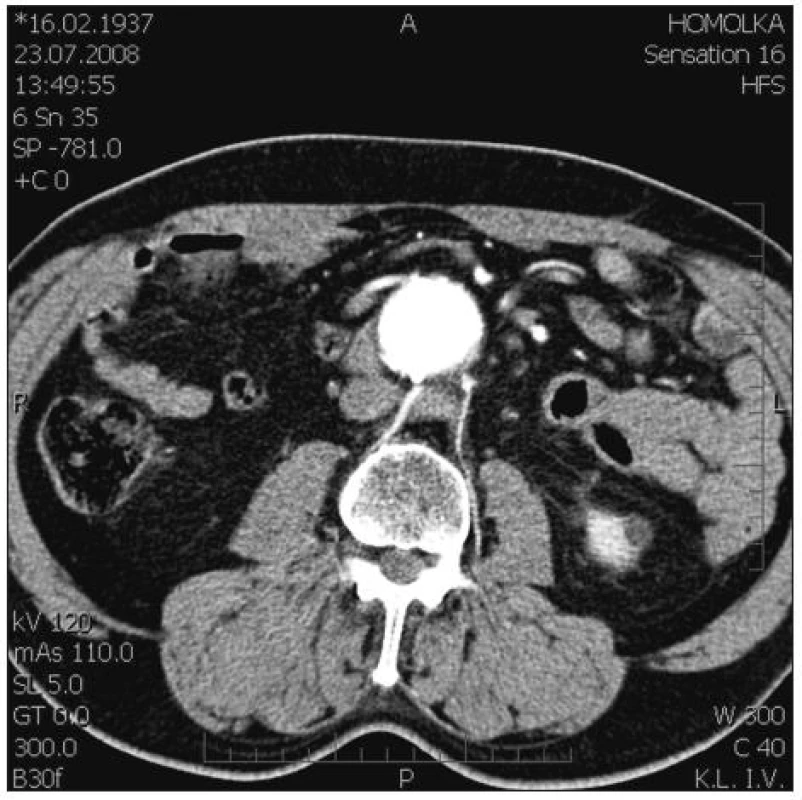
Obr. 3. Coily na zadní stěně vaku AAA před ústími aa. lumbales. V přední části vaku dvě raménka SG Fig. 3. Coils on the posterior AAA sac wall, anterior to the entrances of lumbal arteries. Two SG arms in the anterior part of the sac 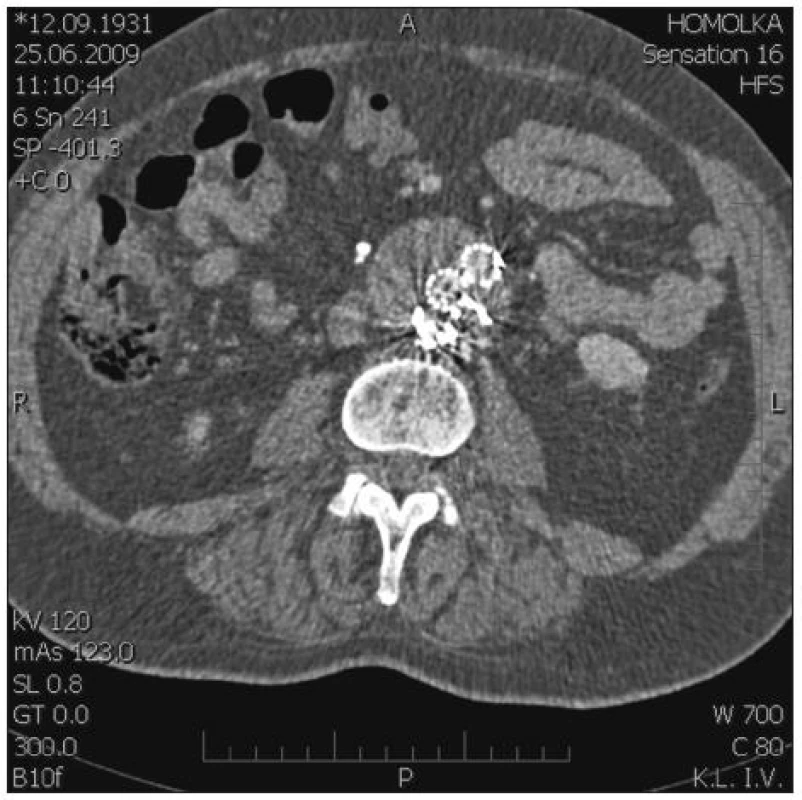
Obr. 4. EL při zadní stěně vaku AAA mezi ústími několika aa. lumbales Fig. 4. EL at the posterior AAA sac wall, between the entrances of several lumbal arteries 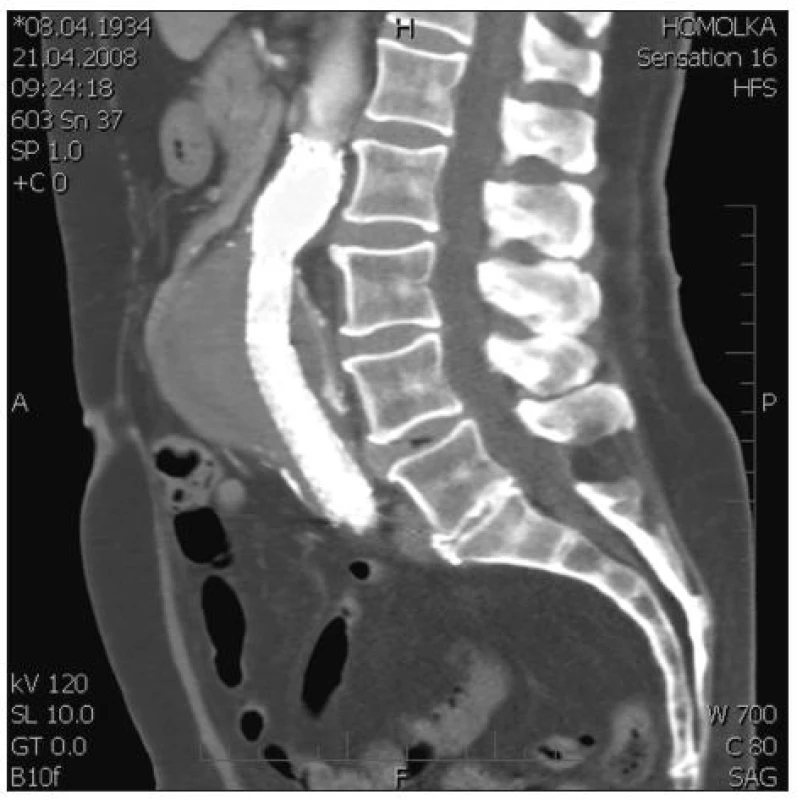
Obr. 5. EL při boční stěně vaku AAAsouvisející s odstupem a. mesenterica inferior Fig. 5. EL at the lateral AAA sac wall, related to the a. mesenterica inferior 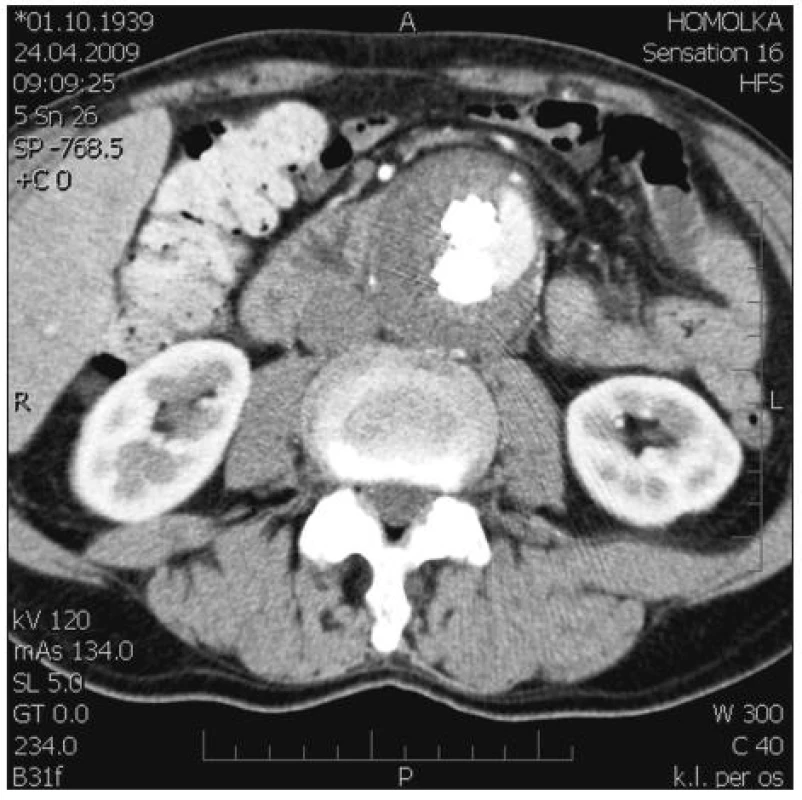
DISKUSE
Pooperační zjištění přítomnosti endoleaku I. a III. typu si obvykle vyžádá brzkou nápravu, ať už endovaskulárním, nebo otevřeným způsobem [7]. Endoleak II. typu nemusí být indikací k nové intervenci, pokud výduť zůstává asymptomatická, a pokud nedochází k progresi velikosti jejího vaku. Až u dvou třetin pacientů EL II. typu postupně vymizí, může ale také být detekován i se zpožděním několika měsíců [4, 5]. Spontánní regresi EL je možné podpořit i jen dočasným vysazením antiagregační nebo antikoagulační medikace, pokud to pro pacienta nepředstavuje riziko ve vztahu k jiným chorobám, dále také dobrou kompenzací hypertenze [16]. Pokud je EL v nezměněné intenzitě přítomen po dobu více než 6 měsíců a maximální průměr vaku se zvětší o více než 5 mm, je obava, že bez intervence bude vak narůstat dále. Schlösser et al. zjistili metaanalýzou dat z literatury, že EL II. typu po implantaci SG bývá příčinou pozdní ruptury v 8,5 %, zatímco EL I. a III. typu kumulovaně ve 42 % případů. K většině těchto ruptur dojde během 36 měsíců po primární operaci a u výdutí s velkým počátečním průměrem (65 mm), přitom až u 15 % sledovaných pacientů nemusí být do té doby pozorován žádný patologický vývoj [3].
Úspěšnost endovaskulární re-intervence při řešení EL II. typu se pohybuje mezi 34 % a 100 % [4, 6, 17, 18]. Endovaskulární řešení je možné a proveditelné různými postupy, ale v některých případech je nutná otevřená chirurgická konverze. Endovaskulární přístup a embolizace coilů nebo mikrocoilů do vaku výdutě jsou umožněny buď cestou iliolumbálních větví přes a. iliaca interna, nebo cestou Riolaniho anastomózy mezi horní a dolní mezenterickou tepnou [17].
Pracoviště s mimořádně vysokým výskytem EL II. typu doporučují předoperační nebo perioperační selektivní embolizaci hlavních zdrojových tepen zpětného krvácení do vaku, zejména AMI [8, 11]. V našem souboru se výskyt EL pohybuje na nízkých hodnotách srovnatelných s pracovišti z opačné části spektra úspěšnosti [6, 9], a to jak ve skupině s coilingem, tak i bez něj. O předoperační embolizaci coily uvažujeme a používáme ji při nutném plánovaném překrytí ústí vnitřních pánevních tepen nebo širokých ústí akcesorních renálních tepen. Přítomnost EL II. typu a narůstání vaku AAA jsme u v našem souboru 86 osob zachytili z dvou (2,3 %) pacientů, kteří po splnění časových a rozměrových kritérií budou případně indikováni k reintervenci.
Další používanou možností je peroperační aplikace trombinu, biolepidel nebo kopolymeru etylen-vinyl alkoholu do vaku výdutě [9, 12]. Sami s tímto postupem v této situaci zkušenosti nemáme. Vzhledem k varování z některých pracovišť před možností průniku tekutých embolizujících látek do necílových tepen, s následkem nekrózy kolon nebo trvalé nervové léze, volíme raději bezpečnější postup s mikrokatétry a mikrocoily [19, 20].
Pokračující expanze vaku AAA nemusí být způsobena pouze EL. Mehta et al. prokázali u primárně klasicky operovaných pacientů s exkludovaným vakem výduti při vynucených reoperacích, že příčinou může být vznikající hygrom způsobený exudací tekutiny ze ztluštělé stěny vaku nebo vasa vasorum a také lokální enzymatická aktivita [21].
ZÁVĚR
Peroperační aplikace coilů do vaku AAA nezmění rychlost zmenšování vaku, nezvýší ani počet pacientů, u kterých se vak po zavedení SG zmenšuje nebo nemění velikost.
Přítomnost coilů ve vaku AAA v našem souboru statisticky významně snížila frekvenci výskytu EL II. typu jak bezprostředně po operaci, tak v delším časovém odstupu.
Statistický výpočet provedl ing. Petr Mazouch z Katedry statistiky a pravděpodobnosti Vysoké školy ekonomické v Praze.
Seznam zkratek:
AAA - aneuryzma aorty abdominální AIM - akutní infarkt myokardu AL - a. lumbalis AMI - a. mesenterica inferior ARA - a. renalis accessoria ASM - a. sacralis mediana CPM - cévní příhoda mozková CT AG - angiografie pomocí počítačové tomografie EL - endoleak (pokud není v textu vyznačeno jinak, rozumí se endoleak II. typu) SG - stentgraft MUDr. Petr Šedivý
Španielova 1324
163 00 Praha 6
e-mail: petr.sedivy@homolka.cz
Zdroje
1. Hinchliffe, R. J., Singh-Ranger, R., Davidson, I. R., Hopkinson, B. R. Rupture of an abdominal aortic aneurysm secondary to type II endoleak. Eur. J. Vasc. Endovasc. Surg., 2001 Dec; 22 (6): 563–565.
2. White, R. A., Donayre, C., Walot, I., Stewart, M. Abdominal aortic aneurysm rupture following endoluminal graft deployment: report of a predictable event. J. Endovasc. Ther., 2000 Aug; 7(4): 257–262.
3. Schlösser, F. J., Gusberg, R. J., Dardik, A., Lin, P. H., Verhagen, H. J., Moll, F. L., Much, B. E. Aneurysm rupture after EVAR: can the ultimate failure be predicted? Eur. J. Vasc. Endovasc. Surg., 2009 Jan; 37(1): 15–22.
4. Steinmetz, E., Rubin, B. G, Sanchez, L. A., Choi, E. T., Geraghty, P. J., Baty, J., Thompson, R. W., Flye, M. W., Hovsepian, D. M., Picus, D., Sicard, G. A. Type II endoleak after endovascular abdominal aortic aneurysm repair: a conservative approach with selective intervention is safe and cost-effective. J. Vasc. Surg., 2004; 39(2): 306–313.
5. Waasdorp, E., van Herwaarden, J. A., van de Mortel, R. H., Moll, F. L., de Vries, J. P. Early computed tomographic angiography after endovascular aneurysm repair: worthwhile or worthless? Vascular., 2008 Sep-Oct; 16(5): 253–237.
6. Conrad, M. F., Adams, A. B., Guest, J. M., Peruchuri, V., Brewster, D. C., Lamuraglia, G. M., Cambria, R. P. Secondary intervention after endovascular surgery. Ann. Surg., 2009 Jul 31 (e-publikace před tiskem).
7. Barbiero, G., Baratto, A., Ferro, F., DallęAcqua, J., Fitta, C., Motto, D. Strategies of endoleak management following endoluminal treatment of abdominal aortic aneurysms in 95 patients: how, when and why. Radiol. Med., 2008; 113(7):1029–1042.
8. Axelrod, D. J., Lookstein, R. A., Guller, J., Nowakowski, F. S., Ellozy, S., Carrocio, A., Teodorescu, V., Marin, M. L., Mitty, H. A. Inferior mesenteric artery embolization before endovascular aneurysm repair: technique and initial results. J. Vasc. Interv. Radiol., 2004; 15(11): 1263–1267.
9. Du Toit, D. F., Saaiman, J. A., Labuschagne, B. C., Vorster, W., van Beek, F. J., Boden, B. H., Geldenhuys, K. M. EVAR: critical applied aortic morphology relevant to type-II endoleaks following device enhancement in patients with abdominal aortic aneurysms. Cardiovasc. J. S. Afr., 2004; 15(4): 170–177.
10. Zanchetta, M., Faresin, F., Pedon, L., Ronsivalle, S. Intraoperative intrasac thrombin injection to prevent type II endoleak after endovascular abdominal aortic aneurysm repair. J Endovasc Ther., 2007 Apr; 14(2): 176–183.
11. Bonvini, R., Alerci, M., Antonucci, F., Tutta, P., Wyttenbach, R., Bogen, M., Pelloni, A,. von Segesser, L., Gallino, A. Preoperative embolization of collateral side branches: a valid means to reduce type II endoleaks after endovascular AAA repair. J. Endovasc. Ther., 2003; 10(2): 227–232.
12. Nevala, T., Biancari, F., Manninen, H., Aho, P. S., Matsi, P., Mäkinen, K., Roth, W. D., Ylönen, K., Lepäntalo, M., Perälä, J. Type II Endoleak After Endovascular Repair of Abdominal Aortic Aneurysm: Effectiveness of Embolization. Cardiovasc. Intervent. Radiol., 2009 Aug 18 (e-publikace před tiskem).
13. Walker, S. R., Macierewicz, J., Hopkinson, B. R. Endovascular AAA repair: prevention of side branch endoleaks with thrombogenic sponge. J. Endovasc. Surg., 1999 Nov; 6(4): 350–353.
14. Sheehan, M. K., Hagino, R. T., Canby, E., Wholey, M. H., Postoak, D., Suri, R., Toursarkissian, B. Type 2 endoleaks after abdominal aortic aneurysm stent grafting with systematic mesenteric and lumbar coil embolization. Ann. Vasc. Surg., 2006 Jul; 20(4): 458–463.
15. Gould, D. A., McWilliams, R., Edwards, R. D., Martin, J., White, D., Joekes, E., Rowlands, P. C., Brennan, J., Gilling-Smith, G., Harris, P. L. Aortic side branch embolization before endovascular aneurysm repair: incidence of type II endoleak. J. Vasc. Interv. Radiol., 2001 Mar; 12(3): 337–341.
16. Hiramoto, J. S., Howell, B., Reilly, L. M., Chuter, T. A. Effect of systemic blood pressure on aneurysm size in the presence of a type II endoleak. Vascular., 2008 Nov-Dec; 16(6): 321–325.
17. Kasirajan, K., Matteson, B., Marek, J. M., Langsfeld, M. Technique and results of transfemoral superselective coil embolization of type II lumbar endoleak. J. Vasc. Surg., 2003 Jul; 38(1): 61–66.
18. Muthu, C., Maani, J., Plank, L. D., Holden, A., Hill, A. Strategies to reduce the rate of type II endoleaks: routine intraoperative embolization of the inferior mesenteric artery and thrombin injection into the aneurysm sac. J. Endovasc. Ther., 2007 Oct; 14(5): 661–668.
19. Bush, R. L., Lin, P. H., Ronson, R. S., Conklin, B. S., Martin, L. G., Lumsden, A. B. Colonic necrosis subsequent to catheter-directed thrombin embolization of the inferior mesenteric artery: a complication in the management of a type II endoleak. J. Vasc. Surg., 2001 Dec; 34(6): 1119–1122.
20. Parry, D. J., Kessel, D. O., Robertson, I., Denton, L., Patel, J. V., Berridge, D. C. Type II endoleaks: predictable, preventable, and sometimes treatable? J. Vasc. Surg., 2002 Jul; 36 (1): 105–110.
21. Mehta, M., Darling, R. C. 3rd, Chang, B. B., Paty, P. S., Roddy, S. P., Kreiberg, P. B., Ozsvath, K. J., Shah, D. M. Does sac size matter? Findings based on surgical exploration of excluded abdominal aortic aneurysms. J. Endovasc. Ther., 2005 12(2): 183–188.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2010 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Prevence endoleaku II. typu pomocí peroperačního coilingu vaku aneuryzmatu abdominální aorty během implantace stentgraftu
- Případ kombinace endoleaku Ib a IIIa typu po zavedení stentgraftu pro subrenální výduť aorty
- Současné možnosti roboticky asistované cévní chirurgie
- Příspěvek k diagnostice infekce cévní protézy
- Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy
- Operace na vnitřních karotidách v lokoregionální anestezii na chirurgické klinice v Plzni za uplynulých 7 let. Diskuse nad AHA a ESVS guidelines
- Klinické zkušenosti s použitím chladem konzervovaných žilních a tepenných alloštěpů: dlouhodobé výsledky
- Pedální bypass – desetileté zkušenosti
- Vícenásobná sekvenční revaskularizace infrapopliteálních tepen při záchraně kriticky ischemické končetiny
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Výsledky kombinované chirurgické a endovaskulární léčby žilního thoracic outlet syndromu v letech 2000 – 2007 na II. chirurgické klinice VFN a 1. LF UK v Praze
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Infekce av spojky k hemodialýze založené ePTFE interponátem. Léčba na základě zkušeností nebo podle nálezů moderních vyšetřovacích metod?
- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Hybridní výkony v léčbě torakoabdominálních výdutí typu IV, V
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Pedální bypass – desetileté zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



