-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaInfekce av spojky k hemodialýze založené ePTFE interponátem. Léčba na základě zkušeností nebo podle nálezů moderních vyšetřovacích metod?
The Infection of the Arteriovenous Hemodialysis Access Created with ePTFE Prosthesis. Treatment Based on Experience or on Modern Examinations Findings?
The infected ePTFE prosthesis for hemodialysis threatens the patient with local complications such as occlusion, the tunnel infection and massive hemorrhage. These complications are associated with the loss of function of the fistula. Infected prosthesis can work as a source for metastatic infections (endocarditis, arthritis, pneumonia), and sepsis. In European countries, interposition of ePTFE graft usually represents the last option of angioaccess beside the catheterization of central venous system; hence attempts occur to maintain the fistula function despite the manifestation of infection. Authors evaluate the total graftectomy (TGE) and the partial graftectomy (PGE) on the basis of their knowledge and literature findings. They take a stand whether it is preferable to remove an infected graft according to experience or to proceed conservatively following the modern examinations (USG, microbiology, PET CT). According to the documented case-report they tend more to the solution based on experience. If the infection of graft is of gram-negative etiology the total graftectomy (TGE) is recommended.
Key words:
arteriovenous fistula for hemodialysis – ePTFE prosthesis – infection of the prosthesis
Autoři: P. Bachleda 1; P. Utíkal 1; L. Kalinová 1; J. Zadražil 2; E. Buriánková 3; M. Kolář 4
Působiště autorů: II. chirurgická klinika FNOL a LF UP v Olomouci, přednosta: doc. MUDr. Petr Bachleda, CSc. 1; III. interní klinika FNOL a LF UP v Olomouci, přednosta: prof. MUDr. Vlastimil Ščudla, CSc. 2; Klinika nukleární medicíny FNOL a LF UP v Olomouci, přednosta: doc. MUDr. Miroslav Mysliveček, CSc. 3; Ústav mikrobiologie FNOL a LF UP v Olomouci, přednosta: prof. MUDr. Milan Kolář, Ph. D. 4
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 1, s. 80-84.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Infikovaný ePTFE interponát, který slouží k hemodialýze, ohrožuje nemocného lokálními komplikacemi jako jsou uzávěr spojky, tunelová infekce a masivní krvácení. Tyto komplikace jsou spojeny se zánikem funkce spojky. Infikovaná spojka může být zdrojem metastatických infekcí (endokarditida, artritida, pneumonie) a sepse. V evropských podmínkách je většinou interponát poslední možností kromě zavedení centrálního žilního katétru přístupu k dialýze, proto je snaha jej i při projevu infekce zachránit. Autoři na základě vlastních zkušeností a literárních poznatků hodnotí totální graftektomii (TGE) a parciální graftectomii (PGE) u infikované cévní protézy a zaujímají stanovisko k otázce, zda zkušenost v této problematice, která doporučuje odstranit infikovaný interponát, je lepším rádcem, než výsledky moderních vyšetřovacích metod (UZ, mikrobiologie, PET CT), které dovolují obhájit konzervativní přístup. Na dokumentované kazuistice se přiklání k řešení na podkladu zkušenosti. Při gramnegativním původu infekce protézy doporučuji autoři odstranění celé protézy (TGE).
Klíčová slova:
arteriovenózní spojka k hemodialýze – ePTFE interponát – infekce interponátuÚVOD
Léčba v chronickém dialyzačním programu vyžaduje cévní přístup k dialýze. Ten je zajišťován kanylací centrálního žilního řečiště, založením autologní arteriovenózní spojky nebo založením arteriovenózní spojky pomocí umělé cévní protézy, která je interponátem mezi arteriálním a žilním řečištěm a je používaná k dialýze. Založení arteriovenózní spojky pomocí autologního řečiště se považuje z hlediska délky funkce spojky a možných komplikací za nejvhodnější cévní přístup [1, 2]. Vždy však existují nemocní, kteří nemají k založení av spojky vhodné autologní podkožní žilní řečiště. Jejich vlastní řečiště je hypoplastické, nebo bylo předchozími výkony spotřebováno. U těchto nemocných se v přístupu k dialýze zavádí centrální žilní katétr nebo se implantuje interponát – graft [2]. V současné době je pro svou dostupnost preferován interponát z ePTFE, protože dobře splňuje požadavky, které jsou na av spojku založenou pomocí cévní náhrady kladeny: snadnou dosažitelnost a manipulaci, inertnost materiálu, rychlé vhojení, nízký výskyt postkanylačního krvácení, relativní odolnost ke vzniku infekčních a trombotických komplikací a tedy dlouhodobou kumulativní funkci. Zkušenosti s ePTFE interponáty lze považovat za dlouhodobé. V chirurgii arteriovenózních spojek k hemodialýze byla protéza z ePTFE poprvé použita již v roce 1973 Volderem [3]. Po zhodnocení výsledků jejich funkce se ePTFE interponáty staly zlatým standardem v chirurgii av spojek [4, 5, 6, 7, 8].
Při hodnocení ePTFE interponátu v hemodialyzačním programu je sledována délka jeho funkce ve vztahu k rozvoji stenotických a trombotických komplikací [9, 10, 11, 12]. Ty jsou v zásadě reparabilní. Za závažnější komplikaci se považuje jeho infekce [13]. Ta může být příčinou celkové infekce dialyzovaného nemocného. Infekce nemocných v programu náhrady funkce ledvin je spojena s vysokou morbiditou a je druhou nejčastější příčinou jejich úmrtí [14, 15, 16, 17]. Grafty jsou infekcí ohroženy v 11–35 % [9, 18, 19, 20, 21], přičemž infekční komplikace, které mají původ v graftu, jsou asi o 1/3 častější než u nemocných s nativní av spojkou [22].
KAZUISTIKA
Muž, 67 roků, s chronickou ledvinnou nedostatečností na podkladě chronické glomerulonefritidy. Hemodialýza od 9/92 cestou radiocefalické (rc) spojky. Transplantace ledviny v roce 1995. V roce 2008 selhání štěpu. V 05/2008 rerekonstrukce av spojky pro stenózu rc anastomózy: při nekvalitní arterii, ale dobré cefalické žíle byl použit ePTFE interponát (graft) na předloktí mezi brachiální arterií v loketní jamce a cefalickou žílou zápěstí s distálním tokem v graftu. Dialyzován kanylacemi graftu.
Obr. 1. Zkalená sekrece z místa arteriální anastomózy Fig. 1. Opaque secretion from the arterial anastomosis site 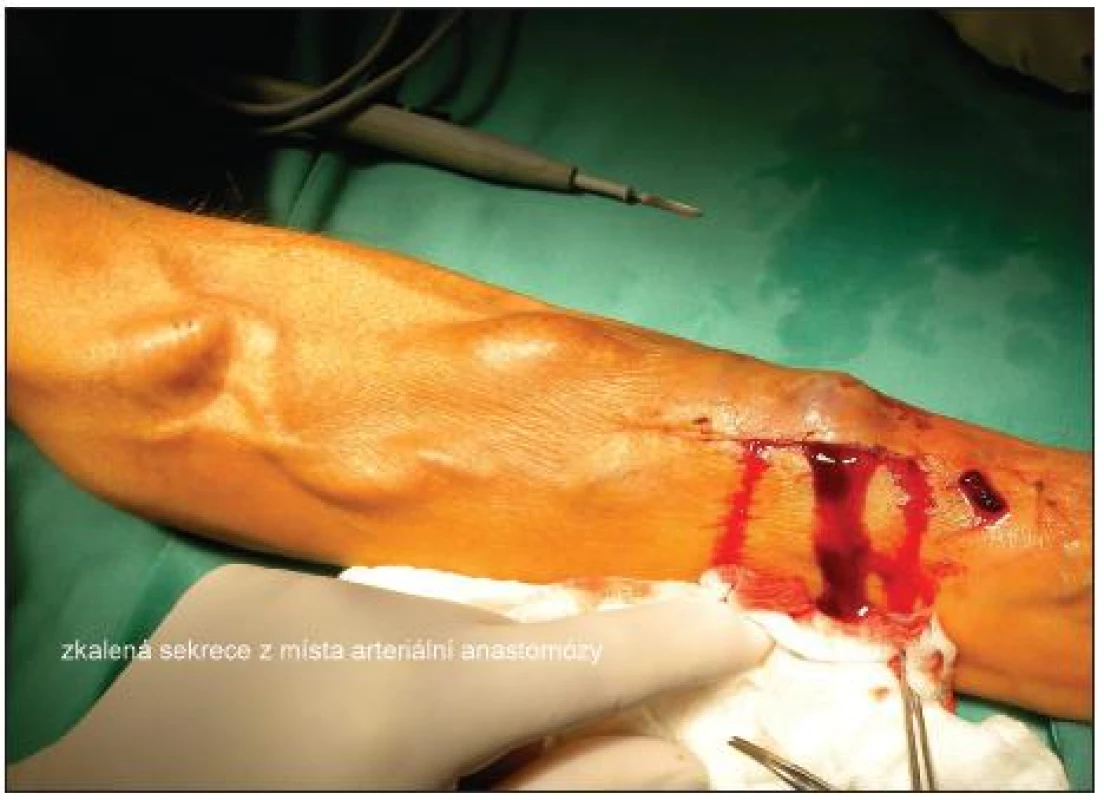
Ve 12/2008 opakovaně léčen pro septické stavy ve spádu. Klinicky byl lokální nález na graftu zcela negativní. V hemokultuře byla prokázána bakterie Pseudomonas aeruginosa. Na základě jícnového echa byla za zdroj infekce považována vegetace na mitrální chlopni. Pacient byl léčen antibiotiky (ceftazidim, gentamicin, ciprofloxacin) do konce 01/2009. Kontrolní jícnové echo bylo negativní. V 04/2009 byl zaznamenán opět septický stav nejasné etiologie s pozitivním nálezem Pseudomonas aeruginosa v hemokultuře. Srdeční echo neprokazuje vegetace. V místě protézo-venózní anastomózy je kožní defekt o průměru asi 3 mm. Podle nemocného se jedná o následek úrazu. Klinicky zcela klidné. Kultivace z defektu byla opakovaně negativní. Jako možný zdroj infekce byla považována dutina ústní, kde byla prováděna rozsáhlá extrakce zubů. Léčen antimikrobními přípravky – ciprofloxacinem a cefprozilem. Další septický stav v 05/09, kožní defekt v místě anastomózy přetrvával a nemocný popsal opakované drobné krvácení. Nebyly žádné klinické příznaky infekce protézy. UZ vyšetření neprokázalo volnou tekutinu v okolí protézy. Pro podezření na krvácení při infekci graftu byla indikována revize (7. 5. 2009), peroperační nález byl bez známky infekce, protéza byla fixována v podkoží. Anastomóza byla resekována a založena proximálněji. Výkon byl v rozsahu parciální graftektomie (PGE) s lokálním ošetřením místa původní anastomózy. Rána se hojila bez komplikací. Mikrobiologické vyšetření resekovaného interponátu prokázalo pseudomonádovou infekci a nemocný byl léčen piperacilin/tazobaktamem a ciprofloxacinem.
Obr. 2. Infikovaná ePTFE protéza av spojky Fig. 2. Infected ePTFE A-V shunt prosthesis 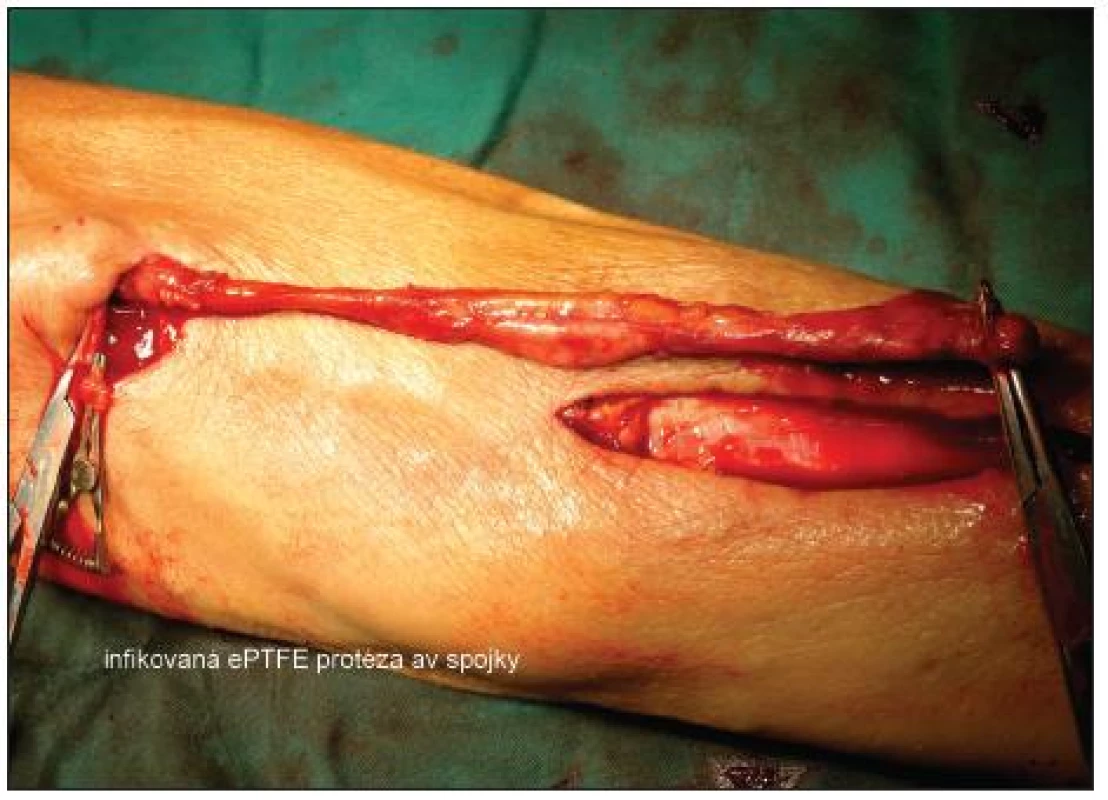
Při příznivém lokálním nálezu bylo zvažováno vyjmutí celé protézy. Nemocný byl oběhově stabilní, afebrilní, spojka byla funkční a operační rána se hojila bez zánětlivých příznaků. Bylo provedeno kontrolní UZ vyšetření av spojky, ta byla funkční s průtokem 450 ml/min, graft byl fixován v podkoží bez průkazu volné tekutiny v okolí. PET CT prokázalo zvýšenou akumulaci 18F-FDG v oblasti předloktí a protézy, ale nebylo možno odlišit zánět od časných reparativních pooperačních změn (6. pooperační den). Došlo k poklesu zánětlivých markerů (CRP, leukocytů). Graft byl ponechán a nemocný jím byl dialyzován. Nemocný byl s antibiotickou terapií a funkční spojkou přeložen 8. pooperační den do spádového zařízení. Důraz byl kladen na sledování lokálního nálezu.
Obr. 3. Vyjmutá ePTFE protéza s trombem Fig. 3. Removed ePTFE prosthesis with thrombus 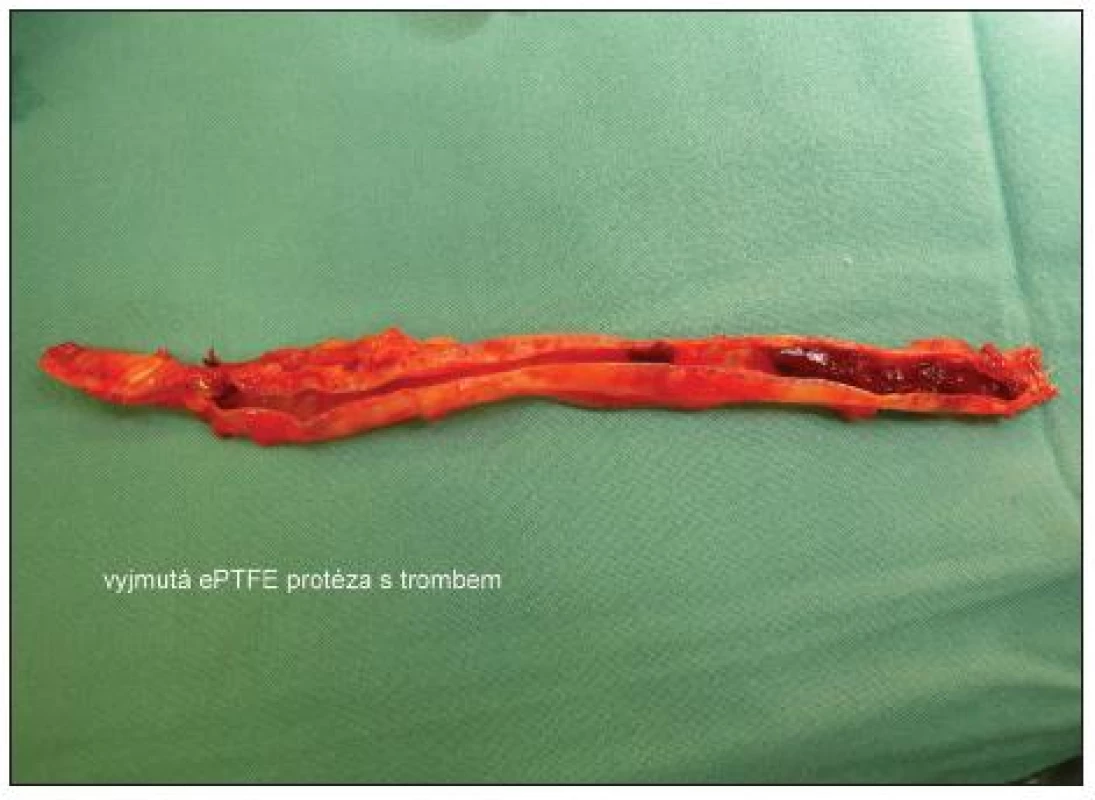
Po 3 týdnech vznikl opět septický stav a byla indikována revize a vyjmutí graftu. Lokální kožní nález byl klidný, při otevření původní rány nad anastomózou byl nalezen zkalený hematom a při opatrné revizi anastomózy došlo k masivnímu krvácení. Protéza byla vyjmuta a rána byla lokálně ošetřována. Nová autologní brachiocefalická spojka byla založena v loketní jamce (viz fotodokumentace). Nemocný je v současné době, 3 měsíce po vyjmutí protézy bez potíží a bez známky infekčního onemocnění.
DISKUSE
Je většinou obtížné odlišit, zda je primární infekce graftu a následující infekční komplikace je z tohoto zdroje, nebo je průběh opačný a z jiné infekce je hematogenně postižena cévní protéza. Na vznik infekce u dialyzovaného nemocného má vliv řada faktorů: snížená imunita dialyzovaného, kterou způsobuje dysfunkce neutrofilů při urémii [23, 24, 25], obezita nemocného, diabetes mellitus [26], hypalbuminemie [27,28] a nedostatečná osobní hygiena [29]. Dalším rizikovým faktorem je HIV infekce [30, 31]. Zásadní vliv má technika kanylace interponátu a délka jeho používání [18, 27, 32, 33]. Interponát, stejně jako všechny cévní protézy, je ohrožen také jinými infekcemi nemocného, které hematogenní cestou proniknou do interponátu [34]. Arteriovenózní graft potvrzuje také známou zkušenost z cévní chirurgie, že antibiotickou léčbou lze projevy infekce potlačit, ale nelze jí infekci z cévní protézy trvale odstranit. Ta je trvalým rizikem zdroje infekčních projevů lokálních nebo celkových. Významným rizikovým faktorem infekce je předchozí výskyt bakteriemie [22].
Cévní přístup k hemodialýze je nejčastěji infikován běžnou kožní mikroflórou, kterou většinou zastupují grampozitivní bakterie. Většinou je infekce způsobena kmeny Staphylococcus aureus nebo jinými grampozitivními bakteriemi, především koaguláza-negativními stafylokoky. Staphylococcus aureus je prokazován až v 68 % infekcí, výskyt ostatních grampozitivních bakterií se pohybuje v rozmezí od 20–60 % [27, 35]. Gramnegativní baktérie jsou méně častou příčinou a jejich výskyt je prokazatelný ve 28 % [27, 36]. Jejich výskyt je dáván do souvislosti s přenosem infekce z dialyzačních přístrojů [37]. Polymikrobiální etiologie se vyskytuje u 6 % nemocných [36]. Vstupní branou infekce je nejčastěji vlastní cévní přístup, následuje močový trakt, gastrointestinální trakt a dýchací cesty.
Stanovení diagnózy infekce interponátu je dáno většinou klinickým nálezem: zarudnutím kůže, proteplením, lokální bolestivostí, otokem, abscesem, sekrecí z rány (po kanylačním vpichu), která může být od serózní po purulentní. K tomu se mohou připojit celkové příznaky jako jsou teploty a třesavky. Velmi závažné jsou tunelové infekce, kdy lůžko graftu je vyplněno hnisem a graft „plave“. V místě kanylace vzniká chronická píštěl s hnisavou sekrecí. Prvním projevem infekce může být krvácení z anastomóz. Především infikovaná arteriální anastomóza graftu na brachiální arterii může být příčinou masivního krvácení [38]. Při nejasném rozsahu infekčního postižení je indikováno UZ vyšetření, které může zobrazit volnou tekutinu kolem graftu [35]. Při sekreci z vpichu nebo z rány je třeba odebrat materiál na mikrobiologické vyšetření a při projevech sepse opakovaně hemokulturu. U septických stavů nejasné etiologie je třeba myslet na klinicky nenápadnou cévní protézu a nemocného došetřit pomocí značkovaných leukocytů [39] nebo pomocí pozitronové emisní tomografie (FDG-PET) [40]. PET CT metoda je považována za jednodušší a přesnější než metoda používající indiem značkované leukocyty [40, 41].
Léčba infikovaného graftu může být konzervativní, chirurgická nebo nejčastěji je kombinací obou metod. Z chirurgického hlediska je základním principem odstranění celé protézy nebo infikovaného úseku protézy. Jedná se o totální graftektomii (TGE), o subtotální graftektomii (SGE) nebo o parciální graftektomii (PGE) [35].
Totální graftektomie je určena pro stavy, kdy je přítomna sepse, krvácení z anastomózy nebo tunelová infekce [42, 43]. Vyjmutí graftu vyžaduje ošetření původních anastomóz, žilní se přešívá, arteriální se ošetřuje žilním patchem, výjimečně se při krvácení z anastomózy arterie podvazuje. Velmi vzácně může podvaz arterie vést k ischemii ruky a je nutný žilní bypass ve zdravém podkoží k revaskularizaci periferie ruky. U výrazně sklerotického arteriálního řečiště předloktí není většinou bypass technicky možný. V tomto případě je třeba upřednostnit ischémii ruky před ohrožením života arteriálním krvácením. Z praxe je známé, že pokud při funkčním interponátu nebyla ruka ohrožena ischemií, lze arterii podvázat [44, 45]. Podvaz brachiální arterie lze také provést pod odstupem hluboké brachiální arterie. Podvaz je proveden ve zdravé tkáni, je bezpečný a má dobrý výsledek bez ischemických komplikací nebo krvácení [46]. V některých případech, kdy arteriální anastomóza není zřejmě infekcí postižena, je akceptabilní ponechání malého zbytku protézy v délce 2–3 mm na arteriální anastomóze, který se přešije [47,48]. Tento výkon se označuje také jako subtotální graftektomie a je určen pro nemocné s infikovaným graftem bez septických příznaků. Zjednodušuje výkon tím, že zmenší riziko poranění arterie nebo nervů v jizevnaté tkáni a zmenší riziko arteriálního krvácení. Po vyjmutí cévní protézy jsou odstraněny nekrotické tkáně a je prováděna laváž lůžka protézy [35].
Ošetření arterie přímou suturou nebo ponechání malého zbytku protézy může být nedostatečným výkonem, protože z obavy poranění okolních struktur nebo z obavy zúžení arterie není výkon radikální a je ponechána okolní infikovaná tkáň. Důsledkem je postup infekce a arteriální krvácení. U nemocných s pozitivní hemokulturou je riziko nového krvácení přes 20 % a je doporučena resekce arterie v místě anastomózy a její náhrada žilním interponátem. To umožní následný dokonalý debridment tkání. Tento postup je z hlediska odstranění infekce radikální a také zabrání vzniku stenózy arterie po jejím primárním ošetření [49]. Následuje mikrobiologické vyšetření graftu a cílená antibiotická terapie [15]. Před získáním výsledků mikrobiologické kultivace jsou nemocní antibioticky léčeni empiricky nejčastěji kombinací gentamicinu nebo vankomycinu s cefalosporiny III. generace [30, 35, 36]. Další antibiotická léčba je dána odběrem materiálu a kultivací. Dávkování antibiotik je korigováno ledvinnými funkcemi a celková doba léčby bývá 3–6 týdnů [30, 35].
Parciální graftektomie je určena pro stavy, kdy je jen část protézy infikována. Kritériem pro tento výkon je peroperační nález, kdy mimo postižený úsek protézy jsou její ostatní oddíly dobře fixovány v podkoží bez známek infekce. Infikovaný úsek je resekován, nepostižené úseky protézy podvázány a podkoží tunelu přešito v místě anastomóz. Infikované podkoží je převázáno a do zdravého podkoží se uloží nová protéza, která se našije na zdravé úseky původní protézy. Metoda umožní dialýzy na původním ponechaném řečišti a není potřeba nemocného zajistit centrálním katétrem. Tento výkon je doporučován, ale z praktického hlediska je jeho aplikace kontroverzní, protože původní protéza je často opět zdrojem infekce. Peroperačně není jednoznačně prokazatelné, kam až infekce zasahuje a PGE má riziko dalších infekčních projevů a krvácení. Dobrý výsledek u PGE je udáván v 74–80 % [18, 35, 42, 43, 50]. Je nutno připomenout, že tento názor není jednoznačně akceptován a některá centra doporučují jen TGE, protože PGE je spojena s dalšími infekčními komplikacemi [51].
V některých případech se jedná o „lokální infekci“, kdy v místě vstupu infekce je kožní nekróza, absces nebo píštěl a nemocný nemá celkové příznaky. Postižení protézy nelze vyloučit, ale lokální nález je malý a je možno řešit stav lokální chirurgickou terapií – drenáží, proplachem a podáním antibiotik podle citlivosti [42, 52]. Tímto přístupem lze většinou infekční proces utlumit, ale nikoliv definitivně vyléčit.
Při zhodnocení naší kazuistiky získáváme následující poznatky. Není prokazatelné, zda zdrojem infekce a sepse byla primárně cévní protéza, nebo zda naopak zdrojem infekce byla endokarditida a hematogenně byla postižena protéza. Pro druhou verzi svědčí lokální klidný nález na graftu. I při informacích o zvládnutých septických stavech existovaly argumenty pro ponechání protézy: příznivý lokální předoperační a peroperační nález, vždy negativní kultivace z kanylačních vpichů, funkční spojka, pokles zánětlivých markerů, negativní UZ nález a v zásadě negativní PET CT nález. Pro vyjmutí graftu svědčil průkaz infekce protézy bakterií Pseudomonas aeruginosa po první operaci, dále nebyla nutnost zachránit tento přístup k dialýze a bylo známo obecné riziko krvácení z reanastomózy. Nález při vyjmutí graftu, zřejmá infekce anastomózy při klidném kožním krytu a její následné peroperační krvácení nás vede k názoru, že i podle uznávaných kritérií správně indikovaná PGE je při pozdějším průkazu gramnegativní infekce v graftu spojena s vysokým rizikem komplikací a protéza se má vyjmout [38, 54].
Obecně lze konstatovat, že u nemocných, kteří jsou dialyzovaní cestou ePTFE interponátu, je třeba graft trvale brát jako potenciální zdroj infekce. Při septických stavech je třeba graft vyšetřit, i když je klinicky klidný. Zásadním pro osud graftu je okamžitá léčba kožních nebo vzdálených infekcí. Jen včasná a razantní antibiotická léčba může pozitivně ovlivnit počínající lokální infekci postihující kůži a podkoží. Z infikovaného graftu není možné infekci antibiotickou terapií odstranit a je nutné graft v postiženém úseku resekovat nebo je podle našich zkušeností správnější graft vyjmout. Gramnegativní infekce graftu je indikací k TGE. Dalším krokem je zajištění náhradního přístupu k dialýze nejčastěji cestou centrálního žilního katétru a intravenózní podávání antibiotik. Po zvládnutí infekční komplikace je nutná další operace, která zajistí přístup k dialýze implantací dalšího graftu nejlépe v jiné lokalizaci než byl původní. Léčba infikovaného graftu je spojena s hospitalizací a tím také s vysokými náklady na péči [42, 59].
Doc. MUDr. Petr Bachleda, CSc.
I. P. Pavlova 6
775 20 Olomouc
e-mail: petr.bachleda@fnol.cz
Zdroje
1. National Kidney Foundation: Kidney Disease Outcome Quality Initiative (NKFK/DOQI) clinical practice guidelines for vascular access. Am. J. Kidney Dis., 2001; 37(Suppl 1): 137–181.
2. Ether, J., Mendelssohn, D. C., Elder, S. R., et al. Vascular access use and outcomes: an international perspective from the Dialysis Outcomes nad Practice Patterns Study. Nephrol. Dial. Transplant., 2008; 23 : 3219–3226.
3. Volder, J. G. R., Kirkham, R. L., Kolff, W. J. AV shunts created in new ways. Trans. Amer. Soc. Artif. Intern. Organs, 1973; 19 : 38–42.
4. Baker, L. D., Johnson, J. M., Goldfarb, D. Expanded polytetrafluoroethylene (PTFE) subcutaneous arteriovenous conduit: an improved vascular access for chronic hemodialysis. Trans. Amer. Soc. Artif. Intern. Organs, 1976; 22 : 382–387.
5. Berardinelli, L. Grafts and graft materials as vascular substitutes for haemodialysis access construction. Eur. J. Vasc. Endovasc. Surg., 2006; 32 : 203–211.
6. Kaufmann, J. L., Garb, J. L., Berman, J. A., et al. A prospective comparison of two expanded polytetrafluoroethylene grafts for linear forearm hemodialysis access: does the manufacturer matter? J. Am. Coll. Surg., 1997; 185 : 74–79.
7. Hurlbert, S. N., Maltos, M. A., Henretta, J. F., et al. Long-term patency rates, complications and cost-effectiveness of polytetrafluoroethylene (PTFE) grafts for hemodialysis access: a prospective study that compares Impra versus Gore-tex grafts. Cardiovasc. Surg., 1998; 6 : 652–656.
8. Sorom, A. J, Hughes, C. B., McCarthy, J. T., et al. Prospective, randomized evaluation of a cuffed expanded polytetrafluoroethylene graft for hemodialysis vascular access. Surgery, 2002; 132 : 135–140.
9. Schild, A. F., Perez, E., Gillaspie, E., et al. Arteriovenous fistulae vs arteriovenous grafts: a retrospective review of 1 700 consecutive vascular access cases. J. Vasc. Access, 2008; 9 : 231–235.
10. Zouny, E. W., Dykstra, D. M., Goodkin, D. A., et al. Hemodialysis vascular access preferences at outcomes in the Dialysis Outcomes and Practice Patterns Study (DOPPS). Kidney International, 2002; 61 : 2266–2271.
11. Anel, R. L., Yevzlin, A. S., Ivanovich, P. Vascular access and patient outcomes in hemodialysis: questions answered in recent literature. Arteficial Organs, 2003; 27 : 237–241.
12. Schwab, S. J., Harrington, J. T., Singh, A., et al. Vascular access for hemodialysis. Kidney Int., 1999; 55 : 2078–2090.
13. Vilhelmi, M., Haverich, A. Material used for hemodialysis vascular access: current strategies and a call to action. Graft, 2003; 6 : 6–15.
14. Sarnak, M. J., Jaber, B. L. Mortality caused by sepsis in patients with end-stage renal disease compared with the general population. Kidney Int., 2000; 58 : 1758–1764.
15. Butterfly, D. W., Schwab, S. J. Dialysis access infection. Curr. Opin. Nephrol. Hypertens, 2000; 9 : 631–635.
16. The United States Renal Data System 1999 annual data report. Am. J. Kid. Dis., 1999; 34 : 1–176.
17. Lafrance, J. P., Rahme, E., Nedjar, H., et al. Vascular access related infections: definitions, incidence rates, and risk factors. Am. J. Kidney Dis., 2008; 52 : 982–983.
18. Raju, S. PTFE grafts for hemodialysis access. Techniques for insertion and management of complications. Ann. Surg., 1987; 206 : 666–673.
19. Zibari, G. B., Gadallah, M. R., Landreneau, M., et al. Preoperative vancomycin prophylaxis decreases incidence of postoperative hemodialysis vascular access infections. Am. J. Kidney Dis., 1997; 30 : 343–348.
20. Zibari, G. B., Rohr, M. S., Landreneau, M. D., et al. Complications from permanent hemodialysis vascular access. Surgery, 1988; 104 : 681–686.
21. Padberg, F. T, Lee, B. C., Curl, L. R., et al. Hemoaccess site infection. Surg. Gynecol. Obstet, 1992; 174 : 103–108.
22. Hoen, B., Paul-Dauphin, A., Hestin, D., et al. EPIBACDIAL: A multicenter prospective study of risk factors for bacteremia in chronic dialysis patients. J. Am. Soc. Nephrol., 1998; 9 : 869–876.
23. Jaber, B. L. Bacterial infections in hemodialysis patients: Pathogenesis and prevention. Kidney Int., 2005; 67 : 2508–2519.
24. Vanholder, R., De Smet, R., Glorieux, G., et al. Review on uremic toxins: Classification, concetration, and interindividual variability. Kidney Int., 2003; 63 : 1934–1943.
25. Girndt, M., Sester, U., Sester, M., et al. Impaired cellular immune function in patients with end-stage renal failure. Nephrol. Dial. Transplant., 1999; 14 : 2807–2810.
26. Dhingra, R. K., Zouny, E. W., Hulbert-Shearon, T. H., et al. Type of vascular access and mortality in US hemodialysis patients. Kidney Int., 2001; 60 : 1443–1451.
27. Minga, T. E, Flanagan, K. H, Allon, M. Clinical consequences of infected arteriovenous grafts in hemodilaysis patients. Am. J. Kidney Dis., 2001; 38 : 975–978.
28. Miller, P. E, Carlton, D., Deirhoi, M. H., et al. Natural history of arteriovenous grafts in hemodialysis patients. Am. J. Kidney Dis., 2000; 36 : 68–74.
29. Kaplowitz, L. G., Comstock, J. A., Landwehr, D. M., et al. A prospective study of infections in hemodialysis patients: Patients hygiene and other risk factors for infection. Infect. Control Hosp. Epidemiol., 1988; 9 : 534–541.
30. Nassar, G. M., Ayus, J. C. Infectious complications of the hemodialysis access. Kidney Int., 2001; 60 : 1–13.
31. Curi, M. A., Pallas, P. J., Silva, M. B. Jr., et al. Hemodialysis access: Influence of the human immunodeficiency virus on patency and infection rates. J. Vasc. Surg., 1999; 29 : 608–616.
32. Kessler, M., Hoen, B., Mayeux, D., et al. Bacteremia in patients on chronic hemodialysis: a multicenter prospective survey. Neohrom, 1993; 64 : 95–100.
33. Allon, M., Depner, T. A., Radova, M., et al. Impact of dialysis dose and membrane on infection-related hospitalisation and death: Results of the HEMO study. J. Am. Soc. Nephrol., 2003; 14 : 1863–1870.
34. Bonomo, R. A, Rice, D., Whalen, C., et al. Risk factors associated with permanent access-site infections in chronic hemodialysis patients. Infect. Control Hosp. Epidemiol., 1997; 18 : 757–761.
35. Ryan, S. V., Calligaro, K. D., Dougherty, M. J. et al. Management of infected prosthetic dialysis arteriovenous grafts. J. Vasc. Surg., 2004; 39 : 73–78.
36. Lentino, J. R, Baddour, L. M., Wray, M., et al. Staphylococcus aureus and other bacteremias in hemodialysis patients: antibiotic therapy and surgical removal of access site. Infection, 2000; 28 : 355–360.
37. Wang, S. A, Levine, R. B., Carson, L. A., et al. An outbreak of gram-negative bacteremia in hemodialysis patientsntraced to hemodialysis machine waste drain ports. Infect. Control Hosp. Epidemiol., 1999; 20 : 746–751.
38. Bachleda, P., et al. Cévní náhrady v chirurgii arteriovenózních spojek k hemodialýze. Prodos, 2001; 78–81.
39. Palestro, C. J., Vega, A., Kim, C. K., et al. Indium 111 labeled leukocyte scintigraphy in hemodialysis access-site infection. J. Nucl. Med., 1990; 31 : 319–324.
40. Musso, G. C., Reynaldi, J., Navarro, M., et al. Hidden clotted vascular access infection diagnosed by fluorodeoxyglucose positron emission tomography. Nephrology, (Carlton), 2008; 13 : 264–2655.
41. Lawrence, P. F., Dres, D. J., Alazraki, N., et al. Indium-111-labeled leukocyte scanning for detection of prosthetic vascular graft infection. J. Vasc. Surg., 1985; 2 : 165–173.
42. Bhat, T. J., Tellis, V. A., Kohlberg, W. I., et al. Management of sepsis involving ePTFE grafts for hemodialysis access. Surgery, 1980; 87 : 445–450.
43. Tailor, B., Sigley, R. D., May, K. J. Fate of infected and eroded hemodialysis grafts and autogenous fistulas. Am. J. Surg., 1993; 165 : 632–636.
44. Haug, M. Der komplizierter av shunt infolge aerterieller Probleme. Angioarchiv, 1991; Bd 22 : 15–17.
45. Humphries, A. L. Jr., Nesbit, R. R. Jr., Caruana, R. J., et al. Thirty-six recommendations for vascular access operation: lessons learned from our first thousands operations. Am. Surg., 1981; 47 : 145–151.
46. Schanzer, A., Ciaranello, A. L., Schanzer, H. Brachial artery ligation with total graft excision is a safe and effective approach to prosthetic arteriovenous graft infection. J. Vasc. Surg., 2008; 48 : 655–658.
47. Gifford, R. R. Management of tunnel infections of dialysis PTFE grafts. J. Vasc. Surg., 1985; 2 : 854–858.
48. Calligaro, K. D, Veith, F. J., Valladares, J. A., et al. Prosthetic patch remnants to treat infected arterial grafts. J. Vasc. Surg., 2000; 31 : 245–252.
49. Wu, M. Y., Ko, P. J., Hsieh, H. C., et al. Repair of arteriotomy after removal of infected hemodialysis access by venous graft. Chang Gung Med. J., 2003; 26 : 911–918.
50. Schulte, W. P., Helmer, S. D., Salazar, R., et al. Surgical treatment of infected prosthesis dialysis arteriovenous grafts: total versus partial graft excision. Am. J. Surg., 2007; 193 : 385–388
51. Schild, A. F., Simon, S., Prieto, J., et al. Single-center review of infections associated with 1574 consecutive access procedures. Vasc. Endovasc. Surg., 2003; 37 : 27–31.
52. Albert, F. J. Clinical considerations in hemodialysis access infection. Adv. Ren. Replace Ther., 2006; 3 : 208–217.
53. Ballard, J. L, Bunt, T. J, Malone, J. M. Major complications of angioacces surgery. Am. J. Surg., 1992; 3 : 229–232.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2010 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Prevence endoleaku II. typu pomocí peroperačního coilingu vaku aneuryzmatu abdominální aorty během implantace stentgraftu
- Případ kombinace endoleaku Ib a IIIa typu po zavedení stentgraftu pro subrenální výduť aorty
- Současné možnosti roboticky asistované cévní chirurgie
- Příspěvek k diagnostice infekce cévní protézy
- Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy
- Operace na vnitřních karotidách v lokoregionální anestezii na chirurgické klinice v Plzni za uplynulých 7 let. Diskuse nad AHA a ESVS guidelines
- Klinické zkušenosti s použitím chladem konzervovaných žilních a tepenných alloštěpů: dlouhodobé výsledky
- Pedální bypass – desetileté zkušenosti
- Vícenásobná sekvenční revaskularizace infrapopliteálních tepen při záchraně kriticky ischemické končetiny
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Výsledky kombinované chirurgické a endovaskulární léčby žilního thoracic outlet syndromu v letech 2000 – 2007 na II. chirurgické klinice VFN a 1. LF UK v Praze
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Infekce av spojky k hemodialýze založené ePTFE interponátem. Léčba na základě zkušeností nebo podle nálezů moderních vyšetřovacích metod?
- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Hybridní výkony v léčbě torakoabdominálních výdutí typu IV, V
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Pedální bypass – desetileté zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



